
Érase una vez un abuelo y una mujer. Y tenían un pollo Ryaba. El pollo puso un testículo, pero no uno simple, sino genéticamente modificado. Un giro inesperado, ¿verdad? Pero esto es precisamente lo que se discutirá hoy. Los productos farmacéuticos han cambiado mucho en las últimas decenas, o incluso cientos de años. Ya no usamos sanguijuelas y no consideramos que la lobotomía sea un excelente remedio para la migraña. Ahora hay una gran cantidad de medicamentos que pueden curar una amplia variedad de enfermedades. La base de estas drogas, naturalmente, son ciertos compuestos químicos, cuya producción a veces está llena de grandes dificultades. Y luego, a los científicos se les ocurrió una idea brillante: ¿por qué necesitamos todos estos biogeneradores complejos, si pueden usar pollos? Sí, has oído bien, son las gallinas las que transportarán los huevos que contienen los compuestos químicos necesarios, como las proteínas. Cómo los científicos han cambiado los pollos para lograr estos objetivos, qué surgió y si no debemos temer capturar el planeta con gallinas carnívoras modificadas genéticamente de dos metros, aprendemos del informe del grupo de investigación. Vamos
Base de estudioVale la pena comenzar con el hecho de que el uso de animales como biorreactores no es algo revolucionario nuevo. Por ejemplo, la Antitrombina III, un medicamento obtenido de la leche de cabras genéticamente modificadas (GM), fue aprobado para su uso en 2006. En otras palabras, las cabras actuaban como un "laboratorio" que producía leche, que incluía el compuesto químico utilizado en la preparación.
Sin embargo, según los científicos, el uso de animales grandes para tales fines es bastante costoso, dado el pequeño número de crías, un largo período de gestación y luego el crecimiento, etc. Es por eso que centraron su atención en los pollos, y también por el hecho de que los huevos de gallina contienen una cantidad suficiente de proteínas. El promedio de 60 g de huevo de gallina contiene aproximadamente 3,5 gramos de proteína. En un año, una gallina puede poner unos 300 huevos. Agregamos aquí la cría barata de pollos y el rápido crecimiento de los números en condiciones normales.
Además, además de las ventajas económicas, los científicos notan más ventajas científicas. Entonces, en pollos y humanos, los patrones de glicosilación, el proceso de adición de azúcares a las moléculas orgánicas, están muy cerca. Y esto significa que habrá una baja inmunogenicidad de las preparaciones de proteína de huevo que necesitan glicosilación para activarse.
Todo esto suena muy, muy interesante, pero sabemos que hasta ahora los huevos de gallina se usan más para tortillas que como fuente de bases medicinales. Es decir, los pollos en este estudio no son simples (no, no son de oro, aunque desde un punto de vista financiero pueden serlo) y están genéticamente modificados.
Los científicos señalan que anteriormente, los lentivirus se usaban para llevar a cabo modificaciones de genes de pollo, ya que transfieren perfectamente la información genética a la célula huésped. La expresión transgénica puede limitarse en el oviducto utilizando la secuencia del gen ovoalbúmina (albúmina de albúmina de huevo). Este método permitió la creación de dos proteínas biológicamente activas en la proteína del huevo, sin embargo, el nivel de expresión fue significativamente menor de 1 g / l. Y esto no es suficiente para que tal técnica sea atractiva desde un punto de vista comercial e industrial.
En este estudio, los científicos decidieron implementar un método más avanzado para producir dos nuevas proteínas, incluido un dímero de citocina, así como un método de purificación mejorado. El interferón α2a, una preparación biológica patentada para el tratamiento de ciertas formas de cáncer y hepatitis (ya obsoleto), se utilizó como modelo.
El principal participante en el estudio fue el factor estimulante de colonias de macrófagos (CSF1), que es un paquete de 4 hélices, es decir, es estructuralmente similar a muchas citocinas, incluidas la insulina, la hormona del crecimiento, el lactógeno placentario, etc. Bueno, el principal "productor" en el estudio son las gallinas. Qué resultados mostraron los experimentos y los consideraremos más a fondo.
Resultados de la investigación Imagen No. 1
Imagen No. 1Se sintetizaron 0,5 cl (miles de pares de nucleótidos / mil bases emparejadas) de la secuencia codificante de interferón α2a y se clonaron en el vector lentiviral del virus de la anemia infecciosa equina defectuosa en la replicación de caballos con el promotor EREOVA.
Para aumentar el grado de expresión, se añadieron 0,9 TPN de la secuencia promotora de ovoalbúmina entre el elemento de respuesta al estrógeno y el elemento regulador dependiente de esteroides (
1a ). Fue este vector lentiviral el que permitió obtener aves transgénicas, entre las cuales se reveló un macho (G1), que es portador de un transgen intacto (entero / intacto). En consecuencia, fue de este macho a quien se fue la línea de aves transgénicas (crías).
Mediante el uso de anticuerpos que responden al interferón α humano, se detectó la presencia de interferón α2a en la proteína del huevo de los pollos de prueba (
1b ) utilizando inmunotransferencia de proteínas.
Protein immunoblot * es un método analítico para determinar la presencia de proteínas en una muestra.
Cuantitativamente, se describió α2a utilizando un ensayo inmunosorbente ligado a enzimas, cuando los anticuerpos se unen a antígenos específicos, lo que permite determinar su cantidad.
Para confirmar la actividad biológica, antes del proceso de limpieza, los científicos colocaron la clara de huevo diluida en un transfector celular con el gen informador del elemento de respuesta estimulada por interferón que controla la expresión de luciferasa (
1c ).
Reporter gene * : se une a las secuencias reguladoras de otros genes para estudiar las manifestaciones de genes en cultivos celulares.
Luciferasa * : enzimas oxidativas que desencadenan una reacción, una de cuyas características es la bioluminiscencia.
Después de todas las verificaciones, se inició el proceso de limpieza, que consistió en:
- clarificación de la ovomucina (glucoproteína en la proteína del huevo) disminuyendo el pH;
- eliminación de ovomucina usando una centrífuga;
- purificación de interferón α2a usando captura HiTrap Blue y cromatografía de exclusión por tamaño adicional.
El grado de purificación (> 95%) se confirmó por electroforesis de proteínas en gel de poliacrilamida (
1d ).
Fue posible obtener 15 mg de interferón α2a a partir de 100 ml de proteína de huevo, y esto representa aproximadamente el 60% del volumen de interferón α2a (25 mg) detectado por inmunoensayo enzimático (
1e ).
Puede que tenga una pregunta, pero ¿qué pasa con las enfermedades que pueden pasar de los pollos a los humanos usando este interferón α2a? Los científicos han comprobado esto, y más precisamente, las propiedades antivirales de α2a mediante la introducción del virus tipo A H1N1 en las células previamente tratadas con α2a. Y los resultados de este análisis fueron más que positivos (
1f ): la actividad antiviral del interferón de la proteína del huevo fue de 1x10
9 U / mg, que es un orden de magnitud mayor que el de las proteínas producidas por bacterias.
 Imagen No. 2
Imagen No. 2Una de las proteínas más importantes en la diferenciación, proliferación y funcionamiento de los macrófagos es CSF1.
La secuencia de codificación CSF1 de cerdo, combinada con F
c , se sintetizó (pCSF1-F
c ) y se clonó en el vector lentiviral pLenti6 (aislado del VIH) entre el promotor EREOVA2 y el elemento regulador post-transcripcional del virus de la hepatitis de marmota (
2a ).
F c * (fragmento de cristalización de la inmunoglobulina) es parte de una molécula de inmunoglobulina que interactúa con el receptor F c en la superficie celular y con algunas proteínas.
Después de la eliminación del macho (G0), que se convirtió en la base de una nueva línea de descendencia, entre las cuales se reveló un transgen intacto en dos hembras y un macho. Estos individuos posteriormente participaron en la cría de la progenie de la próxima generación (G2). La electroforesis de proteínas en gel de poliacrilamida confirmó la presencia de pCSF1-F
c en la proteína de huevo (
2b ).
El CSF1 de cerdo se expresó en células Ba / F3. Esto condujo al hecho de que la existencia misma de estas células dependía de CSF1-F
c . Por lo tanto, fue posible evaluar la viabilidad celular de la proteína de huevo de prueba, que era bastante alta en comparación con el grupo de control (proteína de huevos ordinarios), donde la tasa de supervivencia era casi cero (
2c ).
A continuación, la proteína de huevo de pCSF1-F
de los huevos se purificó de ovomucina y se transfirió al estado sobrenadante (sobrenadante, líquido por encima del residuo seco), como se muestra en la imagen
2d .
La forma dimérica activa de pCSF1-Fc se purificó por absorción de MabSelect SuRe y pulido adicional usando cromatografía de exclusión por tamaño (
2e ). La tasa de pureza fue superior al 97%.
Como resultado, el peso molecular promedio fue de aproximadamente 95.1 kDa (kilodaltons), la monodispersidad de la proteína también fue satisfactoria - Mw / Mn = 1.011 (Mw es el peso molecular promedio en peso, Mn es el peso molecular promedio en número). El análisis del modelo de copolímero mostró la presencia de proteína de 85,6 kDa y oligosacárido de 9,5 kDa.
También se probó la viabilidad celular: algunos de los huevos se colocaron en un refrigerador a -20 ° C durante 1 mes, y parte durante el mismo período, pero a -80 ° C. En ambos casos, las células sobrevivieron (
2 g ), lo que indica la posibilidad de almacenamiento a largo plazo y su uso posterior incluso antes de la purificación sin pérdida de actividad.
También se realizó un análisis de la capacidad de la proteína purificada para interactuar con el receptor CSF1. Esto se realizó utilizando células de médula ósea de ratón y los resultados fueron satisfactorios (
2 h ).
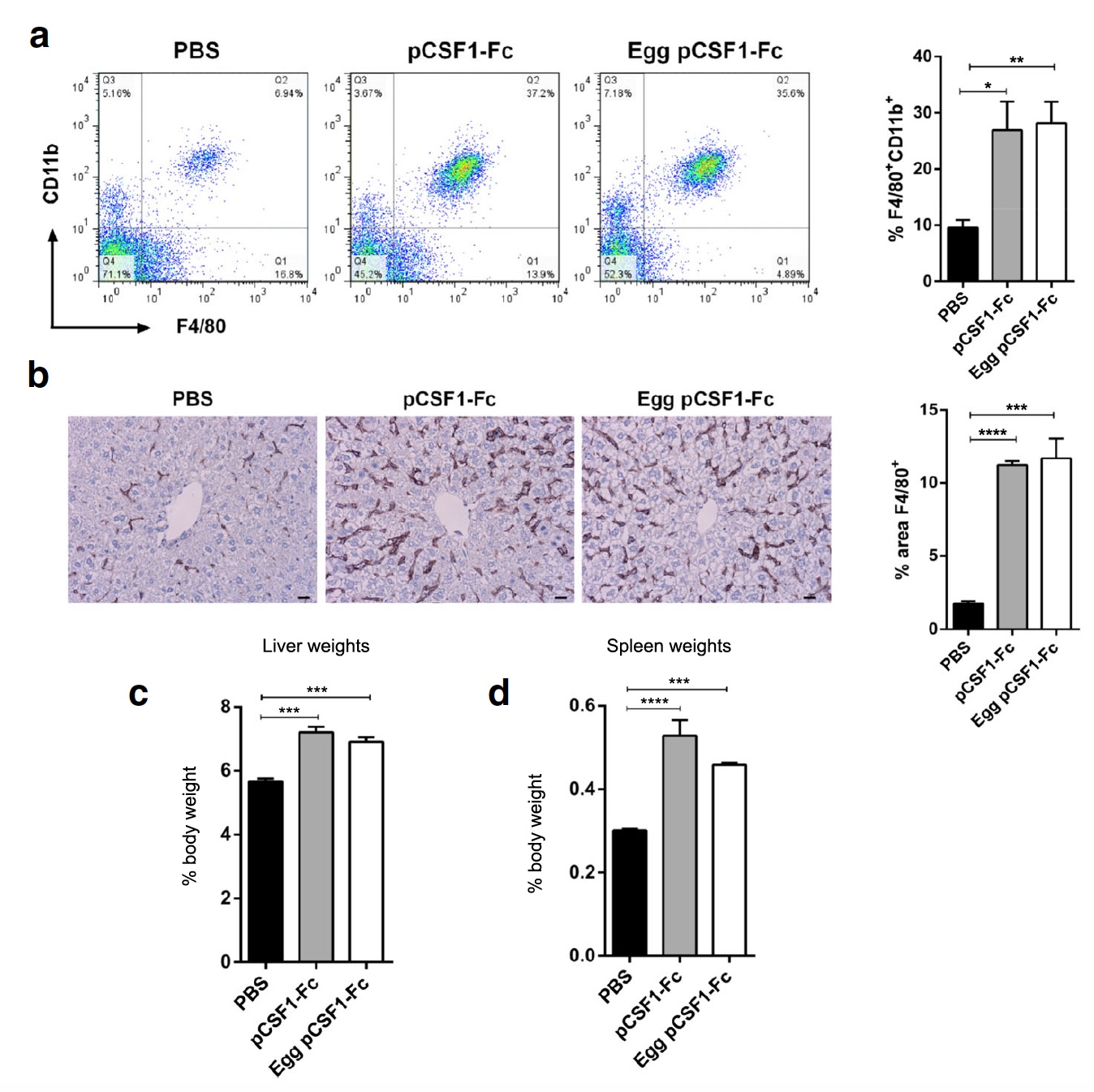 Imagen No. 3
Imagen No. 3Luego, los científicos decidieron probar la actividad de pCSF1-F
c de la proteína del huevo en condiciones de campo, es decir, en ratas de laboratorio que fueron inyectadas con 1 μg / g de control o proteína pCSF1-F
c purificada. Después de eso, se verificó el peso y la histología del hígado, el bazo y la sangre de las ratas. Ambas variantes de pCSF1-F
c condujeron a un aumento en el número de células F4 / 80
+ CD11b
+ en la sangre (
3a ) y macrófagos de tejido F4 / 80
+ en el hígado (
3b ). También se observó un aumento significativo en el peso del hígado y el bazo (
3c y
3d ).
 Imagen No. 4
Imagen No. 4Las pruebas, análisis y experimentos anteriores mostraron muy buenos resultados. Ahora solo queda demostrar que tales métodos pueden permitir la producción de una citocina humana, que puede usarse en medicamentos.
Los científicos señalan que pCSF1-F
c muestra buena actividad en células humanas y puede ser inmunogénico. Para confirmar esto, las ratas de laboratorio fueron inmunizadas con la proteína CSF1-F
c para producir anticuerpos monoclonales que reaccionan de forma cruzada con el CSF1 humano.
Antes de realizar pruebas reales y analizar sus resultados, los científicos prepararon pollos que expresan la proteína CSF1-F
c humana (hCSF1-F
c ). Para hacer esto, utilizamos la técnica y el sistema vectorial descritos anteriormente. En dos pollos, se reveló un transgen intacto que mostró la expresión de proteína necesaria de 1 mg / ml (
4a ). Seguido por el proceso de limpieza anterior (
4b ). La tasa de supervivencia de la hCSF1-Fc purificada también fue alta, incluso después del secado al vacío y la reducción (
4c ).
Para un conocimiento más detallado de los matices del estudio, le recomiendo que consulte el
informe de los científicos .
EpílogoEl resultado de este estudio es la confirmación de que el interferón α2a y CSF1-F
c se sintetizan perfectamente como componentes de la clara de huevo regular. La extracción de estas proteínas tampoco requiere esfuerzos especiales, sino solo técnicas cromatográficas estándar. Las proteínas obtenidas son activas tanto en el laboratorio como en el cuerpo de un sujeto vivo (ratas).
Muchos son muy escépticos sobre las modificaciones genéticas. Algunos incluso tienen miedo de esta frase y de todo lo que se puede conectar con ella. Sin embargo, solo vale la pena comprender un poco las perspectivas que pueden dar las modificaciones genéticas humanas, cómo se disipan los miedos y los dogmas obsoletos. En este caso en particular, examinamos un estudio en el que los científicos literalmente forzaron a los pollos a poner huevos con proteínas humanas, que se pueden usar para producir de manera económica, eficiente y rápida los componentes necesarios para crear medicamentos. Quizás estas gallinas no llevan huevos de oro, pero su valor es mucho mayor.
Y, por supuesto, el viernes fuera del tema:
Un poco de música antes del fin de semana :)
Gracias por mirar, mantén la curiosidad y que tengan un gran fin de semana, muchachos.
Gracias por quedarte con nosotros. ¿Te gustan nuestros artículos? ¿Quieres ver más materiales interesantes?
Apóyenos haciendo un pedido o recomendándolo a sus amigos, un
descuento del 30% para los usuarios de Habr en un análogo único de servidores de nivel de entrada que inventamos para usted: toda la verdad sobre VPS (KVM) E5-2650 v4 (6 núcleos) 10GB DDR4 240GB SSD 1Gbps de $ 20 o cómo dividir el servidor? (las opciones están disponibles con RAID1 y RAID10, hasta 24 núcleos y hasta 40GB DDR4).
VPS (KVM) E5-2650 v4 (6 núcleos) 10GB DDR4 240GB SSD 1Gbps hasta la primavera sin cargo al pagar por un período de seis meses, puede ordenar
aquí .
Dell R730xd 2 veces más barato? ¡Solo tenemos
2 x Intel Dodeca-Core Xeon E5-2650v4 128GB DDR4 6x480GB SSD 1Gbps 100 TV desde $ 249 en los Países Bajos y los Estados Unidos! Lea sobre
Cómo construir un edificio de infraestructura. clase utilizando servidores Dell R730xd E5-2650 v4 que cuestan 9,000 euros por un centavo?