Ya le hemos
hablado sobre el microARN circulante, pero hay otra cosa igualmente genial: el ADN circulante extracelular (ADN libre de células en inglés, ADN circulante). Fue inaugurado en 1948. Ahora el interés en ella se ha intensificado, y este es, de hecho, el problema.
El ADN extracelular (ADNc) se encuentra en varios fluidos corporales: en plasma y suero, orina, saliva, sinovial, peritoneal y líquido cefalorraquídeo.
Consideraremos las características del cfDNA en dos fluidos: sangre y orina. Está claro que es más conveniente para el diagnóstico.
Fuentes de cfDNA en el cuerpo
Como se supo, el ADNc circula en la sangre como parte de cuerpos apoptóticos, microvesículas, nucleosomas, exosomas, complejos de nucleoproteínas con proteínas sanguíneas y, presumiblemente, en forma libre.
Se cree que las causas del cfDNA en la sangre son los procesos de muerte celular, la maduración de los glóbulos rojos, la secreción de ADN por las células, así como las bacterias y los virus. Notamos de inmediato que la última fuente, el ADN de bacterias y virus, hace una contribución muy insignificante al conjunto total de ADN circulante, y el nivel de ADN exógeno durante las infecciones no excede varias decenas de paquetes / ml. Mientras que, según los datos modernos, el nivel normal de cfDNA en un cuerpo sano es de 3-44 ng / ml en plasma y 50-100 ng / ml en suero sanguíneo.
Es probable que una parte significativa del ADNc en el cuerpo sea el resultado de la muerte celular durante la apoptosis, la necrosis y la netosis. Alrededor de cien mil millones de células mueren cada día en un adulto a través de la muerte celular programada (apoptosis), como resultado de lo cual se degrada aproximadamente 1 g de ADN por día.
En el proceso de apoptosis, el ADN nuclear es escindido por una enzima especial, la ADNasa. Después de eso, aparecen fragmentos de ADN con una longitud de un nucleosoma múltiple (180-200 pb, pb - pares de nucleótidos), que los macrófagos deben eliminar como parte de los cuerpos apoptóticos (empaque especial después de la apoptosis). Todos saben que los pares de nucleótidos (adenina-timina y guanina-citosina) en nuestro ADN se repiten tres mil millones de veces. Los nucleosomas son estructuras especiales en la cromatina, que consisten en proteínas de histonas, en las que se enrolla una hebra de ADN una vuelta y media.
Entonces sucede lo extraño. Por razones desconocidas, parte del ADN de las células muertas evita encontrarse con los macrófagos y entra en el torrente sanguíneo. En diferentes momentos, se llevaron a cabo experimentos que confirman la naturaleza apoptótica de cfDNA [1, 2].
Cuando el ADNc de donantes sanos se separa por electroforesis en gel, se detectan bandas correspondientes a fragmentos de longitud de 180-200 pb. y longitudes que son múltiplos de este número, que corresponde a la escisión internucleosómica de la cromatina durante la apoptosis. La detección de ADN fetal en la sangre de la madre también habla a favor de la apoptosis como fuente de ADNc [3].
Normalmente, la necrosis hace una contribución menos significativa a la aparición de cfDNA, aumentando su número en lesiones graves. El cfDNA necrótico en plasma se detecta en forma de fragmentos más largos, de más de 10 mil pb de longitud. Usando PCR (reacción en cadena de la polimerasa) es posible distinguir entre fragmentos largos de ADNc resultante de la necrosis y fragmentos más cortos debido a la apoptosis.
Además de la apoptosis y la necrosis, existe otro tipo poco conocido de muerte celular, que es una fuente de cfDNA: netosis (NETosis).
Con la netosis, las células de neutrófilos expulsan estructuras especiales en forma de red, trampas de neutrófilos extracelulares (NET, trampa extracelular de neutrófilos), cuya tarea es desactivar el patógeno que ha ingresado al cuerpo: virus, hongos y bacterias. En este caso, el neutrófilo muere, arrojando ADN, histonas, diversas proteínas y enzimas al espacio extracelular. Se sabe que a veces el proceso NET es de naturaleza patológica, contribuyendo al desarrollo de trombosis, enfermedades cardiovasculares y autoinmunes, así como el cáncer.
Recientemente, en 2018, se descubrió que en caso de infección por VIH, se producen neutrófilos hiperactivos, el mecanismo NET y la netosis. Como resultado, hubo una muerte extensa de células inmunes capturadas por redes de neutrófilos, células T CD4 + y CD8 +, células B y monocitos, y el desarrollo de patologías cardiovasculares concomitantes [4].
Otra fuente potencial de cfDNA es la secreción de ADN por células normales y tumorales. En 1972, se obtuvo evidencia de la liberación activa de ADN por los linfocitos en el medio extracelular [5].
La presencia de un fenómeno como la liberación de ADN por las células en el medio extracelular sugiere la existencia de mecanismos especiales para la transferencia de ADN a través de la membrana celular. En el curso de los estudios, se descubrió que la liberación de ADN de los linfocitos ocurre con la acción activa de la tripsina, la pronasa y la plasmina en el contexto de una deficiencia de iones Ca2 + y Mg2 +. Un exceso de iones de calcio inhibe la salida de ADN de la célula [6].
Según los bioquímicos rusos de la Universidad Estatal de Kazan, otra fuente probable de ADNc en la sangre puede ser una forma completamente desconocida de ADN citoplasmático, diferente del ADN nuclear y mitocondrial, ADN asociado con la membrana de los linfocitos diploides humanos (ADN asociado a la membrana en el citoplasma de los linfocitos humanos diploides). ) [7].
A pesar del hecho de que este tipo de ADN se descubrió en 1971, aún permanece sin explorar, y solo hay unos pocos trabajos de los mismos autores, aunque en PNAS y Nature.
Según el supuesto de Abramova Z.I. et al., una parte del ADNc se puede formar a partir de este ADN citoplasmático, como lo indican los rasgos característicos de algunos fragmentos del ADNc, diferentes de los nucleares y mitocondriales [6].
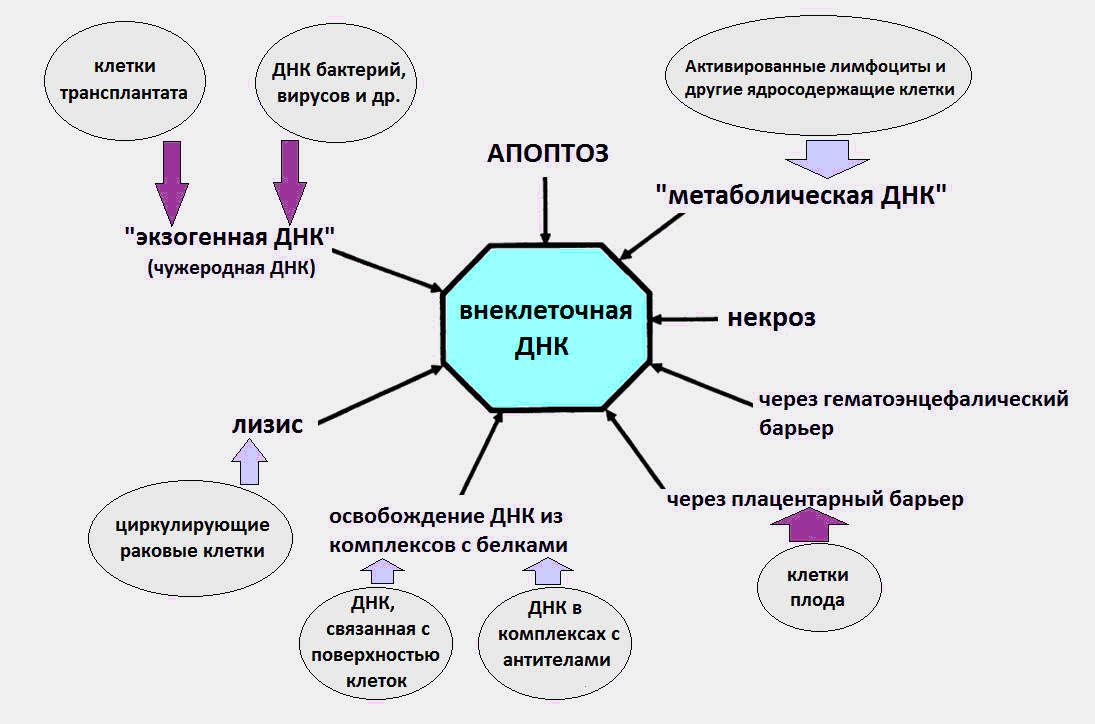 Fig. 1 Las diversas formas en que cfDNA entra en la circulación.
Fig. 1 Las diversas formas en que cfDNA entra en la circulación.Más detalles sobre todos los aspectos de la biología del cfDNA (efectos inmunomoduladores, recepción de cfDNA en la superficie celular, etc.) se pueden encontrar en una revisión detallada del profesor Kozlov V.A. (Instituto de Investigación de Inmunología Clínica SB RAMS) [8].
ADN extracelular como biomarcador para diversas patologías
La lógica sugiere que los niveles de cfDNA deberían cambiar con las patologías que acompañan a la muerte celular en masa. Varios estudios han demostrado un aumento significativo en los niveles de cfDNA con el desarrollo de enfermedades autoinmunes (lupus eritematoso sistémico, esclerodermia sistémica, artritis reumatoide, etc.) y que hay rasgos característicos de cfDNA típicos de cierta patología autoinmune [8-10].
También se sabe que en el infarto agudo de miocardio, que acompaña la muerte de las células cardíacas por el tipo de necrosis y apoptosis, los niveles de cfDNA también aumentan. Y esto tenía un valor diagnóstico potencial, ya que los pacientes que desarrollaron complicaciones tenían niveles más altos que aquellos que se recuperaban mejor [11].
En los pacientes que han tenido un accidente cerebrovascular agudo, la concentración de cfDNA en el plasma sanguíneo, medida en 24 horas, se correlaciona con la gravedad del accidente cerebrovascular y puede servir como predictor de mortalidad y gravedad del resultado incluso en aquellos pacientes que no tienen cambios visibles detectados por los métodos de neuroimagen [12,13] .
Se sabe que el cfDNA se caracteriza por la presencia de una gran cantidad de secuencias de guanina-citosina (GC), que son más resistentes a la destrucción por nucleasas que los fragmentos de ADN de adenina-timina. Por lo tanto, el contenido de una secuencia específica del genoma enriquecida por GC (la región transcrita de la repetición ribosómica) en el ADNc es varias veces mayor que el contenido de esta repetición en el ADN nuclear [14].
Y en las patologías crónicas acompañadas de la activación de la muerte celular (enfermedad coronaria, hipertensión arterial, patologías autoinmunes), el contenido de estas secuencias marcadoras ricas en GC en el ADNc de la sangre aumenta en 10 o más veces [15]. Esto hace posible utilizar los parámetros del ADN ribosómico enriquecido con GC como parte del cfDNA como biomarcador de un proceso patológico crónico.
En la lucha contra el cáncer, la tarea es detectar un tumor en la etapa más temprana posible. Aquí, cfDNA es de gran interés como biomarcador de tumorigénesis.
Se detectaron mutaciones puntuales en el ADNc tumoral en la sangre de los pacientes mucho antes de que se hiciera el diagnóstico [16].
Acerca de los niveles de cfDNA en oncología, buscando mutaciones específicas de ccDNA en carcinogénesis, como oncogenes KRAS, HER2, BRCA1, APC, PIK3CA, BRAF, etc., usando ADN mitocondrial como marcador en ccDNA, estudiando cambios genéticos y epigenéticos característicos Los ADNc, como la hipometilación de elementos móviles de Alu, en el caso de tumores, el uso del "índice de integridad" de ADNc y otros aspectos se pueden encontrar en los trabajos de Vasilieva et al., Gonzalez-Masia et al. [17, 18].
Se ha establecido que el cfDNA se caracteriza por un estado de oxidación mucho más fuerte bajo la influencia de especies reactivas de oxígeno (ROS) que el ADN nuclear.
Por lo tanto, el contenido del conocido marcador de oxidación del ADN, 8-ohodG, en la composición del ADN nuclear normalmente y para diversas patologías varía de 1 a 10 por millón de nucleótidos, y el contenido de este marcador en el ADNc es de 300 o más por millón de nucleótidos [19].
Se estableció un fuerte aumento en el contenido de 8-ohdG en cfDNA en oncología y enfermedades cardiovasculares, que se acompañan de estrés oxidativo, y pueden alcanzar valores de 3000 8-oxodG por millón de nucleótidos [20].
En general, se cree que los niveles de 8-ohdG en el ADNc son un marcador sensible del estrés oxidativo total en el cuerpo.
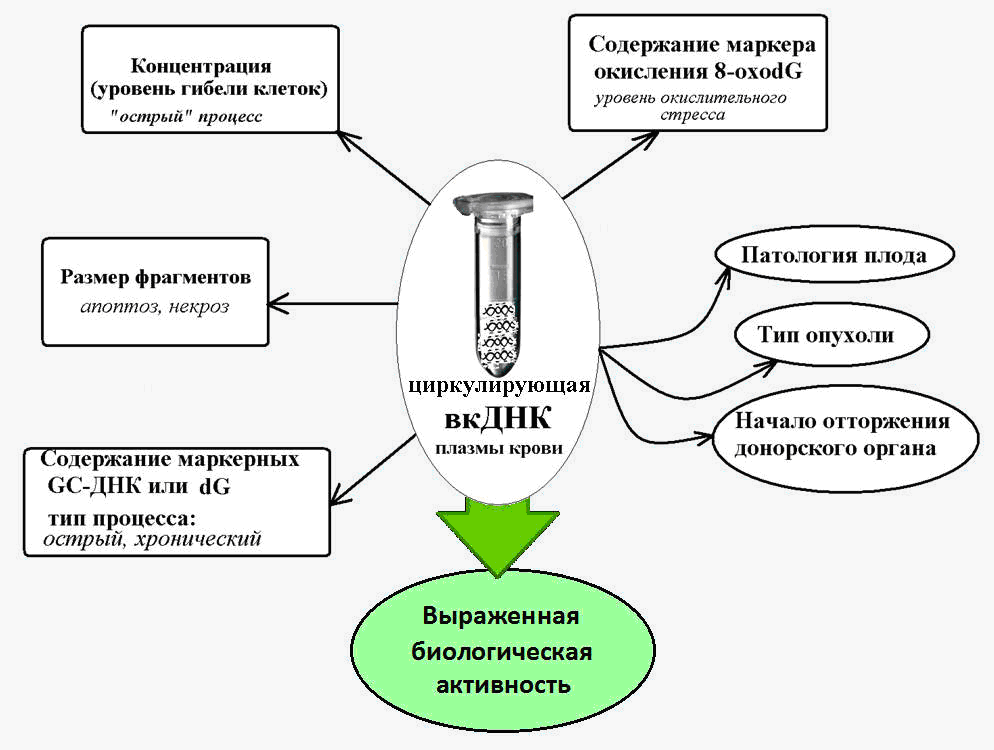 Fig. 2. ADN extracelular circulante: un marcador en diversas afecciones patológicas, acompañado de un aumento de la muerte celular.
Fig. 2. ADN extracelular circulante: un marcador en diversas afecciones patológicas, acompañado de un aumento de la muerte celular.ADN extracelular como elemento móvil
Un avance importante y muy importante en los estudios sobre el papel del cfDNA en los procesos internos ocurrió hace 3 años. En 2015, un grupo de investigadores hizo un descubrimiento emocionante, que demostró que el ADNc, como los elementos genéticos móviles, puede invadir el ADN nuclear y causar mutaciones en el genoma [21]. Todo esto es muy sorprendente.
En trabajos anteriores, ya se demostró que el ADN tumoral de la sangre puede tener la capacidad de integrarse en el ADN nuclear. Se colocaron fibroblastos de ratón en plasma tomado de pacientes con cáncer de colon, después de lo cual se detectaron oncogenes K-ras y genes de la proteína p53 involucrados en la apoptosis en el ADN de las células del ratón, y las células mismas se transformaron con el oncogén (causaron cáncer en ratones sanos) [22 ] Esto indica que el ADN del plasma fue absorbido e integrado por las células colocadas en él. Este supuesto fenómeno, la absorción por parte de células sanas de oncogenes del ADNc que circula en la sangre, puede ser responsable del proceso de metástasis y se denomina "genomeastasis".
En otro trabajo, se proporcionaron datos sobre la absorción e integración de fragmentos del gen DYS14 específicos para el cromosoma Y en el cerebro de una mujer que tiene un feto masculino [23].
En un estudio de 2015, los científicos rastrearon cómo los ADNc etiquetados con fluorescencia tomados de pacientes con cáncer y personas sanas se insertaban fácilmente en el ADN nuclear de fibroblastos murinos en experimentos in vitro (es decir, fuera de un organismo vivo, en cultivos celulares). Además, el ADNc humano se localizó en los núcleos de las células del ratón durante varios minutos, y casi el 100% de los núcleos de las células del ratón mostraron señales fluorescentes durante 30 minutos.
La secuenciación de todo el genoma de las células de ratón mostró la presencia de fragmentos de ADN humano en él, incluidos los elementos móviles característicos de Alu. Además, los autores encontraron la inducción de focos γ-H2AX derivados del daño en el ADN, así como un aumento en la actividad de caspasa-3 y la expresión de los genes ATM, p53, p21, GADD-34 y ADN ligasa. Lo que en conjunto indica una mayor inestabilidad del genoma, la activación de la respuesta al daño del ADN y la apoptosis.
Luego, los autores probaron el efecto de ADNc extraño in vivo en un organismo vivo. Los ratones fueron inyectados por vía intravenosa con ADNc humano, fragmentos de los cuales fueron encontrados en el corazón, pulmones, hígado y cerebro de ratones que fueron sacrificados 7 días después de la inyección.
Además, las partículas de ADN humano administradas a ratones pudieron cruzar la barrera hematoencefálica y penetrar en el cerebro. Como en el caso de las células en cultivo, la administración intravenosa de ADNc causó la inducción de γ-H2AX, la caspasa-3 proapoptótica y la activación de la respuesta al daño del ADN. Y es la respuesta al daño del ADN, según los científicos, lo que juega un papel central en la integración de cfDNA en nuclear.
El ADN nuclear percibe la introducción de extracelular como una ruptura bicatenaria y comienza a "parchearse", incorporando el ADN circulante en su composición: "La activación de la respuesta al daño del ADN combina varios cfDNA heterogéneos y cromatina fragmentada en concatemers largos a través de una conexión no homóloga de los extremos como parte del proceso de recuperación".
Como resultado, los autores llegan a la conclusión paradójica: "Al ser omnipresente y ocurrir constantemente, el daño al ADN nuclear causado por el ADN circulante extracelular puede ser la causa principal del envejecimiento asociado con anormalidades del envejecimiento y la muerte final del cuerpo. Por lo tanto, el ADN, tal vez, juega un papel paradójico como el guardián de los fundamentos de la vida y el destructor de la vida misma ".
No es necesario decir que esta conclusión es muy contraria a todas las ideas sobre el envejecimiento actual.
La lógica sugiere que esta hipótesis correspondería a la siguiente dependencia: cuanto más larga es la vida de una especie, menor es el individuo de esta forma de ADN y / o es menos peligroso para esta especie.
Pero hasta que se haya completado dicho estudio comparativo, queda por suponer que en las especies de larga vida (humanos) y de corta vida (ratones) se producen cfDNA, presumiblemente, en cantidades relativamente comparables. Y el descubrimiento de mayores concentraciones de estas moléculas en los ancianos puede ser, por el contrario, una consecuencia del proceso de envejecimiento, y no su causa.
Aunque esta es una consecuencia que puede fortalecer la causa. Lee el artículo de Belikov.
Además, los autores del descubrimiento sugieren atribuir cfDNA a otra clase de elementos genéticos móviles. Y luego, tal vez, su amplia participación en la evolución de un proceso como la transferencia horizontal de genes, tanto en invertebrados como en vertebrados, representantes del mundo animal, obtenga su explicación. Gracias a lo cual, según uno de los últimos datos, el genoma humano podría tomar prestadas varias decenas de genes de otras especies [24]
Queda abierta una pregunta muy importante: ¿cómo entran exactamente los cfDNA en la célula? Las hipótesis existentes incluyen la sugerencia de que las partículas que contienen ADN pueden penetrar en las células a través de los poros de la membrana, así como a través de diferentes tipos de endocitosis, macropinocitosis dependiente de proteoglicanos o al interactuar con proteínas de membrana.
ADN extracelular para la obesidad, inflamación, rayos X y estrés de varios tipos
Otro descubrimiento interesante fue realizado un año después por investigadores japoneses. Pudieron describir la participación activa de cfDNA, que apareció en la sangre como resultado de la muerte de adipocitos en personas obesas, en el desarrollo de inflamación y resistencia a la insulina. El factor clave que interactúa con el ADNc en estos procesos fue la molécula de inmunidad innata Toll-like receptor 9 (TLR9) [25].
No sin intriga por parte de los científicos rusos del Instituto de Biofísica Teórica y Experimental de la Academia de Ciencias de Rusia. Descubrieron que la irradiación con rayos X y el medicamento antidiabético metformina causan un aumento en la excreción urinaria de ADNc (nuclear y mitocondrial) en ratas.
Sus datos mostraron que antes de los experimentos, la cantidad de ADNc nuclear era un 40% más alta, y la del ADNc mitocondrial era un 50% más alta en la orina de las ratas de edad avanzada en comparación con las ratas jóvenes.
12 horas después de la irradiación, el contenido de i-fccDNA y mt-fcDNA en la orina de ratas jóvenes aumentó en un 200% y 460%, respectivamente, en comparación con el control, mientras que en la orina de ratas ancianas aumentó en un 250% y 720%.
6 horas después de la administración de metformina a otras ratas, la cantidad de i-cfDNA y mt-fcDNA en la orina de ratas jóvenes aumentó en un 25% y 55% y en un 50% y 160% en la orina de ratas ancianas.
Según los autores, estos datos sugieren que los rayos X y la metformina causan un aumento significativo en el cfDNA en la orina de rata (especialmente los viejos), causado por la muerte celular activa en los tejidos. Estos resultados también sugieren que la metformina puede actuar como un senolítico, iniciando la muerte de células viejas que contienen trastornos estructurales y funcionales [26].
En octubre del año pasado, los científicos rastrearon la relación de los niveles de ADNc con el estrés mental y la actividad física en jóvenes de 18 a 36 años. Los resultados mostraron un aumento doble en el ADNc después del estrés agudo de laboratorio psicosocial (TSST) y un aumento de cinco veces en el ADNc después del ejercicio en la cinta (con el logro del agotamiento de la cinta).
También se registró una mayor cantidad de fragmentos más cortos de ADNc, característicos de la apoptosis, en la sangre después del agotamiento físico.
El ADN mitocondrial extracelular mostró el mismo aumento después de ambas cargas de estrés. Además, los perfiles de metilación de ADNc utilizados en este trabajo como un marcador para diferentes orígenes celulares fueron significativamente diferentes para diferentes pruebas de estrés.
Para el análisis de la metilación, los científicos seleccionaron el gen HOXA5 que participa activamente en el desarrollo embrionario debido a la especificidad de su metilación en diferentes tipos de células. Por lo tanto, se caracteriza por la hipermetilación en las células musculares, la hipometilación en las células cerebrales, de las líneas celulares del hipocampo y las neuronas cultivadas, y la metilación diferencial en las células sanguíneas.La metilación del gen HOXA5 en el ADNc disminuyó inmediatamente después del estrés psicosocial y aumentó después del estrés físico, lo que, según los autores, indica varias fuentes celulares de liberación activa de ADN nuclear. [27]ADN extracelular y envejecimiento
Ahora lo principal. Examinemos la relación entre los niveles y las características específicas de cfDNA con el envejecimiento.Los primeros trabajos que mostraron esta relación fueron publicados en 2011-13. Los microbiólogos e inmunólogos finlandeses de la Universidad de Tampere estudiaron los valores de ADNc en hígados mayores de 90 años, participantes en el estudio Vitality 90+ y jóvenes (de 22 a 37 años) como grupo de control.Los resultados de su trabajo mostraron que la concentración de cfDNA en hígados largos fue significativamente mayor que en los jóvenes. También hubo diferencias características en el ADNc: en las personas mayores estaba representado más por fragmentos de bajo peso molecular, en los jóvenes estaba representado por más fragmentos de alto peso molecular, es decir, más largos.En los siguientes estudios, el mismo grupo mostró que los niveles de cfDNA tenían una relación clara con los marcadores de inflamación (correlacionados positivamente con los niveles de proteína C reactiva, amiloide A en suero (SAA), etc.) y la mortalidad en personas mayores de 90 años. Además del hecho de que los niveles más altos de ADNc total e hipometilado se asociaron con inflamación sistémica y el desarrollo de astenia senil (fragilidad) [28-30].Dos de los estudios recientes más recientes sobre cfDNA y envejecimiento mostraron cambios epigenéticos característicos en este ADN.En uno de ellos, un equipo de científicos analizó cómo la metilación de los elementos genéticos móviles LINE-1 y Alu en el ADNc de personas sanas de 23 a 61 años cambia con la edad.El elemento LINE-1 tiene una longitud de aproximadamente 6 mil pb, mientras que los fragmentos de alto peso molecular de ADNc, en comparación, tienen un tamaño de más de 10 mil pbLINE-1 se refiere a retroelementos, es decir a elementos móviles que utilizan la transcripción inversa para su reproducción, la transferencia de información genética del ARN al ADN. LINE-1 es el único elemento móvil del genoma conocido hoy que conserva la capacidad de reproducir y mover sus copias en el genoma. Además, esta es la estructura móvil humana más numerosa: las copias de LINE-1 ocupan una gran parte del ADN, una quinta parte del genoma completo.El segundo elemento, Alu, no puede multiplicarse y hacer nuevas inserciones en el genoma por sí solo, y en este proceso depende del aparato genético del elemento LINE-1 (para más detalles sobre los retroelementos del genoma, consulte el artículo en Popular Mechanics " Retrovirus: la" quinta columna de ADN ").Los resultados del estudio mostraron que con el envejecimiento, hay una disminución significativa en la metilación de los retroelementos LINE-1 y Alu, y este proceso fue notablemente más intenso en los fumadores.Como se descubrió hoy, la actividad de los elementos LINE-1 y Alu, que pueden insertar sus copias en el genoma, contribuyen a una parte significativa de las enfermedades genéticas humanas y el cáncer. Se conocen más de 100 inserciones (insertos) mediadas por LINE-1 que conducen a enfermedades genéticas humanas, y se han encontrado varios insertos de LINE-1 que interrumpen los genes supresores de tumores y provocan cáncer [31].En un segundo estudio, los científicos confirmaron una disminución en la metilación de los elementos LINE-1 y Alu en el ADNc con la edad. Además, entre 4 grupos en el estudio (hígados largos sanos de más de 100, hígados largos no saludables de más de 100 años, personas mayores (71 años) y jóvenes (25 años)), hígados largos sanos con jóvenes y personas mayores con hígados largos no saludables tenían características similares:“Constantemente en nuestro estudio, notamos una mayor similitud en los perfiles de cfDNA, tanto global como localmente, entre los hígados largos jóvenes y sanos, a diferencia de los hígados largos ancianos y no saludables. Por lo tanto, nuestro estudio sugiere que la creación de perfiles de ADNc de fcD puede usarse no solo como un biomarcador de la edad, sino también como un predictor de la salud general ". [32]Por lo tanto, el ADN circulante extracelular resultó estar estrechamente relacionado con el estado de salud y los procesos que ocurren en el cuerpo durante el envejecimiento: estrés oxidativo, inflamación y patologías relacionadas con la edad.Los métodos de investigación modernos, como la PCR cuantitativa en tiempo real, permiten el uso de cfDNA como un biomarcador muy sensible de los procesos relacionados con el envejecimiento.Los estudios han demostrado el gran valor potencial del análisis de ADNc en el diagnóstico de cáncer, transplantología, enfermedades cardiovasculares y renales, fibrosis, diagnóstico prenatal (durante el embarazo), lesiones y sepsis, así como medicina deportiva.Los datos de que el ADNc puede exhibir las propiedades de un elemento móvil e integrarse en el ADN nuclear, afectando así el desarrollo de patologías asociadas con mutaciones y envejecimiento en general, también son de indudable interés.Todo esto requiere más investigación y refinamiento.La revisión fue preparada por: Alexey Rzheshevsky y un poco de Mikhail BatinReferencias- Jahr S, Hentze H, Englisch S, Hardt D, Fackelmayer FO, Hesch RD, Knippers R. DNA fragments in the blood plasma of cancer patients: quantitations and evidence for their origin from apoptotic and necrotic cells. Cancer Res. 2001 Feb 15;61(4):1659-65.
- Deligezer U1, Yaman F, Erten N, Dalay N. Frequent copresence of methylated DNA and fragmented nucleosomal DNA in plasma of lymphoma patients. Clin Chim Acta. 2003 Sep;335(1-2):89-94.
- Bishoff FZ, Dang D., Horne C., Marquez-Do D., Brincley WR, Levis DE Fetal DNA in maternal plasma circulates as apoptotic bodies: elucidations of structural nature of fetal DNA for non-invasive prenatal genetic diagnosis // Am. J. Hum. Genet. 2003. V. 73. P. 189.
- Sivanandham R, Brocca-Cofano E, Krampe N, Falwell E, Venkatraman SMK, Ribeiro RM, Apetrei C, Pandrea. Neutrophil extracellular trap production contributes to pathogenesis in SIV-infected nonhuman primates. J Clin Invest. 2018 Nov 1;128(11):5178-5183.
- Rogers JC, Boldt D., Kornfeld S. Excretion of deoxyribonuclein acid by lymphocytes stimulated with phytohemagglutinin or antigen // Proc. Nat. Acad. Sci. USA. 1972. V. 69, No 7. P. 1685–1689.
- ., .. . 2007. . .149, .23-32.
- Lerner RA, Meinke W., Goldstein DA Membrane-associated DNA in the cytoplasm of diploid human lymphocytes // Proc. Nat. Acad. Sci. USA. 1971. V. 68, No 6. P. 1212–1216.
- .. . . 2013;15(5):399-412.
- Galeazzi M, Morozzi G, Piccini M, Chen J, Bellisai F, Fineschi S, Marcolongo R. Dosage and characterization of circulating DNA: present usage and possible applications in systemic autoimmune disorders. Autoimmun Rev 2003;2:50-5.
- Leon SA, Revach M, Ehrlich GE, Adler R, Petersen V, Shapiro B. DNA in synovial fluid and the circulation of patients with arthritis. Arthritis Rheum 1981;24:1142-50.
- Destouni A, Vrettou C, Antonatos D, Chouliaras G, Traeger-Synodinos J, Patsilinakos S, et al. Cell-free DNA levels in acute myocardial infarction patients during hospitalization. Acta Cardiol 2009;64:51-7.
- Rainer TH, Wong LKS, Lam W, Yuen E, Lam NYL, Metreweli C, Lo YMD. Prognostic Use of Circulating Plasma Nucleic Acid Concentrations in Patients with Acute Stroke. Clin Chem 2003; 49:562-9.
- Lam NY, Rainer TH, Wong LK, Lam W, Lo YM. Plasma DNA as a prognostic marker for stroke patients with negative neuroimaging within the first 24 h of symptom onset. Resuscitation 2006; 68:71-8.
- .., .., .., .., .., .., .., .., .., .., — , , 2008, : 54(1), 78-93.
- Bulicheva, N. et al. Effect of cell-free DNA of patients with cardiomyopathy and rDNA on the frequency of contraction of electrically paced neonatal rat ventricular myocytes in culture. Ann NY Acad Sci. 2008. V. 1137. P. 273-277.
- Lecomte, T. Circulating free tumor DNA and colorectal cancer/ T. Lecomte, N. Ceze, E.
- Dorval, P. Laurent-Puig // Gastroenterol Clin Biol. 2010. V. 34. № 12. P. 662- 681.
- ., .. . . 2013.-N 6.-.673-681
- Gonzalez-Masia, JA et al. Circulating nucleic acids in plasma and serum (CNAPS): applications in oncology. Onco Targets Ther. 2013. V. 8. № 6. P. 819-32.
- Ermakov, AV et al. Oxidized extracellular DNA as a stress signal in human cells. Oxid Med Cell Longev. 2013. V. 2013. P. 649-747.
- Loseva, P. et al. Extracellular DNA oxidation stimulates activation of NRF2 and reduces the
- production of ROS in human mesenchymal stem cells. Expert Opin. Biol. Th. 2012. V.12. № 1. P. 85-97.
- Mittra I, Khare NK, Raghuram GV, et al. Circulating nucleic acids damage DNA of healthy cells by integrating into their genomes. J Biosci. 2015;40(1):91–111.
- Garcia‐Olmo DC, Dominguez C, Garcia‐Arranz M, Anker P, Stroun M, Garcia‐Verdugo JM, Garcia‐Olmo D (2010) Cell‐free nucleic acids circulating in the plasma of colorectal cancer patients induce the oncogenic transformation of susceptible cultured cells. Cancer Res. 70, 560–567
- Chan W, Gurnot C, Montine TJ, Sonnen JA, Guthrie KA, Lee Nelson J (2012) Male Microchimerism in the Human Female Brain. PLoS ONE 7, e45592.
- Crisp A, Boschetti C, Perry M, et al.: Expression of multiple horizontally acquired genes is a hallmark of both vertebrate and invertebrate genomes. Genome Biol. 2015;16:50. 10.1186/s13059-015-0607-3
- Sachiko Nishimoto, Daiju Fukuda et al. Obesity-induced DNA released from adipocytes stimulates chronic adipose tissue inflammation and insulin resistance. Sci Adv. 2016 Mar; 2(3): e1501332.
- Gaziev A, Abdullaev S, Minkabirova G, Kamenskikh K. X-rays and metformin cause increased urinary excretion of cell-free nuclear and mitochondrial DNA in aged rats. J Circ Biomark. 2016 Oct 25; 5:1849454416670782.
- Hummel EM, Hessas E, Müller S, Beiter T, Fisch M, Eibl A, Wolf OT, Giebel B, Platen P, Kumsta R, Moser DA Transl Psychiatry. 2018 Oct 29;8(1):236.
- Jylhävä J1, Kotipelto T, Raitala A, Jylhä M, Hervonen A, Hurme M. Aging is associated with quantitative and qualitative changes in circulating cell-free DNA: the Vitality 90+ study.
- Mech Ageing Dev. 2011 Jan-Feb;132(1-2):20-6.
- Jylhävä J1, Jylhä M, Lehtimäki T, Hervonen A, Hurme M. Circulating cell-free DNA is associated with mortality and inflammatory markers in nonagenarians: the Vitality 90+ Study. Exp Gerontol. 2012 May;47(5):372-8.
- Jylhävä J1, Nevalainen T, Marttila S, Jylhä M, Hervonen A, Hurme M. Characterization of the role of distinct plasma cell-free DNA species in age-associated inflammation and frailty. Aging Cell. 2013 Jun;12(3):388-97.
- Lars Erichsen,a Agnes Beermann et al. Genome-wide hypomethylation of LINE-1 and Alu retroelements in cell-free DNA of blood is an epigenetic biomarker of human aging. Saudi J Biol Sci. 2018 Sep; 25(6): 1220–1226.
- Teo YV, Capri M, Morsiani C, Pizza G, Faria AMC, Franceschi C, Neretti N. Cell-free DNA as a biomarker of aging. Aging Cell. 2019 Feb;18(1):e12890.