El tema de los dispositivos de visión es una parte prominente de la neurobiología. Enormes volúmenes de literatura y cuatro premios Nobel están dedicados a este tema, pero en esta situación uno no puede dejar de notar que el dispositivo de visión de mamíferos descrito en los libros de texto no hace frente a la tarea. El propósito de este ensayo es mostrar una serie de razones por las cuales no debe hacer la vista gorda a esto. De hecho, se presentará un retrato del secreto de la visión, que abarca desde una variedad de pequeños detalles al comienzo del flujo de información visual en los mamíferos, la amenaza de ignorarlos y terminar con un montón de problemas para comprender el procesamiento del cerebro al final del camino.
Dispositivo de sistema de visión
A los ojos de cualquier libro de texto sobre visión, vemos en tres etapas. La primera etapa: la luz ingresa a la retina y se convierte en la excitación nerviosa de los fotorreceptores, neuronas sensoriales de la retina. Además, el ojo normaliza el contraste y el brillo, enfoca la imagen.
La segunda etapa: el proceso en la retina, cuando el mapa de excitaciones nerviosas de los fotorreceptores se transforma en un flujo de información paralelo, cada uno de los cuales codifica su propio aspecto de información visual. Las células ganglionares, cuyos axones forman el nervio óptico, en la retina son mucho más pequeños que los fotorreceptores, se produce la primera compresión de información. Una célula ganglionar puede ser responsable de codificar una señal desde varias en el centro hasta cientos y miles de fotorreceptores en la periferia de la retina. (Figura 1) Las células ganglionares se dividen en dos tipos principales, según la ruta desde el nervio óptico, la señal ingresa a la corteza de los hemisferios cerebrales. Un tipo que prevalece cuantitativamente (80% en las personas) proporciona una gran agudeza visual y percepción del color, el contraste de imagen estable es importante para ellos. Por razones históricas, se llaman células PC o células enanas, ya que la señal de ellas pasa a través de las capas parvocelulares (células pequeñas) de los cuerpos acodados laterales. El segundo tipo de células MC, su señal pasa a través de las capas magnocelulares (células grandes) de los cuerpos acodados laterales. Son responsables de la percepción del movimiento, ya que tienen una mayor sensibilidad a las imágenes que parpadean o se mueven.


 Figura 1. Medición de las propiedades de los campos receptivos. (A) La respuesta de una neurona (una secuencia de potenciales de acción o "adherencias") se controla mediante el registro extracelular de un animal anestesiado por el electrodo en el cuerpo intermedio del cigüeñal (LGN). Los estímulos se entregan a la porción del campo visual correspondiente a la neurona. (B) Tabla de respuestas condicionales de diferentes tipos de neuronas. Cada columna muestra la respuesta de un tipo de neurona. Cada fila muestra respuestas a un tipo de estímulo. Por ejemplo, una neurona que es selectiva en la dirección del movimiento (segunda columna) reacciona solo cuando el estímulo se mueve a través del campo receptivo de izquierda a derecha. Las neuronas que tienen campos receptores estándar "centro / ambiente" son tolerantes al tamaño y la motilidad del estímulo. Los tipos de neuronas no estándar exhiben requisitos de estímulo mucho más intransigentes.
Figura 1. Medición de las propiedades de los campos receptivos. (A) La respuesta de una neurona (una secuencia de potenciales de acción o "adherencias") se controla mediante el registro extracelular de un animal anestesiado por el electrodo en el cuerpo intermedio del cigüeñal (LGN). Los estímulos se entregan a la porción del campo visual correspondiente a la neurona. (B) Tabla de respuestas condicionales de diferentes tipos de neuronas. Cada columna muestra la respuesta de un tipo de neurona. Cada fila muestra respuestas a un tipo de estímulo. Por ejemplo, una neurona que es selectiva en la dirección del movimiento (segunda columna) reacciona solo cuando el estímulo se mueve a través del campo receptivo de izquierda a derecha. Las neuronas que tienen campos receptores estándar "centro / ambiente" son tolerantes al tamaño y la motilidad del estímulo. Los tipos de neuronas no estándar exhiben requisitos de estímulo mucho más intransigentes.Ambos tipos de estas celdas tienen una organización de tipo centro / entorno: una estrategia de codificación supuestamente universal para la información visual. (Figura 2) El mejor estímulo para lograr la respuesta más energética de las células ganglionares es una mancha más o menos redondeada y pequeña en la retina, y cuanto más intensamente se destaca contra el fondo circundante (mancha brillante u oscura), más enérgica es la respuesta celular.
Tercera etapa: la señal se procesa en el cerebro. Desde un punto de vista generalmente aceptado, los principales procesos de procesamiento cerebral comienzan en la corteza visual primaria. Se produce otra grabación importante, las neuronas no solo responden a los puntos oscuros y claros en la superficie de la retina, sino que también se vuelven selectivamente sensibles a los límites de contraste orientados, las secciones de líneas orientadas y sus extremos. Hay configuraciones más complejas de estímulos, cuando las neuronas responden con precisión al límite de contraste independientemente de la posición, si solo está en la zona de responsabilidad de la célula. Este procesamiento "complejo" en la corteza visual se utiliza como el segundo nivel de abstracción en la percepción de una imagen estática, donde el reconocimiento ha alcanzado un nuevo nivel más general de percepción de los límites, independientemente de su posición. Como resultado: primero, la retina transmite señales simples a la corteza cerebral; en segundo lugar, las neuronas de la corteza visual primaria usan estas señales simples para detectar bordes y líneas contrastantes; y en tercer lugar, estos bloques de construcción fundamentales se utilizan para definir los límites de objetos completos y crear una percepción visual.
Probablemente nadie supuso que este punto de vista se convertiría en un dogma fundamental de granito. La detección de bordes se ha visto como si fuera la única forma para que los mamíferos vieran cómo la evolución encontró la solución perfecta al problema de la percepción efectiva de la imagen. En este ensayo, este punto de vista será cuestionado y se harán preguntas incómodas sobre la naturaleza de la visión. Ya se han planteado más de una vez en la historia del estudio de la visión y no sugieren respuestas simples. Así que ahora la tarea principal es concentrarse en estos temas, reuniendo los motivos de duda en la comprensión moderna del dispositivo de visión.
La retina de todos los mamíferos envía señales no estándar al cerebro.
Un estudio exhaustivo de la vía del flujo visual desde los ojos hasta la corteza cerebral en los primates confirma categóricamente que, como en otras especies de mamíferos, muchos canales paralelos contribuyen funcionalmente al flujo visual de los primates [1–4]. (Figura 2) Algunos de estos canales incluso ignoran la corteza visual primaria e inmediatamente van a departamentos de jerarquía superior [5]. Mucho de esto se mencionó en los estudios clásicos de la anatomía de gatos y monos [6–10], pero fue ignorado por los pioneros de la neurobiología en el estudio de la corteza visual. El uso agresivo del principio de la navaja de afeitar Occam permitió dar sentido a las propiedades de las neuronas corticales, ya que desarrollan su función de reconocer líneas o bordes únicamente sobre la base de los aportes de las células ganglionares con la organización "centro / ambiente" [11]. Las células ganglionares con una organización no estándar se descartaron, teniendo un número relativamente bajo de primates en la retina. A continuación se describirá su papel en la percepción visual y, desde el punto de vista de los profesionales de la neurobiología, vale la pena señalar que con la introducción arbitraria de un electrodo en el nervio óptico, la probabilidad de encontrar un axón de una célula ganglionar no estándar es bastante pequeña. Dado que las células no estándar son raras, la mayoría de los experimentadores optaron por seguir el camino de menor resistencia, creando métodos para proyectar estímulos visuales en la retina que son más adecuados para estudiar las células del centro / entorno, lo que convirtió las células no estándar en una "explosión" estadística en datos experimentales.
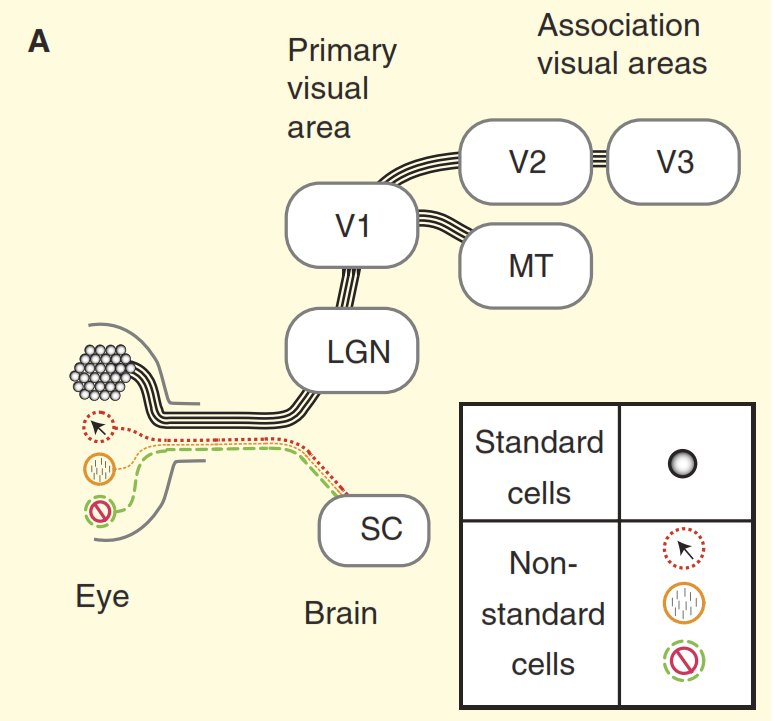
 Figura 2. Percepciones del sistema visual.
Figura 2. Percepciones del sistema visual.
(A) El punto de vista de los libros de texto sobre el diseño del sistema visual de los primates con el ejemplo del macaco. La retina está llena de una gran cantidad de células ganglionares estándar, cuyos axones forman el nervio óptico. La retina también contiene una pequeña cantidad de células ganglionares no estándar que responden a la luz de otras maneras, pero tradicionalmente se supone que se proyectan solo en los centros autónomos del mesencéfalo, es decir, el dicollis superior (SC). Las células concéntricas sobresalen en el núcleo de retransmisión en el tálamo, el cuerpo acodado intermedio (LGN), que a su vez transmite señales a la corteza visual primaria (V1). Y las células estándar a través del cuerpo acodado intermedio (LGN) transmiten una señal a la corteza visual primaria (V1) y luego a las secciones más altas de la corteza visual (V2, V3, MT).
(B) Una vista más realista del sistema visual de primates. Algunas de las células ganglionares no estándar envenenan la señal directamente al cuerpo acodado intermedio (LGN) y luego a la corteza visual primaria. Además, el diodo superior no es una dirección de callejón sin salida, desde allí la señal va al cuerpo acodado intermedio (LGN) y más allá. Pero eso no es todo, comenzando con el cuerpo acodado intermedio (LGN), el flujo visual deja de ser unidireccional y su componente inverso es más poderoso que el directo.El segundo problema se ilustra en la Figura 3. El gráfico superior de la figura muestra la respuesta de la celda "centro / ambiente". El esquema de reacción básico es muy familiar para los neurocientíficos involucrados en la visión: las células ganglionares estándar del centro / ambiente muestran una curva de la línea de respuesta a la frecuencia espacial; la respuesta máxima ocurre cuando la banda reticular coincide exactamente en ancho con la sección central del campo receptivo del centro / célula medio ambiente ". Pero ahora considere la respuesta de una de las células no estándar en el nervio óptico obtenida en el mismo experimento (Figura 3 b). Esta vez, la célula pertenece al llamado tipo coniocelular de células ganglionares, un conjunto compuesto de tipos de células no estándar, que generalmente se generaliza, si es que se denomina, la "vía azul". Esta célula tiene una organización del tipo "supresión por contraste" [6,7,12,13], en este experimento su respuesta es casi completamente opuesta a la respuesta de un "centro / ambiente" celular estándar. Cuando se tiene en cuenta la diferencia en la agudeza visual de monos y gatos, las células ganglionares de "supresión por contraste" se comportan de manera idéntica [12,13].
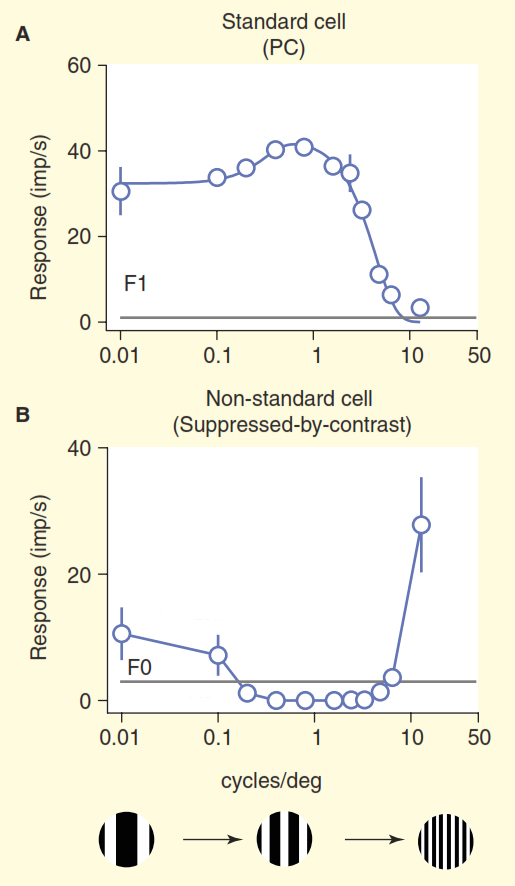 Figura 3. Comparación de campos receptivos estándar y no estándar. Las células fueron estimuladas por una rejilla a la deriva con una frecuencia espacial variable (la frecuencia aquí se expresa como el ancho total de dos bandas de blanco y negro en la rejilla por grado de ángulo de visión). La célula ganglionar estándar "centro / ambiente" (A) se comporta como se esperaba: cuando el ancho de la banda reticular está cerca del ancho del centro del campo receptivo, la célula da una respuesta fuerte. Una celda no estándar con "supresión de contraste" (B) es silenciosa en lugar de excitada, siempre que sea capaz de distinguir entre rayas blancas y negras.
Figura 3. Comparación de campos receptivos estándar y no estándar. Las células fueron estimuladas por una rejilla a la deriva con una frecuencia espacial variable (la frecuencia aquí se expresa como el ancho total de dos bandas de blanco y negro en la rejilla por grado de ángulo de visión). La célula ganglionar estándar "centro / ambiente" (A) se comporta como se esperaba: cuando el ancho de la banda reticular está cerca del ancho del centro del campo receptivo, la célula da una respuesta fuerte. Una celda no estándar con "supresión de contraste" (B) es silenciosa en lugar de excitada, siempre que sea capaz de distinguir entre rayas blancas y negras.Solo podemos suponer que estas células reconocen un relleno monótono en su área de responsabilidad, por ejemplo, un cielo azul claro, ya que cuando el ancho de las barras blancas y negras de la rejilla disminuye por debajo de la resolución del ojo humano, se funden en un gris sólido. Una verdadera comprensión de la codificación de la información visual para estas células no se presenta en el modelo de visión estándar.
Todos los no primates ven bien usando células no estándar
Los defensores del modelo de visión aceptado cuando se consideran primates pueden referirse a un número relativamente pequeño de células no estándar, pero esto no se aplica a las retinas de conejos, gatos, ratas y ratones [7,8,14–16]. Además, en números absolutos (alrededor de 100,000), el número de células no estándar en la retina de los primates es cercano al número total de células en la retina de una rata o un gato [17]. La agudeza visual en gatos, conejos, ratas y ratones es menor que en primates, pero esto no es todo. La visión de todas estas criaturas te permite hacer frente con éxito a la supervivencia en la naturaleza. Cualquiera que dude de esto está invitado a intentar acercarse sigilosamente a un conejo en el campo o atrapar un ratón sin usar una trampa para ratones (una tarea simple para un gato ordinario).
 Figura 4. Percepción visual con poco detalle.
Figura 4. Percepción visual con poco detalle.
Los observadores familiarizados con las personas en la imagen los reconocen a pesar del bajo detalle. Al desenfocar una imagen, queda suficiente información visual útil para una persona. De izquierda a derecha: Príncipe Carlos, Woody Allen, Bill Clinton, Saddam Hussein, Richard Nixon, Princesa Diana.Está claro, aunque solo sea por razones médicas, por qué los neurocientíficos se han concentrado en la retina de los primates. Pero tal concentración selectiva al tratar de comprender la visión lleva al hecho de que los experimentadores traen y transfieren los resultados de la autopercepción a la interpretación de los resultados de la investigación. El denso empaque de las células ganglionares de los primates es muy adecuado para detectar fruta comestible en un árbol o para leer el último número de The New York Times, pero no hay una razón particular para considerar tareas tales como summum bonum (lat .: el bien más alto) de la visión. En la imagen evolutiva general, esta agudeza visual extremadamente alta se puede considerar como una adaptación de nicho específica para la detección de objetos de alto contraste a una gran distancia. La mayoría de los mamíferos en la retina no tienen fóvea (la fosa central en la retina), un área especializada con alta agudeza visual que se encuentra en los primates, pero la visión sin un millón de células ganglionares densamente compactas sigue siendo completamente funcional. La prueba se ilustra en la Figura 4, las personas son fácilmente capaces de reconocimiento sin la agudeza visual habitual [18]. En mamíferos no primates, la codificación de estímulos visuales ha sido especialmente bien estudiada en conejos [19-23]. Los conejos tienen ojos grandes, y el sistema óptico es mejor que muchos tipos de primates, y también tienen células ganglionares centrales / ambientales estándar en su retina. Sin embargo, estas células estándar representan solo una cuarta parte de la población total de células ganglionares de la retina, representadas por unos doce tipos funcionales y anatómicos [14,21]. Está claro que cada uno de estos doce tipos de células está aprisionado por la evolución bajo sus propios estímulos visuales. Pero la importancia de este hecho radica en el hecho de que los canales de las células ganglionares no estándar predominan en el flujo visual que fluye hacia el cerebro del conejo. Esta información no es nueva: la innovación es la prueba de que la retina de todos los mamíferos transmite una variedad de canales visuales de codificación al cerebro [4, 13, 24, 25] y que dicha diversidad debe incluirse en cualquier vista realista del dispositivo visual.
Un ejemplo bien conocido son las células que responden selectivamente a la dirección de movimiento del estímulo. Un tipo de ellos envía directamente una señal a los núcleos del tronco encefálico asociados con el movimiento ocular [26]. Pero no se conoce tan bien otro tipo de estas células, cuya señal va no solo al mesencéfalo, sino también a través de los cuerpos laterales acodados a la corteza visual primaria [19]. Tales células no son tan raras, pero no se mencionan en los libros de texto cuando se describe el dispositivo de visión. La señal de las células ganglionares no estándar llega inequívocamente a la corteza visual, pero ¿cómo la usa?
El segundo tipo de célula no estándar (identificado en conejos, gatos y ratones) es el llamado detector de borde local. Al igual que las células que responden selectivamente a la dirección del movimiento, también se consideraron células ganglionares raras, pero ahora sabemos que esto se debió a un error al usar electrodos: probablemente representan aproximadamente el 15% de todas las células ganglionares [23]. Las señales de estas células también alcanzan la corteza visual primaria, pero sus respuestas van mucho más allá de las respuestas visuales estándar [8,22,23]. Estas células responden mejor a objetivos pequeños y de movimiento lento, como un depredador o un animal depredador, que se mueven a una distancia distante. Sin embargo, si hay muchos objetos pequeños, como en un campo texturizado, las celdas dejan de responder. En otras palabras, las células reaccionan a un pequeño objeto en movimiento, pero solo cuando está solo.
El detector de borde local es aparentemente el tipo más numeroso de células ganglionares de la retina en un conejo, pero no se incluyó en el modelo de visión estándar. ¿Pueden estas células formar un sistema de análisis de movimiento a distancias remotas? ¿Cómo procesa la corteza visual las señales de estas células? ¿Cómo perciben otras especies de mamíferos el mundo con células ganglionares estándar y detectores de borde locales, o incluso células con otra compresión de información visual que aún no se ha descubierto?
La corteza visual es más inteligente de lo que reconocen los libros de texto.
Incluso si suponemos que todo el flujo visual está codificado solo por células retinianas estándar, actualmente se sabe que el procesamiento en la corteza visual primaria no se produce exclusivamente de acuerdo con el método propuesto originalmente usando neuronas "simples", "complejas", "hipercomplejas", pero también neuronas "con inhibición terminal". La discusión de este hecho ha tenido mucho espacio en la literatura especializada [27-30].
Los problemas comienzan con otro hecho obvio de que casi todas las neuronas de la corteza cerebral son no lineales, lo que arroja dudas sobre la utilidad de los esquemas jerárquicos con suposiciones lineales en la interpretación de su función [31,32].
En segundo lugar, la idea de tres tipos básicos de células: “simple”, “complejo” e “hipercomplejo” - es una abstracción aproximada de la rica variedad de tipos de células de la corteza visual primaria, identificada por métodos anatómicos [33,34]. En tercer lugar, las neuronas de la corteza visual dependen no solo del flujo visual entrante, sino también de varias señales contextuales de sus vecinos, de modo que la reacción a los mismos estímulos que forman parte de la imagen cotidiana y creados artificialmente por los experimentadores puede variar [27,35].
Las respuestas de las neuronas de la corteza visual ni siquiera se fijan en el tiempo: la eliminación de una pequeña porción de la retina, que conduce a la aparición de un punto ciego, permite que las neuronas que quedan sin trabajo cambien su área de responsabilidad y procesen la información visual de las secciones de trabajo de la retina más cercanas al punto ciego [36].Desde el punto de vista de la anatomía, nada de lo anterior es sorprendente. Solo hasta el 10% de la entrada de una neurona individual proviene de los canales del flujo visual [37], el resto proviene de las neuronas vecinas o de las neuronas ubicadas en partes superiores distantes de la corteza cerebral, donde las neuronas visuales todavía son poco conocidas y la interpretación de sus funciones es una tarea difícil.Por lo tanto, se hace evidente que una vista estándar del dispositivo de visión está atrapada en un pantano de dogmas. ¿Qué pasos se deben tomar para salir de él?Paso 1: revisa los conceptos básicos
La última buena noticia es que las técnicas de imágenes de células retinianas han experimentado una revolución discreta en los últimos 5 años, por lo que ahora es fácil visualizarlas en grandes cantidades y con una calidad de resolución sin precedentes en forma de imagen tridimensional. El problema de encontrar sinapsis y la posición relativa de las células se resuelve fácilmente, ahora se pueden clasificar no solo "a ojo", sino también utilizando métodos de clasificación objetivos [15,16]. El grado de correspondencia entre la tipificación morfológica y la tipificación fisiológica de las células retinianas muestra una relación directa (discutido en [24]). Por lo tanto, los tipos estructurales de células ganglionares de la retina determinan con precisión el número de canales funcionales en el flujo visual.En todos los sistemas visuales de mamíferos estudiados hasta la fecha, los datos anatómicos indican que el número de canales funcionales es aproximadamente doce. En la retina de monos y gatos, las funciones de aproximadamente la mitad de estos canales son bien entendidas. En un conejo, esta proporción es de aproximadamente un tercio; la retina del ratón y la rata, a pesar de su clara ventaja para la investigación genética, permanece en gran parte inexplorada.Por lo tanto, puede ser útil regresar, armado con métodos modernos, a los asuntos pendientes de la década de 1970 [38]. La tarea es completar la determinación de las funciones de las células ganglionares, la primera etapa de la compresión de la información visual, deshacerse de los puntos ciegos desde el principio, y actualizar sus objetivos en el resto del sistema visual.Paso Fijar incentivos
¿Por qué, después de más de medio siglo de investigación, el conocimiento de la fisiología de la visión está tan por detrás del conocimiento de la anatomía, y qué se puede hacer para mejorar la situación? Dejando de lado el problema de la selectividad de la investigación con un electrodo, el problema principal sigue siendo la elección de los métodos para encontrar el estímulo adecuado.Comprender por qué las células ganglionares de la retina y las neuronas en la corteza visual primaria se utilizan en el sistema de visión, cuál es su ajuste a las características del entorno visible, es mucho más difícil de lo que han sugerido los pioneros de la neurociencia. La técnica de investigación clásica era que los experimentadores escuchaban la señal amplificada del electrodo sumergido aleatoriamente en el nervio óptico o en la corteza cerebral mientras movían manualmente el estímulo proyectado sobre la retina en busca del área de responsabilidad de la célula a la que tocaba el electrodo. Método rápido y efectivo, pero con subjetividad y falta de reproducibilidad. Los estímulos reticulares simples y el análisis sistémico lineal son extremadamente efectivos para las células estándar [38,39], pero, como se mencionó anteriormente,Este método es poco adecuado para el estudio de células no estándar y neuronas no lineales de la corteza visual primaria. Los nuevos intentos de determinar conjuntos de estímulos correctos son interesantes [40], pero hasta ahora no hay consenso.La alternativa se basa en la estrategia de correlación inversa [41–43], donde un estímulo seleccionado aleatoriamente por el experimentador se presenta varias veces, y la respuesta celular se usa para calcular el promedio inverso. Por lo tanto, el experimentador puede construir una representación del estímulo promedio que conduce a la respuesta celular más activa. La gran ventaja de este método es que no implica ningún ajuste específico de la célula al estímulo de prueba. Por razones tanto teóricas como analíticas, el estímulo de prueba generalmente se elige como "aleatorio": un tablero de ajedrez parpadeante o alguna otra forma de ruido visual. Esta estrategia es conceptualmente elegante, pero se limita en gran medida al análisis celular con una organización estándar de centro / entorno,dado que las celdas no estándar (por definición) están sintonizadas con características muy no aleatorias de información visual.Otra alternativa utiliza un enfoque más radical. La estrategia es buscar la correlación inversa de la respuesta de la célula a la imagen capturada en video en un entorno diario y presentada en la pantalla del monitor [27,44]. La idea es que el investigador espera una señal de la célula cuando aparece un estímulo importante para ella. La eficacia de dicho método se probó experimentalmente, pero la pregunta sigue siendo qué tan natural debe considerarse una imagen bidimensional, cómo este método tendrá en cuenta los efectos de la no linealidad y el contexto, y aún más cómo interpretar los resultados.¿Nueva teoría general de la visión?
Una comparación inversa del mundo alrededor de las señales en el cerebro puede verse como empirismo, llevado a extremos. Pero, ¿qué pueden ofrecer los teóricos de la neurociencia en contraste con sus compañeros experimentadores? Tienen la oportunidad de ir con éxito más allá del estilo popular actual, desde un punto de vista formal, que es solo una reformulación de resultados experimentales. A pesar de un cuarto de siglo de esfuerzo, la mayoría del trabajo realizado no pudo pasar la prueba del tiempo y no pudo confirmarse en nuevos hechos experimentales. Aunque las formulaciones precisas y compactas de resultados experimentales son importantes, rara vez conducen a la síntesis de nuevos conocimientos, y el deseo de la conveniencia de la evaluación matemática de los datos puede imponer restricciones invisibles en los experimentos. Un ejemplo específico se dio anteriormente:Si el método experimental se limita a presentar rejillas de ancho variable en forma de estímulo, una célula ganglionar con la organización del tipo de "supresión por contraste" aparece solo como un "estallido" en los datos experimentales, sobre los cuales el investigador no puede decir nada más.¿Cómo pueden ayudar los teóricos? Deben ocuparse de aspectos computacionalmente incómodos del sistema nervioso real. Por ejemplo, los fisiólogos experimentales saben muy bien que los sistemas sensoriales son lineales solo cuando el experimentador los obliga a serlo [27,38,45]. Es necesaria una amplia cobertura de la teoría de la visión para hacer frente a tareas como la comprensión de los méritos de la codificación redundante y dispersa en los sistemas visuales, la necesidad de estirar los puentes entre los estudios de la visión en invertebrados y vertebrados [46,47]. La pregunta es si el replanteamiento de la primera etapa en la compresión de la información visual en la retina dará un resultado [46,48-50]. Anteriormente se enfatizó la variedad de canales funcionales del flujo visual, que con toda su diversidad nos sirve en forma de un sentimiento tan familiar: la visión.Como resultado, la tarea principal seguirá siendo descubrir cómo simplemente "vemos" y cómo, en general, podemos entender esto.Referencias1. Casagrande VA (1994). A third parallel visual pathway to primate area V1. Trends Neurosci. 17, 305–310.
2. Hendry SHC, and Reid RC (2000). The koniocellular pathway in primate vision. Ann. Rev. Neurosci. 23, 127–153.
3. White AJR, Solomon SG, and Martin PR (2001). Spatial properties of koniocellular cells in the lateral geniculate nucleus of the marmoset Callithrix jacchus. J. Physiol. 533, 519–535.
4. Dacey DM, Peterson BB, Robinson FR, and Gamlin PD (2003). Fireworks in the primate retina: in vitro photodynamics reveals diverse LGN-projecting ganglion cell types. Neuron 37, 15–27.
5. Sincich LC, Park KF, Wohlgemuth MJ, and Horton JC (2004). Bypassing V1: a direct geniculate input to area MT. Nat. Neurosci. 7, 1123–1128.
6. Rodieck RW (1967). Receptive fields in the cat retina: a new type. Science 157, 90–92.
7. Stone J. and Hoffmann K.-P. (1972). Very slow-conducting ganglion cells in the cat's retina: a major, new functional type? Brain Res. 43, 610–616.
8. Cleland BG, Levick WR, Morstyn R., and Wagner HG (1976). Lateral geniculate relay of slowly-conducting retinal afferents to cat visual cortex. J. Physiol. 255, 299–320.
9. DeMonasterio FM (1978). Properties of ganglion cells with atypical receptive-field organization in retina of macaques. J. Neurophysiol. 41, 1435–1449.
10. Yukie M., and Iwai E. (1981). Direct projection from the dorsal lateral geniculate nucleus to the prestriate cortex in macaque monkeys. J. Comp. Neurol. 201, 81–97.
11. Hubel DH, and Wiesel TN (1977). Ferrier lecture. Functional architecture of macaque monkey visual cortex. Proc. R. Soc. Lond. Ser. B Biol. Sci. 198, 1–59.
12. Troy JB, Einstein G., Schuurmans RP, Robson JG, and Enroth-Cugell CH (1989). Responses to sinusoidal gratings of two types of very nonlinear retinal ganglion cells of cat. Visual Neurosci. 3, 213–223.
13. Tailby C., Solomon SG, Dhruv NT, Majaj NJ, Sokol SH, and Lennie P. (2007). A new code for contrast in the primate visual pathway. J. Neurosci. 27, 3904–3909.
14. Rockhill RL, Daly FJ, MacNeil MA, Brown SP, and Masland RH (2002). The Diversity of ganglion cells in a mammalian retina. J. Neurosci. 22, 3831–3843.
15. Badea TC, and Nathans J. (2004). Quantitative analysis of neuronal morphologies in the mouse retina visualized by using a genetically directed reporter. J. Comp. Neurol. 480, 331–351.
16. Kong JH, Fish DR, Rockhill RL, and Masland RH (2005). Diversity of ganglion cells in the mouse retina: Unsupervised morphological classification and its limits. J. Comp. Neurol. 489, 293–310.
17. Wassle H. (2004). Parallel processing in the mammalian retina. Nat. Rev. Neurosci. 5, 747–757.
18. Sinha P. (2002). Recognizing complex patterns. Nat. Neurosci. 5 Suppl, 1093–1097.
19. Levick WR, Oyster CW, and Takahashi E. (1969). Rabbit lateral geniculate nucleus: sharpener of directional information. Science 165, 712–714.
20. DeVries SH, and Baylor DA (1997). Mosaic arrangement of ganglion cell receptive fields in rabbit retina. J. Neurophysiol. 78, 2048–2060.
21. Roska B., and Werblin F. (2001). Vertical interactions across ten parallel, stacked representations in the mammalian retina. Nature 410, 583–587.
22. Zeck GM, Xiao Q., and Masland RH (2005). The spatial filtering properties of local edge detectors and brisk-sustained retinal ganglion cells. Eur. J. Neurosci. 22, 2016–2026.
23. van Wyk M., Taylor WR, and Vaney DI (2006). Local edge detectors: a substrate for fine spatial vision at low temporal frequencies in rabbit retina. J. Neurosci. 26, 13250–13263.
24. Masland RH (2001). Neuronal diversity in the retina. Curr. Opin. Neurobiol. 11, 431–436.
25. Dacey DM, Liao HW, Peterson BB, Robinson FR, Smith VC, Pokorny J., Yau KW, and Gamlin PD (2005). Melanopsinexpressing ganglion cells in primate retina signal colour and irradiance and project to the LGN. Nature 433, 749–754.
26. Simpson JI (1984). The accessory optic system. Ann. Rev. Neurosci. 7, 13–41.
27. Carandini M., Demb JB, Mante V., Tolhurst DJ, Dan Y., Olshausen BA, Gallant JL, and Rust NC (2005). Do we know what the early visual system does? J. Neurosci. 25, 10577–10597.
28. Olshausen BA, and Field DJ (2004). Sparse coding of sensory inputs. Curr. Opin Neurobiol. 14, 481–487.
29. Simoncelli EP, and Olshausen BA (2001). Natural image statistics and neural representation. Ann. Rev. Neurosci. 24, 1193–1216.
30. Olshausen BA, and Field DJ (2005). How close are we to understanding v1? Neural. Comput. 17, 1665–1699.
31. Ferster D., and Miller KD (2000). Neural mechanisms of orientation selectivity in the visual cortex. Ann. Rev. Neurosci. 23, 441–471.
32. Anderson JS, Lampl I., Gillespie DC, and Ferster D. (2001). Membrane potential and conductance changes underlying length tuning of cells in cat primary visual cortex. J. Neurosci. 21, 2104–2112.
33. Lund JS, and Yoshioka T. (1991). Local circuit neurons of macaque monkey striate cortex: III. Neurons of laminae 4B, 4A, and 3B. J. Comp. Neurol. 311, 234–258.
34. Cauli B., Audinat E., Lambolez B., Angulo MC, Ropert N., Tsuzuki K., Hestrin S., and Rossier J. (1997). Molecular and physiological diversity of cortical nonpyramidal cells. J. Neurosci. 17, 3894–3906.
35. Zipser K., Lamme VA, and Schiller PH (1996). Contextual modulation in primary visual cortex. J. Neurosci. 16, 7376-7389.
36. Gilbert CD, Sigman M., and Crist RE (2001). The neural basis of perceptual learning. Neuron 31, 681–697.
37. Douglas RJ, and Martin KA (2004). Neuronal circuits of the neocortex. Ann. Rev. Neurosci. 27, 419–451.
38. Troy JB, and Shou T. (2002). The receptive fields of cat retinal ganglion cells in physiological and pathological states: where we are after half a century of research. Prog. Ret. Eye Res. 21, 263–302.
39. Lennie P., and Movshon JA (2005). Coding of color and form in the geniculostriate visual pathway. J. Opt. Soc. Am. 22, 2013–2033.
40. Victor JD (2005). Analyzing receptive fields, classification images and functional images: challenges with opportunities for synergy. Nat. Neurosci. 8, 1651–1656.
41. Srinivasan MV, Jin ZF, Stange G., and Ibbotson MR (1993). 'Vector white noise': a technique for mapping the motion receptive fields of direction-selective visual neurons. Biol. Cybern. 68, 199–207.
42. Meister M., and Berry MJ (1999). The neural code of the retina. Neuron 22, 435–450.
43. Kara P., Reinagel P., and Reid RC (2000). Low response variability in simultaneously recorded retinal, thalamic, and cortical neurons. Neuron 27, 635–646.
44. Ringach DL, Hawken MJ, and Shapley R. (2002). Receptive field structure of neurons in monkey primary visual cortex revealed by stimulation with natural image sequences. J. Vision 2, 12–24.
45. Schwartz O., and Simoncelli EP (2001). Natural signal statistics and sensory gain control. Nat. Neurosci. 4, 819–825.
46. Horridge A. (2000). Seven experiments on pattern vision of the honeybee, with a model. Vision Res. 40, 2589-2603.
47. Srinivasan MV (2006). Honeybee vision: in good shape for shape recognition. Curr. Biol. 16, R58–60.
48. Marr D. (1982). Vision: A Computational Investigation in the Human Representation and Processing of Visual Information (New York: WH Freeman).
49. Barlow HB (1997). The knowledge used in vision and where it comes from. Phil.Trans. Roy. Soc. Lond. B 352, 1141–1147.
50. Riesenhuber M., and Poggio T. (2000). Models of object recognition. Nat. Neurosci. 3, 1199–1204.