Monin Ilya Alekseevich, ctn
imoninpgd@gmail.com
Modelo Atom con un gran núcleo comparable con el tamaño del átomo en su conjunto.
En la actualidad, en Física, el modelo atómico de Rutherford-Bohr se considera universalmente reconocido, en el que un núcleo pequeño, pesado y cargado positivamente está rodeado de capas de electrones casi ingrávidas, mientras que el tamaño de las capas de electrones es 1000 veces mayor que el tamaño del núcleo.
El modelo atómico de Rutherford-Bohr tiene muchos defectos inherentes que se han silenciado durante 100 años desde su inicio.
Lo único que explica el modelo atómico de Rutherford-Bohr es la experiencia de dispersar el flujo de partículas alfa en una fina lámina de oro. De donde se sacó una conclusión sobre el tamaño extremadamente pequeño del núcleo positivo en la composición de un enorme átomo lleno del vacío de las capas de electrones.
¿Y cómo explica el modelo de Rutherford la existencia de sólidos con una densidad fija?
Y de ninguna manera explica las propiedades de sustancias reales que conocemos de la vida cotidiana.
Fue por esta razón que tuve que componer mi propio modelo de la estructura del átomo.
Ninguno de los modelos existentes puede explicar todo a la vez.
En mi modelo, no explico la dispersión de partículas alfa en el experimento de Rutherford.
Bueno, el modelo de Rutherford explica solo una experiencia de dispersión de partículas alfa en una lámina de oro, pero no puede explicar nada más.
Pero mi modelo explica la existencia de sólidos, líquidos, gases y todas las transiciones de fase entre ellos.
En el modelo de Rutherford-Bohr, es completamente incomprensible sobre qué fuerzas existen las sustancias sólidas, de las cuales están compuestos todos los objetos que nos rodean, y la transición de un estado sólido a un estado líquido de un material gaseoso también es incomprensible.
Es hora de repensar el modelo de estructura Atom y crear un nuevo concepto que pueda explicar tanto la Resistencia de los sólidos como la elasticidad de los Gases enrarecidos.
Se propone un nuevo modelo Atom para consideración, cuyas características principales son las siguientes tesis:
- El núcleo del átomo prácticamente coincide en tamaño con el límite exterior del átomo;
- El núcleo atómico no es un grupo caótico de nucleones (neutrones y protones), sino que tiene una Estructura-Arquitectura muy clara, que es responsable de todas las propiedades físicas y químicas de una sustancia simple en particular de la tabla periódica;
- Los átomos en los sólidos entran en contacto directamente con sus núcleos sólidos;
- La transición a diferentes fases (sólido-líquido-gaseoso) se lleva a cabo con un cambio en la posición relativa de los nucleones individuales (o sus elementos) en la estructura del núcleo;
- El concepto de "Electronic Atom Shell" se excluye del Nuevo Modelo Atom, y todas las interacciones de los átomos se llevan a cabo a través del contacto directo de los nucleones de los núcleos y a través de los campos electrostáticos y magnéticos conocidos unidos a nucleones específicos en el núcleo.
- No hay una partícula separada "Electrón" en este modelo de átomo.
El núcleo del átomo prácticamente coincide en tamaño con el límite exterior del átomo. La coincidencia del tamaño del núcleo con las dimensiones externas del átomo permite dar explicaciones a muchos estados de fase previamente inexplicables, es decir, sustancias sólidas, líquidas y gaseosas.
Las sustancias sólidas en el nuevo concepto se explican por Atoms-Nuclei sólidos directamente en contacto entre sí. Además, su resistencia a la tracción está determinada por la atracción de átomos individuales al nivel de fuerzas magnéticas de corto alcance en el núcleo atómico. Bueno, la resistencia a la compresión está determinada exclusivamente por la fuerza de los núcleos atómicos densos. La resistencia a la compresión tiende al infinito, lo que se manifiesta en el hecho mismo de la existencia de objetos gigantes fuertemente comprimidos por la gravedad, como las estrellas y los planetas.
El caso de la presión unilateral no crea las condiciones para una compresión integral y, por lo tanto, los átomos comienzan a deslizarse entre sí bajo la acción de fuerzas de corte en la dirección perpendicular de la fuerza de compresión activa. Es precisamente la posibilidad de tal cambio en el que se basan todas las tecnologías de formación de metal (prensado, forjado, estampado), cuando en un espacio estrecho entre los rodillos es posible enrollar una pieza de metal en una lámina muy delgada o entre el troquel y el punzón, es posible aplanar la pieza en un producto con forma de vidrio. Así es exactamente como las latas de cerveza de paredes delgadas están hechas de pellets de aluminio en blanco mediante estampado.
El núcleo de un átomo tiene una Estructura-Arquitectura muy clara y única, que es responsable de todas las propiedades físicas y químicas de una sustancia simple particular de la tabla periódica.
La transición a la consideración de detalles "pequeños" de la estructura del núcleo nos permite pasar de la característica numérica insignificante existente del número de nucleones y la magnitud de la carga de acuerdo con la tabla periódica a la característica cualitativa informativa de la arquitectura de la estructura del núcleo, que debe llevar todo el conjunto de propiedades químicas y físicas de una sustancia simple.
La transición a diferentes estados agregados (sólido-líquido-gaseoso) ocurre cuando la posición relativa de los nucleones individuales en la estructura del núcleo cambia o los mismos nucleones cambian en la nutria.
En el modelo del átomo de Rutherford-Bohr, el núcleo era miles de veces más pequeño que el tamaño del átomo y, por lo tanto, simplemente no se consideró el efecto de su pequeño núcleo en las transformaciones de fase externa. Con un aumento de mil veces en el tamaño del núcleo, su papel aumenta considerablemente en el efecto sobre todas las propiedades físicas de la materia, incluidas las transiciones de fase a varios estados de agregación. En el contacto directo de grandes núcleos de múltiples núcleos, surge un nuevo tipo de interacción, basada en las conocidas fuerzas magnéticas y electrostáticas.
Con el contacto cercano de los núcleos, ampliado a los límites exteriores del átomo, comienza a aparecer el fenómeno previamente descuidado "Interacción electrostática y magnética de orden de corto alcance", es decir, la interacción de fuertes cargas magnéticas y eléctricas de nucleones a distancias cercanas al tamaño del núcleo y al tamaño de los nucleones individuales.
El modelo anterior consideraba que el átomo era eléctricamente neutro, y no se tuvo en cuenta la separación de la carga negativa de la capa electrónica y el núcleo positivo.
En el nuevo modelo, la interacción de Nuclei-Atoms puede considerarse al nivel del efecto local de convergencia estrecha de los polos del mismo nombre del núcleo interno espaciado Charges-Dipoles. Tal enfoque hace posible crear un modelo de Sólido sobre las fuerzas de atracción magnética, así como un modelo de estados de Gas estático sobre las fuerzas de repulsión electrostática. El estado intermedio en el modelo de fase líquida tiene elementos de los modelos de fase sólida y gaseosa, que se oponen entre sí en un espacio estrecho entre los átomos.
El gas existe en las fuerzas repulsivas del mismo nombre. Cargas electrostáticas en los dipolos de nucleones individuales, cuando todos los dipolos eléctricos del átomo se vuelven hacia afuera con el mismo nombre del polo eléctrico. En este caso, todos los átomos de gas vecinos están erizados con los mismos polos de dipolos eléctricos (en total, el átomo permanece neutral), lo que crea su repulsión mutua electrostática local. (Fig. 1, Fig. 2, Fig. 3).
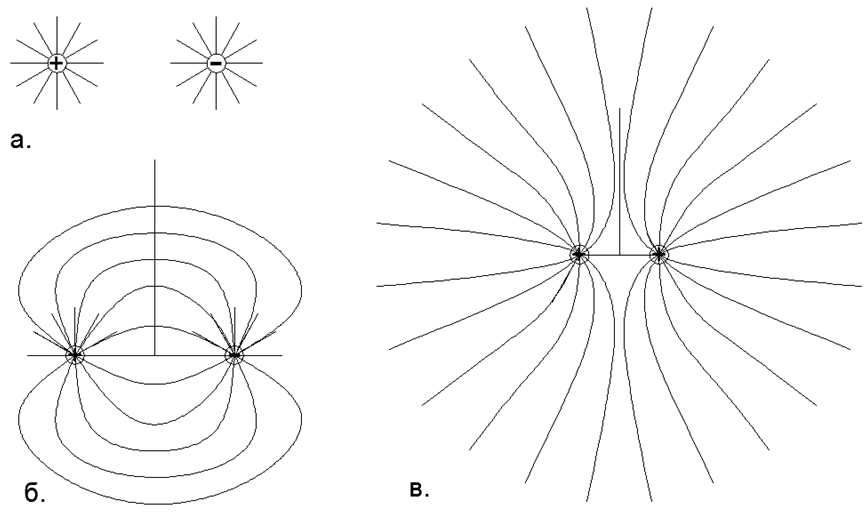 Fig.1. La interacción de los campos de cargas puntuales de acuerdo con el principio de superposición: a) Dos cargas aisladas de manera opuesta con un campo eléctrico regular (esférico) radialmente dirigido, donde las líneas de fuerza se distribuyen uniformemente y se extienden radialmente hasta el infinito, es decir, en el modelo abstracto sus campos no interactúan; b) La forma real de las líneas de fuerza de dos cargas opuestas únicas localizadas, donde, según el principio de superposición, las líneas de fuerza de una carga positiva se cierran sobre una carga negativa, y en el infinito la carga total de este sistema se percibe como cero y las líneas de fuerza de un dipolo no van al infinito; c) La forma real de las líneas de fuerza de dos cargas homónimas y unidimensionales, muy espaciadas, donde según el principio de superposición, las líneas de fuerza de las mismas cargas no se cruzan, sino que se desplazan en medios espacios separados, y en el infinito la carga total de este sistema se percibe como una carga puntual de doble valor.
Fig.1. La interacción de los campos de cargas puntuales de acuerdo con el principio de superposición: a) Dos cargas aisladas de manera opuesta con un campo eléctrico regular (esférico) radialmente dirigido, donde las líneas de fuerza se distribuyen uniformemente y se extienden radialmente hasta el infinito, es decir, en el modelo abstracto sus campos no interactúan; b) La forma real de las líneas de fuerza de dos cargas opuestas únicas localizadas, donde, según el principio de superposición, las líneas de fuerza de una carga positiva se cierran sobre una carga negativa, y en el infinito la carga total de este sistema se percibe como cero y las líneas de fuerza de un dipolo no van al infinito; c) La forma real de las líneas de fuerza de dos cargas homónimas y unidimensionales, muy espaciadas, donde según el principio de superposición, las líneas de fuerza de las mismas cargas no se cruzan, sino que se desplazan en medios espacios separados, y en el infinito la carga total de este sistema se percibe como una carga puntual de doble valor. Es decir, desde un macroambiente distante, los átomos neutros parecen uniformemente neutros, mientras que en el orden de corto alcance con los átomos vecinos los gases se mantienen en un estado estable equidistante por las fuerzas del mismo nombre de repulsión electrostática.
En el modelo de "Interacción electrostática de orden de corto alcance", las moléculas de gas dejan de moverse a velocidades tremendas, permanecen en un estado de descanso eléctricamente intenso, y su temperatura está determinada exclusivamente por la intensidad del campo electrostático en el orden de interacción de corto alcance. Un cambio suave en la temperatura del gas se realiza mediante un cambio sincrónico suave en la longitud de los hombros de los dipolos eléctricos de núcleo interno en la dirección radial del átomo. Cuanto más corto es el brazo dipolo, más corta es la longitud de los pétalos de la corona electrostática que puede crear.
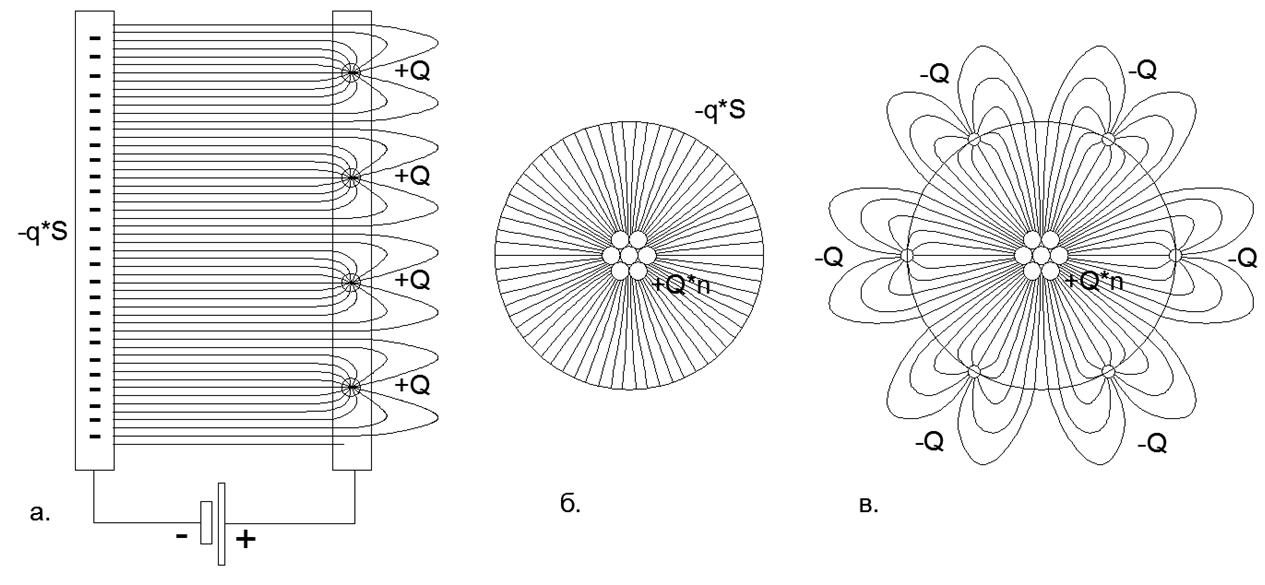 Fig.2 Distribución de líneas de campo eléctrico del campo electrostático en las placas de un capacitor con cargas distribuidas y puntuales: a) Condensador plano con una carga distribuida de las placas Minus (el campo no se cruza con el campo) y cargas puntuales únicas en la placa Plus (el campo se cierra fuera del espacio entre las placas) ; b) Condensador esférico con carga distribuida en el revestimiento negativo y cargas de punto único en el revestimiento positivo; c) Condensador esférico con cargas de punto único en el revestimiento Plus y cargas de punto único en el revestimiento Minus (el cierre de campo en cargas externas crea pétalos de líneas de campo largas que se extienden lejos en el espacio más allá del revestimiento esférico externo sólido del condensador).
Fig.2 Distribución de líneas de campo eléctrico del campo electrostático en las placas de un capacitor con cargas distribuidas y puntuales: a) Condensador plano con una carga distribuida de las placas Minus (el campo no se cruza con el campo) y cargas puntuales únicas en la placa Plus (el campo se cierra fuera del espacio entre las placas) ; b) Condensador esférico con carga distribuida en el revestimiento negativo y cargas de punto único en el revestimiento positivo; c) Condensador esférico con cargas de punto único en el revestimiento Plus y cargas de punto único en el revestimiento Minus (el cierre de campo en cargas externas crea pétalos de líneas de campo largas que se extienden lejos en el espacio más allá del revestimiento esférico externo sólido del condensador).
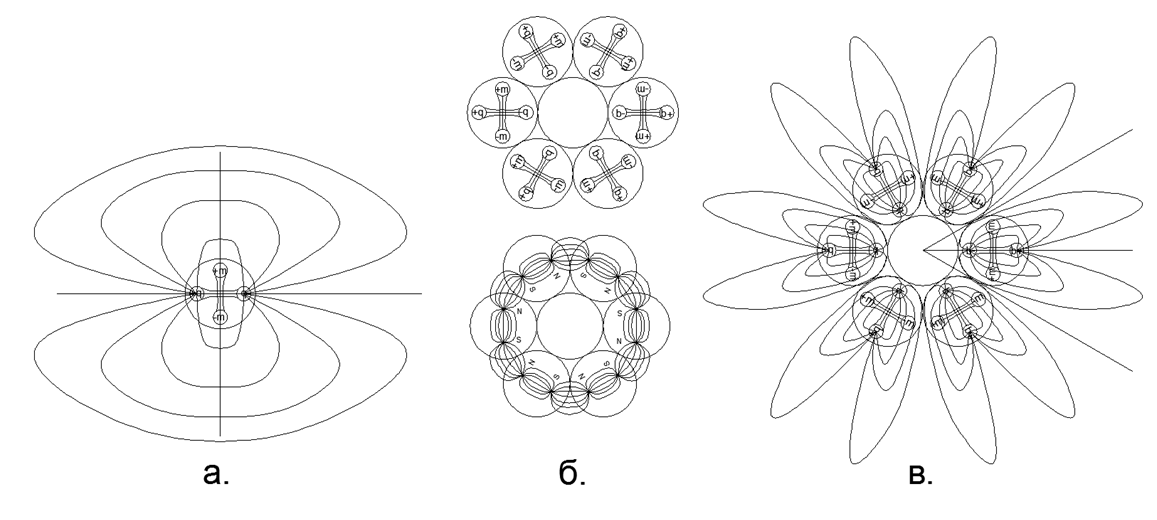 Fig.3. a) Vista del campo eléctrico del dipolo en la composición de un nucleón libre; b) retención sobre las fuerzas magnéticas de una cadena de 6 nucleones cerrados en un anillo, mientras que las líneas de fuerza magnética están completamente cerradas dentro del anillo y no van al espacio exterior; c) El campo eléctrico de los dipolos del anillo de nucleones, formando la "Corona" electrostática (en este caso, los pétalos de las líneas de fuerza de la "corona" eléctrica van mucho más allá de los límites de las dimensiones del átomo).
Fig.3. a) Vista del campo eléctrico del dipolo en la composición de un nucleón libre; b) retención sobre las fuerzas magnéticas de una cadena de 6 nucleones cerrados en un anillo, mientras que las líneas de fuerza magnética están completamente cerradas dentro del anillo y no van al espacio exterior; c) El campo eléctrico de los dipolos del anillo de nucleones, formando la "Corona" electrostática (en este caso, los pétalos de las líneas de fuerza de la "corona" eléctrica van mucho más allá de los límites de las dimensiones del átomo).El efecto de repulsión electrostática de corto alcance en gases y la atracción magnética de los núcleos en la fase líquida (sólida) explican bien el proceso de vaporización durante el calentamiento gradual y el estado crítico del vapor por saturación. Entonces, la evaporación (salida de una fase sólida o líquida a un estado gaseoso) ocurre cuando, cuando se calienta un átomo, los dipolos electrostáticos de los nucleones salen con los mismos polos hacia el exterior de tal manera que en algún punto la repulsión electrostática se vuelve mayor que la fuerza de atracción magnética de los átomos vecinos. La condensación ocurre en el orden inverso: el enfriamiento del átomo conduce a una disminución en la intensidad de repulsión electrostática cuando los dipolos eléctricos se colocan en una posición neutral.
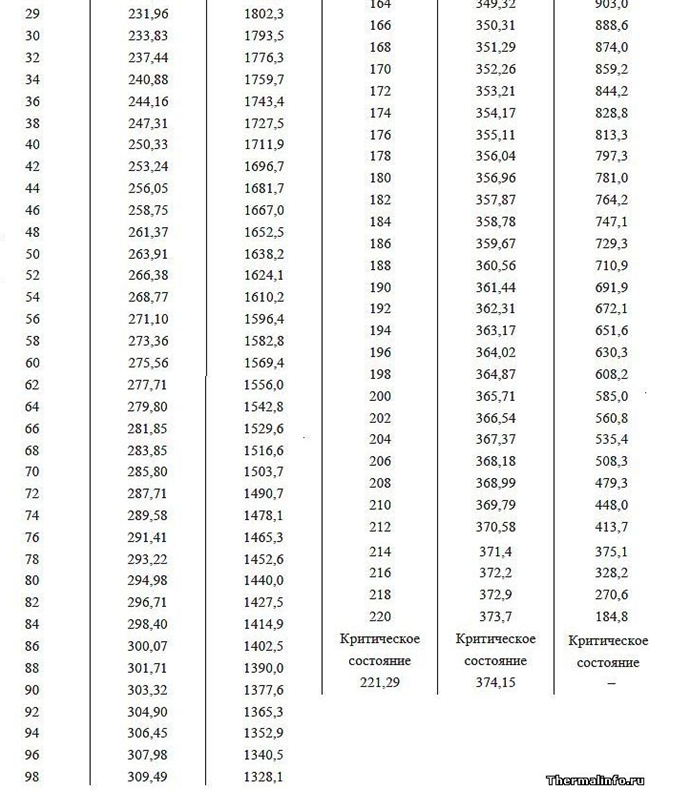
La función de trabajo (energía de vaporización) es la energía de campo adicional gastada por un átomo durante la expansión de la Corona electrostática en un espacio de gas vacío. La energía de salida (calor de vaporización) con el aumento de la presión del gas debe disminuir a una temperatura igual del líquido y el gas por encima de él, lo que se confirma con el ejemplo de la dependencia del calor de vaporización a diferentes presiones de aire alrededor (ver datos de la tabla para presiones por debajo de 1 atm en montañas altas). Además, al aumentar la presión y la temperatura de ebullición del agua (datos tabulares de la temperatura de ebullición del agua a diferentes presiones por encima de 1 atm.), La función de trabajo disminuye, lo que se explica por una reducción en la diferencia en el tamaño de las distancias intermoleculares en las fases líquida y gaseosa, reduciendo así el volumen del campo eléctrico de Corona, que absorbe adicionalmente energía cuando se abre después de dejar agua densa en una fase gaseosa enrarecida.
La transición del estado de vapor al estado de hielo a temperaturas negativas debe pasar por la fase líquida del agua. Al mismo tiempo, la capa más delgada de la fase líquida del agua con una temperatura superior a cero grados Celsius se forma en la superficie del hielo ya solidificado, en el que se distribuye el flujo de calor del pliegue del campo de moléculas de agua de condensación. Cuanto mayor es la diferencia en la temperatura del hielo con respecto a 0, más delgada es la capa de agua en la superficie, ya que una gran diferencia de temperatura aumenta la tasa de transferencia de calor en la capa de hielo líquido, con una disminución proporcional en el espesor de la capa de agua para conducir el flujo de calor deseado de la molécula de agua condensada.
La capa más delgada de agua en la superficie del hielo cuando interactúa con el soporte de una carga externa (la suela de la bota o el trineo) crea las condiciones para la aparición de una "hidroclina" incluso a velocidades relativas de la carga relativas al hielo casi cero. La capa más delgada de agua con un grosor de varias filas moleculares simplemente no tiene tiempo para exprimirse de un espacio delgado, mientras que la viscosidad del agua líquida es muy baja, lo que crea la posibilidad de deslizar la suela sobre hielo en una "hidroclina" de grasa.
Si el grosor de la hidroclina está asociado con una caída de temperatura relativa a 0 ° C, entonces la resbaladiza del hielo debería disminuir con el aumento de las heladas. Este es exactamente el comportamiento del hielo que se puede rastrear en la práctica, cuando el mayor deslizamiento en las carreteras es notable a temperaturas cercanas a cero Celsius. En las heladas severas, cuando se mueve sobre hielo, el contacto directo está hecho de sólido-duro, prácticamente sin la formación de hidroclina, como si hubiera una formación molecular instantánea de hielo con la suela (neumático) con la congelación del soporte al hielo.
Según algunos informes, el espesor de la película de agua en la superficie del hielo, igual a -5 grados 100 nm, disminuye diez veces a -35 grados a 10 nm, y a -170 grados generalmente consiste en una capa de moléculas. Entonces, los residentes del Ártico dicen que arrastrar trineos sobre hielo a temperaturas muy bajas es lo mismo que arrastrarlos sobre arena (después de todo, no hay suficiente lubricación en este caso).
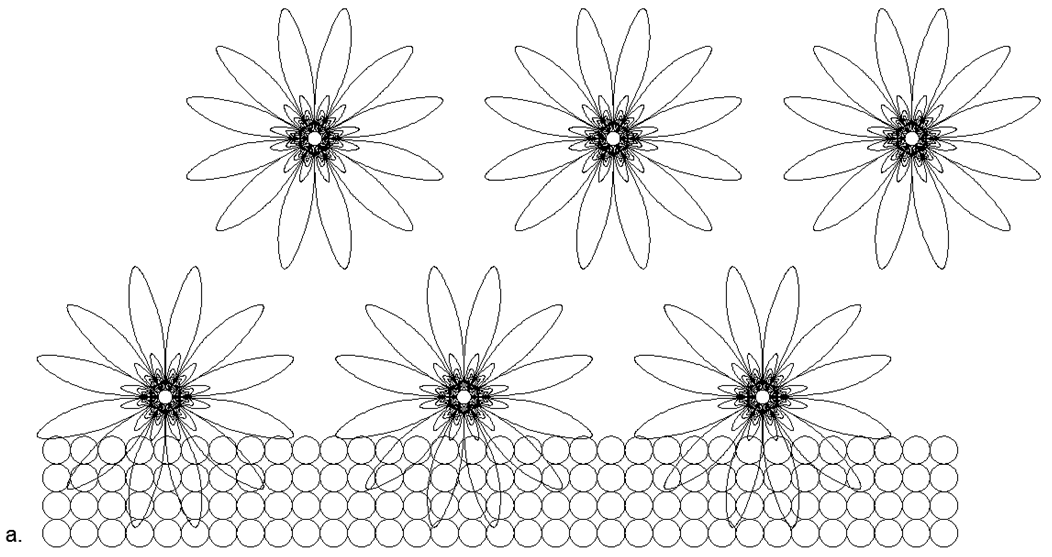
 Fig. 4 Representación esquemática de la zona límite de contacto de diferentes fases Líquido-gas (agua-aire) en el caso de la teoría electrostática del gas: a) Gas a una presión de 1 atm. por encima del agua líquida (la distancia entre los centros de las moléculas es aproximadamente 10 veces mayor que en la fase líquida); b) El mismo gas sobre el agua a la misma temperatura, pero a una presión de 10 atm., mientras que la distancia entre los centros de las moléculas de gas se reduce en 10 ^ 1/3 = 2.15 veces. Se puede ver claramente la deformación de la corona eléctrica monopolar en contacto de los átomos de gas a medida que las moléculas se acercan entre sí. Las líneas de fuerza no pueden cruzarse y, por lo tanto, se ven obligadas a deformarse, ocupando un volumen menor, lo que conduce a un aumento de las fuerzas de repulsión mutua (aumento de la presión de gas).Tab.1. El calor de vaporización del agua, dependiendo de la presión y la temperatura.
Fig. 4 Representación esquemática de la zona límite de contacto de diferentes fases Líquido-gas (agua-aire) en el caso de la teoría electrostática del gas: a) Gas a una presión de 1 atm. por encima del agua líquida (la distancia entre los centros de las moléculas es aproximadamente 10 veces mayor que en la fase líquida); b) El mismo gas sobre el agua a la misma temperatura, pero a una presión de 10 atm., mientras que la distancia entre los centros de las moléculas de gas se reduce en 10 ^ 1/3 = 2.15 veces. Se puede ver claramente la deformación de la corona eléctrica monopolar en contacto de los átomos de gas a medida que las moléculas se acercan entre sí. Las líneas de fuerza no pueden cruzarse y, por lo tanto, se ven obligadas a deformarse, ocupando un volumen menor, lo que conduce a un aumento de las fuerzas de repulsión mutua (aumento de la presión de gas).Tab.1. El calor de vaporización del agua, dependiendo de la presión y la temperatura.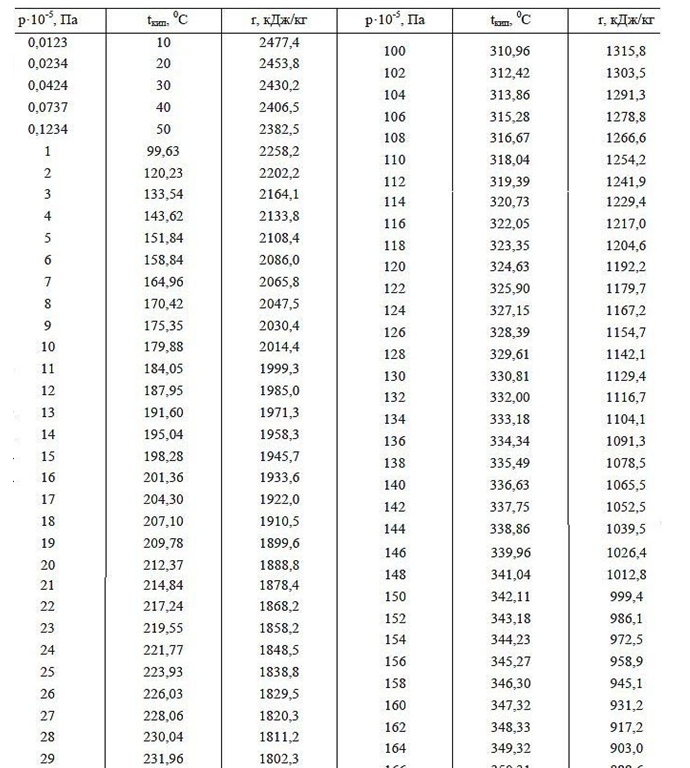
Las ecuaciones de estado existentes de un gas ideal (la ley de Boyle-Marriott) describen bien los gases a bajas presiones (condiciones normales) y altas temperaturas. Pero a altas presiones, esta ley ideal no nos permite describir las transiciones ni al estado líquido ni al estado sólido.
La ley de Van der Waltz intenta corregir inconsistencias mediante la introducción de factores adicionales, ajustando la curva teórica a la dependencia obtenida experimentalmente. En este caso, se produce un rechazo oculto del modelo atómico de Rutherford-Bohr, ya que en la ecuación de van der Wals el átomo está representado por una bola sólida que llena todo el volumen en sus límites externos.
Al mismo tiempo, la naturaleza de la interacción de las bolas atómicas no se explica cualitativamente, dejando explicaciones a nivel de capas electrónicas estadísticas sin peso sobre un pequeño nucleolo, como debería ser según el modelo de Rutherford-Bohr.
En el caso del modelo propuesto, donde se produce la repulsión de superficies con carga similar, es posible considerar el Modelo estático de comprensión, donde cada elemento del modelo tiene una encarnación física y un significado físico comprensibles.
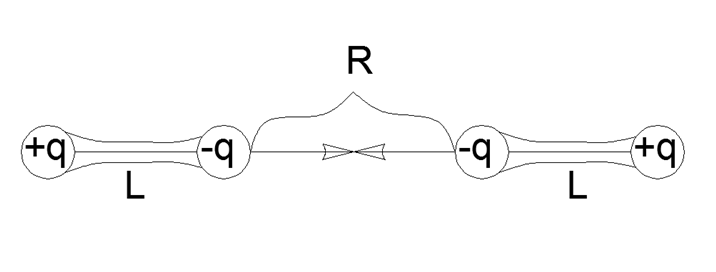
Entonces, la interacción de los dipolos se expresa mediante la fórmula más simple de interacción directa por pares para cargas de cuatro puntos recogidas en pares en dipolos mecánicamente fuertes con un hombro L y una distancia R entre los extremos cercanos de los dipolos:
F = K q2 (1 / R2 - 2 / (R + L) 2 + 1 / (R + 2L) 2)
Llevando a un denominador común y abriendo los corchetes en el numerador, obtenemos una expresión aún más engorrosa:
F = K q2 (2R2L2 + 12RL3 + 4L4) / (R2 (R + L) 2 (R + 2L) 2)
Una característica del modelo de cálculo para dipolos es que la función de repulsión de los dipolos tiende al Infinito lejos del centro del átomo, o más bien, en su borde exterior, donde es posible el contacto directo de los átomos bajo la influencia de las fuerzas más poderosas de atracción atómica magnética. Es este contacto de dos valores que cambian bruscamente de valor y opuestos en las fuerzas de los signos en el límite atómico lo que nos permite crear un modelo equilibrado de Repulsión-Atracción de átomos entre ellos.
Si R >> L, la función de repulsión electrostática de dipolos se simplifica a la forma:
F = K q2 2L2 / R4
La atracción magnética tiene una propiedad de saturación y el gráfico de función no llega al infinito incluso con el contacto directo de los átomos, por lo tanto, la atracción magnética siempre encontrará un punto de equilibrio con repulsión electrostática en una pendiente hiperbólica empinada de la característica electrostática.Por supuesto, está claro que en realidad no hay fuerzas infinitamente grandes, pero hay un cierto límite de valores máximos (por ejemplo, las fuerzas atractivas de los átomos se pueden estimar mediante la medición directa de la resistencia a la tracción en un solo cristal de una sustancia, y la finitud de las fuerzas de interacción electrostática está determinada por la energía fija durante la aniquilación de Electrón y Positrón). Cuando dos átomos se unen, las fuerzas repulsivas en algún punto también dejan de crecer rápidamente y pasan a un valor finito fijo. Por lo tanto, dos valores de atracción y repulsión no infinitamente grandes se equilibran en un cierto punto de equilibrio mutuo, que se puede encontrar en la intersección de las gráficas de estas dos funciones, al trazar gráficas en un sistema de coordenadas. (ver Gráfico 1)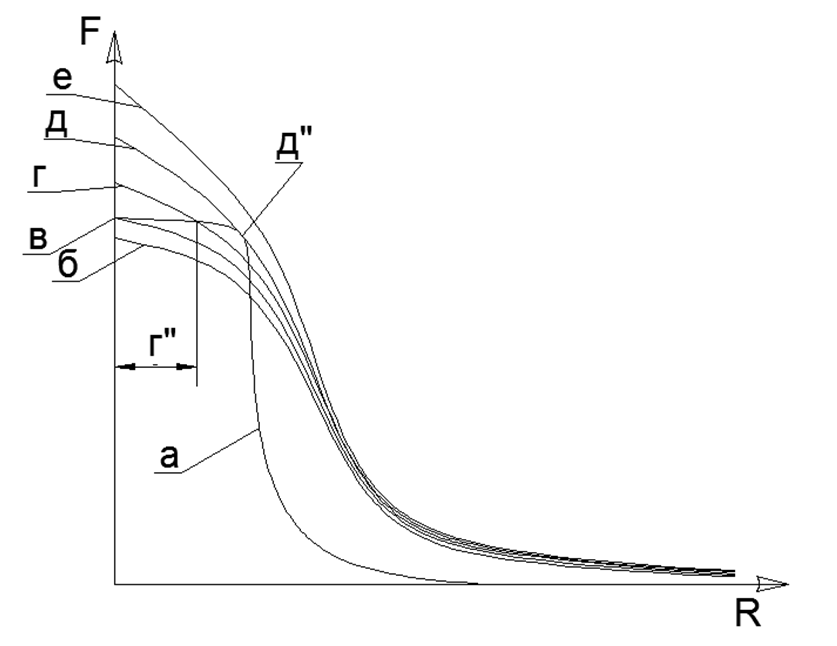 .1. () : (); (), () (''); - () (''); (). R- . (-) () , - , ( ) ( ) (R max - ). La ecuación de Van der Waltz dibuja una imagen muy similar, pero no explica el significado físico de las fuerzas de atracción y repulsión, mientras mueve sutilmente la zona de crecimiento asintótico infinito de la función hacia la zona inalcanzable del centro del átomo.El estado líquido de una sustancia es el momento en que, al calentarse, los dipolos electrostáticos ya han comenzado a repeler, pero esta repulsión aún no es capaz de romper el enlace de la atracción magnética de los átomos. Como resultado, surge una pequeña brecha entre los átomos (g "en el gráfico del Gráfico 1), lo que conduce a un fuerte aumento en la movilidad mutua de los átomos en la capa de" lubricante "electromagnético.La capa límite de gas sólido se forma al contacto de la materia sólida acoplada magnéticamente con átomos de gas estresados electrostáticamente. Los átomos de gas no pueden salir de un sólido con coronas electrostáticas de átomos no reveladas y son presionados a una superficie sólida. Por lo tanto, se forma una capa límite de átomos de gas, presionada a la superficie de una sustancia sólida. En este caso, la capa de gas límite todavía es capaz de repeler otros átomos de gas de sí misma, ya que la capa de gas límite permanece estresada electrostáticamente en el grado necesario. Tal compresión de la capa límite de gas (aire) en un metal sólido explica la apariencia casi instantánea de los óxidos metálicos en la superficie. El contacto adicional de la capa límite de gas ya se lleva a cabo con una película protectora sólida de óxidos en la superficie del metal.protege la capa subyacente de metal puro de una mayor oxidación.Modelado de supuestas arquitecturas estructurales de elementos químicos. En el futuro, consideramos los modelos propuestos de la estructura de los núcleos de átomos de varias sustancias, donde la bola de metal con fuertes propiedades magnéticas será el nucleón (nucleón, protón). La interacción magnética de los nucleones cumple con el criterio de no centralidad de la interacción de la fuerza de los nucleones en el núcleo y la saturación de estas fuerzas cuando los nucleones se acercan entre sí, lo que se ha asumido en la física nuclear por interacciones nucleares fuertes.Los imanes modernos de tierras raras tienen una fuerza magnética muy alta, lo que le permite construir modelos plausibles de estructuras atómicas, basándose únicamente en las fuerzas magnéticas de la retención de los Ball-Nucleons como parte de un solo núcleo con una Arquitectura única. En este caso, las propias fuerzas magnéticas actúan como Controladores de Criterios para cada modelo de núcleo, ya que lejos de todas las combinaciones espaciales de bolas pueden ensamblarse en una forma estable debido a la atracción y repulsión mutuas de bolas polarizadas.El modelo de cada átomo se ensambla a partir del número de nucleones especificado por la tabla periódica (incluidos todos los isótopos estables). Las reconstrucciones de modelos se crean a partir de bolas magnéticas de neodimio con un diámetro de 5 mm. Actualmente, estas bolas magnéticas se venden como juguetes de rompecabezas llamados Neocub, que incluye 216 bolas magnéticas del mismo tamaño (piezas de 6x6x6 cubos).En función de las características geométricas obtenidas de los modelos atómicos de cada sustancia simple, intentaremos encontrar las conexiones lógicas entre la forma del modelo atómico y las propiedades de la materia real a nivel macro.En la etapa inicial de modelar estructuras nucleares, se revelaron algunas regularidades. Por lo tanto, las bolas magnéticas tienden a alinearse en cadenas, y las cadenas lo suficientemente largas se bloquean fácilmente en los anillos. Las estructuras magnéticas de los anillos resultan ser muy fuertes y estables, mientras que el campo magnético externo de estos anillos disminuye bruscamente, ya que casi todas las líneas magnéticas de sus flujos magnéticos separan los imanes de bola a través de las bolas vecinas de su anillo de nucleón magnético (ver Fig.5). Los anillos del mismo tamaño (igual número de bolas de nucleones) pueden conectarse fácilmente entre sí, formando estructuras en forma de pilares muy estables que pueden crecer de forma casi ilimitada con nuevos anillos proporcionales (Fig. 6).Las cadenas de bolas de nucleones se pueden conectar en paralelo entre sí en dos versiones:
.1. () : (); (), () (''); - () (''); (). R- . (-) () , - , ( ) ( ) (R max - ). La ecuación de Van der Waltz dibuja una imagen muy similar, pero no explica el significado físico de las fuerzas de atracción y repulsión, mientras mueve sutilmente la zona de crecimiento asintótico infinito de la función hacia la zona inalcanzable del centro del átomo.El estado líquido de una sustancia es el momento en que, al calentarse, los dipolos electrostáticos ya han comenzado a repeler, pero esta repulsión aún no es capaz de romper el enlace de la atracción magnética de los átomos. Como resultado, surge una pequeña brecha entre los átomos (g "en el gráfico del Gráfico 1), lo que conduce a un fuerte aumento en la movilidad mutua de los átomos en la capa de" lubricante "electromagnético.La capa límite de gas sólido se forma al contacto de la materia sólida acoplada magnéticamente con átomos de gas estresados electrostáticamente. Los átomos de gas no pueden salir de un sólido con coronas electrostáticas de átomos no reveladas y son presionados a una superficie sólida. Por lo tanto, se forma una capa límite de átomos de gas, presionada a la superficie de una sustancia sólida. En este caso, la capa de gas límite todavía es capaz de repeler otros átomos de gas de sí misma, ya que la capa de gas límite permanece estresada electrostáticamente en el grado necesario. Tal compresión de la capa límite de gas (aire) en un metal sólido explica la apariencia casi instantánea de los óxidos metálicos en la superficie. El contacto adicional de la capa límite de gas ya se lleva a cabo con una película protectora sólida de óxidos en la superficie del metal.protege la capa subyacente de metal puro de una mayor oxidación.Modelado de supuestas arquitecturas estructurales de elementos químicos. En el futuro, consideramos los modelos propuestos de la estructura de los núcleos de átomos de varias sustancias, donde la bola de metal con fuertes propiedades magnéticas será el nucleón (nucleón, protón). La interacción magnética de los nucleones cumple con el criterio de no centralidad de la interacción de la fuerza de los nucleones en el núcleo y la saturación de estas fuerzas cuando los nucleones se acercan entre sí, lo que se ha asumido en la física nuclear por interacciones nucleares fuertes.Los imanes modernos de tierras raras tienen una fuerza magnética muy alta, lo que le permite construir modelos plausibles de estructuras atómicas, basándose únicamente en las fuerzas magnéticas de la retención de los Ball-Nucleons como parte de un solo núcleo con una Arquitectura única. En este caso, las propias fuerzas magnéticas actúan como Controladores de Criterios para cada modelo de núcleo, ya que lejos de todas las combinaciones espaciales de bolas pueden ensamblarse en una forma estable debido a la atracción y repulsión mutuas de bolas polarizadas.El modelo de cada átomo se ensambla a partir del número de nucleones especificado por la tabla periódica (incluidos todos los isótopos estables). Las reconstrucciones de modelos se crean a partir de bolas magnéticas de neodimio con un diámetro de 5 mm. Actualmente, estas bolas magnéticas se venden como juguetes de rompecabezas llamados Neocub, que incluye 216 bolas magnéticas del mismo tamaño (piezas de 6x6x6 cubos).En función de las características geométricas obtenidas de los modelos atómicos de cada sustancia simple, intentaremos encontrar las conexiones lógicas entre la forma del modelo atómico y las propiedades de la materia real a nivel macro.En la etapa inicial de modelar estructuras nucleares, se revelaron algunas regularidades. Por lo tanto, las bolas magnéticas tienden a alinearse en cadenas, y las cadenas lo suficientemente largas se bloquean fácilmente en los anillos. Las estructuras magnéticas de los anillos resultan ser muy fuertes y estables, mientras que el campo magnético externo de estos anillos disminuye bruscamente, ya que casi todas las líneas magnéticas de sus flujos magnéticos separan los imanes de bola a través de las bolas vecinas de su anillo de nucleón magnético (ver Fig.5). Los anillos del mismo tamaño (igual número de bolas de nucleones) pueden conectarse fácilmente entre sí, formando estructuras en forma de pilares muy estables que pueden crecer de forma casi ilimitada con nuevos anillos proporcionales (Fig. 6).Las cadenas de bolas de nucleones se pueden conectar en paralelo entre sí en dos versiones:- direcciones asociadas de flujos magnéticos
- dirección contraria del flujo magnético
La dirección concurrente de los flujos magnéticos proporciona una conexión más duradera y compacta de cadenas de bolas (las bolas se encuentran en los vértices de los triángulos isósceles). Los flujos magnéticos opuestos hacen que las bolas se ubiquen en la parte superior de los cuadrados, lo que da un relleno menos denso y menos duradero de las bolas de nucleones.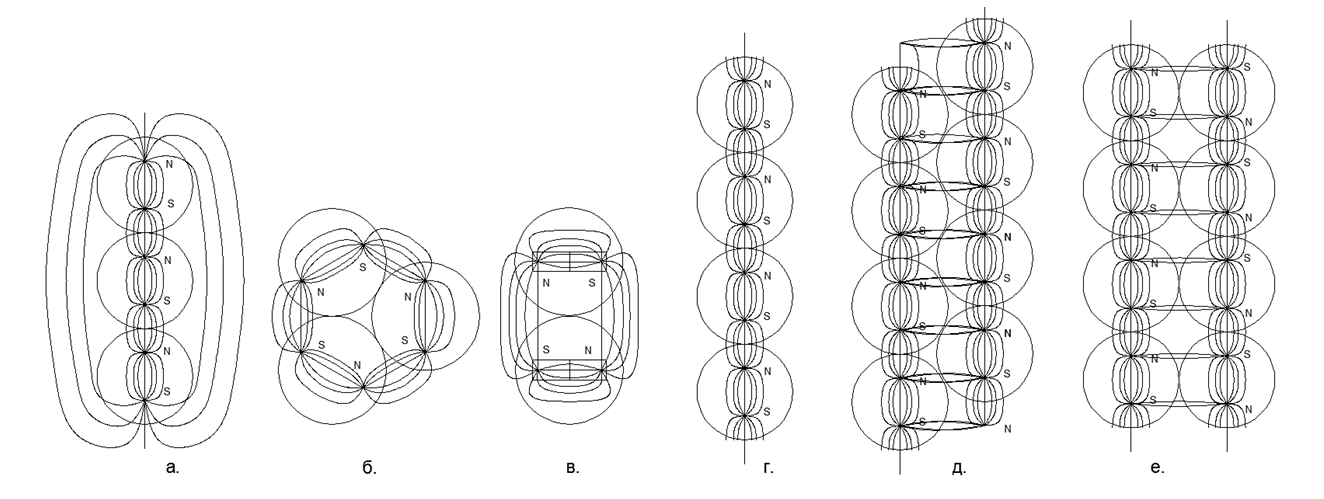 .5. :
.5. :
. 3- ();
. 3- ();
. 2- (), (.);
. - ;
. - , , ;
. - , , . .
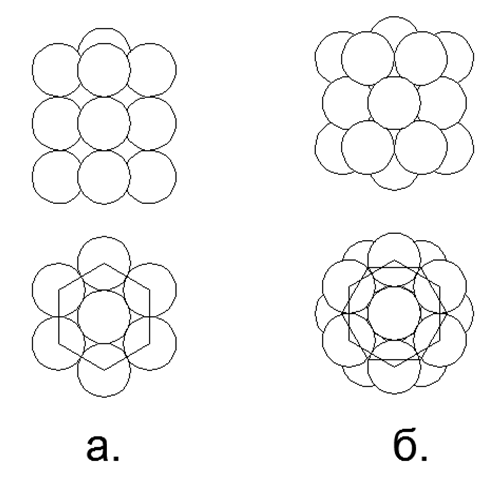 .6. 6- :
.6. 6- :
. ;
. .
- . 6- , .
.
Además de conectar anillos unidimensionales, es posible conectar anillos de diferentes tamaños en varias combinaciones, dando una variedad de formas espaciales. Es esta variedad de posibles formas de conexión de estructuras magnéticas de anillo y bolas magnéticas individuales lo que le permite crear muchos modelos de la Arquitectura de núcleos con un número similar de nucleones, pero relacionados con diferentes sustancias con propiedades químicas y físicas radicalmente diferentes.Como saben, un solo elemento químico puede corresponder a muchos isótopos con un número diferente de neutrones en la composición. Entonces, las estructuras de los átomos con forma de pilar de los anillos con seis o más nucleones tienen un espacio en el centro, lo que permite que se coloquen nucleones adicionales dentro de la columna sin cambiar la apariencia del núcleo atómico. (Fig.6.b).Basado en la versión propuesta de atracción magnética y repulsión electrostática, se puede suponer que los metales incluyen estructuras nucleares que tienen un anillo externo adicional de nucleones acoplados magnéticamente en la parte superior de la columna central de anillos de nucleones unidimensionales (Fig. 7 - fila inferior). Esta suposición se basa en el hecho de que el anillo magnético externo no está cargado, lo que aumenta la brecha entre la columna interna cargada eléctricamente cuando se acerca a otros átomos del mismo tipo. Tal espacio aumenta los puntos de ebullición y fusión del metal, y también crea un área más amplia para la zona de estado líquido.Las sustancias que son gases en condiciones normales, por el contrario, deben tener un anillo de nucleón cargado en el circuito externo, proporcionando repulsión electrostática del mismo tipo de átomos de gas, mientras que se puede colocar una gran cantidad de nucleones dentro del anillo cargado, creando una amplia serie isotópica de este elemento.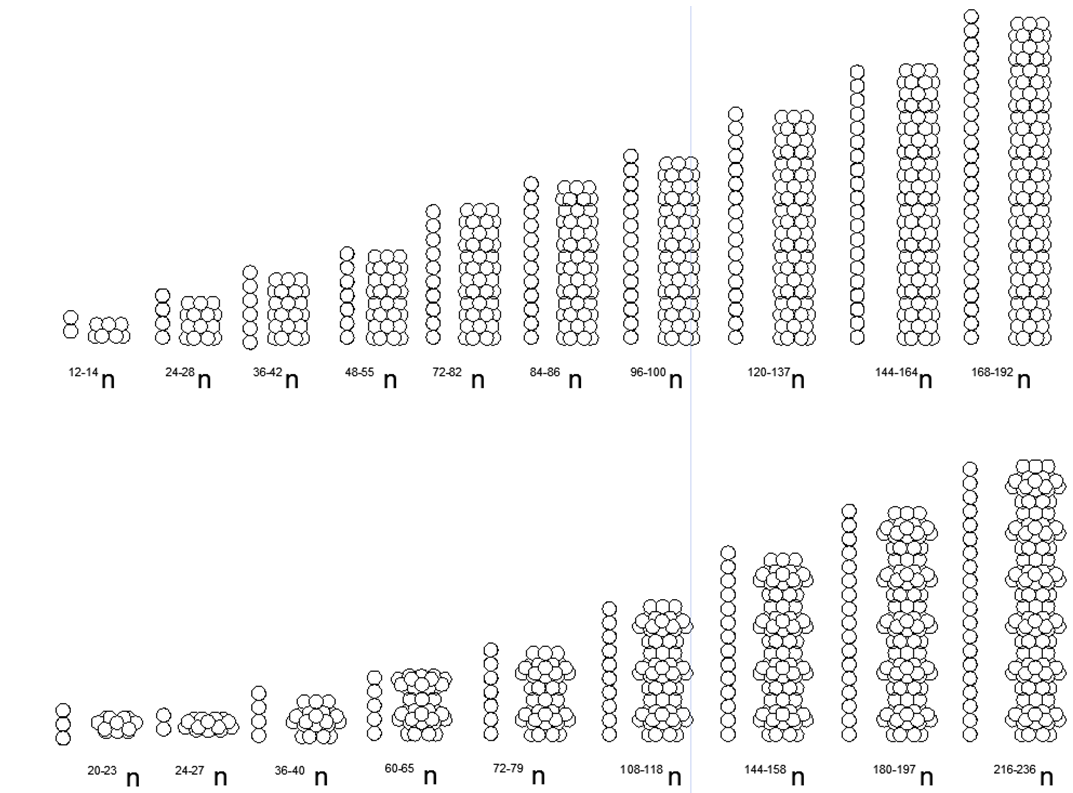 .7. - ( — ) ( - ) . , , . , , .
.7. - ( — ) ( - ) . , , . , , . 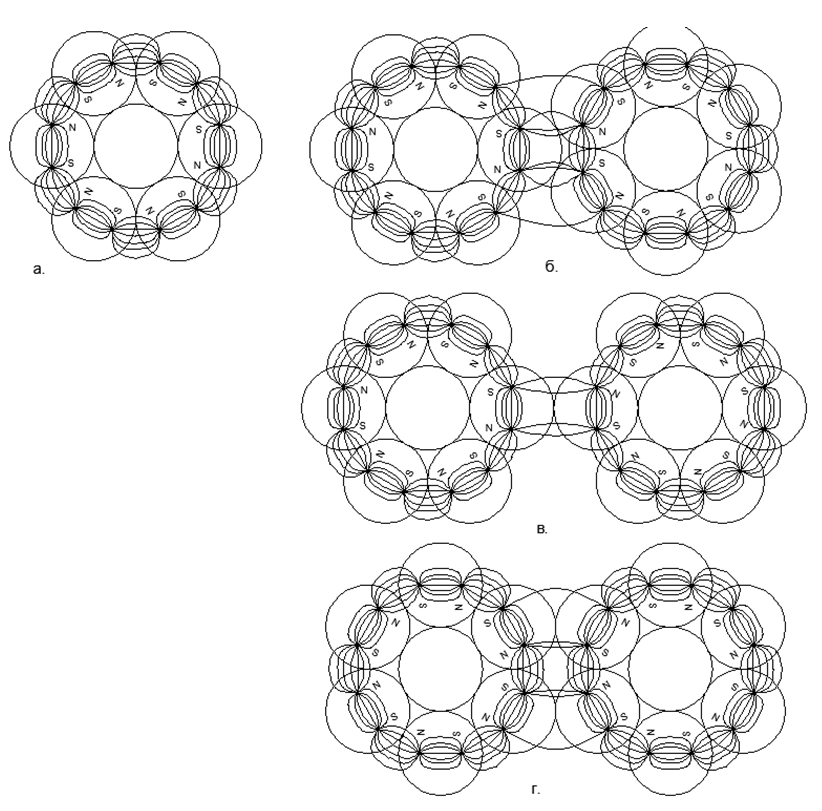 .8. «» :
.8. «» :
. 6- ;
. 6- , , ;
. 6- . , , , (.).
. 6- . , . 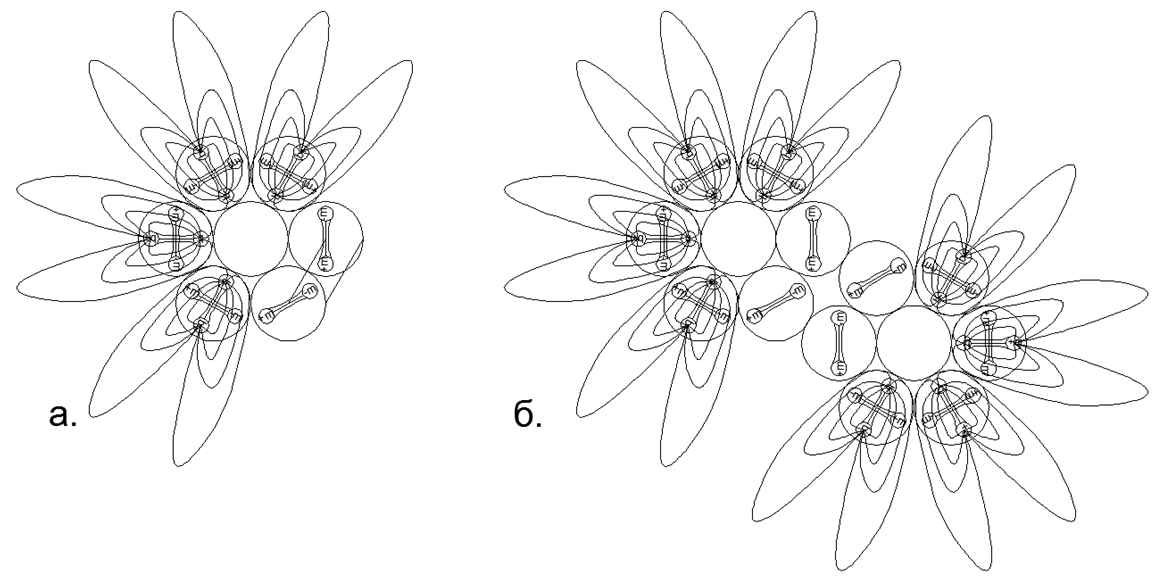 .9. ) , ( N2, 2 ..),; ) , .
.9. ) , ( N2, 2 ..),; ) , . -
En el futuro, consideraremos en detalle las Estructuras-Arquitectura de átomos más probables de elementos individuales con referencia a las peculiaridades de su composición de nucleones y propiedades físicas conocidas (densidad, resistencia, Tplav, TPK, etc.).La siguiente es una tabla de 1-2-3 períodos (cortos) de la tabla periódica, donde en lugar de un peso atómico fraccional, se indican los pesos enteros de los isótopos estables individuales encontrados en la naturaleza (Tabla 2).Tab.2. Pesos atómicos de isótopos estables de elementos químicos de los períodos 1-2-3 de la tabla periódica.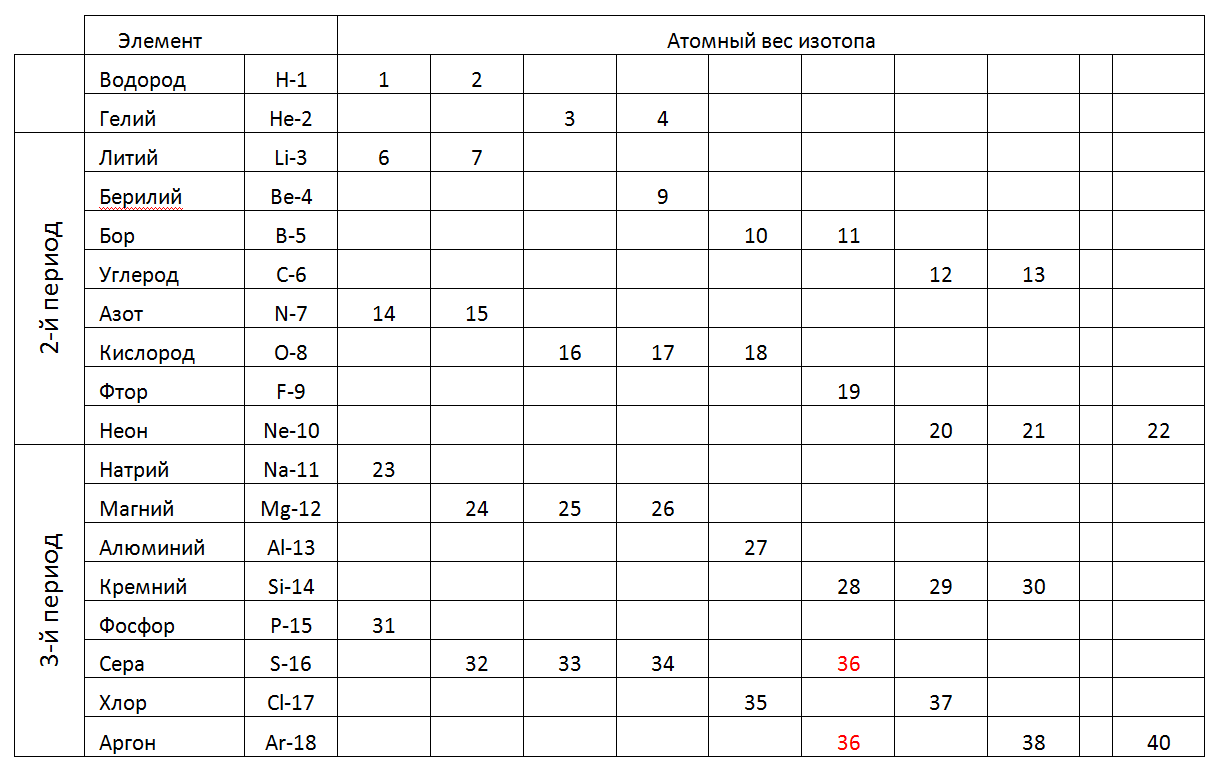 En el primer período y el segundo período (la primera fila completa de la tabla) la tabla periódica contiene elementos con un pequeño número de nucleones. Los átomos de pequeño tamaño de estos períodos nos permiten considerar tales modelos espaciales que corresponden a formas únicas que pueden establecer la dirección de construcción de modelos atómicos para todos los períodos posteriores (ver Fig. 7). Además, la opción de simulación más razonable puede considerarse un aumento gradual en la longitud del anillo Atom cargado principal, complementando con una composición máxima de nucleones de nucleones externos (metálicos) e intraanillos (no metálicos) de acuerdo con su estado químico, y luego buscar un análogo de acuerdo con la tabla de correspondencias de nucleones de elementos químicos .
En el primer período y el segundo período (la primera fila completa de la tabla) la tabla periódica contiene elementos con un pequeño número de nucleones. Los átomos de pequeño tamaño de estos períodos nos permiten considerar tales modelos espaciales que corresponden a formas únicas que pueden establecer la dirección de construcción de modelos atómicos para todos los períodos posteriores (ver Fig. 7). Además, la opción de simulación más razonable puede considerarse un aumento gradual en la longitud del anillo Atom cargado principal, complementando con una composición máxima de nucleones de nucleones externos (metálicos) e intraanillos (no metálicos) de acuerdo con su estado químico, y luego buscar un análogo de acuerdo con la tabla de correspondencias de nucleones de elementos químicos .1.Hidrógeno (11H) 1proton (1p). La sustancia libre tiene la forma H2.
La construcción de un átomo de hidrógeno no requiere ningún esfuerzo, ya que consiste simplemente en una bola de protones. Debido al flujo magnético abierto, el hidrógeno monoatómico es extremadamente activo, lo que hace que reaccione con las sustancias libres más cercanas o que entre en contacto con otros átomos de hidrógeno al estado de un anillo cerrado estable.
Deuterio (21D) 1 protón + 1 neutrón (1p + 1n): la forma también es inequívoca en forma de dos bolas pegadas.
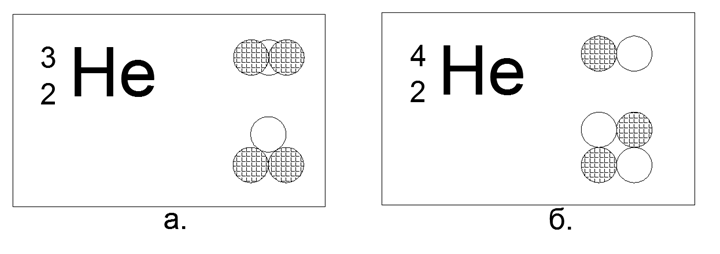
2. Helio (42He) 2 protones + 2 neutrones (2p + 2n)
Para Helium, ya es posible construir varias opciones para modelos de la estructura central:
- Lineal: cuatro nucleones seguidos,
- Plano (Cuadrado): cuatro nucleones en las esquinas de un cuadrado plano,
- Espacial (tetraédrico): cuatro nucleones en las esquinas de un poliedro-tetraedro volumétrico.
En este caso, de 4 bolas magnéticas, es posible construir solo una forma cuadrada plana del núcleo. La forma tetraédrica en las fuerzas magnéticas no se mantiene, convirtiéndose inmediatamente en un cuadrado.
En el futuro, nos centraremos solo en las formas espaciales de los átomos, ya que las variantes lineales en los átomos más masivos no podrán dar una forma de realización significativa.
Isótopo de helio raro (32) 2 protones + 1 neutrón (2p + n)
En esta configuración, solo es posible un triángulo plano.
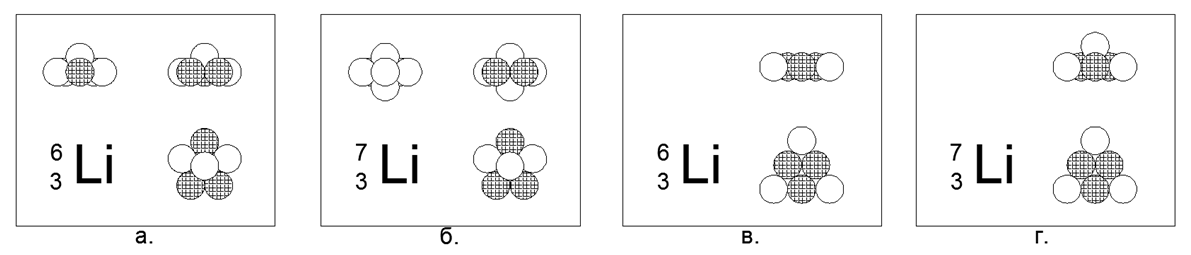
3. Litio (73Li) -7 nucleones (3p + 4n)
Para Lithium, es posible crear un modelo plano y tridimensional del átomo.
El modelo plano es un hexágono con un nucleón en el centro. El modelo de volumen es un pentágono plano con dos bolas en los polos (los polos son puntos en los extremos del eje de rotación de la parte del eje principal del modelo del núcleo atómico). Ambos modelos tienen una simetría pronunciada en forma de estrella. Metal de litio, muy ligero (0.534g / cm3), de fusión relativamente baja (Tm = 454K). Los raros isótopos estables de litio (63Li) -6 nucleones (3p + 3n) se pueden modelar en ambas formas, por lo que no se puede elegir ningún modelo.
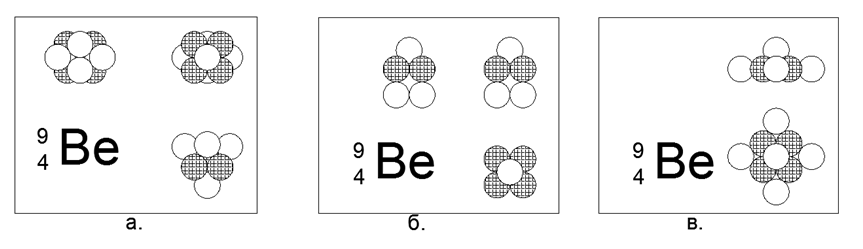
4. Berilio (94Be) - 9 nucleones (4p + 5n).
El único isótopo estable de larga vida. Hay un isótopo de berilio relativamente longevo (104Be): 10 nucleones (4p + 6n) con una vida media de 1.400 millones de años. Muchas implementaciones son posibles. La forma de sensaciones más estable y compacta se parece a una forma de estrella de dos triángulos conectados por planos en un prisma, donde una bola se acopla a las caras laterales del prisma triangular. El berilio es un metal, ligero (1.848 g / cm3), relativamente refractario (Tm = 1551K). En el futuro, la forma STAR se rastreará en la mayoría de los metales. Cuando se agrega la décima bola a la estructura resultante, la forma misma se modifica a otra forma de estrella, pero asimétrica en el plano. La nueva forma se puede describir como una estrella de seis puntas con un centro lleno, en el plano lateral del cual un triángulo de bolas de nucleones atracó. Al mirar a lo largo del eje de la "estrella" en ambas formas de los isótopos de berilio, una estrella de tres puntas de un tipo es claramente visible, lo que determina las propiedades externas básicas de la materia simple.
5. Boro (115Be) - 11 nucleones (5p + 6n).
Isótopos estables de larga vida 10B y 11B. La configuración espacial 10B consta de dos anillos pentagonales conectados en paralelo en la dirección concurrente u opuesta del flujo magnético. La configuración espacial 11B sigue la estructura de 10B, solo se agrega un neutrón a lo largo del eje de los anillos.
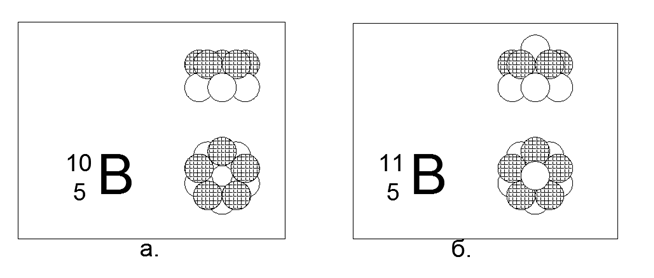
Por lo tanto, se puede suponer que el no metal difiere del metal en su forma externa principal: el no metal es un cilindro de anillos del mismo tipo, el metal tiene cierta forma de estrella (en forma de disco).
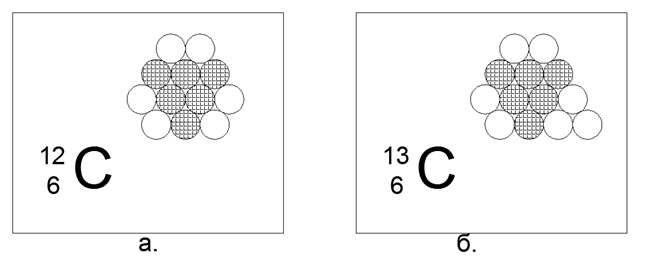
6. Carbono (126) - 12 nucleones (6p + 6n).
Isótopos estables de larga duración 12 (98.93%) y 13 (1.07%), así como 14 radiactivo. Un elemento extremadamente interesante, que está muy extendido y tiene una variedad infinita de formas estructurales en la naturaleza (grafito, diamante, carbón, hollín, nanoestructuras-fullerenos, etc.) Este contenido de forma requiere una estructura de 12 bolas de algunas propiedades especiales sorprendentes. Tal estructura puede resultar ser un hexágono plano no equilátero con tres bolas en el centro.
Los nucleones cargados están dispuestos en un triángulo, a cuyos lados están unidos tres pares de neutrones. El resultado es la simetría de tres haces, donde en los ejes de simetría hay neutrones externos, listos para la conexión magnética de otros átomos. Las capas de grafito, o la superficie de los nanotubos y las estructuras a granel de las estructuras cerradas de Fullerenos, se disponen fácilmente a partir de tales hexágonos.
 Fig. Vista de una capa de grafeno (grafito) compuesta por átomos de carbono planos hexagonales C12.
Fig. Vista de una capa de grafeno (grafito) compuesta por átomos de carbono planos hexagonales C12.Entre los no metales, se distinguen especialmente aquellas sustancias que son gases en condiciones normales. Estos son gases inertes (nobles) monoatómicos, nitrógeno y oxígeno atmosférico diatómico, y el flúor de halógeno diatómico activo.
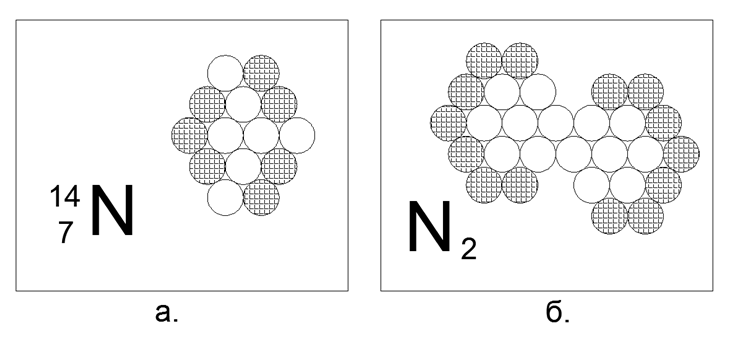
7. Nitrógeno (147N) - 14 nucleones (7p + 7n).
Isótopos estables de larga duración 14N y 15N. En estado libre en condiciones normales, el nitrógeno es un gas diatómico, con muy poca actividad. La atmósfera de nuestro planeta es 78% de nitrógeno. Para poseer la propiedad de gas bajo N.u. el átomo requiere la presencia de nucleones cargados en el perímetro externo, sin roturas en neutrones emparejados. Pero dado que el gas es solo una molécula diatómica, significa que en la estructura del átomo hay una región magnéticamente activa de dos o tres neutrones en una fila en el límite exterior, por el cual los átomos de nitrógeno están unidos a la molécula N2. Esta forma de 14 átomos se ensambla fácilmente en forma de un hexágono no equilátero, similar a un rombo, donde la trama con tres neutrones en una fila en el perímetro exterior del átomo es realmente natural. El enlace en la molécula de N2 es tan fuerte que el gas permanece en estado molecular incluso a 5000 grados C.
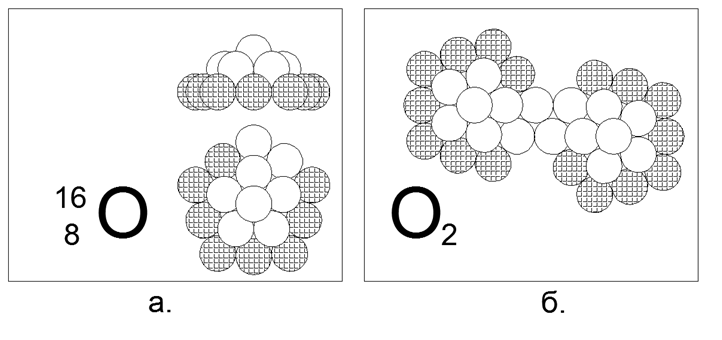
8. Oxígeno (168) - 16 nucleones (8p + 8n).
Isótopos estables de larga vida 17 y 18. La forma supuesta del isótopo más común (99.7%) 16 es un 5-gon de diez nucleones (8 cargados, 2 neutrales), con un espacio de contacto magnético neutro-magnético pronunciado en el anillo externo de diez átomos. El revestimiento interno consiste en un anillo de 5 nucleones con un decimosexto nucleón adicional en el centro. Los anillos de 10 y 5 nucleones no se pueden unir en el plano y, por lo tanto, crean una forma espacial en forma de cúpula. Los isótopos se crean capturando neutrones adicionales en el centro debajo del "domo". La presencia de una brecha externa de dos nucleones en el anillo asegura la creación de una molécula diatómica de O2. La fuerza de enlace dentro de la molécula de O2 es mucho más débil que la del nitrógeno y, por lo tanto, el oxígeno es mucho más activo y entra en la reacción de oxidación (combustión) a temperaturas bastante bajas.
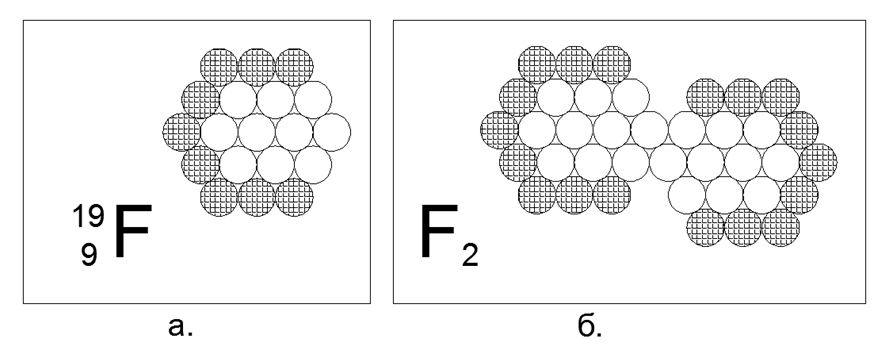
9. Flúor (199F) - 19 nucleones (9p + 10n).
Solo hay un isótopo estable, inestable en vivo desde fracciones de segundos a unidades de horas. La forma asumida de la estructura: un hexágono plano de anillos de 12 y 6 nucleones anidados y un 19º nucleón en el centro. La falta de nucleones cargados en el anillo externo crea una región de atracción magnética de tres nucleones neutros, lo que hace posible crear una molécula diatómica F2, después de lo cual la sustancia exhibe propiedades de gas en condiciones normales. El gas criogénico de flúor-2, es decir, se convierte en líquido solo a temperaturas extremadamente bajas (85K o -188C), lo que lo hace similar a las propiedades de los dos gases diatómicos anteriores.
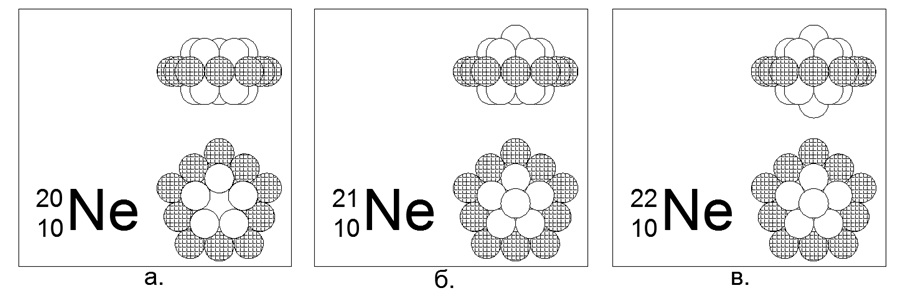
10. Neón (2010He): contenido de 20 nucleones (10p + 10n) en la naturaleza de 90.47%.
Isótopos estables de larga vida 21He (9.25%) y 22He (0.27%). Estructura central estimada: anillo externo cargado de 10 nucleones más dos anillos internos de 5 nucleos anidados.
Los isótopos 21 y 22 se crean agregando un nucleón al centro de uno de los 5 anillos de nucleón a lo largo del eje.
En la Tabla 1, las sustancias con un único isótopo estable son de gran interés, ya que su estructura única no debe permitir que los núcleos adicionales sean absorbidos sin introducir distorsiones en la forma externa. Dichas sustancias incluyen Metales de Berilio-9 (Fig. 7) y Sodio-23 (Fig. 6), Aluminio-27, así como Flúor-19 no metálico, Fósforo-31.
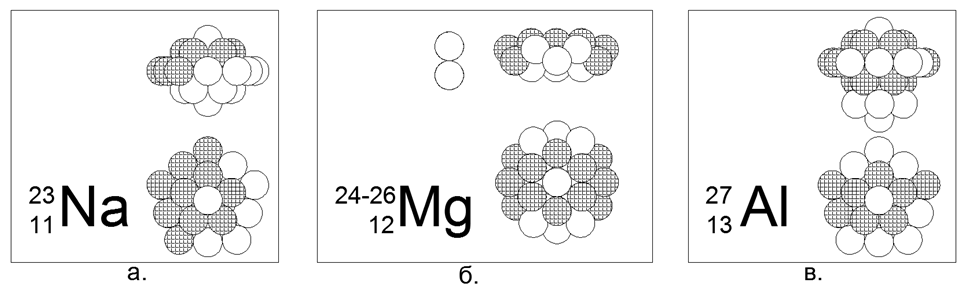
11. Sodio (2311Na) - 23 nucleones (11p + 12n) - Este es el único isótopo estable en la naturaleza, lo que nos permite elegir una configuración de nucleón única para él.
A partir de 23 bolas, fue posible crear solo una versión de una estructura densa y magnéticamente estable de forma de disco estelar. Un anillo de 10 nucleones se enrolla alrededor de la parte central de dos anillos de 5 nucleos unidos por planos. Dentro de la parte central entre los dos anillos de 5 nucleones se conduce un nucleón 21 central. Un nucleón más (22 y 23) está conectado a los lados desde la parte central a lo largo del eje central. En general, el núcleo se asemeja a un yule en forma de lentejas convexas. Debido al hecho de que los anillos de 5 nucleones y 10 nucleones no pueden alinearse en un plano, la forma del anillo de 10 nucleones adquiere una forma en zigzag, mientras que los anillos internos de 5 nucleones están ligeramente separados, lo que permite 21- nucleon
12. Magnesio (12Mg) - 24, 25, 26 nucleones.
Los isótopos tienen una prevalencia del 78,6% - 10,1% -11,3%, respectivamente. Por lo tanto, es obvio que la forma principal es una estructura en forma de disco de dos anillos de 6 nucleones en la parte central y un anillo de 12 nucleos enrollado alrededor. Los isótopos se crean al introducir uno o dos neutrones en el tubo central del disco, que en el anillo de 6 nucleones corresponde exactamente al tamaño de la bola de nucleones.
13. Aluminio (2713Al): 27 nucleones (13p + 14n): este es el único isótopo estable en la naturaleza, que le permite elegir una configuración de nucleón única para él.
De 27 bolas, se creó una versión axisimétrica de la densa estructura magnéticamente estable de una forma de estrella-disco con una multiplicidad de anillos de 5 nucleones: un pilar central de tres anillos de 5 nucleones y un anillo externo de 10 nucleones, y dos nucleones en los extremos del tubo central completan la imagen. Los isótopos 28 y 29 tienen una vida media de 2 minutos y 6 minutos, respectivamente. Isótopo 26 - tiene T1 / 2 = 717 mil años., Y naturalmente se descompone en Magnesio-26 estable por captura de electrones (captura beta). La síntesis continua de Al-26 ocurre en la atmósfera durante la colisión de protones cósmicos rápidos con átomos de argón.

14. Silicio (14Si) - 28, 29, 30 nucleones.
Los isótopos tienen una prevalencia de 92.2% - 4.7% -3.1%, respectivamente. El silicio no es metal. En condiciones normales, el silicio existe en varias formas, y todas ellas son sólidas. En forma cristalina, el silicio es un semiconductor, lo que lo hace similar al carbono del período anterior.
Para 28 nucleones, no había formas regulares de una fila cilíndrica, lo que hizo posible buscar un posible modelo de átomo en una serie de placas poliédricas, como el carbono y el nitrógeno. Entonces se obtienen 28 nucleones de dos átomos de nitrógeno hexagonales planos conectados por planos.
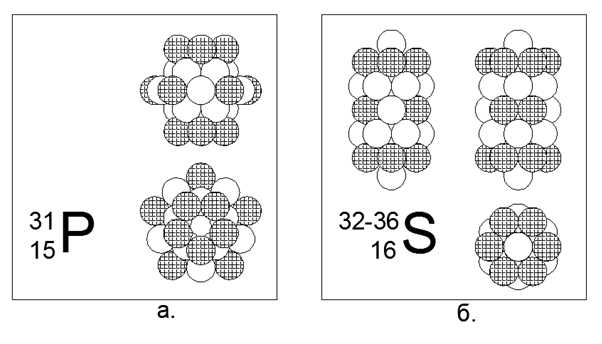
15. Fósforo (3115P) - 31 nucleones.
El único isótopo estable. No metal. Estructura estimada: cuatro anillos de 5 nucleones en el tubo central y un anillo externo de 10 nucleos en el medio del tubo central, que da 30 nucleones, y 31 nucleones son conducidos al centro del anillo de 10 nucleones, donde surge una cavidad debido al acoplamiento no plano 10 Anillos de 5 y 5 nucleones. Las cargas se ubican en 5 piezas en los extremos del tubo central y cinco más uniformemente alrededor del anillo externo de 10 nucleones.
16. Azufre (16S): tiene cuatro isótopos estables de 32, 33, 34 y 36 nucleones.
Los isótopos tienen una prevalencia de 95.013% - 0.75% -4.215% -0.017%, respectivamente. El azufre no es de metal. Suponemos que la forma principal es una estructura cilíndrica de cinco piezas de 6 anillos de nucleones, en el túnel central del cual se colocan nucleones isotópicos adicionales. Para el isótopo raro de Sulphur-36, la estructura se vuelve oscura, ya que dos nucleones adicionales apenas caben dentro del tubo central. El azufre-36 no solo llena completamente el tubo interno del cilindro, sino que también sobresale con nucleones más allá de los bordes de la parte externa cilíndrica. Esta configuración proporciona propiedades típicamente no metálicas de la sustancia, es decir, con puntos de fusión y ebullición relativamente moderados cercanos a las condiciones normales.
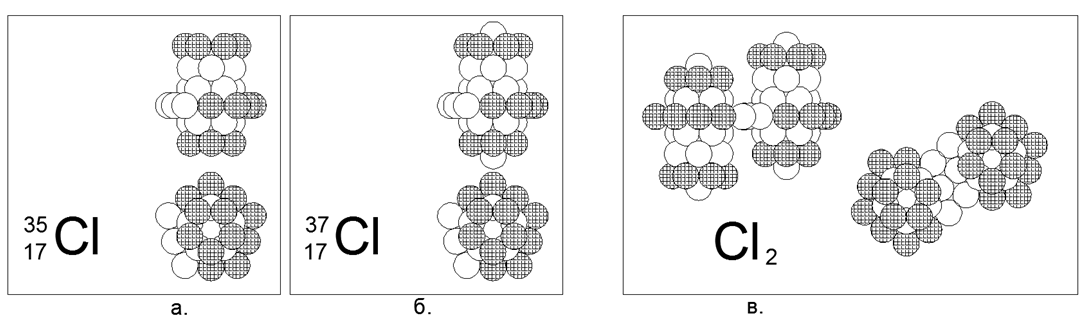
17. Cloro (17Cl): tiene dos isótopos estables de 35 y 37 nucleones.
Los isótopos tienen una prevalencia de 75% y 25%, respectivamente. El cloro es un gas no metálico y diatómico en condiciones normales. Suponemos que la forma principal para el gas es un anillo ancho de 10 nucleones con carga incompleta con una estructura cilíndrica anidada de tres anillos de 5 nucleones a lo largo del eje donde los anillos finales de la tubería están completamente cargados. Para el isótopo pesado Chlor-37, un nucleón se une adicionalmente a los extremos del cilindro principal. El cloro-36 es radiactivo con T1 / 2 = 301 mil años. El cloro-36 inestable es posible tanto en la versión con un nucleón en el extremo abierto del tubo central como con un anillo de 10 nucleones conducido hacia el centro. Con la proximidad de los números de masa de cloro y azufre, que incluso hay intersecciones mutuas de los números de isótopos (isobaras), la estructura del núcleo resulta ser fundamentalmente diferente. La diferencia en la estructura del núcleo también se refleja en la fuerte diferencia en las propiedades químicas y físicas.
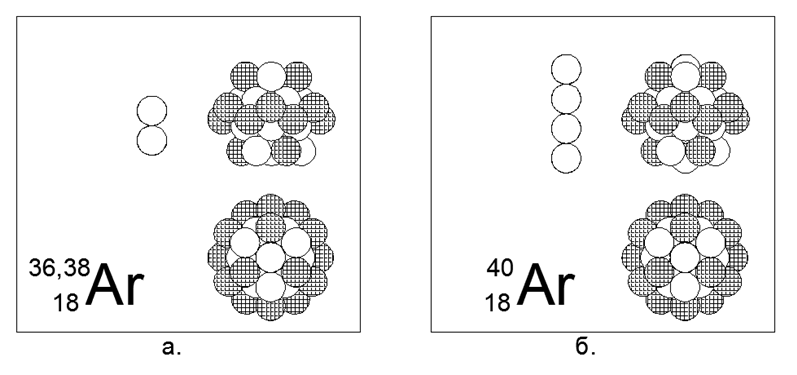
18. Argón (18Ar): tiene tres isótopos estables de 36, 38 y 40 nucleones.
Los isótopos en la Tierra tienen una prevalencia de 0.337% - 0.063% -99.6%, respectivamente, aunque la distribución en el espacio es completamente diferente. En la Tierra, todo el Argón-40 se deriva del Potasio-40 radioactivo en descomposición. El argón es un gas inerte. Se puede suponer que la forma principal es una estructura cilíndrica de cuatro piezas de 6 anillos de nucleones, en el túnel central del cual se colocan 2 o 4 nucleones adicionales de isótopos masivos, y se coloca un anillo completamente cargado de 12 nucleones en la parte superior del tubo central. Un anillo exterior similar completamente cargado es un rasgo característico de los gases inertes, según el modelo teórico desarrollado del Atom-Nucleus.
Argon-36 es un isobar a Sulphur-36 (el segundo par en la tabla periódica), pero las estructuras de la forma principal son significativamente diferentes. Se puede suponer que uno de los siguientes metales alcalinos, a saber, el potasio o el calcio, estará cerca del argón en la estructura del núcleo.
Totales
El aumento gradual de la masa atómica con un aumento lineal en el número de nucleones cargados de acuerdo con la tabla periódica permitió construir una serie consistente de soluciones estructurales de las Estructuras Atómicas-Arquitecturas de elementos químicos que están relacionados con sus propiedades físicas y químicas. Los modelos de Nuclei-Atoms de elementos como requisito obligatorio incluyen la capacidad de construir todos los isótopos estables sin un cambio radical en la forma del átomo.
La principal conclusión obtenida en esta etapa es la siguiente idea:
A pesar de la diferencia en las propiedades químicas de las sustancias ubicadas en la tabla (por ejemplo: gas inerte y el metal alcalino que le sigue), diferirán estructuralmente solo en la ubicación de los nucleones cargados en el perímetro externo del átomo o en las filas internas. Por lo tanto, un cambio periódico en las propiedades está asociado con una transición suave de la concentración de nucleones cargados desde la zona interna del núcleo hacia el exterior.