
¿Desde qué oficina en cualquier hospital gritan de vez en cuando niños y adultos? ¿Qué padres, engañándonos descaradamente en la infancia, en comparación con una picadura de mosquito? Creo que ya has adivinado que este es un análisis de sangre. Ahora este procedimiento se ha vuelto más rápido y menos doloroso. Una cosa no ha cambiado: su importancia. El diagnóstico en medicina juega el papel más importante en las primeras etapas de la lucha contra una enfermedad. Después de todo, para vencer una dolencia, primero debe ser descubierta. Después de haber sobrevivido al procedimiento de muestreo de sangre para el análisis, se puso en marcha con calma para esperar sus resultados. En este momento en los laboratorios, las personas que utilizan dispositivos complejos, voluminosos y muy caros analizan su sangre, descubriendo qué contiene y en qué cantidad. Es bueno tener un laboratorio así en su hospital local, pero este no es siempre el caso. Pero, ¿qué pasaría si hubiera un laboratorio de bolsillo, pequeño y económico, pero al mismo tiempo analizando muestras con la misma precisión y eficiencia que uno ordinario? Suena a ciencia ficción, ¿verdad? La frase "analizador de azúcar en sangre de bolsillo" en su momento también sonaba futurista. Hoy conoceremos la investigación e implementación de la tecnología para el análisis cuantitativo de proteínas y aminoácidos a través de un nuevo tipo de dispositivo compacto. ¿En qué consiste este milagro, cómo funciona y qué tan efectivo? Recibiremos respuestas a estas y otras preguntas en el informe de los científicos. Vamos
Base de estudio
Vivimos en la era de la tecnología digital, que se está implementando con éxito en varias áreas de nuestras vidas. Los estudios de laboratorio (diagnóstico) no son una excepción. Los científicos señalan que el análisis de goteo digital es 1000 veces más preciso que el tradicional y permite realizar millones de análisis en paralelo dentro de una sola gota de una muestra con un volumen medido en femtolitros (fl, 1 fl =
10-15 L).
El uso del análisis digital es extremadamente útil para detectar ácidos nucleicos y proteínas, analizar células individuales e incluso exosomas.
Exosomas * : vesículas extracelulares (diámetro: 30-100 nm), que son secretadas por las células en el espacio intercelular. Los exosomas están involucrados en el trabajo de inmunidad, secreción de proteínas, etc.
Por el momento, los métodos de análisis digital más famosos son dELISA (ensayo de inmunosorción enzimática digital / DIA) y qPCR (reacción en cadena de la polimerasa digital). Estas técnicas le permiten trabajar con células individuales, mientras obtiene resultados muy precisos que no requieren corrección. Recientemente, utilizando estos métodos, se realizó un análisis cuantitativo exitoso de proteínas y ARNm en una célula al mismo tiempo.
Técnicas similares y una demostración de sus talentos muestran una vez más que la implementación del análisis paralelo dentro de un entorno extremadamente pequeño (muestra) es bastante posible. Sin embargo, como cualquier otra tecnología, estos métodos también tienen desventajas. Son bastante triviales: dimensiones, precio y complejidad de fabricación. Los investigadores nos recuerdan que una instalación para un amplificador digital (Quanterix's Simoa) cuesta alrededor de $ 100,000. Y no todas las clínicas privadas pueden pagar tal cantidad, ya no tengo en cuenta las estatales.
Por supuesto, esta "bestia" Simoa de Quanterix es muy poderosa, si es exagerada. Utiliza tabletas con microcélulas con 200,000 células de 40 fl cada una.
 La simoa de Quanterix
La simoa de QuanterixAl mismo tiempo, este dispositivo puede procesar en paralelo hasta 4 tabletas ELISA de 96 células cada una. Por lo tanto, un dispositivo es capaz de producir los resultados de 66 muestras en una hora, cada una de las cuales puede someterse a un análisis de 10 plex (es decir, 1 muestra se analiza para 10 indicadores a la vez). Los números son realmente increíbles. Pero nuevamente, surge la pregunta sobre el precio y las dimensiones de una máquina de milagros.
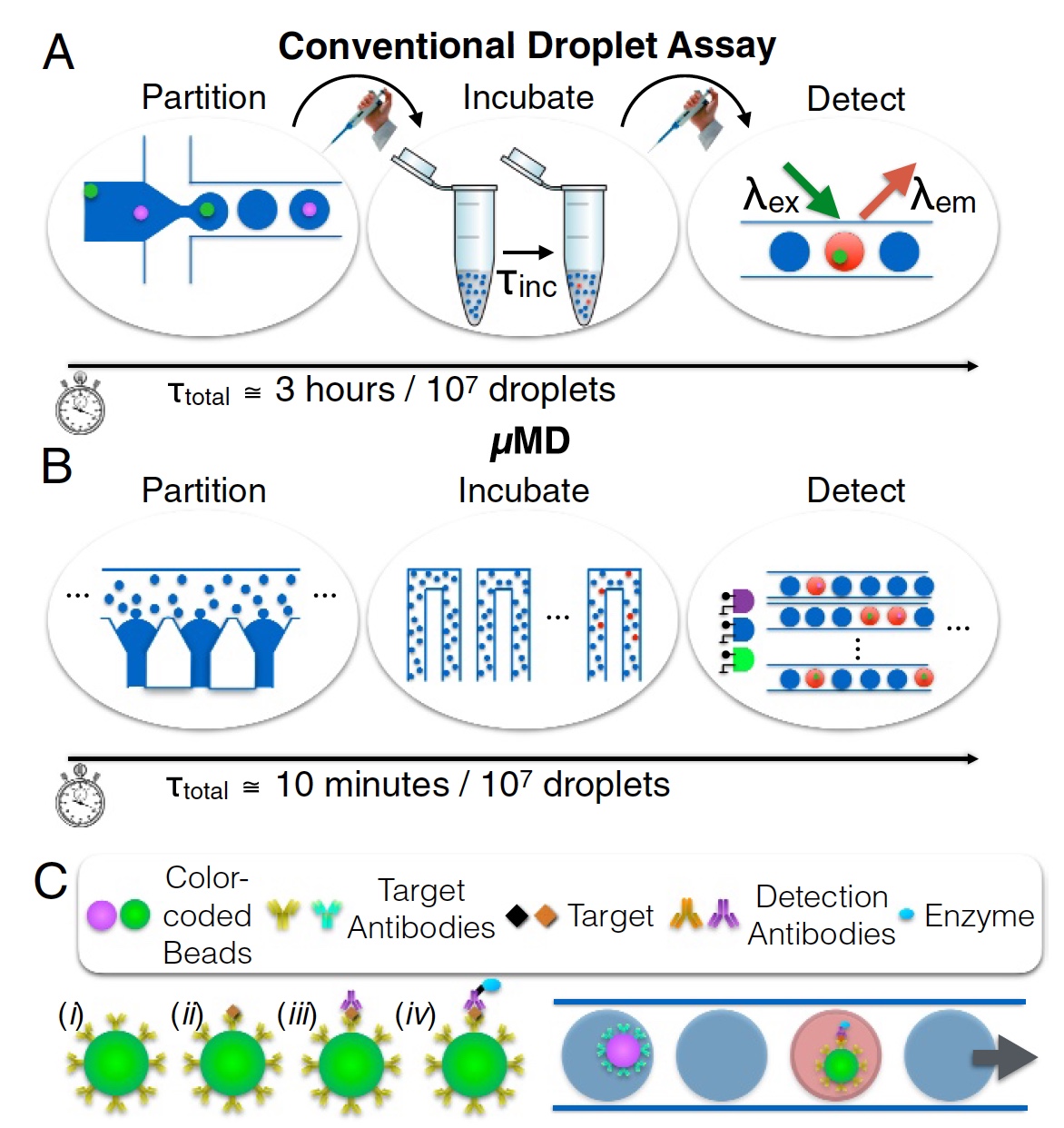 Imagen No. 1
Imagen No. 1Y aquí, los científicos proponen volver la vista hacia los sistemas de gotas microfluídicas. Los sistemas clásicos de este tipo no pueden presumir de un rendimiento colosal Simoa de Quanterix, sin embargo, pueden servir como base para un nuevo dispositivo. La técnica de gotitas microfluídicas de flujo continuo teóricamente puede analizar hasta 1 millón de células. Sin embargo, en la práctica, estos indicadores aún no se han logrado por varias razones. En primer lugar, el rendimiento (menos de 104 gotas por segundo), cuando las gotas se generan secuencialmente (no en paralelo) y son monodispersas. En segundo lugar, la detección de fluorescencia de cada gota se lleva a cabo pasándolas una a la vez a través de un punto láser. En otras palabras, todo está en línea, uno a la vez. Este proceso se muestra en la imagen
1a (separación, incubación y determinación; 3 horas para el análisis de 10
7 gotas).
Los principales problemas de convertir este método a un formato compacto son la dificultad de paralelizar la óptica para la detección multicolor de fluorescencia, la complejidad de integrar el proceso de preparación de muestras y la necesidad de ciertas herramientas para generar flujos de gotas estrictamente controlados. Sin embargo, los científicos no están acostumbrados a rendirse ante las dificultades, no importa cuán impresionantes sean.
Micro-drop Megascale Detector (MD, macro detector) es la creación de nuestros héroes hoy. Este dispositivo no solo se puede implementar en cualquier dispositivo móvil (de bolsillo), sino que también cumple con los estándares de análisis cuantitativo de los laboratorios comunes de tamaño completo. El proceso se muestra en la imagen
1b (separación, incubación y determinación; 10 minutos para el análisis de 10
7 gotas).
Para lograr esto, según los investigadores, se implementaron tres tareas principales:
- En lugar de generar 1 gota cada una, se utilizó la generación paralela de gotas microfluídicas, que funcionaban 100 veces más rápido. Y los logros de otros científicos en el campo de la producción de gotas monodispersas ( enlace a este estudio ) hicieron posible deshacerse de la dependencia de la monodispersidad de las gotas en la velocidad de flujo. Esto permite el uso de bombas peristálticas muy económicas que pueden integrarse en un dispositivo móvil (de mano).
- La lectura rápida de la fluorescencia de gotas a una velocidad de más de 105 por segundo (recuerde el límite de 104, que mencioné anteriormente) se logró gracias a la visualización basada en un teléfono móvil, que es 100 veces más rápido que la lectura convencional (cuando las gotas se leen a su vez). En este caso, no hay necesidad de ópticas costosas, y la implementación en dispositivos móviles de mano es obvia. La principal característica distintiva de esta innovación es la capacidad de superar las limitaciones de la baja velocidad de cuadros de una imagen digital y proporcionar detección de fluorescencia multicolor al modular varias fuentes de excitación de LED o diodos láser de diferentes colores con señales únicas no periódicas. El video se puede decodificar para obtener datos de fluorescencia de gotas, superando los límites de velocidad de cuadros de la cámara. Por lo tanto, es posible lograr las mismas (mencionadas anteriormente) de 1 millón de gotas por segundo.
- Y, por último, la integración de una unidad de procesamiento de microgránulos (o microperlas, objetos esféricos microscópicos), un generador de gotas, líneas de retardo de señal para la incubación de gotas y un detector de fluorescencia. En conjunto, esto proporciona un dispositivo económico, compacto y eficiente para ingresar suero no tratado (muestra) y generar datos moleculares (resultado).
Como demostración de su invención, los científicos implementaron un DIGA multiplexado utilizando diferentes microgránulos de color obtenidos de tintes fluorescentes. Cada color es el "código" de color de la proteína a la que se dirige el anticuerpo microperla (
1c ).
Se realizó un análisis múltiple de suero GM-CSF e IL6 en suero usando gránulos fluorescentes ultravioleta y verde, cuando las gotas contenían un microgránulo con un inmunocomplejo rojo fluorescente. Se usó suero bovino como medio para el análisis cuantitativo, y el límite de determinación fue 0,004 pg / ml (picogramo por mililitro, 1 pg =
10-12 g). Esto es 1000 veces más preciso que el ELISA estándar y corresponde al nivel de precisión del ELISA digital.
Solo lleva 10 minutos procesar 10 millones de gotas. En este caso, el proceso en sí incluye la generación e incubación de gotas, así como la detección de gotas fluorescentes para cada muestra.
Estructura del dispositivo y proceso de análisis.
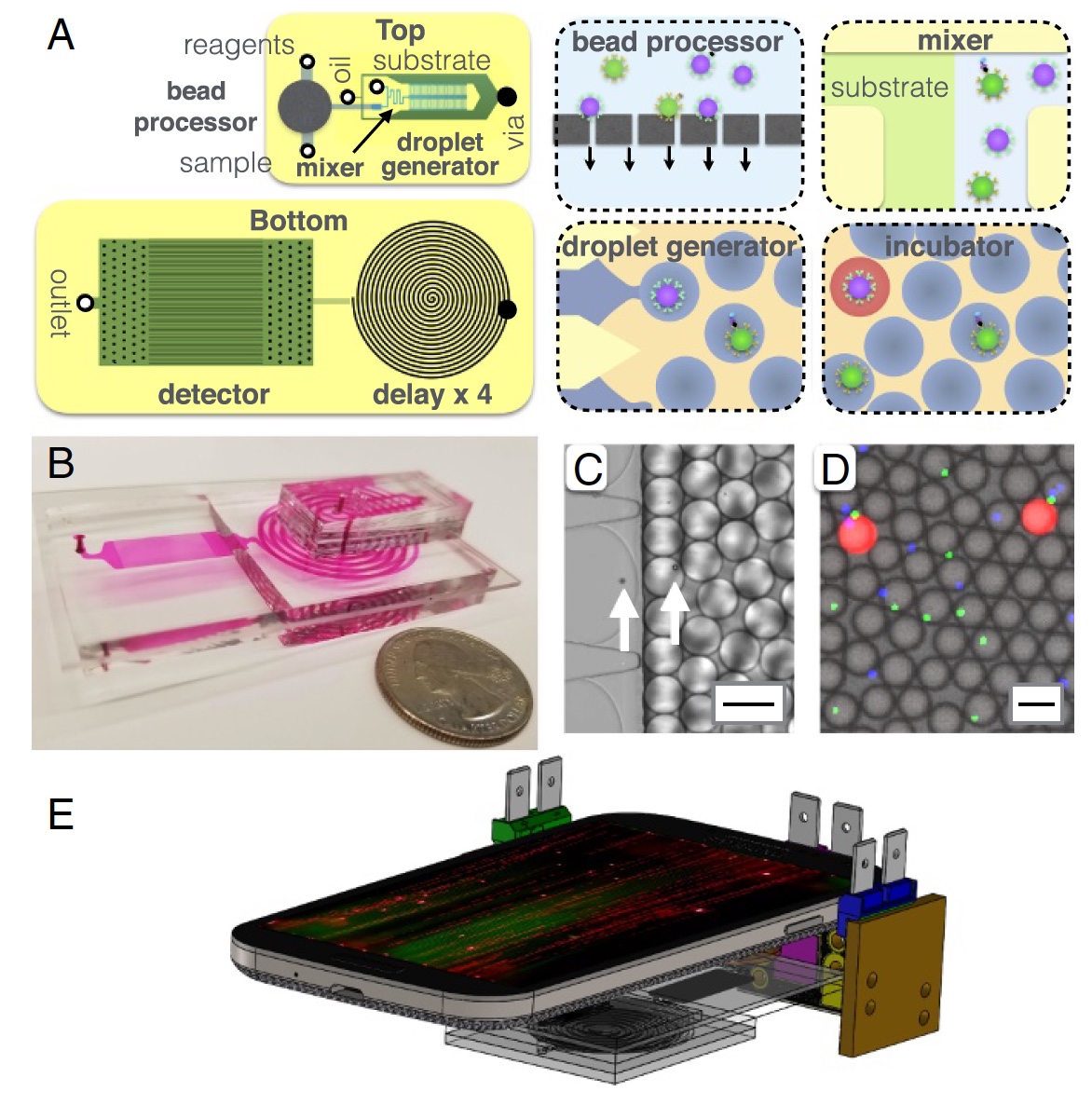 Imagen # 2: estructura del dispositivo MD.
Imagen # 2: estructura del dispositivo MD.Un poco más sobre la imagen de arriba:
2a - diagrama de chip, vista superior e inferior;
2b es una foto de un chip MD en el que todos los canales optofluidos son visibles;
2c es una micrografía del proceso de encapsular microperlas en gotas con un diámetro de 40 μm;
2d es una micrografía de fluorescencia de gotas después de una línea de retardo;
2e es una representación esquemática de una plataforma MD (teléfono móvil, 3 fuentes de luz y el chip MD en sí).
Los componentes principales de MD pueden llamarse procesadores de microgránulos, donde estos últimos capturan proteínas diana del suero. Después de esto, los gránulos se marcan con inmunocomplejos para su posterior amplificación dentro de las gotas. Entre cada uno de estos procesos, se produce una limpieza iterativa (varias veces). También está presente un generador de gotas, donde los microgránulos se mezclan con un sustrato enzimático y se encapsulan en gotas de agua y aceite.
Luego viene un canal microfluídico a través del cual pasan las gotas durante 3.2 minutos. Este canal es necesario como retraso / desaceleración del proceso, lo que permite amplificar enzimáticamente la señal fluorescente. La parte final es un detector (o escáner) basado en un teléfono móvil (cámara), donde se detecta la fluorescencia de las gotas.
El procesador de microgránulos consta de una membrana semipermeable para inmovilizar los gránulos. Se suministran varios reactivos y tampones de lavado a los gránulos inmovilizados. Después de esto, los gránulos se liberan para su posterior análisis.
La membrana en sí está hecha de policarbonato. Una huella grabada de 300 mm
2 con poros de 3 μm de diámetro fue grabada en la membrana.
En este experimento, había dos grupos de microgránulos: (d = 5.4 μm, ex / em = 470/490 nm, CFH-5052-2), funcionalizados con anticuerpo anti-GM-CSF (MAB2172) y (d = 4.5 μm, ex / em = 370/410 nm, CFP-4041-2) funcionalizado con anticuerpo anti-IL6 (MAB206).
En primer lugar, los microgránulos pasan por el proceso de incubación junto con la muestra durante 1 hora, y solo después de eso se capturan en la membrana mencionada anteriormente.
En esta etapa (dentro de la membrana), los gránulos se lavan con 1 ml de tampón T20 a una velocidad de flujo de 10 ml / h, se incuban con 0,1 ml de anticuerpo de detección 0,7 nM en tampón T20 durante 0,5 horas, se lavan nuevamente con 1 ml de tampón T20 a 10 ml / h, y después de eso se liberan de la membrana cambiando el caudal a 6 ml / h.
Después de eso, las microperlas liberadas se mezclan con un sustrato ELISA y se encapsulan en gotas con un diámetro de 40 μm. Para garantizar una mezcla precisa de gránulos y sustrato y para minimizar la señal de fondo de las enzimas que generan una señal fluorescente, se utiliza un canal especial con una longitud de 14 mm.
El generador de gotas está diseñado para que el diámetro de las gotas sea independiente del caudal. Este dispositivo tiene solo 100 de estos generadores, que en la salida dan un rendimiento de 100,000 gotas por segundo.
Cada gota se encapsula con 1 gránulo o permanece intacta. Al mismo tiempo, se logra una cierta concentración: 10 gotas más que los microgránulos (por ejemplo, 20 gotas - 10 con gránulos y 10 sin). Esto reduce la probabilidad de que en una gota haya dos gránulos hasta 0.5%.
Después de los generadores de gotas, hay una línea de retardo similar a una espiral con un ancho de canal de 1.8 mm y una altura de 1.5 mm. La línea de retraso debe ser lo suficientemente larga, pero no puede aumentar el tamaño del dispositivo. Por lo tanto, se hicieron 4 espirales uno a uno, para pasar completamente, lo que a un caudal de 67 ml / h, las gotas tomarían 3,2 minutos.
Para introducir dicho dispositivo en una plataforma móvil, fue necesario resolver ciertas tareas relacionadas con la cámara del teléfono. El uso de una excitación de luz constante de tiempo constante conduce al hecho de que las gotas que se mueven en el campo de visión de la cámara se visualizan como rayas. La longitud de esta tira establece la distancia mínima entre las gotas y, por lo tanto, limita seriamente el rendimiento.
Si usamos la excitación de la luz con una secuencia pseudoaleatoria (en el tiempo), esto nos permitirá "ver" las gotas individuales. La velocidad de modulación de la luz es 10 veces el tiempo de exposición de la cámara. Debido a esta diferencia, las gotas forman tiras, la distancia entre las cuales (tres diámetros de gotas) es suficiente para su determinación individual. En este caso, puede omitir 120 canales de goteo paralelos frente a la cámara.
Otro punto importante en la detección y exploración es la fluorescencia. Para llevar a cabo el ELISA multiplex, se necesitan varias señales fluorescentes diferentes, para esto se utilizaron 3 fuentes de luz a la vez, cada una de las cuales tiene la longitud de onda necesaria para excitar un determinado colorante fluorescente. Este sistema triple consta de dos láseres de diodo (azul, verde) y un LED (UV).
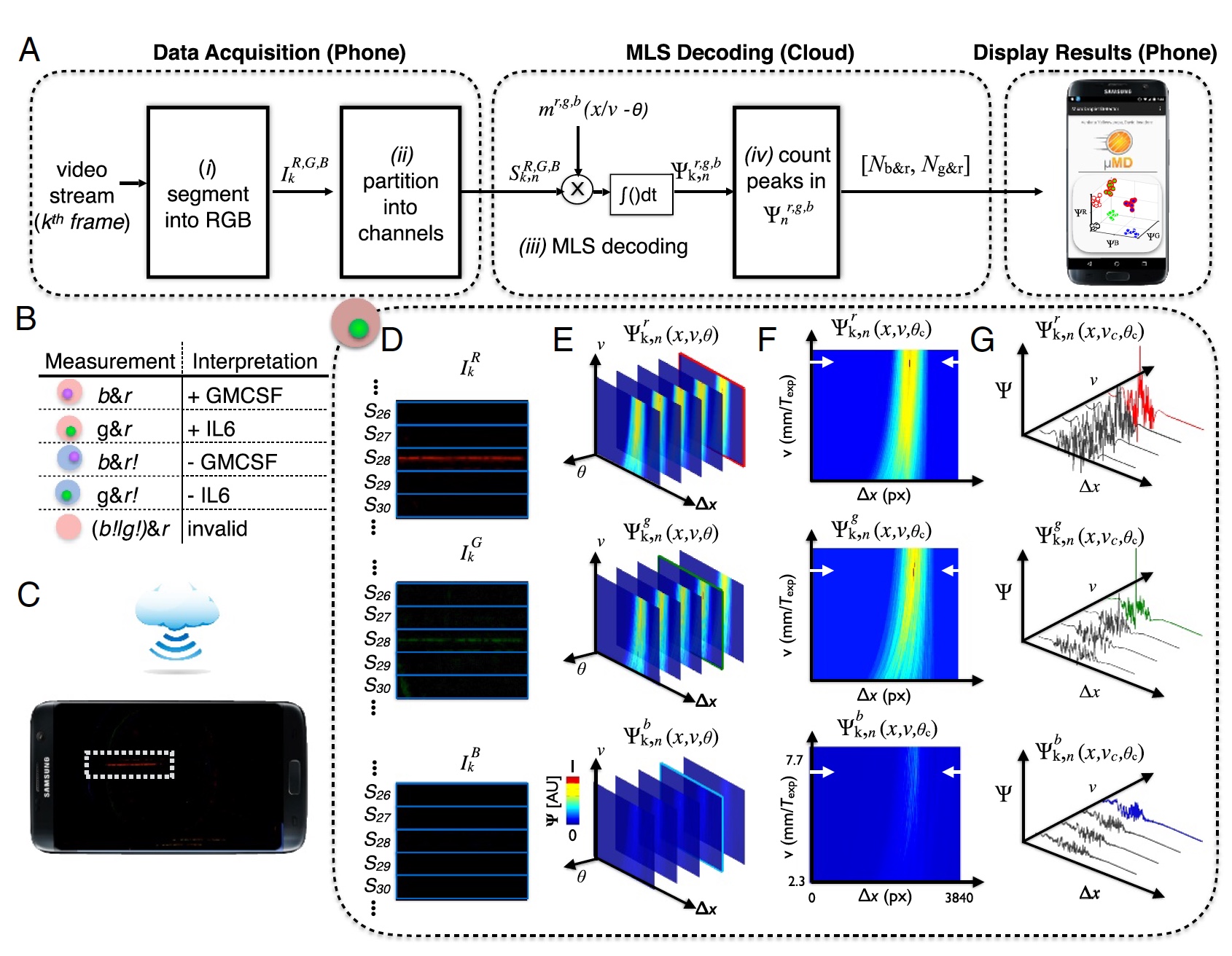 Imagen No. 3: proceso de "resultado de muestra" (decodificación de datos de la cámara del teléfono).
Imagen No. 3: proceso de "resultado de muestra" (decodificación de datos de la cámara del teléfono).Para la decodificación precisa del video desde la cámara del teléfono, fue necesario realizar una detección de correlación para los tres patrones de modulación esperados (
m ), que corresponden a cada una de las tres fuentes de luz.
El resultado fue un vector de correlación (
3a ), donde:
k - cuadros;
n = 1: 120 canales en el dispositivo;
R ,
G ,
B - canales de color de la cámara digital;
r ,
g ,
b - excitación de color.
El patrón de gotas se creó a través de una secuencia de longitud máxima (MLS) con | m | = 63 bits. Además, cada bit tiene 10 píxeles en una imagen digital, es decir, un total de 63 bits es 630 píxeles (1/3 de un marco de ancho en 1920).
Es necesario un escaneo de fluorescencia para determinar si una gota contiene un microgránulo, si es así, para determinar el color (UV o proteína verde, molécula roja objetivo). Después de recibir estos datos, deben ser extraídos. Para hacer esto, el cuadro de video se divide en componentes rojo, verde y azul de acuerdo con los sensores de la cámara (
3d ).
Este dispositivo utiliza tecnología en la nube. Esto se hizo para reducir la carga en la plancha (es decir, en el teléfono). En lugar de controlar la velocidad o fase de las gotas, se realizó la computación en la nube para determinar las gotas con una fase o velocidad desconocida (
3s ). Después de determinar las fases óptimas y la velocidad de la gota, se pueden determinar con precisión los picos en el espacio de correlación Ψ
r, g, b k, n (x, υ
c , θ
c ) (
3f y
3g ).
Los datos recopilados se cargan en una aplicación especial (hasta ahora solo en el sistema operativo Android), que los envía a la nube para procesarlos utilizando MATLAB en un servidor remoto. Después de eso, los datos ya procesados se devuelven al teléfono inteligente y se muestran en la pantalla.
Después de todo el trabajo preparatorio y de prueba, los científicos decidieron llevar a cabo un "combate" con la participación de su creación y el dispositivo comercial existente Simoa.
En el duelo de prueba, se utilizaron tres versiones del medio de trabajo: PBS - tampón de fosfato de sodio, FBS - suero bovino fetal y suero sanguíneo humano. El indicador más importante fue el límite de detección (LOD), es decir, el contenido mínimo del analito en la muestra.
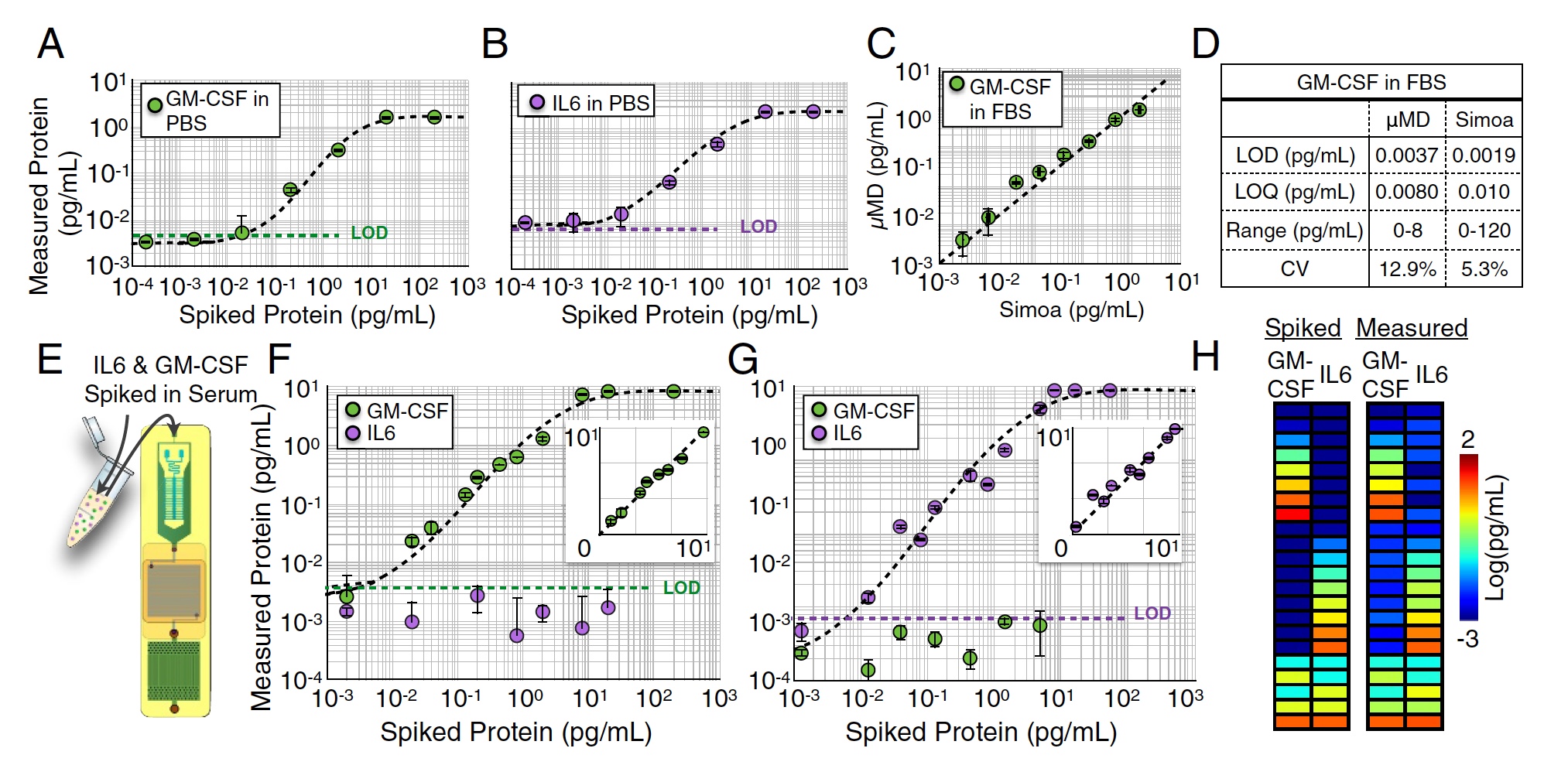
Resultados de la prueba de chip MD.
Se realizaron varias mediciones de un solo complejo de M-CSF (Imagen
A arriba) e IL6 (Imagen
B ) en medio PBS midiendo diluciones en serie de 104 a 102 pg / ml. En esta prueba, se obtuvieron límites de detección muy buenos: LOD = 0.0045 pg / ml para GM-CSF y LOD = 0.0070 pg / ml para IL6.
También se realizaron mediciones similares en solución de FBS (1: 4). En esta etapa, la muestra para análisis se dividió a la mitad entre el dispositivo en estudio y el Simoa comercial "pesado". Como resultado, la creación de científicos mostró excelentes resultados, que prácticamente no fueron inferiores a los de Simoa (R2 = 0.95, imagen
C arriba).
Pero fue un análisis de un solo plex, es decir, un análisis de un indicador. Ahora era necesario verificar cómo el chip MD lidiará con el análisis paralelo de varias proteínas, es decir, con el análisis dúplex de GM-CSF e IL6 simultáneamente. Para empezar, se añadió una cierta cantidad de GM-CSF al FBS, y la concentración de IL6 fue cero (imágenes
F y
G ). Luego se hizo lo contrario: concentración cero de GM-CSF y algo de IL6.
En ambos casos, el límite de detección no difirió mucho de los resultados del análisis one-plex realizado anteriormente (p> 0,88 para GM-CSF y p> 0,90 para IL6).
Después de eso, se añadió una cierta cantidad de GM-CSF e IL6 (imagen h) a la muestra. La precisión de detección fue excelente: R2> 0:99 para GM-CSF y R2> 0:99 para IL6.
La prueba más significativa fue el análisis de suero humano. Se tomaron muestras de sangre de 14 sujetos. Los investigadores cuantificaron el GM-CSF e IL6 de estas muestras usando un chip MD y Simoa.
 Resultados cuantitativos de suero humano GM-CSF e IL6 usando MD y Simoa.
Resultados cuantitativos de suero humano GM-CSF e IL6 usando MD y Simoa.Los resultados del análisis con el chip MD resultaron ser muy similares a los resultados de Simoa (R2 = 0: 96), que actualmente es el analizador más preciso.
Demostración del dispositivo.Para un conocimiento más detallado de los matices y detalles del estudio, le recomiendo que consulte el
informe del grupo de investigación y los
materiales adicionales .
Epílogo
La velocidad juega un papel muy importante en la medicina. Cuanto más rápido se realice el diagnóstico preciso, más rápido podrá comenzar el tratamiento. A veces ni siquiera se trata de días, sino de minutos que no se pueden desperdiciar. , - . , , .
, MD, , . , , , . 500 . - 5.
, . .
, , .
Gracias por quedarte con nosotros. ¿Te gustan nuestros artículos? ¿Quieres ver más materiales interesantes?
Apóyenos haciendo un pedido o recomendándolo a sus amigos, un
descuento del 30% para los usuarios de Habr en un análogo único de servidores de nivel de entrada que inventamos para usted: toda la verdad sobre VPS (KVM) E5-2650 v4 (6 núcleos) 10GB DDR4 240GB SSD 1Gbps de $ 20 o cómo dividir el servidor? (las opciones están disponibles con RAID1 y RAID10, hasta 24 núcleos y hasta 40GB DDR4).
VPS (KVM) E5-2650 v4 (6 núcleos) 10GB DDR4 240GB SSD 1Gbps hasta el verano gratis al pagar por un período de seis meses, puede ordenar
aquí .
Dell R730xd 2 veces más barato? 2 Intel Dodeca-Core Xeon E5-2650v4 128GB DDR4 6x480GB SSD 1Gbps 100 $249 ! Lea sobre
Cómo construir un edificio de infraestructura. clase utilizando servidores Dell R730xd E5-2650 v4 que cuestan 9,000 euros por un centavo?