La publicación anterior recibió una evaluación negativa con la frase "por qué publicar aquí cosas tan elementales". Por lo tanto, inmediatamente advierto que este material está destinado principalmente a escolares que comienzan a estudiar química. Y también para aquellos que no entendieron este tema en sus años escolares. Publicaría un artículo sobre un recurso especializado popular para escolares si existiera.
Y sí, soy consciente de la existencia de un modelo atómico en el que el electrón es una onda de probabilidad ubicada cerca del núcleo. Pero, como regla, es difícil para un estudiante imaginar cómo la probabilidad puede combinar átomos en moléculas. Por lo tanto, afirmo "en los dedos".
La conexión de los átomos en las moléculas.Nuestro mundo no existe en forma de átomos separados, de alguna manera se conectan entre sí. Cual?
Toma dos átomos de hidrógeno. Cada uno de ellos contiene un protón y un electrón, por lo que la carga total de cada uno de estos átomos es cero.
Ley pendiente
F = k * q1 * q2 / r ^ 2nos dice que los cuerpos neutrales no deberían ser atraídos entre sí
(q1 = 0, q2 = 0) .
Entonces, el hidrógeno (y cualquier otro elemento químico) debería existir solo en forma de átomos, y nunca combinarse en moléculas. De hecho, los átomos de hidrógeno siempre se combinan en pares. Por qué
Tomemos dos piezas de metal y ordénelas en paralelo a una pequeña distancia entre sí.

Ambos segmentos contienen el mismo número de protones y electrones, por lo tanto, la carga total de cada uno de ellos es igual a cero. Entonces, no tienen ninguna razón para la atracción mutua.
Sabemos que en los metales una parte de los electrones externos deja sus átomos y camina libremente entre los iones (átomos abandonados) de la red cristalina del metal. Y estos electrones se distribuyen, en promedio, de manera uniforme.
Imagine que de alguna manera logramos mover parte de estos electrones libres al lado izquierdo del segmento inferior del metal. Además, en su lado derecho habrá un déficit de electrones.

Obtuvimos el llamado dipolo: el lado izquierdo del segmento está cargado negativamente, el derecho es positivo. Genial ¿Y qué pasará en el segmento superior? Sabemos que las mismas cargas se repelen entre sí, mientras que las opuestas se atraen. En consecuencia, los electrones del segmento superior, comenzando por los campos eléctricos de los electrones del segmento inferior, irán al lado derecho. Es decir, la imagen de la distribución de electrones en estos dos segmentos de metales se convertirá en un espejo:
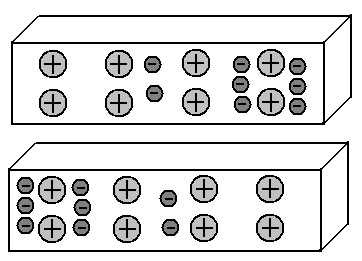
Este efecto de los objetos cargados en los objetos vecinos, que conduce a una redistribución de las cargas en ellos, se llama inducción electrostática.
Ahora lo más interesante: los núcleos atómicos con carga positiva en el lado izquierdo del segmento superior eran electrones opuestos recogidos en el lado izquierdo del segmento inferior. Y se atraen los cargos opuestos. Entonces, las partes izquierdas de los segmentos comenzarán a atraerse entre sí.
Lo mismo sucederá en el lado derecho de los segmentos, solo reflejado. Y los extremos derechos de los segmentos también se atraerán entre sí. Maravilloso, ¿no es así? ¡La redistribución de los cargos dentro de uno de los segmentos de los conductores ha llevado a la atracción mutua de estos dos segmentos!
Pero, ¿qué sucede si ahora movemos los electrones libres del segmento inferior a su extremo derecho? Luego, los electrones libres del segmento superior se moverán al extremo izquierdo. Es decir, moviendo electrones hacia adelante y hacia atrás en uno de los segmentos, ¡hacemos que los electrones del segmento vecino se muevan, lo que no está conectado de ninguna manera con el primero! Tal efecto del movimiento de electrones en un conductor sobre el movimiento de electrones en un conductor adyacente se llama inducción electrodinámica.
Aunque esto no se aplica a nuestro tema, observamos que hemos estudiado de forma algo simplificada cómo funcionan la antena y el receptor durante la transmisión de radio.
Podemos organizar estas dos piezas de metal de manera diferente, con los extremos uno frente al otro:

Si podemos mover los electrones, por ejemplo, al lado derecho del segmento izquierdo, los electrones del segmento derecho, comenzando por ellos, también se moverán al lado derecho del segmento derecho:

Y en este caso, estas dos piezas de metal comenzarán a atraerse entre sí, ya que sus extremos proximales tienen la carga opuesta. Cabe señalar especialmente que en la segunda variante de la disposición de los segmentos, la fuerza de su atracción mutua será más débil, ya que solo se atraen sus extremos opuestos, mientras que en la primera variante de la disposición de los segmentos, tanto la izquierda como la derecha se atraen entre sí. los extremos
Pero, ¿cómo se relaciona esto con la unión de los átomos? Veamos el átomo de hidrógeno. Tiene un electrón moviéndose alrededor del núcleo. Y si el segundo átomo de hidrógeno está cerca, este electrón hará que el electrón vecino se mueva de la misma manera que se movió en nuestros segmentos metálicos, mientras que el electrón de uno de los átomos está en un lado del núcleo de su átomo, el vecino se verá obligado a estar en el lado opuesto de su átomo.
Aquí, por supuesto, la influencia no es unilateral, sino mutua: tanto el primer electrón afecta al segundo como el segundo afecta al primero. Pero lo más importante es que estos dos átomos serán atraídos de la misma manera que dos piezas de metal fueron atraídas en la segunda variante de su disposición mutua (con los extremos uno frente al otro).
La esencia es la misma: los electrones se mantienen alejados entre sí, lo que permite que cargas opuestas se atraigan entre sí. Imagine que el electrón de uno de los átomos estaba entre los núcleos de dos átomos vecinos, mientras que el electrón del átomo vecino estaba en el punto opuesto y remoto de la órbita:

Ahora tenemos un electrón cargado negativamente ubicado entre dos núcleos atómicos cargados positivamente. Los núcleos de ambos átomos son atraídos por este electrón. Por lo tanto, un electrón actualmente une dos átomos.
La distancia entre los núcleos de los átomos es mayor que la distancia desde cada uno de los núcleos hasta el electrón ubicado entre ellos. Y recordamos que la fuerza de interacción de las cargas es inversamente proporcional al cuadrado de la distancia entre ellas. Por lo tanto, en este momento, la fuerza de atracción de los núcleos al electrón es mayor que la repulsión mutua de los núcleos.
Pero los electrones se mueven constantemente y, por lo tanto, después de un tiempo, el primer electrón abandona el espacio entre los núcleos, pero el segundo electrón se mueve allí. En este momento, el papel del aglutinante pasa al electrón del segundo átomo (momento 3 en la figura a continuación).

Tenga en cuenta que en los puntos temporales que se muestran en las Figuras 2 y 4, no hay electrones entre los núcleos de los átomos. En estos momentos, los núcleos se repelen entre sí. Por esta razón, la distancia entre los átomos varía: cambia constantemente durante la rotación de los electrones alrededor de los núcleos, pero su longitud promedio, llamada longitud de enlace, se conserva. La longitud del enlace, la distancia entre los núcleos de los átomos, es individual para cada par de tipos de átomos combinados en una molécula.
Los electrones de estos dos átomos en la molécula de hidrógeno formada intentan estar lo más separados posible, tal como lo hicieron en los segmentos metálicos. Debido a esto, su sincronización ocurre: su ubicación relativa entre sí en cada revolución alrededor de los núcleos es aproximadamente la misma.
Esto es algo que recuerda el desempeño colectivo de un vals, cuando las parejas giran a la misma velocidad para que ni las damas ni los caballeros estén nunca uno al lado del otro, pero siempre se alternan:

Este artículo es un extracto del libro
"Química clara" .
Santa incertidumbre y santa probabilidadLa teoría cuántica afirma que es imposible determinar simultáneamente el lugar exacto de un electrón en el espacio y su momento (dirección y velocidad de su movimiento). Por lo tanto, se cree que alrededor del núcleo de un átomo hay ciertos lugares (áreas) en los que la probabilidad de detectar un electrón es alta. Estas áreas se llaman orbitales de electrones.
Esta teoría no es difícil de explicar en un ejemplo doméstico. Supongamos que vive en un apartamento en el que hay un dormitorio, una cocina y un baño. Si pasa el 90% del tiempo en el dormitorio, el 8% del tiempo en la cocina y el 2% del tiempo en el baño, entonces su orbital puede considerarse el dormitorio y la cocina, ya que la probabilidad de encontrarlo en el baño es muy baja. Después de 100 observaciones tuyas en diferentes momentos, es probable que el observador te encuentre en 90 casos en el dormitorio y en 8 casos en la cocina. Y según estas cifras llegará a una conclusión sobre el área de su hábitat.
Ahora sobre por qué es imposible determinar simultáneamente el lugar de un electrón en el espacio y su velocidad, y la dirección del movimiento. Es aún más fácil. El hecho es que la velocidad solo se puede medir en un cierto
segmento de la distancia recorrida. Dividiendo la longitud de este segmento por el tiempo por el que ha pasado, podemos encontrar la velocidad de movimiento. Pero no podemos considerar un segmento del espacio como la ubicación del cuerpo. La ubicación es la coordenada exacta del cuerpo.
Imagina una mosca volando en una habitación oscura. Al iluminar la habitación con un destello de luz muy corto, podemos ver el lugar donde se encuentra actualmente la mosca. Pero para comprender dónde y a qué velocidad vuela, tendremos que encender la luz durante más tiempo. Luego veremos un cambio en la posición de la mosca con el tiempo y podremos estimar la velocidad de este cambio. Pero en este caso, ya no podemos indicar el
lugar exacto donde estaba la mosca durante la medición de su velocidad, ya que durante este tiempo se movió una cierta distancia. Ese es el punto central del principio de incertidumbre.
Los electrones que se mueven alrededor de los núcleos atómicos cambian muy rápidamente la velocidad y la dirección del movimiento, por lo que es imposible decir exactamente dónde están en un momento dado y dónde se mueven.
Y en el modelo discutido anteriormente, los electrones se mueven como flechas en un reloj. Y esto no puede sino causar la ira justa de los adherentes de la Santa Incertidumbre y la Santa Probabilidad.
Sin embargo, el hecho de que no podamos decir exactamente dónde está ubicado este o aquel electrón, y a cuál de los átomos "pertenece" no cambia en absoluto el mecanismo electrostático del enlace atómico. De otro modo, es imposible unir dos protones que colocar un electrón entre ellos. Ninguna probabilidad o incertidumbre puede conectar átomos en una molécula. Y demuestra perfectamente el ion molecular de hidrógeno H2 +. En este ion no hay ni un doblete de electrones, ni compensación de los espines de electrones emparejados, ni superposición de nubes de electrones, sin embargo, este ion existe y es estable.
Además, no olvide que este es solo un modelo, y sus capacidades "explicativas" son limitadas, al igual que las capacidades de cualquier otro modelo. Por ejemplo, (parece) no explica por qué los átomos de hidrógeno no pueden unirse en cadenas largas como H3, H4, etc.
Sin embargo, se puede suponer que debido a que los orbitales electrónicos en las moléculas de hidrógeno están desplazados hacia el centro de la molécula, no "sobresalen" de sus extremos y, por lo tanto, las moléculas de hidrógeno vecinas no pueden adherirse entre sí mediante el mecanismo de sincronización electrónica.