El envejecimiento humano se define actualmente como una disminución fisiológica de las funciones biológicas en el cuerpo con una adaptación constante al daño interno y externo. El sistema endocrino juega un papel importante en la organización de las interacciones celulares, el metabolismo, el crecimiento y el envejecimiento. Varios estudios, desde gusanos hasta mishas, han demostrado que suprimir la actividad de la vía de la hormona del crecimiento / factor de crecimiento similar a la insulina-1 / insulina (GH / IGF-1 / insulina) puede ser útil para prolongar la vida de una persona, mientras que los resultados en humanos son contradictorios. En esta revisión, discutimos el papel potencial del sistema IGF-1 en la modulación de la longevidad, planteando la hipótesis de que la adaptación endocrina y metabólica observada en centenarios y mamíferos con restricción calórica puede ser una estrategia fisiológica para aumentar la esperanza de vida debido a un crecimiento celular más lento / metabolismo, mejor uso de las reservas fisiológicas, un cambio en el metabolismo celular de la proliferación celular a las acciones regenerativas y una disminución en la acumulación de células envejecidas.
Entrada.El envejecimiento se define como una disminución fisiológica de las funciones biológicas en el cuerpo con una disminución o pérdida progresiva de la adaptación al daño interno y externo. En los humanos, el fenotipo del envejecimiento es extremadamente heterogéneo y puede describirse como un mosaico complejo resultante de la interacción de varios eventos aleatorios y ambientales, cambios genéticos y epigenéticos acumulados a lo largo de la vida. A pesar de su enorme complejidad, la base molecular del envejecimiento está limitada por los pocos mecanismos biológicos altamente evolutivamente conservadores responsables de mantener y restaurar el cuerpo (1).
En las últimas 3 décadas, uno de los temas más discutidos en gerontología ha sido el papel de la hormona del crecimiento (GH) / factor de crecimiento similar a la insulina-1 (IGF-1) / sistema de insulina en la regulación de la longevidad. Los datos acumulados indican que esta vía juega un papel importante en la patogénesis de una serie de enfermedades relacionadas con la edad, que incluyen cáncer, demencia, enfermedades cardiovasculares y metabólicas (2 - 4).
En modelos animales, se ha demostrado que la inhibición del sistema GH / IGF-1 / insulina aumenta significativamente la vida útil. Sin embargo, en humanos los datos son contradictorios (5, 6).
Esta revisión describe los avances recientes en el estudio del sistema IGF-1 y la modulación de la longevidad, y plantea la hipótesis de que la adaptación endocrina y metabólica observada en centenarios y mamíferos durante la restricción calórica puede ser una estrategia fisiológica para aumentar la esperanza de vida debido a un retraso crecimiento / metabolismo celular, mejor control de la transmisión de señales y capacidades de reserva fisiológica, y reducción de la acumulación de células envejecidas.
Sistema IGF-1 y durabilidad en modelos animales.
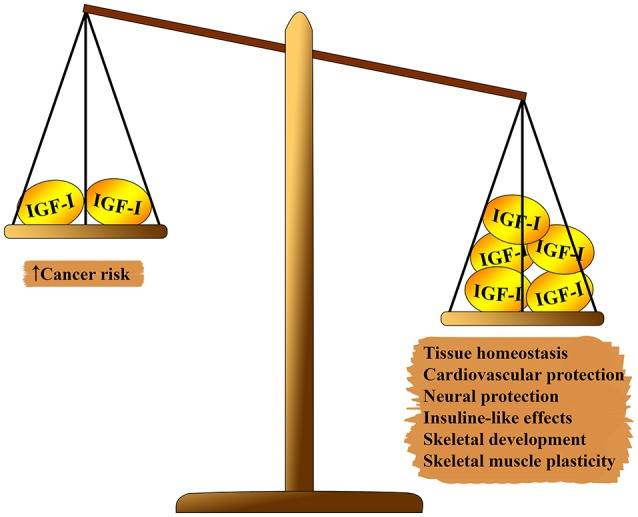 Fig. 1 Efecto pleiotrópico de IGF-1 en el cuerpo. En un lado de la escala, que supera: homeostasis tisular, efectos cardioprotectores y neuroprotectores, efectos similares a la insulina, participación en la formación del esqueleto y regeneración muscular. En el segundo lado del balance: el riesgo de carcinogénesis.
Fig. 1 Efecto pleiotrópico de IGF-1 en el cuerpo. En un lado de la escala, que supera: homeostasis tisular, efectos cardioprotectores y neuroprotectores, efectos similares a la insulina, participación en la formación del esqueleto y regeneración muscular. En el segundo lado del balance: el riesgo de carcinogénesis.El sistema IGF-1 tiene varios efectos pleiotrópicos sobre el envejecimiento biológico (ver figura 1). IGF-1 juega un papel importante en el desarrollo fetal, su crecimiento en la infancia y la adolescencia y la homeostasis del tejido adulto. Además, IGF-1, aparentemente, tiene un efecto ateroprotector, un efecto protector neuronal y similar a la insulina (en altas concentraciones), y regula el metabolismo óseo y la regeneración muscular. Sin embargo, IGF-1 es un factor de riesgo importante en el desarrollo de varios tipos de tumores debido a su fuerte actividad proliferativa, principalmente debido a la modulación del ciclo celular, la apoptosis y la supervivencia celular (7 - 9). La mayoría de estos efectos están mediados por la interacción con el sustrato receptor de insulina (IRS) -1 y-2 y la modulación de la vía objetivo de rapamicina de PI3K / AKT / mamífero (mTOR) (ver Fig. 2)
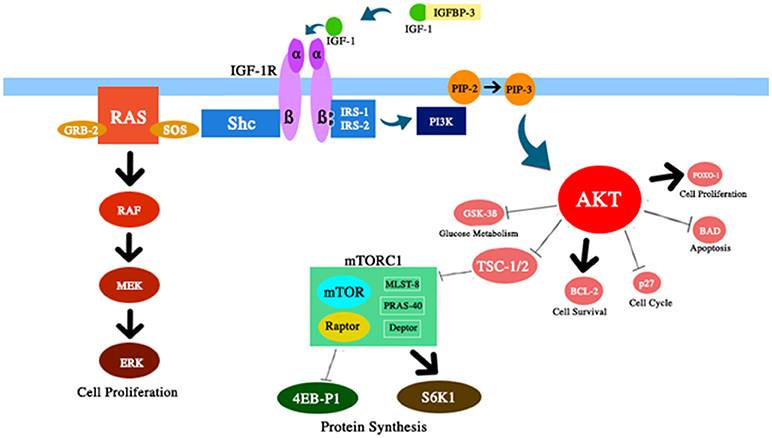 Figura 2 Representación esquemática de varios componentes de la ruta IGF-1 / PI3K / AKT / mTOR discutidos en esta revisión. IGF-1 mejora la actividad de AKT con los efectos correspondientes sobre la supervivencia y proliferación celular, el metabolismo de la glucosa y la síntesis de proteínas.
Figura 2 Representación esquemática de varios componentes de la ruta IGF-1 / PI3K / AKT / mTOR discutidos en esta revisión. IGF-1 mejora la actividad de AKT con los efectos correspondientes sobre la supervivencia y proliferación celular, el metabolismo de la glucosa y la síntesis de proteínas.
Varios estudios preclínicos han informado que las mutaciones en los genes que controlan la vía de señalización de GH / IGF-1 / insulina pueden aumentar significativamente la esperanza de vida en modelos animales tanto de invertebrados como de vertebrados (5, 6).
Modelos de invertebrados.En los invertebrados, la cascada similar a la insulina / IGF está regulada por varios péptidos capaces de interactuar con un receptor común de insulina / IGF-1.
En el nematodo Caenorhabditis elegans, la vía similar a la insulina / IGF consiste en varias proteínas codificadas por los genes daf-2, age-1 (que codifican la subunidad catalítica PI3K), akt-1, akt-2, pdk-1, sgk-1 (serina-treonina quinasas ), daf-16, skn-1 y daf-18 (PTEN, fosfatasa implicada en la inhibición de la vía de señalización de AKT). Se ha demostrado que la actividad reducida de los genes daf-2, age-1, akt-1, akt-2, pdk-1, sgk-1 suprime esta vía, y se ha informado que los animales con estas mutaciones envejecen más lentamente y tienen una vida útil prolongada Hasta 300%. Por el contrario, la estimulación de la vía similar a la insulina / IGF disminuye la vida útil de los nematodos (10, 11).
En la mosca de la fruta Drosophila melanogaster, la señalización similar a la insulina / IGF consiste en dINR (proteína similar al receptor de insulina / IGF-1), sustrato del receptor de insulina CHICO, PI3K Dp110 / p60 y objetivo PK3 PI3K. Se informó que las moscas con una mutación en estos genes aumentaron significativamente la esperanza de vida (12, 13).
Sorprendentemente, los mismos mecanismos moleculares en diferentes tejidos no afectan el envejecimiento de la misma manera. Varios estudios de nematodos y moscas de la fruta han demostrado que una disminución en la señalización similar a la insulina / IGF en los tejidos nerviosos y adiposos desempeña un papel importante en la regulación de la longevidad (14, 15). Aunque se ha demostrado en modelos de invertebrados que esta cascada es importante para modular la vida útil, los efectos de la señalización similar a la insulina / IGF en la vida útil son mucho más complejos en los vertebrados porque tienen moléculas de insulina e IGF funcionalmente específicas, proteínas de unión a IGF (IGFBPs) ), IGFBP, GH proteasas, múltiples receptores y varios mecanismos de transmisión de señal intracelular con diferente expresión específica de tejido (16).
Modelos de vertebradosVarios ratones mutantes GH / IGF-1 fueron diseñados con diferentes objetivos. Los modelos más actuales se describen a continuación.
Ratones Snell y Ames.Los ratones Snell y Ames son dos cepas de ratones con mutaciones en los genes PIT-1 y PROP-1, respectivamente (17, 18). Dado que las proteínas PIT-1 y PROP-1 son necesarias para la diferenciación de las células pituitarias que producen GH, prolactina y hormona estimulante de la tiroides, ambos tipos de ratones mutantes homocigotos carecen de las tres hormonas (18). Estos modelos mostraron un aumento significativo en la esperanza de vida (42-70% más que en ratones de tipo salvaje), mayor sensibilidad a la insulina y una menor frecuencia de tumores (19, 20). Cuando los ratones Ames tenían restricciones de calorías, su vida útil aumentó aún más (21). Aunque estos animales carecen de tres hormonas, se ha demostrado que aumentar la longevidad depende principalmente de la deficiencia de GH (22).
Ratón encendido / encendidoLos ratones encendidos / encendidos tienen deficiencia de GH y una mutación en el gen que codifica el receptor de la hormona liberadora de GH (GHRHR). Estos animales eran enanos, tenían tejido adiposo aumentado, tasas de tumor más bajas y la esperanza de vida aumentó en un 23-25% (19).
Ratón GH-Release Hormone-Knockout (GHRH-KO).Los ratones noqueados La hormona liberadora de GH (GHRH-KO) vive 43% (en hembras) y 51% (en machos) más tiempo que los animales de tipo salvaje y tienen muchas características fenotípicas de los ratones Ames, como una mayor sensibilidad a insulina, una disminución en los niveles de triglicéridos y colesterol en plasma, un aumento en el tejido adiposo, niveles elevados de leptina y adiponectina en plasma (23).
Ratones knockout de receptor de GH (GHR-KO)Los ratones inactivados con receptor de GH (GHR-KO) tienen niveles elevados de GH en suero y niveles muy bajos de IGF-1. También se informó que esta cepa de ratones vivió un 38-55% más que el tipo salvaje (24) y mostró una reducción en el estrés oxidativo, así como una aparición más baja y tardía de tumores fatales (25). Se observaron resultados similares en ratones df / KO, cruzaron dos cadenas de enanos misha, GHR-KO y Ames, que carecían de receptores de GH y GH y continuaron aumentando la esperanza de vida (26). A diferencia de los hermanos Ames salvajes y los ratones enanos, la restricción calórica no aumentó la vida útil de los ratones GHR-KO, lo que sugiere que el eje GH / IGF-1 y la restricción calórica pueden tener mecanismos similares o parcialmente superpuestos para extender la vida útil (27) .
Antagonismo del receptor de GH (GHA)No todos los modelos animales con supresión del sistema GH / IGF-1 muestran un aumento en la esperanza de vida. La cepa de ratones GHA es uno de esos ejemplos. La GHA, generada al reemplazar un aminoácido, puede unir el receptor de GH con la misma afinidad que la GH, pero no causa señalización intracelular. La esperanza de vida de los ratones GHA no aumentó significativamente (28).
IGF-1R +/– RatonesMientras que la mayoría de los ratones con un receptor de IGF-1 inactivo (IGF-1R - / -) mueren al nacer, los animales heterocigotos para el alelo mutante del receptor de IGF-1 (IGF-1R ±) mostraron niveles muy bajos de IGF-1 en suero , aproximadamente 10% más pequeño y 33% más de esperanza de vida en mujeres y 16% en hombres. Sin embargo, en este estudio, los controles de tipo salvaje sobrevivieron a 19 meses, lo que puso en peligro la interpretación de los resultados (29). Estudios más recientes que evalúan la esperanza de vida en otra línea IGF-1R ± mostraron un ligero aumento en la esperanza de vida en un 5–10%, pero solo en mujeres (30, 31). Además, la tensión de fondo principal parece afectar el grado de extensión de la vida en varios modelos de ratones (32).
Un IGF1-R +/− específico del cerebroUn ratón mutante IGF1-R +/− específico del cerebro vivió un 9% más que el tipo salvaje, lo que enfatiza el papel correspondiente del sistema nervioso en la modulación de la longevidad (33).
Ratones alterados con IGF-1 específicos de hígado (LI-IGF-1 - / -).Los ratones con producción de IGF-1 deteriorada (LI-IGF-1 - / -) tienen niveles séricos muy bajos de IGF-1 y niveles séricos elevados de GH debido a la inactivación del gen IGF-1. Los ratones LI-IGF-1 - / - habían reducido notablemente la obesidad y, como resultado, el peso era un 25% más bajo que en los ratones de tipo salvaje. Solo las hembras LI-IGF-1 - / - ratones mostraron un aumento en la esperanza de vida del 16% en comparación con los ratones control (34).
Pappa - / - ratones.Los ratones Pappa - / - tienen un gen inactivo del gen para la proteína plasmática A, PAPP-A, PAPPA asociada al embarazo, una proteasa específica para proteínas de unión a IGF. La vida media de esta cepa de ratón fue un 38% más larga en comparación con los controles de tipo salvaje. Los ratones Pappa - / - eran enanos, pero sus niveles séricos de glucosa, insulina, IGF-1 y GH no diferían de los de los controles de tipo salvaje, lo que sugiere que PAPPA actúa principalmente a nivel autocrino o paracrino. Además de aumentar la esperanza de vida, los ratones Pappa - / - mostraron una menor incidencia de tumores, así como lesiones degenerativas relacionadas con la edad (35, 36).
IRS interrumpido (IRS1 - / -) mouse.IRS-1 y -2 son mediadores importantes para la insulina, así como para la señalización de IGF-1. Los ratones IRS1 - / - eran resistentes a la insulina, con un defecto en la transmisión de señales de insulina principalmente en el tejido muscular, aproximadamente un 30% más corto que el tipo salvaje, y solo las hembras tenían una esperanza de vida un 18% más larga en comparación con los animales de tipo salvaje (37 ) )
Los ratones IRS2 - / - también eran resistentes a la insulina, pero a diferencia de los ratones IRS1 - / -, mostraron defectos de señalización de insulina en más tejidos, incluidos el hígado, el tejido adiposo y el músculo esquelético. Estos ratones desarrollaron diabetes, y su vida útil fue mucho más corta que la de los ratones de tipo salvaje y los ratones IRS2 ±. Los ratones IRS2 +/− mejoraron la sensibilidad a la insulina y aumentaron la esperanza de vida (+ 18%) en comparación con los ratones de tipo salvaje. Además, se informó que los ratones específicos de cerebro IRS2 ± e IRS2 - / - eran resistentes a la insulina y vivían 18 y 14% más que los controles de tipo salvaje, respectivamente (38).
Ratones modificados KLOTHO.La proteína KLOTHO inhibe la señalización de insulina e IGF-1, posiblemente interrumpiendo la interacción receptor / ligando. Se informó que los ratones con sobreexpresión de KLOTHO tenían un tamaño normal, y la resistencia a la insulina se desarrolló en los machos, y la esperanza de vida en los machos y las hembras aumentó significativamente (+18 y + 30%, respectivamente) (39, 40).
Ratón interrumpido P66shc (P66shc - / -).P66shc es una proteína que media la señalización de IGF-1 después del receptor activando la ruta MAPK. Los ratones P66shc - / - tenían un fenotipo normal, pero vivían un 28% más que los controles de tipo salvaje (41). Sin embargo, estos datos no fueron confirmados en un estudio reciente (42).
El papel de la señalización de GH / IGF-1 / insulina en el envejecimiento y la longevidad ha sido profundamente estudiado en todos estos modelos animales. Mientras que los invertebrados, el efecto de la supresión de la vía de IGF-1 / insulina en la esperanza de vida fue obvio y significativo, en modelos de ratones este efecto se debilitó y no fue reproducible en algunos casos, como en las líneas IGF-1R ± y P66shc - / - ratones Sin embargo, la mayoría de estos modelos han mostrado algunas características comunes entre los ratones de larga vida, como niveles reducidos de IGF-1 circulante e insulina y una mayor sensibilidad a la insulina, que probablemente reduzcan la incidencia de cáncer, mejoren la resistencia al estrés y prolongen la vida. . Los cambios genéticos que pueden alterar el sistema IGF-1 pueden mantener a los animales sanos por períodos más largos y pueden retrasar o aliviar algunas enfermedades relacionadas con la edad. En este proceso, los tejidos nerviosos y grasos juegan un papel importante.
Además, se necesitan datos adicionales para determinar el mejor momento en el tiempo durante la vida útil para intervenir en la supresión del sistema IGF-1 para obtener un efecto positivo en la vida útil. En ratones igf f / f C57B l / 6, una deficiencia de IGF-1 circulante, a partir de los 5 meses de edad o antes, aumentó la esperanza de vida en un 15% solo en las mujeres con una disminución en el número de órganos con patología al final de la vida en comparación con el grupo de control . Además, la deficiencia tardía de IGF-1 (15 meses) redujo el riesgo de cáncer, pero no tuvo un efecto positivo en la esperanza de vida (43). Estos datos subrayan la importancia de la deficiencia de IGF-1 a una edad temprana para aumentar la esperanza de vida. Por otro lado, Mao et al. (44) informaron recientemente que la administración tardía de ratones CB6F1 de 18 meses con un anticuerpo monoclonal dirigido contra el receptor IGF-1 extendió la esperanza de vida femenina en un 9% y mejoró algunos aspectos de la salud.
Sistema IGF-1 en personas de larga vida.
Los centenarios centenarios se consideran el mejor modelo humano para estudiar los determinantes biológicos de la longevidad, que han alcanzado los valores más extremos de la esperanza de vida humana (45).
Varios estudios compararon los niveles de insulina circulante e IGF-1 en hígados largos con los de controles más jóvenes (46).
La remodelación metabólica relacionada con la edad es un proceso fisiológico que ocurre en toda la población. El envejecimiento a menudo se asocia con una disminución en la tolerancia a la glucosa, que se asocia con una mayor resistencia a la insulina (47), pero las personas de larga vida tienen una excepción. Se encontró (48) que la resistencia a la insulina aumenta con la edad y disminuye en personas mayores de 90 años que viven en el sur de Italia. De hecho, los sujetos de larga vida mostraron una mayor sensibilidad a la insulina y una mejor función de las células beta que los sujetos más jóvenes. Esta diferencia tampoco dependía de los principales factores antropométricos y metabólicos. En pacientes de 100 años, la concentración de glucosa en plasma durante 2 horas fue menor que en los ancianos (edad promedio 78 años).
En los hígados largos, el consumo de glucosa mediada por insulina fue mayor que en los controles de edad avanzada durante la captación de glucosa euglucémica, lo que mantuvo la tolerancia a la glucosa preservada y la acción de la insulina en este grupo de larga vida (49, 50). Se observaron resultados similares que confirman la mejor sensibilidad a la insulina en otras poblaciones de hígados largos (51, 52).Además, los hígados largos mostraron el efecto conservado de la insulina no solo en el metabolismo de la glucosa, sino también en el tejido adiposo. De hecho, la infusión de insulina generalmente se asocia con la inhibición de la lipólisis y, por lo tanto, con una disminución significativa en la concentración de ácidos grasos libres y triglicéridos en plasma. En los hígados largos, la actividad inhibitoria de la insulina durante la lipólisis fue mayor que en los participantes de control (edad media 78 años) (50). Cabe señalar que los centenarios también tienen un tono simpático más bajo en comparación con los controles de adultos, lo que puede estar asociado con una mejor acción de la insulina y, por lo tanto, con un bajo nivel de insulina en plasma en ayunas (53, 54).Los datos sobre el sistema IGF-1 con respecto a la esperanza de vida siguen siendo contradictorios en sujetos de larga vida (46). Paolisso y col. (55) describieron un aumento de la proporción de IGF-1 / IGFBP-3 en plasma en hígados largos sanos en comparación con las personas mayores. Sugirieron que esta proporción aumentada indica una mayor biodisponibilidad de IGF-1, lo que contribuye a una mejora en la acción de la insulina en los hígados largos. Bonafè y col. (56) informaron que los sujetos con al menos el alelo A del gen del receptor IGF-1 (G / A, codón 1013) tenían bajos niveles plasmáticos de IGF-1 libre y eran más prevalentes entre las personas de larga vida. Arai y col. (57) describieron niveles relativamente bajos de suero IGF-1 en la población japonesa de hígados largos. En esta población, las tasas más bajas de IGF-1 e IGFBP-3 se asociaron con una mayor mortalidad (58).Estos resultados contradictorios probablemente reflejan la complejidad del sistema IGF y las diferencias étnicas en la población registrada. Además, los centenarios a menudo se compararon con un grupo control de sujetos más jóvenes. Por lo tanto, en la mayoría de estos estudios, fue imposible concluir si las diferencias entre IGF-1 en ambos grupos estaban asociadas con diferentes expectativas de vida o reflejaban una disminución fisiológicamente dependiente de la edad en IGF-1. De hecho, existen varias limitaciones para el estudio de los hígados largos: (1) baja prevalencia (1 centenario por 5-10,000 habitantes), (2) debilidad debido a la edad extrema (casi el 95% de los hígados largos tienen al menos 1 criterio de astenia), (3 ) la ausencia de un grupo de control de la misma edad (45, 59). Debido a estas limitaciones, este modelo humano no es adecuado para estudiar variables relacionadas con la edad,que puede estar involucrado en la modulación de la esperanza de vida.Los descendientes de los centenarios son otro modelo interesante para determinar los factores relevantes asociados con la longevidad humana y el envejecimiento saludable. Un conjunto consistente de observaciones en diferentes países sugiere que los descendientes de los hígados largos son más saludables que los representantes de los mismos grupos demográficos (51, 60, 61) y biológicamente (epigenéticamente) más jóvenes que su edad cronológica (62). En general, estos estudios muestran que los familiares de centenarios tienen más probabilidades de vivir más tiempo y tener buena salud (60, 63). Además, el estudio de la descendencia de hígados largos tiene la ventaja de tener un grupo de control apropiado seleccionado demográficamente que consiste en una progenie de edad comparable, en la que ambos padres nacieron en la misma cohorte de centenarios, pero murieron antes de la edad límite.después de lo cual las personas se clasifican como "centenarios". Esta estrategia es crítica para prevenir los efectos de cohorte. Por lo tanto, el modelo de descendencia de hígados largos puede superar algunas de las limitaciones que se encuentran en el estudio de los hígados largos (rareza, debilidad y falta de control adecuado) (60).En varios estudios, el sistema IGF-1 / insulina se caracterizó en descendientes de hígados largos y en el grupo de control correspondiente.Evaluamos la bioactividad circulante de IGF-1, medida utilizando un innovador ensayo de activación del receptor de quinasa (KIRA) realizado en hígados largos, descendientes de hígados largos y descendientes de control comparables. La descendencia de hígados largos e hígados largos tuvo una actividad biológica circulante relativamente menor de IGF-1 en comparación con el grupo de control. Curiosamente, la actividad biológica de IGF-1 en descendientes de hígados largos estaba inversamente relacionada con la sensibilidad a la insulina (51).Suh y col. (64) evaluaron los niveles séricos de IGF-1 en descendientes de centenarios judíos asquenazíes y en controles comparables por edad. En mujeres de larga vida, el suero IGF-1 fue 35% más alto que en los participantes de control. Esta diferencia puede representar una respuesta compensatoria a una disminución en la señalización del receptor IGF-1. Además, la presencia judía de centenarios asquenazíes describió la presencia excesiva de mutaciones heterocigotas en el gen del receptor de IGF-1 junto con niveles relativamente altos de IGF-1 en suero y una disminución de la actividad del receptor de IGF-1 en comparación con el grupo control sin longevidad familiar.Para estudiar la longevidad, otros autores examinaron a hermanos y hermanas de noventa años y sus descendientes. En el estudio de Leyden sobre la longevidad, se seleccionaron 421 familias, que consistían en al menos dos reporteros, hermanos y hermanas, sus descendientes y parejas de descendientes como control. En estas poblaciones, la glucosa sérica, la insulina y los triglicéridos fueron el mejor biomarcador para un envejecimiento saludable (los niveles bajos de glucosa e insulina se consideraron saludables) (65). Los centenarios de nueve años en la proporción más baja de IGF-1 / IGFBP-3 en el torrente sanguíneo se asociaron con una mejor supervivencia (66). Los descendientes de niños de nueve años mostraron una mejor sensibilidad a la insulina en comparación con sus parejas, mientras que se observaron niveles similares de suero IGF-1 e IGFBP-3 en ayunas en ambos grupos de ayuno (67). Interesanteque la secreción total de GH en 24 horas fue 28% menor en la descendencia en comparación con el control (68).Otro enfoque adoptado para estudiar la longevidad en humanos es seleccionar componentes familiares para una longevidad excepcional y un envejecimiento saludable basados en criterios estrictos, como el Estudio familiar de larga vida, una medida de la vida familiar. Estas familias, seleccionadas por su excepcional esperanza de vida, se compararon con un grupo de control sin antecedentes familiares de longevidad (69). En esta población, los niveles circulantes de IGF-1 demostraron ser un biomarcador confiable relacionado con la edad (70).En apoyo del papel potencial del sistema GH / IGF-1 / insulina en la longevidad humana, existen muchos estudios genéticos. De hecho, se ha encontrado que varios loci genéticos están asociados con niveles circulantes de IGF-1 e IGFBP-3 y son potencialmente capaces de afectar el envejecimiento (71). Un análisis de todo el genoma de las asociaciones realizadas en personas de noventa años y poblaciones de pacientes de <60 años mostró un vínculo claro entre la variación genética de los genes involucrados en la vía de insulina / IGF-1 y la esperanza de vida humana (72). En un estudio prospectivo de personas mayores, las mujeres con un perfil genético, que indica una disminución en la actividad de señalización de insulina / IGF-1, mostraron vidas más largas (73).En cuatro cohortes independientes de individuos de larga vida, recientemente se ha descrito un aumento lineal en la prevalencia de la homocigosidad del receptor de GH exógeno 3 (G3R) con la edad. La presencia del genotipo d3 / d3 aumentó la esperanza de vida en aproximadamente 10 años (74).IGF-1
Una de las observaciones más convincentes en la biología del envejecimiento es la capacidad de limitar las calorías para prevenir o retrasar algunas enfermedades relacionadas con la edad y aumentar la esperanza de vida de los mamíferos (75-78). Los mecanismos biológicos de este fenómeno no están del todo claros, pero se sugirió la posible implicación de los cambios correspondientes en el metabolismo energético, el sistema endocrino y el daño oxidativo.
La restricción calórica causa numerosos cambios hormonales. En roedores, la restricción calórica sin inanición suprimió los niveles circulantes de IGF-1 e insulina en proporción al nivel de restricción, aumentó la sensibilidad a la insulina y la resistencia al estrés y la toxicidad, y redujo el riesgo de cáncer (79, 80). Curiosamente, la mayoría de estas características observadas en ratones de tipo salvaje durante la restricción calórica se asemejan a las reportadas en ratones de larga vida debido al deterioro genético de la señalización de GH / IGF-1 / insulina, como se describió anteriormente.
Los ensayos clínicos aleatorizados en humanos han demostrado que la restricción calórica no reduce el IGF-1 en suero a menos que se reduzca la ingesta de proteínas (81, 82). Sin embargo, un metaanálisis reciente que evalúa el efecto de la restricción nutricional en los biomarcadores reconocidos del envejecimiento saludable ha mostrado una disminución en los niveles de IGF-1 humano en la sangre (83).
Se observaron otros cambios hormonales, como una disminución en los niveles de insulina, las hormonas tiroideas y los niveles de leptina, así como un aumento en la adiponectina y la sensibilidad a la insulina, durante la restricción de la dieta (85, 86).
Esta adaptación hormonal puede desempeñar un papel importante en la prolongación de la vida a través de varios mecanismos:
1) Disminución de la tasa metabólica, la proliferación celular y el estrés oxidativo. De hecho, IGF-1 es un factor de crecimiento potente, y la hormona tiroidea es un estimulante potente de la tasa metabólica básica y el metabolismo oxidativo. Además, los patrones de transcripción sugieren que la restricción crónica moderada de calorías en adultos ralentiza el proceso de envejecimiento, cambiando el metabolismo celular del crecimiento al mantenimiento y la recuperación (84).
2) Reducción de la acumulación de células envejecidas. Se ha demostrado que el envejecimiento celular es un mediador clave del envejecimiento (87). Con el tiempo, la homeostasis de las proteínas disminuye y el daño se acumula. Curiosamente, algunas enfermedades relacionadas con la edad pueden retrasarse al debilitar la acumulación de células envejecidas (88, 89). Típicamente, la vía mTOR se activa mediante varias señales, incluidos nutrientes, IGF-1 e insulina (Fig. 2). La desregulación de esta vía, que se informó después de la restricción calórica, aumentó la vida útil de algunos organismos. Este efecto, aparentemente, es secundario a un aumento de la autofagia, un proceso de digestión citoprotectora. De hecho, la autofagia es un proceso de procesamiento celular que puede eliminar componentes celulares viejos o dañados, evitando la acumulación de células envejecidas (90, 91).
3) Contrarrestar la inflamación. La intervención dietética tanto en animales como en humanos puede retrasar el proceso de envejecimiento, debilitando el estado inflamatorio en un grado débil (83, 92). Los mecanismos subyacentes a la actividad antiinflamatoria de la restricción nutricional no están claramente definidos. Se cree que este efecto se debe a una disminución de la masa grasa y a las adipocinas proinflamatorias, así como a una mejora en la integridad de la barrera intestinal observada durante la intervención dietética (93, 94).
Es interesante observar que el perfil bioquímico endocrino observado en sujetos durante la restricción calórica es comparable al de los centenarios, lo que confirma el papel potencial del sistema endocrino en la modulación de la esperanza de vida. Además de aumentar la sensibilidad a la insulina y disminuir los niveles plasmáticos / séricos de IGF-1, varios estudios han demostrado niveles elevados de adiponectina circulante y niveles disminuidos de leptina circulante y hormonas tiroideas en personas de larga vida en comparación con sujetos más jóvenes.
El tejido adiposo es un órgano endocrino que produce varias citocinas involucradas en procesos relevantes, como el metabolismo energético, la homeostasis de los lípidos y la glucosa, y la modulación de la respuesta inflamatoria. El tejido adiposo visceral juega un papel importante en el desarrollo de enfermedades metabólicas (95). El envejecimiento se asocia con un aumento de la masa grasa y la redistribución del tejido adiposo, que se caracteriza por una pérdida de grasa subcutánea periférica y una acumulación de grasa visceral. En las personas mayores, se han descrito cambios en la secreción, síntesis y función de las adipocinas, probablemente debido a un desequilibrio en la función, la proliferación, el tamaño y el número de células grasas (86). La adiponectina es una citocina sensibilizante a la insulina, antiinflamatoria y antiaterogénica. La adiponectina circula en la sangre en varias formas: trímero, hexámero, multímero de alto peso molecular (HMW) y adiponectina globular (forma escindida proteolíticamente). Se cree que el multímero HMW es una forma más activa de adiponectina para la protección contra la resistencia a la insulina y la diabetes (96). La adiponectina circulante se asocia de forma independiente y negativa con aspectos del síndrome metabólico, incluida la resistencia a la insulina, el peso corporal, la presión arterial y los lípidos séricos. La leptina se produce principalmente en el tejido adiposo blanco visceral, subcutáneo y en menor medida. Esta citocina regula la ingesta de alimentos, el gasto energético y la aterogénesis. La leptina promueve la pérdida de peso al reducir el apetito y estimular el metabolismo y tiene propiedades proinflamatorias (97).
Varios estudios han informado que los hígados largos tienen niveles de adiponectina en plasma más altos y concentraciones de leptina más bajas que los controles más jóvenes (53, 98 - 102). Todas las formas de adiponectina aumentaron significativamente en los hígados largos, pero el multímero HMW fue significativamente mayor (99). En los hígados largos, las altas concentraciones de adiponectina resultaron ser independientes del IMC, la función renal o cardiovascular y se asociaron con un fenotipo metabólico favorable (niveles más altos de HDL-C, hemoglobina glucosilada más baja, insulina, HOMA-IR y triglicéridos) (98, 99). También se han encontrado niveles elevados de adiponectina en la descendencia de sujetos de larga vida (mayores de 95 años) (103).
Una disminución en el nivel de hormonas tiroideas es aparentemente característica de los hígados largos. Mariotti y col. (104) informaron que los centenarios sanos tenían niveles de TSH y FT3 en suero más bajos y niveles de rT3 en suero más altos en comparación con los observados en otros grupos de control. En otra población italiana de hígados largos, los valores totales de T4 estaban por debajo del rango normal en el 60% de los examinados (105). Baranovskaya y col. informaron que los niveles séricos de T3 en los centenarios fueron más bajos que los de las mujeres de edad avanzada y jóvenes (52). Recientemente caracterizamos el perfil de la función tiroidea en una cohorte italiana de 672 pacientes (de 52 a 113 años). Se observó una disminución relacionada con la edad en el nivel de FT3 y las relaciones FT3 / FT4, mientras que FT4 y TSH aumentan con la edad (106). En las familias de centenarios chinos, una disminución en la función tiroidea (alta TSH y baja concentración de FT3) parece estar relacionada con la edad, y este fenotipo es hereditario (107).
Corsonello y col. (108) encontraron que los parientes concomitantes (descendientes o sobrinas / sobrinos) tenían enfermedades concomitantes, FT3, FT4 y TSH más bajas que los controles de la misma edad que no eran parientes de hígados largos. En otra población italiana, se observó un nivel más bajo de FT4 en plasma en descendientes de hígados largos en comparación con un grupo de control de la misma edad (60).
En general, los hígados largos son delgados (109) y se adhieren a hábitos alimenticios saludables (110). Similar a los sujetos durante la restricción calórica, los hígados largos observaron un crecimiento / metabolismo celular más lento, un mejor control de la transmisión de la señal y un aumento de la autofagia. Mediante el análisis de la metilación del ADN en todo el genoma en centenarios y sus descendientes, hemos identificado genes y vías modulados epigenéticamente que están potencialmente involucrados en el envejecimiento y la longevidad. Nuestros resultados indican que estas poblaciones se caracterizaron por una mejor conservación del estado de metilación del ADN, un crecimiento / metabolismo celular más lento y un mejor control de la transmisión de señales a través de mecanismos epigenéticos (111). Los hígados largos conservaron su función bioenergética debido a la hipertrofia mitocondrial, que puede compensar los defectos funcionales (112). Además, los hígados largos sanos tienen altos niveles de autofagia, como lo demuestran los niveles séricos más altos de beclin-1 en comparación con pacientes jóvenes con infarto de miocardio y controles sanos (113). También se observó un aumento en la actividad autofágica en sujetos pertenecientes a familias con una longevidad excepcional (114).
El fenómeno correspondiente surge en relación con el estado inflamatorio, que se debilita en los sujetos después de la restricción calórica (115, 116) y es alto en los hígados largos (117 - 119). Con el envejecimiento, existe un estado de patología inflamatoria leve y crónica (inflamación relacionada con la edad) y una mayor prevalencia de una serie de enfermedades, como enfermedades cardiovasculares, aterosclerosis, tumores, deterioro cognitivo, osteoartritis y diabetes (120, 121). Por lo tanto, el debilitamiento del estado inflamatorio crónico después de la restricción calórica es un efecto beneficioso. Los centenarios centenarios muestran signos de inflamación, pero al mismo tiempo, al parecer, evitó sus efectos nocivos. Esta paradoja obvia puede explicarse por el hecho de que los hígados largos tienen un equilibrio complejo y peculiar entre los factores proinflamatorios y antiinflamatorios, lo que conduce a un desarrollo de inflamación más lento, más limitado y equilibrado en comparación con las personas mayores que se caracterizan por una respuesta ineficaz para contrarrestar la inflamación crónica (120). 121).
Estos datos sugieren los mecanismos generales para aumentar la longevidad y retrasar las enfermedades relacionadas con la edad que se encuentran en los hígados largos y los mamíferos durante una dieta restringida en calorías.
Opinión de los autores.Los modelos preclínicos han proporcionado una visión más profunda del proceso de envejecimiento utilizando datos consistentes que tienen en cuenta el papel del sistema GH / IGF-1 / insulina en la modulación de la esperanza de vida. Aunque es bien sabido que el aumento de la sensibilidad a la insulina y los bajos niveles de insulina están asociados con una mejor supervivencia, hay algunas pruebas que demuestran que un debilitamiento del eje GH / IGF-1 puede tener un efecto beneficioso para aumentar la esperanza de vida en humanos. Sin embargo, aún se desconoce cuáles son los niveles óptimos de IGF-1 a lo largo de la vida para vivir más tiempo y ser más saludables. Además, la sensibilidad del receptor IGF-1 y la activación de la vía post-receptor no se han evaluado en la mayoría de los estudios con sujetos de larga vida. Por lo tanto, no es posible determinar el estado real de la activación de la señalización del receptor de IGF-1 con una dosis simple de niveles circulantes de IGF-1. Esto dificulta la identificación de estrategias farmacológicas o ambientales que se dirigen a este sistema para aumentar la longevidad y promover un envejecimiento saludable. Una comprensión integral de estos aspectos sigue siendo el principal problema para identificar intervenciones destinadas a frenar el envejecimiento humano y para su uso en medicina de rehabilitación. Los estudios futuros deberían evaluar el estado funcional de la señalización del receptor de IGF-1, incluso a través de perfiles transcripcionales y análisis de redes funcionales con respecto a genes regulados por IGF-1 en sujetos de larga vida.
ConclusionesSe han descrito sorprendentes similitudes con respecto al perfil endocrino entre los hígados largos y los sujetos después de una dieta restringida en calorías. La adaptación endocrina y metabólica observada en ambos modelos puede ser una estrategia fisiológica para aumentar la esperanza de vida debido a un crecimiento / metabolismo celular más lento, una pérdida más lenta de la reserva fisiológica natural, la transición del metabolismo celular de la proliferación celular a la actividad regenerativa, y reducir la acumulación de células envejecidas. Aparentemente, estos mecanismos, al menos parcialmente, están mediados por la modulación del sistema GH / IGF-1 / insulina.
Referencias- Franceschi C, Valensin S, Bonafè M, Paolisso G, Yashin AI, Monti D, et al .. La red y las teorías de la remodelación del envejecimiento: antecedentes históricos y nuevas perspectivas. Exp Gerontol. (2000) 35: 879-96. 10.1016 / S0531-5565 (00) 00172-8.
- Bartke A, Darcy J. GH y el envejecimiento: trampas y nuevas ideas. Best Pract Res Clin Endocrinol Metab. (2017) 31: 113–25. 10.1016 / j.beem.2017.02.005
- Vitale G, Salvioli S, Franceschi C. Estrés oxidativo y envejecimiento del sistema endocrino. Nat Rev Endocrinol. (2013) 9: 228–40. 10.1038 / nrendo.2013.29
- Vitale G, Cesari M, Mari D. Envejecimiento del sistema endocrino y su impacto potencial en la sarcopenia. Eur J Intern Med. (2016) 35: 10-15. 10.1016 / j.ejim.2016.07.017
- Reddy SSK, Chaiban JT. La endocrinología del envejecimiento: una clave para la longevidad "Grandes expectativas". Endocr Pract. (2017) 23: 1107–16. 10.4158 / EP171793.RA
- Junnila RK, List EO, Berryman DE, Murrey JW, Kopchick JJ. El eje GH / IGF-1 en envejecimiento y longevidad. Nat Rev Endocrinol. (2013) 9: 366–76. 10.1038 / nrendo.2013.67
- Yakar S, Adamo ML. Fisiología del factor de crecimiento 1 similar a la insulina: lecciones de modelos de ratones. Endocrinol Metab Clin North Am. (2012) 41: 231–47. 10.1016 / j.ecl.2012.04.008 [artículo gratuito de PMC] [PubMed] [CrossRef] [Google Scholar]
- Higashi Y, Sukhanov S, Anwar A, Shai SY, Delafontaine P. IGF-1, estrés oxidativo y ateroprotección. Tendencias Endocrinol Metab. (2010) 21: 245-54. 10.1016 / j.tem.2009.12.005 [artículo gratuito de PMC] [PubMed] [CrossRef] [Google Scholar]
- Belfiore A, Malaguarnera R, Vella V, Lawrence MC, Sciacca L, Frasca F, et al .. Isoformas de receptores de insulina en fisiología y enfermedad: una vista actualizada. Endocr rev. (2017) 38: 379-431. 10.1210 / er.2017-00073 [Artículo gratuito de PMC] [PubMed] [CrossRef] [Google Scholar]
- Kenyon C, Chang J, Gensch E, Rudner A, Tabtiang RAC ... elegans mutante que vive el doble de tiempo que el tipo salvaje. Nature (1993) 366: 461-4. 10.1038 / 366461a0 [PubMed] [CrossRef] [Google Scholar]
- Kimura KD, Tissenbaum HA, Liu Y, Ruvkun G. Daf-2, un gen similar al receptor de insulina que regula la longevidad y la diapausa en Caenorhabditis elegans. Science (1997) 277: 942-6. 10.1126 / science.277.5328.942 [PubMed] [CrossRef] [Google Scholar]
- Tártaro M, Kopelman A, Epstein D, Tu MP, Yin CM, Garofalo RS, et al .. Un homólogo mutante del receptor de insulina Drosophila que extiende la vida útil y deteriora la función neuroendocrina. Science (2001) 292: 107-10. 10.1126 / science.1057987 [PubMed] [CrossRef] [Google Scholar]
- Clancy DJ, Gems D, Harshman LG, Oldham S, Stocker H, Hafen E, et al .. Extensión de la vida útil por pérdida de CHICO, una proteína sustrato del receptor de insulina Drosophila. Science (2001) 292: 104-6. 10.1126 / science.1057991 [PubMed] [CrossRef] [Google Scholar]
- Libina N, Berman JR, Kenyon C. Actividades específicas de tejidos de C. elegans DAF-16 en la regulación de la vida útil. Cell (2003) 115: 489-502. 10.1016 / S0092-8674 (03) 00889-4 [PubMed] [CrossRef] [Google Scholar]
- Broughton S, Partridge L. Señalización similar a la insulina / IGF, el sistema nervioso central y el envejecimiento. Biochem J. (2009) 418: 1-12. 10.1042 / BJ20082102 [PubMed] [CrossRef] [Google Scholar]
- Reindl KM, Sheridan MA. Regulación periférica del sistema de factor de crecimiento similar a la insulina de la hormona del crecimiento en peces y otros vertebrados. Comp Biochem Physiol A Mol Integr Physiol. (2012) 163: 231–45. 10.1016 / j.cbpa.2012 / 08 / 08.003 [PubMed] [CrossRef] [Google Scholar]
- Snell GD. Enano, un nuevo personaje recesivo mendeliano del ratón doméstico. Proc Natl Acad Sci Estados Unidos. (1929) 15: 733-4. 10.1073 / pnas.15.9.733 [Artículo gratuito de PMC] [PubMed] [CrossRef] [Google Scholar]
- Berryman D, Christiansen JS, Johannsson G, Thorner MO, Kopchick JJ. Papel del eje GH / IGF-1 en la vida útil y la salud: lecciones de modelos animales. Horma de crecimiento IGF Res. (2008) 18: 455–71. 10.1016 / j.ghir.2008.05.005 [artículo gratuito de PMC] [PubMed] [CrossRef] [Google Scholar]
- Flurkey K, Papaconstantinou J, Miller RA, Harrison DE. Extensión de la vida útil y retraso del envejecimiento inmune y del colágeno en ratones mutantes con defectos en la producción de la hormona del crecimiento. Proc Natl Acad Sci Estados Unidos. (2001) 98: 6736–41. 10.1073 / pnas.111158898 [Artículo gratuito de PMC] [PubMed] [CrossRef] [Google Scholar]
- Brown-Borg HM, Borg KE, Meliska CJ, Bartke A. Ratones enanos y el proceso de envejecimiento. Nature (1996) 384: 33. 10.1038 / 384033a0 [PubMed] [CrossRef] [Google Scholar]
- Bartke A, Wright JC, Mattison JA, Ingram DK, Miller RA, Roth GS. Extendiendo la vida útil de ratones de larga vida. Nature (2001) 414: 412. 10.1038 / 35106646 [PubMed] [CrossRef] [Google Scholar]
- Panici JA, Harper JM, Miller RA, Bartke A, Spong A, Masternak MM. El tratamiento temprano de la hormona del crecimiento de la vida acorta la longevidad y disminuye la resistencia al estrés celular en ratones mutantes de larga vida. FASEB J. (2010) 24: 5073–9. 10.1096 / fj.10-163253 [artículo gratuito de PMC] [PubMed] [CrossRef] [Google Scholar]
- Sun LY, Spong A, Swindell WR, Fang Y, Hill C, Huber JA, et al. La alteración de la hormona liberadora de la hormona del crecimiento prolonga la vida útil y regula la respuesta a la restricción calórica en ratones. Elife (2013) 2: e01098. 10.7554 / eLife.01098 [artículo gratuito de PMC] [PubMed] [CrossRef] [Google Scholar]
- Coschigano KT, Clemmons D, Bellush LL, Kopchick JJ. Evaluación de parámetros de crecimiento y vida útil de ratones con genes GHR / BP alterados. Endocrinology (2000) 141: 2608-13. 10.1210 / endo.141.7.7586 [PubMed] [CrossRef] [Google Scholar]
- Ikeno Y, Hubbard GB, Lee S, Cortez LA, Lew CM, Webb CR, etc. J Gerontol A Biol Sci Med Sci. (2009) 64: 522–9. 10.1093 / gerona / glp017 [artículo gratuito de PMC] [PubMed] [CrossRef] [Google Scholar]
- Gesing A, Wiesenborn D, Do A, Menon V, Schneider A, Victoria B, et al .. Un ratón de larga vida que carece tanto de hormona de crecimiento como de receptor de hormona de crecimiento: un nuevo modelo animal para estudios de envejecimiento. J Gerontol A Biol Sci Med Sci. (2017) 72: 1054–61. 10.1093 / gerona / glw193 [artículo gratuito de PMC] [PubMed] [CrossRef] [Google Scholar]
- Bonkowski MS, Rocha JS, Masternak MM, Al Regaiey KA, Bartke A. La interrupción dirigida del receptor de la hormona del crecimiento interfiere con las acciones beneficiosas de la restricción calórica. Proc Natl Acad Sci Estados Unidos. (2006) 103: 7901-5. 10.1073 / pnas.0600161103 [Artículo gratuito de PMC] [PubMed] [CrossRef] [Google Scholar]
- Coschigano KT, Holland AN, Riders ME, List EO, Flyvbjerg A, Kopchick JJ. La eliminación, pero no el antagonismo, del receptor de la hormona del crecimiento del ratón da como resultado un peso corporal severamente reducido, insulina y niveles de factor de crecimiento similar a la insulina I y un aumento de la vida útil. Endocrinology (2003) 144: 3799-810. 10.1210 / en.2003-0374 [PubMed] [CrossRef] [Google Scholar]
- Holzenberger M, Dupont J, Ducos B, Leneuve P, Géloën A, Even PC, et al .. El receptor IGF-1 regula la vida útil y la resistencia al estrés oxidativo en ratones. Nature (2003) 421: 182–7. 10.1038 / nature01298 [PubMed] [CrossRef] [Google Scholar]
- Bokov AF, Garg N, Ikeno Y, Thakur S, Musi N, DeFronzo RA, et al. ¿La señalización reducida de IGF-1R en ratones Igf1r +/− altera el envejecimiento? Plos ONE (2011) 6: e26891. 10.1371 / journal.pone.0026891 [artículo gratuito de PMC] [PubMed] [CrossRef] [Google Scholar]
- Xu J, Gontier G, Chaker Z, Lacube P, Dupont J, Holzenberger M. El efecto de la longevidad de la mutación IGF-1R +/− depende de la activación del receptor genético específico de fondo. Envejecimiento celular (2014) 13: 19-28. 10.1111 / acel.12145 [artículo gratuito de PMC] [PubMed] [CrossRef] [Google Scholar]
- Mulvey L, Sinclair A, Selman C. Modulación de la vida útil en ratones y los efectos de confusión del fondo genético. J Genet Genomics (2014) 41: 497-503. 10.1016 / j.jgg.2014.06.002 [artículo gratuito de PMC] [PubMed] [CrossRef] [Google Scholar]
- Kappeler L, De Magalhaes Filho C, Dupont J, Leneuve P, Cervera P, Périn L, et al .. Los receptores cerebrales IGF-1 controlan el crecimiento y la vida útil de los mamíferos a través de un mecanismo neuroendocrino. PLOS Biol. (2008) 6: e254. 10.1371 / journal.pbio.0060254tt [artículo gratuito de PMC] [PubMed] [CrossRef] [Google Scholar]
- Svensson J, Sjögren K, Fäldt J, Andersson N, Isaksson O, Jansson JO, et al. El IGF-1 derivado del hígado regula la vida media en ratones. PLoS ONE (2011) 6: e22640 10.1371 / journal.pone.0022640 [artículo gratuito de PMC] [PubMed] [CrossRef] [Google Scholar]
- Conover CA, Bale LK. Loss of pregnancy-associated plasma protein A extends lifespan in mice. Aging Cell (2007) 6:727–9. 10.1111/j.1474-9726.2007.00328.x [PubMed] [CrossRef] [Google Scholar]
- Conover CA. Role of PAPP-A in aging and age-related disease. Exp Gerontol. (2013) 48:612–3. 10.1016/j.exger.2012.06.017 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Selman C, Lingard S, Choudhury AI, Batterham RL, Claret M, Clements M, et al.. Evidence for lifespan extension and delayed age-related biomarkers in insulin receptor substrate 1 null mice. FASEB J. (2008) 22:807–18. 10.1096/fj.07-9261com [PubMed] [CrossRef] [Google Scholar]
- Taguchi A, Wartschow LM, White MF. Brain IRS2 signaling coordinates life span and nutrient homeostasis. Science (2000) 317:369–72. 10.1126/science.1142179 [PubMed] [CrossRef] [Google Scholar]
- Kuro M, Matsumura Y, Aizawa H, Kawaguchi H, Suga T, Utsugu T, et al. Mutation of the mouse Klotho gene leads to a syndrome resembling ageing. Nature (1997) 390:45–51. 10.1038/36285 [PubMed] [CrossRef] [Google Scholar]
- Kurosu H, Yamamoto M, Clark JD, Pastor JV, Nandi A, Gurnani P, et al.. Suppression of aging in mice by the hormone Klotho. Science (2005) 309:1829–33. 10.1126/science.1112766 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Migliaccio E, Giorgio M, Mele S, Pelicci G, Reboldi P, Pandolfi PP, et al. The p66 Shc adaptor protein controls oxidative stress response and life span in mammals. Nature (1999) 402:309–13. 10.1038/46311 [PubMed] [CrossRef] [Google Scholar]
- Ramsey JJ, Tran D, Giorgio M, Griffey SM, Koehne A, Laing ST, et al.. The influence of Shc proteins on life span in mice. J Gerontol A Biol Sci Med Sci. (2014) 69:1177–85. 10.1093/gerona/glt198 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Ashpole NM, Logan S, Yabluchanskiy A, Mitschelen MC, Yan H, Farley JA, et al.. IGF-1 has sexually dimorphic, pleiotropic, and time-dependent effects on healthspan, pathology, and lifespan. Geroscience (2017) 39:129–45. 10.1007/s11357-017-9971-0 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Mao K, Quipildor GF, Tabrizian T, Novaj A, Guan F, Walters RO, et al.. Late-life targeting of the IGF-1 receptor improves healthspan and lifespan in female mice. Nat Commun. (2018) 9:2394. 10.1038/s41467-018-04805-5 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Franceschi C, Passarino G, Mari D, Monti D. Centenarians as a 21st century healthy aging model: a legacy of humanity and the need for a world-wide consortium (WWC100+). Mech Ageing Dev. (2017) 165(Pt. B):55–8. 10.1016/j.mad.2017.06.002 [PubMed] [CrossRef] [Google Scholar]
- Vitale G, Barbieri M, Kamenetskaya M, Paolisso G. GH/IGF-I/insulin system in centenarians. Mech Ageing Dev. (2017) 165:107–114. 10.1016/j.mad.2016.12.001 [PubMed] [CrossRef] [Google Scholar]
- Ferrannini E, Vichi S, Beck-Nielsen H, Laasko M, Paolisso G, Smith U. For European Group for the Study of Insulin Resistance (EGIR). Insulin action and age. Diabetes (1996) 45:947–53. 10.2337/diab.45.7.947 [PubMed] [CrossRef] [Google Scholar]
- Paolisso G, Barbieri M, Rizzo MR, Carella C, Rotondi M, Bonafè M, et al. Low insulin resistance and preserved beta-cell function contribute to human longevity but are not associated with TH-INS genes. Exp Gerontol. (2001) 37:149–56. 10.1016/S0531-5565(01)00148-6 [PubMed] [CrossRef] [Google Scholar]
- Paolisso G, Gambardella A, Ammendola S, D'Amore A, Balbi V, Varricchio M, et al.. Glucose tolerance and insulin action in healty centenarians. Am J Physiol. (1996) 270:E890–4. 10.1152/ajpendo.1996.270.5.E890 [PubMed] [CrossRef] [Google Scholar]
- Paolisso G, Gambardella A, Ammendola S, Tagliamonte MR, Rizzo MR, Capurso A, et al.. Preserved antilipolytic insulin action is associated with a less atherogenic plasma lipid profile in healthy centenarians. J Am Geriatr Soc. (1997) 45:1504–9. 10.1111/j.1532-5415.1997.tb03203.x [PubMed] [CrossRef] [Google Scholar]
- Vitale G, Brugts M, Ogliari G, Castaldi D, Fatti L, Varewijck A, et al.. Low circulating IGF-I bioactivity is associated with human longevity: findings in centenarians' offspring. Aging (2012) 4:580–89. 10.18632/aging.100484 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Baranowska B, Wolinska-Witort E, Bik W, Baranowska-Bik A, Martynska L, Broczek K, et al.. Evaluation of neuroendocrine status in longevity. Neurobiol Aging (2007) 28:774–83. 10.1016/j.neurobiolaging.2006.03.014 [PubMed] [CrossRef] [Google Scholar]
- Paolisso G, Manzella D, Barbieri M, Rizzo MR, Gambardella A, Varricchio M. Baseline heart rate variability in healthy centenarians: differences vs. aged subject. Clin. Sci. (1999) 97:579–84. 10.1042/cs0970579 [PubMed] [CrossRef] [Google Scholar]
- Paolisso G, Tagliamonte MR, Rizzo MR, Carella C, Gambardella A, Barbieri M, et al. Low plasma Insulin like growth factor-1 concentrations predict worsening of insulin mediated glucose uptake in the elderly. J. Am. Geriatr. Soc. (1999) 47:1312–8. 10.1111/j.1532-5415.1999.tb07431.x [PubMed] [CrossRef] [Google Scholar]
- Paolisso G, Ammendola S, Del Buono A, Gambardella A, Riondino M, Tagliamonte MR, et al.. Serum levels of insulin-like growth factor-I (IGF-I) and IGF-binding protein-3 in healthy centenarians: relationship with plasma leptin and lipid concentrations, insulin action, and cognitive function. J Clin Endocrinol Metab. (1997) 82:2204–9. 10.1210/jcem.82.7.4087 [PubMed] [CrossRef] [Google Scholar]
- Bonafè M, Barbieri M, Marchegiani F, Olivieri F, Ragno E, Giampieri C, et al.. Polymorphic variants of insulin-like growth factor I (IGF-I) receptor and phosphoinositide 3-kinase genes affect IGF-I plasma levels and human longevity: cues for an evolutionarily conserved mechanism of life span control. J Clin Endocrinol Metab. (2003) 88:3299–304. 10.1210/jc.2002-021810 [PubMed] [CrossRef] [Google Scholar]
- Arai Y, Hirose N, Yamamura K, Shimizu K, Takayama M, Ebihara Y, et al.. Serum insulin-like growth factor-1 in centenarians: implications of IGF-1 as a rapid turnover protein. J Gerontol A Biol Sci Med Sci. (2001) 56:M79–82. 10.1093/gerona/56.2.M79 [PubMed] [CrossRef] [Google Scholar]
- Arai Y, Takayama M, Gondo Y, Inagaki H, Yamamura K, Nakazawa S, et al.. Adipose endocrine function, insulin-like growth factor-1 axis, and exceptional survival beyond 100 years of age. J Gerontol A Biol Sci Med Sci. (2008) 63:1209–18. 10.1093/gerona/63.11.1209 [PubMed] [CrossRef] [Google Scholar]
- Herr M, Jeune B, Fors S, Andersen-Ranberg K, Ankri J, Arai Y, et al.. Frailty and associated factors among centenarians in the 5-COOP countries. Gerontology (2018) 64:521–31. 10.1159/000489955 [PubMed] [CrossRef] [Google Scholar]
- Bucci L, Ostan R, Cevenini E, Pini E, Scurti M, Vitale G, et al.. Centenarians' offspring as a model of healthy aging: a reappraisal of the data on Italian subjects and a comprehensive overview. Aging (Albany. NY). (2016) 8:1–11. 10.18632/aging.100912 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Gueresi P, Miglio R, Monti D, Mari D, Sansoni P, Caruso C, et al.. Does the longevity of one or both parents influence the health status of their offspring? Exp Gerontol. (2013) 48:395–400. 10.1016/j.exger.2013.02.004 [PubMed] [CrossRef] [Google Scholar]
- Horvath S, Pirazzini C, Bacalini MG, Gentilini D, Di Blasio AM, Delledonne M, et al.. Decreased epigenetic age of PBMCs from Italian semi-supercentenarians and their offspring. Aging (2015) 7:1159–70. 10.18632/aging.100861 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Caselli G, Pozzi L, Vaupel JW, Deiana L, Pes G, Carru C, et al.. Family clustering in Sardinian longevity: a genealogical approach. Exp Gerontol. (2006) 41:727–36. 10.1016/j.exger.2006.05.009 [PubMed] [CrossRef] [Google Scholar]
- Suh Y, Atzmon G, Cho MO, Hwang D, Liu B, Leahy DJ, et al.. Functionally significant insulin-like growth factor I receptor mutations in centenarians. Proc Natl Acad Sci USA. (2008) 105:3438–42. 10.1073/pnas.0705467105 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Deelen J, van den Akker EB, Trompet S, van Heemst D, Mooijaart SP, Slagboom PE, Beekman M. Employing biomarkers of healthy ageing for leveraging genetic studies into human longevity. Exp Gerontol. (2016) 82:166–74. 10.1016/j.exger.2016.06.013 [PubMed] [CrossRef] [Google Scholar]
- van der Spoel E, Rozing MP, Houwing-Duistermaat JJ, Slagboom PE, Beekman M, de Craen AJ, et al.. Association analysis of insulin-like growth factor-1 axis parameters with survival and functional status in nonagenarians of the Leiden Longevity Study. Aging (2015) 7:956–63. 10.18632/aging.100841 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Rozing MP, Westendorp RG, Frölich M, de Craen AJ, Beekman M, Heijmans BT, et al.. Human insulin/IGF-1 and familial longevity at middle age. Aging (2009) 1:714–22. 10.18632/aging.100071 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- van der Spoel E, Jansen SW, Akintola AA, Ballieux BE, Cobbaert CM, Slagboom PE, et al.. Growth hormone secretion is diminished and tightly controlled in humans enriched for familial longevity. Aging Cell (2016) 15:1126–31. 10.1111/acel.12519 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Sebastiani P, Sun FX, Andersen SL, Lee JH, Wojczynski MK, Sanders JL, et al.. Families enriched for exceptional longevity also have increased health-span: findings from the long life family study. Front Public Health (2013) 1:38. 10.3389/fpubh.2013.00038 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Sebastiani P, Thyagarajan B, Sun F, Honig LS, Schupf N, Cosentino S, et al.. Age and sex distributions of age-related biomarker values in healthy older adults from the long life family study. J Am Geriatr Soc. (2016) 64:e189–94. 10.1111/jgs.14522 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Teumer A, Qi Q, Nethander M, Aschard H, Bandinelli S, Beekman M, et al.. Genomewide meta-analysis identifies loci associated with IGF-I and IGFBP-3 levels with impact on age-related traits. Aging Cell (2016) 15:811–24. 10.1111/acel.12490 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Deelen J, Uh HW, Monajemi R, van Heemst D, Thijssen PE, Böhringer S, et al.. Gene set analysis of GWAS data for human longevity highlights the relevance of the insulin/IGF-1 signaling and telomere maintenance pathways. Age (2013) 35:235–49. 10.1007/s11357-011-9340-3 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- van Heemst D, Beekman M, Mooijaart SP, Heijmans BT, Brandt BW, Zwaan BJ, et al.. Reduced insulin/IGF-1 signalling and human longevity. Aging Cell (2005) 4:79–85. 10.1111/j.1474-9728.2005.00148.x [PubMed] [CrossRef] [Google Scholar]
- Ben-Avraham D, Govindaraju DR, Budagov T, Fradin D, Durda P, Liu B, et al.. The GH receptor exon 3 deletion is a marker of male-specific exceptional longevity associated with increased GH sensitivity and taller stature. Sci Adv. (2017) 3:e1602025. 10.1126/sciadv.1602025 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- McKiernan SH, Colman RJ, Lopez M, Beasley TM, Aiken JM, Anderson RM, et al.. Caloric restriction delays aging-induced cellular phenotypes in rhesus monkey skeletal muscle. Exp Gerontol. (2011) 46:23–9. 10.1016/j.exger.2010.09.011 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Colman RJ, Anderson RM, Johnson SC, Kastman EK, Kosmatka KJ, Beasley TM, et al. Calorie restriction delays disease onset and mortality in rhesus monkeys. Science (2009) 325:201–4. 10.1126/science.1173635 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Willcox DC, Willcox BJ, Todoriki H, Curb JD, Suzuki M. Caloric restriction and human longevity: what can we learn from the Okinawans? Biogerontology (2006) 7:173–7. 10.1007/s10522-006-9008-z [PubMed] [CrossRef] [Google Scholar]
- Mattison JA, Roth GS, Beasley TM, Tilmont EM, Handy AM, Herbert RL, et al.. Impact of caloric restriction on health and survival in rhesus monkeys from the NIA study. Nature (2012) 489:318–21. 10.1038/nature11432 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Dunn SE, Kari FW, French J, Leininger JR, Travlos G, Wilson R, et al.. Dietary restriction reduces insulin-like growth factor I levels, which modulates apoptosis, cell proliferation, and tumor progression in p53-deficient mice. Cancer Res. (1997) 57:4667–72. [PubMed] [Google Scholar]
- Berrigan D, Perkins SN, Haines DC, Hursting SD. Adult-onset calorie restriction and fasting delay spontaneous tumorigenesis in p53-deficient mice. Carcinogenesis (2002) 23:817–22. 10.1093/carcin/23.5.817 [PubMed] [CrossRef] [Google Scholar]
- Redman LM, Veldhuis JD, Rood J, Smith SR, Williamson D, Ravussin E, et al.. The effect of caloric restriction interventions on growth hormone secretion in nonobese men and women. Aging Cell (2010) 9:32–9. 10.1111/j.1474-9726.2009.00530.x [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Fontana L, Villareal DT, Das SK, Smith SR, Meydani SN, Pittas AG, et al.. Effects of 2-year calorie restriction on circulating levels of IGF-1, IGF-binding proteins and cortisol in nonobese men and women: a randomized clinical trial. Aging Cell (2016) 15:22–7. 10.1111/acel.12400 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Lettieri-Barbato D, Giovannetti E, Aquilano K. Effects of dietary restriction on adipose mass and biomarkers of healthy aging in human. Aging (2016) 8:3341–55. 10.18632/aging.101122 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Mercken EM, Crosby SD, Lamming DW, JeBailey L, Krzysik-Walker S, Villareal DT, et al.. Calorie restriction in humans inhibits the PI3K/AKT pathway and induces a younger transcription profile. Aging Cell (2013) 12:645–51. 10.1111/acel.12088 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Arai Y, Kojima T, Takayama M, Hirose N. The metabolic syndrome, IGF-1, and insulin action. Mol Cell Endocrinol. (2009) 299:124–8. 10.1016/j.mce.2008.07.002 [PubMed] [CrossRef] [Google Scholar]
- Redman LM, Ravussin E. Endocrine alterations in response to calorie restriction in humans. Mol Cell Endocrinol. (2009) 299:129–36. 10.1016/j.mce.2008.10.014 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Franceschi C, Garagnani P, Vitale G, Capri M, Salvioli S. Inflammaging and 'Garb-aging'. Trends Endocrinol Metab. (2017) 28:199–212. 10.1016/j.tem.2016.09.005 [PubMed] [CrossRef] [Google Scholar]
- Qian M, Liu B. Pharmaceutical Intervention of Aging. Adv Exp Med Biol. (2018) 1086:235–54. 10.1007/978-981-13-1117-8_15 [PubMed] [CrossRef] [Google Scholar]
- Baker DJ, Wijshake T, Tchkonia T, LeBrasseur NK, Childs BG, van de Sluis B, et al.. Clearance of p16Ink4a-positive senescent cells delays ageing-associated disorders. Nature (2011) 479:232–6. 10.1038/nature10600 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Derous D, Mitchell SE, Wang L, Green CL, Wang Y, Chen L, et al.. The effects of graded levels of calorie restriction: XI. Evaluation of the main hypotheses underpinning the life extension effects of CR using the hepatic transcriptome. Aging (2017) 9:1770–824. 10.18632/aging.101269 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Madeo F, Tavernarakis N, Kroemer G. Can autophagy promote longevity? Nat Cell Biol. (2010) 12:842–6. 10.1038/ncb0910-842 [PubMed] [CrossRef] [Google Scholar]
- Cevenini E, Monti D, Franceschi C. Inflamm-ageing. Curr Opin Clin Nutr Metab Care. (2013) 16:14–20. 10.1097/MCO.0b013e32835ada13 [PubMed] [CrossRef] [Google Scholar]
- Meydani SN, Das SK, Pieper CF, Lewis MR, Klein S, Dixit VD, et al.. Long-term moderate calorie restriction inhibits inflammation without impairing cell-mediated immunity: a randomized controlled trial in non-obese humans. Aging (2016) 8:1416–31. 10.18632/aging.100994 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Ott B, Skurk T, Hastreiter L, Lagkouvardos I, Fischer S, Büttner J, et al.. Effect of caloric restriction on gut permeability, inflammation markers, and fecal microbiota in obese women. Sci Rep. (2017) 7:11955. 10.1038/s41598-017-12109-9 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Unamuno X, Gómez-Ambrosi J, Rodríguez A, Becerril S, Frühbeck G, Catalán V. Adipokine dysregulation and adipose tissue inflammation in human obesity. Eur J Clin Invest. (2018) 48:e12997. 10.1111/eci.12997 [PubMed] [CrossRef] [Google Scholar]
- Liu M, Liu F. Regulation of adiponectin multimerization, signaling and function. Best Pract Res Clin Endocrinol Metab. (2014) 28:25–31. 10.1016/j.beem.2013.06.003 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Balaskó M, Soós S, Székely M, Pétervári E. Leptin and aging: Review and questions with particular emphasis on its role in the central regulation of energy balance. J Chem Neuroanat. (2014) 61–62:248–55. 10.1016/j.jchemneu.2014.08.006 [PubMed] [CrossRef] [Google Scholar]
- Arai Y, Nakazawa S, Kojima T, Takayama M, Abihara Y, Shimizu K, et al. High adiponectin concentration and its role for longevity in female centenarians. Geriatr Gerontol Int. (2006) 6:32–9. 10.1111/j.1447-0594.2006.00304.x [CrossRef] [Google Scholar]
- Bik W, Baranowska-Bik A, Wolinska-Witort E, Kalisz M, Broczek K, Mossakowska M, et al.. Assessment of adiponectin and its isoforms in Polish centenarians. Exp Gerontol. (2013) 48:401–7. 10.1016/j.exger.2013.01.015 [PubMed] [CrossRef] [Google Scholar]
- Meazza C, Vitale G, Pagani S, Castaldi D, Ogliari G, Mari D, et al.. Common adipokine features of neonates and centenarians. J Pediatr Endocrinol Metab. (2011) 24:953–7. 10.1515/JPEM.2011.373 [PubMed] [CrossRef] [Google Scholar]
- Baranowska B, Bik W, Baranowska-Bik A, Wolinska-Witort E, Szybinska A, Martynska L, et al.. Neuroendocrine control of metabolic homeostasis in Polish centenarians. J Physiol Pharmacol. (2006) 57 (Suppl. 6):55–61. [PubMed] [Google Scholar]
- Miura Y, Hashii N, Tsumoto H, Takakura D, Ohta Y, Abe Y, et al.. Change in N-glycosylation of plasma proteins in Japanese semisupercentenarians. PLoS ONE (2015) 10:e0142645. 10.1371/journal.pone.0142645 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Atzmon G, Pollin TI, Crandall J, Tanner K, Schechter CB, Scherer PE, et al.. Adiponectin levels and genotype: a potential regulator of life span in humans. J Gerontol A Biol Sci Med Sci. (2008) 63:447–53. 10.1093/gerona/63.5.447 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Mariotti S, Barbesino G, Caturegli P, Bartalena L, Sansoni P, Fagnoni F, et al.. Complex alteration of thyroid function in healthy centenarians. J Clin. Endocrinol Metab. (1993) 77:1130–4. 10.1210/jcem.77.5.8077303 [PubMed] [CrossRef] [Google Scholar]
- Maugeri D, Russo MS, Di Stefano F, Receputo G, Rosso D, Rapisarda R, et al.. Thyroid function in healthy centenarians. Arch Gerontol Geriatr. (1997) 25:211–7. 10.1016/S0167-4943(97)00012-5 [PubMed] [CrossRef] [Google Scholar]
- Ostan R, Monti D, Mari D, Arosio B, Gentilini D, Ferri E, et al.. Heterogeneity of thyroid function and impact of peripheral thyroxine deiodination in centenarians and semi-supercentenarians: association with functional status and mortality. J Gerontol A Biol Sci Med Sci. (2018). 10.1093/gerona/gly194. [Epub ahead of print]. [PubMed] [CrossRef] [Google Scholar]
- He Y, Chen X, Yan D, Xiao F, Liu Y, Lin R, et al.. Thyroid function decreases with age and may contribute to longevity in chinese centenarians' families. JAGS (2015) 63:1474–6. 10.1111/jgs.13553 [PubMed] [CrossRef] [Google Scholar]
- Corsonello A, Montesanto A, Berardelli M, De Rango F, Dato S, Mari V, et al.. A cross-section analysis of FT3 age-related changes in a group of old and oldest-old subjects, including centenarians' relatives, shows that a down-regulated thyroid function has a familial component and is related to longevity. Age Ageing (2010) 39:723–7. 10.1093/ageing/afq116 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Pereira da Silva A, Matos A, Valente A, Gil Â, Alonso I, Ribeiro R, et al.. Body composition assessment and nutritional status evaluation in men and women portuguese centenarians. J Nutr Health Aging (2016) 20:256–66. 10.1007/s12603-015-0566-0 [PubMed] [CrossRef] [Google Scholar]
- Franceschi C, Ostan R, Santoro A. Nutrition and inflammation: are centenarians similar to individuals on calorie-restricted diets? Annu Rev Nutr. (2018) 38:329–56. 10.1146/annurev-nutr-082117-051637 [PubMed] [CrossRef] [Google Scholar]
- Gentilini D, Mari D, Castaldi D, Remondini D, Ogliari G, Ostan R, et al.. Role of epigenetics in human aging and longevity: genome-wide DNA methylation profile in centenarians and centenarians' offspring. Age (2013) 35:1961–73. 10.1007/s11357-012-9463-1 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Sgarbi G, Matarrese P, Pinti M, Lanzarini C, Ascione B, Gibellini L, et al.. Mitochondria hyperfusion and elevated autophagic activity are key mechanisms for cellular bioenergetic preservation in centenarians. Aging (2014) 6:296–310. 10.18632/aging.100654 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Emanuele E, Minoretti P, Sanchis-Gomar F, Pareja-Galeano H, Yilmaz Y, Garatachea N, et al.. Can enhanced autophagy be associated with human longevity? Serum levels of the autophagy biomarker beclin-1 are increased in healthy centenarians. Rejuvenation Res. (2014) 17:518–24. 10.1089/rej.2014.1607 [PubMed] [CrossRef] [Google Scholar]
- Raz Y, Guerrero-Ros I, Maier A, Slagboom PE, Atzmon G, Barzilai N, et al.. Activation-induced autophagy is preserved in CD4+ T-cells in familial longevity. J Gerontol A Biol Sci Med Sci. (2017) 72:1201–6. 10.1093/gerona/glx020 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Fontana L, Villareal DT, Weiss EP, Racette SB, Steger-May K, et al. Calorie restriction or exercise: effects on coronary heart disease risk factors. A randomized, controlled trial. Am J Physiol Endocrinol Metab. (2007) 293:E197–202. 10.1152/ajpendo.00102.2007 [PubMed] [CrossRef] [Google Scholar]
- Ravussin E, Redman LM, Rochon J, Das SK, Fontana L, et al.. A 2-year randomized controlled trial of human caloric restriction: feasibility and effects on predictors of health span and longevity. J Gerontol A Biol Sci Med Sci. (2015) 70:1097–104. 10.1093/gerona/glv057 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Bruunsgaard H, Andersen-Ranberg K, Jeune B, Pedersen AN, Skinhoj P, Pedersen BK. A high plasma concentration of TNF-α is associated with dementia in centenarians. J Gerontol A Biol Sci Med Sci. (1999) 54:M357–64. 10.1093/gerona/54.7.M357 [PubMed] [CrossRef] [Google Scholar]
- Gangemi S, Basile G, Merendino RA, Minciullo PL, Novick D, et al.. Increased circulating interleukin-18 levels in centenarians with no signs of vascular disease: another paradox of longevity? Exp Gerontol. (2003) 38:669–72. 10.1016/S0531-5565(03)00061-5 [PubMed] [CrossRef] [Google Scholar]
- Gerli R, Monti D, Bistoni O, Mazzone AM, Peri G, et al.. Chemokines, sTNF-Rs and sCD30 serum levels in healthy aged people and centenarians. Mech. Ageing Dev. (2000) 121:37–46. 10.1016/S0047-6374(00)00195-0 [PubMed] [CrossRef] [Google Scholar]
- Franceschi C, Capri M, Monti D, Giunta S, Olivieri F, Sevini F, et al.. Inflammaging and anti-inflammaging: a systemic perspective on aging and longevity emerged from studies in humans. Mech Ageing Dev. (2007) 128:92–105. 10.1016/j.mad.2006.11.016 [PubMed] [CrossRef] [Google Scholar]
- Salvioli S, Monti D, Lanzarini C, Conte M, Pirazzini C, Bacalini MG, et al.. Immune system, cell senescence, aging and longevity–inflamm-aging reappraised. Curr Pharm Des. (2013) 19:1675–9. 10.2174/1381612811319090015