
Nuestro cerebro es nuestro todo. La violación del trabajo de este importante órgano conduce a consecuencias terribles, y a veces fatales. La complejidad del cerebro y su organización neural es colosal, lo que complica enormemente el proceso de tratamiento de una enfermedad en particular. Como regla general, cuando tratamos algo, tratamos de deshacernos de los defectos que causa la enfermedad. Pero, ¿qué pasa si estos defectos se usan para combatir lo que los crea? Esto es exactamente lo que decidieron hacer los autores del estudio que estamos considerando hoy. ¿Cómo aplicaron los científicos la interrupción de la barrera hematoencefálica, por qué necesitamos acceso a la matriz extracelular del cerebro y qué papel desempeñó la lamprea parasitaria en los peces en esto? El informe del grupo de investigación nos contará sobre esto. Vamos
Poco de teoría
En primer lugar, vale la pena clasificar los personajes en esta obra de laboratorio.
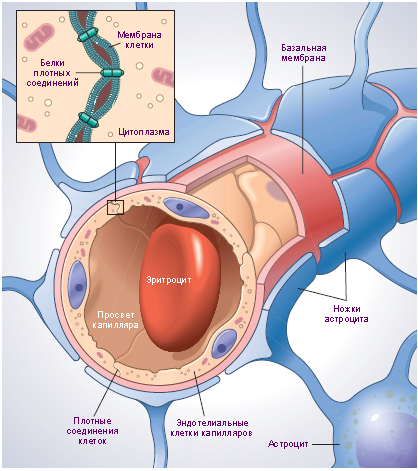 Barrera hematoencefálica
Barrera hematoencefálicaLa barrera hematoencefálica (BBB) desempeña uno de los papeles principales, una barrera fisiológica entre el sistema nervioso central (SNC) y el sistema circulatorio. Esta barrera evita el contacto de los tejidos nerviosos con varios componentes de la sangre circulante, entre los cuales pueden existir toxinas, microorganismos, factores celulares / humorales del sistema inmune que pueden responder a las células cerebrales como extrañas. El BBB puede compararse con un gorila en un club muy costoso, permitiendo que el sistema nervioso central se alimente exclusivamente de nutrientes. Pero este gorila no es muy exigente, a menudo no pierde los medicamentos necesarios para tratar el sistema nervioso central. Resulta que un sistema dirigido al beneficio de nuestra salud puede ser un obstáculo para su tratamiento. Aquí está la ironía en fisiología.
Sin embargo, la barrera hematoencefálica no siempre funciona como un reloj suizo. En casos de accidente cerebrovascular, tumores, diversas lesiones en la cabeza, enfermedades crónicas, el BBB comienza a fallar, es decir, dejar entrar al sistema nervioso central lo que previamente habría eliminado. Además de las causas naturales de la falla, también hay antropogénicos: ultrasonido enfocado de alta intensidad y agentes osmóticos que interrumpen el BBB. ¿Por qué romper algo que asegura el funcionamiento normal del cerebro? Luego, para entregar medicamentos que filtrará un BBB completo. De todos modos, el portero no permitirá que el médico ingrese al club para un visitante que se haya desmayado, porque no tiene una tarjeta del club.
El principal y común para todos los casos, el resultado de la interrupción de la BBB es una exposición patológica de la matriz extracelular (ECM) del cerebro, que se aísla en condiciones normales.
La matriz extracelular es la base del tejido conectivo que proporciona soporte mecánico para las células y el transporte de productos químicos.
Por lo tanto, los científicos creen que al atacar ciertas partes del cerebro con un BBB patológicamente alterado, es posible administrar medicamentos a aquellas partes del sistema nervioso central dañado que antes eran inaccesibles precisamente por el BBB.
Por lo tanto, es posible crear un ligando dirigido a la MEC, que será eficaz en la lucha contra diversas enfermedades del sistema nervioso central, y no con una específica, como los métodos desarrollados previamente.
Para probar la teoría en la práctica, los científicos decidieron aplicar su método de administración de medicamentos al glioblastoma incurable (cáncer de cerebro). Este tipo de enfermedad es bastante rara, pero es extremadamente difícil de vencer. Incluso después de la quimioterapia, la radioterapia y la cirugía, la supervivencia es de aproximadamente 1-2 años.
Estudios recientes han demostrado que el uso de inmunoterapia a través de
receptores de antígeno quimérico * basados en interleucina-13 * es un tratamiento prometedor para el glioblastoma.
Las interleucinas * son moléculas de información peptídica producidas por leucocitos, en menor medida por fagocitos y otros tejidos. Las interleucinas son parte del sistema inmune.
La interleucina-13 * (IL13) es el principal mediador de los cambios fisiológicos causados por la inflamación alérgica en muchos tejidos.
El receptor de antígeno quimérico * es una proteína de fusión recombinante que conecta un fragmento de anticuerpo que puede unirse selectivamente a antígenos específicos y dominios de señalización que activan las células T.
El uso de receptores antigénicos quiméricos dirigidos a la proteína CSPG4 también puede ser un método bastante efectivo para combatir el glioblastoma.
Además, el análisis de resonancia magnética mostró una violación de la barrera hematoencefálica dentro del glioblastoma. Por lo tanto, los tratamientos relacionados con la matriz extracelular deben ser efectivos.
Y aquí entra en escena la inmensa imaginación y creatividad de los científicos. El hecho es que puede usar péptidos y anticuerpos estándar como reactivos dirigidos a ECM, pero esto no es tan divertido. Por lo tanto, los científicos decidieron usar receptores de linfocitos variables (VLR), es decir, receptores de antígeno de lamprea.
 La clase de lamprea tiene alrededor de 40 especies, la mayoría de las cuales son parásitos que se alimentan de la sangre de los peces, a los que chupan.
La clase de lamprea tiene alrededor de 40 especies, la mayoría de las cuales son parásitos que se alimentan de la sangre de los peces, a los que chupan.Los VLR son proteínas ricas en hoz y ricas en leucina que reconocen dianas antigénicas con especificidad y
afinidad * comparables a los anticuerpos basados en inmunoglobulinas.
La afinidad * es la característica termodinámica de la fuerza de la interacción de sustancias como el antígeno y el anticuerpo.
¿Por qué precisamente las lampreas y sus VLR? El hecho es que entre mamíferos y lampreas hay un abismo evolutivo de 500 millones de años. Por lo tanto, los VLR de lamprea tienen más probabilidades de reconocer proteínas y glicanos conservados en la MEC que los anticuerpos de mamíferos.
Para identificar los VLR que se unen al ECM del cerebro, los científicos realizaron un barrido, un método para seleccionar bioelementos específicos (proteínas, petites, etc.) de las bibliotecas de biomoléculas VLR. El resultado fue un grupo de
clones de unión a ECM
* .
Clon * : un grupo de celdas idénticas que comparten un ancestro común (fuente primaria), es decir, provienen de la misma celda.
El clon resultante demostró una acumulación preferencial tanto en áreas destruidas de la barrera hematoencefálica en animales con un trastorno osmótico del BBB o con glioblastoma. Además, el clon estaba bien dirigido a
liposomas * cargados con doxorrubicina (un antibiótico).
Liposomas * : orgánulos intracelulares esféricos utilizados para administrar medicamentos a ciertos tejidos.
Preparación del estudio
Como ya supimos anteriormente, los VLR de unión a ECM se identificaron mediante el desplazamiento de las bibliotecas de VLR. La biblioteca en sí se obtuvo de una colección de VLR de lamprea inmunizados con preparaciones aisladas mecánicamente de la membrana plasmática de la microvasculatura del cerebro del ratón, que contenía el ECM asociado del cerebro.
La biblioteca se enriqueció primero con aglutinantes de ECM utilizando dos ciclos de barrido en un ECM
descelularizado * generado por células endoteliales de ratón cultivadas (línea celular bEnd.3).
La descelularización * es un método para purificar aloinjertos del componente celular para obtener una construcción no inmunogénica, efectiva y segura basada en una matriz extracelular natural.
Además, fue necesario identificar con precisión aquellos clones de unión a ECM que predominantemente doblan ECM de bEnd.3, y no con el grupo control de ECM de fibroblastos de ratón (línea celular 3T3).
A continuación, los clones individuales se colocaron en placas de 96 pocillos, después de lo cual se expandieron e indujeron a mostrar VLR. Después de eliminar los clones adicionales (para que no hubiera subclonación), los científicos pudieron realizar una evaluación comparativa de la unión de VLR a bEnd.3 y 3T3 ECM utilizando la detección ELISA (
1a ).
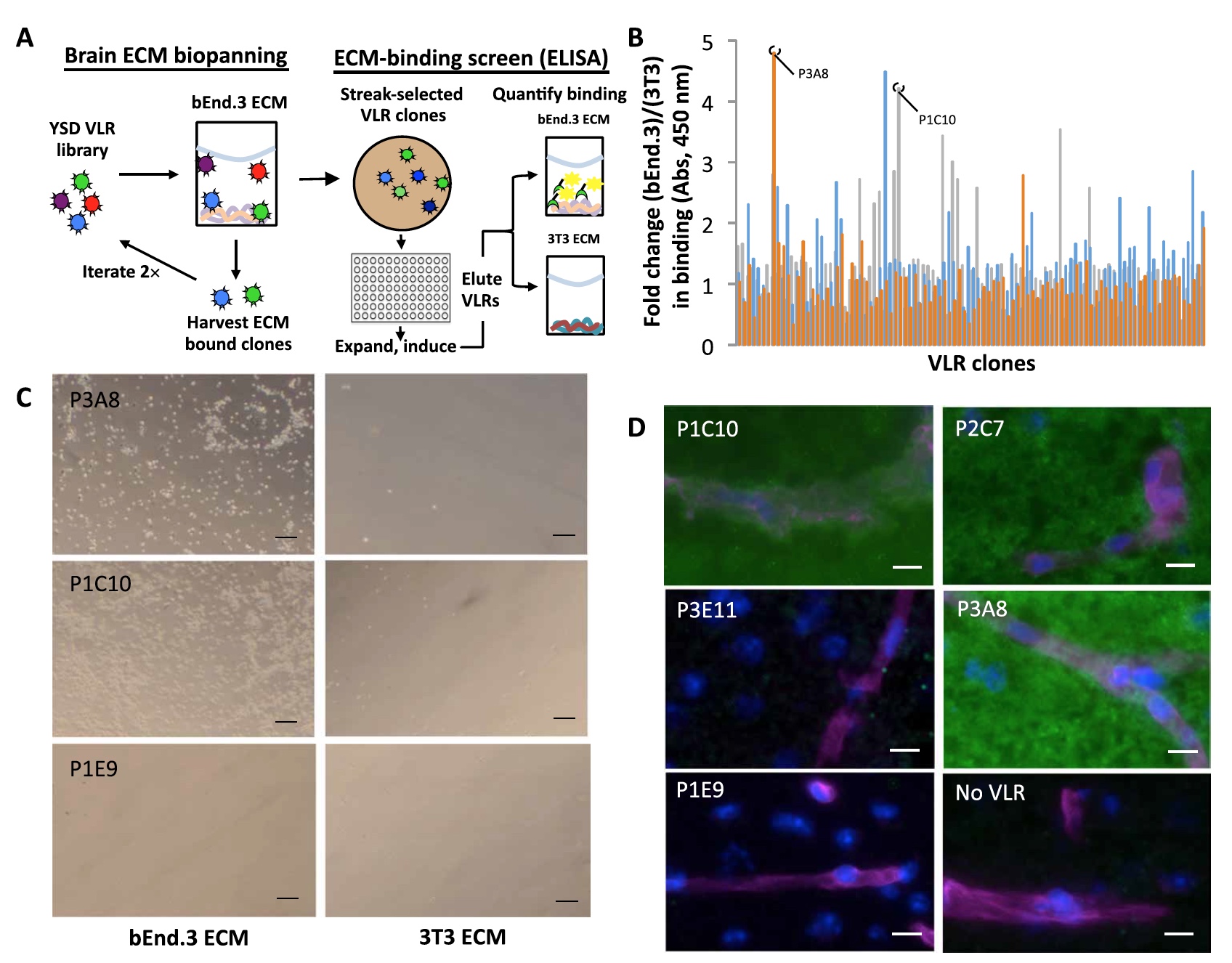 Imagen No. 1
Imagen No. 1Se analizaron un total de 285 clones. Como resultado, se puede ver que las señales de comunicación con bEnd.3 ECM son aproximadamente 5 veces más fuertes que las señales de comunicación con 3T3 ECM (
1b ).
A continuación, los resultados de ELISA se verificaron comparando imágenes de microscopía de campo brillante de clones asociados con bEnd.3 y 3T3 ECM (
1C ).
Como se puede ver en la imagen
1c , los clones P1C10 y P2C7 se unen exclusivamente a ECM bEnd.3, y el clon no vinculante P1E9 prácticamente no muestra ninguna conexión con ningún tipo de ECM.
Luego, los científicos realizaron un análisis comparativo de un método más práctico, en una sección del cerebro del ratón. Ocho de los 10 clones VLR que mostraron el mejor resultado de unión en observaciones anteriores también mostraron unión (
1d ) en este ensayo.
Todos los clones de unión mostraron un esquema EMC parenquimatoso difuso sin ningún enriquecimiento adicional (vascular o celular).
Los científicos identificaron a 2 líderes de acuerdo con los resultados de todas las observaciones anteriores: P1C10 y P3A8. Son estos clones los que se considerarán en el futuro.
Resultados de la investigación
P1C10 y P3A8 se funcionalizaron con colorante fluorescente Cy5. La inmunotinción directa de tejidos de ratón usando conjugados VLR-Cy5 mostró que P1C10-Cy5 tiene una selectividad significativa hacia la ECM del cerebro en comparación con los tejidos de los riñones, el corazón y el hígado (
2a ).
 Imagen No. 2a
Imagen No. 2aInmunotinción * : un proceso que le permite identificar y localizar un antígeno en un área específica de una célula, tejido u órgano.
Pero P3A8-Cy5 se une a las ECM del cerebro y el hígado con la misma intensidad, pero al igual que P1C10-Cy5 no muestra interés en las ECM de riñón y corazón.
Luego, los científicos probaron la reactividad cruzada de P1C10 y el ECM del cerebro humano (se utilizaron criosecciones). La unión de P1C10-Cy5 a la ECM del cerebro humano se asemeja a una imagen del mismo proceso, pero involucra al cerebro del ratón (
2b ). P1C10-Cy5 también se unió con éxito a ECM en criosecciones de una muestra de glioblastoma humano (
2c ).
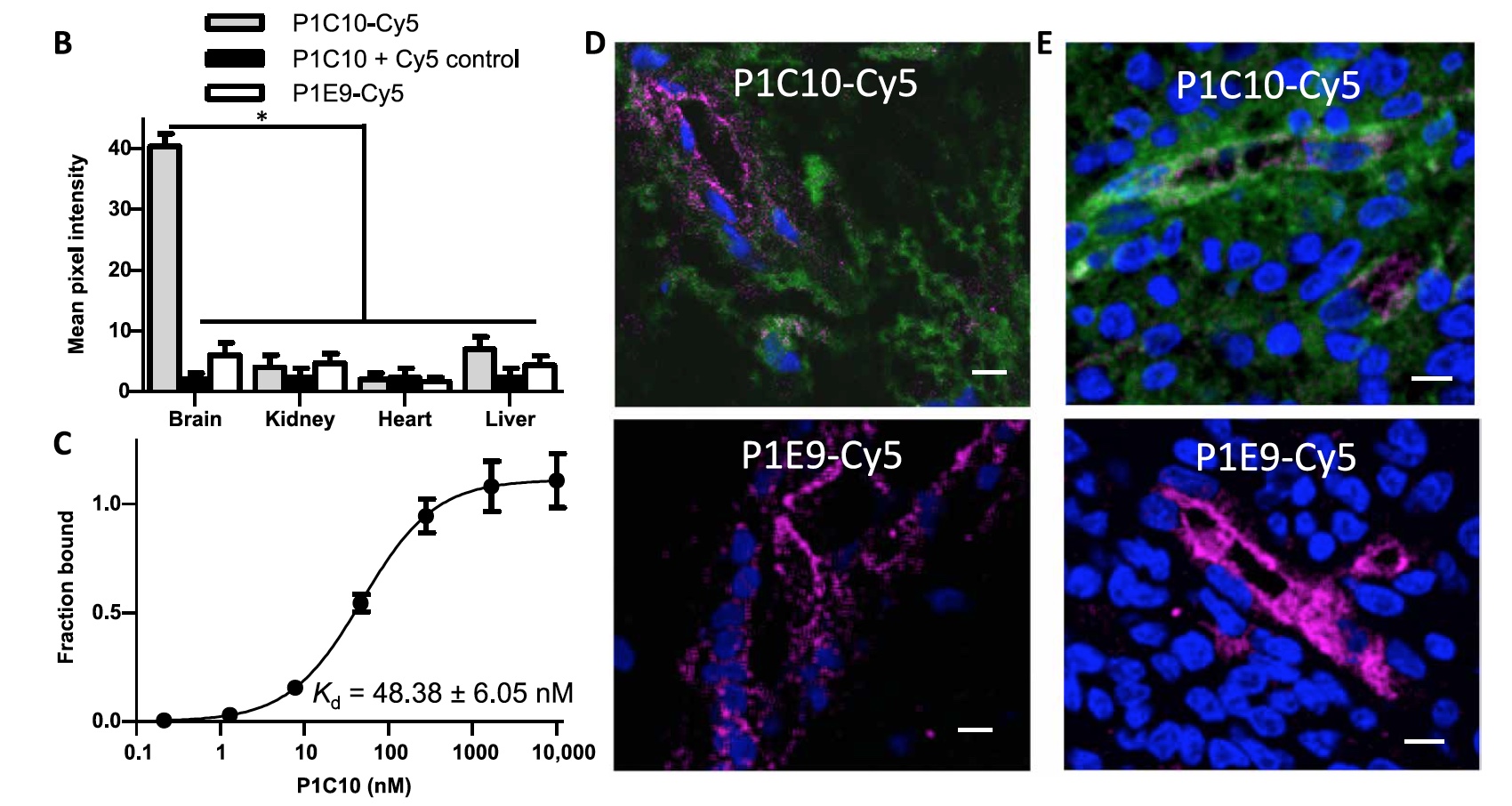 Imagen No. 2b-e
Imagen No. 2b-eDadas estas observaciones, los científicos midieron la
afinidad de * P1C10.
Afinidad * : la capacidad de una célula para capturar y unir ciertos productos químicos.
Como resultado, la constante de disociación (Kd) para la unión a bEnd.3 ECM fue 48,38 ± 6,05 nM (
2d ).
Después de esto, los científicos decidieron verificar si P1C10 se acumulará en lugares de destrucción del BBB en el cerebro del ratón.
Modificado por colorante IR800 cercano a infrarrojo, los clones P1C10 o RBC36 se introdujeron en ratones de laboratorio sanos en un volumen de 1 mg / kg. RBC36 es un VLR que reconoce el trisacárido del antígeno H humano, por lo tanto, se usó como control de isotipo.
A continuación, los ratones fueron inyectados por vía intravenosa con manitol (alcohol hexahídrico) para abrir temporalmente el BBB. Después de eso, se tomaron imágenes cerebrales de ratones para identificar las señales IR800 (imagen a continuación).
 Imagen No. 3
Imagen No. 3Un análisis comparativo mostró que la acumulación de fluorescencia en el cerebro (concentración de la sustancia de prueba marcada con colorante IR800) cuando se usa P1C10-IR800 es 3.3 veces mayor que con RBC36-IR800, y 7.6 veces mayor que cuando se usa solución salina. En consecuencia, P1C10 se acumula selectivamente en el cerebro después de un mal funcionamiento de la barrera hematoencefálica.
Luego, los científicos decidieron verificar si el VLR apuntaría a la matriz extracelular desnuda. Para esto, se crearon dos modelos utilizando GL261 murino y células de glioblastoma U87 humano, que se introdujeron en el cerebro de ratones experimentales. Como resultado, se formaron tumores con una vasculatura caótica y trastornos puntuales de la barrera hematoencefálica.
P1C10 o RBC36 en un volumen de 1 mg / kg se administró por vía intravenosa a ratones con glioblastoma GB261 incorporado. Después de 30 minutos, se tomaron muestras de cerebro para analizar y visualizar la señal IR800 (colorante para P1C10 o RBC36).
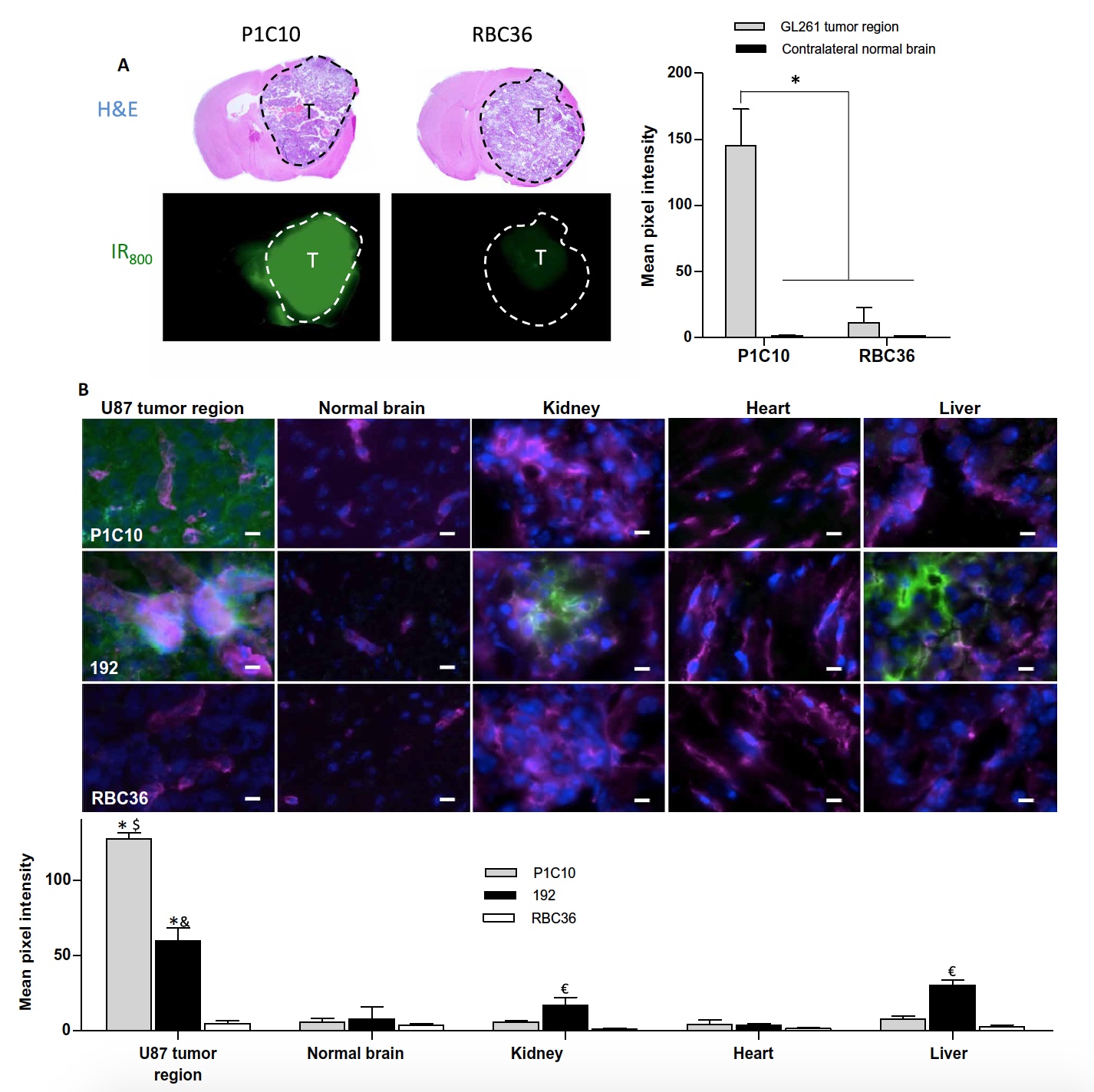 Imagen No. 4
Imagen No. 4La intensidad de fluorescencia promedio en la región tumoral de GL261 en ratones inyectados con P1C10-IR800 fue 112 veces mayor que en la región contralateral (opuesta) del cerebro (
4a ). Pero cuando se usa RBC36-IR800, la intensidad de fluorescencia de la región tumoral fue solo 9 veces mayor que la intensidad en la región opuesta.
Además, se encontró que la acumulación de P1C10-IR800 en el tumor en sí es 13 veces mayor que la acumulación de RBC36-IR800.
Estas observaciones confirmaron la capacidad de P1C10 de dirigirse selectivamente a ECM en tumores de ratón. Ahora era necesario probar este talento en tumores cerebrales humanos.
Se administró VLR a ratones con U87 (tumor cerebral humano). Los científicos probaron no solo P1C10, sino también 192, que mostró una unión selectiva al lado basolateral de la vasculatura del cerebro además de los vasos de los riñones y el hígado, así como la MEC.
P1C10, 192 o RBC36 en un volumen de 3 mg / kg se administraron por vía intravenosa y se dejó circular libremente durante 30 minutos. Después de eso, se tomaron muestras de órganos de interés para visualizar los resultados.
Ambos clones de VLR (P1C10 y 192) mostraron acumulación en los bordes del tumor, y P1C10 se distribuyó por toda la ECM tumoral (
4b ). Pero 192 en su mayor parte se concentró fuera de los grandes vasos tumorales.
Ninguno de los clones VLR se acumuló en el hemisferio contralateral sano del cerebro del ratón. Y RBC36 estaba completamente ausente tanto en las partes sanas como en las partes del cerebro que contienen tumores.
El análisis cuantitativo mostró que P1C10 se acumula en el tumor U87 21.2 veces más que en la región contralateral del cerebro, 21.2 veces los riñones, 15.9 veces el hígado y 29.6 veces el corazón.
La acumulación de P1C10 y 192 en las regiones tumorales fue 25.4 y 11.9 veces mayor que la acumulación de RBC36. Al mismo tiempo, ambos clones de VLR se acumularon principalmente en las áreas de defectos vasculares del tumor.
Estas observaciones confirman la efectividad de P1C10 y su enfoque selectivo en la ECM cerebral. Queda por ver si P1C10 puede entregar medicamentos de manera eficiente a donde lo necesitan.
Los científicos usaron VLR junto con liposomas cargados de doxorrubicina, que se visualiza altamente gracias a su propia fluorescencia, lo que simplifica enormemente el proceso de análisis de la efectividad de VLR. Los liposomas se obtuvieron con un diámetro promedio de 94,2 nm y un contenido de doxorrubicina de 1 a 2 mg / ml. A continuación, los clones VLR se unieron a los liposomas, que retuvieron su actividad de unión después de la combinación (imagen nº 5).
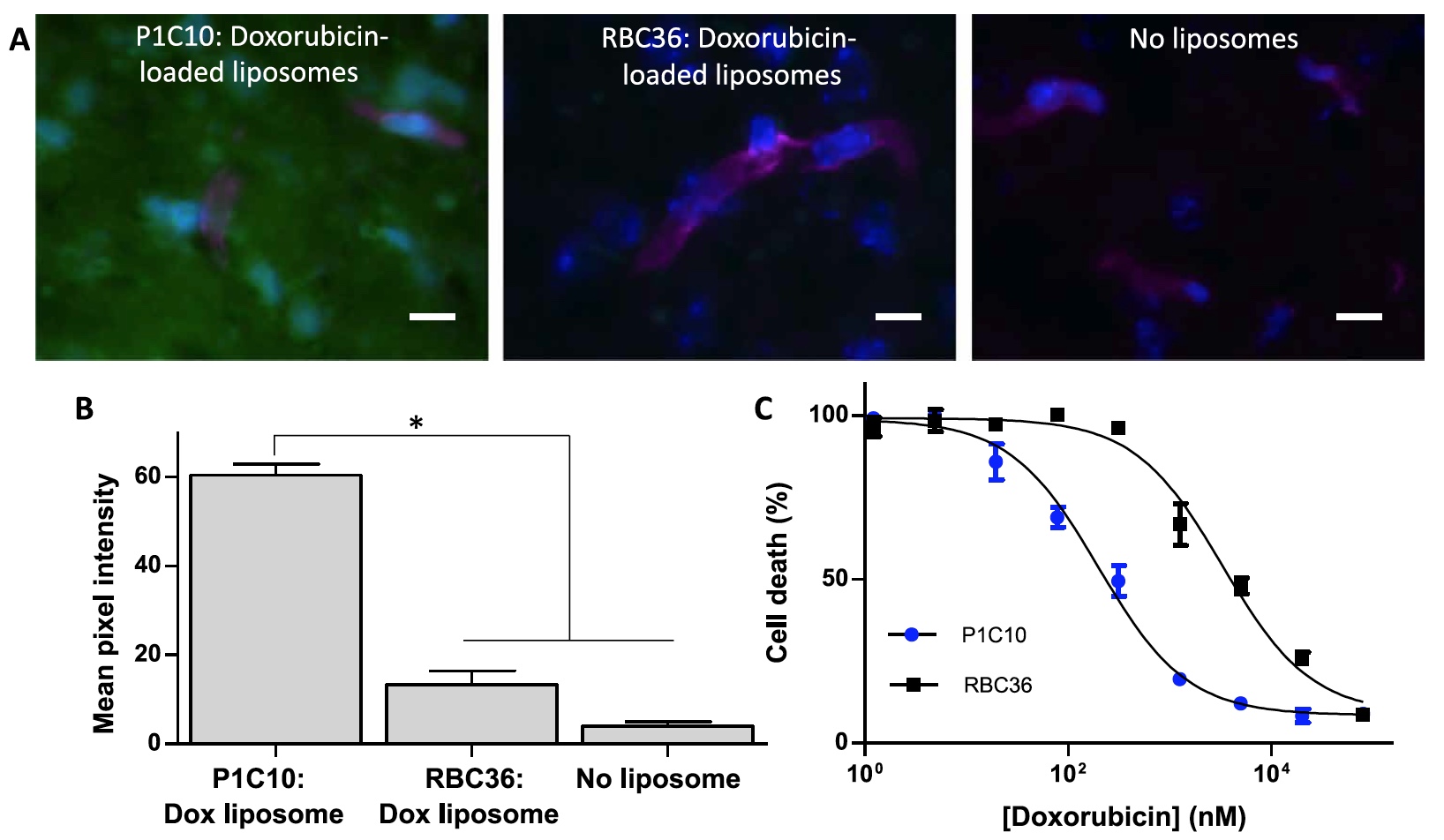 Imagen No. 5
Imagen No. 5Para demostrar la viabilidad del tratamiento de liposomas cargados de doxorrubicina dirigidos a VLR, se incubaron células tumorales U87 (cultivadas en bEnd.3 ECM) con liposomas cargados de doxorrubicina dirigidos a P1C10 o RBC36.
Las observaciones mostraron un crecimiento significativo en las células destruidas por los liposomas dirigidos a P1C10. La concentración efectiva media máxima fue 199.0 ± 1.7 nM para P1C10 y 3312.0 ± - 2.6 para RBC36.
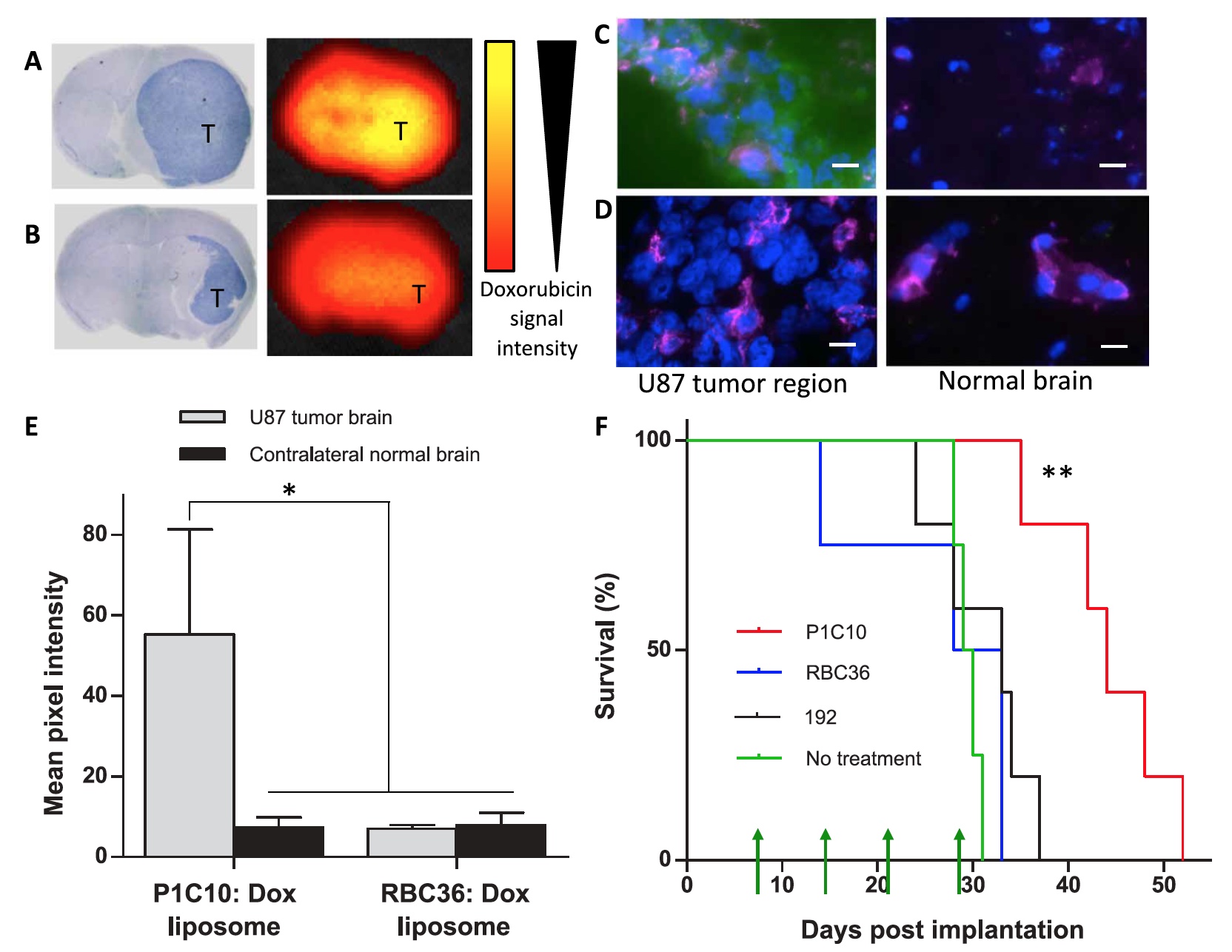 Imagen No. 6
Imagen No. 6Y finalmente, los científicos probaron la potencial utilidad terapéutica de atacar una matriz extracelular del cerebro patológicamente dañada. Para esto, se usaron liposomas cargados de doxorrubicina en combinación con P1C10, 192 o RBC36 en ratones experimentales con células cancerosas U87.
Como se puede ver en las imágenes
6a y
6b , la señal de doxorrubicina es mucho más fuerte cuando se usa P1C10. Se puede ver que esta señal está suficientemente localizada dentro del tumor y no afecta la región contralateral (sana) del cerebro.
Las imágenes
6c y
6d demuestran que la acumulación de P1C10 en la región tumoral es 7,6 veces mayor que en la región sana. Si comparamos el grado de acumulación de P1C10 con RBC36, entonces la diferencia es 7.9 veces a favor de P1C10.
Durante 4 semanas (los días 7, 14, 21 y 28), se administraron 12 mg / kg de doxorrubicina a ratones experimentales con U87 usando P1C10, 192 o RBC36.
Después de la introducción del tumor, la mediana de supervivencia fue: 43 días para P1C10, 30 días para 192 y 28 días para RBC36.
Un grupo de sujetos con P1C10 mostró un aumento significativo en la supervivencia en comparación con los otros dos grupos. Al mismo tiempo, los indicadores 192 y RBC36 no difieren significativamente de los indicadores de los grupos de control que no recibieron ningún tratamiento.
Para un conocimiento más detallado de los matices del estudio, le recomiendo que consulte el
informe de los científicos .
Epílogo
No habría felicidad, pero la desgracia ayudó. Con esta frase puedes describir con bastante precisión este estudio. Los científicos utilizaron los trastornos patológicos de la barrera hematoencefálica como una herramienta para administrar medicamentos a ciertas áreas del cerebro afectadas por un tumor, evitando al mismo tiempo las áreas sanas. Y los científicos recibieron ayuda en este complejo y noble esfuerzo, como dicen, desde donde no esperaron. Las lampreas de linfocitos receptores variables (VLR) se convirtieron en la base de este trabajo. Ahora es seguro decir que incluso los parásitos pueden ser útiles.
El tratamiento de los tumores cerebrales está plagado de una enorme lista de dificultades, y el éxito de este proceso no es tan bueno como nos gustaría. La creación de nuevos métodos y medios para combatir enfermedades tan graves es realmente para lo que existe la ciencia. Al conocer el mundo que nos rodea y dentro de nosotros, no vamos en contra de la voluntad de la naturaleza, solo comenzamos a comprenderla mejor, a encontrar nuevos conocimientos y aplicarlos para el bien.
Viernes off-top:
Desert Seas (2011, voz en off - David Attenborough) es un documental sobre dos ecosistemas submarinos adyacentes diferentes.
Gracias por su atención, tengan curiosidad y tengan un gran fin de semana a todos, muchachos. :)
Gracias por quedarte con nosotros. ¿Te gustan nuestros artículos? ¿Quieres ver más materiales interesantes?
Apóyenos haciendo un pedido o recomendándolo a sus amigos, un
descuento del 30% para los usuarios de Habr en un análogo único de servidores de nivel de entrada que inventamos para usted: toda la verdad sobre VPS (KVM) E5-2650 v4 (6 núcleos) 10GB DDR4 240GB SSD 1Gbps de $ 20 o cómo dividir el servidor? (las opciones están disponibles con RAID1 y RAID10, hasta 24 núcleos y hasta 40GB DDR4).
VPS (KVM) E5-2650 v4 (6 núcleos) 10GB DDR4 240GB SSD 1Gbps hasta el verano de forma gratuita al pagar por un período de seis meses, puede ordenar
aquí .
Dell R730xd 2 veces más barato? ¡Solo tenemos
2 x Intel TetraDeca-Core Xeon 2x E5-2697v3 2.6GHz 14C 64GB DDR4 4x960GB SSD 1Gbps 100 TV desde $ 199 en los Países Bajos! Dell R420 - 2x E5-2430 2.2Ghz 6C 128GB DDR3 2x960GB SSD 1Gbps 100TB - ¡desde $ 99! Lea sobre
Cómo construir un edificio de infraestructura. clase utilizando servidores Dell R730xd E5-2650 v4 que cuestan 9,000 euros por un centavo?