
¿Qué recordamos con la frase "ciencia ficción"? Por supuesto, robots, autos voladores, el estudio de rincones del Universo previamente inexplorados, extraterrestres y toda una serie de tramas. Entre ellos, un lugar especial siempre ha estado ocupado por el tema de establecerse en otro planeta, ya sea por la confianza en la inevitabilidad de la propia muerte o por el deseo de cambiar radicalmente la situación. El primer contendiente por el título de Earth 2.0 siempre ha sido Marte, frío y sin vida. Por el momento, aún no es posible hacer las maletas y volar a Marte de vacaciones durante dos semanas, pero esto es absolutamente realista y factible, la pregunta es qué tan pronto. La desventaja más notable de Marte (con la excepción de la falta de un Internet normal) es la falta de una atmósfera aceptable para la vida. Para volar al destino, salga del avión y respire profundamente, sintiendo toda la frescura del aire local, no se trata de Marte. Pero esto no siempre será así.
Hoy nos reuniremos con usted en un estudio que describe un nuevo método para generar oxígeno a través de una reacción química inusual. ¿Cómo produjeron los científicos oxígeno molecular a partir de CO
2 , qué tan efectivo es este método y dónde se puede usar aparte del viaje interplanetario? Buscaremos respuestas a estas preguntas en el informe de los científicos. Vamos
Base de estudio
Una persona necesita solo tres cosas para la vida: comida, agua y aire, en los cuales habrá suficiente oxígeno. Estas son nuestras necesidades principales (sí, Internet no está en esta lista). Pero el oxígeno simplemente no se encuentra en el camino, especialmente fuera de nuestro querido planeta. Por lo tanto, si queremos ir a algún lugar, debemos llevarlo con nosotros y usar varios dispositivos para limpiar el aire y reutilizarlo. Toda esta alegría ocupa muchos lugares, y tarde o temprano el oxígeno se agotará. Y reponer reservas en el espacio o en Marte será, por decirlo suavemente, problemático.
Sin embargo, relativamente recientemente, los científicos descubrieron una cantidad bastante grande de oxígeno en el cometa 67P / CG6, lo que los llevó a hacer una pregunta muy obvia: ¿de dónde vino? El oxígeno en cuerpos como los cometas es el resultado de una reacción abiótica que ocurre en condiciones extremas, durante las cuales se produce H
2 O, CO
2 , CO, etc. Se libera O
2 (oxígeno). Los científicos afirman que tales reacciones pueden explicar la presencia de oxígeno en los cometas, la atmósfera superior de Marte y en la atmósfera temprana de la Tierra. Una persona puede usar una reacción química para producir O
2 a partir de CO
2 , lo que hará que Marte sea adecuado para la vida.
Si es muy exagerado y breve, entonces la reacción mencionada anteriormente es la descomposición de CO
2 en componentes: C + O
2 . En otras palabras, disociación.
La disociación de CO
2 puede tener lugar en varios escenarios dependiendo de la energía disponible para la reacción. La disociación parcial de CO
2 → CO + O (5.43 o 7.56 eV) requiere la menor energía. También hay una disociación completa de CO
2 → C + O + O, que requiere 16.46 eV. Y, la disociación más curiosa y exótica es cuando el CO
2 se descompone en C y O
2 . Los cálculos muestran que se produce una reacción similar en la superficie de la energía potencial del estado fundamental, formando primero un compuesto cíclico de CO
2 intermedio [c-CO
2 (
1 A
1 )], que luego se transforma en un COO intermedio colineal (
1 Σ
+ ) en el camino hacia la disociación en C + O
2 .
Tal reacción es posible si la molécula está "doblada" de modo que los dos átomos de O se acerquen lo más posible entre sí. Esto requiere 6 eV de energía interna. Y, debes admitir, no importa cuán fuertes los hombres doblen las barras de metal, será mucho más difícil doblar una molécula.
Las transiciones a estados electrónicamente excitados y aniónicos de CO
2 pueden ayudar a doblar la molécula. Los científicos recuerdan que los experimentos recientes de sus colegas han demostrado que el uso de la fotoexcitación VUV (ultravioleta al vacío) y la adición de electrones permite la disociación de CO
2 a C (
3 P) + O
2 (X
3 Σ
g -). Sin embargo, nadie ha estudiado previamente este proceso exótico a un nivel suficientemente detallado. Y todo porque como resultado de tales experimentos no se encontraron productos de O
2 ionizados. Pero, como sabemos, no encontrar algo no significa que no lo sea en absoluto.
Por lo tanto, en el estudio que estamos considerando hoy, los científicos aplicaron métodos de dispersión del haz de iones junto con modelos matemáticos para demostrar una nueva forma de activar la reducción directa de CO
2 a O
2 con la detección de productos de O
2 ionizados. Este proceso contiene una vía de reacción intramolecular previamente desconocida que ocurre durante colisiones activas de iones y la superficie de CO
2 . Lo más sorprendente es la falta de dependencia de esta reacción en la naturaleza y la temperatura de la superficie.
Resultados de la investigación
En primer lugar, los científicos demuestran la formación de O
2 en colisiones hipertérmicas de CO
2 + / Au al trazar la distribución de energía cinética de tres productos de iones moleculares dispersos (CO
2 + , O
2 + y O
2 - ) para diferentes energías incidente de CO
2 + (E
0 ) . A E
0 <80 eV, se detectó una señal muy débil de CO2 disperso (
1a , gráfico a la izquierda).
 Imagen No. 1
Imagen No. 1La energía máxima del CO
2 + saliente
es proporcional a E
0 , es decir, hay un rebote balístico o pulsado desde la superficie, lo que excluye la pulverización física. Los científicos creen que observar una señal "dinámica" de CO
2 + es crucial porque es evidencia de que algo de CO
2 sobrevive a una colisión en la superficie. Además, es posible determinar la secuencia de colisiones de átomos constituyentes. Además de CO
2 + , también se observaron señales de iones de O
2 dispersos (
1b ,
1c / gráfico en el centro y a la derecha). En este caso, las energías del O
2 + y O
2 liberado representan una gran fracción de la energía de las partículas incidentes (57%) y aumentan uniformemente en paralelo a E
0 en un rango más amplio que el CO
2 + disperso. La señal máxima de iones O
2 se observó a E
0 ~ 100 eV.
Los investigadores consideran sorprendente el descubrimiento de productos iónicos de O
2 , ya que ni la atomización de la superficie de O
2 ni la abstracción del átomo de O pueden explicar la formación de estos iones. Y todo porque ambos mecanismos producirían O
2 a energías de salida mucho más bajas que las observadas. Es lógico suponer que la disociación de CO
2 está involucrada aquí.
La disociación parcial y completa de CO
2 está en buen acuerdo con otros productos iónicos detectados (CO
+ , CO
- , O
+ , O
- y C
+ ). Y la energía del CO
+ , CO
- y O
- saliente cambia en paralelo con la energía de las partículas incidentes, lo que es consistente con la formación dinámica en una colisión superficial.
Pero los picos O
+ y C
+ muestran una dependencia extremadamente pequeña de E
0 , lo que indica un origen diferente, es decir, la pulverización. La confirmación de la disociación completa son productos C
+ dispersos, que se manifiestan a E
0 > 80 eV.
Luego, los científicos usaron cinemática para describir el mecanismo de dispersión.
La teoría binaria de colisiones (BPS) nos permite calcular el factor cinemático, definido como la fracción de la energía de las partículas incidentes, retenida por el producto disperso que sale de la superficie. En el modelo más simple, el CO
2 + se dispersa como una molécula completa, es decir como una esfera sólida con una masa atómica de 44 Da. En este caso, el BPS predice un coeficiente cinemático de 0.6349, que está bastante débilmente correlacionado con los datos (
2a ).
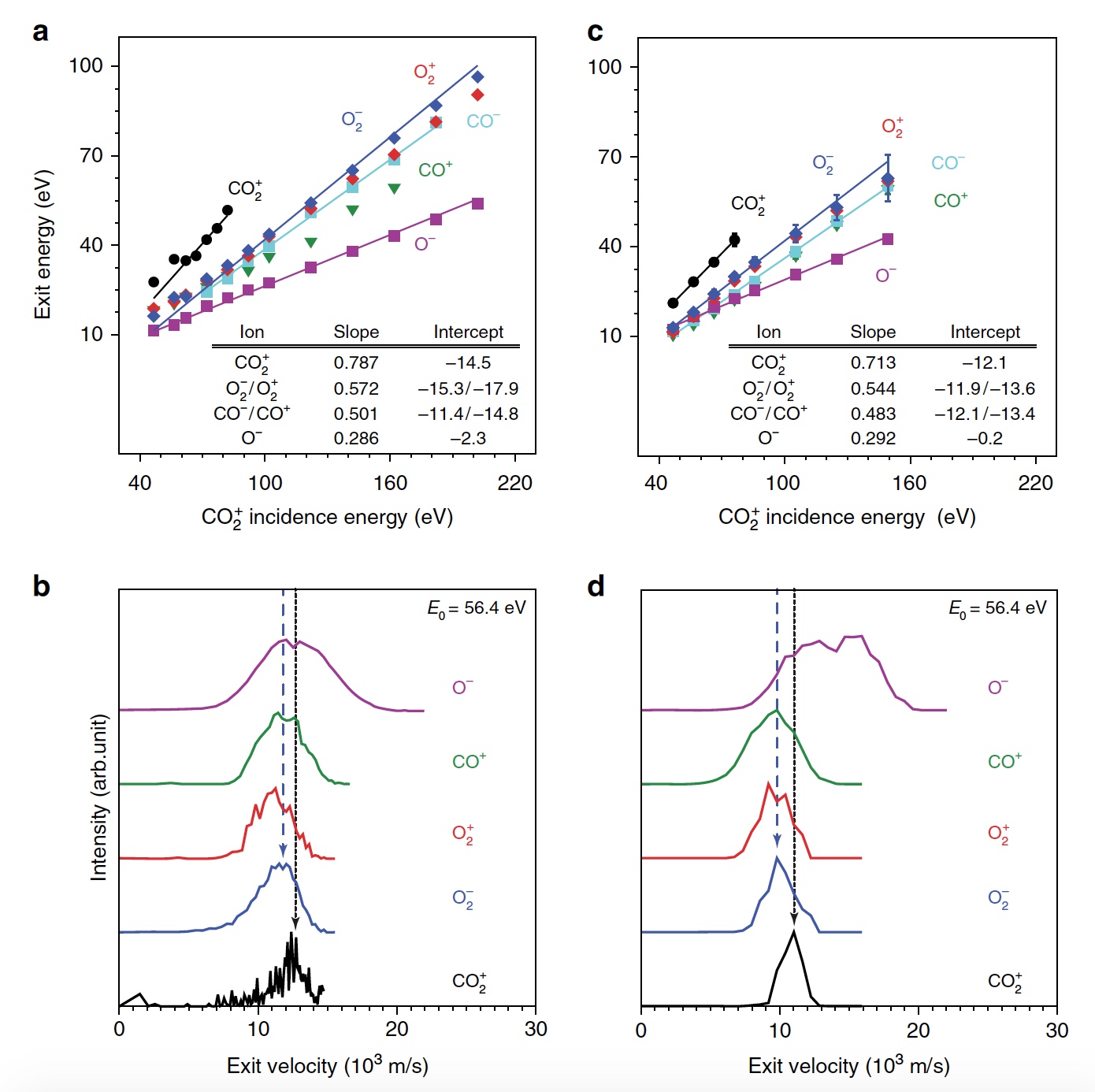 Imagen No. 2
Imagen No. 2Después de eso, los científicos aplicaron un modelo en el que el átomo de O colisiona primero con el átomo de Au de la superficie, y luego se produce la segunda colisión del fragmento de CO sin una disociación rápida de la molécula de CO
2 . La aplicación de BPS a este modelo de colisiones sucesivas da un coeficiente cinemático de 0.7870, que está en excelente acuerdo con los datos de energía del CO2 saliente (línea negra en
2a ). El gráfico
2a también muestra las energías de otros productos iónicos dispersos salientes.
La principal fuente potencial de tales productos puede denominarse disociación parcial o completa de CO
2 y pulverización superficial de fragmentos de CO
2 adsorbidos. A pesar del hecho de que se observa algo de pulverización catódica a valores altos de E
0 (> 140 eV), un análisis cinemático de los datos sobre la energía de las partículas salientes proporciona evidencia convincente de la presencia de una disociación pulsada precisa de la molécula de CO2.
A continuación, los científicos realizaron un análisis de la velocidad de las partículas dispersas observadas.
La figura
2b muestra una comparación de los picos de la distribución de iones en E
0 = 56.4 eV. Como podemos ver, las tasas de salida de CO
+ disperso, O
2 + , O
2 - y la parte más lenta de la distribución O
- se superponen, lo que indica un origen común. Sin embargo, la distribución de O
es notablemente más amplia, extendiéndose a velocidades de salida más altas, lo que puede indicar un origen alternativo. Los productos de iones de O
2 salen a velocidades inferiores a las de CO
2 + debido a la inelasticidad debido a la ruptura de los enlaces químicos y la ionización de superficie no resonante.
El análisis cinemático anterior, dicen los científicos, ha proporcionado evidencia concluyente de que algunas moléculas de CO
2 están dispersas intactas después de una colisión secuencial de dos pasos de fragmentos de O y CO. Sin embargo, aún quedan preguntas sobre varios aspectos del mecanismo de formación de O
2 .
Después de los experimentos, quedan varias preguntas. Primero, no está claro si el O
2 es producido por el mecanismo electrónico adiabático o no adiabático. En segundo lugar, se desconocen los caminos de colisión que subyacen a la distribución de la velocidad a la salida de los fragmentos iónicos. En tercer lugar, no se sabe cuánto O
2 neutro
se forma .
En este caso, el modelado puede aclarar la situación, a saber, el método clásico de dinámica molecular (método MD).
Para simular la trayectoria de dispersión de CO
2 en Au (111), se aplicó la geometría de dispersión observada en el experimento. Se supone que el CO
2 se libera en la superficie de la energía potencial de un electrón singlete en el caso de la neutralización de los iones de CO
2 + entrantes antes de una colisión fuerte.
La neutralización rápida ocurre a través del túnel resonante de electrones desde la superficie del metal hacia el catión molecular, ya que el nivel molecular de CO
2 (-13.8 eV) está dentro de la zona de Au ocupada (de -5.3 a -15.3 eV). En la simulación, también se tuvieron en cuenta las transferencias de electrones desde / hacia la superficie para tener en cuenta la ionización de productos de colisión neutrales.
La imagen
2c muestra los valores de energía calculados de las partículas salientes.
Se encontró que una pequeña cantidad de CO
2 mantiene la integridad a E
0 > 80 eV, lo que es consistente con la ausencia de una señal a estas energías durante los experimentos prácticos. Los datos obtenidos a través del modelado están en excelente acuerdo con los datos experimentales, que son fáciles de ver comparando los gráficos
2a (experimento) y
2c (simulación).
Además de este acuerdo entre experimentos y modelado, también se manifiesta en una comparación de la tasa de iones de salida en E
0 = 56.4 eV (
2d ). Tanto el modelo como el experimento muestran una expansión de la distribución de las velocidades de CO
+ y O
- . También se ha confirmado que las distribuciones de O
2 + y O
2 - son similares al catión que sale más lentamente que el anión. Además, en ambos casos, se descubrió que el CO
2 + emerge a una velocidad mayor que los productos de O
2 ionizados.
Por lo tanto, el uso de esta técnica de modelado puede proporcionar datos bastante precisos sobre el mecanismo de reacción de la conversión directa de CO
2 a O
2 .
Durante la etapa principal de la simulación, se recrearon 20,000 trayectorias de colisión de CO2 en Au a diferentes energías de las partículas salientes. Como resultado, se obtuvieron varias variantes de productos de disociación, incluyendo O
2 (
3a ).
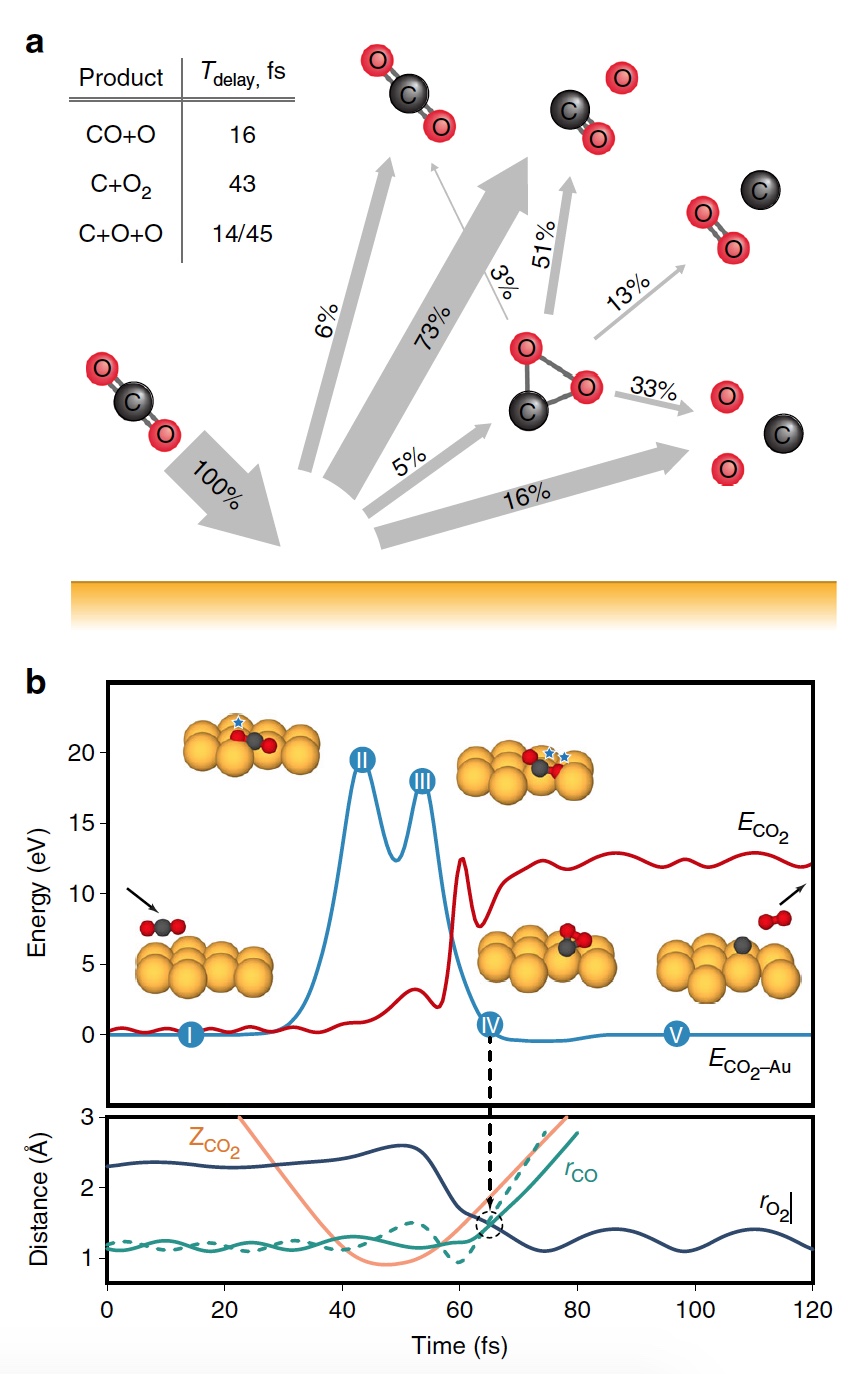 Imagen No. 3
Imagen No. 3La figura
3b muestra una trayectoria representativa que da como resultado la formación de O
2 . Como resultado de la transferencia de energía pulsada durante una colisión, se produce un reordenamiento intramolecular significativo dentro del CO2 que rebota. La distancia O - O disminuye, y la distancia C - O aumenta, alcanzando un pico cuando el CO
2 adquiere una configuración triangular con longitudes de enlace casi iguales. Tal producto intermedio de CO
2 fuertemente doblado tiene una cantidad significativa de energía interna y se disocia rápidamente, lo que resulta en la formación de un átomo de C libre y una molécula de O
2 vibracionalmente caliente.
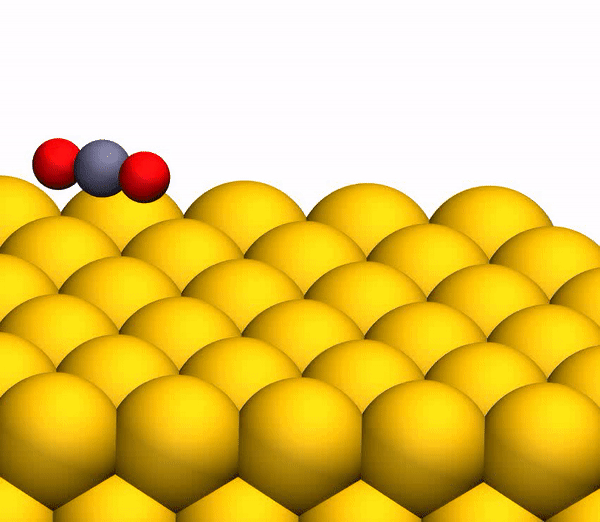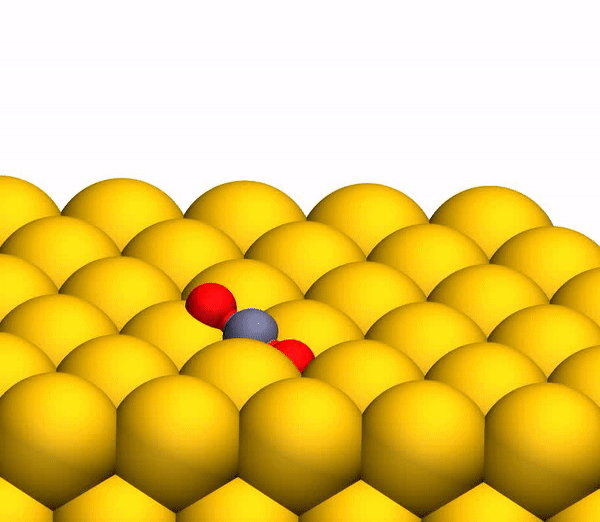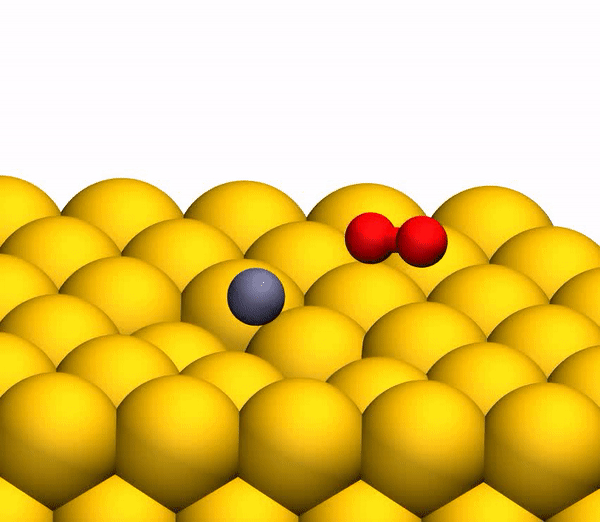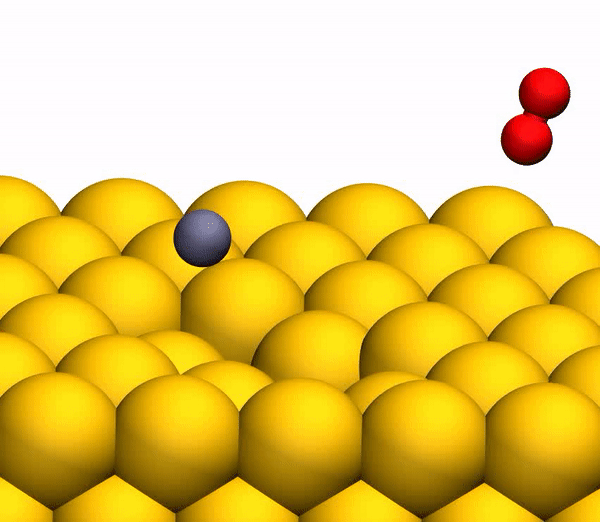 El proceso de separación de CO 2 en un átomo de C libre y una molécula de O 2 vibracionalmente caliente.
El proceso de separación de CO 2 en un átomo de C libre y una molécula de O 2 vibracionalmente caliente.Vale la pena señalar que el mecanismo de separación descrito anteriormente es totalmente coherente con las conclusiones del modelo cinemático utilizado anteriormente.
Los cálculos mostraron que aproximadamente el 5% de todas las trayectorias conducen a un estado intermedio fuertemente doblado de CO
2 , que es una de las etapas de la extracción de O
2 . Esta condición se fragmenta principalmente a través de una disociación parcial (51%), después de lo cual se produce una disociación completa nuevamente, pero con un resultado más alto (33%).
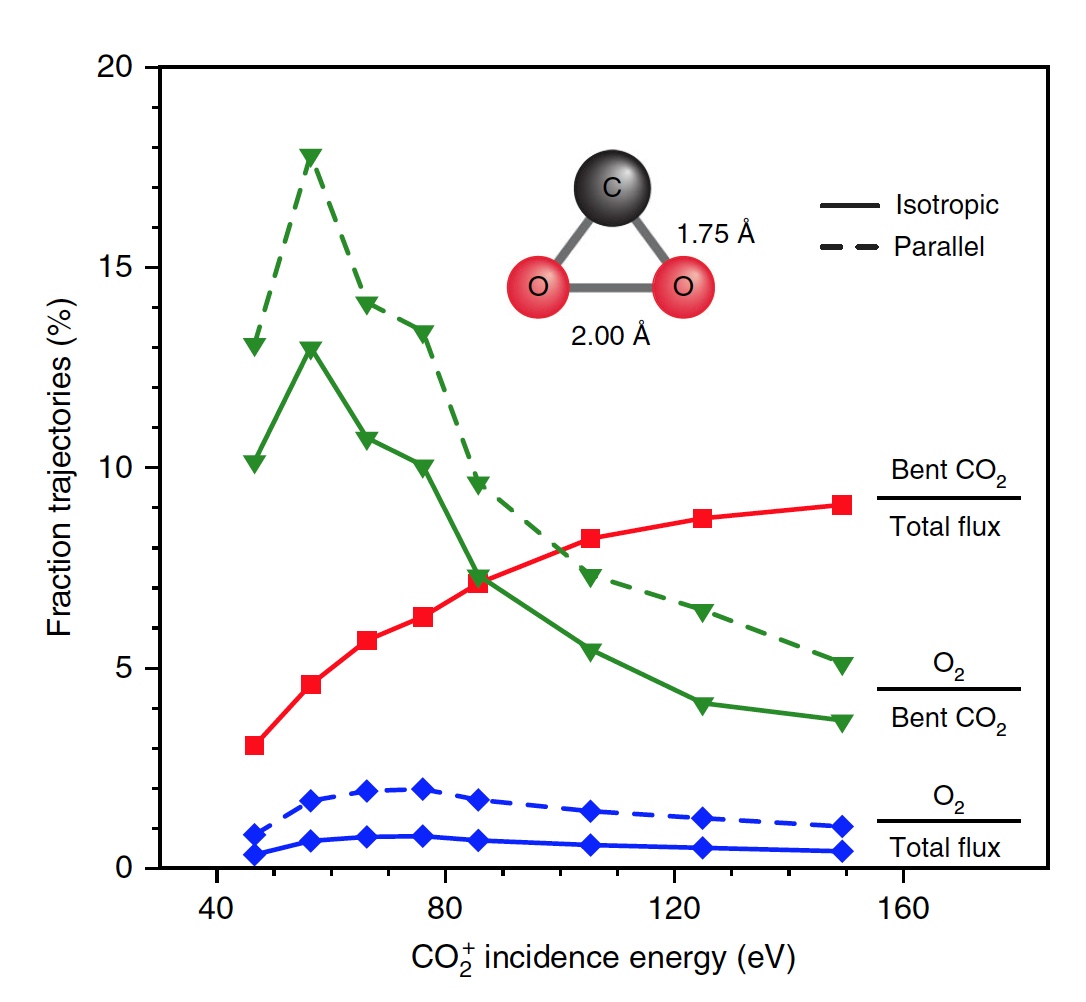 Imagen No. 4
Imagen No. 4Los científicos señalan que de todas las moléculas curvas de CO
2 , solo el 13 por ciento produce oxígeno. Es decir, el resultado general de la disociación de CO
2 → C + O
2 es 0.6% a E
0 = 56.4 eV. Si aumenta la energía de las partículas incidentes, puede obtener O
2 hasta 0.8 ± 0.2% a E
0 ~ 70 ± 15 eV (línea azul en la imagen No. 4).
Además, la fracción de trayectorias formadoras de O
2 aumenta significativamente cuando se alcanza un estado intermedio fuertemente doblado de CO
2 (línea verde), alcanzando un máximo del 13% a E
0 ~ 55 ± 10 eV. El menor rendimiento total de O
2 neutro se debe al hecho de que solo una pequeña fracción de las moléculas lineales de CO
2 alcanza un estado fuertemente doblado (línea roja). Si cambia específicamente la orientación de las moléculas de CO
2 entrantes (eje paralelo a la superficie), como resultado, puede obtener un 2% más de O
2 (línea verde discontinua).
Para un conocimiento más detallado de los matices del estudio, le recomiendo que consulte el
informe de los científicos .
Epílogo
Este trabajo ha demostrado que a través de reacciones químicas no estándar es posible obtener oxígeno del dióxido de carbono. Nadie argumentará que tal técnica requiere más refinamientos y mejoras. Sin embargo, el hecho de que este trabajo realmente abre nuevas posibilidades para el viaje interplanetario, la colonización de Marte, y no solo no se puede negar. También hay un problema con el oxígeno y el dióxido de carbono en nuestro planeta. Más bien, con este último, su volumen ha aumentado significativamente desde la industrialización. Y teniendo en cuenta que el CO
2 es uno de los principales culpables del calentamiento global, reducir su cantidad y obtener oxígeno parece una idea muy tentadora. Como todavía no podemos prescindir de fábricas, fábricas, automóviles con motores de combustión interna y otras cosas, los nuevos métodos de limpieza de nuestra atmósfera no solo son necesarios, sino extremadamente necesarios. Para viajar a planetas distantes es ciertamente genial, pero antes del traslado masivo a Marte todavía está muy, muy lejos, por lo tanto, vale la pena pensar más en la Tierra en la que vivimos que en Marte, con el que soñamos.
¡Gracias por su atención, sigan curiosos y tengan una buena semana de trabajo, muchachos! :)
Gracias por quedarte con nosotros. ¿Te gustan nuestros artículos? ¿Quieres ver más materiales interesantes?
Apóyenos haciendo un pedido o recomendándolo a sus amigos, un
descuento del 30% para los usuarios de Habr en un análogo único de servidores de nivel de entrada que inventamos para usted: toda la verdad sobre VPS (KVM) E5-2650 v4 (6 núcleos) 10GB DDR4 240GB SSD 1Gbps de $ 20 o cómo dividir el servidor? (las opciones están disponibles con RAID1 y RAID10, hasta 24 núcleos y hasta 40GB DDR4).
Dell R730xd 2 veces más barato? ¡Solo tenemos
2 x Intel TetraDeca-Core Xeon 2x E5-2697v3 2.6GHz 14C 64GB DDR4 4x960GB SSD 1Gbps 100 TV desde $ 199 en los Países Bajos! Dell R420 - 2x E5-2430 2.2Ghz 6C 128GB DDR3 2x960GB SSD 1Gbps 100TB - ¡desde $ 99! Lea sobre
cómo construir infraestructura clase utilizando servidores Dell R730xd E5-2650 v4 que cuestan 9,000 euros por un centavo?