
Fuera de la ventana brilla el sol brillante, el aire está lleno de humedad cálida y la brisa fresca y fría decidió tomarse unas vacaciones, dejándonos al calor desgarrado. Quiero cambiar mis jeans a pantalones cortos, una computadora portátil a una pelota de voleibol y una oficina a la playa. El verano está asociado con días festivos y vacaciones, pero a veces un invitado que generalmente esperamos en los meses de invierno, es decir, un resfriado, se ve incluido en esta lista inactiva. No hay nada peor que la temperatura cuando la temperatura del aire es de aproximadamente 30. En el verano, las infecciones virales respiratorias agudas convierten a una persona en un caracol, tejiendo lentamente a lo largo del asfalto caliente, dejando un rastro mucoso.
¿Puede la ciencia de rescate ayudarnos a combatir los rinovirus? Por supuesto, tal vez los científicos le responderán si descubren una nueva forma de lidiar con los rinocerontes / enterovirus ocultos en el "bolsillo" del virus previamente inexplorado. ¿Qué clase de bolsillo es este, qué quieren poner los científicos en él y cómo ayudará esto a derrotar a los rinovirus? Encontraremos las respuestas en el informe del grupo de investigación.
Base de estudio
Para empezar, recordamos rápidamente lo que tenemos ARVI y lo que realmente es.
 Visualización de rinovirus.
Visualización de rinovirus.ARVI, es decir, una infección viral respiratoria aguda, es el resultado de la actividad activa del virus en el cuerpo humano, es decir, en su sistema respiratorio. Estos virus incluyen rinovirus del género enterovirus. Una de las principales características estructurales del rinovirus es el virión abierto, es decir, una partícula de virus sin caparazón.
En los humanos, los rinovirus causan inflamación del tracto respiratorio superior, porque prefieren multiplicarse en la membrana mucosa que cubre la nasofaringe. Los síntomas en caso de infección son bastante estándar y familiares para todos: temperatura, secreción nasal, dolor en la laringe. En ausencia de tratamiento y una respuesta inmune disminuida del cuerpo, las infecciones virales respiratorias agudas pueden convertirse en bronquitis, sinusitis u otitis media.
¿Se pueden tratar y / o vacunar los rinovirus? Teóricamente posible, pero casi imposible, ya que el número de variantes serológicas del patógeno es muy grande. Las infecciones por rinovirus se tratan aliviando los síntomas, y el virus en sí mismo derrota al sistema inmunitario.
Si hablamos sobre el tratamiento de una infección viral como tal, entonces vale la pena entender el proceso de matar el virus en sí. Como regla general, esto se lleva a cabo introduciendo una droga en él, en términos generales. Por el momento, los inhibidores más estudiados son los aglutinantes de la cápside, que se colocan en el bolsillo hidrofóbico de la cápside viral.
En el estudio que estamos considerando hoy, los científicos han identificado un bolsillo previamente desconocido que está formado por las proteínas virales VP1 y VP3 y es una característica común para diferentes tipos de entero-rinovirus. La introducción del medicamento en este bolsillo estabilizará la región clave del virión, lo que evitará la expansión conformacional necesaria para la liberación de ARN viral. Por lo tanto, no mocos, tos y fiebre. De acuerdo, suena muy inspirador.
Resultados de la investigación
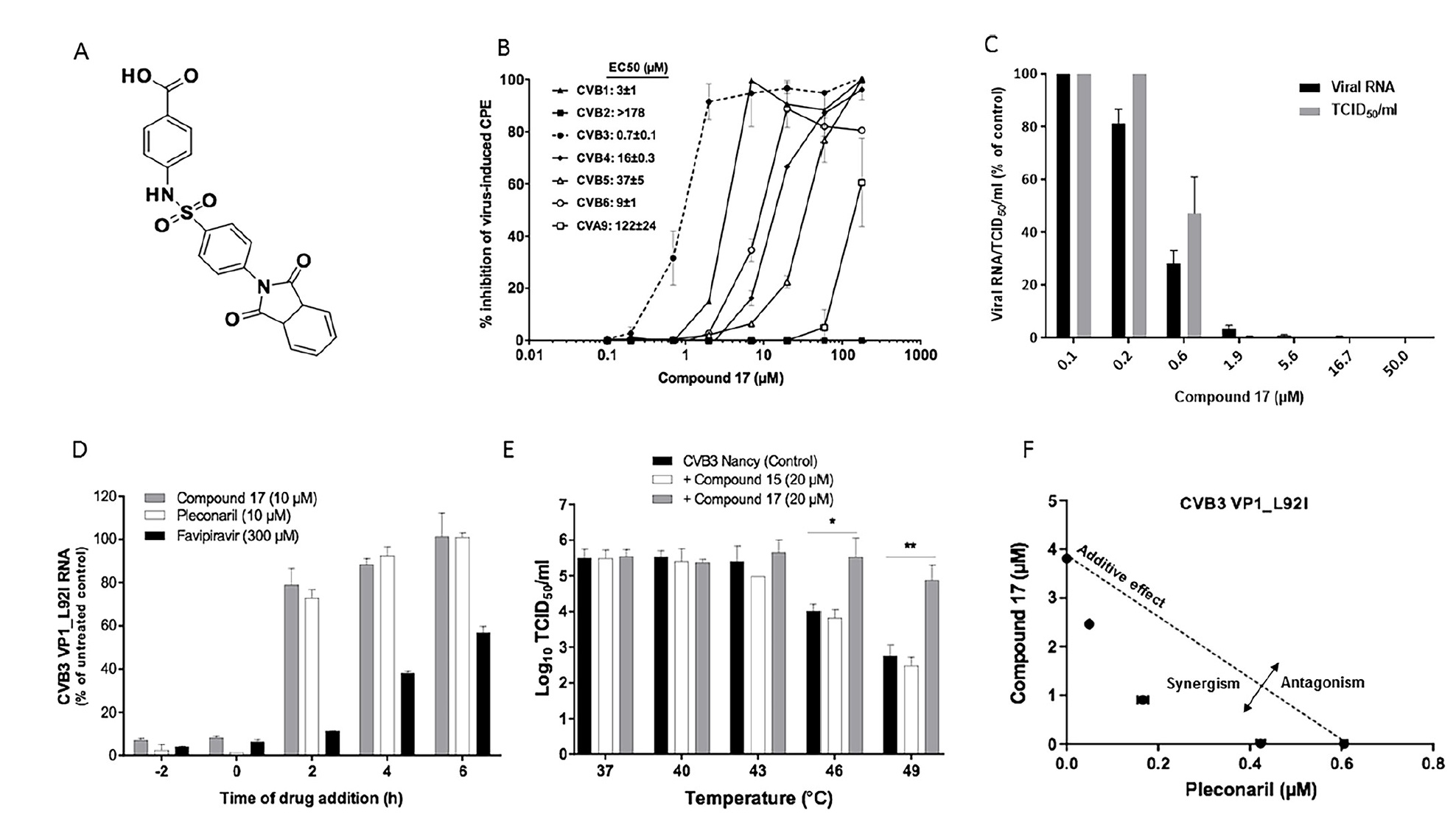 Imagen No. 1
Imagen No. 1Los científicos han descubierto que el
compuesto 17 (
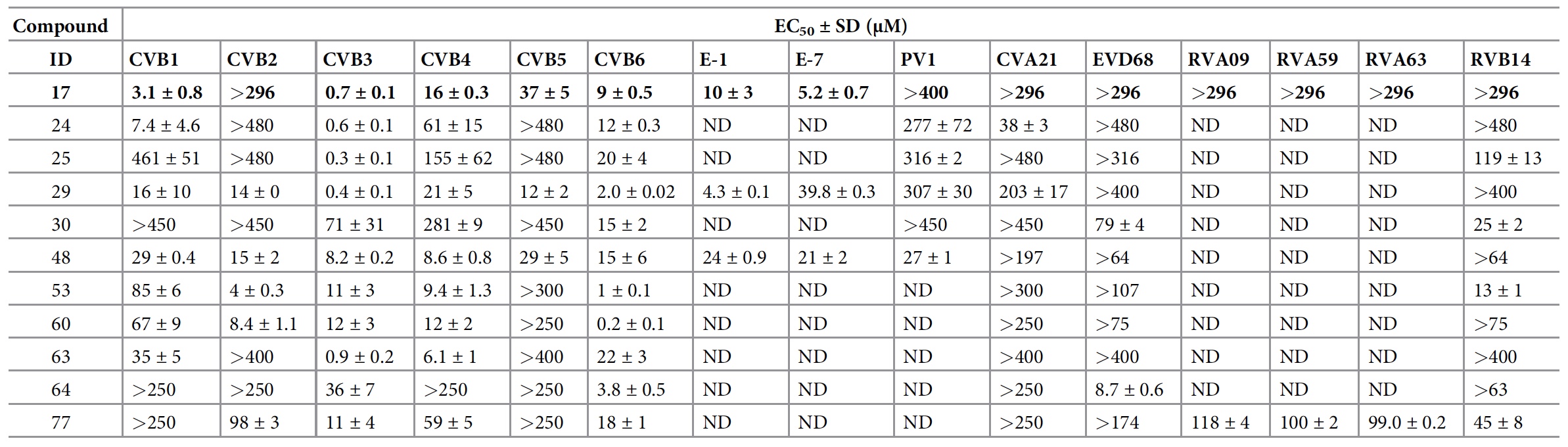
1a ), que es un derivado de la bencenosulfonamida, es un potente inhibidor de la cepa B3 del virus Coxsackie. La concentración efectiva media máxima (CE50) es 0.7 ± 0.1 μM (
1b ).
El compuesto 17 también inhibe la replicación de CVB1 y CVB6, exhibe actividad moderada contra el virus CVB4, CVB5 y Coxsackie A9 (CVA9), pero no reacciona contra CVB2 incluso a la concentración más alta probada (
1b ). Además, este compuesto no se inhibe en CVA16 y EVA71 (grupo EV-A), CVA21 y PV1 (grupo EV-C), EVD68 (grupo EV-D) y rinovirus B14 (RVB14, RV-B).
La actividad antiviral del compuesto 17 se confirmó adicionalmente en un análisis de carga viral, en el que redujo la forma dependiente de la dosis de la formación de ARN del virus CVB3 y CVB3 con valores de CE50 de 0.4 ± 0.01 μM y 1.1 ± 0.3 μM, respectivamente (
1 s ).
El compuesto 17, como pleconaril (un fármaco antiviral), se dirige a la replicación de CVB3 en las primeras etapas del ciclo viral. En el caso de la introducción del compuesto 17, 2 horas después de la infección, la actividad antiviral se reduce considerablemente (
1d ).
Los científicos nos recuerdan que los inhibidores de enterovirus en etapa temprana (p. Ej., Pleconaril) interactúan con las cápsides virales y aumentan su resistencia a la inactivación térmica. El compuesto 17 aumentó la estabilidad térmica de CVB3 en 1,5 a una temperatura de 46 ° C y en 2,1 a 49 ° C (
1e ).
Si se combinan el compuesto 17 y pleconaril, se observará una actividad antiviral sinérgica. Es decir, estas dos sustancias tienen diferentes mecanismos de acción antiviral (
1f ).
Los datos de observación nos permiten concluir que el compuesto 17 es muy adecuado para pruebas relacionadas con el bolsillo detectado en la cápside viral.
Para considerar mejor el proceso de interacción del compuesto 17 y la cápside viral CVB3, los científicos realizaron una microscopía crioelectrónica.
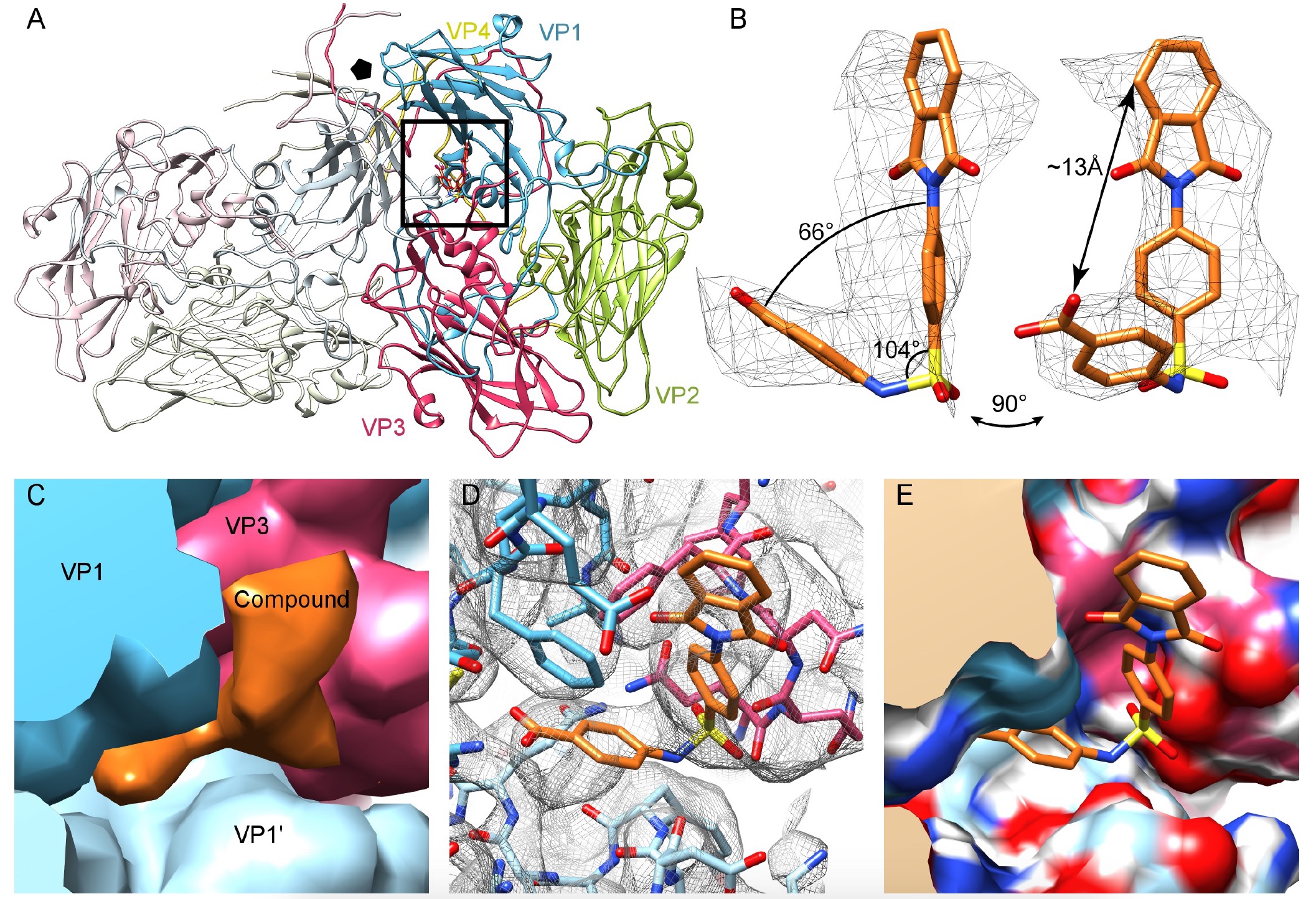 Imagen No. 2
Imagen No. 2Las cadenas laterales de la proteína de la cápside se identificaron fácilmente, y el modelo de homología Nancy CVB3 podría encajar fácilmente en el mapa del sello. Además, la cepa cryo-EM de Nancy mostró una falta de compactación del factor lipídico en la bolsa hidrofóbica de VP1. Sin embargo, un análisis de las diferencias reveló una compactación adicional, que puede asociarse con el modelo atómico del compuesto 17 (
2a ,
2c ).
Como se puede ver en la imagen 2b, el compuesto tiene una forma de L con un hombro largo y corto, lo que permite el "acoplamiento" con la conexión 17. La simulación mostró que la conexión 17 está conectada en el bolsillo por medio de dos bloques VP1 y un bloque VP3 en la interfaz del protoprotómero. Debido al tipo de simetría icosaédrica del virus, puede haber 60 regiones de este tipo en un solo caso (
2c ).
La región considerada se encuentra a una distancia de 16 Å de la bolsa hidrofóbica a la que apunta el pleconaril. Por lo tanto, el compuesto 17 no funciona en el mismo lugar que el pleconaril, es decir, sin interferir con su actividad antiviral, sino complementarlo.
Los científicos han simulado interacciones dentro de proteínas, interfaces, estructuras y compuestos, que mostraron los residuos VP1 (73, 75–78, 155–157,159–160, 219 y 234) y VP3 (233–236), que forman una bolsa (
2d y
2e ) .
Un análisis de la conservación de estos residuos de bolsillo en las 56 secuencias de aminoácidos de CVB3 mostró que 7 de 16 están completamente preservados (es decir, hay un compuesto 17 en el interior), y aproximadamente 14 residuos mostraron un resultado de 97% de conservación. La preservación de bolsillo también ocurre en todos los enterovirus del grupo B.
Sin embargo, no todos los virus son tan fácilmente susceptibles a la inhibición por el compuesto 17. Por lo tanto, era necesario comprender qué los hace tan resistentes. Para hacer esto, los científicos llevaron a cabo una selección clonal, destacando 4 mutaciones de resistencia. Tres de las cuatro mutaciones de aminoácidos se ubicaron cerca del bolsillo (F76C, E78G y A98V), y otra (D133G) estaba bastante distante.
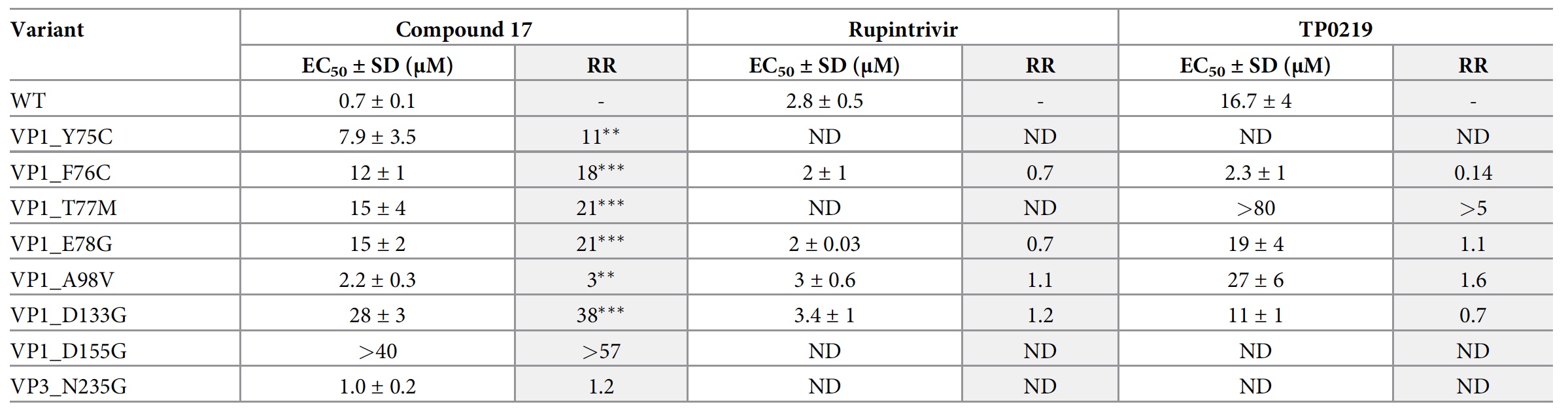 Alcance del efecto del compuesto 17, rupintrivir (inhibidor de la proteasa 3C) y TP0219 (compuesto que agota el glutatión) sobre la replicación CVB3 WT y las variantes CVB3 modificadas.
Alcance del efecto del compuesto 17, rupintrivir (inhibidor de la proteasa 3C) y TP0219 (compuesto que agota el glutatión) sobre la replicación CVB3 WT y las variantes CVB3 modificadas.Los científicos han preparado 12 mutantes CVB3 en el clon CVB3 mediante ingeniería inversa. También se creó una versión independiente de glutatión de VPB1_T77M CVB3, resistente al compuesto que agota el glutatión TP0219.
Solo ocho de los 12 mutantes eran viables (
2d ), 7 de ellos eran resistentes al compuesto 17 y reaccionaban igualmente al rupintrivir.
El examen de la única mutación resistente lejos del bolsillo ha demostrado que VP1_D133G es más resistente al calor que CVB3 Nancy, y el compuesto 17 todavía puede estabilizarlo. Es decir, VP1_D133G es una mutación compensatoria, y no una mutación que impide la unión del compuesto 17.
Pero VP1_T77 estuvo involucrado en la unión del glutatión. El análisis mostró que la variante independiente de glutatión VP1_T77M CVB3 tiene una sensibilidad reducida al compuesto 17. También se descubrió que el éster etílico de glutatión no tenía efecto sobre la actividad antiviral del compuesto 17 incluso a la concentración más alta probada.
A continuación, los científicos verificaron el grado de efecto potencial del compuesto 17 sobre la unión de los receptores virales. Para esto, se utilizaron la proteína del virus Coxsackie humano y el receptor de adenovirus (hCAR) unidos en una cadena. La afinidad de unión de CVB3 no disminuyó en presencia del compuesto 17 incluso a la concentración más alta probada. Además, el compuesto 17 era activo contra el enterovirus B
dependiente de CD55 * (virus E-11).
CD55 (factor de aceleración de descomposición del complemento) * - proteína de membrana, inhibidor del sistema del complemento.
Los datos experimentales también se confirman por el hecho de que los sitios de unión del receptor de Coxsackie + adenovirus y CD55 + CVB3 no se cruzan con la bolsa.
Por lo tanto, los científicos han descubierto que el compuesto 17 se integra perfectamente en el bolsillo de la cápside de varios virus. La siguiente etapa del estudio es verificar la efectividad del medicamento introducido en este bolsillo.
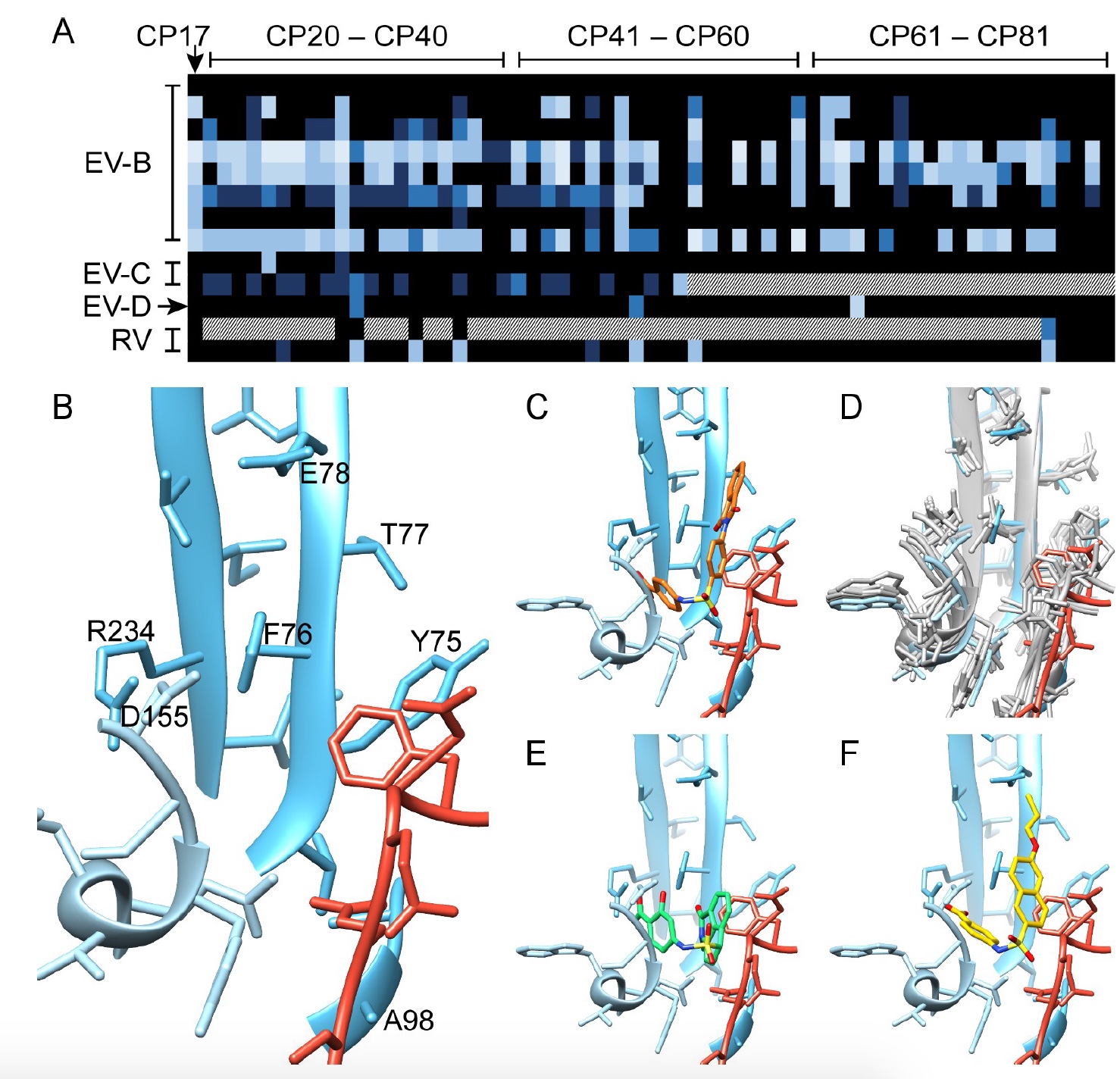 Imagen No. 3
Imagen No. 3Durante esta prueba, se utilizaron tanto sustancias disponibles comercialmente (compuestos 20–50) como modificaciones hechas en laboratorio (compuestos 51–81).
El conocimiento sobre la actividad del compuesto 17 hizo posible aislar las características específicas necesarias para la preparación futura. Los científicos analizaron información de ensayos antivirales y la usaron en la síntesis de análogos más activos del compuesto 17.
La síntesis dio como resultado análogos que fueron activos contra varios enterovirus: EV-B (CVB), EV-C (PV1 y CVA21), EV-D (EVD68), RV-A (RVA09, RVA59 y RVA63) y RV-B ( RVB14) (
3a ). Desafortunadamente, ninguno de los compuestos creados fue activo contra los virus EVA (CVA16 y EVA71).
 Compuestos con actividad potencial máxima con respecto a ciertos virus.
Compuestos con actividad potencial máxima con respecto a ciertos virus.Entre todos los análogos, los compuestos 29 y 48 fueron activos contra los 6 CVB probados (virus del grupo B de Koskashi). El compuesto 48 inhibió completamente la replicación de PV1 a una concentración de 144 μM. El compuesto 77 mostró actividad antiviral contra RV-A y RV-B.
Como se ve en la imagen No. 3, la forma de las nuevas moléculas complementa la forma del bolsillo. Los científicos pudieron establecer una clara relación estructura-propiedad (la estructura química de la molécula con su actividad biológica) del grupo carboxilo en la posición R3, donde el átomo de hidrógeno es necesario para la actividad antiviral, y en la posición R2, donde el grupo hidroxilo demuestra su beneficio para un amplio efecto antiviral. La estructuración Cryo-EM mostró que existe una complementariedad de carga entre R3 y el residuo inhibido VP1_R234.
La totalidad de los resultados de las pruebas indica un grado bastante alto de implementación de los compuestos probados en las bolsas de virus de la cápside de varios grupos.
Para conocer más detalladamente los matices del estudio, le recomiendo que consulte el informe de los científicos (
aquí o
aquí )
Epílogo
En resumen, los científicos han identificado bolsas en la estructura de los enterovirus que pueden llenarse con medicamentos que evitan la propagación del virus o lo destruyen por completo.
El personaje principal fue el compuesto 17 y sus análogos modificados, que mostraron un alto grado de actividad contra CVB3. Los bolsillos identificados son bastante similares entre sí en diferentes grupos de virus, lo que permite un mayor desarrollo de fármacos con un amplio espectro de acción.
En otras palabras, los virus que nadie ha tratado previamente ahora pueden superarse fácilmente. Por supuesto, confiar únicamente en el sistema inmune humano no es la idea más sensata, dada la cantidad de enfermedades y anormalidades que pueden interrumpir su trabajo, abriendo las puertas al cuerpo humano a una amplia variedad de virus. Tal investigación y desarrollo es extremadamente importante en nuestro tiempo, dada la población del planeta y la tasa de urbanización. Y estos indicadores afectan en gran medida la tasa de propagación de infecciones virales. Además, al tener un medicamento que puede vencer al virus en la raíz, una persona no necesita tratar cada síntoma individualmente, es decir, comprar un montón de otros medicamentos (gotas, aerosoles, tabletas, suspensiones, etc., etc.).
Los científicos continuarán su trabajo, enfocándose en encontrar compuestos que sean más efectivos contra la mayor cantidad posible de virus. Solo podemos desearles buena suerte y, hasta que hayan terminado el trabajo, luchar contra el frío por su cuenta.
Viernes off-top:No solo las personas sufren de virus, sino también computadoras y, a veces, personajes animados. ( La segunda serie está aquí).Gracias por su atención, mantenga la curiosidad, cuide su salud y tenga un gran fin de semana para todos. :)
Gracias por quedarte con nosotros. ¿Te gustan nuestros artículos? ¿Quieres ver más materiales interesantes?
Apóyenos haciendo un pedido o recomendándolo a sus amigos, un
descuento del 30% para los usuarios de Habr en un análogo único de servidores de nivel de entrada que inventamos para usted: toda la verdad sobre VPS (KVM) E5-2650 v4 (6 núcleos) 10GB DDR4 240GB SSD 1Gbps de $ 20 o cómo dividir el servidor? (las opciones están disponibles con RAID1 y RAID10, hasta 24 núcleos y hasta 40GB DDR4).
Dell R730xd 2 veces más barato? ¡Solo tenemos
2 x Intel TetraDeca-Core Xeon 2x E5-2697v3 2.6GHz 14C 64GB DDR4 4x960GB SSD 1Gbps 100 TV desde $ 199 en los Países Bajos! Dell R420 - 2x E5-2430 2.2Ghz 6C 128GB DDR3 2x960GB SSD 1Gbps 100TB - ¡desde $ 99! Lea sobre
Cómo construir un edificio de infraestructura. clase utilizando servidores Dell R730xd E5-2650 v4 que cuestan 9,000 euros por un centavo?