
Los éxitos de la oncología clínica moderna son innegables. Operaciones cada vez más complejas, nuevos medicamentos, métodos efectivos de alivio del dolor y eliminación de síntomas dolorosos. En nuestro blog
hablamos lo suficiente sobre cómo hoy es posible extender y facilitar la vida de los pacientes, incluso en las últimas etapas de la enfermedad.
Pero, sin embargo, miles de pacientes con cáncer en todo el mundo diariamente se enteran de que un tumor que ayer cedió a cierto tratamiento está creciendo nuevamente o haciendo metástasis. Los médicos se encuentran regularmente paralizados: se han probado todos los medicamentos recetados y los métodos de tratamiento, y no quedan medicamentos efectivos para este paciente.
Sin embargo, incluso se puede encontrar una salida de este callejón sin salida. Con el desarrollo de la genética y la biología molecular, los oncólogos han encontrado una nueva forma de estudiar el tumor para encontrar vulnerabilidades en él.
Para hacer esto, use las pruebas genéticas moleculares: determinar las características del ADN de las células cancerosas. El método es técnicamente complicado, costoso, requiere un conocimiento específico de un médico.
El estudio lleva 3 semanas, cuesta de 250 a 670 tr Como resultado, el médico recibe un informe de 30 páginas de información compleja, que aún debería poder usar. Pero para los pacientes que ya han dejado de tener esperanzas, esto les da tiempo de vida adicional.
En
Medicine 24/7, recurrimos regularmente a la investigación de genética molecular para tratar a una persona cuando "todos lo han intentado, nada más que hacer". Y los pacientes, que parecían no ser más para ayudar, continúan viviendo. Algunos son dos meses en lugar de dos semanas, y otros son años en lugar de un par de meses.
Hoy queremos hablar sobre cómo se realizan las pruebas genéticas moleculares, en qué casos puede ayudar al paciente y qué conocimiento da el médico.
Todos somos mutantes, esta es la norma. Pero algunas mutaciones conducen al cáncer.Las células "decentes" viven sin molestar a los demás. Utilizan una cantidad de recursos estrictamente asignada, realizan adecuadamente sus funciones biológicas y, a su debido tiempo, mueren, dando paso a las próximas generaciones (este proceso se llama apoptosis). Cada 7-10 años, el cuerpo humano se actualiza por completo.
Para hacer esto, todas las células somáticas (las que forman el cuerpo), excepto los glóbulos rojos, se dividen continuamente.
Antes de dividirse, la célula se almacena con una "copia" de la información genética hereditaria que se encuentra en su núcleo. Las cadenas de ADN "plegadas" en cromosomas dentro del núcleo se replican, es decir Doblar Y después de eso, la célula se divide, distribuyendo silenciosamente a cada una de las células hijas un conjunto idéntico de cromosomas. De una célula, dos son absolutamente iguales, y junto con su bagaje genético, cada uno de ellos obtiene "conocimiento" sobre cómo debe vivir, qué función desempeñar y cuántas veces en la vida para compartir.
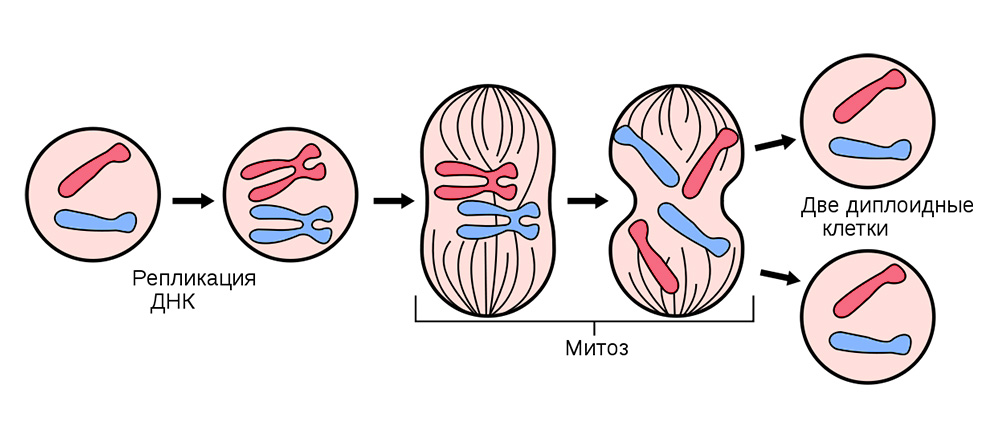 La división celular somática ocurre en todos los órganos y tejidos.
La división celular somática ocurre en todos los órganos y tejidos.A veces, en el proceso de fallas de división, resultan mutaciones. O la cadena de ADN se romperá, se copiará con un error o las secciones de los cromosomas se mezclarán. Cientos de factores pueden afectar esto: desde el estrés y el humo del tabaco hasta la exposición a la radiación.
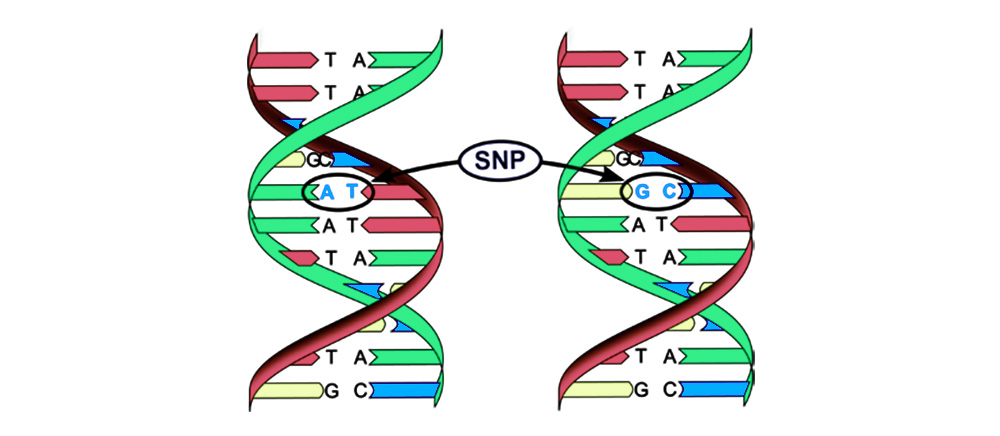
Las mutaciones se pueden dividir en 4 tipos.1. Reemplazo de un par de bases (polimorfismo
de un solo nucleótido, SNP): un nucleótido - la "letra" del código genético - cambia a otro. La estructura de la proteína codificada por esta secuencia de nucleótidos también está alterada.
 2. Aberraciones cromosómicas.Deleción
2. Aberraciones cromosómicas.Deleción : pérdida de un sitio cromosómico. Ocurren debido a la terminación de la porción terminal o la ruptura del ADN en dos lugares a la vez. Eso es todo: este gen ya no se expresa en el cromosoma.
Se pueden insertar "pedazos" de ADN en el cromosoma adyacente; se producirá una
inserción (o inversión, si la inserción se produce en el orden inverso). Algunas veces entre los cromosomas hay un "intercambio mutuo" de secciones de ADN:
translocación . El resultado es uno: se
expresan genes "extra".
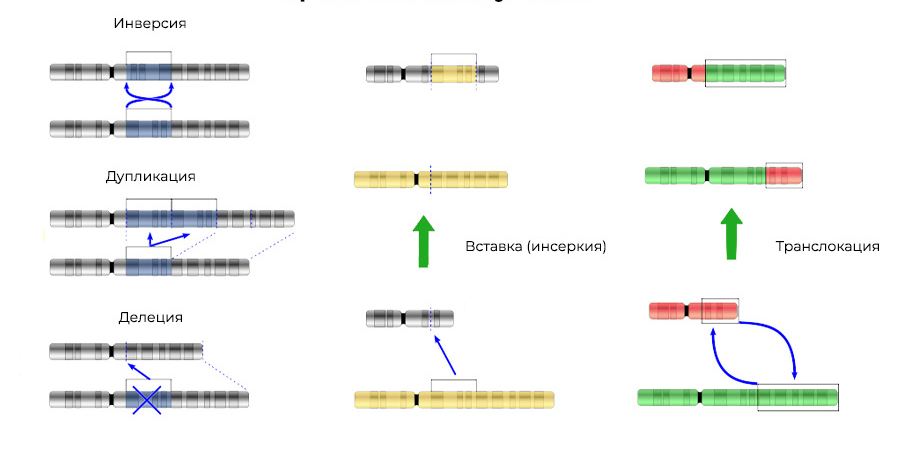 Las mutaciones cambian no solo la estructura de un sitio de ADN, sino también el orden de estos sitios3. Fusión génica
Las mutaciones cambian no solo la estructura de un sitio de ADN, sino también el orden de estos sitios3. Fusión génica : un gen se "ensambla" a partir de partes de otros genes y se expresa (dispara) como un todo. La proteína en la expresión de dicho gen quimérico también resulta ser inusual, híbrida, con propiedades nocivas.
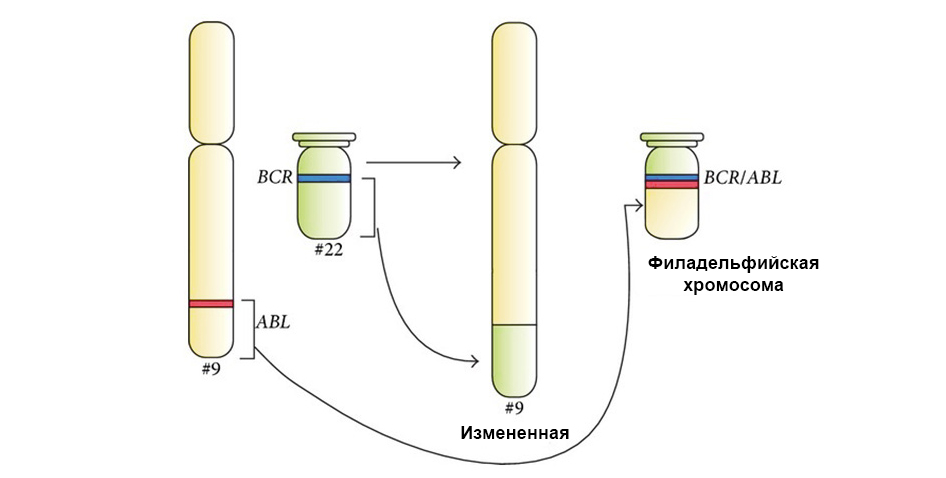 Dos genes "se unieron" durante la translocación y formaron un gen quimérico (causa leucemia)
Dos genes "se unieron" durante la translocación y formaron un gen quimérico (causa leucemia)Tenemos suerte de que el ADN esté lleno de secciones no demasiado significativas que no codifiquen nada. Muchas mutaciones ocurren en estas áreas, y resultan ser insignificantes, no tienen efecto en el trabajo posterior de las células. Y dicha célula, con una ligera diferencia con respecto al "estándar", continúa viviendo y compartiendo normalmente.
Durante 70 años, se producen 100 billones de divisiones celulares en el cuerpo humano. Esto es 1,4 trillones de divisiones por año: hay suficientes casos para acumular una "masa crítica" de errores en el ADN a lo largo del tiempo, o para que otra falla aún pueda entrar en la sección de ADN que codifica algo importante. Esto dará como resultado una mutación no inofensiva, debido a la cual la célula se volverá maligna (maligna).
Una célula maligna se distingue de un trastorno normal del ciclo celular.El ciclo celular (vida celular de división a división / muerte) está estrictamente regulado por el
trabajo de proteínas especiales: quinasas, ciclinas, factores de crecimiento y factores de transcripción : hay docenas de ellas en cada célula viva, y cada una tiene su propia función especial, pero importante.
Transmiten señales entre las células de un organismo multicelular, se activan entre sí, comienzan el proceso de división y controlan su corrección, mantienen la activación correcta de los genes, realizan sus funciones por la célula, "verifican" la integridad del genoma, "ordenan" a la célula que inicie la apoptosis si es hora de morir, y t .p.
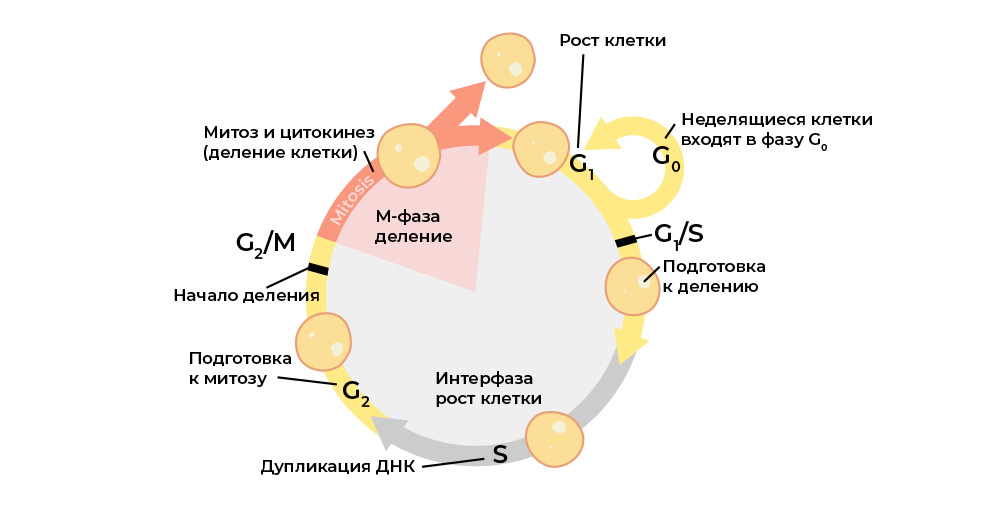 Cada etapa del ciclo celular está controlada por proteínas reguladoras.
Cada etapa del ciclo celular está controlada por proteínas reguladoras.Y cada una de estas proteínas está codificada en una
parte específica del ADN: el gen. Si dicho gen sufre una mutación dañina, "reproducirá" la proteína reguladora correspondiente de forma incorrecta. Y el regulador de proteínas "incorrecto" interrumpirá el ciclo celular y, con ello, el comportamiento de toda la célula.
Por ejemplo, el gen para la proteína reguladora de la proliferación (crecimiento de la masa celular) "se descompone", y los "mutantes" comienzan a dividirse más de lo que deberían, las células sanas se "aplastan".
Tales genes significativos, cambios en los que pueden conducir a la carcinogénesis (aparición de cáncer) son dos grandes grupos.Los protooncogenes son genes "normales" que pueden convertirse en
oncogenes debido a la mejora o el cambio en sus funciones. Los genes cuya expresión puede provocar malignidad de la célula y el desarrollo de neoplasias se denominan
oncogenes . Si se produce una mutación dañina en el protooncógeno, se convierte en un
oncógeno y puede causar un tumor.
De los que están mejor
estudiados y son escuchados ampliamente:
- EGFR, ALK, BRAF: cáncer de pulmón de células no pequeñas;
- BRAF - melanoma;
- HER2 - cáncer de mama (cáncer de mama);
- KRAS - cáncer colorrectal.
Además, las mutaciones de estos genes se encuentran en varios tipos de tumores. Por ejemplo, una mayor expresión de HER2 se encuentra no solo en el cáncer de mama, sino también en el cáncer de pulmón y estómago.
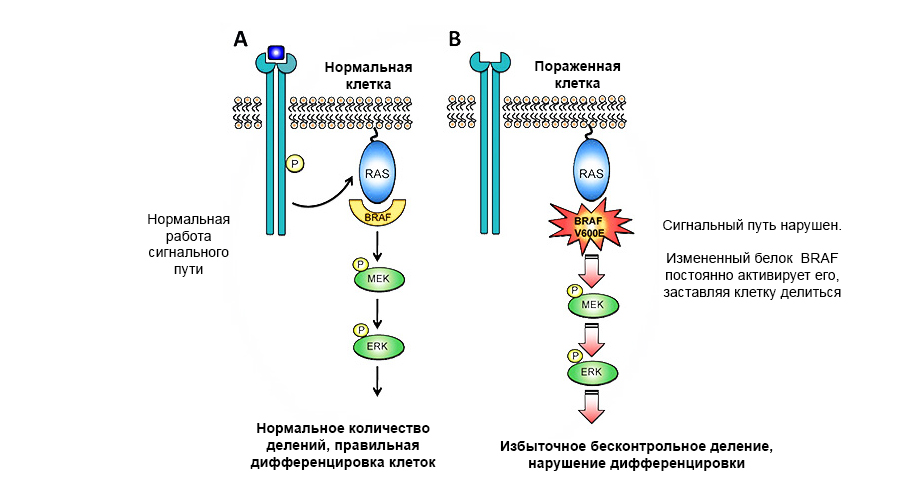 Una mutación en el protooncógeno de la proteína BRAF conduce a un crecimiento tumoral incontrolado.
Una mutación en el protooncógeno de la proteína BRAF conduce a un crecimiento tumoral incontrolado.Genes supresores de tumores (anti-oncogenes): por el contrario, pueden
suprimir el crecimiento de células tumorales o participar en la reparación (reparación) del ADN dañado. Pero la inactivación de genes supresores como resultado de mutaciones aumenta dramáticamente la probabilidad de un tumor maligno.
Por ejemplo:
- mutaciones BRCA1, BRCA2 - cáncer de las glándulas mamarias, ovarios;
- mutaciones p53: hasta el 50% de varios tipos de tumores cancerosos, incluidos sarcomas
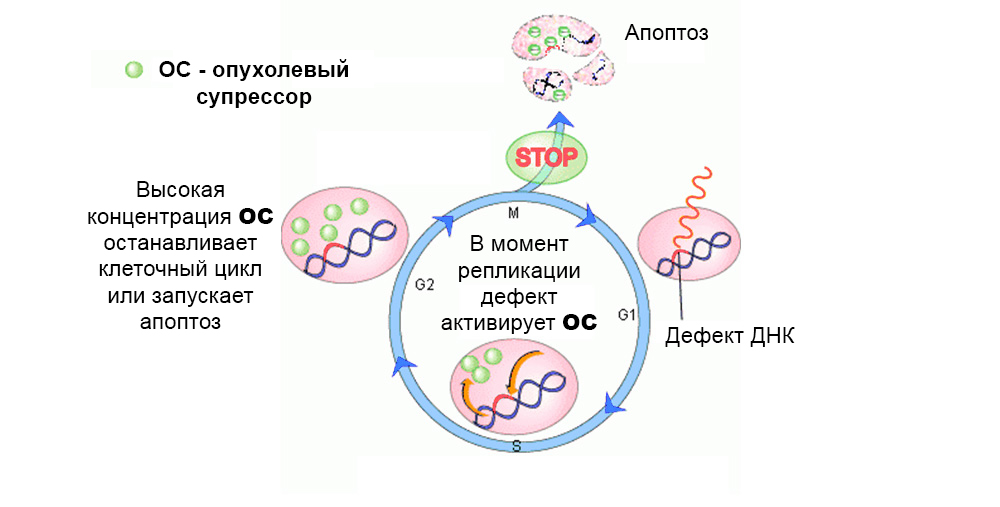 Normalmente, los mecanismos de protección actúan contra el desarrollo de células mutadas. Un defecto en el gen supresor tumoral los "apaga"
Normalmente, los mecanismos de protección actúan contra el desarrollo de células mutadas. Un defecto en el gen supresor tumoral los "apaga"En total, se estudió el efecto de varias decenas de protooncogenes y supresores tumorales sobre la carcinogénesis.
¿Por qué hay tantas dificultades y cómo prolongan la vida de los pacientes?Cada mutación encontrada en un protooncógeno o gen supresor es una causa de "superpoderes" de células cancerosas, como el descuido de la apoptosis y la capacidad de esconderse de la inmunidad. Pero al mismo tiempo, este es su punto débil potencial.
Sabiendo cuál es la razón de las peculiaridades del mecanismo de operación del tumor, uno puede encontrar una sustancia que "cuña" este mecanismo e interrumpa la cadena de reacción patológica en la célula. Es decir, mutaciones específicas en el tumor: indican el objetivo en el que los médicos "golpean" con el medicamento. Este principio ha permitido el desarrollo de
una terapia dirigida .
La terapia dirigida , el nombre de toda una rama de la terapia farmacológica eficaz para el cáncer, nació de la palabra objetivo en inglés. Los medicamentos dirigidos actúan "dirigidos" en las células cancerosas, porque solo ellos tienen mutaciones en los genes correspondientes. Las células sanas no tienen tales mutaciones, y los medicamentos no actúan sobre ellas.
La siguiente figura muestra el mecanismo de acción del medicamento dirigido Imatinib sobre las células tumorales con la mutación cromosómica Filadelfia: el gen de fusión BCR-ABL. Esta mutación lleva al hecho de que el mecanismo de apoptosis deja de funcionar en la célula: los errores en el genoma se acumulan y la célula se degenera en cancerosa.
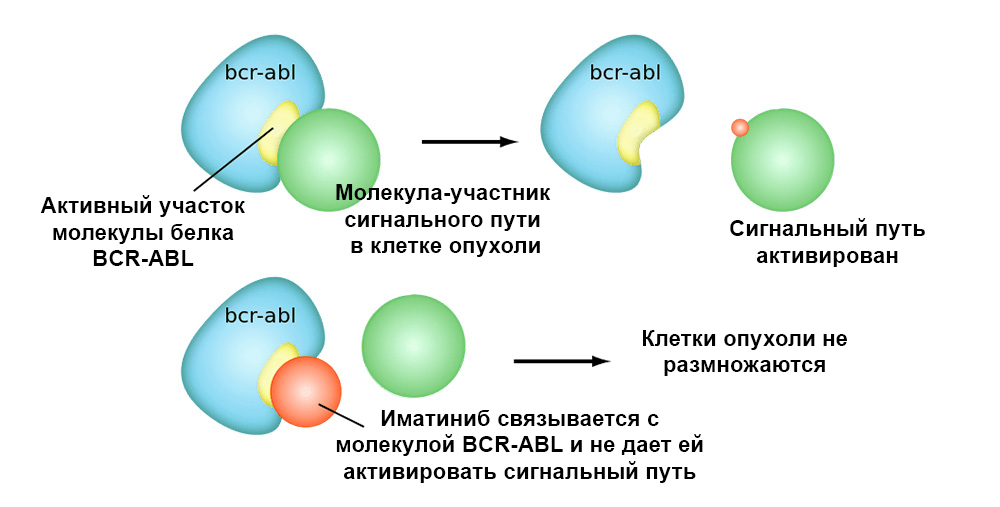 El imatinib se une al sitio activo de la molécula de proteína BCR-ABL y bloquea su capacidad de interactuar con otras moléculas en las vías de señal.Por lo tanto, los medicamentos dirigidos tienen 2 ventajas importantes sobre la quimioterapia clásica.Mayor eficiencia.
El imatinib se une al sitio activo de la molécula de proteína BCR-ABL y bloquea su capacidad de interactuar con otras moléculas en las vías de señal.Por lo tanto, los medicamentos dirigidos tienen 2 ventajas importantes sobre la quimioterapia clásica.Mayor eficiencia. La acción dirigida sobre las células tumorales permite lograr una mejor "respuesta" del tumor al tratamiento. Por ejemplo, en comparación con el tratamiento clásico, la adición del fármaco dirigido Trastuzumab junto con la quimioterapia para el cáncer de mama con sobreexpresión de HER2
aumentó significativamente la frecuencia de "respuestas" - 81% versus 73%, y la frecuencia de remisión morfológica completa (desaparición del tumor) - 43% versus 23%
Menos efectos secundarios. Quimioterapia clásica con efecto citotóxico. Esencialmente, sustancias tóxicas para matar o al menos ralentizar el crecimiento de las células cancerosas. Sobre todo, actúan sobre células que se dividen rápidamente. Es por eso que, por ejemplo, el cabello se cae: también es un tipo de células que se dividen activamente y "caen bajo la distribución". Debido a esta acción no muy específica, los medicamentos quimioterapéuticos producen efectos secundarios graves: el tracto gastrointestinal y otros órganos también sufren.
En la práctica
de la Medicina 24/7, con frecuencia prescribimos medicamentos específicos como parte de un tratamiento integral: combinamos quimioterapia, diana e inmunoterapia.
La dificultad es que cada tumor es único en su conjunto de mutaciones "objetivos"Así como cada persona tiene un código de ADN único, los tumores son únicos. Después de todo, "nacen" de las propias células del cuerpo. No hay tumores con las mismas propiedades genéticas moleculares. Por lo tanto, crear una "píldora" universal para el cáncer es fundamentalmente imposible. El cáncer es una enfermedad demasiado individual.
Pero el tratamiento para él debería ser apropiado, seleccionado individualmente para un paciente en particular, en función del hecho de que determinamos mutaciones en sus células tumorales.
En el pasado reciente, los tumores malignos solo podían clasificarse por histología, es decir, según el órgano en el que se originaron y el aspecto de las células cancerosas bajo un microscopio.
Para utilizar eficazmente la terapia dirigida, esto no es suficiente. El médico debe saber qué mutaciones hay en las células tumorales de un paciente en particular, si existen "objetivos" de biomarcadores para este o aquel medicamento. Medicina personalizada como es.
Para esto, utilizamos estudios de genética molecular. Para encontrar los "objetivos" para los cuales necesita golpear con medicamentos dirigidos e inmunotrerapeuticos, debe determinar a partir de qué genes se ensambla el ADN del tumor y qué genes en él están "rotos". Como resultado:
- aprendemos la sensibilidad del tumor a las drogas;
- averiguar si el tumor tiene resistencia a ciertos medicamentos;
- descubrir las características genéticas que dan hipersensibilidad a las drogas;
- elegiremos un nuevo tratamiento si el tumor ha dejado de responder a la terapia estándar;
detectar un tumor / metástasis en una etapa muy temprana, por fragmentos de su ADN en la sangre; - Podemos predecir un curso favorable o agresivo de la enfermedad.
La muestra suele ser el tejido tumoral, ya sea que se toma durante la operación para extirpar la lesión primaria o una biopsia: se toma una pieza microscópica del tumor con una aguja larga y delgada especial.
Puede buscar el ADN de las células tumorales en la sangre, luego necesita una llamada biopsia líquida, dos tubos de ensayo con sangre de 8,5 ml cada uno.
Durante una biopsia, a menudo encontramos el hecho de que muchos pacientes tienen miedo de tocar el tumor por completo; tienen miedo de que esto provoque que crezca. Hasta la fecha, no hay estudios disponibles que muestren dicha relación. Por supuesto, una biopsia debe realizarse correctamente. Cuando tomamos una biopsia, los médicos suelen marcar el lugar de entrada de la aguja: o hacen un pequeño tatuaje (hay un instrumento ), o ponen un soporte (quirúrgico). Si se necesita una operación más tarde, extirpan todo el curso donde estaba la aguja, desde la piel hasta el tumor, por lo que hacemos que la posibilidad de que las células cancerosas se propaguen más allá del tumor aún menos.Luego, las muestras se envían al laboratorio de estudios de genética molecular.Allí, el ADN tumoral se aísla de la muestra y se secuencia. Es decir, "leen" la secuencia de "letras" -nucleótidos. Y luego lo comparan con un panel de diagnóstico seleccionado de la base de datos de bibliotecas, genomas ya descifrados de miles de otras personas. El panel se selecciona para cada paciente, teniendo en cuenta el historial y los datos clínicos. Todo esto, por supuesto, se realiza mediante secuenciadores automáticos y una computadora.
Y si hace 20 años la "lectura" del genoma tomó meses, requirió un descifrado lento y complejo, hoy en el laboratorio con el que trabajamos, un análisis se realiza en unos pocos días hábiles.
Además, se utilizan varios métodos a la vez:
secuenciación de una nueva generación (NGS), secuenciación de Sanger y el método de hibridación de fluorescencia (FISH) . Juntos, le permiten leer la secuencia de ADN completa de un tumor, descubrir mutaciones impulsoras, es decir, aquellas que iniciaron el proceso maligno y ahora pueden ser atacadas por una terapia dirigida, e incluso visualizar el cariotipo completo (conjunto de cromosomas).
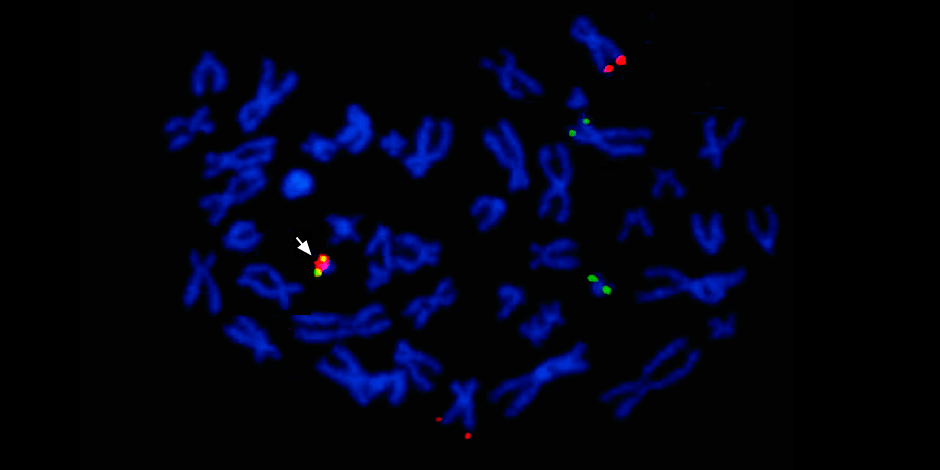 Debajo de la flecha a la izquierda, la fusión de la señal roja y verde, evidencia de la fusión del material genético de los cromosomas 9 y 22 con la formación del cromosoma quimérico Filadelfia.
Debajo de la flecha a la izquierda, la fusión de la señal roja y verde, evidencia de la fusión del material genético de los cromosomas 9 y 22 con la formación del cromosoma quimérico Filadelfia.Además, un estudio genético molecular completo determina necesariamente la
inestabilidad de microsatélites (MSI, inestabilidad de microsatélites) , una violación del mecanismo de reparación del ADN, que conduce a la rápida acumulación de mutaciones en las células. Este factor le permite hacer un pronóstico sobre el curso posterior de la enfermedad.
Después de obtener el perfil genético molecular del tumor, comienza su análisis.Los programas especiales procesan los resultados y hacen recomendaciones automáticamente. Pero estas recomendaciones son necesariamente supervisadas manualmente por un equipo de expertos. El análisis involucra genética, bioinformática, oncólogos, inmunólogos y quimioterapeutas. En esta etapa, necesariamente ocurren refinamientos y adiciones.
Dependiendo de la solicitud, dicho estudio puede tomar
de 5 a 15 días hábiles : un paciente solo necesita determinar el tipo de tumor y aclarar la terapia recomendada, solo verifique la presencia de un conjunto básico de 20 mutaciones de ADN de acuerdo con las recomendaciones de las asociaciones mundiales de cáncer. Y otro, con un diagnóstico poco común o resistencia al tratamiento estándar, debe hacer un "pasaporte molecular" del tumor y, para esto, secuenciar 400 genes.
Como resultado, en la primera parte del informe, se registran todas las mutaciones encontradas en el tumor del paciente y se
registran los medicamentos dirigidos que serán más efectivos en este caso.
La terapia dirigida está aprobada para este tipo de tumor con mutaciones detectadas, y la terapia dirigida está aprobada para el tratamiento de otros tipos de cáncer con las mismas mutaciones. En la práctica, hemos tenido casos en que los medicamentos de segundo orden, fuera de etiqueta, se prescribieron y actuaron bien.
Además, el personal del laboratorio realiza un gran trabajo al monitorear la investigación científica, lo cual puede ser significativo en el caso de este paciente.
La segunda parte del informe contiene una revisión de los estudios existentes en ese momento con datos detallados sobre la frecuencia de aparición de esta mutación, sobre el efecto de diferentes fármacos y sobre la posibilidad de utilizar uno u otro tipo de terapia dirigida para las mutaciones identificadas. Esto ayuda a hacer al menos un pronóstico aproximado para el paciente.
La tercera parte del informe contiene estudios clínicos relevantes en los que el paciente puede participar para recibir tratamiento experimental. Este es el último método de emergencia, pero conocer todos los detalles al respecto es útil para la tranquilidad del paciente.
Como resultado, de este informe, el médico recibe el perfil genético molecular más completo del tumor maligno. Tiene información sobre qué tratamos exactamente, qué desglose específico en una celda. Existe una comprensión "más reciente" de los medicamentos actualmente aprobados o disponibles para su uso en ensayos clínicos.
 El informe es bastante pesado: 30 páginas de lectura impresionante
El informe es bastante pesado: 30 páginas de lectura impresionante¿Quién necesita esto?
Aquellos que han desarrollado resistencia tumoral o intolerancia a todos los medicamentos del protocolo de tratamiento estándar.
La situación cuando "todos lo intentaron, no ayudó"., , (NCCN), « 24/7», – « » .
, 1- – , . . – – – 2- – , . – 3- , .. «» .
, , : , «» , . – . , , . – , , .
– «», . , off-label, . , ?
- , , . – .
. , . , , 80% , 20% – . , - , 80% , 20% .
- , , . , , . , : , , , . , , 10 – 10 .
30% – . , – : 600 . , , HER2/Neu.
. - – , – . , . 600 . ., 5 – , , , . .
- . . «» . , , , , ..
, . (, , ) – , .
, , «». – .
, , .
, 48 , ( ). , . , , . .
- . , 600 . , , 250, – , .
, . EGRF – .
4 . 5 , . , , 4 , .
,
« 24/7» , – .
.