(
c ) Terapia de fagos
Han pasado 91 años desde el descubrimiento de la penicilina, el primer fármaco que revolucionó la efectividad del tratamiento de enfermedades bacterianas.
Durante casi un siglo de existencia de medicamentos antibacterianos, muchas enfermedades casi han sido olvidadas. Entonces, desde 1947 se cree que Yersinia pestis, la bacteria de la peste, la culpable de la muerte de 150 millones de personas, fue derrotada. Y los principales medios de la primera etapa del tratamiento fueron los antibióticos.
Sin embargo, debido a la mayor probabilidad del regreso de los olvidados y la aparición de nuevas enfermedades infecciosas, la Organización Mundial de la Salud ha estado haciendo sonar la alarma durante la última década. Las causas del desastre fueron negligencia, estupidez y evolución. Pronto, incluso un corte normal en el dedo puede terminar en la muerte. Pero están llegando nuevos métodos de lucha.
Primeros problemas
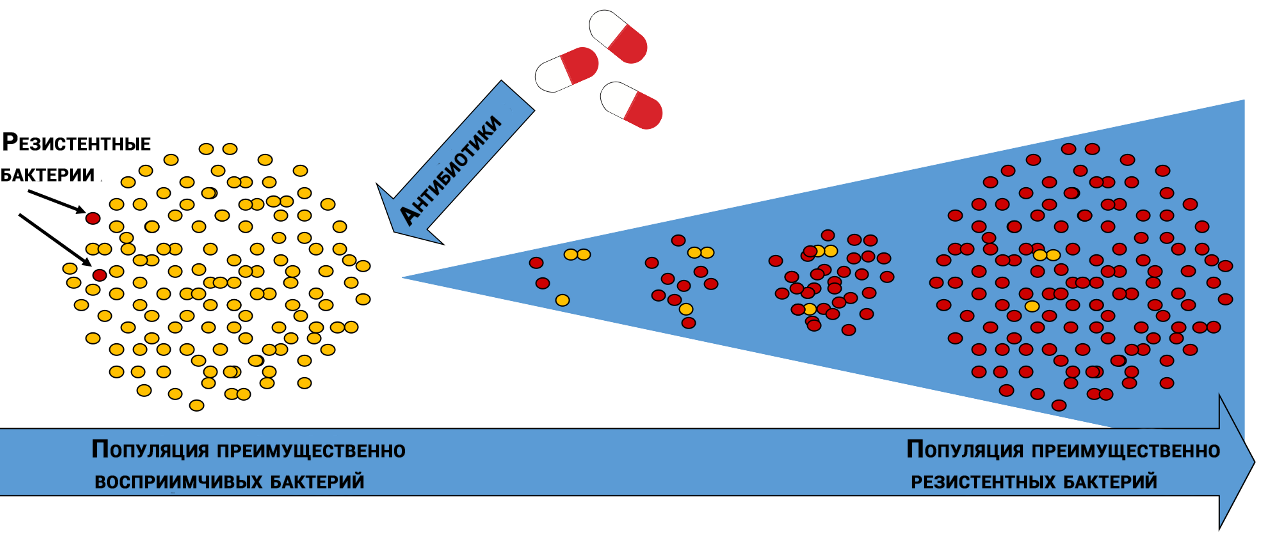 Selección natural de bacterias resistentes a los antibióticos.
Selección natural de bacterias resistentes a los antibióticos.En diferentes poblaciones bacterianas, las moléculas afectadas por antibióticos tienen diferentes "sensibilidades". Además, las bacterias de la misma especie pueden diferir entre sí, como los copos de nieve: a través de la diversidad, la vida siempre encuentra su camino.
Por casualidad, algunas bacterias son menos susceptibles a la acción del antibiótico, y algunas de las bacterias que sobrevivieron al genocidio darán descendencia que crecerá y morirá, pero tendrán tiempo de dejar a su descendencia, que en una serie de generaciones creará una población "ideal".
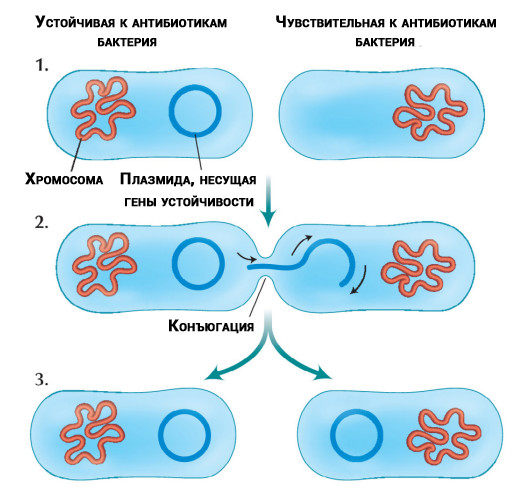 Transferencia de moléculas de ADN resistentes a antibióticos (plásmidos) aisladas de cromosomas entre bacterias
Transferencia de moléculas de ADN resistentes a antibióticos (plásmidos) aisladas de cromosomas entre bacteriasEl problema no viene solo. Los investigadores
han descubierto que algunas bacterias pueden transferir genes de resistencia a otras bacterias de la misma especie o diferentes. La transferencia se produce independientemente de si los antibióticos están presentes en el tratamiento o no.
Desde el descubrimiento de la penicilina, el uso excesivo de antibióticos ha influido significativamente en el desarrollo de resistencia bacteriana, la inmunidad a los antimicrobianos, lo que condujo a la aparición de superinfecciones incurables.
Cruzar el rubicón
Para reducir la propagación de la resistencia a los antimicrobianos,
actualmente se utiliza la herramienta
AWaRe (Acceso, Vigilancia y Reserva), desarrollada por expertos de la OMS en forma de una
lista de los principales medicamentos efectivos.
En esta lista, los antibióticos se dividen en tres grupos: acceso (disponibilidad, medicamentos de primera elección), vigilancia (estado de alerta) y reserva (reserva). Determina qué antibióticos deben usarse solo para bacterias específicas que causan las enfermedades más comunes, que aumentan significativamente el riesgo de resistencia, y cuáles deben usarse en casos extremos, con infecciones con resistencia múltiple.
En la práctica, el algoritmo funciona de la siguiente manera. La descarga del cuerpo del paciente (pus, secreción de la herida, raspado del bronquio, etc.) se recoge en un vial estéril y se envía a un laboratorio bacteriológico, donde se determina qué bacteria estaba en el material, qué antibióticos eran sensibles y cuáles eran resistentes. .
Si la bacteria no es sensible a los antibióticos de primera línea, los médicos recurren a medicamentos menos utilizados. Algunos de ellos siempre deben estar en stock y no deben usarse donde puedan manejar otros medicamentos. En consecuencia, los microorganismos están menos familiarizados con ellos y aún son sensibles.
Irónicamente, entre los antibióticos de la reserva, hay medicamentos derivados de las bacterias mismas. Por ejemplo, la colistina, producida en 1949, se deriva de la bacteria Paenibacillus polymyxa. Este antibiótico, como otros del grupo de la última reserva, se usó, como se creía, rara vez. Sin embargo, en 2015, se encontraron bacterias resistentes a la colistina.
Más de 100 países han desarrollado planes nacionales para combatir la resistencia a los antimicrobianos, pero el 75% de ellos no tienen los medios o la motivación para financiar el plan para el uso adecuado de antibióticos.
En particular, China, a pesar de las recomendaciones internacionales,
usó 12 mil toneladas de colistina (preparación de reserva) por año para engordar cerdos y prevenir enfermedades en otros animales.
En ausencia de una comprensión clara de por qué es necesario el control total de la propagación de la resistencia a los antimicrobianos, las matemáticas ayudan a los investigadores de todo el mundo, lo que le permite simular diversas situaciones y calcular los riesgos de desarrollar resistencia, incluidas las fatales. La ciencia con una precisión despiadada muestra lo que amenaza al mundo.
Fiasco farmacéutico
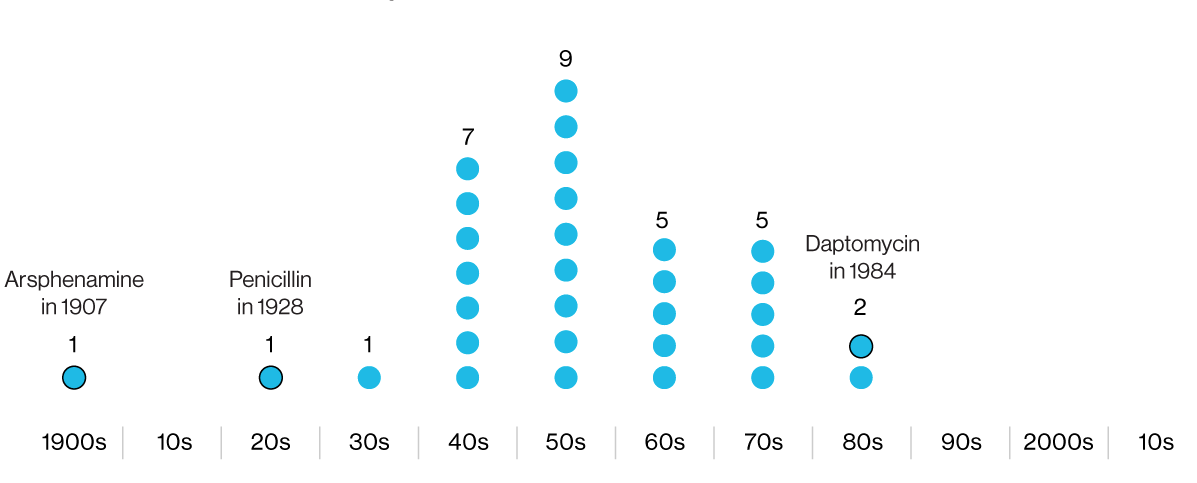 Las infografías indican los años de desarrollo de los antibióticos, posteriormente llevados a la práctica clínica. El primero es la arsfenamina, un químico antimicrobiano que contiene arsénico peligroso. La última, la daptomicina, ha perdido efectividad contra algunas cepas de MRSA.
Las infografías indican los años de desarrollo de los antibióticos, posteriormente llevados a la práctica clínica. El primero es la arsfenamina, un químico antimicrobiano que contiene arsénico peligroso. La última, la daptomicina, ha perdido efectividad contra algunas cepas de MRSA.Después de la revolución de la penicilina en los campos de batalla de la Segunda Guerra Mundial, la industria farmacéutica entró en la era dorada de los antibióticos. Las empresas contrataron investigadores, misioneros y viajeros de todo el mundo para recolectar muestras de suelo en busca de nuevos compuestos antibacterianos. Pero la "edad de oro" rápidamente quedó en nada, y en la década de 1980 llegó el "invierno de los antibióticos", que continúa hasta nuestros días.
Hoy, el desarrollo de antibióticos fundamentalmente nuevos es un evento raro. De los cincuenta medicamentos en varias etapas de ensayos clínicos,
menos de una docena son verdaderamente innovadores.
Los inversores se guían por la lógica, no por las emociones: el costo de tales medicamentos es difícil de aumentar, ya que el público puede estar indignado y no debe confiar en las entregas regulares, por la razón de que el medicamento puede ponerse en espera.
Además, al pasar años buscando una nueva sustancia y ensayos clínicos de eficacia y seguridad, las compañías farmacéuticas corren el riesgo de detectar resistencia pocos meses después de ingresar al mercado.
De todos los ensayos aleatorios doble ciego controlados con placebo probados en los últimos años, solo ocho antibióticos o combinaciones de los mismos han sido aprobados en los últimos años: delafloxacina, meropenem + waborbactam, ozenoxacina, plasomicina, eravaciclina, imipenem + cilastatina + relebactam, lefamulina.
La lefamulina, comercializada bajo la marca Xenlent, fue el primer medicamento aprobado en 20 años con un nuevo mecanismo de acción contra la neumonía bacteriana adquirida en la comunidad. Es significativo que el fabricante no pueda obtener nada del triunfo médico incondicional.
Esto ya ha
sucedido . Entonces, la compañía Achaogen, después de haber gastado $ 250 millones, durante 15 años trató de lanzar al mercado un nuevo antibiótico, la plasomicina, después de lo cual de repente se declaró en bancarrota.
Dada la relevancia del problema, otros investigadores están buscando nuevos enfoques pragmáticos en el desarrollo de métodos para inhibir el crecimiento bacteriano.
Jinetes del optimismo.
 La startup ha desarrollado una plataforma para reprogramar bacterias en una bioimpresora genética que imprime fragmentos de ADN de hasta 10 mil pares de bases de largo.
La startup ha desarrollado una plataforma para reprogramar bacterias en una bioimpresora genética que imprime fragmentos de ADN de hasta 10 mil pares de bases de largo.La empresa de biotecnología con sede en Boston, Ginkgo Bioworks, apoyada por el departamento militar de EE. UU. DARPA y el capital de riesgo Y Combinator, en lugar de antibióticos más efectivos,
crea probióticos en la bioimpresora, bacterias útiles destinadas a combatir microorganismos resistentes "competidores".
Los expertos de Locus Biosciences están
desarrollando un producto igualmente impresionante utilizando el método de edición de genes CRISPR Cas3. La tecnología CRISPR es conocida por usar la enzima Cas9, que actúa como una "tijera genética" para cortar, editar y reemplazar fragmentos de ADN.
Cas3 supera a Cas9 en amplitud: puede influir en largos tramos de ADN. CRISPR Cas3
actúa a propósito sobre bacterias y virus, y no solo corta, sino que borra efectivamente ciertas secuencias de ADN, hasta 100 mil pares de nucleótidos a la vez.
Locus Biosciences planea usar esta tecnología para controlar bacterias peligrosas. A favor del método, el gran tamaño de la enzima Cas3 juega: actúa sobre las células bacterianas, pero es demasiado grande para penetrar en la célula humana y dañar nuestro ADN.
Me gustaría terminar el artículo lleno de muerte y decepción en una nota importante. No estamos solos en la lucha contra las bacterias. Durante miles de millones de años, los virus bacteriófagos siguieron siendo una de las herramientas más poderosas para controlar las poblaciones microbianas, pero apenas se estudiaron en el contexto del éxito de los antibióticos.
 Los fagos están ocupados haciendo lo que aman: atacan a la bacteria .
Los fagos están ocupados haciendo lo que aman: atacan a la bacteria .Después de la Segunda Guerra Mundial, se desarrolló una situación paradójica. En los Estados Unidos y Europa occidental, los bacteriófagos siguieron siendo el foco de atención únicamente de los biólogos, y en los países del bloque oriental, se crearon medicamentos reales a partir de bacteriófagos. Como resultado, Rusia se ha convertido en un líder mundial en el número de preparaciones de bacteriófagos
registrados .
En los Estados Unidos, un renacimiento de bacteriófagos se ha producido solo en los últimos años. En mayo de 2019, se publicaron los resultados del uso de una mezcla de tres tipos de bacteriófagos en un paciente con una infección difícil de tratar causada por uno de los representantes de micobacterias no tuberculosas Mycobacterium abscessus. Los resultados son
alentadores : el paciente se está recuperando.
La investigación ya
ha comenzado
en varias otras cepas de bacteriófagos modificadas genéticamente y naturales, pero los medicamentos disponibles para el consumidor masivo que son efectivos contra ciertas bacterias solo aparecerán en unos pocos años.
A pesar de los logros, estamos en el comienzo de una lucha larga y agotadora contra las bacterias: la batalla principal está por venir. Hasta ahora, la mayoría de los fagos
no se han descrito o no están disponibles para la manipulación genética.
Otras herramientas para resolver el problema antibacteriano también están lejos de ser perfectas. Mientras tanto, sin aumentar el ritmo de la investigación química y farmacéutica, nos enfrentamos a décadas difíciles de amenazas globales.
En septiembre de 2019, el Comité Mundial de Monitoreo de Preparación (
GPMB) presentó el informe
World at Risk , que reconoció la probabilidad real de un patógeno que podría matar a 50-80 millones de personas en una nueva pandemia.