A medida que mejoran las herramientas para estudiar biología, los investigadores comienzan a revelar los detalles de las microproteínas, que, aparentemente, son clave para algunos procesos celulares, incluidos los relacionados con el cáncer. Las proteínas están formadas por cadenas de aminoácidos unidos, y la proteína humana promedio contiene aproximadamente 300 residuos de aminoácidos. Mientras tanto, las microproteínas contienen menos de 100 residuos de aminoácidos. Los científicos han demostrado recientemente que una de las microproteínas, PIGBOS, que consta de 54 aminoácidos, ayuda a aliviar el estrés celular.
Trabaja en ello por Alan Saghatelian et al. fue publicado en Nature Communications.
El estudio comenzó cuando los científicos descubrieron PIGBOS en las mitocondrias.
El primer intento de detectar la proteína PIGBOS a través de la proteína verde fluorescente (GFP) falló. La microproteína era demasiado pequeña en comparación con el tamaño de GFP. El equipo de científicos resolvió este problema probando un enfoque menos común llamado GFP compartido, en el que combinaban solo una pequeña parte de la GFP, llamada beta, con PIGBOS.
Los investigadores pudieron ver PIGBOS y estudiar cómo interactúa con otras proteínas. Cuando mapearon la ubicación de PIGBOS, se dieron cuenta de que estaba en la membrana mitocondrial externa, lista para hacer contacto con proteínas en otros orgánulos. Se sorprendieron al ver que PIGBOS interactúa con una proteína llamada CLCC1, que es parte de un orgánulo llamado retículo endoplásmico (ER).
"PIGBOS sirve como la unión entre las mitocondrias y la sala de emergencias", dice otro coautor del trabajo, Qian Chu. "No solíamos ver esto en las microteínas, y rara vez se ve en las proteínas ordinarias".
Los investigadores encontraron que PIGBOS en realidad se une a CLCC1 para regular el estrés en la sala de emergencias. Sin PIGBOS ER, es probable que experimente estrés, lo que conduce a una cadena de eventos cuando la célula intenta limpiar las proteínas deformadas dañinas (respuesta al plegamiento de proteínas inadecuado, UPR). Si una célula no puede deshacerse de estas proteínas, inicia una secuencia de autodestrucción y muere.
Los científicos no esperaban ver el papel de la proteína mitocondrial en la reacción del EPU. Esta nueva comprensión de PIGBOS abre la puerta a futuros tratamientos que pueden dirigirse a las células de estrés.
"En el futuro, podríamos considerar cómo PIGBOS está involucrado en enfermedades como el cáncer", dice Q. Chu. "En pacientes con cáncer, la ER es más estresante que en una persona normal, por lo que controlar el estrés ER puede ser un buen objetivo".
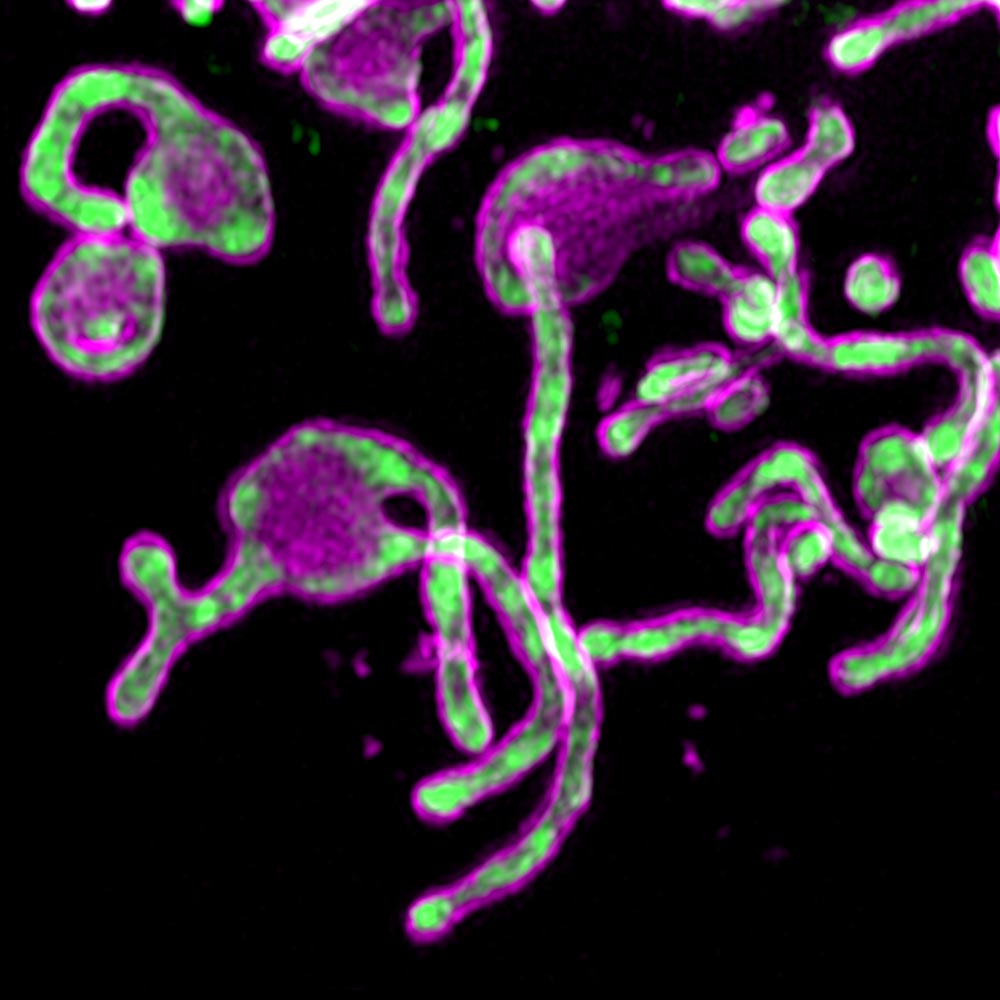 Fig. 1. Imágenes de microproteínas PIGBOSwww.salk.edu/news-release/mysterious-microproteins-have-major-implications-for-human-disease
Fig. 1. Imágenes de microproteínas PIGBOSwww.salk.edu/news-release/mysterious-microproteins-have-major-implications-for-human-diseaseLos investigadores están interesados en estudiar el papel de otras proteínas mitocondriales en el estrés ER, así como también cómo funciona PIGBOS en modelos animales. El equipo también avanza en la caracterización de una extensa biblioteca de microteínas que pueden ser críticas en la biología celular.
¿Qué son las microproteínas?
El término "microproteínas" se refiere a proteínas pequeñas que están codificadas por pequeños marcos de lectura abiertos (smORF). Los avances en la tecnología genómica y proteómica indican que se cree que los genomas de mamíferos contienen cientos de miles de microteínas codificadas por smORF. Como una parte grande y todavía poco estudiada del genoma, las microteínas brindan una gran oportunidad para obtener una nueva comprensión de la biología moderna.
No es casualidad que la revista estadounidense The Scientist llamara a las microproteínas "la materia oscura del proteoma humano". Aunque el primero de ellos, Id, fue descubierto hace unos 30 años. Una característica común de la familia de proteínas Id en mamíferos es su regulación del destino celular. Las proteínas Id actúan en varios tejidos y células, incluidos los mioblastos, el sistema nervioso y el sistema inmunitario. Además del hecho de que actúan como moduladores del mecanismo de transcripción y afectan el destino de las células del desarrollo, las proteínas Id también afectan el control del ciclo celular y se sobreexpresan en varios tumores humanos. La función molecular de las proteínas Id en los procesos de desarrollo se conoce bien, pero hasta ahora se sabe poco sobre la función de las proteínas Id en adultos.
Hasta la fecha, solo unos pocos smORF y microteínas están bien caracterizados. Por ejemplo, algunos smORF específicos de músculos nos han permitido describir nuevas vías que controlan la función y el desarrollo muscular. La microproteína humana MOTS-C regula la homeostasis metabólica, la microproteína NoBody (polipéptido disociante del cuerpo P no anotado) interactúa con proteínas de corte de ARNm, que son los componentes moleculares del primer paso enzimático en la vía de descomposición del ARNm. Y una microteína llamada CYREN regula la elección de la vía de reparación del ADN durante el ciclo celular.
El mecanismo de acción actualmente conocido de las microproteínas es suprimir la formación de complejos proteicos. Y así es como se ve. Muchas proteínas cumplen sus funciones actuando como parte de complejos de múltiples proteínas. La formación de estos complejos está estrictamente regulada y mediada por dominios de interacción proteína-proteína. La interrupción del complejo o la capacidad de las proteínas para formar homodímeros, heterodímeros o multímeros puede tener serias consecuencias para la función celular. En este sentido, la formación de dímeros y multímeros puede ser interrumpida por microteínas. Las microproteínas se comportan como reguladores postraduccionales, forman dímeros homotípicos con sus objetivos y actúan mediante la supresión dominante negativa de la función del complejo proteico.
En pocas palabras, las microproteínas interfieren con el trabajo complejo de proteínas más grandes, inhibiendo algunos procesos celulares y estimulando otros. Los estudios demuestran que la acción de las microteínas es evolutivamente conservadora y común tanto en el reino animal como en el vegetal. Los resultados de estudios primarios muestran que las microproteínas están involucradas en procesos inmunes, controlan la destrucción de moléculas de ARN defectuosas, protegen a las bacterias del calor y el frío, dictan el período de floración de las plantas y sirven como fuente de toxinas de muchos tipos de venenos para animales. Según los científicos, parece que las microproteínas están involucradas en todos los procesos biológicos. Justo antes de que no prestaran atención.
Es probable que muchos otros procesos celulares clave también estén mediados por microteínas no descritas. Tanto la detección como la caracterización de smORFs y microteínas son una tarea de investigación importante.
A pesar de los misterios restantes, los científicos ya están probando el uso potencial de estas moléculas. Una compañía vende insecticidas derivados de microproteínas encontradas en el veneno de un atracidio australiano. En ensayos clínicos, se prueba un agente de contraste basado en otra pequeña proteína en el veneno de escorpión. La tarea de esta sustancia es aislar los límites de los tumores para que los cirujanos puedan extraerlos con mayor precisión. Muchas compañías farmacéuticas ahora están buscando microproteínas con potencial médico.
Cuán pequeños pueden ser todavía no está claro. Drosophila necesita una microproteína con 11 aminoácidos para desarrollar patas normales, y algunos microbios pueden producir proteínas de menos de diez aminoácidos de longitud. Pero incluso las microteínas más grandes no alcanzan proteínas de tamaño mediano, como la alfa-amilasa, una enzima de 496 aminoácidos que se encuentra en nuestra saliva y descompone el almidón.
Solo la detección reciente de una pequeña cantidad de microteínas se asocia con el criterio de reconocimiento de genes establecido hace unos 20 años. Cuando los científicos analizan el genoma del cuerpo, a menudo escanean marcos de lectura abiertos (ORF). Para no ahogarse en una gran cantidad de datos, en el pasado, los investigadores generalmente descartaban cualquier SRO con una proteína de menos de 100 aminoácidos en eucariotas o 50 aminoácidos en bacterias. Por ejemplo, en la levadura, esta condición limitó la lista de OPC a aproximadamente seis mil.
El debilitamiento de este criterio muestra que las células contienen significativamente más OPC. A principios de este año, los científicos identificaron fragmentos del genoma de microbios que habitan en cuatro partes del cuerpo humano, incluidos los intestinos y la piel. Al buscar pequeñas OPC que pueden codificar proteínas de cinco a 50 aminoácidos de largo, los investigadores encontraron alrededor de cuatro mil familias de microteínas potenciales. Casi la mitad de ellos no son similares a las proteínas conocidas, pero la secuencia de un pequeño SRO sugiere que la proteína correspondiente se encuentra en los ribosomas, y esto indica que puede desempeñar un papel fundamental. Cuando los científicos pasaron por alto los OPC pequeños, no solo se perdieron genes con algunas funciones raras, sino genes con funciones clave.
Otras células también contienen una gran cantidad de OPC cortos: la levadura, por ejemplo, es capaz de producir más de 260 mil moléculas con un espectro de dos a 99 aminoácidos. Pero las células casi con certeza no usan todos estos ORS, y algunas de las cadenas de aminoácidos que producen pueden no ser funcionales.
Weissman y col. encontraron microproteínas de otra manera: usando el método que inventaron, dirigido a una identificación más generalizada de qué tipo de proteínas son producidas por las células. Para formar cualquier proteína, la célula primero copia el gen en un mensajero de ARN. Luego, los ribosomas leen el ARNm y unen los aminoácidos en un orden específico. Al secuenciar el ARNm unido a los ribosomas, Weissman y su equipo determinan con precisión cuáles de ellos se convierten en proteínas y dónde el ribosoma comienza a "leer" en el ARN. En un estudio de células de 2011, un científico de su equipo aplicó este método de perfilado de ribosomas, también llamado Ribo-seq, a células madre embrionarias de ratón y descubrió que las células producen miles de proteínas imprevistas, incluidas muchas en las que el número de aminoácidos estará por debajo del umbral de 100 unidades. "Estaba claro que el universo estándar ignoraba el vasto universo de proteínas, muchas de las cuales eran cortas", dice Weissman.
Saghatelian y sus colegas adoptaron un tercer enfoque para detectar la abundancia de microteínas en nuestras propias células. Los científicos utilizaron el análisis espectrométrico de masas, en el que las proteínas se dividen en fragmentos ordenados según la masa, para identificar el espectro de identificación de cada proteína. Saghatelyan y sus colegas aplicaron este método a mezclas de proteínas de células humanas, y luego les restaron los signos de los tipos conocidos de proteínas. Este método reveló espectros de 86 proteínas diminutas previamente desconocidas, la más pequeña de las cuales tenía 18 aminoácidos de largo, como señalaron los científicos en un artículo en la revista Nature Chemical Biology en 2013.
El tamaño pequeño limita el potencial proteico. Las proteínas más grandes se combinan en formas complejas destinadas a la implementación de ciertas funciones, por ejemplo, catalizando reacciones químicas. No es probable que las proteínas que contienen de 50 a 60 aminoácidos formen compuestos. Y por lo tanto, no son adecuados para la formación de enzimas o proteínas estructurales.
Sin embargo, su pequeño tamaño también abre ciertas posibilidades. Son lo suficientemente pequeños como para caber en los rincones de las proteínas grandes que funcionan como canales y receptores. Las proteínas pequeñas a menudo comparten tramos cortos de aminoácidos con sus parejas más grandes y, por lo tanto, pueden unirse y alterar la actividad de estas proteínas. Las microproteínas unidas también pueden dirigir moléculas grandes a nuevos lugares, por ejemplo, facilitando su penetración en las membranas celulares.
Debido a su atracción por proteínas más grandes, las proteínas más pequeñas pueden dar a las células una forma reversible de activar o desactivar proteínas más grandes. En un estudio de 2016 publicado en la revista PLOS Genetics, Stephan Wenkel y sus colegas modificaron genéticamente las plantas de Arabidopsis para producir una cantidad adicional de dos proteínas pequeñas. Las plantas generalmente florecen en un momento en que el día es lo suficientemente largo, pero después del nacimiento de una cantidad excesiva de dos tipos de microteínas, la floración se retrasó. Las proteínas pequeñas provocaron este retraso al bloquear la proteína grande de floración llamada CONSTANS. Se unen a CONSTANS a otras proteínas inhibidoras que lo desactivan.
En 2016, Saghatelyan y sus colegas descubrieron que las células humanas producen una proteína que contiene 68 aminoácidos, que llamaron NoBody. Esta proteína puede ayudar con la destrucción de moléculas de ARN defectuosas o innecesarias. El nombre "Nikto" refleja el papel de esta proteína en la prevención de la formación de cuerpos procesivos, grupos misteriosos en el citoplasma, donde puede ocurrir la destrucción del ARN. Cuando no hay suficiente proteína, se forman más cuerpos procesadores, lo que acelera la destrucción del ARN y cambia la estructura interna de la célula. "Esto demuestra que las proteínas pequeñas pueden tener un gran efecto dentro de la célula", dicen los científicos.
Los músculos dependen de muchas microproteínas diferentes. Durante el desarrollo del embrión, las células musculares individuales se fusionan en fibras que desencadenan la contracción. La proteína Myomixer de 84 aminoácidos se combina con una proteína más grande para conectar las células, como lo demostraron Olson et al. En 2017 en su trabajo en la revista Science. Sin ella, los embriones de ratón no pueden formar músculos y son casi transparentes.
Además, a medida que se desarrolla, la miorregulina entra en vigor, lo que ayuda a regular la actividad muscular. Cuando un músculo recibe un estímulo, el depósito de células libera calcio, estimulando la contracción del tejido y la producción de energía. Luego, una bomba de iones, una proteína llamada SERCA, comienza a devolver el calcio al almacenamiento, permitiendo que el tejido muscular se relaje. La mioregulina se une a SERCA y lo inhibe. Este efecto limita la frecuencia de la contracción muscular, probablemente proporcionando una reserva de energía para una emergencia, por ejemplo, cuando huye de un depredador. Otra proteína pequeña, DWORF, tiene el efecto opuesto de activar SERCA y estimular la contracción muscular sistemática.
Incluso los organismos estudiados a fondo, como la bacteria E. coli (Escherichia coli), esconden pequeñas proteínas inesperadas que juegan un papel importante. Storz y col. informó en 2012 que una proteína de 49 aminoácidos previamente desconocida llamada AcrZ ayuda a este microbio a sobrevivir cuando se expone a ciertos tipos de antibióticos al estimular una bomba libre de drogas.
El veneno producido por una variedad de organismos, incluyendo arañas, scolopendras y moluscos venenosos, también abunda en proteínas diminutas. Muchos componentes del veneno inmovilizan o matan, bloqueando los canales de sodio u otros iones necesarios para la transmisión de los impulsos nerviosos. Las proteínas pequeñas "golpean estos canales iónicos con sorprendente precisión y potencia, dicen los científicos. Son los componentes principales de los venenos, y es con ellos que se asocian la mayoría de las consecuencias farmacológicas y biológicas.
El insecto australiano gigante que come peces, por ejemplo, no solo depende de mandíbulas afiladas y partes de la boca en forma de pico para derrotar a su presa. Presenta a sus víctimas una dosis que contiene más de 130 proteínas, de las cuales 15 son menos de 100 aminoácidos.
A diferencia de las proteínas grandes, como los anticuerpos, las microproteínas que se ingieren de tabletas o inyecciones pueden penetrar en las células y modificar sus funciones. El captopril, el primero de una clase de medicamentos de alta presión conocidos como inhibidores de la enzima convertidora de angiotensina, se desarrolló a partir de la pequeña proteína que se encuentra en el veneno del calor común, una especie de víbora venenosa. Este medicamento, aprobado para su venta en los Estados Unidos en 1981, fue descubierto por casualidad, incluso antes de que los científicos reconocieran las proteínas pequeñas como un grupo separado. Hasta ahora, solo unas pocas microteínas han salido al mercado o en ensayos clínicos.
Los investigadores del cáncer están tratando de usar la microproteína que se encuentra en el veneno de escorpión amarillo, que es común en África y Oriente Medio. Esta molécula es misteriosamente atraída por los tumores. Al agregarlo a una sustancia de tinción fluorescente, los científicos esperan resaltar los límites de los tumores cerebrales para que los cirujanos puedan extirpar de manera segura las áreas afectadas por el cáncer. Ilumina el tumor. Por lo tanto, puede ver sus bordes y detectar la presencia de metástasis. En ensayos clínicos, los investigadores ahora están evaluando si una molécula dual ayudará a los cirujanos a eliminar los tumores cerebrales en los niños.
Todavía se desconoce qué importancia tendrán las proteínas pequeñas en la medicina, pero ya han revisado varias afirmaciones de los biólogos. Norbert Hübner del Centro Max Delbrück de Medicina Molecular en Berlín y sus colegas descubrieron docenas de nuevas microteínas en las células del corazón humano. El grupo reveló su fuente inesperada: secuencias cortas dentro de ARN largos no codificantes, es decir, en una especie que previamente se pensaba que no producía proteínas. Al identificar 169 ARN no codificantes largos, probablemente leídos por ribosomas, Huybner y su equipo utilizaron uno de los tipos de espectrometría de masas para confirmar que más de la mitad de ellos producen microproteínas en las células del corazón.
su papel de rendimiento fue publicado este año en Cell.Las secuencias de ADN de otras proteínas diminutas también se pueden encontrar en lugares no convencionales. Por ejemplo, algunos están en los marcos de lectura abiertos, OPC, proteínas más grandes. Los científicos creían previamente que estas secuencias ayudan a controlar la producción de proteínas más grandes, pero rara vez producen proteínas por sí mismas. Algunas secuencias de codificación de microteínas recién detectadas se encuentran incluso en secuencias que codifican otras proteínas más largas.Estas sorpresas genómicas pueden arrojar luz sobre cómo surgen nuevos genes, dice la bióloga de sistemas evolutivos Anne-Ruxandra Carvunis de la Universidad de Pittsburgh, Pensilvania. Los científicos creían previamente que la mayoría de los genes aparecen cuando los genes existentes se multiplican o fusionan, o cuando las especies intercambian ADN. Sin embargo, según Karvunis, las microproteínas indican que se pueden formar protógenos cuando las mutaciones establecen nuevas señales de inicio y parada en la parte no codificante del genoma. Si el OPC resultante produce una proteína útil, las nuevas secuencias permanecerán en el genoma y pasarán por el proceso de selección natural, evolucionando aún más hacia genes más grandes que codifican proteínas más complejas.En un estudio de 2012, Carvounis y sus colegas encontraron que la levadura transforma más de mil SRO cortos en proteínas. Y esto sugiere que estas secuencias son protógenos. En un nuevo estudio, Carvounis y su equipo probaron si los SRO jóvenes podrían ser beneficiosos para las células. Alteraron genéticamente la levadura para aumentar el resultado de 285 SRO en evolución reciente, la mayoría de las cuales se dirigen a moléculas más pequeñas que las proteínas estándar o un poco más que eso. En casi el 10% de las proteínas, un aumento en sus niveles mejoró el crecimiento celular en al menos un medio."Las microproteínas son un área de rápido crecimiento", dice A. Saghatelian. "Pero creo que este estudio nuestro realmente influyó en la comprensión actual de la influencia de las microproteínas en la bioquímica y la biología celular".Enlaces :Regulación de la función proteica por 'microproteínas' Elnuevo universo de miniproteínas está volcando la biología celular y la genéticaRegulación de la respuesta al estrés ER por una microproteína mitocondrial