
Cualquier sistema, sin importar cuán complejo y de múltiples capas pueda ser, tiene su propia base, la base sin la cual no funcionaría de la manera en que funciona. En la biosfera de nuestro planeta también hay ladrillos básicos sobre los que descansa todo. Son autótrofos, organismos que pueden convertir compuestos inorgánicos en orgánicos. Hoy nos reuniremos con usted en un estudio en el que científicos de Israel crearon en el laboratorio un nuevo tipo de bacteria que se alimenta de dióxido de carbono. ¿Qué métodos se utilizaron en el proceso de desarrollo, cómo se comportó la bacteria y qué puede significar este trabajo para la humanidad? Aprendemos sobre esto del informe del grupo de investigación. Vamos
Base de estudio
Los autótrofos se pueden llamar una de las criaturas más antiguas del planeta. Se cree que los primeros autótrofos aparecieron hace dos mil millones de años, cuando una bacteria heterotrófica (incapaz de sintetizar compuestos orgánicos a partir de inorgánicos) a través de la evolución adquirió la capacidad de fotosíntesis. El término en sí fue propuesto en 1892 por el científico alemán Albert Bernhard Frank.
 Albert Bernhard Frank
Albert Bernhard FrankAlgunos organismos se encuentran en la encrucijada de la síntesis autotrófica y heterotrófica, ya que obtienen carbono de los compuestos orgánicos, pero energía de los inorgánicos. Siguiendo esta lógica, los autótrofos se pueden dividir en varios principales: fotótrofos, quimiotróficos, radiótrofos, litótrofos y mixótrofos. También hay grupos de transición, cuyos representantes son extremadamente difíciles de atribuir a uno u otro borde del espectro de síntesis, pero su clasificación aún no se ha completado.
Los fotótrofos , como su nombre lo
indica , usan fotones como fuente de energía, o más bien energía solar. Es a partir de estos organismos que se produce un tipo de nutrición como la fotosíntesis.
Los quimiotróficos son una química más cercana que la física. Dichos organismos utilizan diversas reacciones redox como fuentes de energía, es decir. quimiosíntesis
Los tipos menos estudiados y, al mismo tiempo, los más curiosos son los
radiotróficos , resultado de un fenómeno llamado "radioestimulación de hongos". Este es el proceso de estimular el metabolismo microscópico de los hongos debido a la radiación ionizante. Por primera vez, estos organismos se encontraron en 1991 como parte del moho negro, cuyas muestras se obtuvieron de la central nuclear de Chernobyl. Un poco más tarde (en 2006), científicos de Nueva York probaron la hipótesis de la radioestimulación de hongos y descubrieron que tres hongos de las especies Cladosporium sphaerospermum, Wangiella dermatitidis y Cryptococcus neoformans, que contienen el pigmento melanina, aumentaron su biomasa y acetato acumulado (ácido acético, CH
3 OH) ) en un entorno donde el nivel de radiación excedió la norma en 500 veces.
Los litotróficos procesan compuestos inorgánicos en la energía y el carbono que necesitan a través de la respiración aeróbica o anaeróbica. Solo los representantes de las arqueas (unicelulares sin un núcleo y orgánulos de membrana) y las bacterias pueden presumir de quimiolitotrofia.
Los mixótrofos son soldados universales, ya que pueden usar varios tipos diferentes de alimentos al mismo tiempo (o alternativamente, dependiendo de las circunstancias), es decir. ser fotótrofos y quimiotróficos, por ejemplo.
Los autores del estudio que estamos considerando hoy creen que una comprensión más detallada de los procesos de actividad vital de los autótrofos permitirá aplicar los conocimientos adquiridos a gran escala. Y en su opinión, la mejor manera de estudiar la autotrofia es crear un organismo autotrófico sintético. Teóricamente, puede crear una bacteria que se alimentará de dióxido de carbono. Pero llamar a este proceso lenguaje fácil no cambia. Los propios investigadores identifican tres etapas principales que deben completarse para que su trabajo se realice.
En primer lugar, para una transición completa a la nutrición autotrófica, el cuerpo debe usar el mecanismo de fijación de CO
2 en el camino donde el carbono entrante consiste exclusivamente en CO
2 , y las moléculas de salida son moléculas orgánicas que entran en el metabolismo central del carbono y suministran los 12 precursores de biomasa principales.
En segundo lugar, el cuerpo debe utilizar mecanismos enzimáticos para obtener energía regenerativa mediante la recolección de energía no química (luz, electricidad, etc.) o mediante procesos redox que no son fuentes de carbono.
En tercer lugar, el cuerpo debe regular y coordinar las formas de recolectar energía y fijar CO2, para que juntos mantengan un crecimiento constante cuando el CO2 es la única fuente de carbono.
Anteriormente, se realizaron estudios en los que trataron de crear un organismo que se alimentara de CO
2 , pero en esos trabajos había un gran defecto: la presencia de compuestos orgánicos de múltiples carbonos dentro del cuerpo, que servían como una fuente de nutrición "reserva". En otras palabras, aún no ha sido posible crear un organismo heterotrófico que tome carbono exclusivamente del CO
2 .
Como base metodológica para su investigación, los científicos utilizaron
el ciclo de Calvin (
ciclo de Calvin-Benson-Bassam), una serie de reacciones bioquímicas durante la fotosíntesis en plantas, cianobacterias, etc. Este ciclo es el mecanismo de fijación de dióxido de carbono más común.
Y el principal experimento fue la bacteria
Escherichia coli , mejor conocida por nosotros bajo el nombre de "E. coli".
Resultados de la investigación
En primer lugar, fue necesario llevar a cabo la reorganización metabólica y la evolución del laboratorio en el cuerpo para realizar la transición a la autotrofia. Se consideraron varios compuestos candidatos que podrían servir como donantes de electrones para la fijación de CO
2 , lo que permitiría que las bacterias se transfirieran para completar la autotrofia.
El formato * se eligió como fuente de electrones, ya que este compuesto orgánico de un carbono puede servir como fuente de la parte reductora del proceso, pero no es compatible con el crecimiento de
E. coli y no se absorbe en la biomasa.
Formatos * - sales y ésteres de ácido fórmico.
El potencial de recuperación del formiato (E
0 = 420 mV) es lo suficientemente bajo como para reducir NAD
+ , el principal portador electrónico en la célula (E
0 = 280 mV en
E. coli ). Otra ventaja es que puede obtenerse electroquímicamente de fuentes renovables, mientras que la biomasa será negativa en carbono.
Para recolectar electrones del formiato y dirigirlos al reservorio de recuperación de energía celular principal de NADH (nicotinamida adenina dinucleótido), FDH (formiato deshidrogenasa) ligada a NAD
+ de la bacteria metilotrófica
Pseudomonas sp .
Un análisis estequiométrico (proporción de masa del compuesto químico) de la red metabólica en
E. coli mostró que agregar FDH, Rubisco (ribulosa bisfosfato carboxilasa) y Prk (fosforibulocinasa) a la red metabólica de
E. coli sería suficiente para el crecimiento autotrófico (imagen a continuación).
 Imagen 1: Esquema de una bacteria quimiotrófica modificada en laboratorio E. coli.
Imagen 1: Esquema de una bacteria quimiotrófica modificada en laboratorio E. coli.Desafortunadamente, la coexpresión de tres enzimas recombinantes en la cepa primaria de
E. coli (BW25113) no condujo al crecimiento en condiciones autotróficas. Dado que el análisis estequiométrico no tiene en cuenta la cinética de la enzima, el nivel de expresión y regulación, se decidió utilizar la evolución de laboratorio adaptativa como una herramienta para la optimización metabólica para lograr el crecimiento autotrófico.
Este método se debe al hecho de que la expresión heteróloga de un mecanismo enzimático extraño expande el espacio de posibles reacciones metabólicas para la célula, proporcionando la posibilidad de crecimiento autotrófico. El problema es que no hay garantía de que la secuencia necesaria atraviese un conjunto de reacciones recientemente ampliado.
Por lo tanto, dado que el metabolismo central de
E. coli se adapta al crecimiento heterotrófico, es probable que se utilice una distribución de flujo que apoye el crecimiento heterotrófico. Es precisamente por eso que se utilizó la evolución de laboratorio, capaz de redirigir el flujo a lo largo de la vía metabólica deseada.
Uno de los procesos más importantes de la evolución de laboratorio es la reorganización del metabolismo central para establecer la dependencia de la corriente de carboxilación de Rubisco y la adaptación del medio de crecimiento para suprimir el flujo a través de las vías heterotróficas originales (
2A ). En otras palabras, era necesario hacer que la bacteria dejara de usar los mecanismos heterotróficos del metabolismo, cambiando a autotrofia.
 Imagen No. 2: esquema de la estrategia evolutiva desarrollada para convertir la bacteria heterotrófica E. coli en una quimiotrófica.
Imagen No. 2: esquema de la estrategia evolutiva desarrollada para convertir la bacteria heterotrófica E. coli en una quimiotrófica.En primer lugar, durante la evolución artificial, se excluyeron tres genes que codifican dos enzimas en el metabolismo central del carbono: la fosfofructoquinasa (Pfk) en la glucólisis y la glucosa-6-fosfato deshidrogenasa (Zwf) en la vía oxidativa de la pentosa fosfato. El primero tiene dos isoenzimas codificadas por dos genes (pfkA y pfkB). Cuando las células crecen con
xilosa *, esta reorganización asegura que el crecimiento celular dependa de la carboxilación de Rubisco, que es necesaria para la transición a la quimiotrofia.
La xilosa * es un monosacárido pentosa (C 5 H 10 O 5 ).
A continuación, se realizó la expresión heteróloga de Rubisco, Prk, anhidrasa carbónica (CA), que convierte CO
2 y bicarbonato y FDH. Después de esto, se encuentra el proceso de crecimiento de células en
quimiostatos limitados por xilosa
* , que apoyan a las células en constante inanición de carbono.
Chemostat * es un método de cultivo de microorganismos cuando el equilibrio óptimo y la concentración de sustratos se mantienen en el medio nutritivo donde crecen.
Tal medio de cultivo permite que las células proliferen (crecimiento de tejido por división celular), pero ralentiza las vías heterotróficas
catabólicas * .
Catabolismo * : descomposición metabólica de sustancias complejas en otras más simples u oxidación de una sustancia (metabolismo energético).
El quimiostato, donde se cultivaron las células, también contenía un exceso de formiato y se purgaba constantemente con aire enriquecido con CO
2 (contenido
de CO
2 del 10%).
Por lo tanto, este medio de crecimiento ralentiza la heterotrofia, haciendo que las células tiendan a autotrofarse. Literalmente, las células se ven obligadas a reducir su dependencia de la contribución externa de carbono del azúcar orgánico.
El método de cultivo estaba listo, era necesario verificarlo. Una vez a la semana, se extrajeron muestras de quimiostatos y se analizó su crecimiento en condiciones autótrofas. En particular, estas son condiciones quimioorganotróficas para Escherichia coli, que consisten en un medio de tipo M9 con la adición de formiato de sodio 30 milimoles (milimolar) en una atmósfera con un alto contenido de CO
2 (10%), pero sin ninguna otra fuente de carbono.
Después de aproximadamente 200 días de propagación en quimiostatos, equivalente a aproximadamente 150 generaciones, se detectó crecimiento en medios que carecen de xilosa (es decir, en condiciones autotróficas). Este fenotipo estuvo presente en todas las muestras de ese día. En el día 350, la xilosa se excluyó completamente del medio de cultivo (
2B ). El crecimiento sostenido y la turbidez implicaron que exclusivamente células independientes de xilosa estaban presentes en el quimiostato. Se descubrió que las muestras necesitaban un medio con una alta concentración de CO
2 para su crecimiento, lo que sugiere un mecanismo de fijación de carbono.
Luego, los científicos eligieron uno de los
clones más sólidos en crecimiento
* para un análisis más profundo. El
tiempo de duplicación se estableció
* 18 ± 4 horas (
2C ).
Clon * : en este caso, nos referimos a un grupo de células genéticamente idénticas.
Tiempo de duplicación * : el tiempo que tarda algo en duplicarse en tamaño.
Era necesario asegurarse de que las células crecidas sean realmente autótrofas, y durante su crecimiento no hubo fuentes de carbono "ocultas" ni activación de formiatos heterotróficos. Para esto, se realizaron experimentos sobre el etiquetado de isótopos.
Para empezar, los clones evolucionados se cultivaron en un medio con formiato marcado con
13 C y
13 CO
2 (10 generaciones hasta que se obtuvo un estado isotópico estable). A continuación, se realizó un análisis de
13 etiquetas C para diversos metabolitos mediante cromatografía líquida y espectrometría de masas en tándem.
13 C * - carbono-13, un isótopo de carbono estable.
Metabolitos * : productos metabólicos de cualquier compuesto.
El método de cromatografía líquida y espectrometría de masas en tándem * es un método de investigación química que combina cromatografía líquida que separa mezclas de varios componentes y espectrometría de masas, lo que garantiza la identidad estructural de los componentes individuales.
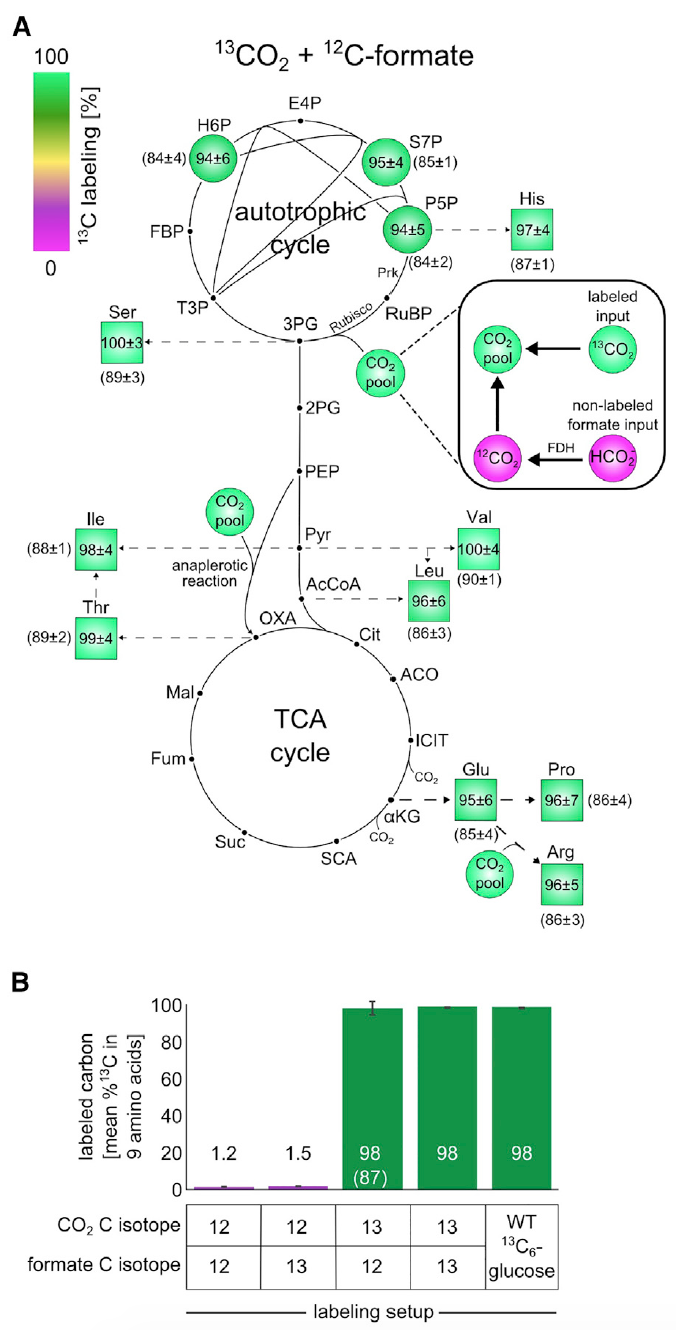 Imagen 3: Los experimentos de etiquetado de isótopos con 13 C muestran que todos los componentes de biomasa se forman a partir de CO 2 como única fuente de carbono.
Imagen 3: Los experimentos de etiquetado de isótopos con 13 C muestran que todos los componentes de biomasa se forman a partir de CO 2 como única fuente de carbono.El análisis mostró que aproximadamente el 98% de los átomos de carbono en los bloques de construcción de la biomasa del metabolismo central fueron etiquetados con éxito. Estos datos corresponden a formiato marcado y CO
2 que contienen aproximadamente 99% de
13 C y 1% de bicarbonato sin marcar disuelto en un medio nutriente.
Esta observación es evidencia irrefutable de que el carbono en la biomasa de las células proviene precisamente del CO
2 y el formiato.
Además, se verificó si el formiato se concentra en la biomasa. Para esto, las células se cultivaron en medio M9 (la concentración de CO
2 en la atmósfera fue del 10%, como en experimentos anteriores) usando formiato marcado con carbono-13.
El esquema de marcado de
13 C para los bloques de construcción de biomasa después del crecimiento en un ambiente dado mostró una marca de
13 C dentro del 1-2% (
3B ), que es el valor esperado basado en el contenido natural de
13 C y una pequeña cantidad de formato marcado. En otras palabras, los resultados mostraron que las células no asimilan el formiato.
La totalidad de los resultados de los experimentos anteriores sugiere con confianza que la fuente de carbono para los cultivos son exclusivamente CO2 y formiato. Y esto, a su vez, indica un cien por cien de
autotrofia de las células de
E. coli que han experimentado evolución de laboratorio.
Los científicos realizaron otro experimento para verificar esta afirmación, donde se usaron
13 CO
2 etiquetados y formiato sin etiquetar. Debido al alto costo de
13 CO
2 , se cerraron los recipientes en los que se realizó el experimento. Este pequeño matiz es extremadamente importante, ya que debido al ambiente cerrado (en los experimentos anteriores, los contenedores fueron ventilados), se acumuló CO
2 sin marcar debido a la oxidación del formiato. Y esto distorsiona los resultados de la observación. Sin embargo, el proceso de "contaminación" podría ser monitoreado e incluso corregido con un ojo en él a través del análisis de glutamato marcado.
Esta experiencia demostró que alrededor del 85-90% de los átomos de carbono en los bloques de construcción de la biomasa del metabolismo central fueron etiquetados con éxito. Como se puede ver en las imágenes
3A y
3B , si aplicamos el ajuste para el componente marcado con
13 C, el etiquetado de los átomos en la biomasa será casi del 100%, lo que indica la naturaleza autotrófica del desarrollo de la bacteria
E. coli .
El hecho de que las bacterias se hayan convertido en autótrofos está fuera de toda duda. Queda por descubrir qué tipo de cambios genéticos, es decir, mutaciones, ocurrieron en el proceso de evolución de laboratorio.
Para aclarar esto, los científicos aislaron seis clones capaces de crecimiento autotrófico en formiato, y secuenciaron su genoma y
plásmidos * .
Los plásmidos * son moléculas de ADN físicamente separadas de los cromosomas y capaces de replicarse de forma autónoma (el proceso de crear dos moléculas de ADN hijas basadas en la molécula de ADN original).
Se aislaron dos clones (clones 1 y 2) cuando la xilosa todavía estaba presente en el medio de cultivo (día 250 de evolución), tres clones (clones 3, 4 y 5) después de que la xilosa se excluyó del medio de cultivo del quimiostato ( 400º día de evolución). El último clon (clon 6) se aísla después de la propagación de uno de los clones previamente aislados (clon 1) durante varios ciclos de dilución en serie.
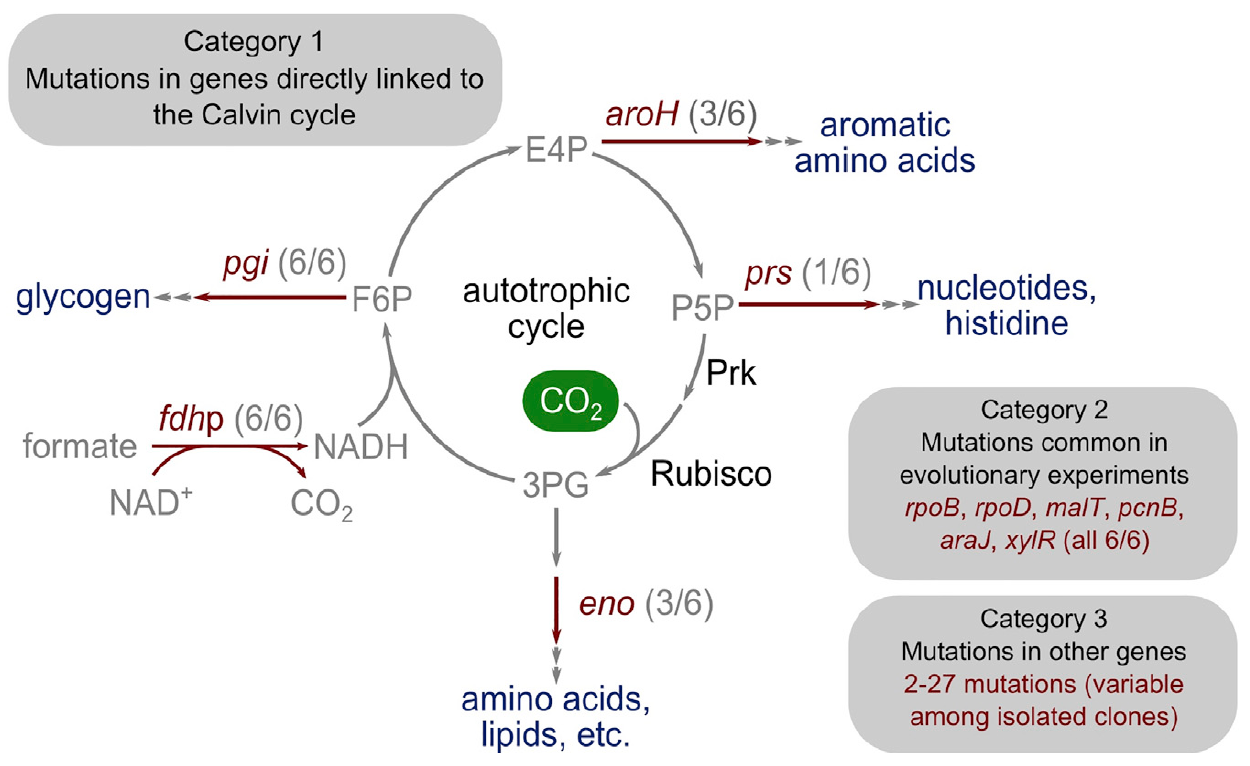 Imagen 4: La base genética de la transición a la autotrofia.
Imagen 4: La base genética de la transición a la autotrofia.Sorprendentemente, el número de mutaciones fue bastante pequeño. Los investigadores los dividieron en tres categorías principales.
La primera categoría consiste en genes que codifican enzimas con un enlace metabólico directo con la función del ciclo de Calvin. Este gen, que codifica la ribosa fosfato difosfoquinasa, dirige la ribosa fosfato hacia la biomasa.
La segunda categoría de genes mutados consiste en aquellos que mutaron en experimentos previos sobre evolución adaptativa de laboratorio: pcnB (R161P), rpoB (D866E), rpoD (F563S), malT (E359K) y araJ (W156). Los científicos asocian estas mutaciones con el proceso mismo de la evolución del laboratorio, es decir, no están necesariamente asociadas con el proceso de transición de las bacterias a la autotrofia. Del mismo modo, se descubrió una mutación en el gen xylR que codifica una proteína reguladora para los operones responsables del catabolismo del azúcar D-xilosa (E337K). Se asocia con la inanición prolongada de xilosa en un quimiostato durante el cultivo, pero de ninguna manera se asocia con la autotrofia.
La tercera categoría de mutaciones incluye aquellas que no tienen un papel característico y pueden ser el resultado de un fenómeno como el "autostop genético". En diferentes aislamientos, hay de 2 a 27 genes mutados adicionales, algunos de los cuales pueden ser mutaciones del fenotipo autotrófico, pero no son estrictamente necesarios para ello.
En el futuro, los científicos tienen la intención de realizar estudios adicionales de mutaciones genéticas para determinar cuáles de ellos son básicos y necesarios para la transición de las bacterias a la autotrofia.
Para conocer más detalladamente los matices del estudio, le recomiendo que examine el
informe de los científicos y los
materiales adicionales .
Epílogo
En este estudio, los científicos lograron excelentes resultados. En primer lugar, vale la pena señalar la evolución del laboratorio, un proceso controlado por científicos que les permite transformar el cuerpo de acuerdo con un nuevo "diseño".
La manipulación evolutiva obligó literalmente a E. coli a convertirse en un autótrofo, absorbiendo CO
2 para proporcionarse carbono. Dicha bacteria mutante puede ser extremadamente útil para una sociedad que sufre el calentamiento global, uno de los motivos es precisamente el dióxido de carbono. , ,
2 , . «» , . -, . -, , ,
2 . , , .
La bacteria que salvará al mundo del calentamiento global, suena increíble, incluso un poco de ciencia ficción. Pero, incluso si se crea dicha bacteria, no libera a una persona de la responsabilidad de la situación ambiental del planeta. Porque no es puramente donde limpian, sino donde no tiran basura.Gracias por su atención, sigan curiosos, cuiden el planeta y tengan una buena semana de trabajo, muchachos. :)
Un poco de publicidad :)
Gracias por quedarte con nosotros. ¿Te gustan nuestros artículos? ¿Quieres ver más materiales interesantes? Apóyenos haciendo un pedido o recomendando a sus amigos
VPS basado en la nube para desarrolladores desde $ 4.99 , un
análogo único de servidores de nivel básico que inventamos para usted: toda la verdad sobre VPS (KVM) E5-2697 v3 (6 núcleos) 10GB DDR4 480GB SSD 1Gbps desde $ 19 o cómo dividir el servidor? (las opciones están disponibles con RAID1 y RAID10, hasta 24 núcleos y hasta 40GB DDR4).
Dell R730xd 2 veces más barato en el centro de datos Equinix Tier IV en Amsterdam? ¡Solo tenemos
2 x Intel TetraDeca-Core Xeon 2x E5-2697v3 2.6GHz 14C 64GB DDR4 4x960GB SSD 1Gbps 100 TV desde $ 199 en los Países Bajos! Dell R420 - 2x E5-2430 2.2Ghz 6C 128GB DDR3 2x960GB SSD 1Gbps 100TB - ¡desde $ 99! Lea sobre
Cómo construir un edificio de infraestructura. clase utilizando servidores Dell R730xd E5-2650 v4 que cuestan 9,000 euros por un centavo?