Introduccion
“La neblina anterior al amanecer se retiró a regañadientes a lo largo de los barrancos, aparecieron tallos de centeno, brillando bajo el viento. Las aves ya se habían regocijado por la mañana y charlaban discretamente sobre sus orejas. Las últimas gotas de sueño cayeron en una taza de café aromático. Es agradable encontrarse con el disco del sol, estirando las juntas heladas y mirando a lo lejos. Quien es ese La idea se congeló cuando su mirada se deslizó por un camino que huía del bosque. Una amplia sonrisa iluminó su rostro. Desde los primeros movimientos la reconoció. Solo ella podía moverse con tanta gracia y gracia de cierva. La mano se congeló a medio camino de la mesa. Siguiendo con la sonrisa, de repente se volvió bruscamente y entró en la cocina. Otra taza y una bandeja de bayas aparecieron sobre la mesa. El aroma del jarabe de lavanda inundó la terraza. Sería un buen día, pensó, un desayuno agradable, seguro.
Un puñado de frambuesas desapareció rápidamente de la bandeja de bayas tras bayas. Una suave voz femenina contó las últimas noticias. Durante la semana pasada, no pusieron una sola cruz en el cementerio de la ciudad. Hemos sobrevivido! - Una exhalación de alegría brotó de los pulmones que ya habían sido acortados por la edad. ¡Sí! Ella le respondió. Estos malditos cuartos de siglo. Un cuarto de siglo que no ha dejado un solo parche liso en la cara.
Sus ojos, que ya eran muy miopes, la miraron y en ellos vio las líneas interminables de los gráficos del espectrómetro de masas, vio esa fatiga sin fondo que no retrocedía en los intentos de meterlo en una caja. Él hizo frente, resistió. La gente ya no tenía un miedo animal terrible de perecer, probablemente la muerte más terrible que se podría haber imaginado ... "
Este es el comienzo de una historia fantástica que leí en mi tiempo libre. Describe un nuevo tipo de arma biológica. Horrible en su poder destructivo. Las personas quedaron atónitas cuando reconocieron su destino. El miedo a esta desgracia invisible e inevitable era peor que la muerte misma.
"Prurito"Gran Bretaña, primera mitad del siglo XVIII. La niebla se disipa sobre los verdes y jugosos campos. Un gran rebaño de ovejas avanza lentamente hacia el río. De repente notamos algo inusual. Al menos una quinta parte de las ovejas rueda furiosamente por la hierba y frota su piel contra las piedras que sobresalen sobre la superficie de la tierra, dejando restos desordenados. Peinado, perdió el pelo del costado cubierto de terribles úlceras y erosión. Parte de la oveja ya no puede picar; simplemente, lentamente, con un paso tembloroso, rechinando los dientes cruzan el campo, hasta el último lugar de tranquilidad. Qué tipo de desgracia es esta, pensaron los pastores, llamando a la enfermedad según su manifestación principal: SCRAPIE ("prurito"). Esta infección no ha retrocedido durante siglos, apareciendo de vez en cuando aquí y allá, dejando atrás familias arruinadas.
Gusanos cerebralesLos verdaderos científicos no son personas comunes y corrientes, al familiarizarse con sus biografías, a menudo uno se sorprende de lo loco que giraba el barril de la fortuna.
Uno de los hilos de nuestra historia comenzará con la biografía de Daniel Carlton Gaidusek (1923-2008). Imagínese a un hombre joven, tiene 23 años, acaba de recibir una maestría en Harvard, va con gran entusiasmo a trabajar en la Universidad Tecnológica de California, y no con nadie, sino con el propio Linus Pauling (dos veces ganador del Premio Nobel). Tres años después, acepta la invitación y toma el puesto de investigador en la facultad de pediatría y enfermedades infecciosas en su alma mater. A pesar de una carrera tan exitosa, algo no va bien y no le da paz. Sin haber trabajado durante 3 años, arroja todo y primero se va a Teherán en el Instituto Pasteur, y tres años después, en un extraño zigzag a través del Hindu Kush, se encuentra en el Instituto Médico Walter y Eliza Hall en Melbourne. Cambio descendente, no de otra manera.
Fue en Australia donde tuvo lugar el fatídico conocido de Daniel Gaidusek con el médico Vincent Zigas (1920-1983), quien interactuó estrechamente con las tribus de Papua Nueva Guinea, brindándoles atención médica. Zigas le cuenta a Daniel sobre una enfermedad desconocida, cuyos síntomas extraños se manifiestan en una sola nación: Foret. Gaidusek se apresura impacientemente a aprender el idioma de los aborígenes y unos meses después Zigas trae y representa a Gaidusek del grupo étnico Foret. Durante casi un año viven entre una tribu salvaje, siguiendo todos los hábitos y costumbres. Observar a los pacientes y realizar autopsias de los muertos. [1]
Así es como describen la secuencia de desarrollo de una enfermedad tan interesante para ellos en su artículo:
“... La apatía y la fatiga abrumadora superan a una persona. Después de un mes o un poco más, comienzan las sacudidas y temblores característicos. El temblor de las extremidades, el tronco y la cabeza se vuelve más distintivo y constante. Una persona pierde la capacidad de moverse. Entre uno y dos años, se produce la muerte. Los miembros de la tribu Phore llaman a esta enfermedad "Kuru", lo que significa temblar, echarse a perder. Y creen que la razón radica en el mal de ojo del chamán ".
Después de una autopsia, se descubrió que Zigas y Gaidusek, que murió a causa de la enfermedad, transformaron el cerebro en una sustancia esponjosa. [2]
La residencia a largo plazo dentro de la tribu permitió a Haidusek y Zigas descubrir la causa de la enfermedad. Resultó que la tribu Foret practicaba el canibalismo.
Después de la muerte de uno de los miembros más antiguos del género, se talló su cuerpo, se abrió la caja del cráneo y se comió el cerebro, ya que se creía que comer el cerebro es un ritual de los últimos honores para el difunto, y el que lo coma adquirirá su sabiduría, coraje y otras cualidades nobles, que poseía Por lo general, las mujeres comían la mayor parte del cerebro y, por lo tanto, entre ellas, el número de casos era mayor. [3] Con la erradicación de una costumbre tan perniciosa, la enfermedad de Kuru fue derrotada casi por completo.
Para la descripción de la enfermedad de Kuru en 1976, Gaidusek recibió el Premio Nobel. Y aquí los motivos del Comité Nobel, que atrajo la atención de Vincent Zigas, no están claros. En su conferencia Nobel, Gaidusek habló sobre la naturaleza viral de la enfermedad de Kuru. Aprendemos si tenía razón o no más tarde.

Un paciente afectado por la "gallina".
"Tuve tiempo"Mientras tanto, avance rápido a Alemania. A principios del siglo XX, una clínica psiquiátrica en Breslau, un departamento dirigido por Alois Alzheimer. El médico de un joven barco viene a trabajar, quien decidió convertirse en neurólogo. Si bien persiste en comprender los conceptos básicos de la profesión, se las arregla para encontrar pacientes con una enfermedad desconocida hasta ahora. La investigación es interrumpida por la Primera Guerra Mundial, que devolvió al Dr. Hans-Gerhard Kreutzfeld a la marina. Solo en 1920, después de 6 años, publica una descripción de la enfermedad.
En la descripción encontramos que los pacientes perdieron su memoria a gran velocidad, dejaron de ser conscientes de sí mismos y murieron 8-12 meses después de las primeras manifestaciones del cuadro clínico. En las preparaciones cerebrales obtenidas de tales pacientes, se encontraron "estructuras esponjosas" características.
Vale la pena decir que fue increíblemente afortunado si llegaba seis meses tarde, y el viento del tiempo habría disipado su nombre durante siglos, ya que unos meses después el trabajo de Alfons Jacob con una descripción de la misma enfermedad que encontró el nombre de sus descubridores: la enfermedad de Creutzfeldt-Jakob. (CJK)
¿Qué podría ser común entre scrapie, kuru y CJK? Esta es la pregunta que los científicos comenzaron a formular en los años 50 del siglo XX, porque estas enfermedades eran muy similares a un largo período de incubación de 5 a 10 años y al triste destino invariable de la persona afectada, ya sea un animal o una persona. Además, el daño superó principalmente al cerebro. Se llamó a este grupo de enfermedades de neurodegeneración con un largo período de incubación.
Cuerpo principal
Los experimentos
Con el desarrollo de métodos experimentales de bioquímica, se hizo posible finalmente abordar estas patologías. Fue increíblemente difícil encontrar la fuente de infección, siempre y cuando las manifestaciones de la enfermedad se puedan detectar solo después de años, a pesar de las dificultades, los intentos de descubrir las causas de la enfermedad no se detuvieron. Los laboratorios estaban buscando formas de simplificar el trabajo experimental, reduciendo el período de incubación a uno aceptable.
Así que Patison y Guiley pudieron transmitir la enfermedad de ovejas a ovejas usando filtrados sin células. Para comenzar los experimentos de laboratorio, solo quedaba un paso: transferir la enfermedad de las ovejas al animal de laboratorio. Y Chandler lo hace en 1960, sobre el cual escribe un pequeño pero muy famoso artículo en 1961 [4]. Logró infectar un ratón de laboratorio con una sustancia del cerebro de un animal enfermo. Además, en estudios recientes, la manifestación de la enfermedad tuvo que esperar solo 7 meses. Se ha vuelto conveniente estudiar la enfermedad en el laboratorio.
La búsqueda de un agente infeccioso se ha intensificado. No fue posible instalarlo durante mucho tiempo. Al principio buscaron un virus desconocido, similar al herpes o la encefalitis, pero no encontraron nada. Fue sorprendente para todos los investigadores que la capacidad de infectar esta sustancia, aislada del cerebro de animales enfermos, persistiera después de un fuerte calentamiento prolongado y después del tratamiento con acetaminetilamina. Se realizaron experimentos en los que el filtrado se trató con radiación UV y ionizante dura. A pesar de esto, el filtrado retuvo la capacidad de infectarse. [5] Las sospechas comenzaron a arrastrarse porque los virus en este caso no tenían nada que ver con eso, porque los ácidos nucleicos (un componente indispensable de cualquier virus) simplemente colapsan bajo tal impacto.
Griffith, en una breve nota en una página y media de texto en 1967, expresó un pensamiento herético: el agente infeccioso no contiene ácidos nucleicos. [6] Esta es una proteína que es capaz de auto-reproducción en la célula. Fue con esta nota que comenzó una nueva era.
Proteína infecciosa
Los experimentos de investigación de la tembladera seguían siendo complejos y largos. Solo 15 años después, Stanley Pruziner, de la Universidad de California en San Francisco, identificó y describió un agente que, en su forma pura, puede causar el desarrollo de la enfermedad por tembladera. Resultó que esta increíble sustancia es resistente al calor, retiene la infectividad después del tratamiento con varios agentes dañinos, como: proteinasa K, urea, cloruro de guanidina, detergentes, SDS y nucleasas, enzimas que dañan el ADN, pero también se descubrió que este agente infeccioso es sensible a la ionización. radiación en presencia de oxígeno, que es característica de las proteínas hidrófobas que tienen una alta afinidad por los lípidos. [8]
Pruziner acuñó el nombre de un agente que causa la tembladera - “PRION” (prión - partícula infecciosa proteica). La proteína priónica (Prione Protein PrP) se aisló un poco más tarde. Los métodos de secuenciación en ese momento ya se desarrollaron bastante bien y rápidamente hicieron posible establecer la secuencia primaria de PrP. Todos comenzaron a buscar la fuente de PrP. Un artículo publicado en Nature en 1985, que marcó el final de la búsqueda, dejó perplejos a muchos investigadores: se encontró ARN de matriz (una molécula, una plantilla mediante la cual se sintetizan las proteínas) necesarias para la síntesis de PrP en un cerebro sano. [7]
Esto significaba solo una cosa: la proteína responsable del desarrollo de la enfermedad siempre está presente en el cerebro, independientemente del desarrollo de la enfermedad. Más tarde se descubrió que el gen que codifica PrP está presente en todos los mamíferos, así como en aves y peces.
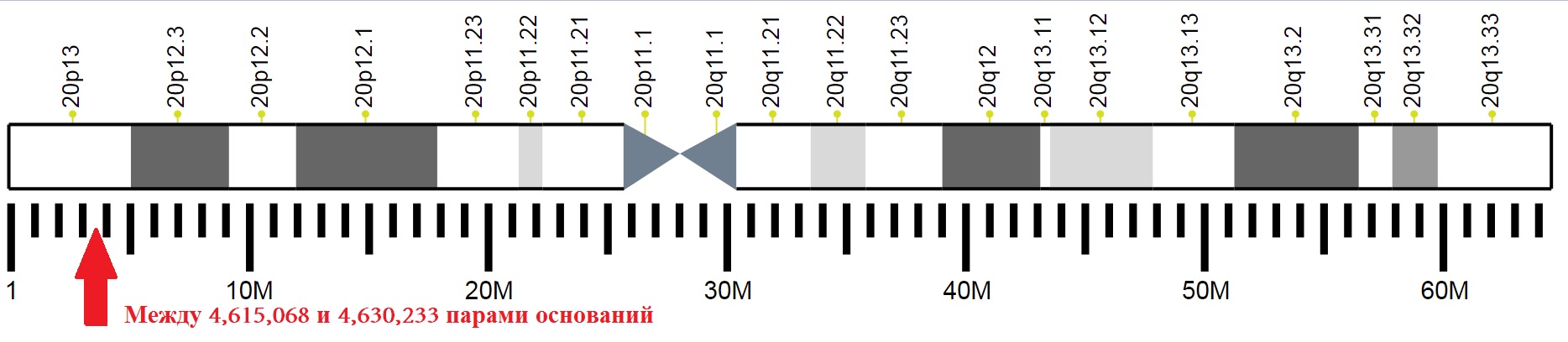
La ubicación de secciones individuales del vigésimo cromosoma de una persona con una marca de la ubicación del gen que codifica PrPC.
Estructura proteica
¿Qué es esta increíble proteína? Su función y después de 37 años desde el momento del descubrimiento no se ha aclarado (aquí vale la pena decir gracias al modelo occidental de ciencia de artículos de subvención). Se sabe que esta proteína está unida a la membrana celular. Y quizás responsable de las interacciones intercelulares en el cerebro.
Para comprender cómo la proteína común se vuelve contagiosa, debe observar la estructura de las proteínas. La estructura primaria de una proteína es la secuencia de residuos de aminoácidos. Esta secuencia es la misma en PrPC normal y en la forma infecciosa de PrPSc.
Se encontraron diferencias a nivel de la estructura espacial secundaria y terciaria. En PrPC, la estructura secundaria está representada por el 42% de las hélices α y el 3% de las estructuras β, mientras que al mismo tiempo PrPSc contiene el 30% de las hélices α y el 43% de las estructuras β. Este hecho sugiere que la forma patológica de la proteína se forma al plegar incorrectamente la secuencia de aminoácidos en capas plegadas β.
En la imagen de arriba, la secuencia de aminoácidos de PrP, con regiones resaltadas de varias estructuras de proteínas de las hélices H1, H2, P3 - α. La transformación de espirales en capas plegadas β se muestra a continuación. Imagen: Por Olivia May, Ph.D
Hipótesis de priones
Basado en los datos acumulados en 1991, Pruziner forma la Hipótesis del Prión, que postula lo siguiente:
- el agente infeccioso es la proteína PrPSc,
- el agente infeccioso PrPSc puede replicarse en ausencia de un ácido nucleico,
- La conversión de proteína de forma normal (PrPC) a infecciosa (PrPSc) ocurre a través de una transición conformacional,
- La transición conformacional de PrPC a PrPSc puede ocurrir espontáneamente, dando lugar a formas esporádicas de enfermedades priónicas. Puede ser causada por la ingestión de la forma patológica de PrPSc desde el exterior (formas adquiridas de enfermedades priónicas),
- la transición puede ocurrir debido a mutaciones en el gen Prnp que contribuyen a la formación de PrPSc a partir de PrPC (formas hereditarias de enfermedades por priones). [9,10].
Por lo tanto, las enfermedades por priones pueden ser causadas por un defecto genético, infección externa o una combinación de los mismos.
A pesar de los ardientes ataques de los críticos de esta teoría, ahora casi todos están de acuerdo en que Pruziner tenía razón, y existe una cantidad considerable de evidencia experimental de esto. Por ejemplo, si imaginamos que la reproducción de PrPSc después de la ingestión ocurre a través de la transferencia de conformación patológica a PrPC, entonces los organismos que carecen de PrPC deberían ser resistentes a la infección por priones. Tal experimento se realizó usando ratones transgénicos homocigotos para una deleción del gen Prnp (Prnp0 / 0). La introducción del tejido cerebral frotado de ratones enfermos con tembladera a ratones transgénicos Prnp0 / 0 no condujo al desarrollo de la enfermedad debido a la falta de PrP normal. Además, resultó que en ausencia de PrPC no solo se produce la reproducción de priones, sino que también se daña el tejido nervioso.
La prueba final del concepto de priones ha estado limitada por mucho tiempo por la imposibilidad de obtener una cantidad significativa de PrPres, una forma de PrPSc formada in vitro que es resistente a la proteólisis parcial y puede causar enfermedades cuando se administra a animales experimentales. Recientemente, se demostró que un fragmento de PrP de ratón recombinante sintetizado en Escherichia coli forma fibrillas in vitro que, cuando se introducen en ratones transgénicos que expresan el mismo fragmento de PrP, conducen al desarrollo de la enfermedad por priones. [13]
Recientemente, se ha desarrollado un sistema de amplificación cíclica de la forma priónica de la proteína PrP, con la ayuda de la cual es posible formar una cantidad significativa de PrPres (versión patológica artificial del prión) in vitro. Esto permitió obtener y demostrar la infectividad del prión sintetizado artificialmente.
Un lector atento notará que es poco probable que los priones formados en el cerebro de una oveja sean patógenos para los humanos. Y estarán casi en lo cierto. Se sabe que la transmisión de la infección por priones entre especies de mamíferos está limitada por barreras interespecíficas. Por ejemplo, la enfermedad de Creutzfeldt-Jakob se transmite de persona a persona y de humanos a chimpancés; La tembladera se transmite entre ovejas y cabras, pero no se transmite a los chimpancés. Al mismo tiempo, las barreras interespecíficas no son absolutas. Las barreras interespecíficas pueden expresarse no tanto en la imposibilidad de transmitir la infección a animales de una especie distante, sino en el alargamiento del período de incubación, así como en el hecho de que no todos, sino una parte de los animales infectados experimentalmente se enferman. Se cree que las barreras interespecíficas son causadas por diferencias en la estructura primaria de PrP y modificaciones en mamíferos de diferentes especies. Esto fue confirmado por las siguientes observaciones. Los ratones transgénicos que expresan la PrP del hámster fueron muy sensibles a la infección por el prión del hámster, en contraste con los ratones de tipo salvaje. La transmisión entre humanos y ratones de la enfermedad de Creutzfeldt-Jakob está limitada por la barrera interespecífica, pero los ratones transgénicos que expresan PrP humana son susceptibles a la infección.
También hay dificultades para infectar animales con proteína priónica pura. Estas dificultades pueden explicarse fácilmente.
La primera razón es que en las células de un organismo ordinario, las proteínas experimentan una modificación postraduccional, que es difícil de reproducir en condiciones experimentales.
La segunda razón es que el prión es una proteína de membrana y se debe suponer que su estructura es más estable en las condiciones de un entorno similar a la membrana, como lo demostraron estudios recientes.
Se demostró en ellos que los priones en presencia de colesterol y fosfatidiletanolamina formaron la forma patogénica mucho más fácilmente y tuvieron una infectividad mucho mayor.
Priones - armas biológicas
En este podría terminar de hablar de priones de miedo. Sin embargo, el lector legítimamente preguntará: "¿Y qué hay de las armas biológicas?" Después de todo, para que se produzca la infección, es necesario que la molécula de prión patógena ingrese al cerebro. No haremos una craneotomía por nosotros mismos ".
De hecho, la situación con posibles vías de infección resultó ser mucho peor de lo que uno podría imaginar.
En 1974, se describió el primer caso de enfermedad iatrogénica (debido a la exposición externa) de la enfermedad de Creutzfeldt-Jakob, generalmente considerada una patología genética.Hay descripciones de 3 casos de transmisión de CJD como resultado de una transfusión de sangre de un donante que fue diagnosticado con CJD durante un brote de la enfermedad en el Reino Unido [28]. ¿De dónde vino este brote? Como siempre, debido a la codicia. CJD se ha desarrollado en humanos después de comer carne infectada con priones.En 1986, una epidemia de enfermedad por priones en vacas estalló en Gran Bretaña, también llamada "enfermedad de las vacas locas", que provocó la muerte de más de 160,000 reses [29]. La razón fue el uso de suplementos nutricionales de harina de carne y hueso cuando, debido a reglas mal controladas para procesar subproductos animales, la PrPSc de ovejas y otros bovinos infectados con tembladera cayó en la alimentación de las vacas. Por lo general, la tecnología para producir dicha harina después de la molienda completa de la materia prima incluye el tratamiento con solventes grasos activos, así como el tratamiento térmico a una temperatura de 130 ° C. Sin embargo, a fines de los años 70, los empresarios, después de haber decidido aumentar el valor nutricional de la harina de carne y huesos, redujeron el modo de tratamiento térmico a 110 ° C y también redujeron la cantidad de sustancias extractoras de grasa.Fueron estos cambios los que contribuyeron al surgimiento y desarrollo de la epidemia entre el ganado vacuno.Se demostró que la epidemia en las vacas condujo a la aparición de un nuevo tipo de ECJ, llamada "variante de ECJ" [15]. Los primeros casos de FBC se informaron en 1995, cuando se diagnosticó la enfermedad en 2 adolescentes británicos [16,17]. Debido al largo período de incubación, el vínculo entre la enfermedad y la carne infectada en el Reino Unido no se estableció hasta que la incidencia en las vacas se haya convertido en una epidemia. La epidemia se tomó bajo control después de una matanza masiva de ganado y cambios en la tecnología de producción que redujeron drásticamente la contaminación de la carne con componentes del tejido nervioso. En el Reino Unido, el número anual de nuevos casos de ECJ, que alcanzó su punto máximo en 2000, está disminuyendo constantemente, y solo se confirmó un caso en 2013 [18].En todos los pacientes, la ECJ se desarrolló después de comer carne obtenida de ganado enfermo. Pero, a pesar de la epidemia generalizada que afectó a cientos de miles de reses, relativamente pocas personas que comieron carne de animales enfermos desarrollaron ECJ [33]. (recuerde la barrera interespecífica).El período de incubación (el tiempo entre el consumo de carne infectada y la manifestación de los síntomas) fue largo: la mayoría de los pacientes se infectaron a fines de los 80 y la incidencia máxima se produjo a principios de la década de 2000, es decir, el período de incubación fue de 11-12 años. En los últimos casos diagnosticados, el período de incubación fue de 12 a más de 20 años [18,19].Las manifestaciones clínicas de la variante CJD son diferentes de otras formas de CJD. La enfermedad se pone al día con los jóvenes de hasta 30 años, su aparición se caracteriza por cambios de personalidad: el paciente pierde sus viejos intereses, comienza a rechazar a las personas cercanas, desarrolla ansiedad, insomnio, depresión. Los trastornos del movimiento ocurren aproximadamente seis meses después del inicio de la enfermedad. La demencia ocurre más tarde que en la forma clásica, el paciente es consciente de su empeoramiento. Bastante rápido, pierde la capacidad de autoservicio. No solo el inicio a una edad más joven, sino también la supervivencia promedio que excede los 14 meses son típicos de cJDV [18,19]. Es probable que las diferencias en la supervivencia entre la ECJ clásica y su variante estén en parte relacionadas con la corta edad de los pacientes.Entonces, la naturaleza misma nos ha demostrado la posibilidad de usar priones como armas con un tiempo de exposición retrasado.Para mi profundo pesar, en 2011 durante el trabajo experimental en el estudio de la enfermedad de Creutzfeldt-Jakob, se mostró en ratones la posibilidad de infección en el aire con aerosoles que contienen partículas de priones.¿Son los priones un arma biológica ideal?
¿Cuáles son las principales ventajas?- La enfermedad se manifiesta en un período retrasado, el atacante tiene tiempo para infectar a tantas personas como sea posible. En este caso, todos los que estén a su alrededor estarán en completa ignorancia.
- Puede detener la infección, tan silenciosamente como la comienza. Encontrar rastros y la fuente de infección después de 5-7 años será increíblemente difícil. Además, necesitará saber qué buscar.
- . ,
- .
- , . . , .
- .
- . , [9]
Los priones son la tecnología perfecta para el terror. Existe una tecnología bien descrita para la síntesis de formas patógenas de proteínas priónicas [13].Incluso si fuera difícil para un terrorista ordinario organizar un laboratorio bioquímico, nadie se molesta en usar innumerables rebaños de animales para obtener una gran cantidad de sustancia cerebral infectada con CJD.Nadie ni nada detendrá a los terroristas de comenzar la síntesis masiva de proteínas priónicas y agregarlas a la leche en polvo, fórmula infantil, carne picada, despojos de carne y hueso, harina de soya o cualquier otra sustancia, cuya planta de producción estará a su alcance.Si imaginamos que un bioquímico talentoso caerá en manos de los terroristas por la fuerza o por razones financieras, ideológicas y de otro tipo, entonces nadie evitará que sintetice un aerosol de proteína lipídica con partículas de priones. Luego rocíe aerosol indetectable en los sistemas de ventilación. Este método es más terrible que a través de los alimentos, ya que el ganglio nasofaríngeo tiene una estrecha conexión con el cerebro y la probabilidad de infección aumenta muchas veces.Imagina los efectos de la infección. Después de 3-7, o tal vez los 15 años en un territorio ilimitado, comienza el desarrollo masivo de la enfermedad priónica del cerebro. Pánico, horror, miedo, destrucción. Ciudades enteras de personas son zombis, cuyo cerebro literalmente se convierte en una esponja. No hay cura, no hay esperanza, solo el horror de una muerte inminente inevitable.Conclusión
El uso de tales armas es solo cuestión de tiempo. Por lo tanto, ahora debe seguir una serie de pasos:- Realice investigaciones sobre la creación de sistemas de detección confiables para priones patológicos en alimentos, agua, aire y haga que esta prueba sea obligatoria para su uso en todo el mundo. Introducir sistemas de detección de proteínas priónicas.
- Buscar la posibilidad de diagnosticar la aparición de priones patológicos en humanos. Hay buenas noticias de que se ha desarrollado un método altamente sensible para detectar priones patológicos. [12]
- Busque una manera de curar a una persona. Lo que parece increíblemente difícil, a pesar de los avances prometedores con anticuerpos anti-prión que pueden cruzar la barrera hematoencefálica.
- Rastree casos masivos de enfermedades por priones en animales a nivel de servicios especiales.
Deseo de año nuevo
¡Deseo no encontrarme nunca con una sola molécula de PrPSC!Buscaré una oportunidad para obtener una prueba de diagnóstico altamente sensible: un sistema para determinar si ya hemos logrado infectarnos ...Referencias a fuentes1. www.nobelprize.org/prizes/medicine/1976/gajdusek/biographical2. Gajdusek, DC; Zigas, V. (1957-11-14). "Enfermedad degenerativa del sistema nervioso central en Nueva Guinea". New England Journal of Medicine. 257 (20): 974–978.3. Hussain Khan, CG Bio-medical Paradigm // Temas bio-sociales en salud. Editor general, RK Pathak. Nueva Delhi: Northern Book Center, 2008. - p. 15
4. Chandler RL (1961) Lancet, 1,1378–1379
5. Alper T., Cramp WA, Haig DA, and Clarke MC (1967) Nature, 214, 764–766.
6. Griffith JS (1967) Nature, 215,1043–1044.
7. Chesebro B., Race R., Wehrly K., Nishio J., Bloom M., Lechner D., Bergstrom S., Robbins K., Mayer L., Keith JM, et al. (1985) Nature,315, 331–333.
8. Prusiner SB (1982) Science, 216,136–144
9. Prusiner SB (1991) Science, 252,1515–1522
10. Prusiner SB (1993) Proc. Natl. Acad. Sci. USA Vol. 90, pp. 10962-10966, December 1993 Biochemistry
11. Saima Zafar et al., Handbook of Clinical Neurology, Vol. 165, 2019 (3rd series)
12. Serena Singh, Mari L. DeMarco JALM, January 2020
13. Nature Communications (2018) Chae Kim, Xiangzhu Xiao, Shugui Chen, Tracy Haldiman, Vitautas Smirnovas, Diane Kofskey, Miriam Warren, Krystyna Surewicz, Nicholas R. Maurer, Qingzhong Kong, Witold Surewicz & Jiri G. Safar Artificial strain of human prions created in vitro volume 9, Article number: 2166
14. Llewelyn CA, Hewitt PE, Knight RS, Amar K, Cousens S, Mackenzie J, Will RG. Possible transmission of variant Creutzfeldta Jakob disease by blood transfusion. Lancet. 2004;363:417-421.
15. Collinge J. Human prion diseases and bovine spongiform encephalopathy (BSE). Hum Mol Genet. 1997;6(10):1699-1705
16. Bateman D, Hilton D, Love S, Zeidler M, Beck J, Collinge J. Sporadic Creutzfeldt Jakob disease in a 18-year-old in the UK. Lancet. 1995; 346(8983):1155-1156.
17. Britton TC, al-Sarraj S, Shaw C, Campbell T, Collinge J. Sporadic Creutzfeldt—Jakob disease in a 16-year-old in the UK. Lancet. 1995; 346(8983): 1155.
18. Soomro S, Mohan Ch. Biomarkers for sporadic Creutzfeldt Jakob disease. Annals of Clinical and Translational Neurology. 2016;3(6):465-472.
19. Imran M, Mahmood S. An overview of human prion diseases. Virol J. 2011;8:559.