
على الرغم من وجود عوائق وصعوبات واضحة تعيق أحيانًا تطوير وتنفيذ منتجات الهندسة الوراثية (GI) ، لا يمكن تخيل القرن الحادي والعشرين بدون ثمار هذه التكنولوجيا المهمة والمتنوعة في ترسانة عالم الأحياء الحديث. البكتيريا هي أكثر الكائنات الحية استخدامًا في الجهاز الهضمي.
ما هو الجهاز الهضمي ولماذا نحتاجه؟ لماذا تحظى البكتيريا بشعبية كبيرة لدى المهندسين الجينات؟ ما هي أسهل طريقة لإدخال الجين المطلوب إلى البكتيريا؟ ما الصعوبات التي يمكن مواجهتها عند العمل مع هذه الكائنات الحية؟ ماذا حدث من قبل: إنشاء أول بكتيريا معدلة وراثيا أو اكتشاف بنية الحمض النووي والجينوم؟ اقرأ عن هذا وأكثر من ذلك بكثير تحت القط.
0. برنامج تعليمي موجز في علم الأحياء
تقدم هذه الفقرة وصفًا موجزًا لما يسمى
بالعقيدة المركزية للبيولوجيا الجزيئية . إذا كانت لديك معرفة أساسية بالبيولوجيا الجزيئية ، فلا تتردد في التخطي إلى الخطوة 1.
 العقيدة المركزية للبيولوجيا الجزيئية في صورة واحدة
العقيدة المركزية للبيولوجيا الجزيئية في صورة واحدةلذلك دعونا نبدأ. يتم ترميز جميع المعلومات حول جميع مراحل التطور وخصائص أي كائن حي ، سواء
بدائيات النوى (البكتيريا) أو
القديمة أو
حقيقيات النواة (كل الباقي مفرد ومتعدد الخلايا) في الحمض النووي الجيني ، وهو مركب من سلسلتين متعدد النوكليوتيدات مكملان لبعضهما البعض ، وتشكيل حلزون مزدوج ( نوكليوتيدات DNA التكميلية: AT و GC). كروموسومات حقيقيات النوى هي جزيئات DNA خطية مزدوجة الشرائط ، ويتم كروموسومات بدائية النواة. غالبًا ما تشكل الجينات جزءًا صغيرًا فقط من الجينوم بأكمله (في البشر - حوالي 1.5٪).
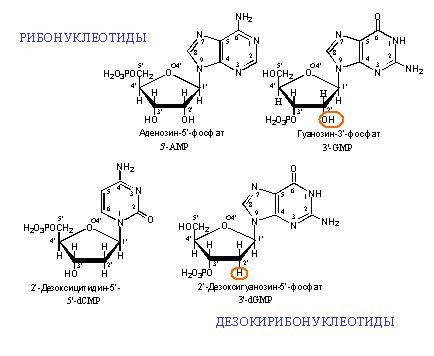 أمثلة على مونومرات DNA و RNA. "Deoxy" في اسم DNA يعني عدم وجود ذرة أكسجين في الموضع 2 '(في الشكل ، الموضع 2' محاطة بدائرة باللون الأحمر).
أمثلة على مونومرات DNA و RNA. "Deoxy" في اسم DNA يعني عدم وجود ذرة أكسجين في الموضع 2 '(في الشكل ، الموضع 2' محاطة بدائرة باللون الأحمر).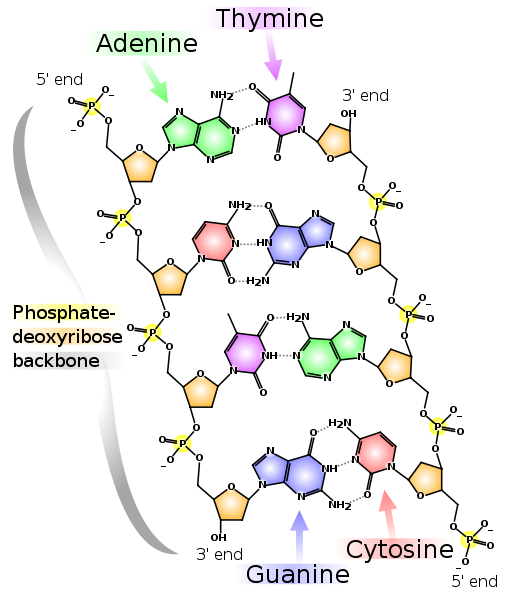 خيطين من الحمض النووي التكميلي. تظهر الخطوط المتقطعة الروابط الهيدروجينية بين القواعد. كما يتبين ، يشكل الأدينين والثيامين رابطين هيدروجين بين بعضهما البعض ، ويشكل الجوانين والسيتوزين ثلاثة. لذلك ، تكون رابطة GC أقوى ، والأجزاء الغنية بـ GC من DNA المزدوج المجدول أكثر صعوبة في الفصل إلى سلسلتين.
خيطين من الحمض النووي التكميلي. تظهر الخطوط المتقطعة الروابط الهيدروجينية بين القواعد. كما يتبين ، يشكل الأدينين والثيامين رابطين هيدروجين بين بعضهما البعض ، ويشكل الجوانين والسيتوزين ثلاثة. لذلك ، تكون رابطة GC أقوى ، والأجزاء الغنية بـ GC من DNA المزدوج المجدول أكثر صعوبة في الفصل إلى سلسلتين.لاحظ أن كل سلسلة لها نهاية 5'ونهاية 3'. يمكن ملاحظة أنه بالقرب من نهاية 5'للسلسلة اليسرى توجد نهاية 3'لليمين والعكس بالعكس ، وبالتالي فإن السلاسل تسمى "antiparallel". يحتوي RNA أيضًا على نهاية 5'- و 3'. تم اختيار الوضعين 5 و 3 للإشارة إلى البداية والنهاية لأنه من خلالها يتم تكوين روابط تساهمية في سلاسل DNA و RNA.
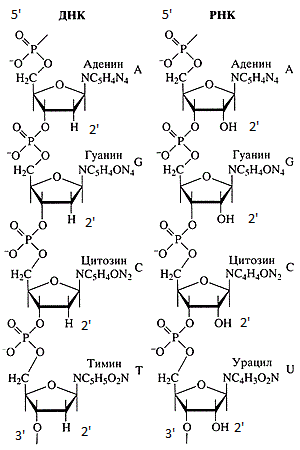 سلاسل DNA و RNA.
سلاسل DNA و RNA.دائمًا ما يتم تسجيل تسلسلات DNA و RNA من الطرف 5 إلى النهاية 3. هناك عدد من الأسباب لذلك:
- يبدأ تخليق سلاسل DNA و RNA الجديدة من النهاية 5'( DNA polymerase (إنزيمات توليف سلسلة DNA التكميلية في مصفوفة DNA أو RNA) و RNA polymerase (إنزيمات توليف سلسلة RNA مكملة على مصفوفة DNA أو RNA) الاتجاه 3 '-> 5' ، لذلك يتم تصنيع سلسلة جديدة في الاتجاه 5 '-> 3') ؛
- يقرأ الريبوسوم الكودونات ، يتحرك على طول mRNA في اتجاه 5 '-> 3' ؛
- يتم كتابة تسلسل الحمض الأميني في سلسلة ترميز الحمض النووي في الاتجاه 5 '-> 3' (جزء كبير من mRNA هو نسخة طبق الأصل من منطقة ترميز الحمض النووي مع استبدال الثايمين مع اليوراسيل ومجموعة هيدروكسيل (-OH) بدلاً من الهيدروجين في الموضع 2 '، بالطبع) ؛
- أخيرًا ، من الملائم وجود قاعدة تسجيل مقبولة بشكل عام.
الجين هو جزء من DNA الجينومي الذي يحدد تسلسل النيوكليوتيدات في جزيء RNA:
- تشفير RNA: messenger RNA (mRNA) ، حيث يتم ترميز تسلسل الحمض الأميني للبروتين المقابل ككودونات. يمكنك أيضًا العثور على اسم "RNA الإعلامية" ، ثم يبدو الاختصار مثل "mRNA" ؛
- RNA غير المشفر: RNA النقل ، RNA الريبوزومي وغيرها.
دور الحمض الريبي النووي النقال هو توصيل الأحماض الأمينية إلى مجمع مرنا - الريبوسوم. بالإضافة إلى ذلك ، فإن الحمض الريبي النووي النقال هو المسؤول عن التعرف على كودونات مرنا ؛ لهذا ، فإن كل الحمض الريبي النووي النقال يشمل ما يسمى "أنتيكونون" - ثلاثية مكملة لرمز مرنا.
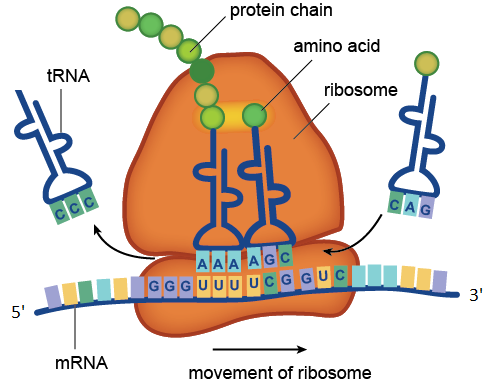 حفزت عملية الريبوزوم عملية الترجمة. في الشكل ، تم التعرف على كودونات UUU و UCG الواردة في mRNA بواسطة مضادات الأنماط AAA و AGC الموجودة في جزيئات tRNA. نقل RNA مع CCC المضاد للكودون بالفعل حمضه الأميني إلى سلسلة البروتين المتنامية ، و tAG مع CAG المضاد للكودون ينتظر في الطابور. تتكون مؤامرة جزيء مرنا الموضح في الشكل من أربعة كودونات: GGGUUUUCGGUC. يتوافق الكودون GGG مع جليسين الأحماض الأمينية ، UUU إلى فينيل ألانين ، UCG إلى سيرين ، GUC إلى فالين. لذا فإن منطقة mRNA هذه ترمز إلى جزء من البروتين بتسلسل الحمض الأميني glycine-phenylalanine-serine-valine.
حفزت عملية الريبوزوم عملية الترجمة. في الشكل ، تم التعرف على كودونات UUU و UCG الواردة في mRNA بواسطة مضادات الأنماط AAA و AGC الموجودة في جزيئات tRNA. نقل RNA مع CCC المضاد للكودون بالفعل حمضه الأميني إلى سلسلة البروتين المتنامية ، و tAG مع CAG المضاد للكودون ينتظر في الطابور. تتكون مؤامرة جزيء مرنا الموضح في الشكل من أربعة كودونات: GGGUUUUCGGUC. يتوافق الكودون GGG مع جليسين الأحماض الأمينية ، UUU إلى فينيل ألانين ، UCG إلى سيرين ، GUC إلى فالين. لذا فإن منطقة mRNA هذه ترمز إلى جزء من البروتين بتسلسل الحمض الأميني glycine-phenylalanine-serine-valine.الرنا الريبوزومي هي مكونات لا غنى عنها في الريبوسوم. تتمثل الوظيفة الرئيسية لـ rRNA في ضمان عملية الترجمة: فهي تشارك في قراءة المعلومات من mRNA باستخدام جزيئات محول من tRNA وتحفيز تكوين روابط الببتيد بين الأحماض الأمينية المرتبطة بـ tRNA وسلسلة البروتين المتنامية.
 الأنواع الرئيسية لجزيئات الرنا (في الواقع ، هناك الكثير).
الأنواع الرئيسية لجزيئات الرنا (في الواقع ، هناك الكثير).البروتين ، من ناحية أخرى ، هو سلسلة من الأحماض الأمينية مرتبطة تساهميًا ببعضها البعض عبر رابطة الببتيد (يمكنك رؤية ما يشبه المفسد قليلاً). بعد التوليف ، يجب أن تأخذ سلسلة الأحماض الأمينية بنية مكانية معينة - "
التشكل " (
أخبروني بالفعل عن البنية المكانية للبروتينات
في Geektimes ). بالإضافة إلى ذلك ، تتكون العديد من البروتينات الكبيرة في الواقع من عدة بروتينات مدمجة بالتفاعلات الكارهة للماء وروابط الهيدروجين في بنية مستقرة واحدة. في هذه الحالة ، يُطلق على كل من "بروتينات البناء" "وحدة فرعية" ، ويسمى البروتين الكبير الناتج بـ "وحدات فرعية متعددة".
20 من الأحماض الأمينية التي تتكون منها البروتينات  مجمع الريبوزومي. تم التقاط الصورة من منشور OlegKovalevskiy "الطباعة ثلاثية الأبعاد لنماذج جزيء البروتين" .
مجمع الريبوزومي. تم التقاط الصورة من منشور OlegKovalevskiy "الطباعة ثلاثية الأبعاد لنماذج جزيء البروتين" .في حالة الجينات المشفرة للبروتين ، تبدو عملية فك تشفير المعلومات الوراثية كما يلي:
- RNA polymerase يتعرف على المروج ويربطه (إذا كان "مفتوحًا" ، فسوف نناقش المزيد من تنظيم نشاط المروج) ؛
- استنادًا إلى مبدأ التكامل ، يقوم إنزيم بوليميراز RNA على مصفوفة DNA بتكوين "فارغ" من قالب RNA (ما قبل mRNA ، في حقيقيات النوى) أو mRNA الوظيفي النهائي (في بدائيات النوى). هذه العملية تسمى "النسخ" .
- (فقط في حقيقيات النوى) يخضع جزيء ما قبل مرنا تعديلات ("ينضج") ويصبح مرنا وظيفيا ؛
- يتم التعرف على mRNA بواسطة الريبوسوم ، وهو إنزيم يفك شفرة الشفرة الثلاثية لـ mRNA ، وبناءً عليه ، يقوم بتوليف الببتيد / البروتين. يتم توصيل الأحماض الأمينية التي يبني منها الريبوسوم البروتين في مركب مع النقل RNA ( tRNA ). هذه العملية تسمى "البث" ؛
- يمكن أن يخضع الببتيد / البروتين لتعديلات ما بعد الترجمة ("النضج" عن طريق القياس مع mRNA) ويصبح فعالاً. عامل مهم هو أن نظام تعديل ما بعد الترجمة من حقيقيات النوى أكثر تعقيدًا وتنوعًا من نظام بدائيات النوى ، لذلك ، لا يمكن تصنيع كل بروتين حقيقيات النوى بشكل صحيح بواسطة البكتيريا.
بالإضافة إلى مناطق التشفير ، يحتوي الجينوم على العديد من الأجزاء التي تشارك أيضًا في النسخ بطريقة أو بأخرى. يتم التعرف على المؤامرات الموجودة بالقرب من الجين وتسمى المروجين بواسطة polymerases RNA (يقولون أن الجين تحت سيطرة هذا المروج). يتم التعرف على المروجين المختلفة من قبل البوليمرات RNA المختلفة. على سبيل المثال ، لن يتم نسخ الجين الخاضع لسيطرة محفز
الجراثيم إلى بكتيريا إذا لم يتم تصنيع بوليميراز RNA من الجراثيم المقابلة فيه.
بشكل عام .
يمكن أن يكون لكل جين أيضًا عدة تسلسلات تنظيمية ، والتي يمكن أن تكون موجودة إما مباشرة بالقرب من المروج (أو حتى تتداخل معها) ، أو على مسافة عشرات الآلاف من أزواج النوكليوتيدات منه. تسمى عناصر تعزيز النسخ
"المحسنات" ، وتسمى عناصر
تثبيط النسخ كواتم الصوت ، وتسمى البروتينات التي تتفاعل معها
عوامل النسخ . على الرغم من أنه من المعتاد أيضًا استدعاء عوامل النسخ ، فإن المكونات الضرورية لمجمع بدء النسخ ، والتي بدونها يكون النسخ مستحيلًا من حيث المبدأ. والحقيقة هي أنه فقط لبدء تركيب جزيء الحمض النووي الريبي على مصفوفة الحمض النووي في حقيقيات النوى والأثريات ، فإن تجميع المركب فوق الجزيئي بأكمله ضروري. تتضمن أبسط هذه المعقدات أنزيم بوليميراز RNA وستة ما يسمى
"عوامل النسخ الشائعة" (TFIIA و TFIIB و TFIID و TFIIE و TFIIF و TFIIH). يطلق على المجمع نفسه اسم
"معقد ما قبل النسخ" (
مقطع فيديو ، يتم تمييز كل مكون من مكونات المركب بلون أو آخر).
مجمع النسخ بدائية النواة مختلف تمامًا ، لذلك ليس هناك فائدة من تضمين الجين الحقيقي النواة مع المروج حقيقي النواة في البكتيريا. يمكن تسمية التناظرية بدائية النواة لعوامل النسخ الشائعة من حقيقيات النوى و archaea بروتين يسمى
"عامل سيجما" .
 مجمع النسخ بدائية النواة. تعتبر الحروف الموضحة في الشكل تسميات مقبولة عمومًا للوحدات الفرعية المقابلة. 70- عامل سيجما لجينات E. coli المنزلية
مجمع النسخ بدائية النواة. تعتبر الحروف الموضحة في الشكل تسميات مقبولة عمومًا للوحدات الفرعية المقابلة. 70- عامل سيجما لجينات E. coli المنزليةتشترك جينومات بدائيات النوى وحقيقيات النوى في العديد من السمات المشتركة ، والعقيدة المركزية للبيولوجيا الجزيئية ، المذكورة سابقًا ، صحيحة لكلتا الممالك. ومع ذلك ، هناك أيضًا العديد من الاختلافات المهمة. على سبيل المثال ، تتميز البكتيريا بنظام من الأوبونات - جينات مجمعة معًا تشارك في نفس العملية ولا يتم نسخها بشكل منفصل ، ولكن كجزء من مرنا طويل واحد. في حقيقيات النوى ، كل شيء مختلف تمامًا: تتناثر الجينات المشاركة في عملية واحدة عبر الكروموسومات المختلفة ، وتنقسم الجينات نفسها إلى أجزاء ترميز
exons بواسطة مناطق غير
مشفرة للإنترونات . في هذه الحالة ، في البداية يتم نسخ الجين بالكامل ، وبعد ذلك ، في مرحلة الحمض النووي الريبي ، يتم استئصال الإنترونات ، وتتقاطع exons لتشكيل mRNA الترميز. هذه العملية تسمى
الربط . في الوقت نفسه ، لا يمكن دمج جميع exons المتاحة في mRNA النهائي ، ولكن جزءًا منهم فقط ، في هذه الحالة ، يتحدث عن
"الربط البديل" . وهكذا ، يمكن لخلية حقيقية النواة توليف العديد من البروتينات ، مع نسخ نفس الجين. من بين أمور أخرى ، يعطي هذا نتيجة مهمة للغاية: غالبًا ما يكون من غير المنطقي إدخال الجين حقيقي النواة في البكتيريا "كما هو الحال في الكروموسوم" ، لأن البكتيريا ببساطة غير قادرة على الربط.
هناك فرق مهم آخر. تتميز بدائيات النوى بوجود مادة جينية قائمة على الحمض النووي خارج الحلقة "كروموسوم" ، ما يسمى ب
"البلازميدات" - وهي جزيئات صغيرة دائرية مزدوجة الجديلة. بالإضافة إلى ذلك ، تفتقر بدائيات النوى إلى العضيات ، بما في ذلك النواة: جميع مكونات الخلية البكتيرية لها حرية السفر في جميع أنحاء الفضاء داخل الخلايا. ومع ذلك ، لا تحتوي حقيقيات النوى على بلازميدات ، ولكن هناك
بلاستيدات وميتوكوندريا في الجينوم الذي يتم تضمين البلازميدات (وفقًا للفرضية الأكثر ثباتًا ، فإن البلاستيدات والميتوكوندريا هي "أحفاد" العمارة بدائية النواة لجينوم البكتيريا الزرقاء والبكتيريا المحصورة داخل البروتون أحادي الخلية القديم). علاوة على ذلك ، فإن وجود نواة وأجزاء أخرى داخل الخلية محاطة بغشاء خاص بها هو بالفعل نموذجي لحقيقيات النوى. لذلك ، تتطلب الهندسة الوراثية للخلايا حقيقية النواة أساليب مختلفة عن الهندسة الوراثية للبكتيريا.
يتم تنظيم الشفرة الوراثية نفسها على النحو التالي. يتكون كل جين / إكسون من مجموعة من ثلاثة توائم / كودونات - سلاسل من ثلاث نيوكليوتيدات لا توجد فجوات بينها. منظمة ثلاثية صالحة على حد سواء للجينات في الحمض النووي وجزء الترميز من مرنا. في عملية الترجمة ، نقل الحمض النووي الريبي (الحمض الريبي النووي النقال) تحمل حمض أميني محدد "التعرف" على ثلاثة توائم من ثلاثة أحرف. يفصل الريبوسوم الحمض الأميني من الحمض الريبي النووي النقال ويربطه بسلسلة الأحماض الأمينية المتنامية ، والتي ستصبح في نهاية الترجمة على الفور بروتينًا ناضجًا يعمل بكامل طاقته ، أو قبل خضوعه أيضًا لسلسلة من التعديلات. في هذه الحالة ، يتوافق حمض أميني واحد فقط مع كل ثلاثية ، ولكن يمكن أن تتوافق عدة كودونات مختلفة مع حمض أميني واحد. هذا أمر مفهوم ، لأنه يوجد في الكود الجيني القياسي 61 كودونًا للتشفير ، ولا يوجد
سوى 20 من الأحماض الأمينية البروتينية (إجمالي الكودونات ، بالطبع ، 4 * 4 * 4 = 64 ، لكن ثلاثة منها غير مشفرة ، وبدلاً من ذلك فهي بمثابة إشارة لإيقاف الترجمة وتسمى " أوقف الكودونات ").
 الكودونات في الكود الجيني القياسي. بفضل ويكيبيديا للصورة.
الكودونات في الكود الجيني القياسي. بفضل ويكيبيديا للصورة.لذا ، البروتينات هي بالضبط تلك العناصر التي هي الحلقة الأخيرة في السلسلة بين الحمض النووي الجيني وخصائص الجسم ، ما يسمى
"النمط الظاهري" . لذلك ، من أجل تغيير خصائص الكائن الحي المهم بالنسبة لنا بطريقة أو بأخرى ، نحتاج إلى تغيير الحمض النووي الخاص به بطريقة ، ونتيجة لذلك ، تظهر بعض البروتينات في خلاياه ، والتي ستزودنا بالنتيجة المستهدفة. هذه هي الفكرة الأساسية لكل الهندسة الوراثية.
1) لأي غرض تستخدم البكتيريا في الهندسة الوراثية ولماذا
لذا ، اكتشفنا كيف ولماذا يؤثر تسلسل الحمض النووي الجيني على خصائص وخصائص الجسم. بالطبع ، سيكون من الجيد جدًا إذا تم تحديد السمة تمامًا بواسطة جين واحد فقط - لم يعد إدخال جزء صغير مشكلة خطيرة. على سبيل المثال ، غالبًا ما يتم تحديد مقاومة النبات لمبيدات الأعشاب أو الآفات بجين واحد ، لذلك فإن إنشاء أصناف بالمقاومة المطلوبة في مثل هذه الحالات ليس أمرًا صعبًا (على عكس جلب مثل هذا النبات إلى السوق). وينطبق الشيء نفسه على العديد من مقاومة البكتيريا للمضادات الحيوية (في الواقع ، لدى البكتيريا العديد من آليات الحماية ضد المضادات الحيوية ، ولكنها تعمل بطريقة مستقلة). المثال المعاكس ، على سبيل المثال ، محاولة العلماء لتعليم النباتات لامتصاص النيتروجين من الغلاف الجوي. والحقيقة هي أن المصدر الوحيد للنيتروجين للنباتات هو التربة التي يتم فيها تصنيع المركبات المحتوية على النيتروجين المناسبة لاستيعاب النبات بواسطة الكائنات الحية الدقيقة (أو التي يتم إدخالها في شكل أسمدة من قبل بستاني رعاية أو كلب يمر). من الواضح أن إنشاء مصنع بآلية غذائية بديلة سيكون مفيدًا جدًا للزراعة. ولكن ، لسوء الحظ ، فإن هذه العملية معقدة للغاية لدرجة أن مشكلة "نقلها" من الكائنات الحية الدقيقة إلى النبات لم يتم حلها حتى الآن.
أخيرًا ، إذا كان هدفنا هو الحصول على البروتين لأي غرض محدد (دراسة بنية البروتين ووظائفه ، وإنشاء المستحضرات الطبية أو الكواشف المختبرية على أساسه ، وما إلى ذلك) ، فمن الواضح أيضًا أننا سعداء تمامًا بدمج جين واحد في الخلية ، والذي في هذه الحالة ، من المعتاد تسمية "كائن المنتج".
البكتيريا في الهندسة الوراثية هي مصدر محتمل لخلق:
- منتج للبروتين الذي نحتاجه على مستوى المختبر أو الصناعة ؛
- عامل نشط في تحويل كيميائي معين لمركب إلى آخر ، سواء كان ذلك عملية تخمير في صناعة الأغذية ، وخلق ظروف أكثر ملاءمة لنمو النبات من خلال إدخال "منتج الأسمدة البكتيرية" في التربة أو التخلص من خردة الصلب ؛
- klonotek من الجينات (موضوع ، وصف جيد سيزيد من حجم المقالة إلى غير لائق) ؛
- دواء هام طبيًا ، على سبيل المثال ، لاستعادة البكتيريا في الجهاز الهضمي ؛
- سلالات بكتيرية من Agrobacterium tumefaciens للتعديل الجيني اللاحق للنباتات.
* يمكن أن أنسى شيئًا ، لذا فإن الإضافات في التعليقات مرحب بها.
حقيقة مثيرة للاهتمام هي أن التجارب الناجحة الأولى في مجال الهندسة الوراثية للبكتيريا حدثت قبل وقت طويل من العمل التاريخي لـ Watson و Crick. علاوة على ذلك ، وعلى أساس هذه التجارب ، تم إثبات حقيقة أن المعلومات الموجودة في الحمض النووي ، وبعد ذلك لم يتمكن العلماء من قضاء وقتهم في فرضيات حول الحمض النووي الريبي والبروتين.
يُعرف هذا العمل ، الذي تم إجراؤه في عام 1944 ، باسم
Avery و MacLeod و McCarthy Experiment ، استنادًا إلى
عمل فريدريك غريفيث ، حيث تم العثور على أن إصابة سلالات المكورات الرئوية غير الممرضة الحية والمسببة للعدوى المسببة للمرض تسبب تطور المرض ، بينما فرديا أنها لا تسبب أعراض كبيرة. من هذه التجربة ، تم استنتاج أن البكتيريا الميتة قادرة على نقل شيء إلى "زميل" غير ممرض ، ونتيجة لذلك تصبح خطيرة. لكن ماذا يمررون لبعضهم البعض؟ بحلول عام 1944 ، كان هناك ثلاثة مرشحين رئيسيين: DNA ، RNA ، والبروتين. من أجل إنشاء الناقل ، تم إجراء تجربة أنيقة: في ذلك الوقت ، كانت الإنزيمات القادرة على تدمير DNA (DNase) بشكل منفصل ، RNA (RNase) بشكل منفصل وبروتينات منفصلة (بروتيناز) متاحة بالفعل. وقد تبين أن نقل الخصائص المسببة للأمراض لم يحدث فقط في تلك الحالات عندما تم علاج إعداد سلالة ممرضة ميتة باستخدام DNase ولم يكن يعتمد على علاج الدواء باستخدام RNase والبروتينات.
وهكذا ، ثبت أن الحمض النووي هو الناقل للمعلومات حول العلامات. بالإضافة إلى ذلك ، فقد ظهر بوضوح أن الاختراق التلقائي لجزيء DNA غريب في الخلية البكتيرية ممكن.
لماذا تحظى البكتيريا بشعبية كبيرة مع وجود عيوب واضحة (على سبيل المثال ، نقص التعديلات حقيقية النواة بعد الترجمة)؟ كل شيء بسيط.
فهي متواضعة في التشغيل وسهلة الاستخدام ولا تتطلب وسائط مغذية باهظة الثمن.2) كيف يتم إنشاء بنية جينية يتم إدخالها في البكتيريا
الهندسة الجينية الحديثة للبكتيريا هي في الأساس إدخال ناقل البلازميد (بلازميد بكتيري معدل يحتوي على الجين المستهدف ومجموعة من العناصر الضرورية الأخرى ، والتي سيتم مناقشتها أدناه). تغيير الكروموسوم البكتيري أقل شيوعًا ، لكن هذا الإجراء ليس غريبًا أيضًا: على سبيل المثال ، تم إدخال جين T7 البكتيري RNA polymerase في كروموسوم E. coli باستخدام ناقل يعتمد على الدفع λ أثناء إنشاء إحدى السلالات الشائعة في لوحة المختبر. هناك ثلاثة أسباب لاختيار الباحث غالبًا إدخال الجين في ناقلات البلازميد:إن ناقل البلازميد النموذجي للعمل مع البكتيريا هو جزيء دنا دائري مزدوج مزدوج الخيط يحمل جين البروتين المستهدف تحت سيطرة مروج محدد وعدد من الجينات والعناصر التنظيمية الضرورية ، ويضمن وجودها كمية ثابتة من البلازميد في الخلية ("التحكم في النسخ"). من الواضح ، حتى في حالة توليف mRNA فائق الكفاءة ، فإن الناقل لن يكون له فائدة تذكر إذا كان موجودًا في البكتيريا في كمية زوج من القطع: في عملية الانقسام ، فإن احتمال تكوين خلية ابنة بدون البلازميد الضروري سيكون عاديًا.بالإضافة إلى الجين والمحفز ، فإن العناصر الرئيسية لناقلات البلازميد هي:- أوري هو المنطقة الأصلية لتكاثر البلازميد. هناك حاجة للحفاظ على كمية ثابتة من البلازميد وميراثه من قبل الخلايا الابنة.
- — , , , . , , (« »). , , . , .
, β- (GUS). , . , . — (GFP) ( GUS GFP );
- , ( — , — );
- — , ( ). , «» .
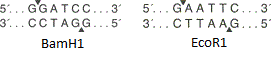 ويبين الشكل مواقع تقييد نوكلياز داخلية BamH1 و وEcoR1 . يتعرف كلا الإنزيمين على موقع معين من ستة أزواج قاعدية ويقدمان استراحات مفردة في أماكن مختلفة (يشار إليها بأسهم مثلثية). في هذه الحالة ، لا تتطابق نقاط كسر السلسلة ، مما يعني أن "النهايات اللاصقة" تتشكل (إذا تزامنت ، يتم تشكيل "نهايات حادة").
ويبين الشكل مواقع تقييد نوكلياز داخلية BamH1 و وEcoR1 . يتعرف كلا الإنزيمين على موقع معين من ستة أزواج قاعدية ويقدمان استراحات مفردة في أماكن مختلفة (يشار إليها بأسهم مثلثية). في هذه الحالة ، لا تتطابق نقاط كسر السلسلة ، مما يعني أن "النهايات اللاصقة" تتشكل (إذا تزامنت ، يتم تشكيل "نهايات حادة").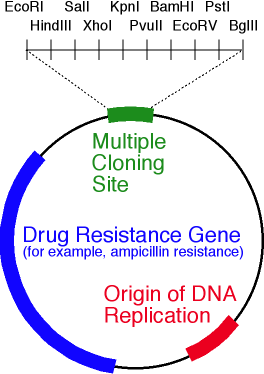 مخطط مبسط لناقلات البلازميد. يوضح الشكل أوري ، جين مقاومة المضادات الحيوية و polylinker التي تحتوي على 10 مواقع تقييد النوكليز.حسنا ، ناقلات في أيدينا. كيف يتم تضمين الجين فيه؟ وعلى أي حال ، أين يمكنني الحصول على هذا الجين؟لنفترض أننا نعرف تسلسل النوكليوتيدات للجين الذي نحتاجه. ثم تابع على النحو التالي:
مخطط مبسط لناقلات البلازميد. يوضح الشكل أوري ، جين مقاومة المضادات الحيوية و polylinker التي تحتوي على 10 مواقع تقييد النوكليز.حسنا ، ناقلات في أيدينا. كيف يتم تضمين الجين فيه؟ وعلى أي حال ، أين يمكنني الحصول على هذا الجين؟لنفترض أننا نعرف تسلسل النوكليوتيدات للجين الذي نحتاجه. ثم تابع على النحو التالي:- , ;
- .
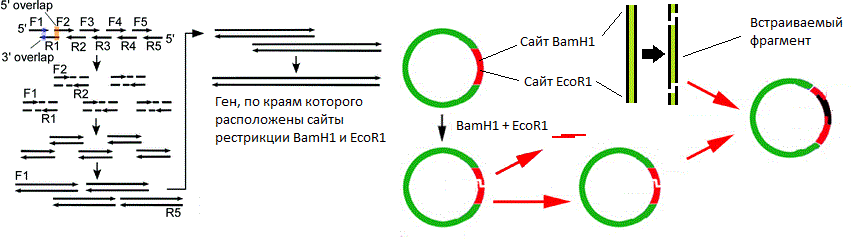 ( ). .
( ). ., , , . , (
BamH1 EcoR1 ) , , « » . , . ,
-، الذي يقضي على فواصل السلسلة في جزيئات الحمض النووي المزدوج.عامل آخر مهم في تجميع الجينات هو حقيقة أن ترددات الكودونات المختلفة تختلف عن الكائنات الحية المختلفة ، بينما يوجد في الخلايا عادة أكثر من تلك الحمض الريبي النووي النقال التي تتوافق مع الكودونات "الأكثر شعبية". نظرًا لأن العديد من الأحماض الأمينية يتم ترميزها بواسطة العديد من الكودونات ، فمن المحتمل جدًا أن نسخ الجين من كائن حي إلى آخر بلا خجل ، فإننا نخاطر بالحصول على تأخير قوي في عملية الترجمة. في الواقع ، إذا كانت العديد من الكودونات لهذا الجين نادرة في الكائن الحي الجديد ، فإن الريبوسوم سينتظر لفترة أطول عندما يصل الحمض الريبي النووي النقال المطلوب أخيرًا.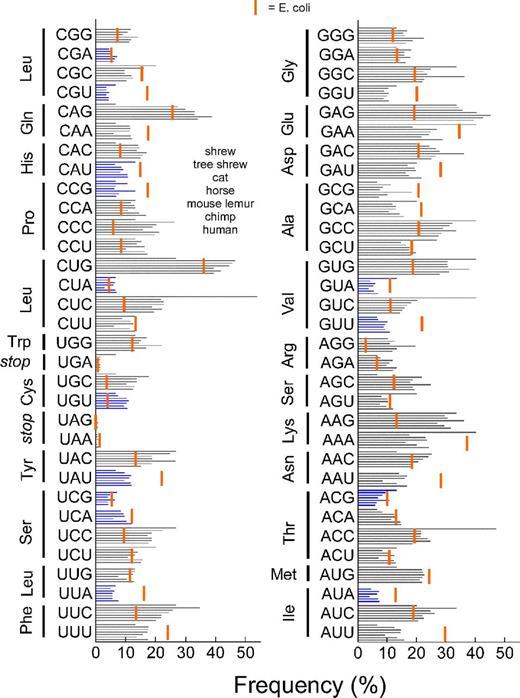 , , , , , . E. coli .الآن بضع كلمات عن المروج. يعد اختيار المروج المناسب أمرًا مهمًا للغاية ، نظرًا لأن عملية النسخ تعتمد إلى حد كبير عليه. ينقسم المروجين بشكل مشروط إلى قوي ومتوسط وضعيف. يتم تحديد "قوة" المروج من خلال مدى فعالية نسخ الجينات تحت سيطرتها ، وكل الأشياء الأخرى متساوية: كلما كان النسخ أكثر نشاطًا ، كلما كان المروج أقوى. من الواضح ، عندما نريد إنشاء منتج للبروتين ، يجب أن نبدأ بمحفزات قوية. في بعض الحالات ، يؤدي النسخ السريع بشكل مفرط (وبالتالي الترجمة النشطة) إلى الإضرار بالخلية ، وفي هذه الحالة يمكنك محاولة استخدام محفز أضعف. على الرغم من حقيقة أنه من الأسهل بكثير التأثير على نشاط النسخ لمنتج حالي من إنشاء منتج جديد.شيء آخر مهم. في كثير من الأحيان ، يكون للبروتينات المشفرة بواسطة الناقل تأثير سلبي للغاية على الجدوى البكتيرية. لا يقتصر الأمر على توليف هذه البروتينات على كمية كبيرة من الموارد (ويجب ألا تقل كمية البروتين المستهدف عن 10٪ من إجمالي الوزن الجاف للخلية) ، بل تطفو أيضًا ذهابًا وإيابًا من خلال السيتوبلازم ! لذلك ، في الوقت الحالي ، من الأفضل إيقاف تعبير الجين الغريب عن الخلية تمامًا. لهذا الغرض ، تم تطوير أنظمة تعبير مضبوطة تسمح لك "بتمكين" تعبير الجين الذي نحتاجه "عند الطلب". الأكثر شيوعًا هي:
, , , , , . E. coli .الآن بضع كلمات عن المروج. يعد اختيار المروج المناسب أمرًا مهمًا للغاية ، نظرًا لأن عملية النسخ تعتمد إلى حد كبير عليه. ينقسم المروجين بشكل مشروط إلى قوي ومتوسط وضعيف. يتم تحديد "قوة" المروج من خلال مدى فعالية نسخ الجينات تحت سيطرتها ، وكل الأشياء الأخرى متساوية: كلما كان النسخ أكثر نشاطًا ، كلما كان المروج أقوى. من الواضح ، عندما نريد إنشاء منتج للبروتين ، يجب أن نبدأ بمحفزات قوية. في بعض الحالات ، يؤدي النسخ السريع بشكل مفرط (وبالتالي الترجمة النشطة) إلى الإضرار بالخلية ، وفي هذه الحالة يمكنك محاولة استخدام محفز أضعف. على الرغم من حقيقة أنه من الأسهل بكثير التأثير على نشاط النسخ لمنتج حالي من إنشاء منتج جديد.شيء آخر مهم. في كثير من الأحيان ، يكون للبروتينات المشفرة بواسطة الناقل تأثير سلبي للغاية على الجدوى البكتيرية. لا يقتصر الأمر على توليف هذه البروتينات على كمية كبيرة من الموارد (ويجب ألا تقل كمية البروتين المستهدف عن 10٪ من إجمالي الوزن الجاف للخلية) ، بل تطفو أيضًا ذهابًا وإيابًا من خلال السيتوبلازم ! لذلك ، في الوقت الحالي ، من الأفضل إيقاف تعبير الجين الغريب عن الخلية تمامًا. لهذا الغرض ، تم تطوير أنظمة تعبير مضبوطة تسمح لك "بتمكين" تعبير الجين الذي نحتاجه "عند الطلب". الأكثر شيوعًا هي:- نظام يعتمد على العناصر التنظيمية لـ operact E. coli E. coli ( lac -peron) ومعزز قوي.
الحقيقة هي أن E. coli لديها قواعدها الغذائية الخاصة. أولاً ، هناك آلية لقمع نشاط لاك- بيرون ، والتي يتم تنشيطها فقط عندما لا يدخل اللاكتوز إلى الخلية. هذا أمر منطقي: لماذا تضيع الطاقة على تجميع ما هو غير مفيد؟ ولكن بمجرد أن يبدأ اللاكتوز في دخول الخلية بكميات كافية ، يتم إيقاف تشغيل هذه الآلية.
ومع ذلك ، هناك آلية ثانية لقمع نشاط لاك- بيرون. إذا كان هناك غلوكوز في الوسط ، فإن الخلية تتغذى حصريًا على الجلوكوز ، حيث أنها تنشط الآلية الثانية لتثبيط النسخ من لاك- بيرون. وبالتالي ، فإن لاك- بيرون ينشط فقط عندما يكون هناك فقط اللاكتوز في المساحة المحيطة بالخلية. إن ناقص أوبرا اللاكتوز هو محفز ضعيف للغاية ، لذلك في سلالات المنتج يتم استبداله بآخر قوي. غالبًا ما يتم اشتقاق المروجين الأقوياء من مسببات الأمراض. يتم عزل أقوى المروجين الأكثر استخدامًا في الهندسة الوراثية بدائيات النوى من الفيروسات البكتيرية - البكتيريا . على سبيل المثال ، يستخدم معزز T7 phage على نطاق واسع.
بالمناسبة ، يتم أيضًا عزل بعض المروجين الأقوياء للهندسة الوراثية للنباتات من الفيروسات ، على سبيل المثال ، هذا هو المروج لفيروس فسيفساء القرنبيط.

كما ذكر أعلاه ، لا تحتوي E. coli على بوليميراز RNA الذي يتعرف على محفزات البكتيريا ؛ لذلك ، تم إدخال جين RNA polymerase للجراثيم المقابلة في المنتج سابقًا.
ويحمل نظام تخليق البروتين المشهور E. coli الجين T7 phage RNA polymerase تحت سيطرة معزز RNA polymerase البكتيري ، الذي تنظمه آلية laconon. إذا تم تحويل هذه السلالة مع ناقل يحمل الجين المستهدف تحت سيطرة معقد "phage T7 معزز + تنظيم معقد نوع المروج laconon" ، فستظهر آلية ذات مستويين لتثبيط نسخ الجين المستهدف.
عند استخدام هذا التصميم ، يضاف الجلوكوز واللاكتوز إلى الوسط الغذائي في وقت واحد. لبعض الوقت ، تتغذى الخلايا على الجلوكوز وتنقسم بهدوء ، حيث يتم تخليق بروتين غريب تمامًا. في الوقت الذي ينتهي فيه الجلوكوز وتتحول الخلايا إلى استقلاب اللاكتوز ، سيكون هناك بالفعل ما يكفي من الكتلة الحيوية في الثقافة ، لقد حان الوقت لبدء تخليق البروتين الذي نحتاجه. يسمى هذا الإجراء "الحث التلقائي".
يمكنك القيام بذلك بطريقة أخرى: لا تضيف الجلوكوز واللاكتوز إلى الوسط الغذائي ، وبعد ذلك ، عندما تصل الثقافة إلى الكثافة المطلوبة ، أضف ما ستحتاجه الخلية لللاكتوز ، ولكن لا يمكن استقلابه أو تدميره. الآن ، يتم استخدام IPTG كمحرض .
- نظام يعتمد على الآلية التنظيمية لمحفز pL للجراثيم λ .
تم تعطيل هذا المروج بواسطة بروتين cI repressor. في الوقت نفسه ، تم اكتشاف شكل حساس للحرارة من هذا البروتين ، يسمى cI857: يحتفظ عامل النسخ هذا بوظائفه عند درجة حرارة حوالي 30 درجة مئوية ويفقدها عند 42 درجة مئوية. لذلك ، عند استخدام مثل هذا النظام ، يتم زراعة الثقافة البكتيرية أولاً إلى الكثافة المطلوبة عند 30 درجة مئوية ، ثم ترتفع درجة الحرارة إلى 42 درجة مئوية ، وبالتالي بدء تخليق البروتين المستهدف.
حسنًا ، تم تصميم المتجه. ثم الشيء الصغير هو إيجاد طريقة مناسبة لإدخالها في الخلية البكتيرية. لكن هذه قصة مختلفة تمامًا.