
عندما يتم تجاوز درجة حرارة معينة ، تصبح الخلية غير صالحة للاستعمال وتموت. أحد أبسط التفسيرات لمثل هذا التعصب الحراري هو أن البروتينات الضرورية للحياة هي تلك التي تستخرج الطاقة من الطعام أو ضوء الشمس ، وتدافع عن نفسها من التدخلات ، وتدمر النفايات ، إلخ. - غالبًا ما يكون لها شكل دقيق بشكل مدهش. ابتداءً من خيوط طويلة ، يتم ثنيها في شكل حلزون ، "دبابيس شعر" وأشكال أخرى تمليها تسلسل مكوناتها. وتلعب هذه الأشكال دورًا كبيرًا في أنشطتها. ولكن عندما تبدأ درجة الحرارة في الارتفاع ، يتم كسر الروابط التي تمسك بهياكل البروتين: أولاً الأضعف ، ثم الأقوى. من المنطقي أن تكون خسارة بنية البروتين المنتشرة قاتلة ، ولكن حتى وقت قريب ، لم تكن تفاصيل كيفية قتل الخلايا المفرطة الحرارة بالضبط واضحة.
الآن ، درس علماء الفيزياء الحيوية من المدرسة التقنية العليا السويسرية في زيورخ سلوك كل بروتين في خلايا أربعة كائنات مختلفة مع ارتفاع في درجة الحرارة. أظهرت هذه الدراسة والمجموعة الغنية من البيانات التي تم جمعها
في مجلة ساينس العلمية أنه عند درجة حرارة كافية لموت خلية - خلايا بشرية أو خلايا الإشريكية القولونية - يتم تدمير عدد قليل من البروتينات الرئيسية فقط. علاوة على ذلك ، ارتبطت وفرة البروتينات في الخلايا بشكل غير متوقع باستقرارها. لقد سمحت الدراسات للعلماء بالتعرف بسرعة على القواعد الأساسية التي يتم من خلالها بناء عمل البروتينات وترتيبها ، والتي تمتد عواقبها ، كما اتضح ، إلى أبعد من الموت البسيط بسبب الحرارة.
أوضحت Paola Piccotti ،
عالمة الفيزياء الحيوية التي وجهت العمل ، أن التجارب كانت مدفوعة بأسئلة قديمة وغير محلولة: لماذا تعيش بعض الخلايا في درجات حرارة عالية ، بينما تموت أخرى؟ تعيش بكتيريا Thermus thermophilus بسعادة في الينابيع الساخنة وفي السخانات المنزلية [عند درجة حرارة مثالية تبلغ 65 درجة مئوية - تقريبًا. trans.] ، في حين أن خلايا E. coli تنخفض عند درجات حرارة أعلى من 40 درجة مئوية. تشير الدلائل المقنعة إلى أن النقطة هنا هي الاستقرار المختلف لبروتينات هذه الكائنات الحية. لكن تتبع البروتين في الخلية الحية ، والذي سيكون طريقة مثالية للدراسة ، غير مريح للغاية. إن عزل البروتين في أنبوب الاختبار لا يعطي جميع الإجابات ، لأنه داخل الجسم تتعثر البروتينات معًا وتؤثر على كيمياء بعضها البعض ، أو أنها تدعم بعضها البعض في الشكل اللازم. لفهم ما هو بالضبط ولماذا ينهار ، من الضروري مراقبة البروتينات في وقت لا تزال فيه تؤثر على بعضها البعض.
كيف تدمر الحرارة البروتينات
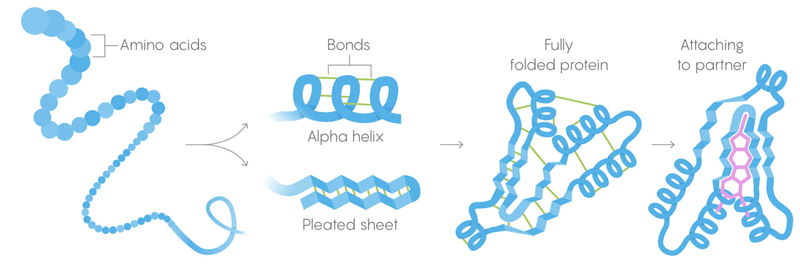 1) البنية الأساسية للبروتينات هي سلاسل طويلة من الأحماض الأمينية ، مجتمعة في تسلسلات تعطى بواسطة الجينات.
1) البنية الأساسية للبروتينات هي سلاسل طويلة من الأحماض الأمينية ، مجتمعة في تسلسلات تعطى بواسطة الجينات.
2) الهيكل الثانوي هو حمض أميني يطوى أيضًا في تكوينات تحتفظ بها روابط بين الجزيئات ضعيفة.
3) البنية الثلاثية - الروابط الضعيفة التي تثبت موقع الأجزاء المستقيمة والملتوية للهيكل ثلاثي الأبعاد للبروتين. يسمح موقعها للبروتين بالالتزام بالجزيئات المطلوبة.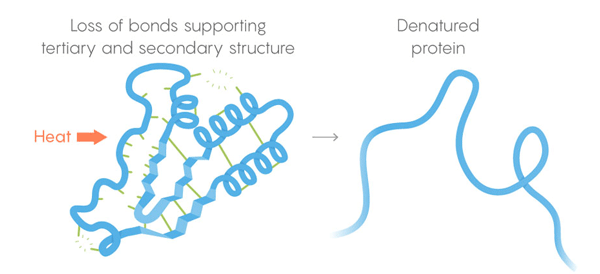 الموت الحراري. تفقد الروابط الضعيفة قدرتها على الاحتفاظ بالهياكل الثلاثية والثانوية ، وتتكشف مخلفات البروتين ، أي تتكشف. ولكن لا تتكشف جميع البروتينات في نفس درجة الحرارة - حيث يمكن لبيئة البروتين في الخلية أن تمنحها استقرارًا إضافيًا.
الموت الحراري. تفقد الروابط الضعيفة قدرتها على الاحتفاظ بالهياكل الثلاثية والثانوية ، وتتكشف مخلفات البروتين ، أي تتكشف. ولكن لا تتكشف جميع البروتينات في نفس درجة الحرارة - حيث يمكن لبيئة البروتين في الخلية أن تمنحها استقرارًا إضافيًا.لحل المهمة ، طور الفريق إجراء رصد آلي. قطعوا الخلايا وسخنوا محتوياتها على مراحل ، وأطلقوا في كل مرحلة الإنزيمات التي فصلت البروتينات. هذه الإنزيمات جيدة بشكل خاص في قطع البروتينات غير المطوية ، لذلك يمكن للباحثين الذين يعتمدون على بقايا البروتينات المقطوعة أن يحكموا على البروتينات التي انهارت عند درجة حرارة معينة. وهكذا ، تمكنوا من بناء منحنيات تمسخ لكل آلاف من البروتينات التي تمت دراستها. تنتقل أقواس المنحنيات من البنية غير الممسوحة للبروتين عند درجة حرارة مريحة له إلى حالة متطورة بالكامل عند درجة حرارة عالية. للبحث عن الاختلافات بين منحنيات الأنواع المختلفة من الكائنات الحية ، أجريت التجارب على خلايا البشر ، E. coli ، T. thermophilus والخميرة. قال
ألان دروموند ، عالم الأحياء في جامعة شيكاغو ، "كانت الدراسة جميلة" ، في إشارة إلى حجم العملية ودقتها.
خلال الملاحظات ، لوحظ بوضوح أن بروتينات جميع الكائنات الحية لا تنفجر مرة واحدة مع ارتفاع درجة الحرارة. قال بيكيوتي: "رأينا أن مجموعة فرعية صغيرة فقط من البروتينات انهارت في المراحل المبكرة جدًا ، وكانت هذه بروتينات رئيسية". في رسم تخطيطي لربط الروابط البروتينية بالبروتين ، غالبًا ما تحتوي البروتينات الأكثر هشاشة من هذه المجموعة الفرعية الصغيرة على عدد كبير من الروابط ، مما يعني أنها تؤثر على العديد من العمليات التي تحدث في الخلايا. قال بيكوتي: "بدون هذه البروتينات ، لا يمكن للخلايا أن تعمل". "عندما تختفي ، يتم تدمير الشبكة بالكامل." ومع ذلك ، من الواضح أن حياة الخلية تتوقف.
قد يكون هذا التناقض - أهم البروتينات الأكثر هشاشة - انعكاسًا لكيفية إنشاء التطور لها لأداء المهام المقابلة. إذا كان للبروتين العديد من الأدوار ، فإن عدم استقراره وميله للتكشف وإعادة لف يمكن أن يكون ميزة ، لأنه يمكن أن يسمح له بأخذ أشكال مختلفة ، ومناسبة لمهام مختلفة. وأوضح بيكوتي أن "العديد من هذه البروتينات الرئيسية تتمتع بمرونة كبيرة ، مما يجعلها أقل استقرارًا" ، ولكنها تمنحها في الوقت نفسه القدرة على الارتباط بجزيئات مستهدفة مختلفة في الخلية. "على الأرجح ، هذه هي الطريقة التي يتعاملون بها مع وظائفهم. هذا حل وسط ".
بعد أن درسوا بدقة الإشريكية القولونية ، والتي كانت البيانات التي تم جمعها من أعلى مستويات الجودة ، وجد الباحثون علاقة بين وفرة البروتين - عدد النسخ في الخلية - واستقراره. كلما زاد عدد النسخ التي يصنعها البروتين من الخلية ، زادت درجة الحرارة المطلوبة لتدميرها. اتضح أن عددًا كبيرًا من النسخ لا يرتبط بأهمية البروتين من أجل البقاء. بعض البروتينات الرئيسية نادرة جدًا. يؤكد هذا الارتباط بين الوفرة والموثوقية الفكرة التي طرحها Drummond قبل عشر سنوات - النظام الخلوي الذي يصنع البروتينات لديه ميل إلى ارتكاب الأخطاء من وقت لآخر. عادة ما يؤدي الخطأ إلى زعزعة استقرار البروتين. إذا وجد أن هذا البروتين وفير ، وظهر مثل هذا البروتين في الخلية مائة أو ألف مرة في اليوم ، فإن النسخ المطوية بشكل غير صحيح المنتجة بكميات كبيرة يمكن أن تسد الخلية. وبالتالي ، سيكون من المفيد للجسم أن يتطور بحيث تكون البروتينات الأكثر وفرة هي الأكثر استقرارًا ، وهو ما تؤكده البيانات التي حصل عليها فريق Piccotti.
لفهم صفات البروتين التي تجعله مستقرا ، قارن الباحثون البيانات من E. coli و T. Thermophilus. بدأت بروتينات E. coli تتداعى عند 40 درجة مئوية ، وتدهورت تمامًا عند 70 درجة مئوية. ولكن عند درجة الحرارة هذه ، بدأت بروتينات T. thermophilus في الشعور بعدم الراحة - بعضها حافظ على شكله حتى عند 90 درجة مئوية. وجد الفريق أن T. thermophilus عادة ما تحتوي على بروتينات أقصر ، وأن بعض أنواع أشكال ومكونات البروتين كانت أكثر شيوعًا في الأكثر استقرارًا.
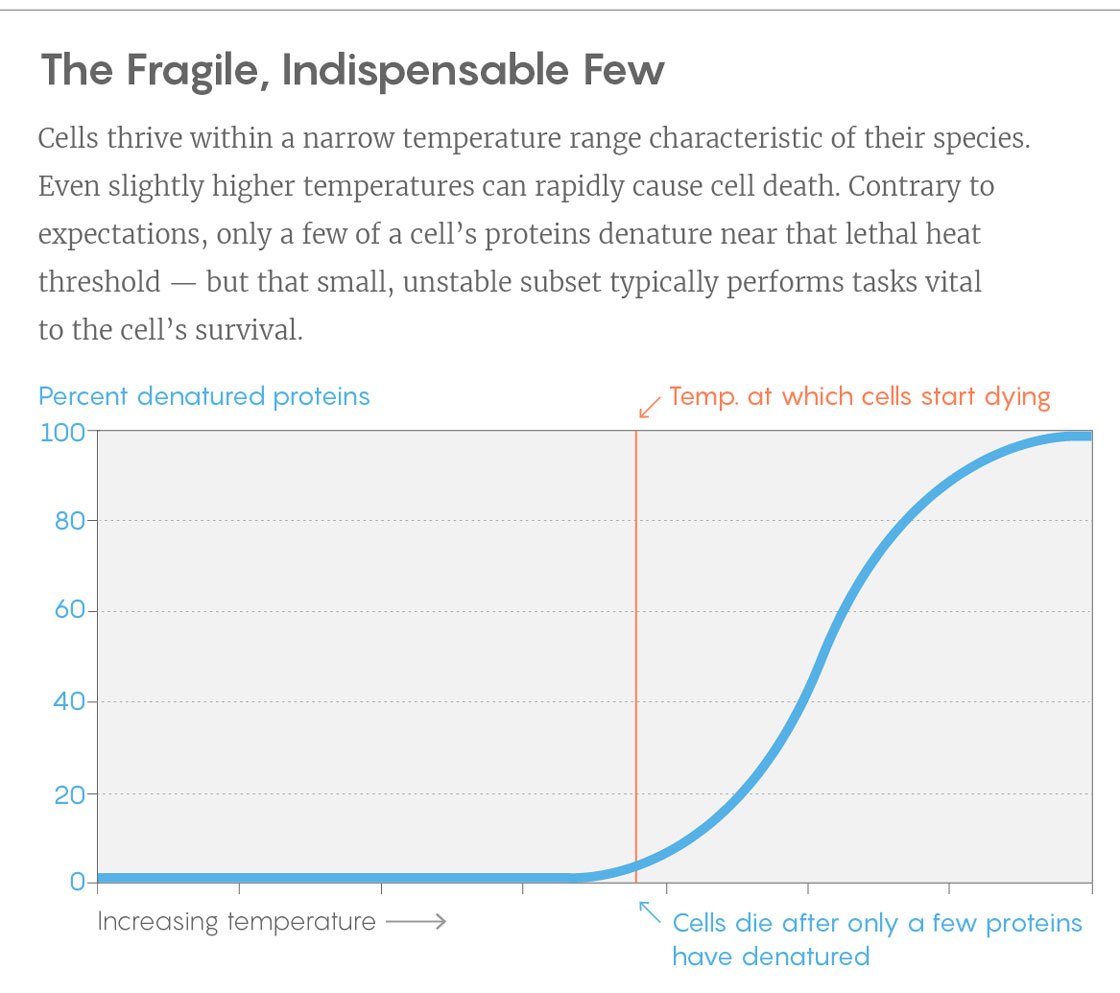 مثال على منحنى من تجربة. عمودي - نسبة البروتينات غير المطوية ، درجة الحرارة الأفقية. الشريط العمودي هو درجة الحرارة التي تبدأ فيها الخلايا بالموت. للقيام بذلك ، قم باستدارة عدد قليل من البروتينات الرئيسية.
مثال على منحنى من تجربة. عمودي - نسبة البروتينات غير المطوية ، درجة الحرارة الأفقية. الشريط العمودي هو درجة الحرارة التي تبدأ فيها الخلايا بالموت. للقيام بذلك ، قم باستدارة عدد قليل من البروتينات الرئيسية.يمكن للاكتشافات أن تساعد الباحثين على تطوير البروتينات التي يكون استقرارها مفصلاً حسب احتياجاتهم. في العديد من العمليات الصناعية حيث يتم استخدام البكتيريا ، تؤدي زيادة درجة الحرارة إلى زيادة العائد - ولكن سرعان ما تبدأ البكتيريا في الموت من الحرارة. وقال بيكوتي إن من المثير للاهتمام معرفة ما إذا كان بإمكاننا تثبيت البكتيريا عن طريق جعل البروتينات الرئيسية أكثر مقاومة للحرارة.
وفرة المعلومات حول مدى سهولة اكتشاف بعض البروتينات يسر بعض علماء الأحياء. يعتمد احتمال تراكمه بشكل مباشر على استقرار البروتين: ظهور كتل من البروتينات غير المطورة تلتصق ببعضها البعض. يمكن أن تتحول كتل البروتين إلى كابوس للخلايا وتتداخل مع تنفيذ المهام الرئيسية. على سبيل المثال ، يتم اتهامهم بالتسبب في بعض المشاكل العصبية الخطيرة ، مثل مرض الزهايمر ، حيث تسد لويحات البروتينات غير المطوية الدماغ.
 باولا Piccotti
باولا Piccottiلكن هذا لا يعني أن التجميع يحدث فقط في الكائنات الحية التي تعاني من أمراض معينة. على العكس ، أدرك الباحثون أنه من الممكن أن يحدث ذلك طوال الوقت ، وأن الخلايا السليمة لديها طرق للتعامل معها. قالت ميشيل فيندروسكولو ، أخصائية الكيمياء الحيوية في جامعة كامبريدج ، "أعتقد أن هذه الظاهرة أصبحت شائعة بشكل متزايد". "معظم البروتينات لا تطوى بشكل صحيح وتتراكم داخل الخلايا. أهم شيء أنشأه فريق Piccotti هو طول الوقت الذي يكون فيه أي بروتين محدد في الحالة الموسعة. هذه المرة تحدد درجة تراكم البروتينات الممكنة ". بعض البروتينات لا تدور أبدًا تقريبًا ولا تتراكم ، والبعض الآخر يتصرف في ظروف معينة ، بينما البعض الآخر يفعل ذلك طوال الوقت. وفقا للكيمياء الحيوية ، فإن الوصف التفصيلي للبروتينات في العمل الجديد سيسهل بشكل كبير دراسة وفهم هذه الاختلافات بين البروتينات. تشير بعض منحنيات التمسخ إلى أن بروتيناتها تتراكم بعد أن تتكشف. قال Vendruscolo ، "لقد تمكنوا من تتبع المرحلتين - النشر والتجميع اللاحق". "هذا هو جمال هذه الدراسة."
وعلى الرغم من أن العديد من العلماء مهتمون بالركام بسبب الضرر الذي تسببه ، إلا أن البعض ينظر إلى هذه الظاهرة من وجهة نظر مختلفة. يقول دروموند إنه أصبح من الواضح أن بعض المجاميع ليست مجرد قطع قمامة معلقة في قفص. تحتوي على بروتينات نشطة تستمر في أداء وظائفها.
يقول دروموند ، تخيل من مسافة ترى الدخان يتصاعد من مبنى. حول المبنى ترى بعض الأشكال ، وتتخيل أن هذه الأجسام انتشلت من تحت الأنقاض. ولكن إذا اقتربت ، فقد تجد أنهم أناس هربوا من مبنى محترق ، في انتظار انتهاء الحادث. هذا هو الحال مع دراسة الركام ، يقول دروموند: وجد الباحثون أن البروتينات في الركام ليست ضحايا ، بل ناجين. "الآن ينمو مجال جديد من العلوم بوتيرة متفجرة ،" يقول.
قد لا يكون تكتل البروتين علامة على الضرر ، ولكن طريقة للبروتين للحفاظ على وظائفه في وضع صعب. يمكنها ، على سبيل المثال ، حمايتهم من البيئة. وعندما تتحسن الظروف ، يمكن للبروتينات ترك الركام والطي مرة أخرى. يقول دروموند: "يتغير شكلها مع درجة الحرارة بطريقة تبدو للوهلة الأولى غير قابلة للطي". "لكن هذا له معنى آخر." في
مقال بمجلة الخلية من عام 2015 ، حدد هو وزملاؤه 177 بروتينًا من الخميرة احتفظت بوظائفها بعد دخولها المجاميع. في
ورقة نشرت في مارس ، وصف هذا الفريق أنه إذا تم تغيير أحد البروتينات بحيث لا يمكن أن يتراكم ، فإن ذلك سيؤدي إلى مشاكل خطيرة في عمل الخلية.
بشكل عام ، يدعي العمل أن البروتينات هي هياكل ديناميكية بشكل مدهش. في البداية ، قد تبدو وكأنها آلات صلبة تعمل في مهام ثابتة مناسبة لشكل معين. ولكن في الواقع ، يمكن للبروتينات أن تتخذ عدة أشكال مختلفة أثناء عملها الطبيعي. وفي الوقت المناسب ، يمكن أن يتغير شكلها كثيرًا لدرجة أنها قد تبدو وكأنها تتدهور ، على الرغم من أنها في الواقع تعزز على العكس. على المستوى الجزيئي ، يمكن أن تكون الحياة روابط دائمة وانفصال الروابط.