Neurogenesis هو عملية متعددة المراحل لتشكيل خلايا عصبية جديدة في الجهاز العصبي المركزي الناضج (CNS) ، وهي وظيفتها التكيفية.
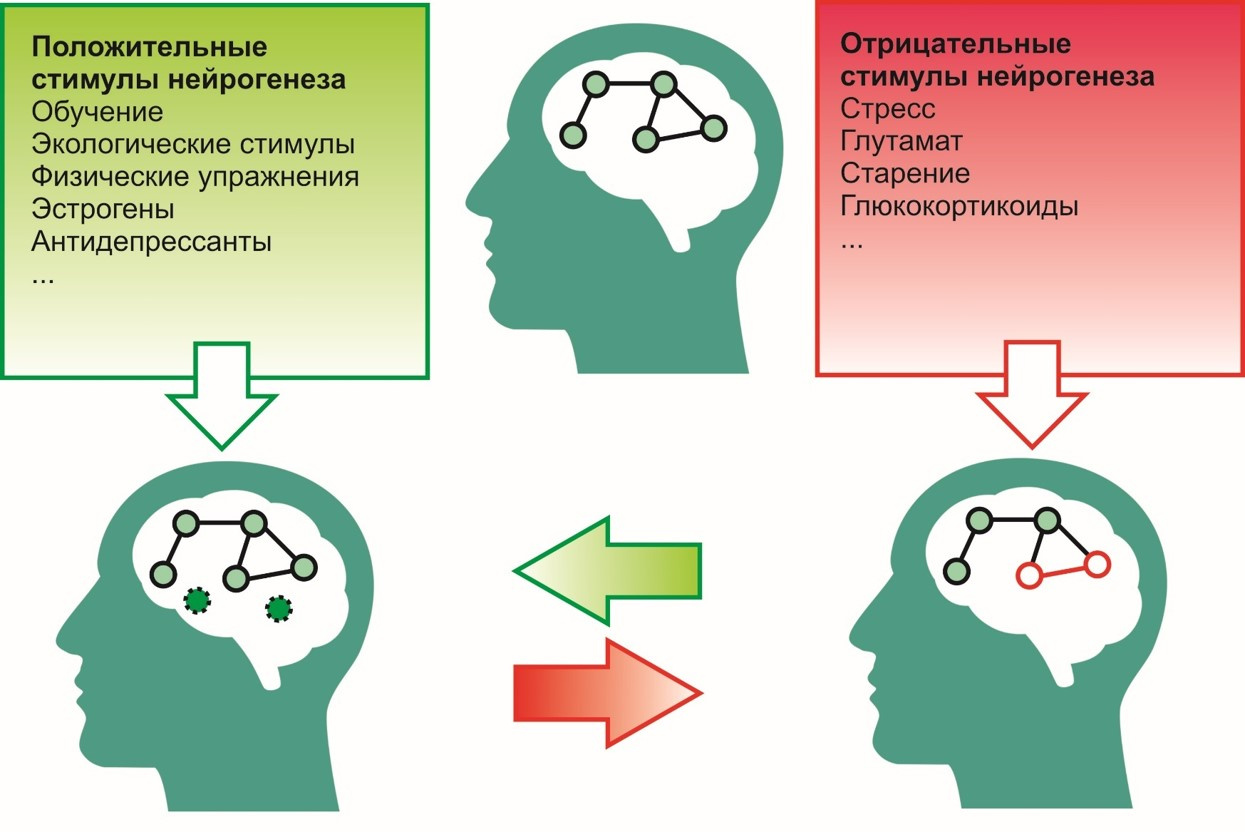
إلى الحوافز الإيجابية ، أي تشمل الحوافز التي تساهم في عملية تكوين الخلايا العصبية ما يلي:
- عملية التعلم
- البيئة الايكولوجية (بيئة مواتية) ،
- تمارين بدنية (مثل الجري)
- مضادات الاكتئاب
- هرمون الاستروجين الخ
إلى سلبي -
- الإجهاد
- النشاط المفرط للجلوتامات في الجهاز العصبي المركزي ،
- التعرض للجلوكورتيكويدات (هرمون الكورتيزول - الإجهاد) ،
- الشيخوخة وغيرها.
لسنوات عديدة في علم الأحياء العصبية المركزية ، كانت هناك عقائد مركزية لم تسمح باحتمالية تكون الخلايا العصبية.
 استندت فكرة غياب تكوين الخلايا العصبية في دماغ الفقاريات الناضجة إلى أربعة مبادئ:
استندت فكرة غياب تكوين الخلايا العصبية في دماغ الفقاريات الناضجة إلى أربعة مبادئ:- السريرية. لا يعاني المرضى الذين يعانون من أمراض عصبية مع آفة سائدة في الجهاز العصبي المركزي من التعافي الوظيفي. إن الاضطرابات الدماغية الوعائية والآفات الرضحية والأمراض العصبية التنكسية ، مثل مرض باركنسون ومرض الزهايمر ، هي أمراض الجهاز العصبي المركزي مع التدهور والتدهور في الحالة السريرية للمريض. بشكل عام ، يمكن لأساليب العلاج المختلفة أن تقضي فقط على الأعراض ، ولكن لا توقف تطور المرض.
- وظيفية. إنه يقوم على حقيقة أن الجهاز العصبي المركزي يتحكم في العديد من العمليات المعقدة: تنظيم العواطف والحركات وردود الفعل وما إلى ذلك. تتطلب إدارة هذه العمليات المعقدة ضبطًا دقيقًا للغاية. كان يعتقد أن تكوين خلايا عصبية جديدة ، وتمايزها وهجرتها يمكن أن يعطل التنظيم الهيكلي والوظيفي للمسارات العصبية الموجودة ويعطل الجهاز العصبي المركزي.
- يرتبط بنظرية الذاكرة والتعلم. لفترة طويلة ، كان يعتقد أن "الذكريات" هي استخراج المعلومات من الشبكات العصبية التي تشكلت أثناء عملية التدريب. في هذا السياق ، اعتبر تكوين الخلايا العصبية الجديدة حدثًا لا يتوافق مع الذاكرة.
- التقنية والتجريبية. عدم القدرة التقنية على اكتشاف تكوين الخلايا العصبية والخلايا الجذعية العصبية في الجهاز العصبي المركزي الناضج.
مراحل تكوين الأفكار حول تكوين الخلايا العصبية للدماغ الناضج- 60s - جوزيف التمان وآخرون. يمكن أن تتضمن خلايا التلفيف المسنن في الحُصين ثيميدين المشع ، الذي يتم دمجه في الحمض النووي للخلايا المنقسمة ، مما يسمح بتصورها. بسبب عدم وجود علامات جزيئية ، كان من المستحيل إثبات أنه تم وصف الخلايا العصبية.
دوى: 10.1126 / العلوم .135.3509.1127
- السبعينات - مايكل كابلان وجيمس هندس. قاموا بإعادة إنتاج تجربة ألتمان وأكدوا من خلال الفحص المجهري الإلكتروني أن الخلايا العصبية (التلفيف المسنن والمصباح الشم) هي التي تم تمييزها.
دوى: 10.1126 / العلوم .8797941
- 80 - فرناندو نوتيبوم. وأوضح أنه خلال موسم التزاوج في نوى الدماغ في طيور الكناري المسؤولة عن النطق والتدريب ، يزداد عدد الخلايا العصبية بشكل حاد.
دوى: 10.1038 / Scientificamerican0289-74
- التسعينات - Peter Ericsson et al. وللمرة الأولى ، ظهر تكوين خلايا عصبية جديدة في الحصين البشري.
دوى: 10.1038 / 3305
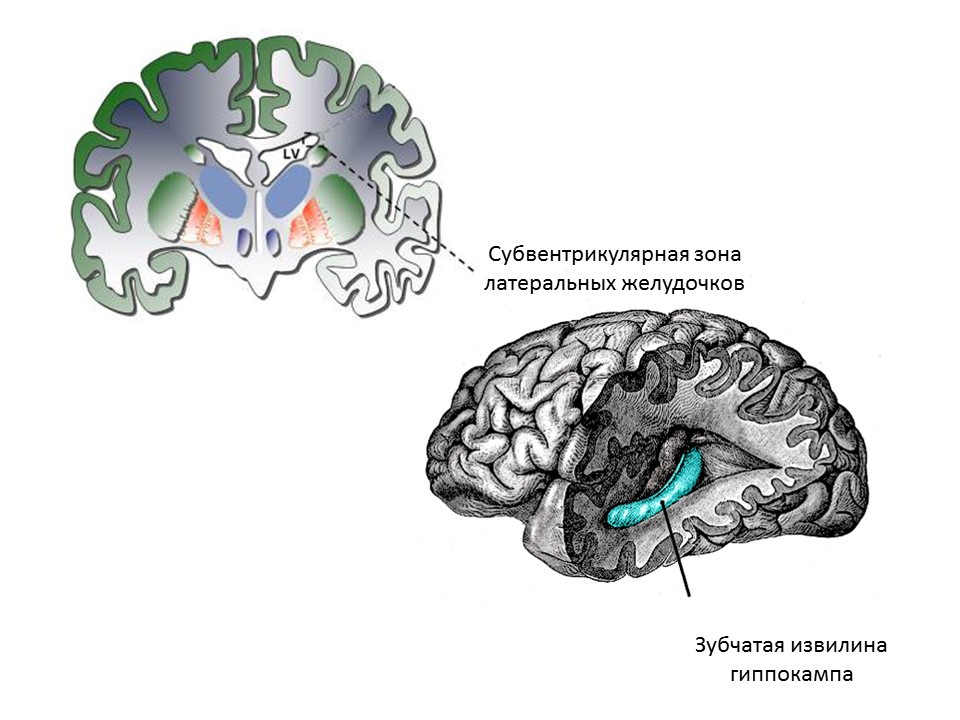
المناطق العصبية الرئيسية للدماغ البالغ (أو الناضج) هي التلفيف المسنن للحُصين والمنطقة تحت البطينية للبطينين الجانبيين. تظهر المناطق في الشكل.
 مراحل تكوين الخلايا العصبية في التلفيف المسنن بالحُصين في الدماغ الناضج
مراحل تكوين الخلايا العصبية في التلفيف المسنن بالحُصين في الدماغ الناضج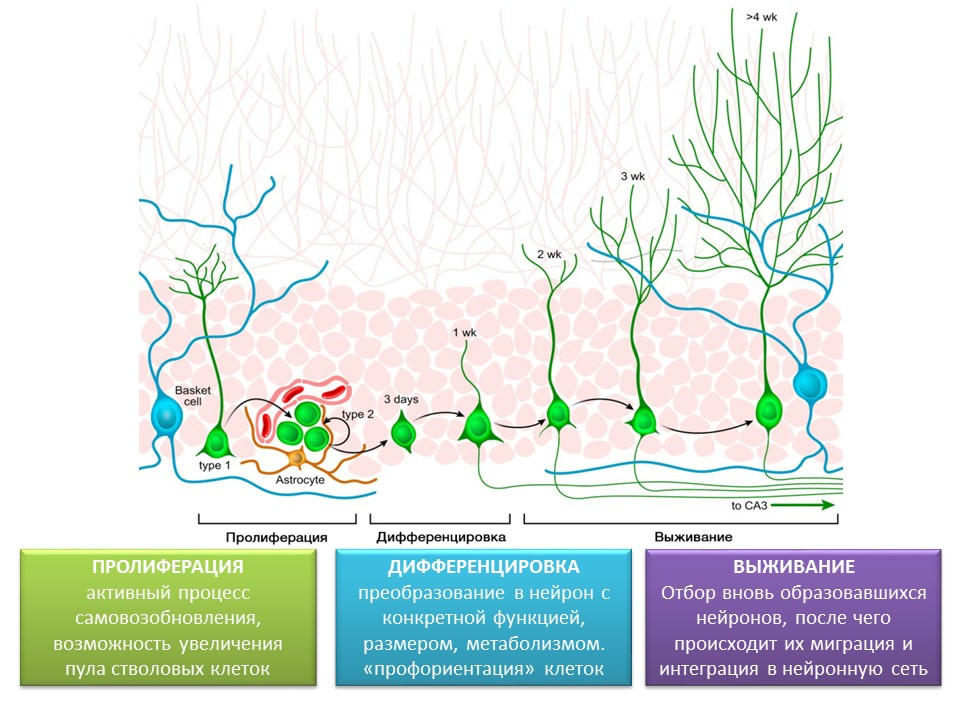
الانتشار هو عملية نشطة للتجديد الذاتي ، وإمكانية زيادة تجمع الخلايا الجذعية.
التمايز - التحويل إلى خلية عصبية ذات وظيفة محددة والحجم والتمثيل الغذائي. في الواقع ، "التوجيه الوظيفي" للخلايا العصبية في المستقبل.
البقاء على قيد الحياة هو اختيار الخلايا العصبية المشكلة حديثًا ، وبعد ذلك تهاجر وتندمج في الشبكة العصبية. اختيار الخلايا العصبية هو موت الخلايا المبرمج (موت مبرمج) لجزء من الخلايا العصبية المشكلة. تهاجر الخلايا المتبقية إلى المنطقة المقابلة من الدماغ وتندمج في الشبكة العصبية.
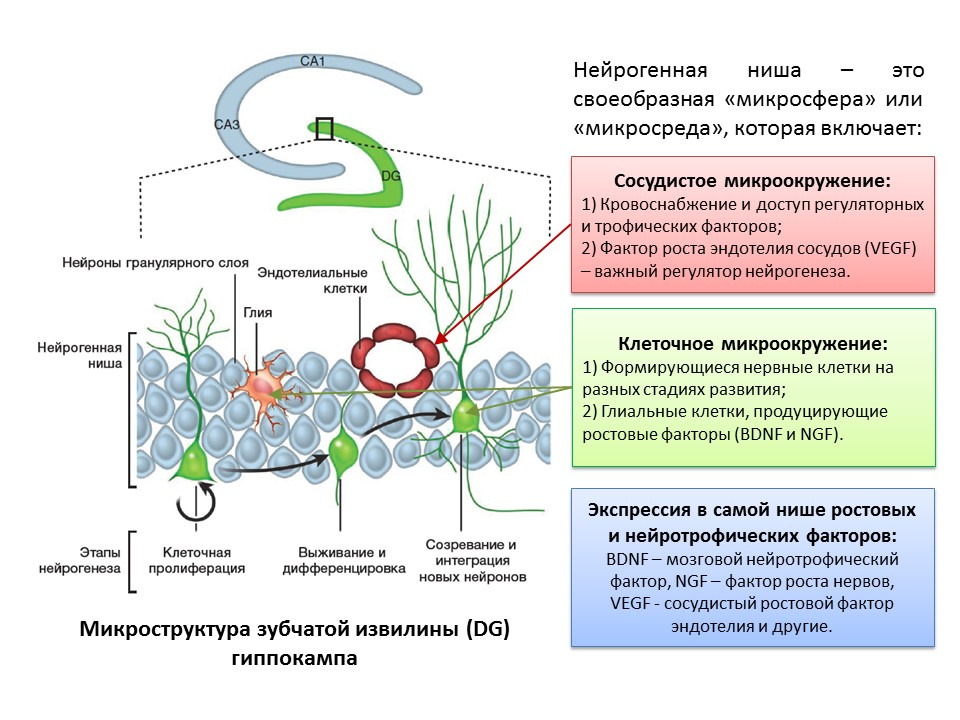
يرتبط مصطلح "تكوين الخلايا العصبية" ارتباطًا وثيقًا بمفهوم "مكانة الخلايا العصبية". "الكوة العصبية" نفسها "مجهرية" تتم فيها عملية تكوين الخلايا العصبية نفسها. يشمل المجال العصبي:
- البيئة الميكروية الوعائية ، التي تقوم أولاً بتزويد الدم إلى مكانه نفسه وتضمن توصيل جزيئات تنظيمية مختلفة (يتم تكوين الخلايا الجذعية وتحويلها على مقربة من الأوعية الدموية ، وثانيًا ، يعد عامل النمو البطاني الوعائي (VEGF) عاملاً تنظيميًا مهمًا ليس فقط في عملية تكوين الأوعية الدموية (نمو الأوعية الجديدة في نظام الأوعية الدموية الموجود) وتكوين الأوعية الدموية (تشكيل نظام الأوعية الدموية الجنينية) ، ولكن أيضًا منظم مباشر لتكوين الأوعية العصبية ؛
- بيئة الخلايا الدقيقة ، التي تشمل الخلايا العصبية في مراحل مختلفة من التطور والخلايا الدبقية التي تؤدي وظيفة التغذية (تنتج عوامل النمو ، على سبيل المثال ، عامل التغذية العصبية في الدماغ - BDNF وعامل نمو الأعصاب - NGF) ؛
- التعبير في مكانة النمو والعوامل التنظيمية. بالإضافة إلى الخلايا الدبقية والهياكل الناضجة الأخرى المتخصصة ، فإن الخلايا الجذعية قادرة على إنتاج عوامل تنظيمية ونمو ، وبالتالي أداء التنظيم الذاتي (التنظيم الذاتي).
تقييم عمليات تكوين الخلايا العصبية باستخدام علامات محددة
هناك مسألة مهمة ومثيرة تستحق الاهتمام الخاص وهي مسألة كيفية اكتشاف تكوين الخلايا العصبية في أنسجة المخ من الثدييات الناضجة.
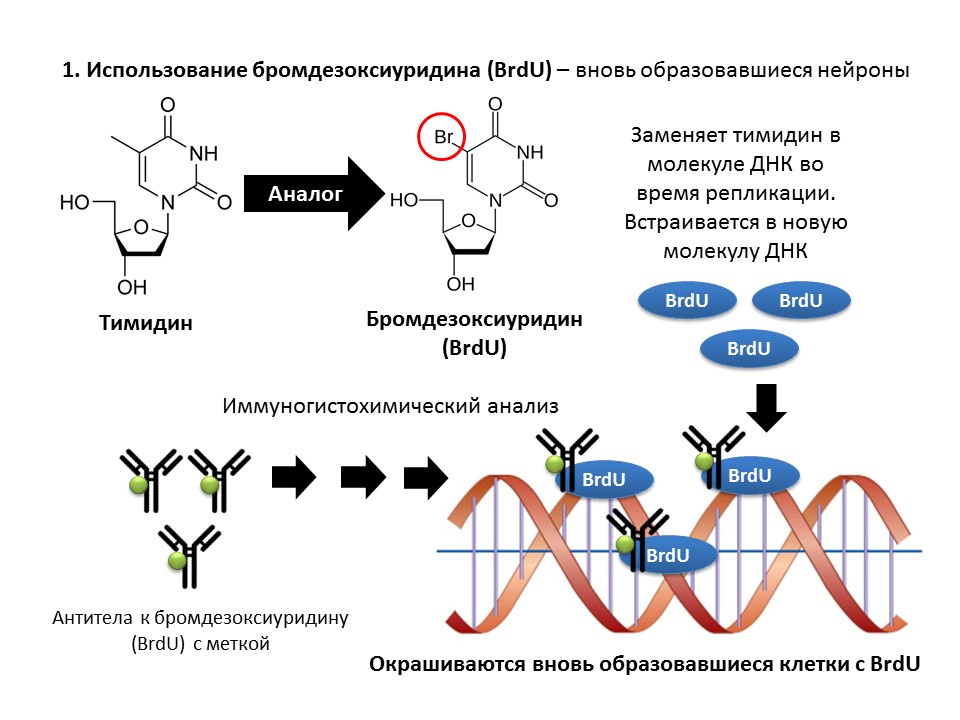
برومودوكسيوريدين (BrdU) هو نظير بنيوي للثيميدين - أحد مكونات جزيء الحمض النووي. عند إدخال الجسم ، يتم إدخال BrdU في الحمض النووي لتقسيم الخلايا بدلاً من الثيميدين ، مما يوفر الفرصة لاكتشاف الخلايا المشكلة حديثًا وفصلها عن "القديمة". بعد الحصول على عينة من أنسجة المخ ، يتم معالجتها بالأجسام المضادة لـ BrdU (تحتوي الأجسام المضادة على تسمية الفلورسنت) ، التي ترتبط بـ BrdU عبر آلية التفاعل المناعي للجسم المضاد للمستضد وتمكن من تحديد اللونية لـ BrdU. وهكذا ، في التحضير الدقيق ، من الممكن قياس الخلايا المسماة بـ BrdU ، ما يسمى الخلايا الإيجابية BrdU.
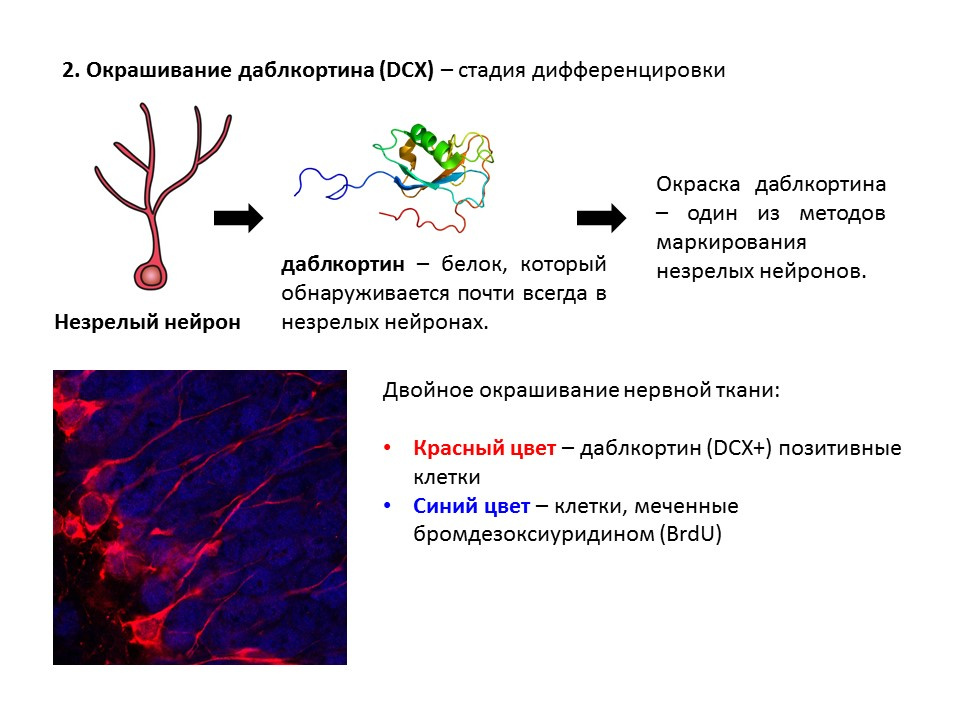
Doublecortin هو بروتين يوجد دائمًا تقريبًا في الخلايا العصبية غير الناضجة ويسمح باكتشافه.
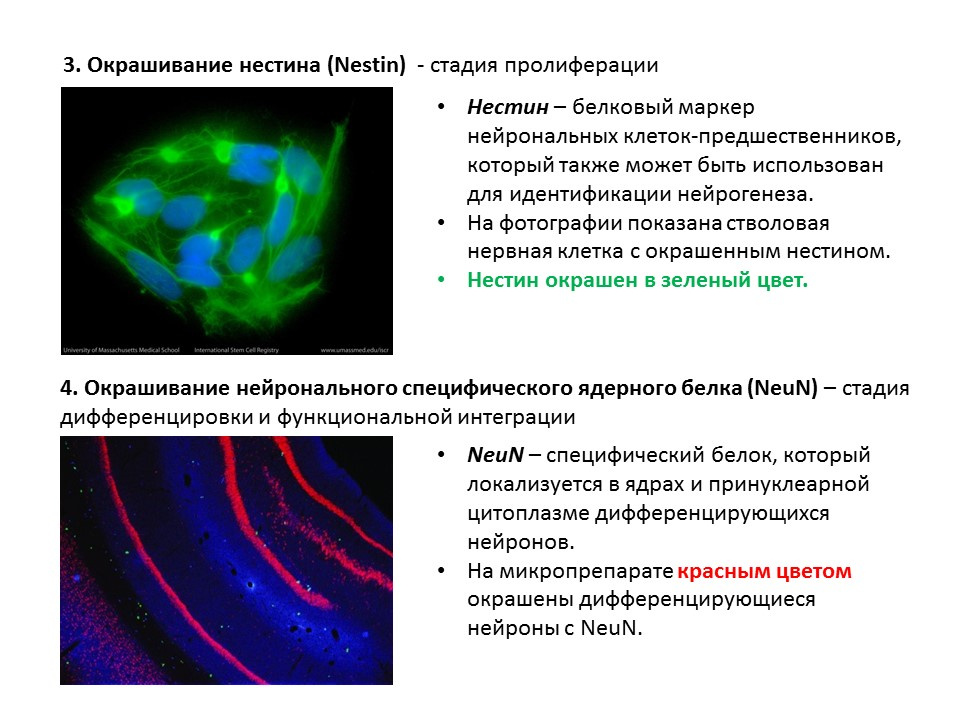
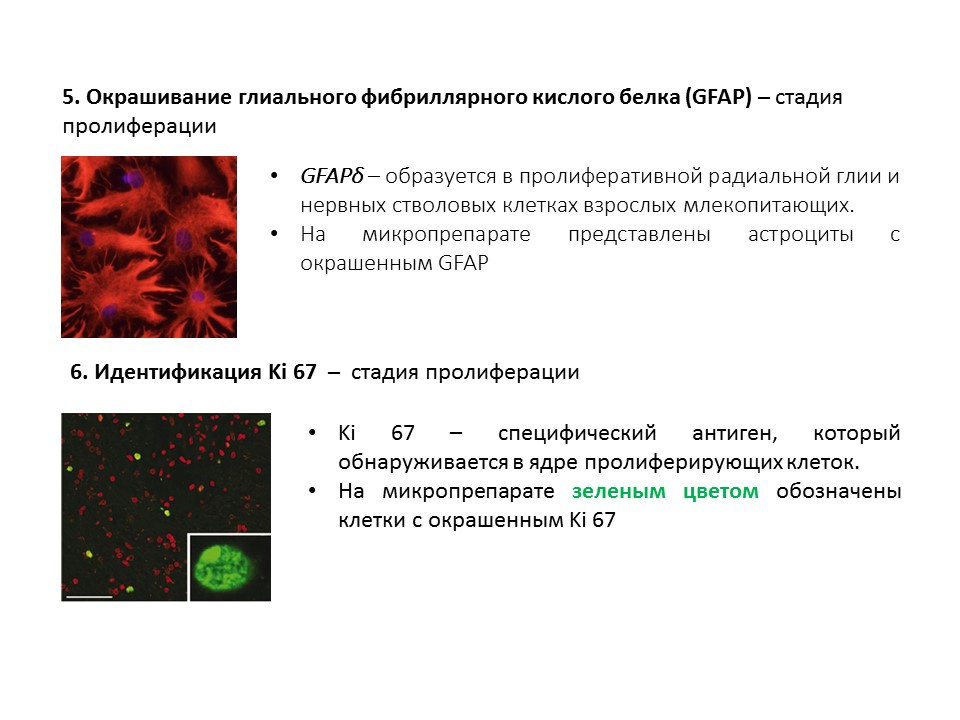 رسم تخطيطي للطرق الرئيسية للكشف عن المراحل المختلفة لتكوين الخلايا العصبية ، يلخص المعلومات السابقة المقدمة.
رسم تخطيطي للطرق الرئيسية للكشف عن المراحل المختلفة لتكوين الخلايا العصبية ، يلخص المعلومات السابقة المقدمة.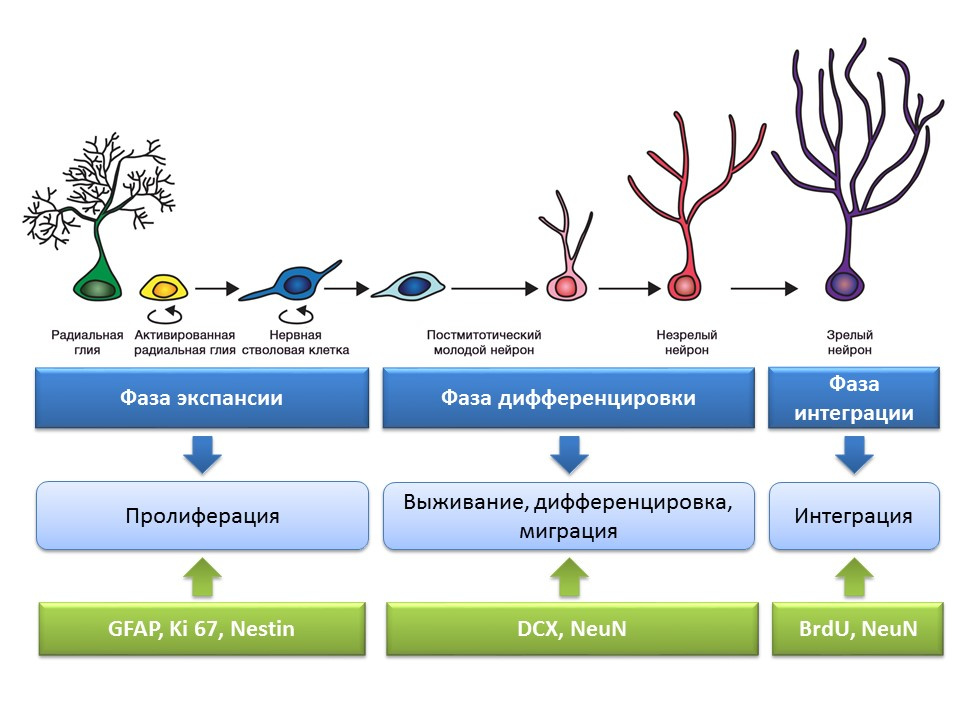
تنظيم تكوين الخلايا العصبية في الدماغ الناضج
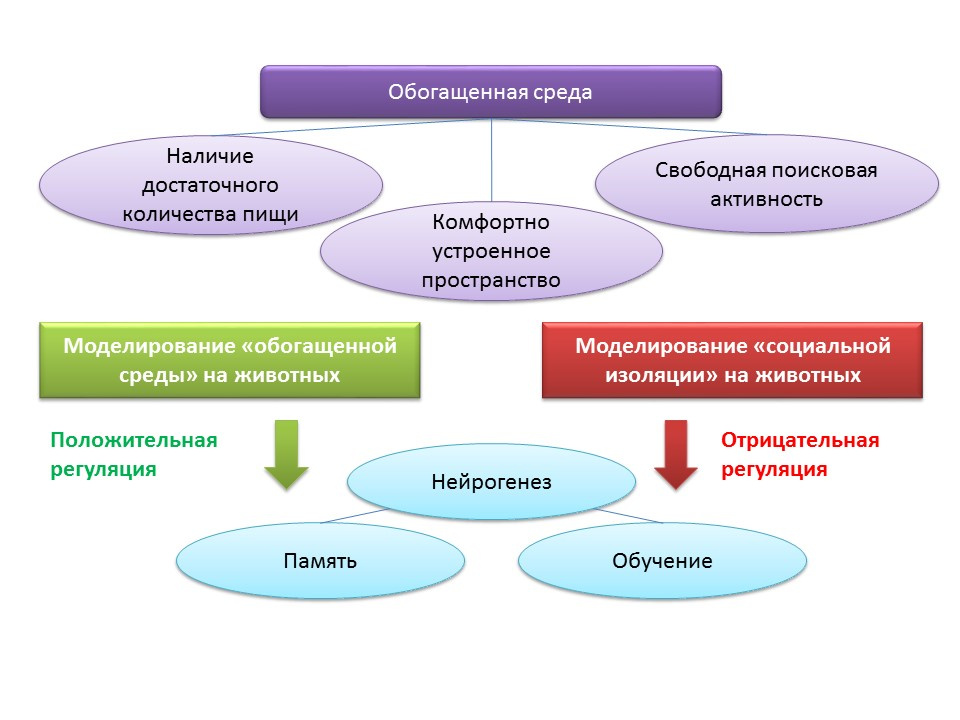
ترتبط العوامل البيئية لتنظيم تكوين الخلايا العصبية بمفهوم "البيئة المخصبة". يتضمن مصطلح "البيئة المثرية" بحد ذاته بيئة معيشية مواتية ، وهي وجود ما يكفي من الغذاء ، ومساحة مريحة وفرصة لنشاط البحث المجاني.
 دوى: 10.1002 / هيبو 222218دوى: 10.1038 / 386493a0دوى: 10.1016 / j.brainres.2011.08.00.007دوى: 10.1016 / j.neuroscience.2011.10.040PMID: 9547229
دوى: 10.1002 / هيبو 222218دوى: 10.1038 / 386493a0دوى: 10.1016 / j.brainres.2011.08.00.007دوى: 10.1016 / j.neuroscience.2011.10.040PMID: 9547229في التجارب على الحيوانات ، وجد أن البقاء في "بيئة غنية" له تأثير إيجابي على تكوين الخلايا العصبية: إنتاج عوامل النمو والعصارات العصبية ، وعدد الخلايا المتكاثرة وزيادة بقائها. زيادة تكوين الخلايا العصبية يرتبط بالوظيفة المعرفية المحسنة في الحيوانات (بشكل رئيسي مع التعلم والذاكرة).
تم الاحتفاظ بفئران C57BL / 6J التجريبية لمدة شهرين في مساحة محمية تحت ظروف محطة بيولوجية (في غابة غابات) ، وتم الاحتفاظ بالمجموعة الضابطة في ظروف مختبرية قياسية. في حيوانات المجموعة التجريبية ، لوحظت زيادة في عدد المشابك المثبطة والمثبطة مقارنة بالمجموعة الضابطة. تظهر هذه التجربة أن الظروف البيئية يمكن أن تؤثر بشكل إيجابي على شكل ووظيفة الجهاز العصبي المركزي للقوارض الموضوعة في بيئة غنية.
على العكس من ذلك ، كان الحفاظ على الحيوانات في ظل ظروف العزلة الاجتماعية في المختبر بمثابة منظم سلبي لتكوين الخلايا العصبية.
علاوة على ذلك ، ساهم وضع الحيوانات في "بيئة غنية" بعد نقص التروية الدماغية في تعزيز عمليات التجدد في المناطق العصبية للدماغ.
نتائج هذه الدراسات ليست شيئًا غير عادي ، حيث يتم استخدام دورات إعادة التأهيل في الطب الحديث وأيام العافية.
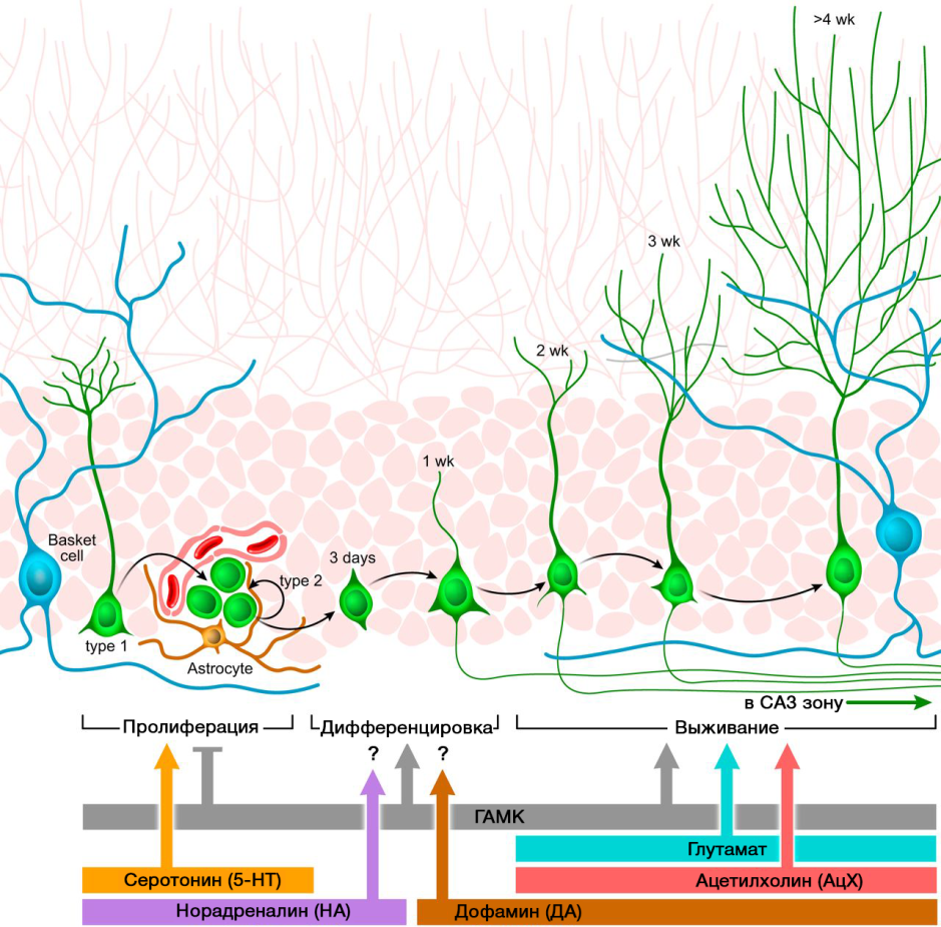
تلعب الناقلات العصبية للجهاز العصبي المركزي دورًا مهمًا في تنظيم تكوين الخلايا العصبية. توضح الصورة مخططًا موجزًا لمثل هذا التنظيم.
 دوى: 10.1152 / physrev.00004.2014
دوى: 10.1152 / physrev.00004.2014يرتبط الدور التنظيمي للناقلات العصبية CNS المقدمة في عمليات تكوين الخلايا العصبية بنقص أو زيادة هذه الجزيئات في أمراض مختلفة في الجهاز العصبي المركزي المرتبط بتغيير في مستوى تكوين الخلايا العصبية.
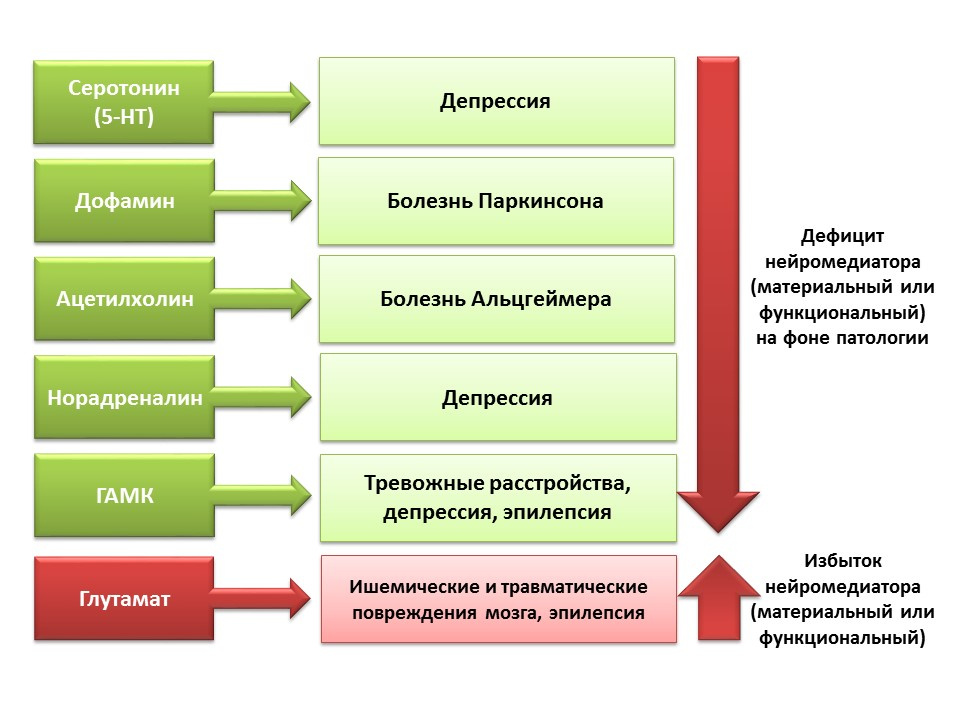
نظرًا لاحتمال التلاعب الدوائي لأنظمة الناقل العصبي للجهاز العصبي المركزي ، يمكننا تقييم مساهمة الناقل العصبي في المراحل المختلفة من تكوين الخلايا العصبية للدماغ الناضج.
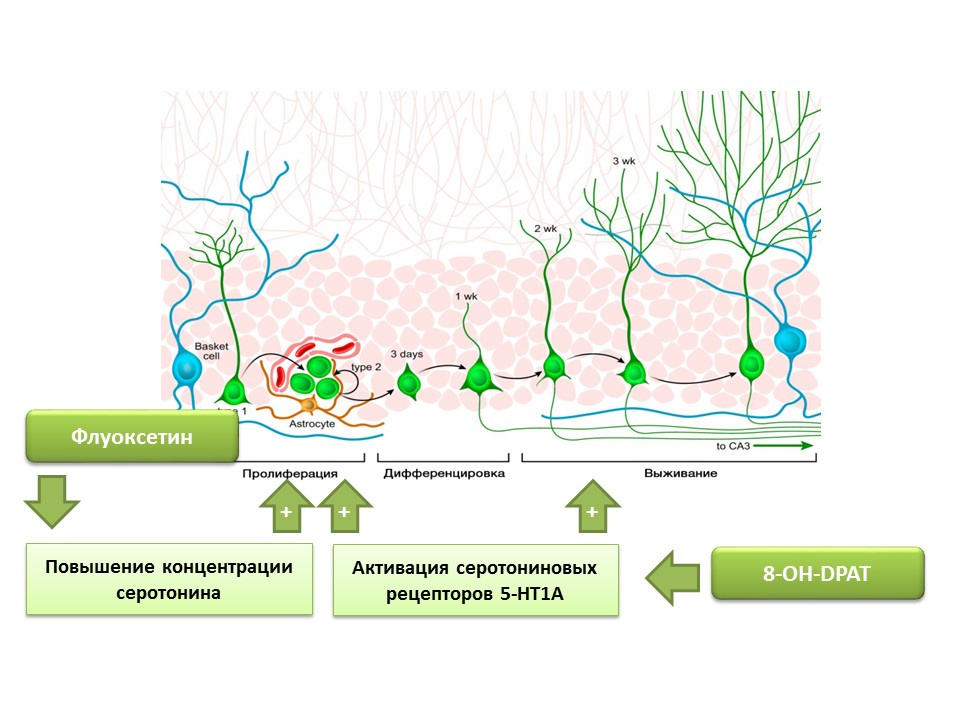
ثبت أن فلوكستين (مضاد للاكتئاب من مجموعة مثبطات امتصاص السيروتونين الانتقائية) ، والتي يمكن أن تزيد من تركيز السيروتونين في الجهاز العصبي المركزي ، يعزز تكاثر الخلايا الجذعية العصبية في التلفيف المسنن من الحصين من القوارض والرئيسات. في وقت لاحق ، تم الكشف عن مستقبلات النوع الفرعي السيروتونين 1A (مستقبلات 5-HT1A) على الخلايا الجذعية نفسها وهذا يتماشى مع قدرة مادة 8-OH-DPAT (المنشط الانتقائي لهذه المستقبلات) على تحفيز تكاثر وبقاء الخلايا العصبية الجديدة في التلفيف المسنن في فرس النهر من الحيوانات التجريبية (الفئران و الفئران).
تعرضت الرئيسيات للضغط المزمن (العزلة الاجتماعية) ، وبعد ذلك تم تقييم السلوك الشبيه بالاكتئاب والقلق ، وكذلك تكوين الخلايا العصبية الحصينية (بعد الموت). أدى الإجهاد المزمن إلى انخفاض في تكوين الخلايا العصبية مع العجز السلوكي (زيادة السلوك الشبيه بالاكتئاب والقلق). العلاج بالفلوكستين (مضاد للاكتئاب يزيد من تركيز السيروتونين في الجهاز العصبي المركزي عن طريق تثبيط امتصاصه) حفز تكوين الخلايا العصبية ومنع السلوك الشبيه بالاكتئاب والقلق.
دوى: 10.1371 / journal.pone.0017600
تؤكد تجربة أخرى دور السيروتونين في تنظيم تكوين الخلايا العصبية لدى البالغين. أدى التحفيز المزمن لمستقبلات السيروتونين 5-HT1A مع 8-OH-DPAT في الفئران إلى زيادة تكاثر الخلايا الجذعية العصبية وبقاء الخلايا العصبية المتمايزة في التلفيف المسنن في الحُصين ومنطقة تحت البطين ، بالإضافة إلى زيادة التكون.
دوى: 10.1016 / j.euroneuro.2009.11.00.00
تؤكد التجارب المقدمة الدور التنظيمي المهم للسيروتونين في عمليات تكوين الخلايا العصبية في الدماغ البالغ.
 دوى: 10.4161 / cc.8.18.9512دوى: 10.1016 / j.neuropharm.2011.01.026
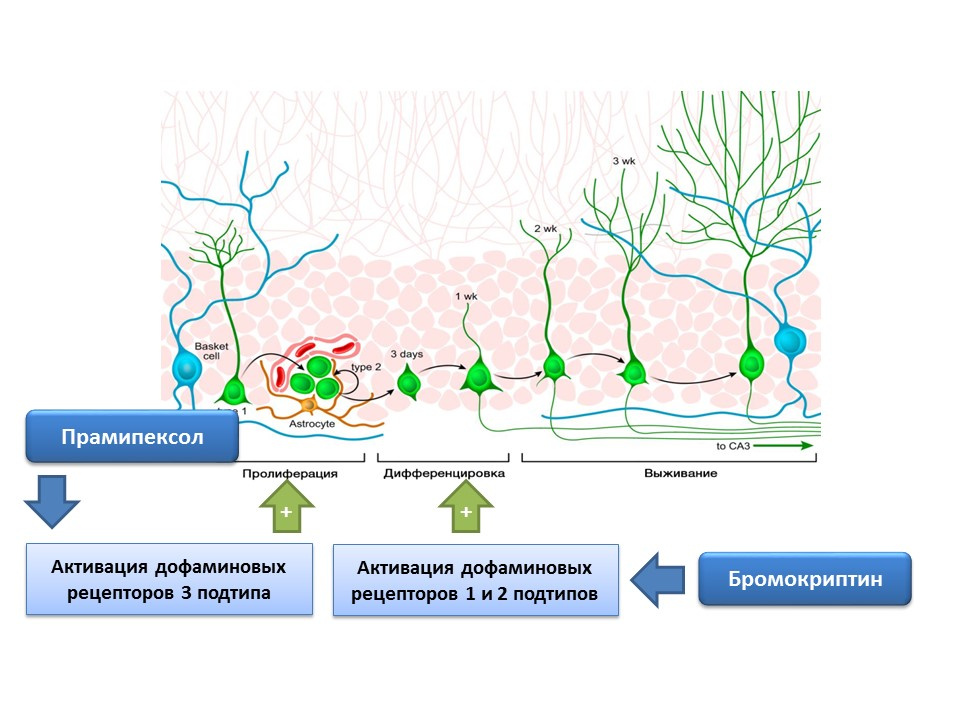
دوى: 10.4161 / cc.8.18.9512دوى: 10.1016 / j.neuropharm.2011.01.026يشارك الدوبامين أيضًا بنشاط في تنظيم تكوين الخلايا العصبية. لقد تبين أن تنشيط مستقبلات الدوبامين من النوع 1 و 2 (D1 و D2) مع بروموكريبتين يعزز عملية التمايز بين الخلايا الجذعية العصبية ، بينما يؤدي تحفيز مستقبلات D3 مع البرامبيكسول إلى زيادة التكاثر.
يستخدم براميبيكسول ، وهو ناهض مستقبلات الدوبامين مع تقارب أكبر لمستقبلات D3 من D2 ، في مرض باركنسون ، ويزيل بشكل فعال أعراض هذا المرض. بالإضافة إلى ذلك ، فإن الدواء لديه نشاط عصبي. في تجربة ، تم تقييم تأثير pramipexole على تكوين الخلايا العصبية في ثقافة الخلية من الفئران. وقد تبين أن علاج ثقافة الخلية مع برامبيكسول أدى إلى زيادة في حجم الخلايا العصبية (مجموعات من الخلايا الجذعية المشكلة حديثًا) والخلايا التي تحتوي على ثنائي الكورتين (الخلايا العصبية غير الناضجة). تم القضاء على التأثير المحفز للبرامبيكسول على تكوين الخلايا العصبية بواسطة حاصرات مستقبلات الدوبامين - U99194A والسولبيريد. بالإضافة إلى ذلك ، ثبت أن pramipexole يعزز إطلاق BDNF. تشير النتائج المعروضة إلى أن فعالية pramipexole في مرض باركنسون لا ترتبط فقط بتجديد نقص الدوبامين الوظيفي ، ولكن أيضًا مع تأثير محفز على تكوين الخلايا العصبية ، وتشير أيضًا إلى دور تنظيمي مهم للدوبامين في مرحلة تكاثر الخلايا الجذعية العصبية.
دوى: 10.1016 / j.neuropharm.2011.01.026
تم تأكيد وجود مستقبلات الدوبامين من النوعين الفرعيين 1 و 2 على الخلايا الجذعية العصبية ، وأظهر الدور التنظيمي المهم للدوبامين في الانتشار والتمايز في زراعة الخلايا العصبية. على وجه الخصوص ، أدى علاج ثقافة الخلية في المنطقة تحت البطينية مع بروموكريبتين (محفز لمستقبلات الدوبامين D1 و D2 الأنواع الفرعية) في ظل ظروف تلفها بواسطة السم العصبي MPTP (نمذجة مرض باركنسون في زراعة الخلايا) أدى إلى زيادة تكاثر الخلايا وتمايزها.
دوى: 10.4161 / cc.8.18.9512
يمكن لـ Norepinephrine زيادة عدد السلائف للخلايا الجذعية العصبية من خلال تنشيط مستقبلات بيتا 3 الأدرينالية. تم عرض هذا التأثير باستخدام ناهض مستقبلات بيتا -3 انتقائية (المنشط) - مادة BRL37344.
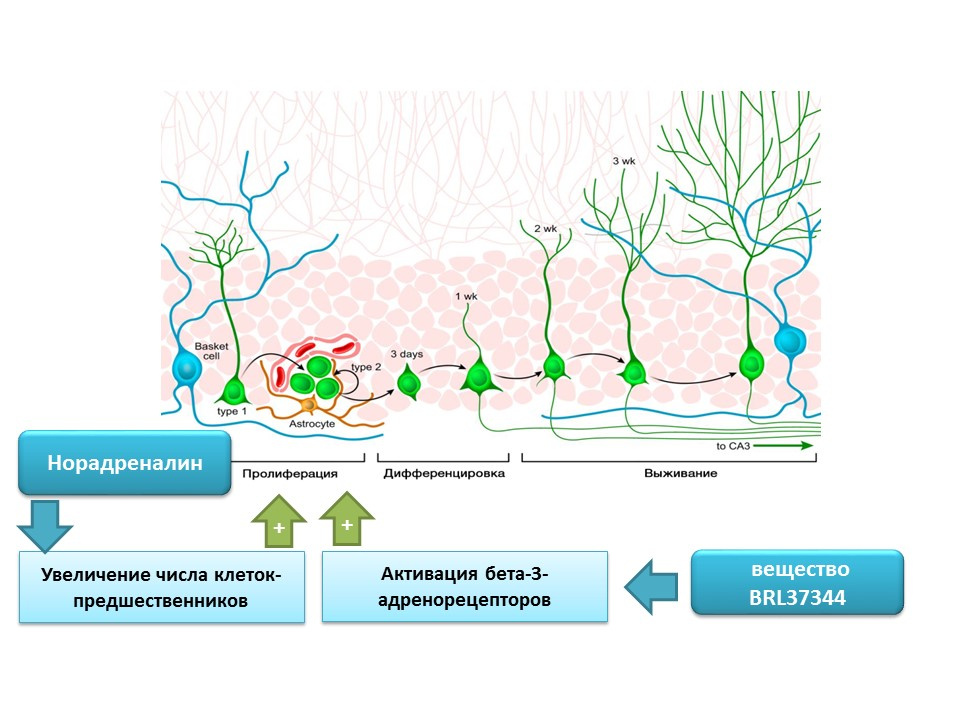
تم تقييم الدور التنظيمي للنورادرينالين في عمليات تكوين الخلايا العصبية الناضجة في دراسة مخبرية شاملة (في زراعة الخلايا) في الجسم الحي (في الفئران). أدت إضافة النوربينفرين إلى زراعة الخلايا إلى زيادة في حجم الخلايا العصبية (تراكم الخلايا الجذعية العصبية). أدى الإعطاء الجهازي لمنبه مستقبلات بيتا -3 انتقائية إلى زيادة تكاثر الخلايا الجذعية العصبية في الحصين في الفئران. تؤكد هذه الدراسات وجود مستقبلات الأدرينالية على الخلايا العصبية غير الناضجة ، وتشير أيضًا إلى الدور التنظيمي للنورادرينالين ، والذي ، على ما يبدو ، يتحقق من خلال مستقبلات بيتا 3-الأدرينالية.
دوى: 10.1523 / JNEUROSCI.3780-09-09الخلايا الجذعية العصبية ، كما ذكرنا سابقًا ، قادرة على إنتاج العوامل التنظيمية نفسها. أحد هذه العوامل هو حمض جاما أمينوبوتيريك (GABA) - الوسيط المثبط الرئيسي للجهاز العصبي المركزي. على وجه الخصوص ، في ثقافة سلائف الخلايا العصبية الفأرية ، تبين أن الخلايا الجذعية العصبية تعزز تخليق GABA ، والذي بدوره يعزز الانتشار من خلال تنشيط الخلايا الدبقية الشعاعية (يؤدي إلى ظهور الخلايا الجذعية) ويساهم في زيادة حجم الخلايا العصبية (تراكم الخلايا الجذعية) في التجربة.
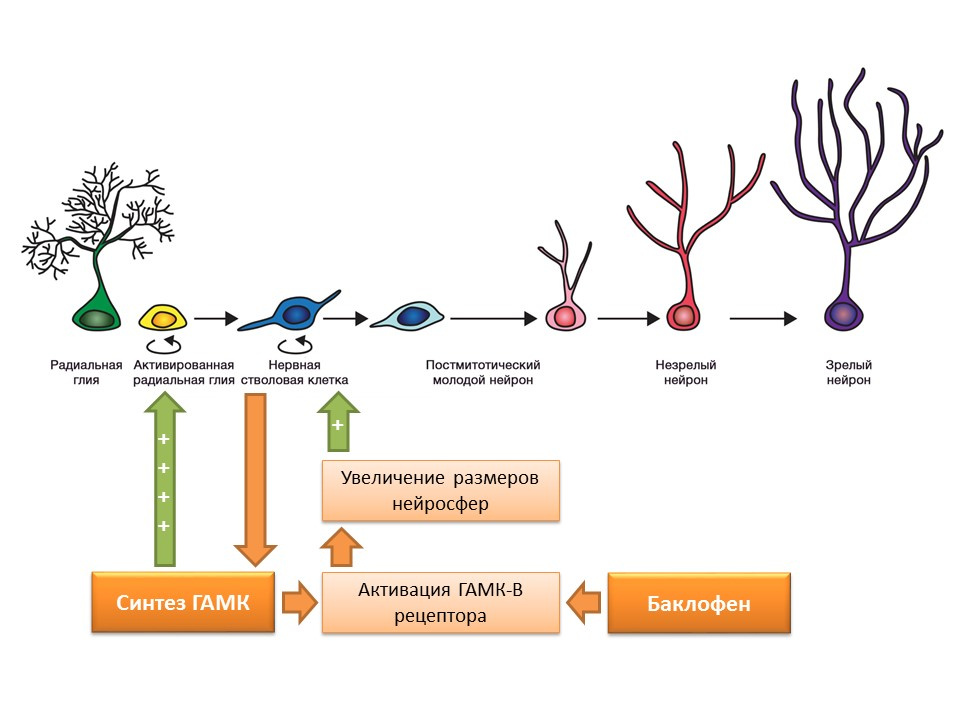
وجد أن تأثير GABA يتحقق من خلال مستقبلات GABA-B. استخدمت الدراسات ناهض مستقبلات GABA-B الانتقائي - باكلوفين.
دوى: 10.1002 / jcp.21422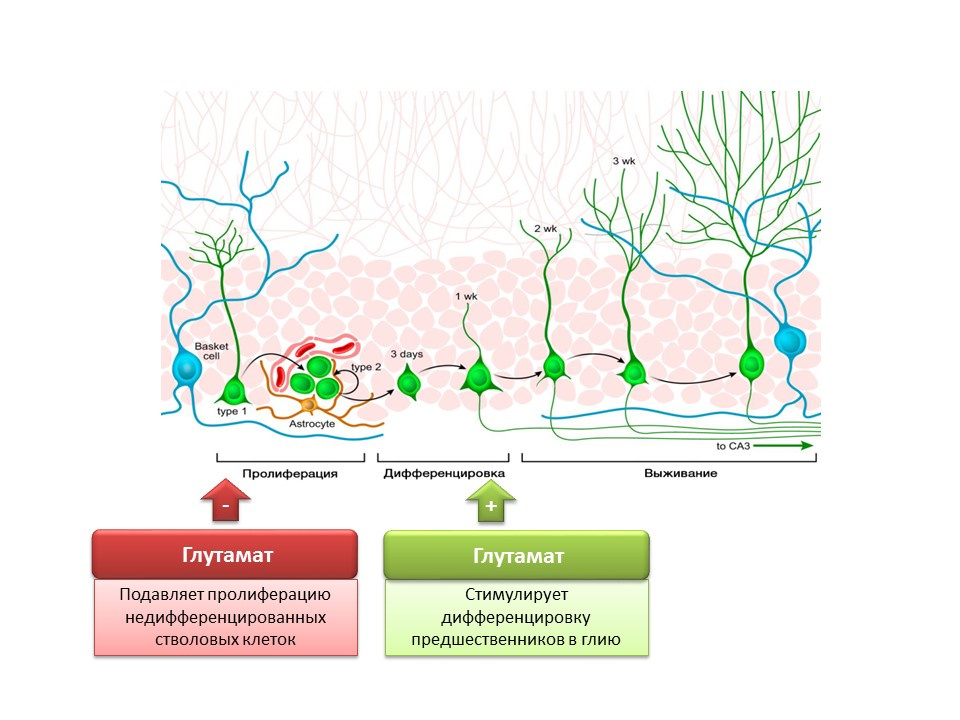 ناكاميشي ن ، تاكارادا تي ، يونيدا واي. تولد الخلايا العصبية بوساطة حمض غاما أمينوبوتيريك وغلوتاماتيسجن. J. علم فارماكول. 2009 ؛ 110 (2): 133-49
ناكاميشي ن ، تاكارادا تي ، يونيدا واي. تولد الخلايا العصبية بوساطة حمض غاما أمينوبوتيريك وغلوتاماتيسجن. J. علم فارماكول. 2009 ؛ 110 (2): 133-49دور الوسيط المثير الرئيسي في الجهاز العصبي المركزي ذو شقين. من ناحية ، يمنع الغلوتامات تكاثر الخلايا الجذعية غير المتمايزة. من ناحية أخرى ، فإنه يحفز تمايز السلائف في الخط الدبقي. يعتقد أن نسب معينة من الغلوتامات و GABA ضرورية لتنظيم تمايز الخلايا الجذعية العصبية إلى أنواع معينة من الخلايا العصبية. على سبيل المثال ، يعزز الغلوتامات ، كما سبق ذكره ، تكوين الخلايا الدبقية (الخلايا النجمية) ، ويشجع GABA على تكوين الخلايا العصبية التي توليف GABA نفسها (الخلايا العصبية GABAergic).
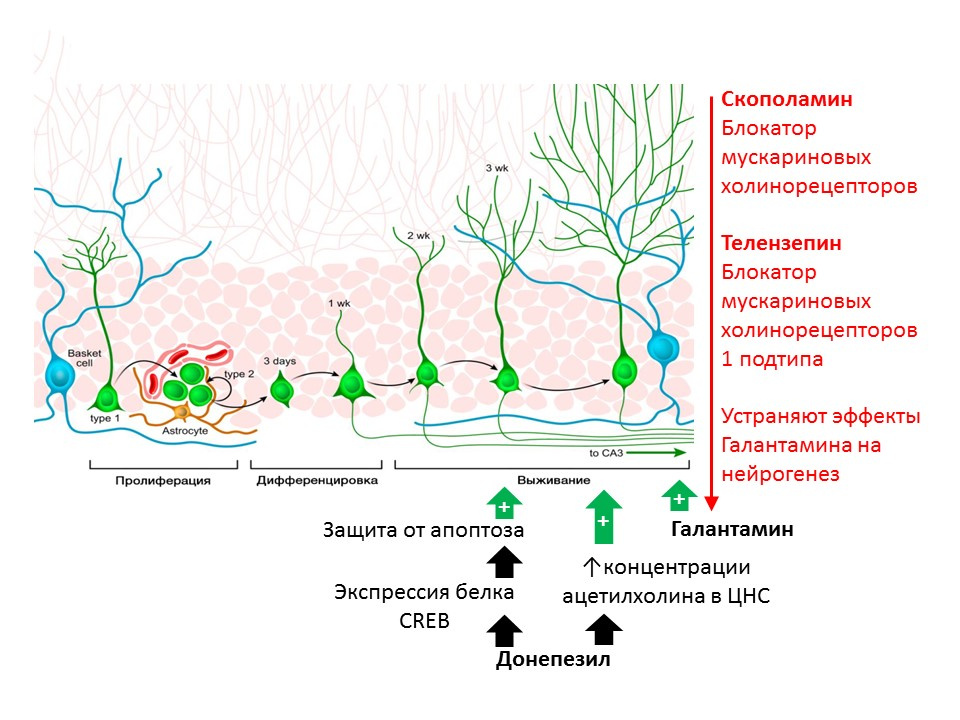 كوتاني وآخرون. H. Donepezil ، وهو مثبط أستيل ، يعزز تكوين الخلايا العصبية الحصينية للبالغين. 2008 ؛ 175 (1-3): 227-30
كوتاني وآخرون. H. Donepezil ، وهو مثبط أستيل ، يعزز تكوين الخلايا العصبية الحصينية للبالغين. 2008 ؛ 175 (1-3): 227-30
Kita Y وآخرون. يعزز Galantamine تكوين الخلايا العصبية الحصينية للبالغين عن طريق مستقبلات النيكوتين المسكارينية و α7 في الفئران. Int J Neuropsychopharmacol.2014؛ 17 (12): 1957-68.يظهر الدور التنظيمي لأسيتيل كولين (ACX) في الفئران باستخدام المواد التي تمنع تدميره (مثبطات أستيل كولين - إنزيم يكسر ACX). يزيد Donepezil و galantamine من تركيز ACX في الجهاز العصبي المركزي (يزيد donepezil أيضًا من التعبير عن بروتين CREB ، وهو عامل النسخ ، وبالتالي يعزز حماية الخلايا العصبية غير الناضجة من موت الخلايا المبرمج) ويزيد من بقاء الخلايا العصبية غير الناضجة. يتم التخلص من التأثير الإيجابي لجالانتامين على تكوين الخلايا العصبية بواسطة سكوبولامين (مانع جميع الأنواع الفرعية لمستقبلات الكوليني المسكاريني) و telenzepine (مانع النوع الفرعي 1 لمستقبلات الكوليني الموسكاريني) ، مما يشير إلى تحقيق تأثيرات ACh على تكوين الخلايا العصبية من خلال تنشيط مستقبلات المسكارين من النوع 1
، دوت كوت. مثبط ، يعزز تكوين الخلايا العصبية الحصينية للبالغين. Chem Biol Interact.2008 ؛ 175 (1-3): 227-30 ؛ Kita Y et al. يعزز Galantamine تكوين الخلايا العصبية الحصينية عن طريق مستقبلات النيكوتين Muscarinic و α7 في الفئران. Int J Neuropsychopharmacol. 2014 ؛ 17 (12): 1957-68. ).
مصادرShetty AK. تولد الخلايا السلفية من منطقة CA3 من الحصين الجنيني في يوم 19 الفئران الأنماط العصبية العصبية الخاصة بالمنطقة في المختبر. الحصين. 2004 ؛ 14 (5): 595-614
Gómez-Lira G et al. النمط الظاهري المبرمج والمستحث للخلايا الحبيبية الحصينية. J العصبية. 2005 ؛ 25 (30): 6939-46
ناكاميشي ن ، تاكارادا تي ، يونيدا واي. تولد الخلايا العصبية بوساطة حمض غاما أمينوبوتيريك وإشارات الغلوتامات. J. علم فارماكول. 2009 ؛ 110 (2): 133-49
Arenas E. هندسة النمط الظاهري الدوباميني في الخلايا الجذعية / السليفة: دور Nurr1 والإشارات المشتقة من الخلايا الدبقية و Wnts. Ann Ann Acad Sci. 2005 ؛ 1049: 51-66
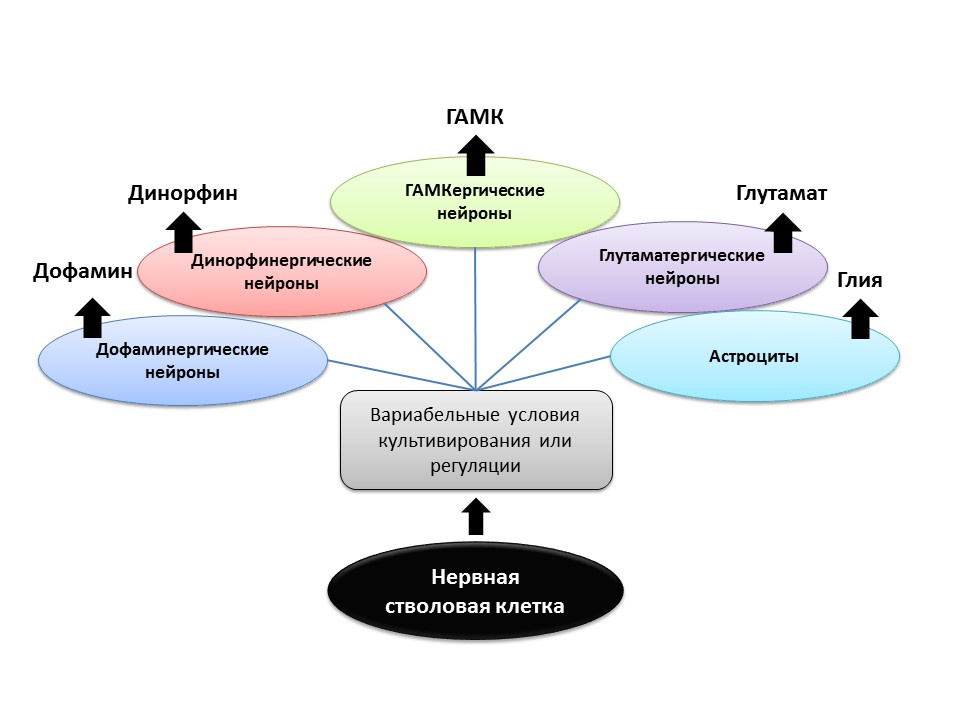
في ظل الظروف التجريبية (في الحيوانات أو في زراعة الخلايا) ، تبين أنه من خلال تغيير نسبة العوامل التنظيمية وإضافة الناقلات العصبية إلى الخلايا الجذعية العصبية نفسها ، يمكن "النمط الظاهري للناقل العصبي" (أي وظيفة الخلية المستقبلية) للخلايا العصبية المشكلة حديثًا "برمجتها". لذلك ، على سبيل المثال ، تسمح لك زراعة الخلايا الجذعية باستخدام الخلايا النجمية بالحصول على عدد من الخلايا العصبية للغلوتاميتيرج (الخلايا العصبية التي تنتج الغلوتامات) ، ومع الخلايا الدوبامين - الدوبامينية.
من الممكن أن يتم استخدام مثل هذا الإجراء الموجه في المستقبل للتكوين الانتقائي للخلايا العصبية لنمط ظاهري معين. على سبيل المثال ، إذا كنا نعرف ما هو النوع المفقود في مرض معين (مع مرض باركنسون ، يموت مرضى الدوبامين ، مع مرض الزهايمر ، الكوليني).
ولكن في الوقت الحاضر ، لا يزال هذا الجانب من تكوين الخلايا العصبية غير مكتشف تمامًا ، ومن السابق لأوانه الحديث عن التنظيم المبرمج لتكوين الخلايا العصبية (هناك عدد قليل من الدراسات).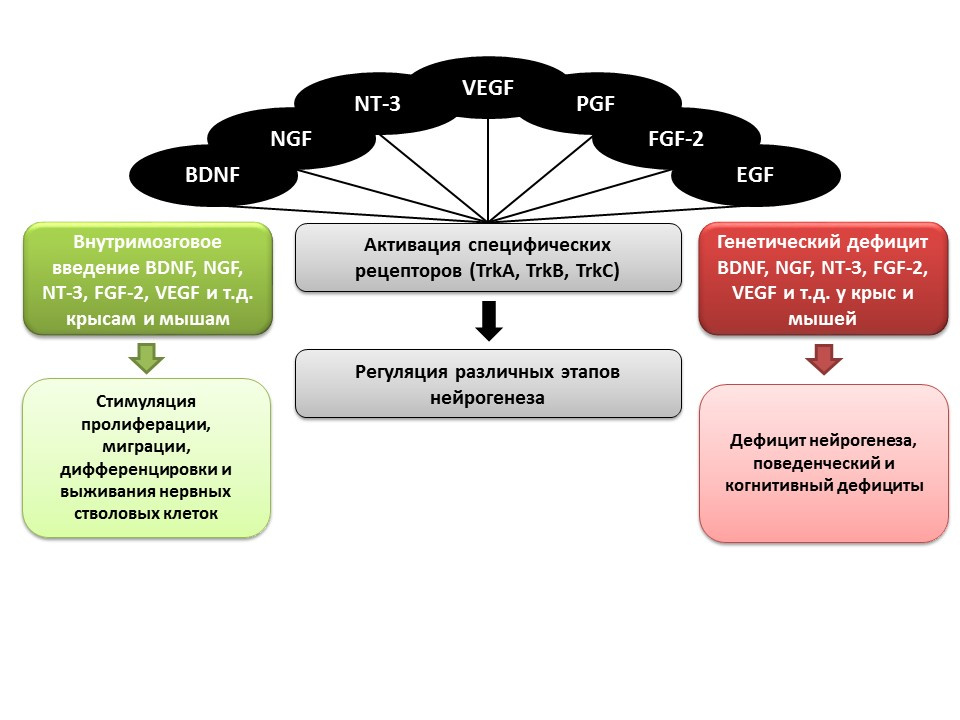
مصادرPencea V et al. Infusion of BDNF into the lateral ventricle of the adult rat leads to new neurons in the parenchyma of the striatum, septum, thalamus, and hypothalamus. J.Neurosci. 2001;21:6706–6717
Bath KG et al. Variant brain-derived neurotrophic factor (Val66Met) alters adult olfactory bulb neurogenesis and spontaneous olfactory discrimination. J Neurosci. 2008; 28:2383–2393
Gascon E, Vutskits L, Zhang H, et al. Sequential activation of p75 and TrkB is involved in dendritic development of subventricular zone-derived neuronal progenitors in vitro. Eur J Neurosci. 2005;21:69–80
Kahn MA, Kumar S, Liebl D, et al. Mice lacking NT-3, and its receptor TrkC, exhibit profound deficiencies in CNS glial cells. Glia. 1999;26:153–165
Shimazu K, Zhao M, Sakata K, et al. NT-facilitates hippocampal plasticity and learning and memory by regulating neurogenesis. Learn Mem. 2006; 13(3):307-15)
Zhao M, Li D, Shimazu K, et al. Fibroblast growth factor receptor-1 is required for long-term potentiation, memory consolidation, and neurogenesis. Biol Psychiatry. 2007;62:381–390
يلعب النمو وعوامل التغذية العصبية دورًا مهمًا في تنظيم تكوين الخلايا العصبية ، كما ذكرنا سابقًا ، بما في ذلك:- عامل التغذية العصبية الدماغية (BDNF)
- عامل نمو الأعصاب (NGF)
- العصبية -3 (NT-3)
- عامل النمو البطاني الوعائي (VEGF)
- عامل نمو الصفائح الدموية (PGF)
- عامل نمو الأرومة الليفية 2 (FGF-2)
- عامل نمو البشرة (EGF)
في التجارب على الحيوانات (الفئران والفئران) ، تبين أن الإعطاء داخل الدماغ للعوامل المذكورة أعلاه يعزز جميع مراحل تكوين الخلايا العصبية. يؤدي النقص الخلقي (الفئران المعدلة وراثيا مع الجينات المعطلة من العوامل ذات الصلة) إلى ضعف تكوين الخلايا العصبية ، فضلا عن العجز السلوكي والمعرفي. تؤكد هذه البيانات الدور التنظيمي الهام لهذه العوامل في تكوين الخلايا العصبية.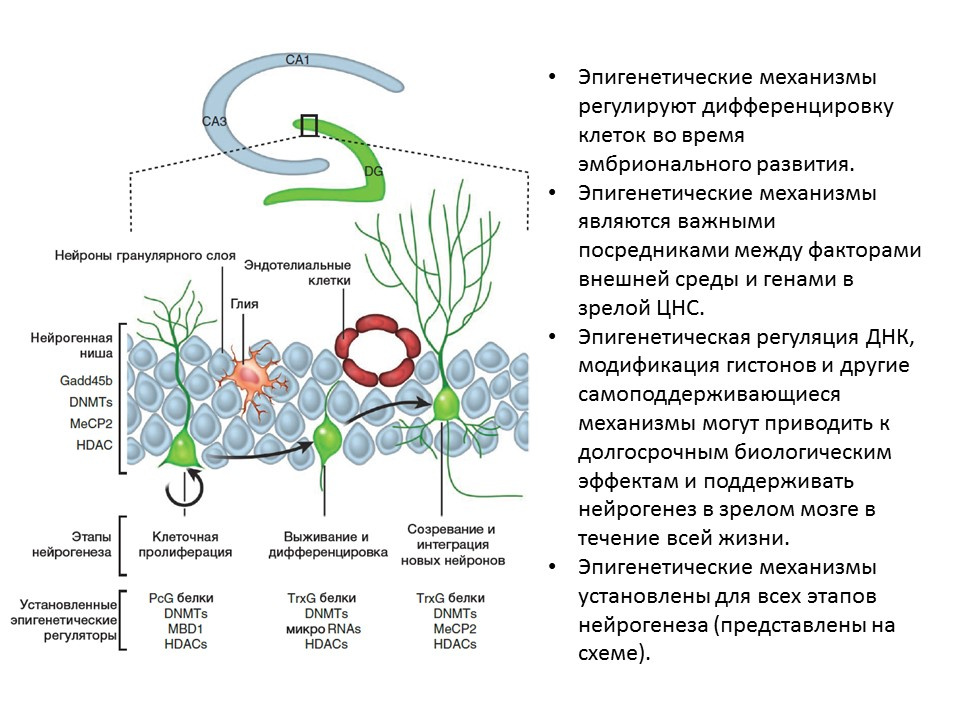 ما DK ، Marchetto MC ، Guo JU ، Ming GL ، Gage FH ، Song H. مصمم التوليد اللاجيني لتكوين الخلايا العصبية في دماغ الثدييات البالغ. نات نيوروسسي .2010 ؛ 13 (11): 1338-44.تم تحديد العوامل التنظيمية الجينية لجميع مراحل تكوين الخلايا العصبية ، على سبيل المثال:
ما DK ، Marchetto MC ، Guo JU ، Ming GL ، Gage FH ، Song H. مصمم التوليد اللاجيني لتكوين الخلايا العصبية في دماغ الثدييات البالغ. نات نيوروسسي .2010 ؛ 13 (11): 1338-44.تم تحديد العوامل التنظيمية الجينية لجميع مراحل تكوين الخلايا العصبية ، على سبيل المثال:- ديسيتيلازات الهيستون (HDACs)
- نقل ميثيل الدنا (DNMTs)
- الحمض النووي الريبي الصغير
- وغيرهم.
مصادرCoras R, Siebzehnrubl FA, Pauli E, et al. Low proliferation capacities of adult hippocampal stem cells correlate with memory dysfunction in humans. Brain. 2010;133(11):3359-72
Cheyne JE, Grant L, Butler-Munro C, et al. Synaptic integration of newly generated neurons in rat dissociated hippocampal cultures. Mol Cell Neurosci. 2011;47(3):203-14
Hernández-Rabaza V, et al. Neuroscience. 2009;159(1):59-68).
Mochizuki N, Moriyama Y, Takagi N, et al. Intravenous injection of neural progenitor cells improves cerebral ischemia-induced learning dysfunction. Biol Pharm Bull. 2011;34(2):260-5
Sahay A., Hen R. Hippocampal neurogenesis and depression. Novartis Found Symp. 2008;289:152-60
Toni N, Laplagne DA, Zhao C, et al. Neurons born in the adult dentate gyrus form functional synapses with target cells. Nat Neurosci. 2008; 11:901–7
, ( ), () (, , ..), «» ( ).
, . «», .
Lichtenwalner RJ et al. Neuroscienc 2001;107, 603–613
Luo J, et al. Aging Cell. 2006;5(2):139-52
Cuppini R et al. Hippocampus. 2006;16(2):141-8;
Shetty AK, Hattiangady B, Shetty GA. Glia 2005; 51, 173–186
Drapeau E, Nora Abrous D. Aging Cell. 2008;7(4): 569-89
Hattiangady B, Shetty AK. Neurobiol. Aging.2008; 29: 129–177
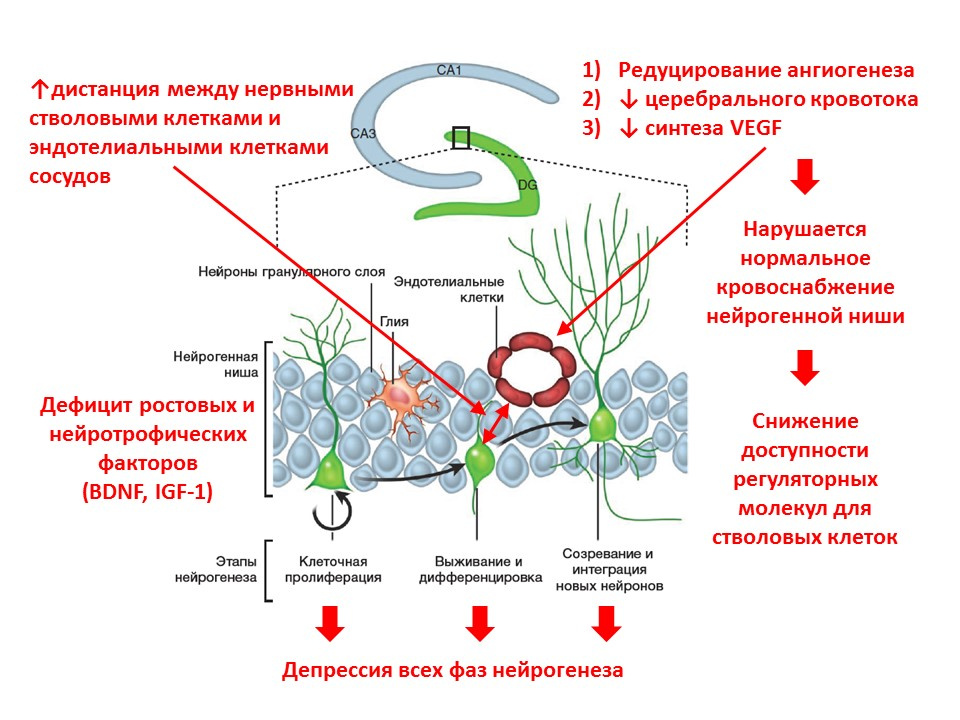
. :
- نقص عوامل النمو والعصب العصبي - أحد المنظمين الرئيسيين ؛
- يتغير توازن الناقل العصبي للدماغ (ينخفض عدد بعض الوسطاء ، ويزيد البعض الآخر ، على العكس) ؛
- تقل شدة جميع مراحل تكوين الخلايا العصبية ؛
- ينخفض تدفق الدم إلى الكوة العصبية (يتم تقليل تكوين الأوعية الدموية ، والتعبير عن عامل نمو بطانة الأوعية الدموية - ينخفض VEGF) ، مما يقلل من توافر العوامل التنظيمية للخلايا الجذعية ؛
- تزداد المسافة بين الخلايا الجذعية العصبية والخلايا البطانية الوعائية (تتحول الخلايا الجذعية الطبيعية بالقرب من الأوعية).
ومع ذلك ، لا يمكن التراجع عن التغيرات المرتبطة بالعمر في تكوين الخلايا العصبية ، ويمكن تحفيز وظيفة الدماغ التكيفية.- , , .. (Jakubs K et al. Inflammation regulates functional integration of neurons born in adult brain. J Neurosci. 2008 Nov 19;28(47):12477-88).
- , . . (Bachstetter AD et al. Fractalkine and CX3CR1 regulate hippocampal neurogenesis in adult and aged rats. Neurobiol Aging. 2011;32(11):2030-44).
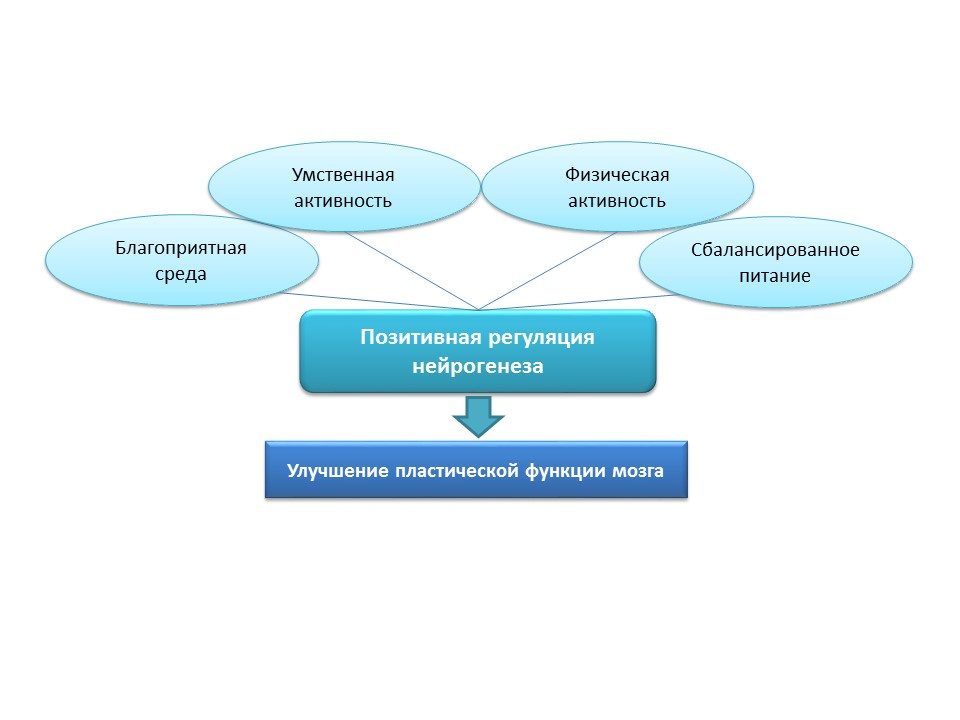
تظهر الصورة معلومات عن تحفيز تكوين الخلايا العصبية في الفئران القديمة عن طريق تحريض التهاب العصب العصبي وإدارة بروتين الفركتالين. توضح هذه البيانات حقيقة أن الدماغ يحتفظ بالوظيفة التكيفية التي يحملها تكوين الخلايا العصبية.
من أجل التحفيز الطبيعي لتكوين الخلايا العصبية لدى كبار السن ، تبدو هذه الاستراتيجيات عدوانية بشكل مفرط ، وبالتالي ، يجب اعتبار المحفزات الإيجابية الطبيعية عوامل "تدريب" وعصبية "داعمة": بيئة مواتية ، نشاط عقلي ، نشاط بدني ، تغذية متوازنة.
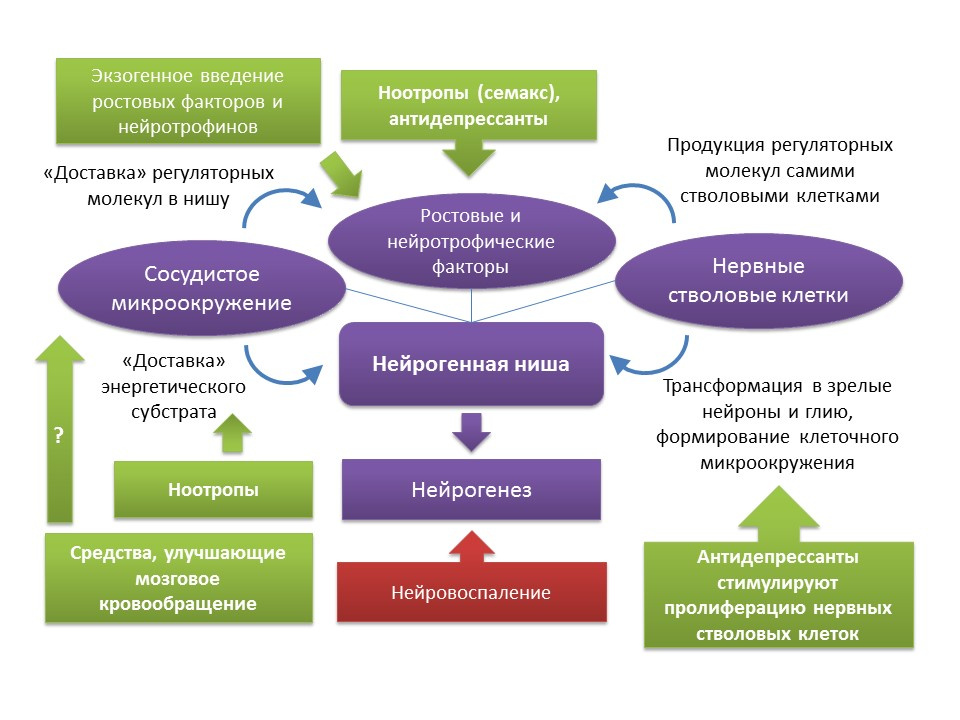 ميدفيديفا ، EV ، دميتريفا ، VG ، Stavchansky ، VV وآخرون. Int J Pept Res Ther (2016) 22: 197.
ميدفيديفا ، EV ، دميتريفا ، VG ، Stavchansky ، VV وآخرون. Int J Pept Res Ther (2016) 22: 197.
جاكوبس ك وآخرون. ينظم الالتهاب التكامل الوظيفي للخلايا العصبية المولودة في دماغ البالغين. J العصبية. 2008 نوفمبر 19 و 28 (47): 12477-88
يحفز وكلاء تاوبين بي نووتروبيك تكوين الخلايا العصبية. رأي الخبراء بات. 2009 مايو ؛ 19 (5): 727-30.كما ذكرنا سابقًا ، على الرغم من التغييرات المتعلقة بالعمر التي يمر بها مكان العصبية ، يمكن استعادة وظيفة تكوين الخلايا العصبية إذا كانت هناك حوافز معينة. وتجدر الإشارة إلى أن معدل الشيخوخة والتغيرات المرتبطة بالعمر في تكوين الخلايا العصبية المرتبطة بهذه العملية غير متجانسة ويتم تحديدها من خلال الخصائص الفردية للجسم. على وجه الخصوص ، يعتقد أن الأشخاص الذين لديهم مستوى أعلى في البداية من تكوين الخلايا العصبية لديهم مستوى أعلى من المرونة العصبية في الدماغ ، وبالتالي ، هم أكثر مقاومة للتغيرات المرتبطة بالعمر في الجهاز العصبي المركزي. ومع ذلك ، لا توجد حاليًا طريقة لإحداث تأثير شامل على المكانة العصبية بأكملها. كما ذكرنا سابقًا ، فإن الكوة العصبية نفسها هي نوع من البيئة الدقيقة التي تحتوي على العديد من العناصر (البيئة الأوعية الدموية والخلوية ، ومجموعة من النمو وعوامل التغذية العصبية). من ناحية ، هناك تجربة دوائية قوية إلى حد ما في تنظيم تكوين الخلايا العصبية بسبب التأثير على المكونات الفردية لهذه "البيئة الدقيقة" (إدخال أو تحريض الجزيئات التنظيمية الداخلية ؛ التحفيز من خلال عقاقير الانتشار والتمايز والبقاء للخلايا العصبية المشكلة حديثًا ؛ تحسين الدورة الدموية الدماغية واستقلاب الطاقة في الجهاز العصبي المركزي). من ناحية أخرى ، من المعروف أن الخلايا الجذعية نفسها تنتج عوامل نمو وعصبية - BDNF ، NGF ، VEGF ، وما إلى ذلك (
علاج السكتة الدماغية Guzman R .: من استبدال الخلايا إلى الدعم الغذائي. مراجعة الخبراء لعلاج القلب والأوعية الدموية .2009 ؛ 7 (10 ): 1187-1190 ). قد يؤدي هذا إلى استنتاج أنه ، لاستعادة وظيفة مكانة عصبية ، يمكن للمرء ، على سبيل المثال ، استخدام العلاج بالخلايا الجذعية نفسها أو مع العوامل التي يمكن أن تحفز تكاثر الخلايا الجذعية العصبية. لهذه الوسائل ، كما سبق ذكره ، هي مضادات الاكتئاب من مجموعات دوائية مختلفة. قد تؤكد الأدلة السريرية على انخفاض خطر الإصابة بالخرف الشيخوخة بعد الدورة (المضاعفات المتكررة بعد الاكتئاب في سن مبكرة) من العلاج المضاد للاكتئاب مثل هذا الاستنتاج بشكل غير مباشر. وتجدر الإشارة إلى أن البيانات المتعلقة بتأثير مضادات الاكتئاب على خطر الخرف مثيرة للجدل. وهكذا ، وجد أن استخدام مضادات الاكتئاب ثلاثية الحلقات يرتبط بانخفاض خطر الإصابة بالخرف ، في حين أن مثبطات MAO (مونو أمين أوكسيديز) ، ومضادات الاكتئاب غير المتجانسة ومثبطات SSRI (مثبطات امتصاص السيروتونين الانتقائية) ، على العكس من ذلك ، قد تزيد من الخطر أو ليس لها أي تأثير على تطور الخرف. (
Kessing LV، Forman JL، Andersen PK. هل تحمي مضادات الاكتئاب المستمرة من الخرف لدى المرضى الذين يعانون من اضطراب اكتئابي حاد؟ Int Clin Psychopharmacol.2011؛ 26 (6): 316-22؛ Lee CW et al. علاج مضاد للاكتئاب وخطر الخرف: دراسة الحالات والشواهد بأثر رجعي قائمة على السكان. J Clin Psychiatry.2016 Jan؛ 77 (1): 117-22؛ quiz 122 ). ومع ذلك ، تتطلب هذه البيانات السريرية الحذر عند التفسير ، لأن هذه المراجعات السريرية لا تأخذ في الاعتبار عددًا من العوامل (تاريخ تدخين المرضى ، واستهلاك الكحول ، وشدة وأشكال الاضطرابات الاكتئابية ، والأمراض المصاحبة ، وما إلى ذلك).
مجموعة أخرى مثيرة للاهتمام من الأدوية التي يمكن اعتبارها عوامل عصبية محتملة هي منشط الذهن. تحتوي أدوية منشط الذهن على عدد من الميزات المحددة: 1) تعمل فقط على خلفية علم وظائف الوظائف. 2) لها طبيعة تراكمية للعمل ؛ 3) متنوعة في آليات عملها وهيكلها الكيميائي ؛ 4) يتصرف مثل المنشطات النفسية ، ولكن ليس له الآثار الجانبية الكامنة ؛ 5) حتى الآن ، لا توجد بيانات مقنعة عن الفعالية السريرية لنووتروبيكس. يعتقد أن أدوية منشط الذهن لها تأثير معقد على الجهاز العصبي المركزي: فهي تحسن الدورة الدموية الدماغية ، واستقلاب الطاقة ، وتتفاعل مع مستقبلات معظم الناقلات العصبية (GABA ، الغلوتامات ، أستيل كولين). في الدراسات التجريبية ، تم إثبات القدرة المحتملة لبعض منشط الذهن لتحفيز تكوين الخلايا العصبية. على وجه الخصوص ، عزز بيراسيتام عملية التمايز في ثقافة الخلايا الجذعية العصبية البشرية (
Taupin P. العوامل منشط الذهن
تحفز تكوين الخلايا العصبية. الخبير Opin Ther Pat. وعوامل التغذية العصبية في دماغ الفئران بعد تناولها داخل الصفاق تحت ظروف نمذجة السكتة الدماغية (
ميدفيديفا ، EV ، دميتريفا ، VG ، Stavchansky ، VV وآخرون. Int J Pept Res Ther (2016) 22: 197 ) ، مما يشير أيضًا إلى التأثير المحتمل للإصابة المسببة للدواء. . في ضوء المعرفة الضعيفة للنووتروبيك ، من الصعب التحدث عن الآلية المحددة لنشاطهم العصبي ، حيث يمكن لكل من تأثيرها المعقد على الجهاز العصبي المركزي وبعض المكونات المحددة المشاركة. من الواضح أن هذه القضية تتطلب المزيد من الدراسات التفصيلية.
مجموعة أخرى من الأدوية التي يمكن أن تحفز تكوين الخلايا العصبية هي مصححات الدورة الدموية الدماغية (على سبيل المثال ، nimodipine أو pentoxifylline). ومع ذلك ، فإن البيانات المتعلقة بتأثير هذه الأدوية على تكوين الخلايا العصبية شحيحة. في التجارب على الفئران ، تبين أن العلاج باستخدام البنتوكسيفيلين يحسن الذاكرة قصيرة المدى ويقلل موت الخلايا المبرمج للخلايا العصبية الحصينية تحت ظروف نقص التروية الدماغية ، والتي قد تشير إلى خصائصها العصبية (
بارك JH وآخرون. Pentoxifylline يخفف من ضعف الذاكرة الناتج عن نقص التروية- نقص التروية الناتج عن نقص الذاكرة على المدى القصير عن طريق قمع موت الخلايا المبرمج في الحصين لجرذ الجرذ Int Neurourol J 2016؛ 20 (2): 107-113 ). وعلى النقيض من ذلك ، أظهر نيموديبين القدرة على تثبيط تكوين الخلايا العصبية المحفزة لإقفار الدم في الحصين من الفئران (Luo CX وآخرون. إن حصار قناة Ca ذات الجهد الكهربي المحبب للجهد يثبط نقص التروية العصبية الناجم عن نقص التروية في ماوس البالغين. مجلة الكيمياء العصبية ، 2005). ، والتي ، على ما يبدو ، مرتبطة بآليتها المباشرة للعمل - حصار قنوات الكالسيوم من النوع L.
للحصول على صورة كاملة عن التلاعب الدوائي لمكان عصبي في ظروف التغيرات المرتبطة بالعمر ، هناك حاجة إلى مزيد من الدراسات التفصيلية التي ستوسع فهم نشاط الأدوية العصبية في الظروف ذات الصلة وتسمح لنا باستنتاج أن هناك اتجاهات واعدة في إنشاء الأدوية التي تمنع وتصحح الانخفاض المرتبط بالعمر في النشاط العصبي في الدماغ.
دور تكوين الخلايا العصبية في مختلف الأمراض في الجهاز العصبي المركزي
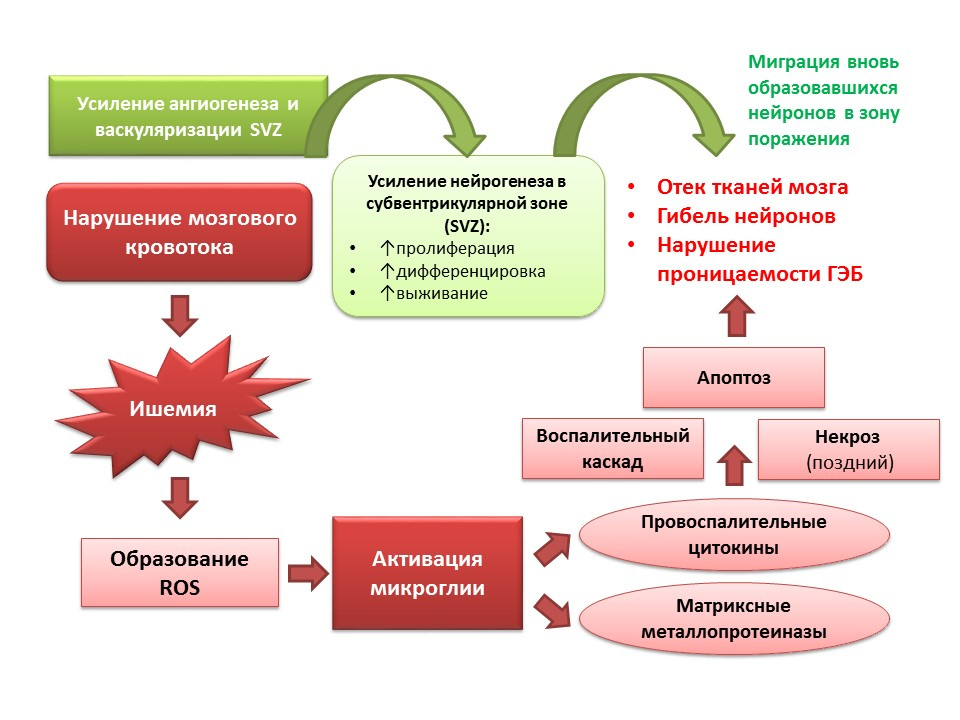
مصادرBordt ، EA ، Polster ، BM (2014). NADPH أوكسيديز وميتوكوندريا أنواع الأكسجين التفاعلي المستمدة في التنشيط الميكروي للالتهابات: علاقة ثنائية الحزبين؟ Free Radic Biol Med ، 34-46
Liu J ، Solway K ، Messing RO ، Sharp FR. زيادة تكوين الخلايا العصبية في التلفيف المسنن بعد إقفار الدم العالمي العابر في الجربوع. J العصبية. 1998 ؛ 18 (19): 7768-78
Zhang ZG، Zhang L، Jiang Q، et al. VEGF يعزز تكوين الأوعية الدموية ويعزز تسرب الحاجز الدموي الدماغي في الدماغ الإقفاري. J Clin Invest. 2000 ؛ 106: 829-38
Nakayama D، Matsuyama T، Ishibashi-Ueda H، et al. الخلايا الجذعية العصبية / السلف التي تسببها الإصابة في القشرة الدماغية البشرية بعد السكتة الدماغية. يورو ج نيوروسسي. 2010 ؛ 31 (1): 90-8)
Minger SL ، Ekonomou A ، Carta EM ، et al. تكوين الخلايا العصبية الذاتية في الدماغ البشري بعد احتشاء دماغي. ريجين ميد. 2007 ؛ 2 (1): 69-74).
يؤدي تكوين الخلايا العصبية أيضًا وظيفة تكيفية على خلفية أمراض الجهاز العصبي المركزي. على وجه الخصوص ، تؤدي السكتة الإقفارية إلى موت الخلايا العصبية (يظهر مخطط مبسط للإمراض على الشريحة). ومع ذلك ، مع نقص التروية ، يموت عدد قليل من الخلايا العصبية بسرعة (دقائق) - وهذا هو ما يسمى نواة نقص التروية. معظم الخلايا العصبية تعاني من نقص في الجلوكوز والأكسجين ، لكنها تبقى قابلة للحياة لعدة ساعات (نافذة علاجية للمساعدة) - وهذا هو ما يسمى بنومبرا أو بنومبرا من نقص التروية. في ظل ظروف تلف الدماغ الإقفاري ، يتم تنشيط تكوين الخلايا العصبية في المنطقة تحت البطينية للبطينين الجانبيين وتهاجر الخلايا العصبية المشكلة حديثًا إلى منطقة الظليل.
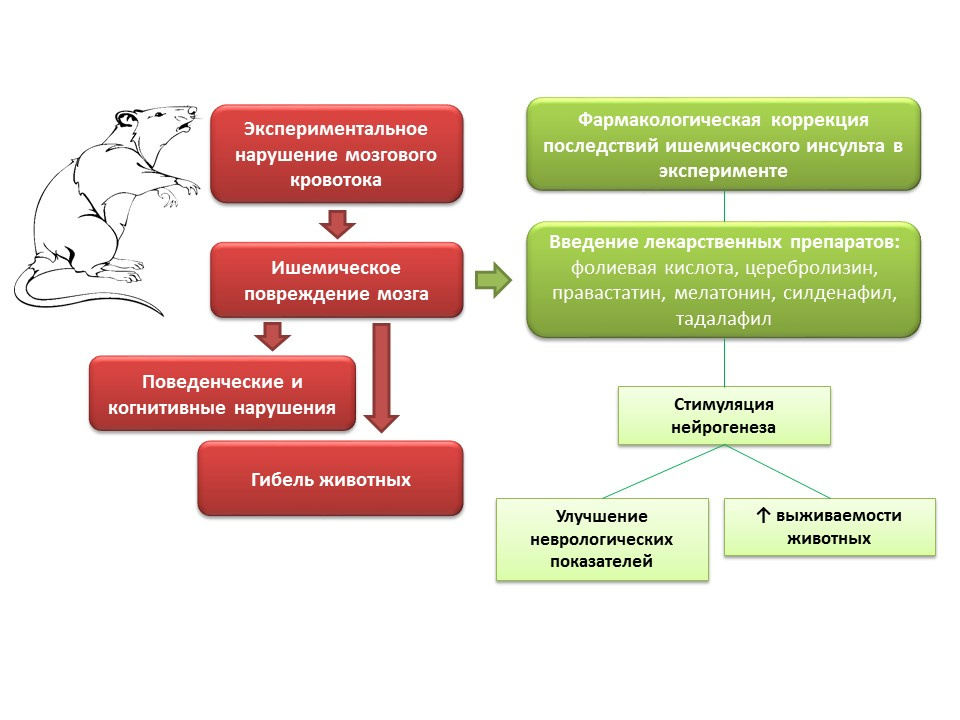
مصادرZhang ، RL ، Zhang ، ZG ، & Chopp ، M. (2013). استهداف أكسيد النيتريك في العلاج التصالحي دون الحاد للسكتة الإقفارية. رأي خبير في الأدوية الاستقصائية ، 22 (7) ، 843-851.
Chern CM ، Liao JF ، Wang YH ، Shen YC. يعمل الميلاتونين على تحسين الوظيفة العصبية من خلال تعزيز تكوين الخلايا العصبية الذاتية من خلال مستقبلات الميلاتونين MT2 في فئران السكتة الدماغية. راديتش بيول ميد. 2012 ؛ 52 (9): 1634-47
Zhang X ، Huang G ، Liu H ، et al. حمض الفوليك يعزز إشارات الشق ، تكوين عصبي الحصين ، والوظيفة المعرفية في نموذج الفئران من نقص تروية الدماغ. نيوتروسى نوتر. 2012 ؛ 15 (2): 55-61
Zhang C، Chopp M، Cui Y، et al. يعزز Cerebrolysin تكوين الخلايا العصبية في الدماغ الإقفاري ويحسن النتائج الوظيفية بعد السكتة الدماغية. J Res Neurosci Res. 2010 نوفمبر 15 ؛ 88 (15): 3275-81
Zhang RL ، Zhang Z ، Zhang L ، وآخرون. العلاج المتأخر مع السيلدينافيل يعزز تكوين الخلايا العصبية ويحسن الانتعاش الوظيفي في الفئران المسنة بعد نقص التروية الدماغية البؤري. J Res Neurosci Res. 2006 ؛ 83 (7): 1213-9
Zheng Z، Chen B. تأثيرات Pravastatin على الحماية العصبية و تكوين الخلايا العصبية بعد نقص التروية الدماغية في الفئران. نيوروسسي بول. 2000 ؛ 23 (4): 189-97
في التجارب على الحيوانات ، عند نمذجة اضطرابات تدفق الدم في الدماغ ، لوحظت الاضطرابات العصبية (العجز المعرفي والسلوكي) ، بالإضافة إلى نسبة كبيرة من وفيات الحيوانات. إدخال الأدوية إلى هذه الحيوانات بآلية عمل مختلفة ، ولكن مع سمة مشتركة - القدرة على تحفيز تكوين الخلايا العصبية (حمض الفوليك ، سيبروليسين ، برافاستاتين ، ميلاتونين ، سيلدينافيل ، تادالافيل) - تحسين المعلمات العصبية للحيوانات وتقليل الوفيات بشكل ملحوظ.
ما هي احتمالات التلاعب في تكوين الخلايا العصبية لتلف الدماغ الإقفاري؟- إمكانية استخدام بعض الأدوية من مجموعة الأعصاب (cerebrolysin) كجزء من العلاج المعقد للسكتة الدماغية الحادة لمنع موت الخلايا العصبية في الظليل.
- بالنسبة للعديد من الأدوية التي أظهرت القدرة على تحفيز تكوين الخلايا العصبية وتحسين الحالة العصبية للحيوانات بعد نمذجة السكتة الدماغية ، فإن هذا التأثير ليس أساسيًا ، وبالتالي فإن استخدامها السريري معقد بسبب وجود تأثيرات خاصة بها ، والتي قد تكون غير مرغوب فيها.
- من ناحية أخرى ، تعتبر دراسة الآليات الكامنة وراء التأثيرات العصبية مهمة مهمة ، لأنها يمكن أن توفر الأساس لتطوير عقاقير جديدة فعالة للغاية بشكل أساسي للعلاج التصالحي للسكتة الدماغية.
- يفتح التنظيم الدوائي للتكوين العصبي ، على خلفية تلف الدماغ الإقفاري ، إمكانية إنشاء مجموعة جديدة من الأدوية التي تقلل من الوفيات وتحسن نوعية حياة المرضى بعد السكتة الدماغية.
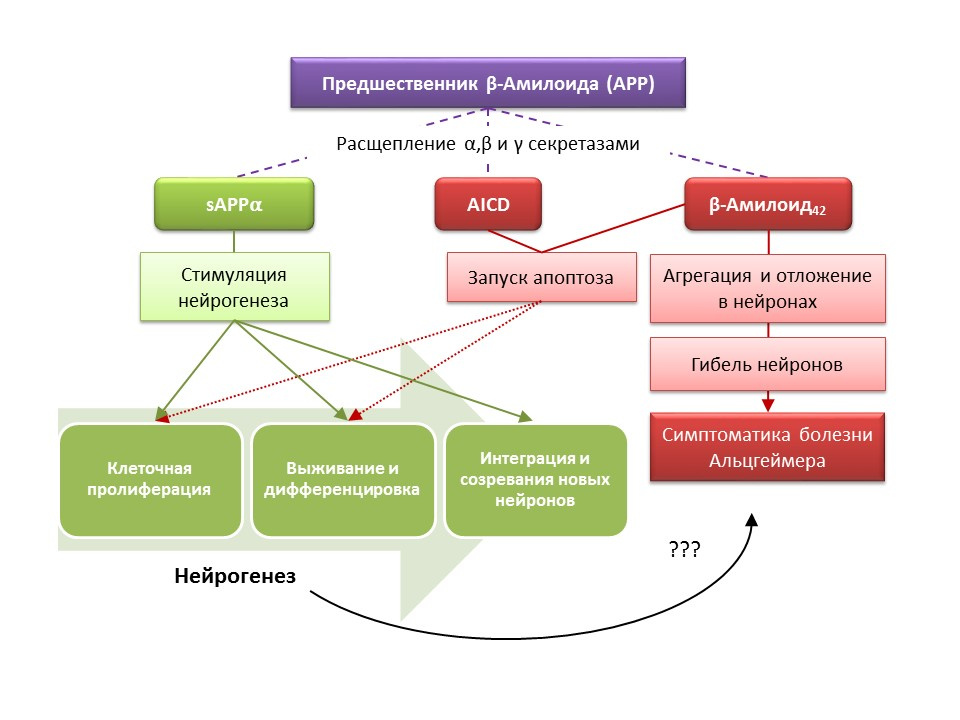
مصادرYu Y وآخرون. زيادة تكوين الخلايا العصبية الحصينية في المرحلة التدريجية من النمط الظاهري لمرض الزهايمر في نموذج الماوس المعدلة وراثيا APP / PS1 المزدوج. الحصين. 2009 ؛ 19 (12): 1247-53
Ghosal K ، Stathopoulos A ، Pimplikar SW. يضعف مجال APP داخل الخلايا تكوين الخلايا العصبية لدى البالغين في الفئران المعدلة وراثيًا عن طريق إحداث التهاب عصبي. بلوس واحد. 2010 ؛ 5 (7): e11866
Mu Y ، Gage FH. تكوين الخلايا العصبية للحصين ودورها في مرض الزهايمر. مول Neurodegener. 2011 ؛ 6: 85
Jin K، Peel AL، Mao XO، et al. زيادة تكوين الخلايا العصبية في الحصين في مرض الزهايمر. Proc Natl Acad Sci USA. 2004 ؛ 101 (1): 343–347
مرض الزهايمر (AD) هو مرض تنكسي عصبي يرافقه موت الخلايا العصبية الكولينية (الخلايا العصبية التي تنتج أستيل كولين). لم يتم تحديد أسباب مرض الزهايمر حاليًا بدقة ، ويعتبر المرض متعدد العوامل. يعتمد التسبب في مرض الزهايمر على انتهاك التمثيل الغذائي لبروتين بيتا أميلويد ، الذي يتم ترسيخ أجزاء منه في الخلايا العصبية المركزية للجهاز العصبي وتؤدي إلى وفاتها. تؤثر الكسور النشوانية على تكوين الخلايا العصبية بطرق مختلفة ، لذا فإن سليفة ألفا الأميلويد القابلة للذوبان (sAPPα) تحفز جميع مراحل تكوين الخلايا العصبية ، في حين أن المجال داخل الخلايا من السلائف النشواني (AICD) وبيتا أميلويد -42 يسبب موت الخلايا المبرمج للخلايا الجذعية العصبية ، مما يقلل من تكاثر الخلايا الجذعية العصبية معدل البقاء. يتم تسجيل تنشيط تكوين الخلايا العصبية بالفعل في المراحل الأولى من مرض الزهايمر ، عندما لا يوجد حتى الآن تنكس عصبي واضح وخرف. يبدو أن تكوين الخلايا العصبية ضد مرض الزهايمر يلعب أيضًا وظيفة تكيفية. في معظم النماذج الحيوانية من AD (الفئران المعدلة وراثيا مع استقلاب بيتا أميلويد) والمواد بعد الوفاة من مرضى AD ، تم تسجيل زيادة في عدد الخلايا إيجابية BrdU. ومع ذلك ، هناك دليل على عدم وجود تغييرات في تكوين الخلايا العصبية في بعض النماذج الحيوانية لمرض AD وما بعد الوفاة لبعض المرضى المصابين بمرض الزهايمر. أخيرًا ، يبقى السؤال مفتوحًا حول قدرة الخلايا المشكلة حديثًا على استبدال الخلايا العصبية التي ماتت في م.
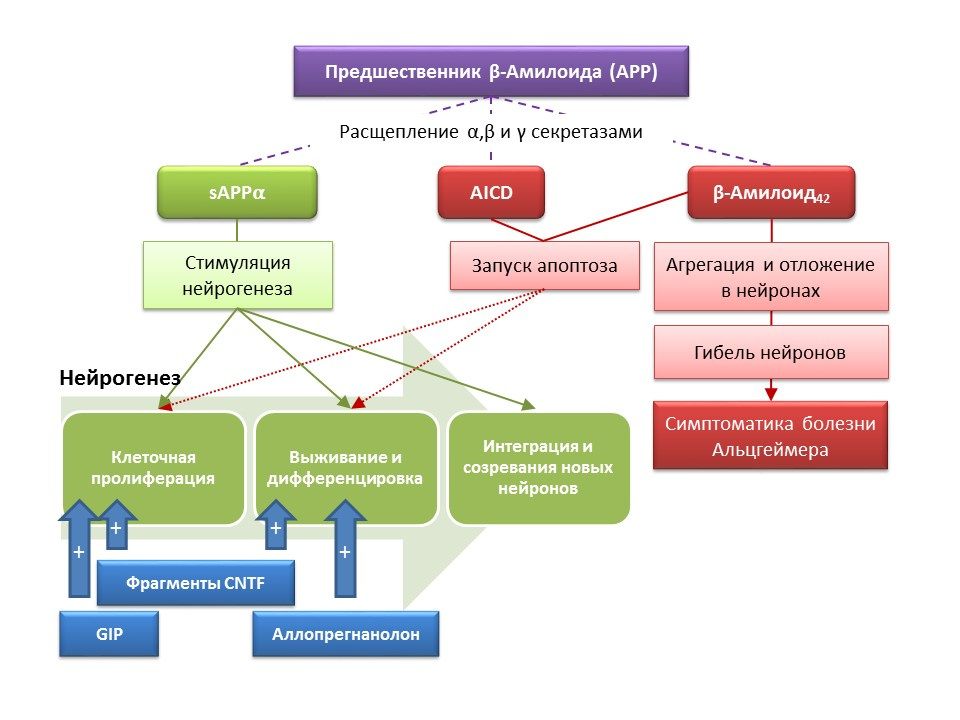 دوى: 10.3233 / JAD-2011-110914دوى: 10.1016 / j.ejphar.2011.11.007دوى: 10.1371 / journal.pone.0024293
دوى: 10.3233 / JAD-2011-110914دوى: 10.1016 / j.ejphar.2011.11.007دوى: 10.1371 / journal.pone.0024293أثبتت الدراسات التجريبية على الأساليب الجديدة للتصحيح الدوائي لمرض الزهايمر قدرة عدد من المواد على تحفيز تكوين الخلايا العصبية في الفئران المعدلة وراثيًا (في الفئران ، التمثيل الغذائي الطبيعي لبيتا أميلويد هو نموذج حيواني لمرض الزهايمر) بالاشتراك مع التفاعلات السلوكية المحسنة (رد فعل بحثي توجيهي ، التعلم و الذاكرة):
- حفز إدخال أجزاء وظيفية من الببتيدات العصبية الهدبية CNTF 6 و 6 A تكوين خلايا جذعية جديدة وبقاء الخلايا العصبية التي تم تكوينها حديثًا في المنطقة تحت البطينية ، التلفيف المسنن للحُصين والمصابيح الشمية (Rockenstein E ، Ubhi K ، Doppler E ، et al. مقارنة إقليمية للتأثيرات العصبية من الببتيدات المشتقة CNTF و cerebrolysin في الفئران المعدلة وراثيا AβPP J Dis Alzheimers Dis. 2011؛ 27 (4): 743-52)
- أدى إعطاء الببتيد الأنسولين المعتمد على الجلوكوز (GIF) مع خصائص عامل النمو إلى زيادة تكاثر الخلايا الجذعية العصبية في التلفيف المسنن في الحُصين (Faivre E ، Hamilton A ، Hölscher C. تأثيرات الإدارة الحادة والمزمنة لـ GIP المقارن على الإدراك ، اللدونة المشبكية والتكوين العصبي في الفئران. Eur J Pharmacol.2012؛ 674 (2-3): 294-306)
- ساهم الإعطاء المزمن وشبه المزمن للستيرويد العصبي Allopregnanolone في بقاء الخلايا العصبية المشكلة حديثًا (Chen S ، Wang JM ، Irwin RW ، et al. يعزز Allopregnanolone التجديد ويقلل من عبء β-amyloid في نموذج ما قبل السريري لمرض الزهايمر. PLoS One.2011 ؛ 6 ( 8): e24293 ؛ سينغ سي ، ليو ل ، وانغ ج.م ، وآخرون. Neurobiol Aging.2012؛ 33 (8): 1493-506)
تشير النتائج إلى احتمالات استخدام المواد التي تحفز تكوين الخلايا العصبية للتخفيف من أعراض مرض الزهايمر ، وكذلك للحد من معدل تطور التنكس العصبي ، والذي يمثل نهجًا جديدًا أساسيًا لتصحيح الدواء لهذا المرض.
آفاق التلاعب في تكوين الخلايا العصبية في مرض الزهايمر- لا تزال المسببات الدقيقة لمرض الزهايمر غير معروفة اليوم ، مما يجعل من الصعب العثور على أدوية جديدة تهدف إلى سبب المرض.
- البيانات التي تم الحصول عليها أثناء النمذجة الجينية لمرض الزهايمر في الحيوانات ودراسة المواد بعد الموت في الأشخاص الذين يعانون من مرض الزهايمر متناقضة.
- في الوقت نفسه ، في النماذج الحيوانية لمرض الزهايمر ، تبين أن زيادة تكوين الخلايا العصبية لوحظ بالفعل في المراحل المبكرة من المرض (قبل ضعف الوظيفة المعرفية). ويعتقد أن هذا التحسين يمكن اعتباره رد فعل وقائي تكيفي للجهاز العصبي المركزي.
- في النماذج الحيوانية لمرض الزهايمر ، تبين أن عددًا من المواد (شظايا نشطة من النيوتروتروبين الهدبي - CNTF ، الببتيد المعتمد على الجلوكوز - GIP ، و allopregnanolone) يمكن أن تحفز تكوين الخلايا العصبية وتحسين النمط السلوكي للقوارض.
- العيب الكبير لهذه التلاعبات هو حقيقة أن انتهاك تكوين الخلايا العصبية ، على ما يبدو ، ليس سبب مرض الزهايمر ، ولكن مجرد عرض. ومع ذلك ، فإن احتمالات مثل هذا العلاج قد تكون لإبطاء تطور المرض وتأخير تطور الخرف.
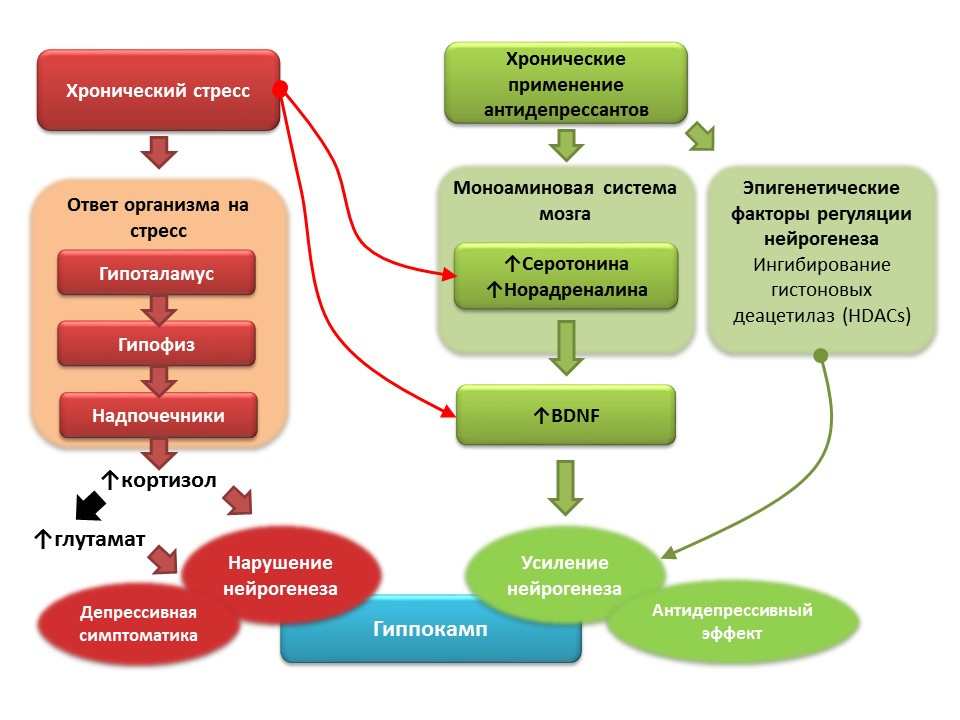 دوى: 10.1016 / j.pharma.2013.02.02.006بميد: 11124987دوى: 10.1186 / s13045-017-0499-7
دوى: 10.1016 / j.pharma.2013.02.02.006بميد: 11124987دوى: 10.1186 / s13045-017-0499-7على خلفية الاكتئاب السريري (اضطراب اكتئابي كبير) ، يتم تسجيل انخفاض في تكوين الخلايا العصبية وانخفاض في حجم الحُصين ، الذي يتم ترميمه بعد دورة من مضادات الاكتئاب. يعتقد أن الإجهاد المزمن يلعب دور عامل الزناد في التسبب في الاضطرابات الاكتئابية ، مما يؤدي إلى سلسلة من التفاعلات التي تعتمد على الإجهاد التي تؤدي إلى فرط إنتاج الكورتيزول وزيادة تركيز الغلوتامات في الجهاز العصبي المركزي. هذه العوامل تعطل مرونة الدماغ (ولا سيما تكوين الخلايا العصبية) وتساهم في تطور أعراض الاكتئاب). على العكس من ذلك ، يحفز الاستخدام المزمن لمضادات الاكتئاب تكوين الخلايا العصبية ، مما يزيد من التركيز في الجهاز العصبي المركزي للأحاديات (السيروتونين والنورادرينالين) ، وهو عامل غذائي عصبي في الدماغ. تحتوي بعض مضادات الاكتئاب أيضًا على آليات إضافية لتنظيم تكوين الخلايا العصبية. على سبيل المثال ، amitriptyline قادر على تثبيط deacetylases الهيستون ، التي تلعب دور المنظمين اللاجيني لتكوين الخلايا العصبية ، وبالتالي تحفز تكاثر الخلايا الجذعية العصبية.
آفاق التلاعب بالأعصاب في الاكتئاب- معظم مضادات الاكتئاب ، بغض النظر عن المجموعة وآلية العمل ، قادرة على تحفيز تكوين الخلايا العصبية في ظروف نمذجة الاكتئاب في النماذج الحيوانية.
- في الأشخاص المصابين بالاكتئاب ، يؤدي الاستخدام المزمن لمضادات الاكتئاب إلى استعادة حجم الحُصين ، وهو انخفاض يُلاحظ عادةً في الاضطرابات الاكتئابية.
- الآلية العامة لعمل جميع مضادات الاكتئاب هي التأثير على نظام أحادي الأمين ، على وجه الخصوص ، القدرة على زيادة تركيزات السيروتونين والنورادرينالين في الجهاز العصبي المركزي.
- وقد أظهرت العديد من الدراسات التجريبية الدور الهام للأحاديات (السيروتونين والنورادرينالين) في تنظيم تكوين الخلايا العصبية الحصينية في الدماغ البالغ.
- يبدو أن الاتجاه الواعد هو دراسة تفصيلية إضافية لآليات تنظيم تكوين الخلايا العصبية بواسطة السيروتونين والنورادرينالين ، والتي يمكن أن يساعد فهمها في تطوير وسائل أحدث للتصحيح الدوائي للاكتئاب.
- ومع ذلك ، لا يمكن لجميع مضادات الاكتئاب أن تحفز تكوين الخلايا العصبية من تلقاء نفسها ، فالبعض فقط يعيد المستوى الأولي لتكوين الخلايا العصبية ، ويقلل من الإجهاد المزمن.
- لذلك ، هناك مجال مهم آخر هو دراسة آليات مضادات الاكتئاب التي لا ترتبط بنظام أحادي الأمين. على سبيل المثال ، تأثير مضادات الاكتئاب على منظمات التولد الوراثي للتكوين العصبي.
- يتم تمثيل اتجاه منفصل من خلال تطوير المستحضرات التي تعتمد على عامل التغذية العصبية الدماغية (BDNF) وانخفاض في تأثير الغلوتامات على الجهاز العصبي المركزي (حاصرات مستقبلات NMDA الغلوتامات).
المنظورات العامة والمقاربات لدراسة تكوين الخلايا العصبية1. دراسة الآليات الجزيئية لتنظيم تكوين الخلايا العصبية في الدماغ الناضج.- ما هي الأنظمة المشاركة في تنظيم تكوين الخلايا العصبية في الدماغ البالغ وما الاضطرابات التي تؤدي إلى تثبيط تكوين الخلايا العصبية؟
- النظر في هذه الأنظمة ومكوناتها الفردية كأهداف محتملة لتصحيح المخدرات من تكوين الخلايا العصبية.
- البحث عن "صيغ" جديدة للأدوية التي يمكن أن تنظم عمليات تكوين الخلايا العصبية في الدماغ البالغ.
2. يجب أن يجيب البحث الإضافي على السؤال: إلى أي مدى يمكن للخلايا العصبية المشكلة حديثًا أن تحل محل الجهاز العصبي المركزي المفقود أثناء علم أمراض معين؟3. من الضروري تقييم النتائج المحتملة للتحفيز الخارجي طويل الأمد لتكوين الخلايا العصبية لدى البالغين.4. من الضروري تطوير إستراتيجية شاملة لتصحيح اضطرابات تكوين الخلايا العصبية تأخذ في الاعتبار جميع العوامل الرئيسية:- الحاجة إلى تكوين الأوعية
- تكوين الخلايا العصبية نفسها
- التوليف
- إعادة عرض المحور المحوري
- خلق ظروف خارجية مواتية