يختلف الورم الخبيث عن أنواع أخرى من الأورام والأمراض في أن خلاياه تشبه الخلايا السليمة في الجسم. لذلك ، يواجه العلماء مهمة صعبة: التمييز بين الخلايا وتدمير الخلايا المصابة فقط. طوال القصة ، كان لدى الأطباء أفكار مختلفة حول كيفية القيام بذلك. سيتحدث
الأطلس اليوم عن كيفية تطور علم الأورام وكيف يتم علاج السرطان اليوم.
 الرسوم التوضيحية: مايكل كوالسكي
الرسوم التوضيحية: مايكل كوالسكينظرية الخلط أبقراط
حتى القرن الثامن عشر ، كان من الصعب دراسة أمراض الأورام: لم يتم اختراع المعدات المناسبة حتى الآن ، ونعت الكنيسة تشريح الجثة ، وأدى الطاعون والجدري إلى مقتل المزيد من الأشخاص وجذب الانتباه. لذلك ، منذ العصور القديمة ، وصلنا عدد قليل من السجلات للأورام الخبيثة ، ولكن مع ذلك.

تم العثور على أول ذكر للسرطان في ورق البردي من إدوين سميث - النص الطبي لمصر القديمة ، والذي يعود تاريخه إلى القرن السادس عشر قبل الميلاد. يمكن النظر إلى هذه
البردي وقراءتها. تصف القضية رقم 45 الأورام الخبيثة. وتلاحظ أيضًا أنه لا توجد طريقة علاج.
كان أبقراط (400 قبل الميلاد) أول من ميز بين الأورام الحميدة والخبيثة. كان يعتقد أن جسم الإنسان يحتوي على أربعة من الفكاهة أو السوائل - الدم والمخاط والأصفر والأسود - وأي خلل يؤدي إلى المرض. كان يعتقد أن سبب الأورام الخبيثة هو تراكم الصفراء في مكان معين. أشار أبقراط إلى أنه بدون علاج ، يمكن للمرضى أن يعيشوا لفترة أطول: انتشرت الصفراء السوداء بالفعل في جميع أنحاء الجسم ولا يمكن إزالتها.
بالطبع ، لا يوجد الصفراء في جسم الإنسان ، ولكن فكرة انتشار الورم في جميع أنحاء الجسم كانت صحيحة. تنفصل الخلايا الخبيثة في نهاية المطاف عن الورم وتعطي النقائل.
استخدم الأطباء والمعالجون النظرية الخلطية لأكثر من 1300 سنة. خلال هذه الفترة ، تم حظر تشريح الجثث لأسباب دينية ، مما حد من دراسة الأورام. العلاجات المتوفرة في العصور القديمة والعصور الوسطى كانت الجراحة ، الكى ، إراقة الدماء والطقوس.
الجراحة الأولى
الجراحة هي واحدة من أقدم فروع الطب. ومع ذلك ، في العصور الوسطى ، لم تؤد التدخلات دائمًا إلى النتائج المرجوة بسبب فقدان الدم الكبير ، وارتفاع خطر العدوى بعد الجراحة ، وغياب المطهرات.
جالينوسكتب الطبيب الروماني جالين (130-200 سنة بعد الميلاد) عن العلاج الجراحي لسرطان الثدي في مرحلة مبكرة ، لكنه لم يعتبر هذه الطريقة فعالة في علاج الأورام الكبيرة و "المخفية". تمسك بالنظرية الخلطية واقترح أنه لا يمكن إزالة الصفراء السوداء بالكامل من الجسم. أنقذ هذا النهج حياة العديد من الناس: في العصور الوسطى ، مات المرضى غالبًا أثناء الجراحة أو بسبب مضاعفات بعده.
إلغاء النظرية الخلطيةبعد رفع الحظر عن تشريح الجثة في القرن السادس عشر ، جمع أندرياس فيزاليوس أول دليل تشريحي لجسم الإنسان ، وبعد قرن وصف ماثيو بيلي بنية الأمراض المختلفة. كان لا بد من مراجعة النظرية الخلطية ، حيث لم يجد العلماء أي الصفراء السوداء.

في القرن السابع عشر ، بدأت الطرق الجراحية لإزالة الأورام في التطور. قام الجراح الألماني فيلهلم فابري خلال عملية لإزالة سرطان الثدي باستئصال ورم مع تضخم الغدد الليمفاوية ، وقام الجراح الهولندي أدريان هيلفيتيوس بإجراء استئصال الثدي ، وإزالة الثدي بالكامل. بعد بضع سنوات ، كتب عن إحدى الحالات: "منذ ذلك الحين ، تعافى المريض تمامًا. توقفت الآلام تمامًا ، وتلتئمت الندبات ، وتتمتع بالحالة الصحية نفسها التي كانت عليها قبل السرطان.
اكتشف العالم الألماني رودولف فيرشو في خمسينيات القرن التاسع عشر انقسام الخلايا غير المنضبط في الأورام. أطلق على هذه الظاهرة الأورام ، وأصبح عمله الرئيسي ، علم الأمراض الخلوية ، الأساس لفهم أسباب السرطان.
التخدير والمطهرفي عام 1846 ، تم اختراع التخدير. هذا حل مشكلة الألم ، حيث كان من قبل أن يخضع الناس لعملية جراحية في أذهانهم. وفي عام 1867 ، اكتشف الطبيب الفرنسي جوزيف ليستر أن مرهم حمض الكربوليك يعمل كمطهر ويساعد على التئام الجروح بعد الجراحة.
لقد وسع التخدير والمطهر الأول من إمكانيات الجراحة ، وبدأت العمليات الجراحية في كل مكان. ومع ذلك ، في بعض الحالات ، عاودت الأورام الظهور. ثم بدأ الجراحون في توسيع حجم التدخلات ، مما أدى في النهاية إلى ظهور طريقة جراحية جذرية.
جراحة جذريةاعتقد الجراح وليام هالستيد أنه كلما تمت إزالة المزيد من الأنسجة أثناء الجراحة ، قل احتمال انتكاسها. الاستنتاج ليس صحيحًا تمامًا ، حيث يمكن أن تنتشر الخلايا الخبيثة في جميع أنحاء الجسم وتنتقل إلى الأنسجة الأخرى قبل الجراحة.

فقط في السبعينيات من القرن الماضي خلال التجارب السريرية ، ثبت أن العمليات الأقل انتشارًا فعالة مثل العمليات الجذرية. لسوء الحظ ، بحلول هذا الوقت ، اكتسب استئصال الثدي الجذري شعبية كبيرة واعتبر تقريبًا الطريقة الحقيقية الوحيدة لعلاج سرطان الثدي.
الحداثةفي التسعينات ، قلل الجراحون من التدخلات في الأنسجة البشرية السليمة. اليوم ، تنقسم العمليات إلى نوعين: مفتوح وبأقل تدخل جراحي. للجراحة المفتوحة ، يقوم الطبيب بعمل شق كبير لإزالة الورم ، والأنسجة غير الصحية ، وربما الغدد الليمفاوية.
لإجراء عملية طفيفة التوغل ، يقوم الطبيب بعمل عدة شقوق صغيرة ، ويجد الورم باستخدام أنبوب رفيع مع كاميرا (منظار البطن) ، ويزيل الورم من خلال شق آخر باستخدام الأدوات. بعد هذه العملية ، يتعافى المريض بشكل أسرع.
العلاج الإشعاعي
في نهاية القرن التاسع عشر ، لفت العلماء الانتباه إلى قدرة الأشعة السينية على قتل الخلايا الخبيثة. ثم لم يكن لدى أي شخص فكرة عن كيفية تأثير الإشعاع المدمر على الأنسجة السليمة أيضًا.
أنابيب الأشعة السينيةتم اكتشاف الأشعة السينية في عام 1895 ، بالتزامن مع تطور الجراحة الجذرية. بعد عام ، لاحظ طبيب شاب إميل جروبي كيف تم تدمير جلد وأظافر الأشخاص الذين يعملون مع مصادر الإشعاع. واقترح أن الأشعة تقتل الخلايا السرطانية أيضًا ، وكانت أول من استخدم العلاج الإشعاعي لعلاج الأورام.
اكتسبت الطريقة بسرعة شعبية: في أوروبا والولايات المتحدة فتحت عيادات جديدة تقدم العلاج الإشعاعي. كانت فعالة في الحالات التي لم يكن فيها الورم الوقت للانتشار إلى الأعضاء الأخرى.
كانت فكرة استخدام الإشعاع رائعة ، لكنها لم تأخذ في الاعتبار عيبين مهمين لأنبوب الأشعة السينية: تدفق إشعاعي غير متجانس وقوة اختراق غير كافية. يتم امتصاص معظم الجرعة بواسطة أنسجة أخرى أو مبعثرة. وبالتالي ، فإن الأشعة السينية تزيد من عدد الطفرات في الخلايا السليمة ، مما يؤدي إلى تكوين أورام جديدة. لا يمكن اعتبار هذا الخيار علاجًا مناسبًا.
الراديومفي عام 1902 ، اكتشف العلماء بيير وماري كوري الخصائص المشعة للراديوم. للوهلة الأولى ، اخترقت هذه المادة أعمق من الأشعة السينية ووفرت المزيد من الفرص للعلاج. على مدى السنوات العشر التي تلت اكتشاف الراديوم ، أصيب العديد من الأطباء والعلماء الذين ليسوا على دراية بمخاطر التعرض لأمراض خبيثة مختلفة. استمر هذا حتى ظهرت الجرعات والمعايير الأولى لقياس الإشعاع المشع.
مسرع الإلكترون والكوبالت المشعفي عام 1940 ، قام دونالد كيرست بتجميع بيتاترون ، مسرع إلكترون دوري. يقوم الجهاز بإصدار جسيمات ذات طاقة عالية وقدرة اختراق ، لذلك عند استخدامه يكون هناك عدد قليل من الأشعة المتناثرة. في عام 1951 ، قام جراح الأعصاب السويدي لارس ليكسيل بتطوير سكين غاما. لديها العديد من مصادر إشعاع الكوبالت المشع وتعطي شعاعًا موحدًا للطاقة العالية. يتم استخدام Betatron وسكين غاما بنجاح لعلاج الأورام اليوم.

الإشعاع يدمر الحمض النووي للخلايا بشكل مباشر أو غير مباشر. في الحالة الثانية ، يتحول الماء الموجود في الخلايا إلى جذور حرة - جسيمات مشحونة تتلف الحمض النووي. الإشعاع لا يفهم الخلايا التي يجب تدميرها ، صحية أو خبيثة ، لذلك ، تتطلب الأجهزة ضبطًا دقيقًا بحيث تقع ذروة الجرعة عند العمق المطلوب.
الحداثةاليوم ، يستخدم علم الأورام الأشعة السينية وأشعة جاما والجسيمات المشحونة. يمكنهم دخول الجسم والعمل على الخلايا الخبيثة من خلال جهاز خاص أو يأتون من مادة مشعة توضع في جسم المريض بجوار الورم (العلاج الإشعاعي الموضعي).
هناك أيضًا نوع ثالث من العلاج الإشعاعي - نظامي. يتم حقن المريض بسائل مشع ، مثل اليود ، الذي يعثر على خلايا الورم ويقتلها. ولكن في هذه الحالة ، من الصعب مراعاة الكمية الدقيقة للنظير الذي يمتصه الجسم ، ويمكن أن تكون الجرعة ضارة.
العلاج الكيميائي
تم استخدام الجراحة والعلاج الإشعاعي لعلاج الأورام الصلبة التي لا تتطور من خلايا نظام المكونة للدم. لا أحد يعرف كيف يعالج سرطان الغدد الليمفاوية وسرطان الدم.
غاز الخردلنشأت فكرة استخدام مواد سامة لعلاج هذه الأمراض بعد الحرب العالمية الأولى. في ذلك الوقت ، تم استخدام غاز الخردل وغاز الخردل كسلاح كيميائي. أحرق الجلد والأغشية المخاطية ، وقتل أيضا خلايا الدم البيضاء: كانت غائبة عمليا في الجرحى.
تساءل العلماء عما إذا كان غاز الخردل قادرًا على علاج سرطان الغدد الليمفاوية ، وهو ورم في الأنسجة اللمفاوية. مع هذا المرض ، تقوم الخلايا الليمفاوية بتقسيم وتعطيل عمل الغدد الليمفاوية والأعضاء الأخرى بشكل لا يمكن السيطرة عليه ، لذلك يبدو أن الحد من الخلايا الليمفاوية هو القرار الصحيح. في عام 1942 ، بعد دراسات على الحيوانات ، تم إعطاء مريض مصاب بالورم اللمفاوي عن طريق الوريد 10 جرعات من غاز الخردل. انخفض عدد الخلايا الليمفاوية بسرعة ، وانخفض الورم ، لكنه بدأ في النمو مرة أخرى في وقت لاحق. هذا يعني أن العلاج نجح ، لكن الجرعة لم تكن كافية للتعافي بالكامل.
حدثت مغفرة بسبب إدراج غاز الخردل في مجموعة عوامل الألكلة التي تدمر الحمض النووي للخلايا وتمنعها من الانقسام. ولكن بعد ذلك ما زالوا لا يعرفون أي شيء.
 سلائف الميثوتريكسات
سلائف الميثوتريكساتفي عام 1947 ، أظهر الطبيب سيدني فاربر أن أحد مشتقات حمض الفوليك ، أميثوبتيرين ، يمنع تطور سرطان الدم الحاد لدى الأطفال ، والذي يتميز بالانقسام غير المنضبط لخلايا الدم البيضاء. كان هذا الدواء مقدمة الميثوتريكسيت ، الذي لا يزال يستخدم حتى اليوم.
كانت نتائج خزعة نخاع العظام للمرضى بعد مسار العلاج بالأميثوبترين طبيعية. أطال العلاج الكيميائي حياة الأطفال حتى 6 أشهر ، ولكن بعد ذلك عاد المرض. ألقى فاربر كل قوته في العثور على علاج يمكن أن يشفي بالكامل من سرطان الدم. ثم كان من الصعب افتراض أنه كان من الضروري استخدام العديد من المواد السامة في وقت واحد ، وليس واحدًا.
في عام 1950 ، قامت جيرترود إليون بتطوير عقار 6-mercapturine (6-MP) ، والذي حصل بسرعة على الموافقة على استخدامه لدى الأطفال المصابين بسرطان الدم. بعده ، لاحظ الأطباء مرة أخرى مغفرة قصيرة.
الجمع بين العلاج الكيميائيفي وقت لاحق ، أجريت تجارب سريرية عشوائية ، أصبح من الواضح خلالها أن استخدام عقارين بدلاً من أحدهما يطيل المغفرة ويحسن التكهن.
في عام 1956 ، أكد الدكتور مين تشيو لي سريريًا أن توليفة من أربعة أدوية عالجت سرطانة المشيمية النقيلي عند النساء الحوامل. اعتبر المعهد الوطني للأورام في البداية هذه الإجراءات بمثابة علاج عدواني وغير ضروري للمرضى ، وتم إيقاف العالم عن العمل. فقط في وقت لاحق أصبح من الواضح أن النساء فقط اللواتي خضعن لكامل العلاج لي قد نجا. كان هذا أول علاج كامل للعلاج الكيميائي.
العلاج الكيميائي المساعدفي الستينيات والسبعينيات ، حاول العلماء استخدام العلاج الكيميائي كعلاج إضافي لسرطان الثدي بعد الجراحة. كان الجراحون مترددين في إجراء التجارب السريرية: لم يرغب أحد في التعامل مع الآثار الجانبية الإضافية في المرضى. لكنهم كانوا مخطئين.
في الواقع ، أي ورم هو مرض جهازي. تنتشر الخلايا الخبيثة في جميع أنحاء الجسم حتى في المراحل المبكرة على شكل انحرافات دقيقة. تبقى في الجسم حتى بعد إزالة الورم ، لذا فإن طرق العلاج المحلية ليست كافية. من الضروري التأثير بشكل منهجي على المرض بمساعدة العلاج بالعقاقير. على سبيل المثال ، يمكن أن يقلل العلاج المساعد (العلاج الكيميائي بعد الجراحة) من خطر الانتكاس والوفاة.
أظهرت العديد من الدراسات فائدة العلاج الكيميائي المساعد في علاج سرطان الثدي وسرطان القولون والمستقيم. أيضا في عام 1974 ، ثبت تأثير إيجابي في حالة سرطان الخصية النقيلي ، واستخدم العلاج الكيميائي لعلاج الأورام الصلبة.
تتوقف أدوية العلاج الكيميائي وتبطئ انقسام الخلايا. أثناء العلاج ، تموت الخلايا التي تنقسم بسرعة. هذه ليست خلايا خبيثة فقط ، ولكنها أيضًا صحية ، مما يؤدي إلى آثار جانبية: تساقط الشعر والغثيان وقابلية الإصابة بالعدوى.
العلاج المناعي
العلاج المناعي هو نوع جديد نسبيًا من علاج السرطان. يعتمد على استخدام الأدوية التي تدرب الخلايا المناعية للمريض. وقد تم ذلك بفضل اكتشاف بنية الحمض النووي ، ودراسة خصائص الخلايا الخبيثة وخلايا الجهاز المناعي.
لقاح القولونفي عام 1891 ، لاحظ وليام كولي أن مرضى السرطان الذين يعانون من الحمى القرمزية أو مرض الحمرة لديهم مغفرة. بعد ذلك ، بدأ بإعطاء بكتيريا المكورات العقدية للمرضى المصابين بالسرطان المتقدم. انخفض الورم ، لكن المرضى ماتوا بسبب العدوى. ثم قامت Kolya بتسخين اللقاح وقدمت للمكورات العقدية الميتة.
كانت النتيجة في ذلك الوقت مثيرة للإعجاب: تعافى المرضى وعاشوا لعدة سنوات. ومع ذلك ، فإن لقاح Kolya ليس واسع الانتشار. لم يستطع العلماء تفسير آلية عمل البكتيريا على الورم ، وخطر الإصابة بالعدوى مرتفع. كان الجميع مهتمين أكثر بالعلاج الكيميائي والعلاج الإشعاعي.
في عام 1976 ، تم استخدام لقاح BCG ، الذي تم استخدامه للوقاية من مرض السل ، بنجاح لعلاج سرطان المثانة. ينشط الجهاز المناعي ويساعد الجسم على محاربة هذا النوع من السرطان.
الأجسام المضادة وحيدة النسيلةفي عام 1975 ، نشر جورج كولر وسيزار ميلستين مقالًا حول طريقة إنتاج خلية هجينة لخلية ورمية وخلايا لمفاوية. تسمح تقنية الورم الهجين للمرء باكتشاف المستضدات المميزة لأورام أنسجة معينة ، والحصول على أجسام مضادة لها واستخدامها لتشخيص الأورام وكتابتها. تسمى هذه الأجسام المضادة أحادية النسيلة: يتم إنتاجها عن طريق الخلايا المستنسخة المناعية التي تأتي من نفس الخلية الأم.
وتصف أنواع أخرى من الأجسام المضادة الخلايا السرطانية لتسهيل اكتشاف الجهاز المناعي وتدميره.
في أواخر التسعينات ، وافقت إدارة الأغذية والأدوية FDA على أول الأجسام المضادة العلاجية أحادية النسيلة ، ريتوكسيماب و trastuzumab. الأول لعلاج سرطان الغدد الليمفاوية ، والثاني لسرطان الثدي.
في عام 2010 ، أعلن ستيفن روزنبرغ عن نجاح العلاج بمستقبلات المستضدات الخيميرية. وهو يقوم على تعديل جيني لخلايا T الخاصة بالمريض لعلاج الورم الخبيث.
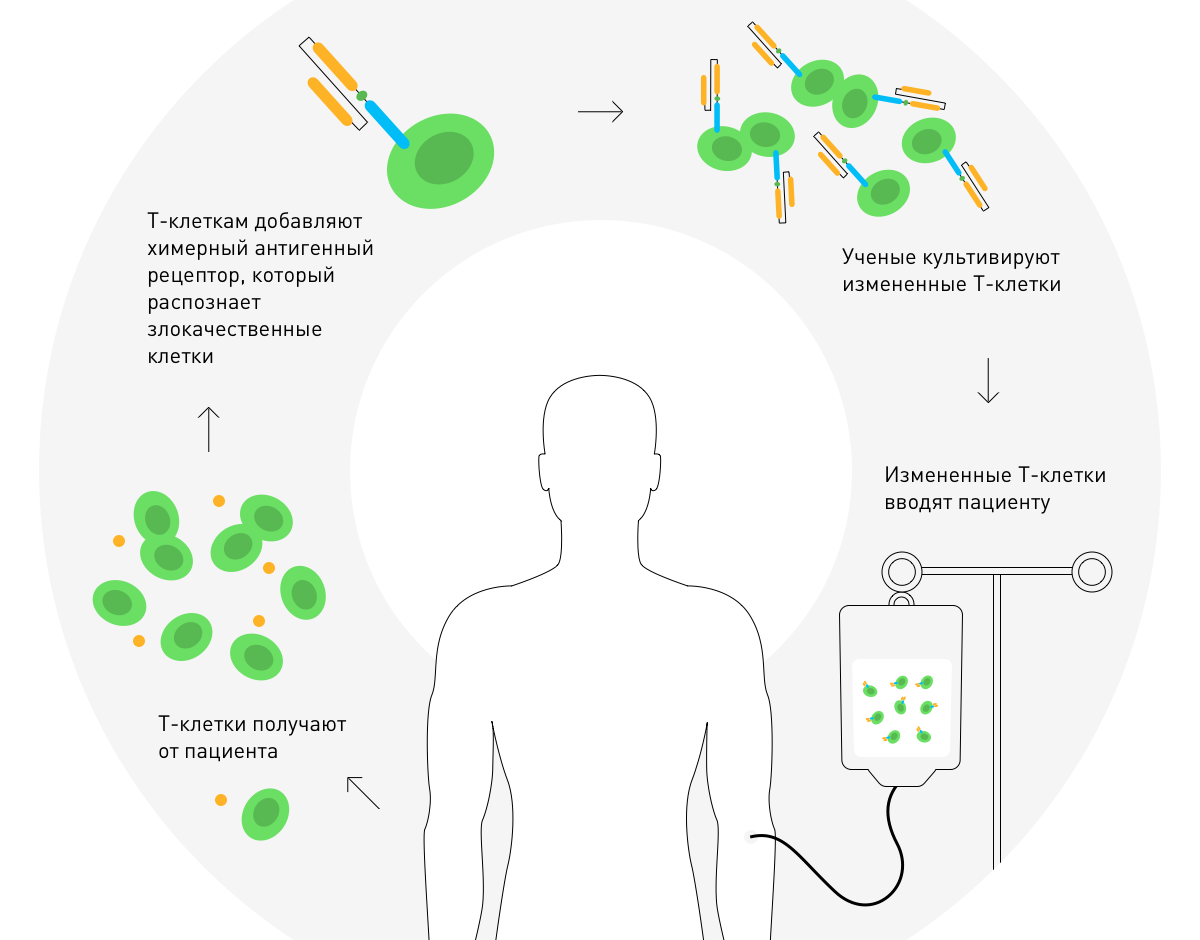 السيتوكينات
السيتوكيناتطريقة أخرى للعلاج المناعي هي إدخال عضلة أو وريد السيتوكينات ، وهي بروتينات نشطة بيولوجيًا تنظم الاستجابة المناعية. يساعد Interleukin-2 خلايا الجهاز المناعي على الانقسام بشكل أسرع ، والإنترفيرون - لمحاربة الالتهابات الفيروسية والأورام الخبيثة.
نقاط التحكمهناك مجال آخر واعد هو التأثير على نقاط التحكم المناعي ، التي تقمع استجابة الجهاز المناعي. لقد تعلم العلماء منع نقاط التحكم في الخلايا التائية ، مما يساعد الجهاز المناعي على التعرف على الخلايا الخبيثة ومهاجمتها. تمت الموافقة بالفعل على هذه الطريقة من قبل إدارة الغذاء والدواء الأمريكية لعلاج السرطان.
يمكن اختيار العلاج الأمثل باستخدام التشخيص الجزيئي. يقوم العلماء بفحص المادة الجراحية أو الخزعة للمريض لتحديد الطفرات في جينات الأورام الجينية والمثبطات. مجموعة الطفرات فردية لكل ورم ، لذلك يجب تخصيص العلاج. في المرة القادمة ، سيتحدث
الأطلس بالتفصيل عن التشخيص الجزيئي.