من خلال هذه المراجعة ، نبدأ سلسلة من المقالات التي تصف المؤشرات الحيوية المحتملة للوحة تشخيص الشيخوخة SENS.
اقترح عالم الشيخوخة البريطاني أوبري دي جراي مفهوم SENS (إستراتيجيات الشيخوخة الضئيلة المهندسة ، وهي استراتيجية لتحقيق الشيخوخة التي لا يعتد بها بالطرق الهندسية). فكرة هذا المفهوم هي الحاجة إلى تطوير وتطبيق تقنيات لمكافحة الشيخوخة والأمراض المرتبطة بالعمر من أجل "إصلاح" الضرر المتراكم في الجسم. الهدف من مراجعتنا للمؤشرات الحيوية المحتملة هو إنشاء لوحة تشخيص SENS للشيخوخة.
لماذا أحتاج إلى تشخيصات SENS؟
- لتمكين الشخص من التقييم الموضوعي لما يحدث لجسمه أثناء الشيخوخة من وجهة نظر SENS.
- انظر المخاطر الفردية لأنواع معينة من الأضرار المرتبطة بالشيخوخة.
- لتقييم فعالية الطرق المتجددة للتجديد. انظر كيف يعمل النشاط البدني والنظام الغذائي والروتين اليومي والمكملات الغذائية والأدوية من حيث استراتيجية لإبطاء الشيخوخة.
- قارن مع لوحات الشيخوخة التشخيصية الأخرى واستكمل تطورها.
- قدم بيانات عن تغييرات المعلمات للبحث.
- اتخذ قرارًا بشأن تمويل البحث بناءً على أكثر المخاطر إثارة وحساسية.
- ابحث عن أشخاص متشابهين في التفكير لحل المشاكل البيولوجية التي نشأت نتيجة لفهم حالة الجسم الخاصة بهم من حيث SENS.
يتضمن مفهوم SENS 7 أقسام. العنصر الأول الذي يجب أخذه بعين الاعتبار ، اخترنا اختلال الميتوكوندريا (أو MitoSENS).
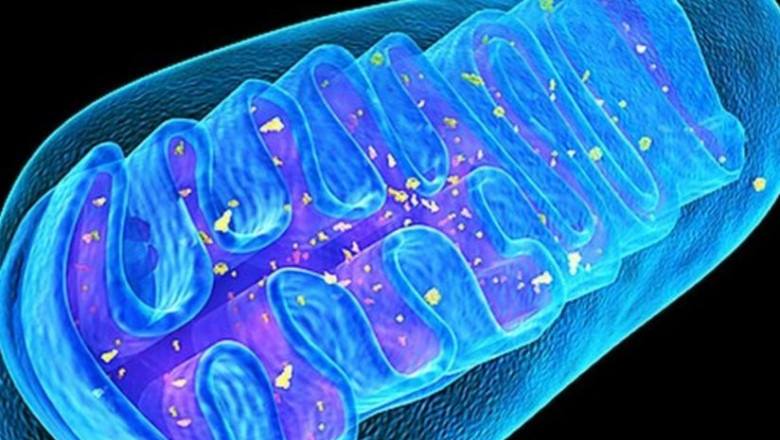
الميتوكوندريا هي عضيات صغيرة من الكائنات حقيقية النواة (باستثناء اللمبلية التي تعيش في أمعاء شينشيلا) ، والتي تولد الطاقة لجميع العمليات البيوكيميائية. وفقًا للنسخة الأكثر شيوعًا ، كانت الميتوكوندريا وحدات حياة مستقلة ذات مرة ، بكتيريا التمثيل الضوئي الأرجواني ، ولكن في عملية التطور ، تم امتصاصها بواسطة الكائنات الحية الدقيقة القديمة ، العتيقة ، وبدأت في توليد الطاقة لها. يمكن أن تحتوي كل خلية على أكثر من ألف ميتوكوندريا ، على سبيل المثال ، تحتوي خلايا عضلة القلب على ما يصل إلى 5000 ميتوكوندريا. المحركات الجزيئية ، تركيب ATP ، المدمج في الغشاء الداخلي للميتوكوندريا ، يدور ويجمع مصدر الطاقة الرئيسي ، حمض الأدينوزين ثلاثي الفوسفوريك ، ATP ، تحت تأثير تدفق البروتون. تشير التقديرات إلى أن جسم البالغ يقوم بتوليف واستهلاك حوالي 40 كجم من ATP يوميًا.
الميتوكوندريا ، على عكس العضيات الأخرى ، لها 2-10 نسخ من الحمض النووي ، mtDNA. في عملية إنتاج الطاقة ، تولد الميتوكوندريا "نفايات" سامة - أنواع الأكسجين التفاعلية (ROS) ، والتي يمكن أن تضر بالجزيئات الأخرى والهياكل الخلوية المختلفة ، وقبل كل شيء ، الميتوكوندريا نفسها ، والتي يمكن أن تسبب طفرات في الحمض النووي للميتوكوندريا وتؤثر سلبًا على إجمالي توازن الطاقة في الجسم. وهكذا ، فإن mtDNAs التي لها عمليات حذف (فقدان المواقع) قادرة على التكاثر بسرعة وملء مساحة الخلية مع نفسها ، مما يتسبب في ساركوبينيا وانتكاس عصبي. تبدأ الميتوكوندريا "التالفة" في إنتاج كميات أكبر من ROS ، مما يؤدي إلى زيادة في الإجهاد التأكسدي ، والذي بدوره يمكن أن يتسبب في تطور أمراض مختلفة ، الشيخوخة المبكرة ، وموت الخلايا.
حقيقة مثيرة للاهتمام تتعلق بالإجهاد التأكسدي. وقد وجد أن هناك علاقة واضحة بين مستوى تشبع الأحماض الدهنية في الأغشية وعمر الحيوانات: كلما زادت الأحماض غير المشبعة في الغشاء ، كان عمر الحيوان أقصر. تتبع علماء الأحياء الإسبان مثل هذا التسلسل ، وأظهروا زيادة في العمر الافتراضي مع تقليل محتوى الأحماض الدهنية docosahexaenoic ω-3 في الأغشية: الفأر → الفئران → الأرنب → الإنسان → الحوت [1].
من السهل تفسير هذا النمط ، لأن الأحماض الدهنية غير المشبعة هي "الضحايا" الرئيسيون لبيروكسيد الدهون. وهكذا ، فإن التركيبة الدهنية لأغشية الخلايا الحيوانية ، والتي تتميز بعمر أطول ، يوضح المتوسط الذهبي: كمية صغيرة من الأحماض الدهنية غير المشبعة تمامًا 22: 6 3-3 وهيمنة الأحماض الدهنية الأقل تشبعًا غير المشبعة 18:03،-3 ، والتي يخلق نفس التوازن الذي يوفر الحماية ضد تأثيرات ROS ، والحفاظ على السيولة اللازمة للغشاء.
بالإضافة إلى التكوين الدهني لأغشية الخلايا الحيوانية ، فإن نسبة الجينين والسيتوزين الأكثر استقرارًا ديناميكيًا حراريًا بين جميع مخلفات النيوكليوتيد mtDNA ترتبط أيضًا بالعمر الأقصى للأنواع للثدييات [2].
يرى مبدعو مفهوم SENS حلاً لمشكلة الخلل في الميتوكوندريا عن طريق نقل "نسخ احتياطية" من جينات الميتوكوندريا إلى النواة ، حيث لا يمكن أن تتلفها ROS الناتجة في الميتوكوندريا. وهكذا ، حتى لو تضررت الجينات الأصلية في mtDNA ، فإن النسخ الاحتياطية في DNA النووي ستكون قادرة على تزويد البروتينات اللازمة للحفاظ على إنتاج الطاقة الطبيعي. ويسمى هذا النهج التعبير الوتوبي للبروتينات. يحتوي mtDNA البشري على ما مجموعه 37 جينًا ، منها 13 فقط ترميز البروتينات اللازمة للميتوكوندريا ، والبروتينات المتبقية (أكثر من 1000) التي تنسق عمل الميتوكوندريا يتم ترميزها في الحمض النووي النووي. وفقا لمؤلفي SENS ، تم نقل جينات الميتوكوندريا الرئيسية إلى النواة عن طريق التطور تحديدا لهذا الغرض - لحمايتها من التأثير الضار لـ ROS.
تم تأكيد فكرة مؤلفي SENS حول النقل التطوري للحمض النووي الميتوكوندري إلى النووي من أجل حماية الحمض النووي الميتوكوندري من العوامل الضارة ، وبالتالي إطالة العمر ، في الدراسات المخصصة لتحليل NUMT (مقطع الحمض النووي الميتوكوندري النووي). يشير المصطلح NUMT إلى أجزاء mtDNA المنقولة إلى الحمض النووي النووي. أظهر تحليل مقارن لـ 17 نوعًا من الحيوانات مع جينومات الميتوكوندريا والنووية المتسلسلة تمامًا ارتباطًا إيجابيًا كبيرًا بين متوسط العمر المتوقع وعدد تسلسلات NUMT [3]. الآن يبقى إيجاد حل هندسي لنقل النسخ الاحتياطية من الجينات الـ 13 mtDNA المتبقية.
ولكن هناك طرق بديلة لتحسين وظيفة الميتوكوندريا. وأحدها زرع الميتوكوندريا من الخارج. تم وصف "المجموعة الفرعية" الناجحة من الميتوكوندريا الأجنبية في التجارب على الحيوانات. وهكذا ، تم استخدام نقل الميتوكوندريا في النماذج الحيوانية لتلف الرئة الحاد وأمراض القلب والأوعية الدموية ومرض باركنسون. يمكن إجراء زرع الميتوكوندريا بعدة طرق: أولاً ، الحقن المباشر للميتوكوندريا المعزولة (الحقن المحلي) ، عندما يتم حقن الميتوكوندريا المعزولة مباشرة في خلايا المنطقة المتضررة ؛ ثانيًا ، الإدارة الجهازية ، عندما يتم إدخال الميتوكوندريا في مجرى الدم العام ، ثم يتم توزيعها في جميع أنحاء الجسم. تشير النتائج التي تم الحصول عليها إلى آفاق زرع الميتوكوندريا في علاج عدد من الأمراض [4].
إلى جانب ذلك ، سيكون من المنطقي العثور على المؤشرات الحيوية المحتملة لتحديد الإجهاد التأكسدي الناجم عن الخلل في الميتوكوندريا.
الإجهاد التأكسدي هو اختلال التوازن بين المؤكسدات (أنواع الأكسجين التفاعلية) والدفاع المضاد للأكسدة في الجسم تجاه العوامل المؤكسدة. تتفاعل المؤكسدات في الخلايا بنشاط مع الجزيئات الحيوية (الدهون الفوسفاتية والبروتينات والأحماض النووية). ونتيجة لذلك ، تتلف هذه الجزيئات الحيوية بشكل لا رجعة فيه ، مما يؤدي إلى خلل وظيفي في الخلية ، ونتيجة لذلك ، أمراض مختلفة في الجسم وموت الخلية. واحدة من أكثر النظريات شيوعًا للشيخوخة ، الراديكالية الحرة التي اقترحها د. هارمان في الخمسينيات ، ترى أن هذا هو الآلية الرئيسية للشيخوخة.
يمكن أن تكون الجزيئات التي تكونت أثناء الأكسدة بمثابة مؤشرات حيوية. يستخدم تحليلهم لقياس الإجهاد التأكسدي لدى البشر. يتم تحديد تركيزات عالية من المؤشرات الحيوية الإجهاد التأكسدي ليس فقط في الأمراض المرتبطة بالعمر أو التنكسية ، مثل مرض الزهايمر أو ارتفاع ضغط الدم أو مرض السكري من النوع 2 أو عدة أنواع من السرطان ، ولكن أيضًا في مرض الانسداد الرئوي المزمن والتدخين والعيش في المناطق المحرومة بيئيًا.
واحدة من أهم المؤشرات الحيوية للإجهاد التأكسدي هي 8-iso prostaglandin F2α (8-isoprostane). 8-الأيزوبروستين يتشكل أثناء الأكسدة غير الأنزيمية للفوسفوليبيدات للأغشية الحيوية الخلوية ، وبالتحديد حمض الأراكيدونيك. هذه المادة الشبيهة بالبروستاجلاندين تسبب تضيق الأوعية الدموية والشعب الهوائية ، وتقلل من تدفق الدم في الكلى ، وتؤثر على تراكم الصفائح الدموية ، وبالتالي ، تشارك في أمراض عدة أمراض. تعتبر القيم الطبيعية لـ 8-isoprostane لدى الأشخاص الأصحاء 11 ± 4 جزء من الغرام / مل [5].
يُعرف أيضًا كمؤشر حيوي للأكسدة الدهنية هو مالونديالديهيد (MDA) ، والذي يتكون من بيروكسيد الدهون بواسطة الجذور الحرة وانهيار جزيئات الأحماض الدهنية غير المشبعة. يعمل زيادة تركيز MDA في المصل كعلامة ليس فقط للإجهاد التأكسدي ، ولكن أيضًا لدرجة التسمم الداخلي. لذلك ، لوحظ زيادة في تركيز MDA في البلازما لدى المدخنين ، وكذلك في الأشخاص الذين يتعاطون الكحول. يشكل MDA قواعد Schiff مع مجموعات أمينية من البروتين ، مما يؤدي إلى تكوين مجمعات بروتين دهني غير قابلة للذوبان (ارتداء أصباغ أو ليبوفوسين). يتم تحديد MDA في عينات من العديد من السوائل البيولوجية: المصل والبلازما والبول ومكثفات الزفير. تركيز MDA في المصل في الأشخاص الأصحاء (عادي) أقل من 1 ميكرومول / لتر [6].
أثناء أكسدة الأحماض الأمينية التي تتكون منها البروتينات ، يتم تشكيل عدد من المؤشرات الحيوية المحتملة للإجهاد التأكسدي: o-tyrosine و 3-chlorothyrosine و 3-nitrotyrosine.
من الناحية الفسيولوجية في الجسم ، يتكون التيروزين الداخلي من الأكسدة الإنزيمية لفينيل ألانين بواسطة هيدروكسيلاز فينيل ألانين. تتشكل o-tyrosine (o-Tyr) و m-tyrosine (m-Tyr) أثناء الأكسدة بواسطة الأشكال النشطة للأكسجين فينيل ألانين. o-Tyr و m-Tyr ليسوا من الأحماض الأمينية الطبيعية ويعتبرون مؤشرات حيوية للإجهاد التأكسدي. تم العثور على تركيزات عالية من o-Tyr و m-Tyr في مرضى إعتام عدسة العين ، ووجد ارتفاع o-Tyr في بلازما الدم والبول لمرضى السكري من النوع 2. 3 - الكلوروتيروزين (3-ClTyr) يتكون في عمليات الجذور الحرة أثناء تفاعل حمض هيبوكلوروس (HClO ، مشتق من بيروكسيد الهيدروجين) و p- التيروزين.
يلعب تكوين 3-ClTyr دورًا مهمًا في نظام القلب والأوعية الدموية ، حيث يرتبط بتطور تصلب الشرايين. يعزز 3-ClTyr هجرة خلايا العضلات الملساء الأبهرية البشرية (الآلية الرئيسية لتشكيل الآفات الوعائية) ، ويمكن لمستويات مرتفعة من 3-ClTyr تحت ظروف الالتهاب أن تساهم في أمراض الأوعية الدموية. 3-nitrotyrosine (3-Notyr) يتكون أثناء الإجهاد التأكسدي عن طريق نترتة التيروزين مع بروتين بلعم العدواني myeloperoxidase (MPO). تؤثر هذه النترجة سلبًا على وظيفة البروتين. تم العثور على تركيزات أعلى من 3-Notyr في السائل الدماغي الشوكي للمرضى المصابين بمرض الزهايمر (11.4 ± 5.4 نانومتر في المرضى و 1.6 ± 0.4 نانومتر في مجموعة المتطوعين الأصحاء) ، وكذلك في الأشخاص المصابين بالتهاب المفاصل وتصلب الشرايين و ارتفاع ضغط الدم [5].
أيضا ، تحت تأثير ROS و HClO على البروتينات ، يتم تشكيل منتجات مختلفة من أكسدة البروتين (AOPP). لا تؤدي هذه البروتينات وظائفها ويمكن أن تسبب ضررًا كبيرًا. يتم إنتاج AOPPs بواسطة نظام بيروكسيد الهيدروجين myeloperoxidase. تم العثور على تركيزات أعلى من AOPP في البلازما أو بول المرضى الذين يعانون من متلازمة الشريان التاجي الحادة أو التهاب القولون التقرحي النشط. تعتبر مستويات البلازما من 60-70 نانومتر مؤشرات طبيعية لـ AORP في الأشخاص الأصحاء [5].
المؤشرات الحيوية المعروفة لأكسدة الأحماض النووية هي 8-هيدروكسي جوانوزين (8-OHG) و 8-هيدروكسي-2'-ديوكسيغوانوزين (8-OHdG). 8-OHdG هو المنتج الرئيسي لأكسدة DNA. 8-OHG يتكون من أكسدة الحمض النووي الريبي. تم العثور على تركيز أعلى من 8-OHdG في المرضى الذين يعانون من مرض الزهايمر والتهاب المفاصل وتصلب الشرايين وإعتام عدسة العين وارتفاع ضغط الدم وهشاشة العظام وداء السكري من النوع 2. يعتبر 8-OHdG أيضًا علامة بيولوجية محتملة للسرطان المرتبط بالتدخين (مثل سرطان الرئة). يمكن العثور على 8-OHG في المرضى الذين يعانون من مرض الزهايمر ، وقد ثبت أن تلف RNA التأكسدي أعلى من تلف الحمض النووي. تركيزات 8-OHdG في الدم لدى الأشخاص الأصحاء هي 1.09 ± 0.52 نانومتر ، ومستويات 8-OHG (في السائل الدماغي الشوكي) هي 97 ± 32 pM [5].
هناك مؤشر حيوي آخر يحدد الخلل في الميتوكوندريا والإجهاد التأكسدي هو عدد نسخ mtDNA الخلوي (هناك أيضًا mtDNA خارج الخلية التي تدخل مجرى الدم عندما تتحلل الخلايا ويزداد مستواها مع تقدم العمر). لذا ، من المعروف أنه مع تقدم العمر ، تقل كمية الحمض النووي الميتوكوندري الخلوي لدى الرجال أكثر من النساء. يرتبط انخفاض mtDNA أيضًا بشكل كبير بتطور وهن الشيخوخة (الشيخوخة ، الهشاشة). يمكن أن يكون عدد نسخ mtDNA أيضًا علامة تنبؤية فعالة للوفيات من جميع الأسباب ، من أمراض القلب والأوعية الدموية ، والأورام ، والجهاز التنفسي [7].
إن مضادات الأكسدة الذاتية ، مثل الجلوتاثيون ، السيستين ، حمض اليوريك و ubiquinol ، لديها أيضًا القدرة على استخدام الخلل في الميتوكوندريا والإجهاد التأكسدي كمؤشرات حيوية. عند التفاعل مع أنواع الأكسجين التفاعلية ، تتأكسد مضادات الأكسدة الذاتية ، ولكن يتم استعادتها مرة أخرى باستخدام إنزيمات خاصة. لذلك ، في الجسم ، توجد الجزيئات المضادة للأكسدة في شكلين: شكل مخفض (مضاد للأكسدة) أو مؤكسد (بعد التفاعل مع المؤكسدات). باستخدام طريقة الكروماتوغرافي ، من الممكن تحديد نسبة الأشكال المضادة للأكسدة المختزلة والأكسدة وبالتالي تحديد درجة الإجهاد التأكسدي [8].
المؤشرات الحيوية لخلل الميتوكوندريا والضغط التأكسدي:
1.8-ايزوبروستين.
2. Malondialdehyde
3. O- التيروزين ، 3-كلوروثيروزين ، 3-نيتروتيروزين.
4. منتجات أكسدة البروتين (AOPP).
5.8-هيدروكسي جوانوزين (8-OHG)
6. 8-هيدروكسي -2'-ديوكسيغوانوزين (8-OHdG).
7. خلية mtDNA (عددها ووجود متغيرات متحولة مع حذف)
8. مضادات الأكسدة الذاتية (الجلوتاثيون ، السيستين ، حمض اليوريك ، يوبيكوينول).
مؤلفو المراجعة: دينيس أودينوكوف ، أليكسي رزيشيفسكي.
قائمة الأدب المستخدم:1. Pamplona، R.، Portero_Otn، M.، Ruiz، C.، Gredilla، R.، Herrero، A.، and Barja، G. (2000) يرتبط ارتباط الرابطة المزدوج للفوسفوليبيدات وبيروكسيد الدهون بشكل سلبي مع الحد الأقصى لطول العمر في قلب الثدييات ، Mech. الشيخوخة ، 112 ، 169-183.
2. ليمان G1 ، سيغال E ، Muradian KK ، فرايفيلد VE. هل يكمل الحمض النووي للميتوكوندريا ومعدل التمثيل الغذائي بعضهما البعض في تحديد طول عمر الثدييات الأقصى؟ Res تجديد شباب. 2008 أبريل 11 (2): 409-17.
3. Muradian KK1، Lehmann G، Fraifeld VE. فرضية NUMT ("الجبار الجديد") على طول العمر. Res تجديد شباب. 2010 أبريل-يونيو .13 (2-3): 152-5.
4. جوليو ، جينا ل ، سمير ب. باتيل ، وألكسندر ج. رابفسكي. استراتيجيات زرع الميتوكوندريا كعلاجات محتملة لصدمة الجهاز العصبي المركزي. أبحاث التجديد العصبي 13.2 (2018): 194.
5 - كاميلا سيسلوفا ، وأديلا بوموفا ، وميلوش ميكوسكا ، وماريك كوزما ، ودانييلا بيلكلوفا ، وبتر كايسر. الفحص متعدد العلامات للإجهاد التأكسدي في الشيخوخة. الأكسدة Med Cell Longev. 2014؛ 562860. نشرت على الإنترنت 2014 Jul 16.
6. Yashin A. ، Yashin Y. كروماتوغرافيا سائلة عالية الأداء لعلامات الإجهاد التأكسدي. 2011. تحليلات. رقم 1 ، 34-43.
7. Foram N. et al. ارتباط مستويات الحمض النووي للميتوكوندريا مع حالات الوفاة لكل حالة. J Mol Med (Berl). 2015 فبراير ؛ 93 (2): 177-186.
8. Goon A.A. Subbotina T.F. ، Alekseevskaya E.S. ، Moiseeva O.M. ، Gavrilyuk N.D. ، Irtyuga O.B. علامات التمثيل الغذائي والبروتينات للخلل في الميتوكوندريا في مرضى القلب والأوعية الدموية التشخيص المختبري السريري. 2015 ؛ 60 (7): 35-41.