تلعب البروتينات دورًا حاسمًا في جميع الكائنات الحية ، حيث تؤدي العديد من الوظائف المختلفة. كما تعلم ، فهي تتكون من الأحماض الأمينية. من أجل أداء وظائفها ، يجب ألا تكون البروتينات مجرد سلسلة من بعض الأحماض الأمينية ، ولكن لها شكل مكاني معين ، مناسب بشكل صحيح في الفضاء. لأسباب مختلفة ، قد يحدث خلل في الطي الطبيعي للبروتين في الهيكل المطلوب. ثم بدلاً من البروتينات المطوية بشكل غير صحيح ، والتي تميل إلى التوحد في العناقيد ، تكون كتل البروتين عبارة عن ألياف أمييلية. أشهر هذه الركام هو β-amyloid (Aβ ، Abeta) ، والذي يفترض أنه مرتبط بتطور أمراض الأعصاب ، بالإضافة إلى بعض أنواع السرطان وأحد أسباب الخرف لدى الأشخاص الذين يعانون من متلازمة داون.
يبلغ قطر هذه الهياكل البروتينية حوالي 5-10 نانومتر وطول يصل إلى 800 نانومتر ، وتتكون من خيوط متعددة الاتجاهات متوازية أو أكثر تشكل بنية محددة - التشكل عبر الطيات بيتا. هذه البنية هي التي تحدد الخاصية البصرية المحددة لأميلويد - القدرة على الانكسار الثنائي. واكتشاف هذه الخاصية هو الأساس لتشخيص داء النشواني. الفحص المجهري للبقع باستخدام مستحضرات صبغ أحمر الكونغو في صورة أميلويد خفيفة مستقطبة يغير اللون الأحمر إلى توهج أخضر [1].
يطلق على مؤلفي مفهوم SENS "الحطام خارج الخلية" (مركزة الخردة خارج الخلية) مركمات البروتينات غير الطبيعية ويحددون أحد أسباب الشيخوخة ، والتي تبدو عادلة تمامًا. ألياف الأميلويد ، بسبب تركيبها ، لا تخضع لعمل إنزيمات خاصة تكسر البروتينات (البروتياز) ، وبالتالي لها خاصية التراكم في أنسجة الجسم ، مما يعطل عملهم. تعتمد الخصائص الهيكلية والكيميائية الفيزيائية للنشواني على بروتين السلائف الرئيسي ، والذي يبلغ محتواه في الألياف حوالي 80 ٪ ، وهذا يحدد سمة معينة لكل نوع من أنواع النشواني. يشير مصطلح الداء النشواني إلى مجموعة من الأمراض الوراثية أو المكتسبة المرتبطة بالترسب خارج الخلية لألياف البروتينات غير القابلة للذوبان التي تسبب اضطرابات بنية الأنسجة واختلال الأعضاء. في الوقت الحالي ، يُعرف أكثر من 20 بروتينًا من السلائف النشوانية ونفس العدد من المتغيرات السريرية للداء النشواني. بالإضافة إلى yl-amyloid المعروف ، هناك amyloid AA مرتبط بالتهاب المفاصل الروماتويدي ، وأمراض القلب ، وأمراض الكلى والتهاب الأمعاء ، و amyloid AIAPP تشارك في التسبب في مرض السكري من النوع 2 السكري ، وغيرها [2].
 β اميلويد.
β اميلويد.يرى مؤلفو SENS طريقة لحل مشكلة تراكم الركام البروتيني في استخدام الأجسام المضادة المتخصصة المحفزة النشطة ، ما يسمى بالإنزيمات (الإنزيم الإنجليزي ، إنزيم الأجسام المضادة) ، والتي يتم اختيارها خصيصًا للأميلويد وإزالتها من الأنسجة. في الآونة الأخيرة ، تم تطوير طريقة واعدة كجزء من هذا النهج. تم اكتشاف مجموعة فرعية من الأجسام المضادة البشرية التي لها نشاط تحفيزي ضد مستضد معين ، وتقسمها إلى شظايا أصغر وأقل ضررًا ، بدلاً من التقاطها لإزالتها أو تدميرها بواسطة خلايا مناعية أخرى. يوفر استخدام هذه الأجسام المضادة الحفازة الجديدة كعلاجات استهداف أميلويد مزايا محتملة على عزل الأجسام المضادة المستخدمة في لقاحات الأميلويد الأخرى. الأول هو أن تخفيض الجرعة مطلوب لإزالة الركام خارج الخلية بشكل فعال من الأنسجة. وذلك لأن الأجسام المضادة التي تم عزلها يمكن أن تلتقط ثم تنقل جزيءًا أميلويدًا واحدًا في كل مرة. بينما ترتبط الإنزيمات بجزيء الأميلويد ، قم بطحنه ثم انتقل إلى الجزيء التالي تلو الآخر ، مما يسمح لكل جزيء جسم مضاد بتدمير العديد من جزيئات الأميلويد بسرعة. آخر هو أن الأجسام المضادة الحفازة تنتمي إلى فئة يتم نقلها بشكل أكثر كفاءة من خلال حاجز الدم في الدماغ الذي يحمي دماغنا ، في حين أن الأجسام المضادة المتسلسلة تكون أكثر صعوبة في التغلب على هذا الحاجز [3].
أشهر نشوئ النشواني والأكثر دراسته اليوم هو β-amyloid ، والذي ينسبه العديد من الباحثين إلى مرض الزهايمر. تم وصف هذا المرض قبل أكثر من قرن من قبل أ. الزهايمر ، الذي كان أول من أشار إلى الأعراض المرضية الرئيسية لهذا المرض - لويحات الشيخوخة غير القابلة للذوبان الموجودة في دماغ الموتى الذين يعانون من هذا المرض. يوجد اليوم في العالم أكثر من 40 مليون شخص مصابون بمرض الزهايمر - يتضاعف احتمال تطوير هذا المرض كل خمس سنوات بعد 65 عامًا. وتقديرات منظمة الصحة العالمية طويلة الأجل بشأن الزيادة الهائلة في هؤلاء المرضى في العقود القادمة متشائمة للغاية.
من المعروف أن اللويحات غير القابلة للذوبان في دماغ المرضى تتكون بشكل رئيسي من ببتيد β-amyloid (Aβ) ، الذي يبلغ وزنه الجزيئي 4 كيلو دالتون وطول حوالي 40 بقايا الأحماض الأمينية. Aβ هو جزء من بروتين غشاء بروتين السلائف الأميلويد (بروتين السلائف الأميلويد ، APP) ، والذي يوجد في العديد من أنسجة الجسم ، بما في ذلك في المشابك العصبية. يشارك APP في بعض العمليات الفسيولوجية المرتبطة بالمرونة العصبية ، وتشكيل المشابك ، والحماية العصبية (بقاء الخلايا العصبية) [4].
على عكس سابقتها ، Aβ سامة للخلايا العصبية ، مما يساهم في انحطاطها وموتها. يتم تشكيلها عن طريق فصل المجال خارج الخلية N (sAPP) من بروتين السلائف. يمكن تنفيذ هذه العملية من خلال سرازين مختلفين - α-secretase و β-secretase ، اللذان لهما فرق أساسي في عملهما. في الحالة الأولى ، يحدث التجزؤ بين بقايا الأحماض الأمينية ضمن تسلسل Aβ ، مما يمنع التكوين اللاحق لببتيد الأميلويد. ثانيًا ، المرضية ، تحت تأثير secret-secretase ، تنتهي عملية التجزئة بسبب ميزاتها في تكوين Aβ. هذا المسار الثاني المرتبط بتطور أمراض الأعصاب أكثر ندرة ، ولماذا لا يزال تفتيت بروتين السلائف يتبعه غير واضح تمامًا [5].
 β- إفراز.
β- إفراز.ترتبط السمية العصبية لـ Aβ بانتهاك استتباب الكالسيوم ، والسمية الإثارة ، والعمليات الالتهابية ، وتحفيز الإجهاد التأكسدي وموت الخلايا المبرمج. كان الرأي السائد هو أن تراكم Aβ في الدماغ هو عملية مرضية بحتة بسبب استحالة إزالة Aβ من أنسجة المخ. من المعروف اليوم أنه مع ذلك يمكن التخلص من Aβ من الدماغ بطريقتين على الأقل: حول الأوعية الدموية (من خلال اللمف) والتحلل البروتيني (الانقسام بواسطة إنزيمات مختلفة) [6 ، 7]. لذلك ، يمكن أن يرتبط تكوين الشيخوخة بمرض الزهايمر مع التراكم المصاحب لألياف الأميلويد غير القابلة للذوبان مع عوامل تحفيز مختلفة. والتي قد تكون ذات طبيعة وراثية ومرتبطة بالضغط ونقص الأكسجة ونقص التروية والسكتات الدماغية السابقة [8].
β-amyloid يؤكسد الكوليسترول والأحماض الدهنية المتعددة غير المشبعة ، ويشكل أكثر الأشكال سمية لأنواع الأكسجين التفاعلية - جذر الهيدروكسيل وبيروكسيد الهيدروجين. إن تسميم حمض L- الأسبارتيك في البروتينات طويلة العمر يعزز تكوين β-amyloid و α-synuclein. لوحظت تراكمات مرضية لهذا الأخير في مرض باركنسون ، ومرض الزهايمر ، ومرض ليفي وأمراض التنكس العصبي الأخرى.
من العلامات المرضية الأخرى للانحلال العصبي في مرض الزهايمر هي تجمعات بروتين تاو الفوسفوريليتيد (τ بروتين): خيوط حلزونية مزدوجة (PHF) وتشابك ليفية عصبية (NFT). من الناحية الفسيولوجية ، يشارك البروتين τ في تثبيت الأنابيب الدقيقة للخلايا العصبية ، والتي تضمن الانتقال من خلال السيتوبلازم للخلايا العصبية للعضيات الخلوية والبروتينات السكرية وغيرها من المواد. في مرض الزهايمر ، يكون البروتين τ مفرط الفسفور ، ويفقد قدرته الطبيعية على تثبيت الأنابيب الدقيقة ويتراكم في الخلية مع تراكيب عصبية غير قابلة للذوبان. ما يحدث في وقت سابق أثناء تكوين علم الأمراض - تشكيل تجمعات البروتين النشواني أو τ البروتين - ليس سؤالًا واضحًا. ولكن من الواضح أن هاتين العمليتين مترابطتان وتحفز بعضهما البعض. لذلك ، يظهر كلا البروتينين المرضيين خصائص بريون مشابهة لبروتين PrPsc Prion: أشكال مطوية بشكل غير صحيح من البروتينات حسب نوع التفاعل المتسلسل تحفز تحويل البروتينات الطبيعية إلى بروتينات غير منتظمة في الخلايا العصبية السليمة المحيطة بها. فيما بينها ، يتفاعل Aβ والبروتين also أيضًا حسب نوع البريونات: يتم وصف كيفية تنشيط Aβ لبروتين كيناز GSK3 ، فسفرة بروتين τ وتسبب في تكوينه بشكل غير صحيح [5].
 τ بروتين.
τ بروتين.في الآونة الأخيرة ، كان يعتقد أنه على الرغم من أن أمراض البريون ومرض الزهايمر لديهم بعض التشابه الكيميائي الحيوي ، فإن علم الأمراض الثاني ، على عكس الأول ، ليس معديًا ولا ينتقل من كائن إلى آخر. ولكن في عام 2015 ، ظهرت أول أخبار مزعجة. في دورية Nature ، تم نشر مقال بواسطة أطباء الأعصاب البريطانيين تحدثوا فيه عن المسار المحتمل لانتقال Aβ من شخص إلى آخر. أجرى المؤلفون دراسة تشريح لأدمغة ثمانية أشخاص ماتوا بسبب مرض كروتزفيلد جاكوب. في القتلى الستة ، بالإضافة إلى الإصابات المرتبطة بالمرض الأساسي ، تم العثور على تراكمات واسعة من الأميلويد في الدماغ. ما هو غير معهود لا لصغر سن الأموات ولا لهذا المرض. لم يتم العثور على أي عيوب مرتبطة بتكوين الأميلويد وأمراض الأعصاب في جينوماتهم. اقترح الباحثون أنه تم إدخال Aβ إلى جسم المتوفى أثناء حقن هرمون النمو المصاب بالنشواني. بالطريقة نفسها التي أصيب بها عدة مئات من الأشخاص وماتوا بسبب حقن هرمون النمو المحتوي على البريونات [9].
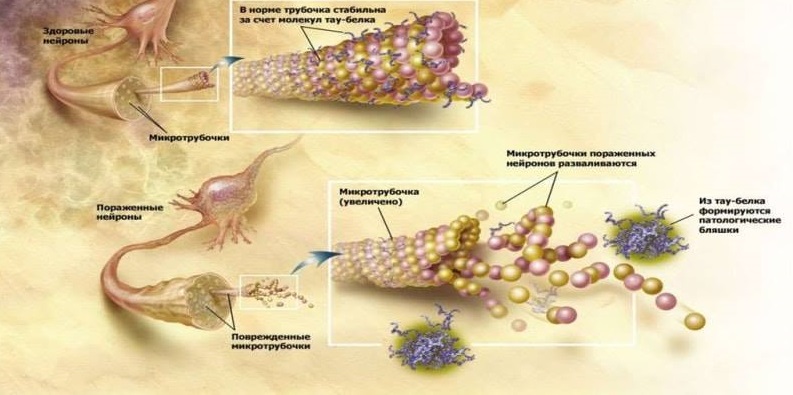 وظائف البروتين normal طبيعية ومرضية.
وظائف البروتين normal طبيعية ومرضية.يمكن أن يكون تأكيد العدوى لمرض الزهايمر دراسة أخرى تم فيها دمج الفئران المعملية ذات التكون النشواني المتزايد والفئران العادية جراحيًا مع تدفق الدم. ونتيجة لذلك ، بدأت الفئران السليمة تتراكم Aβ في الدماغ ، وهو أمر غير معتاد بالنسبة لهذه القوارض. أظهرت هذه الدراسة لأول مرة إمكانية تغلغل A blood بالدم في الدماغ والمشاركة اللاحقة في تطور التنكس العصبي [10].
تحدد العلاقة بين تراكم β أميلويد وبروتين in في الأنسجة ذات الأمراض العصبية المرتبطة بالعمر الحاجة إلى إيجاد طرق فعالة لتحديد هذه البروتينات كمؤشرات حيوية لعلم الأعصاب المستقبلي والشيخوخة المتسارعة. اليوم ، العديد من هذه الأساليب معروفة بالفعل.
يمكن الكشف عن رواسب الأميلويد في أنسجة الدماغ باستخدام التصوير المقطعي بانبعاث البوزيترون ، عندما يتم تحديد β-amyloid بواسطة النظائر المشعة التي يتم إدخالها إلى الجسم وتوصيلها بالنشواني.
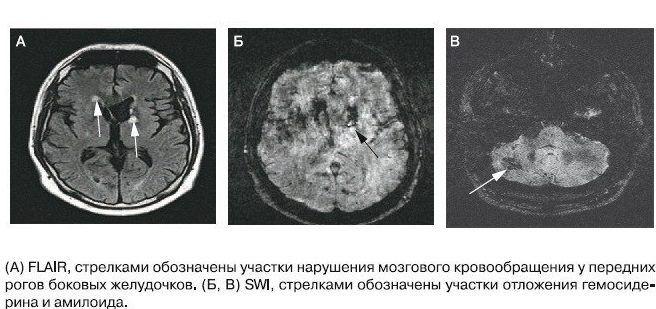
يعتبر أحد أكثر المؤشرات الحيوية حساسية في التشخيص المبكر لمرض الزهايمر واضطرابات الاحتقان المعتدلة (UKI) في مرحلة الانتقال إلى مرحلة علم الأمراض اليوم هو مستويات البروتين النشواني A-42 ، إجمالي البروتين τ والبروتين الفسفوري ory في السائل الدماغي الشوكي. علاوة على ذلك ، تظهر الأميلويد مع علم الأمراض انخفاضًا في المستوى ، وتزيد مستويات السائل الدماغي الشوكي للبروتين τ ، الإجمالي والفسفوريلات. هذا يرجع إلى حقيقة أنه في الأشخاص الأصحاء لا توجد تراكمات من الأميلويد في شكل لويحات ، وبالتالي ، توجد كمية كبيرة من الأميلويد الحر في السائل الدماغي الشوكي. تُظهر القيم المنخفضة للبروتين the عدم تدمير الهيكل الخلوي العصبي.
تم العثور على ارتباط كبير بين العمر وتباطؤ في إفراز β-amyloid من الجهاز العصبي ، والذي قد يرتبط بتصلب الأوعية اللمفاوية وانخفاض في قدرة التصريف. استعادة التصريف هو أحد العلاجات الواعدة لمرض الزهايمر ، الذي اقترحه Leucadia ، وتمت ترجمة مقابلة مع المؤسس ونشرت على
habr.com/post/371513لذلك ، يمكن اعتبار التركيز Aβ-42 في السائل الدماغي الشوكي عند مستوى 716.9 ± 94.2 نانوغرام / مل كمؤشرات طبيعية للشخص السليم. ومستوى Aβ-42 ، الذي يظهر زيادة خطر الإصابة بأمراض الأعصاب ، هو <209 نانوغرام / مل. بالنسبة للبروتين بيتا ، تعتبر مستويات 73.9 ± 51.7 نانوغرام / مل من القيم الطبيعية في السائل النخاعي. قد تشير الزيادة في مستويات البروتين τ إلى 231.6 ± 158.5 نانوغرام / مل إلى وجود عملية تنكس عصبي نشطة. وفقًا لأفكار اليوم ، أظهرت دراسة مشتركة لمستويات Aβ-42 وبروتين protein في السائل النخاعي حساسية عالية في التشخيص المبكر لأمراض الأعصاب - 94 ٪ من احتمال تشخيص مرض الزهايمر [11].
قريبًا ، من المتوقع ظهور طرق فائقة الحساسية المناعية وطيفية الكتلة لتشخيص داء النشواني (نسب Aβ42 / 40 أو APP669-711 / Aβ42 من البروتينات) والتنكس العصبي (τ-البروتينات والخيوط العصبية) في بلازما الدم [12]. هناك أيضًا طرق "بدون علامات" للكشف عن البروتينات المطوية بشكل غير صحيح في البلازما [13].
مؤلفو المراجعة: دينيس أودينوكوف ، أليكسي رزيشيفسكي.
قائمة الأدب المستخدم- Rameev V.، Kozlovskaya L. Amyloidosis: الأساليب الحديثة للتشخيص والعلاج. العلاج الدوائي الفعال. المسالك البولية وأمراض الكلى. 2012. رقم 11 ، ص.6-15.
- Butler L.I ، Karpova O.Yu ، Alexandrova E.N. ، Petrova S.Yu. داء النشواني للقلب عند كبار السن. أرشيف الطب الباطني. 2015. رقم 6 (26) ، ص. 28-36.
- AmyloSENS: إزالة القمامة بين الخلايا ..
- 4Lee، V.، Goedert، M.، Trojanowski، J. (2001) Neupodegenerative tauopathies، Annu. القس الأعصاب .24 ، 1121-1159.
- Tatarnikova O.G. ، Orlov MA ، Babkova N.V. الأميلويد بيتا وبروتين تاو: البنية والتفاعل والخصائص الشبيهة بالبرايون. التقدم في الكيمياء البيولوجية ، المجلد .55 ، 2015 ، ص. 351-390.
- Weller، R.، Yow، H.، Preston، S.، Mazanti، I.، Nicoll، J. (2002) يعد المرض الدماغي الوعائي عاملاً رئيسيًا في فشل القضاء على بيتا النشواني من الدماغ البشري المسن ، آن. NY Acad. علوم ، 977 ، 162–168.
- Nalivaeva ، N. ، Fisk ، L. ، Belyaev. ن. ، تورنر ، أ. (2008) إنزيمات تحلل الأميلويد كأهداف علاجية في مرض الزهايمر ، Curr. Res مرض الزهايمر ، 5 ، 212-224.
- Fisk ، L. ، Nalivaeva ، N. ، Boyle ، J. ، Peers C. ، Turner A. (2007) آثار نقص الأكسجة والإجهاد التأكسدي على التعبير عن النيبريسين في خلايا ورم الخلايا البدائية العصبية البشرية والخلايا العصبية القشرية والفئران ، Neurochem. الدقة 32 ، 1741-1748.
- Jaunmuktane Z. ، Mead S. ، Ellis M. ، Wadsworth JDF ، Nicoll AJ ، Kenny J. ، et al .. (2015). دليل على انتقال الإنسان لعلم أمراض النشواني والاعتلال الوعائي النشواني الدماغي. الطبيعة 525 ، 247-250.
- XL Bu و Y Xiang و WS Jin و J Wang و LL Shen و ZL Huang و K Zhang و YH Liu و F Zeng و JH Liu و HL Sun و ZQ Zhuang و SH Chen و XQ Yao و B Giunta و YC Shan و J Tan و XW Chen و ZF Dong و HD Zhou و XF Zhou و W Song & YJ Wang. يحث بروتين أميلويد β المشتق من الدم على أمراض مرض الزهايمر. الطب النفسي الجزيئي. 2017.
- V.Yu. Lobzin ، A.Yu. Emelin، L.A. أليكسيفا. المؤشرات الحيوية للإنحلال العصبي في التشخيص المبكر للضعف المعرفي. نشرة الأكاديمية الطبية العسكرية الروسية. 2013 ، رقم 4 ، ص. 15-20.
- بلينو وكاج وهينريك زيتيربيرج. "المؤشرات الحيوية لمرض الزهايمر - الوضع الحالي وآفاق المستقبل." مجلة الطب الباطني (2018).
- نابرس وأندرياس وآخرون. "المرمز الحيوي لأميلويد يكتشف مرض الزهايمر." الطب الجزيئي EMBO (2018).