الميتوكوندريا - عمال صغار أم أرباب عمل كبار؟إذا كنت تعتقد أن أهم قصة لنا للعيش معًا تبدأ أثناء الزفاف ، فهذا ليس هو الحال على الإطلاق. بدأت أهم قصة في حياة كل شخص منذ أكثر من مليار عام عندما أجبر أسلافنا البعيدين عن الخلية على توقيع "عقد زواج" مع أولئك الذين نسميهم الآن الميتوكوندريا (انظر نظرية التكافل).
تحتوي الميتوكوندريا على غشاءين (داخلي وخارجي) ومادة وراثية خاصة بها في شكل DNA (الشكل 1). يوجد على الغشاء الداخلي للميتوكوندريا نظام فسفرة مؤكسدة ، يوفر تشغيله أكسدة ركائز الطاقة مع تكوين ATP.
التين. 1 . التركيب التخطيطي للميتوكوندريا
في عقد الزواج للخلية والميتوكوندريا لا يوجد بند "في المرض والصحة" - وجيد. إذا أصبحت الميتوكوندريا قديمة ، يمكن للخلايا أن تقتلها أثناء البلع ، والميتوكوندريا ، بدورها ، تنظم عملية موت الخلايا المبرمج في الخلايا المختلة وظيفيا والخلايا القديمة. إذا تم تعطيل عملية مراقبة الجودة المتبادلة ، يتم إطلاق آليات الشيخوخة. يتم تعطيل آليات الاستماتة ، ويزداد عدد الجذور الحرة التي لا تسيطر عليها الميتوكوندريا. وهذا يسبب التهابًا جهازيًا وتلفًا في الحمض النووي للخلية. وبالتالي ، هناك علاقة قوية بين خلل MX ، والأمراض المرتبطة بالعمر ، والشيخوخة ، واختلالات التمثيل الغذائي [1]. ضعف التمثيل الغذائي هو متسابق دائم في نهاية العالم من الشيخوخة.
"مثل السنجاب في عجلة" - ديناميات الميتوكوندريا
ليس كل اللوم على الاضطرابات الأيضية يكمن في الإفراط في تناول الطعام. ترتبط الاضطرابات الأيضية في المقام الأول بعدم قدرة الميتوكوندريا على التكيف مع العناصر الغذائية. الميتوكوندريا في الخلية ليست سهلة. نحن "نطعم" خلايانا إما كثيرًا أو قليلًا جدًا ، ونقدم لها "طلبًا" لإعطاء طاقة في شكل ATP ، يجب أن يتناسب مقدارها تمامًا مع احتياجاتنا. من أجل "الخروج" بانتظام من هذا الوضع ، تستخدم الميتوكوندريا حقًا بعض "الحركات" - الانشطار والاندماج. تتحد هذه "الحركة الميتو" تحت اسم "ديناميكيات الميتوكوندريا". التوازن بين انقسام الميتوكوندريا والاندماج هو الآلية المركزية للتكيف مع الطاقة الحيوية للاحتياجات الأيضية للخلية [2 ، 3].
تم العثور على معظم الميتوكوندريا في الأنسجة ذات الاحتياجات العالية من الطاقة - العضلات والكبد والأنسجة الدهنية البنية والدماغ. ليس من المستغرب أن يتم دراسة ديناميكيات الميتوكوندريا في هذه الأنسجة بشكل أفضل.
لذا ، إذا تلقت خلية من أي من هذه الأنسجة (باستثناء بعض الخلايا العصبية في الدماغ ، المزيد عن ذلك لاحقًا) كمية كبيرة من المغذيات (يتجاوز الاستهلاك التكلفة) ، فإن الميتوكوندريا في حالة مقسمة (مجزأة). إذا كانت الخلية في حالة من الجوع (دخل أقل من التكلفة) ، عندئذ تندمج الميتوكوندريا وتكون في حالة متصلة. [3،4]. هذه هي الطريقة التي يتم بها الحفاظ على التوازن الخلوي (الشكل 2).
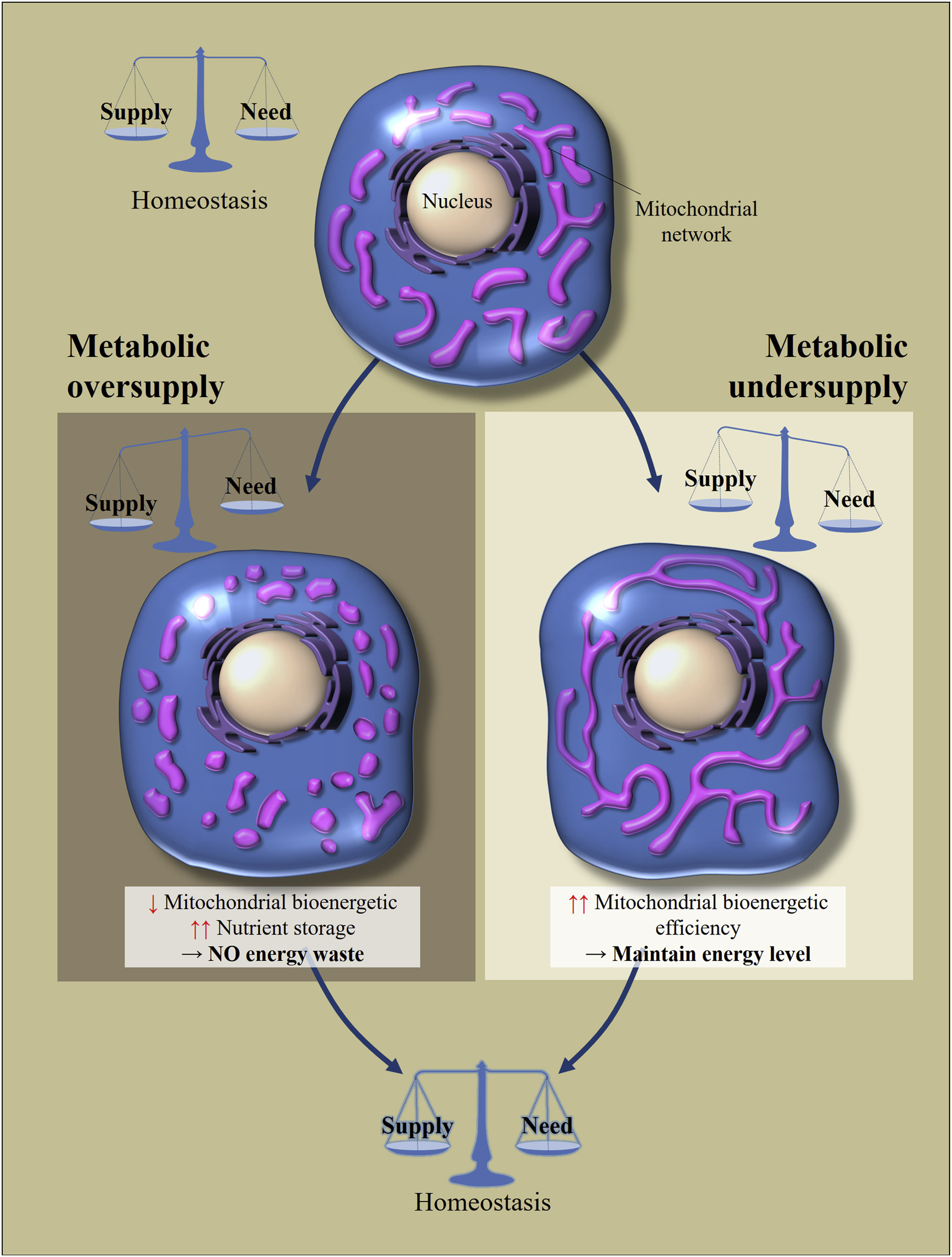 التين. 2
التين. 2 تنظيم المورفولوجيا وكفاءة الطاقة في الميتوكوندريا استجابة لزيادة أو عدم كفاية تناول المغذيات [من أصل 2]
يعتمد استتباب التمثيل الغذائي الخلوي على التوازن بين تناول المغذيات واستهلاكها. تؤدي التغييرات في إمدادات المغذيات إلى تعديلات خلوية لاستعادة التوازن. تؤدي التغذية الزائدة إلى تفتيت شبكة الميتوكوندريا ، مما يتسبب في انخفاض كفاءة الطاقة الحيوية للميتوكوندريا. سيؤدي ذلك إلى تجنب فقدان الطاقة. في المقابل ، مع الجوع الأيضي ، تصبح الميتوكوندريا أطول من أجل زيادة كفاءتها في الطاقة الحيوية.ما هي خدعة هذه الحركات؟ إذا كانت الخلية في حالة من الجوع ، فإن دمج الميتوكوندريا يمكن أن يزيد من كفاءتها في الطاقة الحيوية (كمية ATP التي يتم إنشاؤها لكل جزيء مغذى). إذا دخلت فائض من العناصر الغذائية إلى الخلية ، فيمكن أن تكون إما 1) مخزنة ، أو 2) تبدد هذه الطاقة في شكل حرارة. تتمثل مهمة الميتوكوندريا في هذه الحالة في تبديد المزيد من الطاقة في شكل حرارة ، وتخزين أقل في شكل ATP (يؤدي تراكم NADH و ROS إلى إجهاد مؤكسد). إن تجزئة الميتوكوندريا يسمح لها بتقليل كفاءة الطاقة الحيوية ، وتعتبر الآلية الرئيسية للحد منها "تسرب" البروتونات.
لذا ، نذهب إلى العمل ، وتستمر حياة الميتوكوندريا باستمرار في دورة الانقسام والاندماج (الشكل 3).
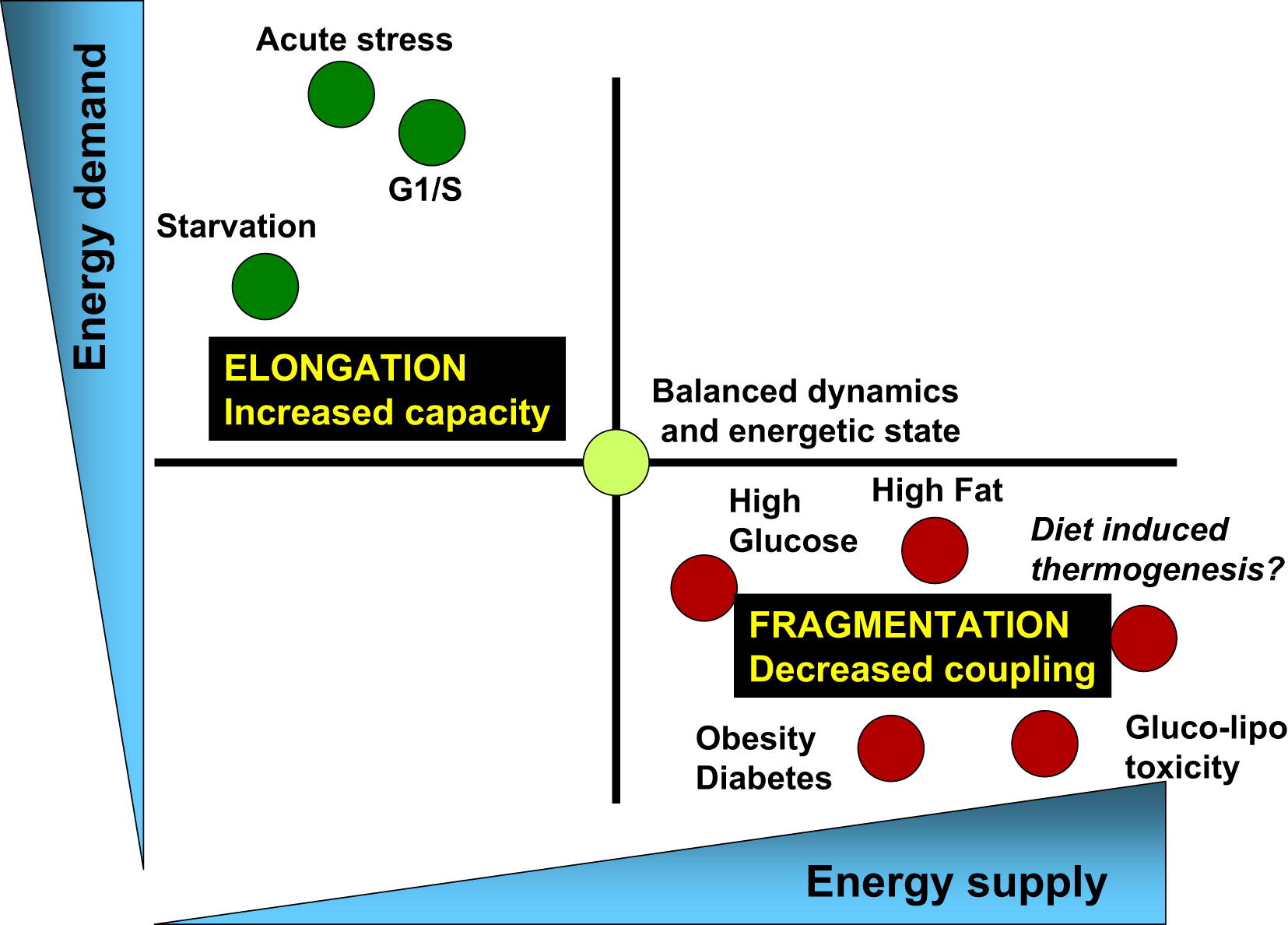 الشكل 3 يرتبط توازن استهلاك الطاقة وإمدادات الطاقة بالتغيرات المقابلة في بنية الميتوكوندريا وكفاءتها في الطاقة الحيوية [من 3]
الشكل 3 يرتبط توازن استهلاك الطاقة وإمدادات الطاقة بالتغيرات المقابلة في بنية الميتوكوندريا وكفاءتها في الطاقة الحيوية [من 3]
تتميز العمليات الفسيولوجية المرتبطة بزيادة الطلب على الطاقة وانخفاض إمدادات الطاقة (على سبيل المثال ، الإجهاد الحاد والمجاعة ومرحلة G1 / S) باستطالة الميتوكوندريا والتنفس المرتبط بتوليف ATP. من ناحية أخرى ، ترتبط العمليات الفسيولوجية المرتبطة بانخفاض الطلب على الطاقة وزيادة العرض (مستويات عالية من العناصر الغذائية والسمنة والسكري من النوع 2) بتجزئة الميتوكوندريا أو إنتاج الحرارة أو انخفاض وظيفة الميتوكوندريا.دورات الانشطار والاندماج الصحية هي المفتاح لصحة التمثيل الغذائي للخلية
تعد الدورة الطبيعية لتقسيم الميتوكوندريا والانصهار عنصرًا رئيسيًا في مراقبة الجودة. لماذا؟ أثناء الانقسام الميتوكوندري ، يتم تشكيل ابنتان ، إحداهما ذات قدرة غشائية أعلى وتذهب إلى دورة تقسيم الانصهار ، والأخرى ، مع غشاء أكثر استقطابًا ، تظل منفصلة حتى يتم استعادة إمكانات الغشاء. إذا تمت استعادة الإمكانات ، فإنها تتحد مع شبكة الميتوكوندريا. إذا بقيت مستقطبة ، يتم التخلص منها في عملية الالتهام الذاتي ، وهو المفتاح لجودة تجمع الميتوكوندريا (الشكل 4).
يؤدي تثبيط انقسام الميتوكوندريا طويل الأمد (مع تجويع الخلايا لفترات طويلة) إلى تراكم الميتوكوندريا المتضررة ، والتي لا يمكن فصلها [3 ، 4].
من ناحية أخرى ، تؤدي زيادة العناصر الغذائية إلى تثبيط انصهار الميتوكوندريا ، مما يؤدي إلى تعطيل دورة ديناميكيات الميتوكوندريا ، مما يزيد من عدم التجانس بين الخلايا الميتوكوندريا. نعم ، مع وجود فائض من الطعام ، فإن تجزئة الميتوكوندريا واقية ، ولكن التجزؤ المطول ، مثل الاندماج لفترات طويلة ، ضار لمراقبة جودة الميتوكوندريا. لا يوجد إزالة انتقائية ؛ ستنخفض كتلة الميتوكوندريا وتتكون من الميتوكوندريا المستقطبة الصغيرة.
 الشكل 4 دورة حياة الميتوكوندريا وتنظيمها لتوافر المغذيات [من 3]
الشكل 4 دورة حياة الميتوكوندريا وتنظيمها لتوافر المغذيات [من 3]Mitofusins ليست مجرد بروتينات
على المستوى الجزيئي ، يعد اندماج الميتوكوندريا عملية من مرحلتين تتطلب اندماجًا منسقًا للأغشية الخارجية والداخلية خلال أحداث متسلسلة منفصلة. في الثدييات ، يتم تنظيم هذه العملية من خلال ثلاثة بروتينات تنتمي إلى GTPases: Mfn1 و Mfn2 ضرورية لدمج الغشاء الخارجي ، و OPA1 - لدمج الغشاء الداخلي. هناك حاجة إلى بروتينات أخرى للانقسام ، Fis1 و Drp1.
تمت دراسة دور بروتينات ميتوفوسين في دراسات فقدان الوظيفة وكسبها. تموت الفئران المتحولة لبروتينات ميتوفوسين في وقت مبكر من منتصف الحمل ، لأن اندماج الميتوكوندريا يصبح مستحيلاً بالنسبة لها. Mitofusins مهمة لعمليات الالتهام الذاتي والبلعمة. نقص التعبير عن Mfn2 في خلايا عضلة القلب يمنع بدء عملية البلعمة الذاتية ، لأن انسداد المريء الذاتي مع الليزوزومات مسدود. يؤدي استنفاد Mfn2 إلى انخفاض في إمكانات أغشية الميتوكوندريا ؛ للتعويض ، هناك انخفاض في عمل سلسلة الجهاز التنفسي ، ويزيد امتصاص الجلوكوز ويقلل تخليق الجليكوجين. تتحول الخلية إلى التحلل السكري اللاهوائي ، وهذا هو المسار إلى تنكس الأورام في الخلية. يؤدي نقص Mfn2 إلى تغييرات تنكسية عصبية. زيادة في التعبير عن Mfn2 في عضلات الهيكل العظمي يزيد من حساسيتهم للأنسولين.
يؤدي Mfn1 وظائف مماثلة ، ولكن ربما في أنسجة أخرى (يختلف التعبير عن Mfn2 و Mfn1 في الأنسجة المختلفة) - يتم التعبير عن Mfn1 بشكل أكبر في القلب والكبد والبنكرياس والخصيتين و Mfn2 في القلب والعضلات الهيكلية والدماغ والأنسجة الدهنية البنية .
وبالتالي ، فإن mitofusins هي المنظم الرئيسي لديناميات الميتوكوندريا. يختلف التعبير عن الميتوفوزين في الأعضاء المختلفة ، فهي توفر كفاءة الطاقة الحيوية وآليات التكيف لتوافر المغذيات ، ويعتمد عليها "مصير" الخلية. ليس من المستغرب أن بروتينات دمج الميتوكوندريا هي أهداف محتملة للتدخلات الدوائية [2 ، 5].
المهاد ، الميتوكوندريا ، اختلال التمثيل الغذائي والشيخوخة
ديناميات الميتوكوندريا مهمة في جميع الخلايا. في خلايا بيتا في البنكرياس ، الميتوكوندريا هي أجهزة استشعار المغذيات ومولدات إشارات تخليق الأنسولين ، في العضلات ، ديناميات الميتوكوندريا مهمة لتنظيم استقلاب الجلوكوز ، إلخ. ومع ذلك ، فإن الشخص ليس مجرد مجموعة من أنواع مختلفة من الخلايا ، كل منها يتخذ قرارات مستقلة. الكائن الحي هو نظام له ارتباط تنظيمي مركزي للحفاظ على استتباب الطاقة والجلوكوز. هذا المنظم الرئيسي هو تحت المهاد.
يقع تحت المهاد في الدماغ البيني وهو الذي يوفر الترابط بين الأنظمة التنظيمية العصبية والخلطية. الخلايا العصبية تحت المهاد تدرك وتعالج وتستجيب للإشارات من الأنسجة الدهنية (الليبتين) والبنكرياس (الأنسولين) والمحفزات الهرمونية الأخرى (الغريلين ، كوليسيستوكينين ، بولي ببتيد البنكرياس ، وما إلى ذلك). يتحكم المهاد في نشاط نظام الغدد الصماء البشري بسبب حقيقة أن الخلايا العصبية قادرة على إفراز أجهزة إرسال الغدد الصماء العصبية التي تحفز أو تمنع إنتاج الهرمونات عن طريق الغدة النخامية. وبعبارة أخرى ، فإن منطقة ما تحت المهاد ، التي لا تتجاوز كتلتها 5 ٪ من الدماغ ، هي مركز تنظيم وظائف الغدد الصماء والحفاظ على توازن الكائن الحي بأكمله.
حتى ديلمان (Dilman V. M "ساعة بيولوجية كبيرة") أشارت إلى الدور الرائد في منطقة ما تحت المهاد في التطور المنهجي لخلل التمثيل الغذائي ، مما يؤدي إلى السمنة والسكري وأمراض القلب والأوعية الدموية والأورام والشيخوخة. وفقًا لنظرية فرط التكاثر التي شكلها ديلمان ، فإن حساسية مستقبلات الوطاء للإشارات القادمة من أنسجة الجسم (الليبتين ، الأنسولين ، إلخ) تتناقص تدريجيًا بشكل منتظم مع تقدم العمر. من أجل إثارة "استجابته" ، هناك حاجة إلى المزيد والمزيد من هرمون أو آخر - المزيد من الأنسولين ، المزيد من الليبتين. تطور مقاومة الأنسولين واللبتين والأمراض الأيضية التي تؤدي إلى الشيخوخة والموت.
اعتمادًا على الوظائف التي يتم إجراؤها ، يتم دمج مجموعات من الخلايا العصبية في نواة منطقة ما تحت المهاد. واحد منهم - النواة المقوسة (المقوسة) هي منظم رئيسي لسلوك الأكل والتمثيل الغذائي. الببتيدات العصبية Orexigenic (تحفيز الشهية) و anexexigenic (قمع الشهية) ، المقابلة للخلايا العصبية AgRP و POMC ، على التوالي ، يمكن أن تتشكل فيه. تؤثر الإشارات المحيطية (الأنسولين ، الغريلين ، الليبتين ، إلخ) على التعبير عن الببتيدات التي تحفز أو تقمع الشهية ، مما يضمن تماسك التنظيم المركزي (الشكل 5).
 التين. 5. التحكم تحت المهاد في استقلاب الطاقة. يدمج الدماغ إشارات التمثيل الغذائي (اللبتين ، الأنسولين ، الغريلين ، PYY3-36) من الأنسجة الطرفية مثل البنكرياس ، الأنسجة الدهنية ، والمعدة. في الدماغ ، تنسق الشبكات العصبية المتخصصة التغيرات التكيفية في امتصاص واستهلاك الطعام [من أصل 5].
التين. 5. التحكم تحت المهاد في استقلاب الطاقة. يدمج الدماغ إشارات التمثيل الغذائي (اللبتين ، الأنسولين ، الغريلين ، PYY3-36) من الأنسجة الطرفية مثل البنكرياس ، الأنسجة الدهنية ، والمعدة. في الدماغ ، تنسق الشبكات العصبية المتخصصة التغيرات التكيفية في امتصاص واستهلاك الطعام [من أصل 5].فمن وكيف ينظم حساسية الخلايا العصبية تحت المهاد؟
أظهرت دراسة ديناميات الميتوكوندريا في أنسجة الدماغ أن ديناميات الميتوكوندريا تلعب دورًا مهمًا في قدرة الخلايا العصبية تحت المهاد على التحكم في مستويات الجلوكوز واستتباب الطاقة في الجسم [6،7،8].
في الخلايا العصبية AgRP (الخلايا العصبية AgRP المعززة للجوع) ، التي تحفز الشهية وتنظم زيادة الوزن ، يؤدي المجاعة إلى انقسام الميتوكوندريا ، وتؤدي التغذية عالية الدهون إلى الاندماج. أي أن استجابة الميتوكوندريا تختلف عن تلك الموجودة في معظم الخلايا الأخرى.
ينظم اندماج MX في هذه الخلايا العصبية النشاط الكهربائي استجابة لنظام غذائي غني بالدهون ، مما يحفز إنتاج الببتيد الأصلي (ببتيد AgRP) ، وهو ضروري لزيادة الوزن وترسب الدهون مع زيادة العناصر الغذائية. نتج عن حذف Mfn1 و Mfn2 في هذه الخلايا العصبية زيادة في وزن الفئران بسبب انخفاض مستويات اللبتين المتداول.
الخلايا العصبية POMC (قمع الشهية) لها وظيفة عكسية ، وديناميكيات الميتوكوندريا ردا على تناول المغذيات مختلفة. يؤدي انخفاض في التعبير عن الميتوفوزين في هذه الخلايا العصبية إلى انقطاع في اتصال الميتوكوندريا مع EPS ، ونتيجة لذلك ، فرط البلع ، ومقاومة اللبتين ، والسمنة. في الوقت نفسه ، زاد استهلاك الغذاء ، وانخفض استهلاك الطاقة.
وبالتالي ، تعتمد استجابة الجسم لنظام غذائي غني بالدهون على أنماط ديناميكيات الميتوكوندريا في الخلايا العصبية تحت المهاد. إن إعادة عرض الميتوكوندريا في الخلايا العصبية يوفر استجابتها لتناول المغذيات ، ويحفز إنتاج الببتيدات العصبية التي ستحفز أو تقمع الشهية ، مما يؤثر على التمثيل الغذائي على مستوى الجسم (الشكل 6).
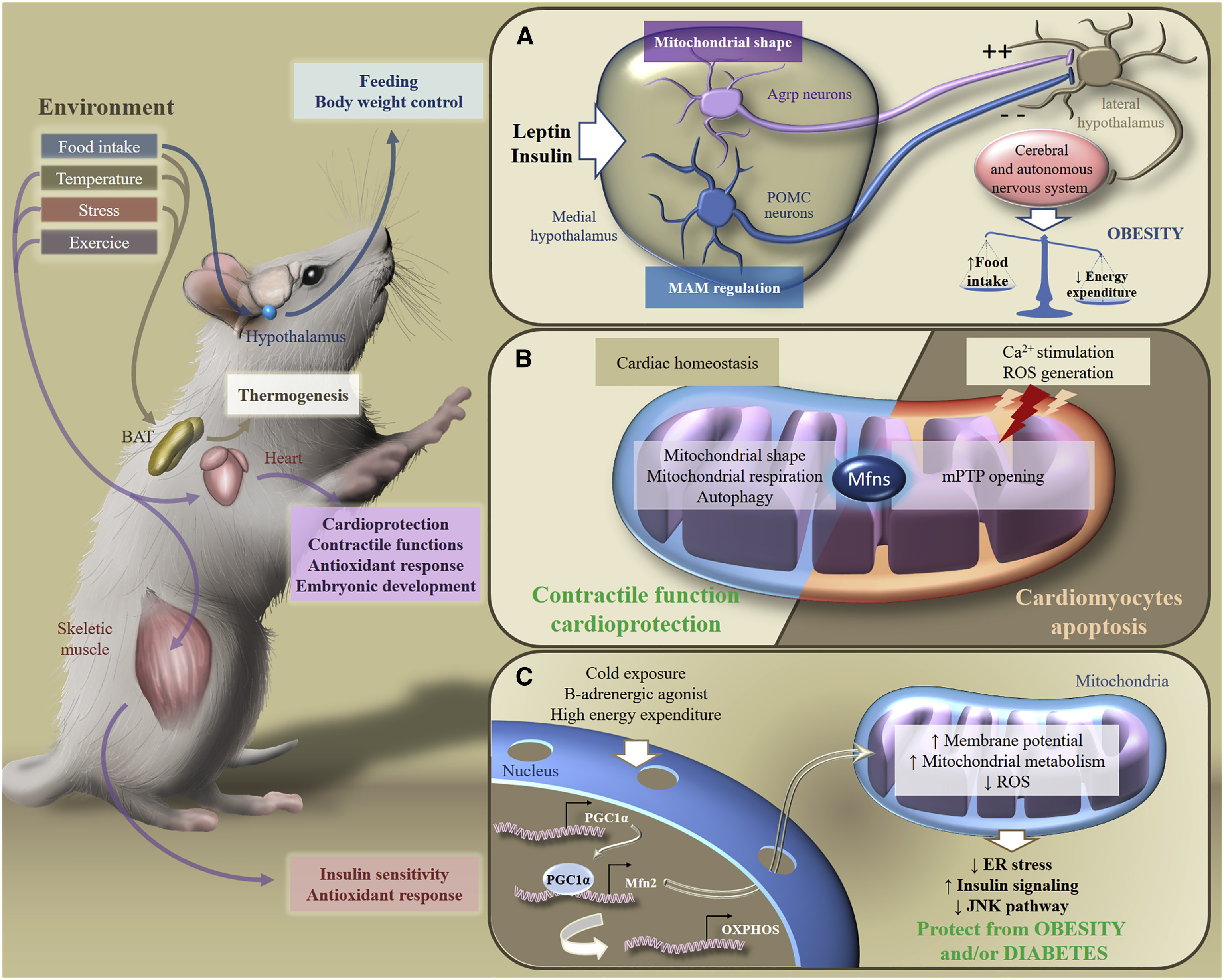 الشكل 6. التكيف الأيضي مع المحفزات البيئية [من 2]
الشكل 6. التكيف الأيضي مع المحفزات البيئية [من 2]استجابة للمنبهات الخارجية ، يشارك Mfns في تنبيغ الإشارات الأيضية في مختلف الأعضاء ، مما يضمن الحفاظ على توازن الطاقة في جميع أنحاء الجسم. على وجه الخصوص ، استجابةً لتناول الطعام ، أو تغيرات درجة الحرارة ، أو الإجهاد ، أو التمرين ، تعمل الأنسجة الدهنية البنية ، أو الدماغ ، أو القلب ، أو العضلات الهيكلية على تكييف عملية التمثيل الغذائي للتحكم في التغذية ، أو وزن الجسم ، أو وظيفة الانقباض ، أو الاستجابة المضادة للأكسدة ، أو حساسية الأنسولين.
كيف تؤثر على ديناميات الميتوكوندريا؟
1. التغذية وممارسة الرياضةدورات التغذية الأطعمة الزائدة واتباع نظام غذائي غني بالدهون (HFD) تمنع اندماج الميتوكوندريا في الخلايا (تختلف الآلية في بعض الخلايا العصبية في الدماغ). تعطل دورة انصهار الميتوكوندريا غير المكتملة عمليات الالتهام الذاتي → تزداد تغايرية الميتوكوندريا داخل الخلايا → لا يوجد إزالة انتقائية للميتوكوندريا → الميتوكوندريا مع تراكم الخلل الوظيفي.
يحفز تقييد السعرات الحرارية (دورة التغذية / الصيام) التكيف مع الطاقة الحيوية ، ويوفر آليات جودة الميتوكوندريا.
2. أغشية صحية: حمض دهني ، كارديوليبين ، حمض الفوسفاتيدتعتمد جميع العمليات الرئيسية على "صحة" أغشية الميتوكوندريا - البلعمة الذاتية ، البلعمة الميتة ، موت الخلايا المبرمج ، علاقة الميتوكوندريا بالشبكة الإندوبلازمية ، وديناميكيات الميتوكوندريا. تتكون أغشية العضيات الخلوية من الدهون والبروتينات. يتم التحكم في إعادة تشكيل هذه الأغشية من خلال التفاعلات بين الدهون والبروتينات المحددة.
تشمل الأحماض الدهنية المشبعة بالميتيك (C16) و دهني (C18). وقد تبين أن استخدام حمض دهني (C18: 0) يحفز عملية اندماج الميتوكوندريا. يرتبط عملها بتأثير على mitofusins. في الفئران ، يمكن للمكملات الغذائية لحمض دهني أن تعيد جزئيًا خلل وظيفي في الميتوكوندريا بسبب طفرات في جينات Pink1 أو باركن. في العدلات من الأشخاص الذين يتبعون نظامًا غذائيًا منخفض C18: 0 لمدة يومين ، تكون الميتوكوندريا في حالة مجزأة (50 ٪ من الخلايا كانت مجزأة MX ، 10 ٪ مرتبطة بـ MX). قادهم استخدام حمض دهني إلى دمج الميتوكوندريا بعد 3 ساعات [8]. وبالتالي ، فإن حمض الستريك مهم للحفاظ على ديناميكيات الميتوكوندريا. تم العثور على معظم حامض دهني في حبوب الكاكاو (31-34٪).
الدهون الفوسفاتية هي المكونات الرئيسية لأغشية العضية. كما أنها تنظم ديناميات الميتوكوندريا ، وتأثيرها مختلف [9].
يحفز Cardiolipin (CL) انقسام الميتوكوندريا ودمج الأغشية الداخلية.
يعتبر Cardiolipin ضروريًا لتشغيل المركب IV المعقد (citrochrome C oxidase) لسلسلة النقل الإلكترونية. يقع Cardiolipin بشكل حصري تقريبًا في الغشاء الداخلي للميتوكوندريا. مع تقدم العمر ، هناك انخفاض في كمية الكارديوليبين. هناك نظرية مفادها أن فقدان وظيفة Cardiolipin مرتبط باستبدال الأحماض الدهنية المشبعة في جزيئها بالأحماض الدهنية المتعددة غير المشبعة. لحل هذه المشكلة ، من الضروري إدخال الدهون المشبعة الغنية أولاً بالحمض الدهني الدهني في النظام الغذائي.
لزيادة كفاءة توصيل الأحماض الدهنية المشبعة إلى الغشاء ، يمكن استخدام الناقلات. على سبيل المثال ، استخدام phosphatidylcholine المشبع (dipalmitophosphatidylcholine و dyseroylphosphatidylcholine) ، والذي يمكن أن يسلم FAs المشبعة مباشرة إلى Cardiolipin [10]. يمر الكولين ، كحامل ، بسهولة عبر العصارة الخلوية ويدخل الميتوكوندريا.
يمنع حمض الفوسفاتيك (RA) انقسام الميتوكوندريا ويحفز اندماج الأغشية الخارجية (الشكل 7).
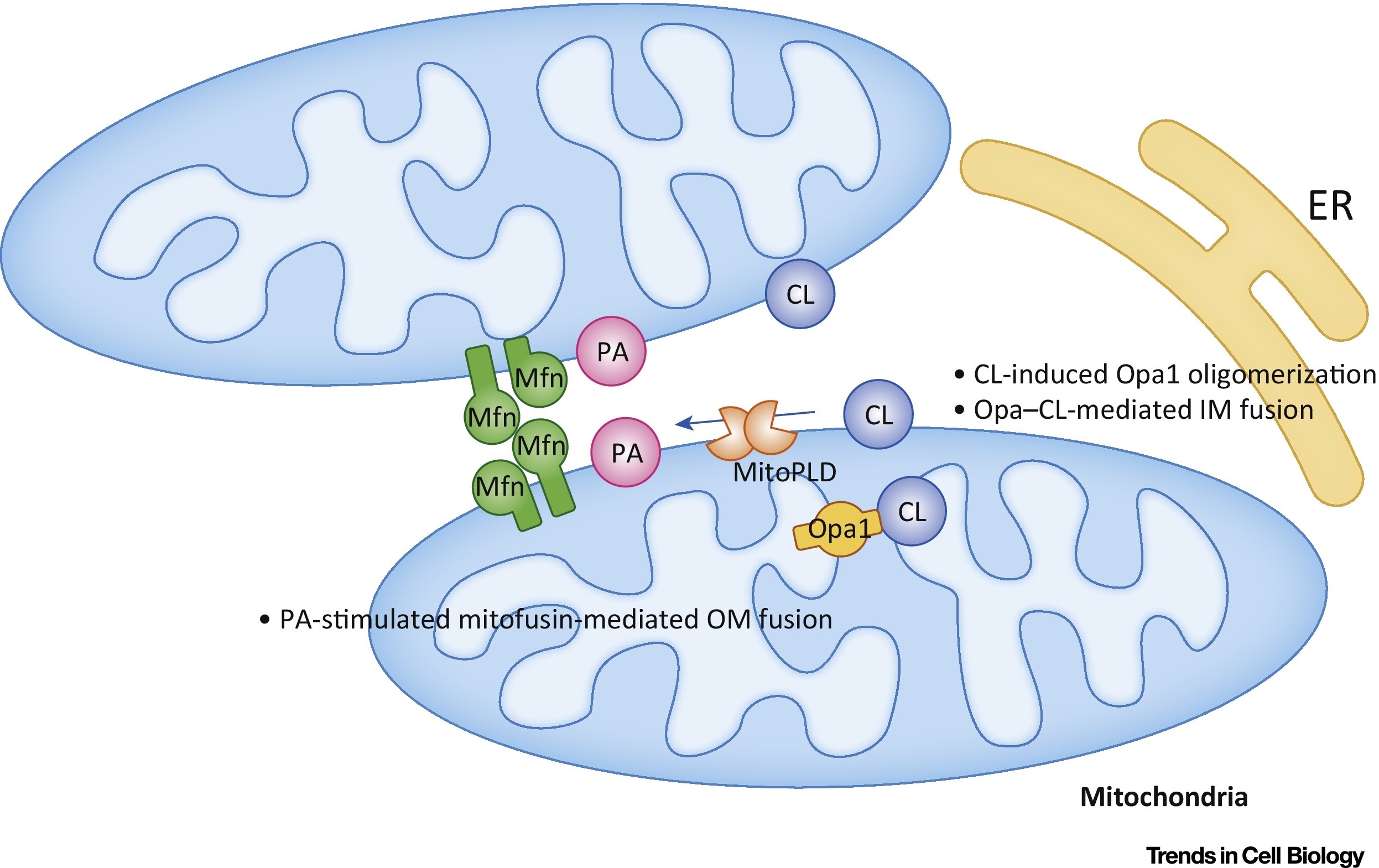 التين .7 تنظيم اندماج الميتوكوندريا مع حمض الفوسفاتيدك (PA) وكارديوليبين (CL) [من 9].
التين .7 تنظيم اندماج الميتوكوندريا مع حمض الفوسفاتيدك (PA) وكارديوليبين (CL) [من 9].في الغشاء الخارجي (OM) ، يحفز التهاب المفاصل الروماتويدي الانصهار بوساطة mitofusin (Mfn). في الغشاء الداخلي (IM) ، يحفز CL الانصهار بوساطة Opa1. الاختصارات: ER - الشبكة الإندوبلازمية. MitoPLD ، - فوسفوليباز د.
3. تنظيم التعبير عن الميتوفوزين (البروتينات المسؤولة عن ديناميات الميتوكوندريا)كل ما تحدثنا عنه أعلاه (تقييد السعرات الحرارية ، وحمض دهني ، والدهون الفسفورية) يعمل عن طريق التأثير على التعبير عن الميتوفوزين.بالإضافة إلى ذلك ، هناك عدد من الأدوية التي يمكن أن تؤثر بشكل غير مباشر على ديناميكيات الميتوكوندريا. وتشمل هذه استخدام الميتفورمين.الأكثر إثارة للاهتمام هو استخدام المواد التي يمكن أن تؤثر بشكل مباشر على التعبير عن mitofusins. واحدة من الأدوية المحتملة تسمى leflunomide (leflunomide) ، والتي تمت الموافقة عليها من قبل FDA [5،11]. وهو محفز للتعبير عن Mfn1 و Mfn2 ، وقد تم تسجيله كدواء لعلاج التهاب المفاصل الروماتويدي.العلاج الجيني للميتوكوندريا
قد تترافق ديناميكيات الميتوكوندريا الضعيفة مع ضعف التعبير عن البروتينات المسؤولة عن اندماج الميتوكوندريا والانقسام. بالإضافة إلى ذلك ، يمكن أن يرتبط الخلل في هذه البروتينات (وهذا يحدث غالبًا) مع طفراتها. هناك طريقتان للنظر في تفاعلات السبب والنتيجة لخلل في الميتوكوندريا.كان يعتقد في السابق أن نمط الحياة ، بما في ذلك الإفراط في تناول الطعام ، يؤدي إلى تكوين الجذور الحرة ، والإجهاد التأكسدي ، وتحولات جينوم الميتوكوندريا ، وبالتالي خلل في الميتوكوندريا. ومع ذلك ، هناك مؤخرًا دليل مقنع على أن طفرات الحمض النووي للميتوكوندريا أمر لا مفر منه ، وكلها لديها طفرات نقطة DNA غير متجانسة وترتبط بأخطاء التكرار ، وليس بالضرر التأكسدي ، الذي يكون الحمض النووي للميتوكوندريا مستقرًا تمامًا [12]. بالفعل في مرحلة البويضة المخصبة ، تحمل بعض الميتوكوندريا طفرات. بمرور الوقت ، ينقسمون ، هناك المزيد من الميتوكوندريا الطافرة ، لا يمكنهم أداء وظائفهم بشكل طبيعي.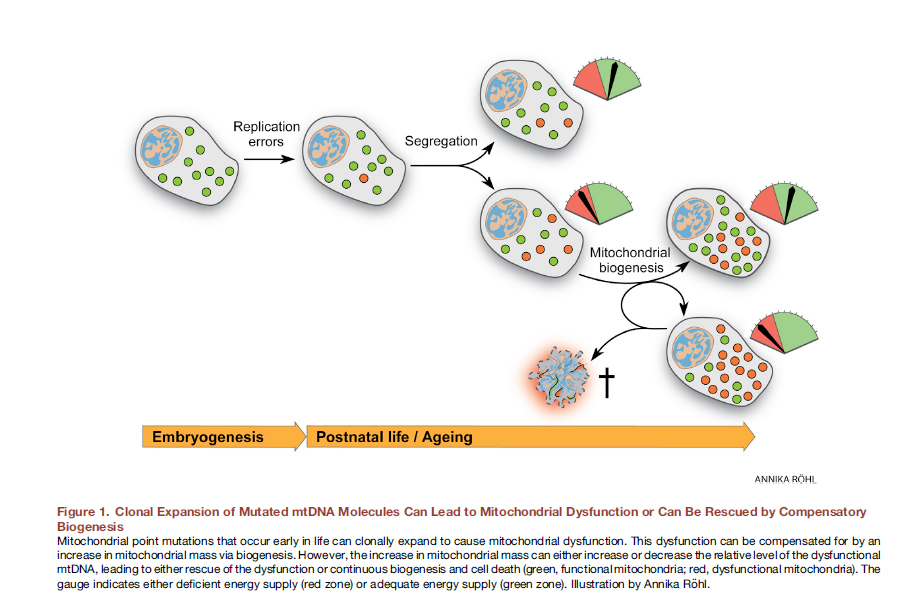 التين. 8 يمكن أن يؤدي التوسع النسيلي لجزيئات mtDNA المتحولة إلى خلل وظيفي في الميتوكوندريا أو يمكن "حفظه" عن طريق التكوين الحيوي التعويضي [من أصل 12].هنا ، في الجسم الحي ، يمكن أن يكون تحرير جينوم الميتوكوندريا مفيدًا جدًا. وقد ثبت أنه بالنسبة لطفرات نقطة الحمض النووي غير المتجانسة في الفئران ، فقد تم تحقيق نجاح كبير بالفعل مع نوكليازات الزنك-الإصبع المستهدفة (mtZFN) مع التسليم باستخدام ناقل الفيروسة الغدانية [13].
التين. 8 يمكن أن يؤدي التوسع النسيلي لجزيئات mtDNA المتحولة إلى خلل وظيفي في الميتوكوندريا أو يمكن "حفظه" عن طريق التكوين الحيوي التعويضي [من أصل 12].هنا ، في الجسم الحي ، يمكن أن يكون تحرير جينوم الميتوكوندريا مفيدًا جدًا. وقد ثبت أنه بالنسبة لطفرات نقطة الحمض النووي غير المتجانسة في الفئران ، فقد تم تحقيق نجاح كبير بالفعل مع نوكليازات الزنك-الإصبع المستهدفة (mtZFN) مع التسليم باستخدام ناقل الفيروسة الغدانية [13].نقل الميتوكوندريا
طريقة أخرى واعدة للقضاء على الخلل في الميتوكوندريا هي زرع الميتوكوندريا. جوهر هذا النهج هو "استبدال" الميتوكوندريا المتضررة بميتوكوندريا صحية خارجية. تم استخدام هذا النهج لأول مرة سريريًا في الأطفال الذين يعانون من نقص تروية عضلة القلب. تم استخدام الميتوكوندريا المعزولة ذاتيًا للزرع ، والتي تم عزلها باستخدام العضلة البطنية المستقيمة (تم إجراء الخزعة ، ثم تم تحضير المستحضر) ، ثم تم إعطاؤها عن طريق الحقن المباشر [14]. يتم تطوير مناهج مختلفة لإدخال الميتوكوندريا: الحقن المباشر للميتوكوندريا المعزولة (الحقن الموضعي) والحقن الجهازي في مجرى الدم ، عندما تقوم الميتوكوندريا نفسها "بالبحث" عن الخلية التي تذهب إليها. تدرس مجموعات من الباحثين إمكانية زرع الميتوكوندريا في مرض باركنسون ، ونقص تروية الكبد ، والسكتة الدماغية ، وأمراض الميتوكوندريا [15].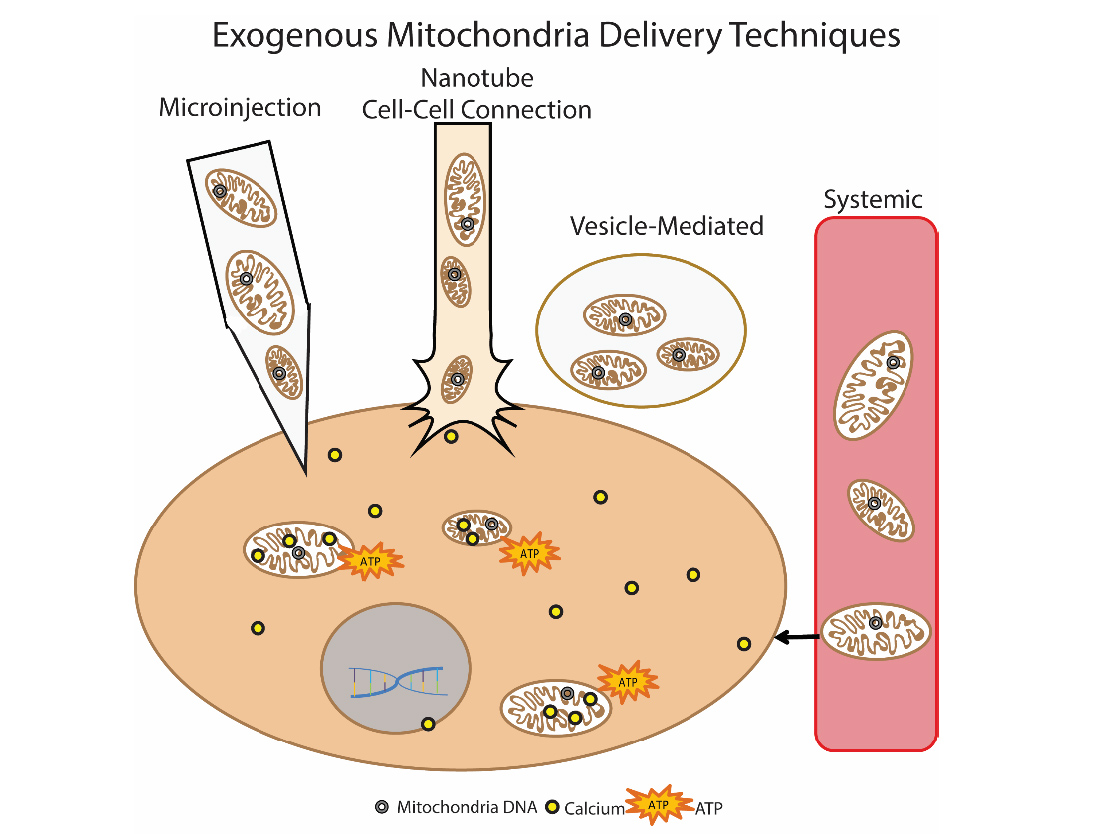 الشكل 9 طرق إيصال الميتوكوندريا الخارجية إلى الخليةالمؤلف Olga Borisova
الشكل 9 طرق إيصال الميتوكوندريا الخارجية إلى الخليةالمؤلف Olga Borisovaالأدب1. Kauppila, Timo ES, Johanna HK Kauppila, and Nils-Göran Larsson. «Mammalian mitochondria and aging: an update.» Cell metabolism 25.1 (2017): 57-71.
www.sciencedirect.com/science/article/pii/S15504131163050222. Schrepfer, Emilie, and Luca Scorrano. «Mitofusins, from mitochondria to metabolism.» Molecular cell 61.5 (2016): 683-694.
www.sciencedirect.com/science/article/pii/S1097276516001337#fig13. Marc Liesa, Orian Shirihai “Mitochondrial Dynamics in the Regulation of Nutrient Utilization and Energy Expenditure” Cell methabolism (2013): 491-506
www.sciencedirect.com/science/article/pii/S1550413113001046#fig34. Ramos, Eduardo Silva, Nils-Göran Larsson, and Arnaud Mourier. «Bioenergetic roles of mitochondrial fusion.» Biochimica et Biophysica Acta (BBA)-Bioenergetics 1857.8 (2016): 1277-1283.
www.sciencedirect.com/science/article/pii/S00052728163008585. Cunarro, Juan, et al. «Hypothalamic mitochondrial dysfunction as a target in obesity and metabolic disease.» Frontiers in endocrinology 9 (2018): 283.
www.frontiersin.org/articles/10.3389/fendo.2018.00283/full6. Marcelo O.Dietrich et al. «Mitochondrial Dynamics Controlled by Mitofusins Regulate Agrp Neuronal Activity and Diet-Induced Obesity”.
www.sciencedirect.com/science/article/pii/S0092867413010957#figs27. Steculorum, Sophie M., and Jens C. Brüning. „Sweet mitochondrial dynamics in VMH neurons.“ Cell metabolism 23.4 (2016): 577-579.
www.sciencedirect.com/science/article/pii/S15504131163011768. Senyilmaz-Tiebe, Deniz, et al. „Dietary stearic acid regulates mitochondria in vivo in humans.“ Nature communications 9.1 (2018): 3129.
www.nature.com/articles/s41467-018-05614-69. Kameoka, Shoichiro, et al. „Phosphatidic Acid and Cardiolipin Coordinate Mitochondrial Dynamics.“ Trends in cell biology (2017).
www.sciencedirect.com/science/article/pii/S096289241730158710.
raypeatforum.com/community/threads/mitolipin-liquid-saturated-phosphatidylcholine-pc-mix.1039811. Miret-Casals, Laia, et al. „Identification of new activators of mitochondrial fusion reveals a link between mitochondrial morphology and pyrimidine metabolism.“ Cell chemical biology25.3 (2018): 268-278.
12. Kauppila, Timo ES, Johanna HK Kauppila, and Nils-Göran Larsson. „Mammalian mitochondria and aging: an update.“ Cell metabolism 25.1 (2017): 57-71.
13. Gammage et al. “Genome editing in mitochondria corrects a pathogenic mtDNA mutation in vivo” Nature medicine, 2017
www.nature.com/articles/s41591-018-0165-914. Emani, Sitaram M., et al. „Autologous mitochondrial transplantation for dysfunction after ischemia-reperfusion injury.“ The Journal of thoracic and cardiovascular surgery 154.1 (2017): 286-289.
www.jtcvs.org/article/S0022-5223 (17)30258-1/fulltext
15. McCully, James D., et al. „Mitochondrial transplantation: From animal models to clinical use in humans.“ Mitochondrion 34 (2017): 127-134.
www.sciencedirect.com/science/article/pii/S1567724917300053