آليات مكافحة الشيخوخة والعمر الأطول المرتبط بتقييد السعرات الحرارية: بيانات من دراسات الحيوانات المعدلة وراثيا.
من المعروف أن تقييد السعرات الحرارية (CR) يزيد من متوسط العمر المتوقع ويمنع التغيرات الفيزيولوجية المرضية المختلفة. CR يمنع إشارات هرمون النمو / عامل النمو الشبيه بالأنسولين و mTORC1 ، ينشط السرتوين ويعزز تنظيم الأكسدة الميتوكوندريا. لكن الآليات الدقيقة قيد المناقشة. في هذه المراجعة ، نناقش آليات CR باستخدام بيانات البحوث الحيوانية التي تم تعديلها وراثيًا وفقًا للتطورات الحديثة في التقنيات الجزيئية والجينية ، من حيث فرضية الاستجابة التكيفية التي اقترحها هوليداي في عام 1989. سنشرح أيضًا الآثار الإيجابية لـ CR ، المصنفة وفقًا لما إذا كانت تعمل في ظل ظروف غذائية أو صيامية.
في عام 1935 ، تم وصف CR لزيادة طول العمر في الفئران [1]. يستخدم CR ، المعروف أيضًا باسم تقييد النظام الغذائي أو تقييد الطاقة ، على نطاق واسع في أبحاث الشيخوخة كمعالجة غذائية قوية ويمكن استنساخها بسهولة لإطالة العمر. وقد لوحظ CR في العديد من الأنواع ، من الخميرة والديدان الخيطية إلى الثدييات. في الثدييات ، تمت دراسته بشكل رئيسي باستخدام القوارض حيث يقوم CR بقمع التغيرات الفيزيولوجية المرضية المرتبطة بالعمر ويطيل متوسط وأقصى عمر. ومع ذلك ، تختفي الآثار المفيدة ل CR في سلالات و / أو ظروف معينة. تفصل مراجعة حديثة هذه القيود [2]. تعتمد الدرجة التي يمارس فيها CR التأثيرات المفيدة على عوامل مثل أنواع القوارض ، والسلالات ، وتوقيت ظهور CR. بشكل عام ، ومع ذلك ، بدأ CR على المدى الطويل في سن مبكرة يقمع التغيرات الفيزيولوجية المرضية المرتبطة بالعمر ويطيل طول العمر في القوارض المختلفة. من المهم أيضًا أن قيود المغذيات الفردية (على سبيل المثال ، الجلوكوز والدهون والبروتين) دون تقييد الطاقة لا تسبب مثل هذه الآثار المفيدة [3 ، 4].
منذ أكثر من 20 عامًا ، وجد أن فئران Ames القزمة التي لديها طفرة في الجين Prop1 تعيش لفترة أطول من الفئران البرية [5]. كان هذا هو التقرير الأول الذي يشير إلى أن طفرة جينية واحدة أو تعديل جيني يمكن أن يمدد طول العمر في الثدييات. على حد علمنا ، يعيش أكثر من 40 من الفئران والفئران ذات الطفرة الجينية أو التعديل الجيني لفترة أطول من الحيوانات البرية. من بين هذه الفئران والجرذان ، يظهر ما يقرب من الثلث إشارات هرمون النمو (GH) / عامل النمو الشبيه بالأنسولين 1 (IGF1). بما أن CR يثبط أيضًا إشارات GH / IGF1 ، يمكن أن تستند التأثيرات المفيدة لـ CR على هذا. الآليات الجزيئية الأخرى التي تم اقتراحها لتنظيم التأثيرات المفيدة لـ CR تشمل تثبيط نشاط الهدف الميكانيكي لمركب rapamycin 1 (mTORC1) ، تنشيط البلعمة الذاتية ، تنشيط NAD + واستقلاب السرتوين ، وزيادة تنظيم الأكسدة الميتوكوندريا [6 ، 7]. ومع ذلك ، هذه الآليات ليست مفهومة بالكامل.
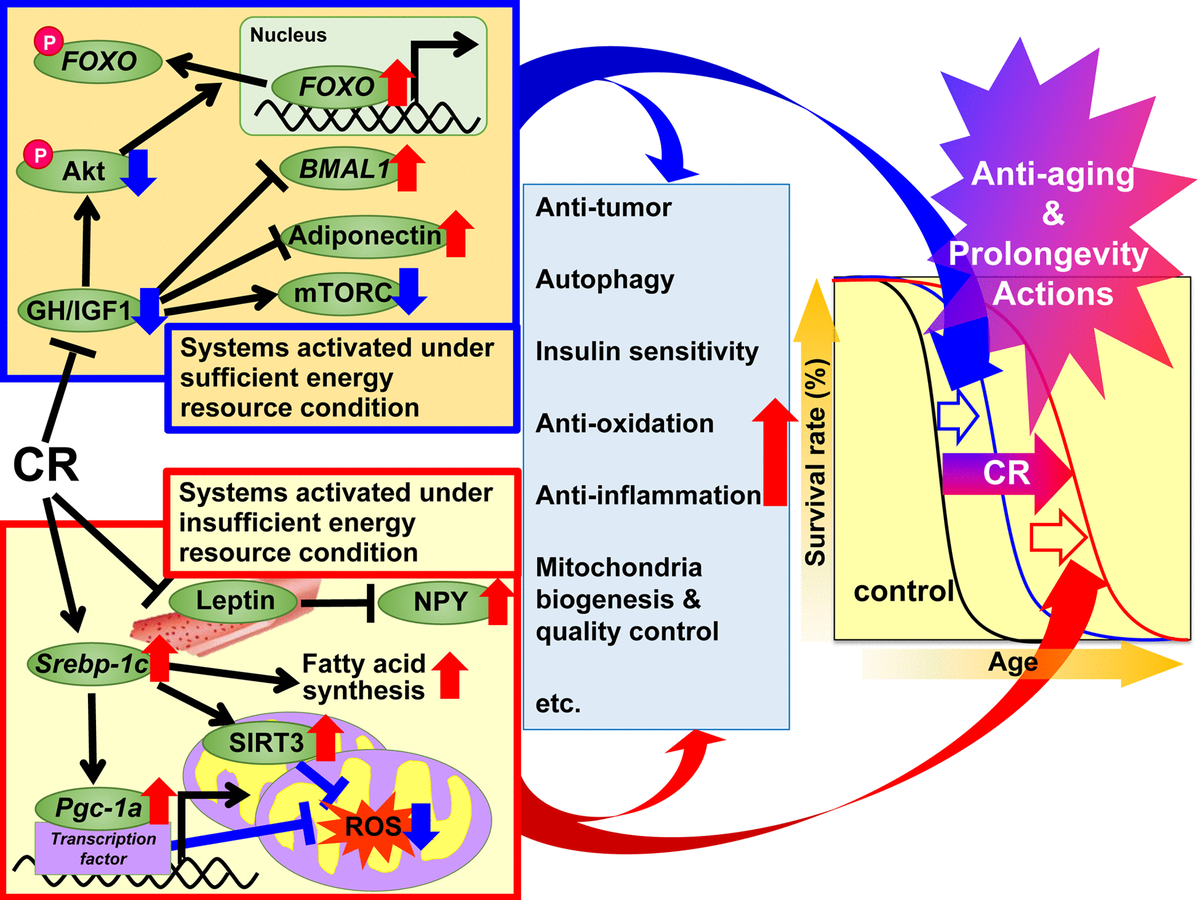 الشكل 1. آليات العمل المقترحة لتقييد السعرات الحرارية (CR) ضد الشيخوخة وزيادة العمر بناء على فرضية الاستجابة التكيفية. يقترح تقسيم الآليات التنظيمية CR إلى نظامين. يتم تنشيط النظام الأول في ظل ظروف طاقة كافية ، عندما يكون من الممكن استخدام الطاقة بحرية ، وتنمو الحيوانات بشكل جيد ، وتتكاثر أكثر وتخزن الطاقة الزائدة في شكل الدهون الثلاثية (TG) في الأنسجة الدهنية البيضاء (WAT) للاستخدام اللاحق. يتضمن هذا النظام هرمون النمو (GH) / عامل النمو الشبيه بالأنسولين 1 (IGF1) ، Akt ، FOXO ، mTORC ، adiponectin و BMAL1. يتم تنشيط النظام الثاني في ظروف الطاقة غير الكافية ، عندما لا تكون هناك فائدة من الاستخدام المفرط للطاقة ، وتقوم الحيوانات بقمع النمو والتكاثر واستخدام الطاقة الموفرة للحفاظ على الوظيفة البيولوجية. يتضمن هذا النظام مسارات الإشارات: بروتين SREBP-1c ، سيرتوين (SIRT) ، بروتين PGC-1α ، أنواع الأكسجين المتفاعلة الميتوكوندريا (ROS) ، لبتين و Neuropeptide Y (NPY) .. في الحيوانات التي بها CR ، تكون هذه الإشارات فعالة استخدام الطاقة. علاوة على ذلك ، يمكن أن تساهم الإشارات و / أو العوامل المختلفة في التأثيرات المفيدة المرتبطة بالتهاب المفاصل الروماتويدي ، بما في ذلك مضادات الأكسدة ومضادات الالتهاب ومضادات الأورام وغيرها من إجراءات CR بدرجات متفاوتة في كل نسيج أو عضو ، وبالتالي تؤدي إلى تجديد الحياة وإطالة العمر.
الشكل 1. آليات العمل المقترحة لتقييد السعرات الحرارية (CR) ضد الشيخوخة وزيادة العمر بناء على فرضية الاستجابة التكيفية. يقترح تقسيم الآليات التنظيمية CR إلى نظامين. يتم تنشيط النظام الأول في ظل ظروف طاقة كافية ، عندما يكون من الممكن استخدام الطاقة بحرية ، وتنمو الحيوانات بشكل جيد ، وتتكاثر أكثر وتخزن الطاقة الزائدة في شكل الدهون الثلاثية (TG) في الأنسجة الدهنية البيضاء (WAT) للاستخدام اللاحق. يتضمن هذا النظام هرمون النمو (GH) / عامل النمو الشبيه بالأنسولين 1 (IGF1) ، Akt ، FOXO ، mTORC ، adiponectin و BMAL1. يتم تنشيط النظام الثاني في ظروف الطاقة غير الكافية ، عندما لا تكون هناك فائدة من الاستخدام المفرط للطاقة ، وتقوم الحيوانات بقمع النمو والتكاثر واستخدام الطاقة الموفرة للحفاظ على الوظيفة البيولوجية. يتضمن هذا النظام مسارات الإشارات: بروتين SREBP-1c ، سيرتوين (SIRT) ، بروتين PGC-1α ، أنواع الأكسجين المتفاعلة الميتوكوندريا (ROS) ، لبتين و Neuropeptide Y (NPY) .. في الحيوانات التي بها CR ، تكون هذه الإشارات فعالة استخدام الطاقة. علاوة على ذلك ، يمكن أن تساهم الإشارات و / أو العوامل المختلفة في التأثيرات المفيدة المرتبطة بالتهاب المفاصل الروماتويدي ، بما في ذلك مضادات الأكسدة ومضادات الالتهاب ومضادات الأورام وغيرها من إجراءات CR بدرجات متفاوتة في كل نسيج أو عضو ، وبالتالي تؤدي إلى تجديد الحياة وإطالة العمر.الأهداف والآليات الجزيئية CR
إشارات GH و IGF1 و FOXO1
GH ينظم إنتاج IGF1 في الغالب في الكبد عبر مستقبلات GH (GHR). يعمل IGF1 على مستقبل IGF1 ومن ثم فوسفوريلات Akt ، كيناز سيرين / ثريونين في الخلايا المستهدفة. شكل الفوسفوريلات Akt ثم الفسفوريلات ينسخ عوامل FOXO ، مما يسهل التصدير النووي. لذلك ، فإن قمع إشارات GH / IGF1 يزيد نسبيًا التعبير عن العديد من الجينات التي يتم تنشيطها بواسطة عوامل النسخ FOXO.
تظهر العديد من أنواع الفأر المعدلة ، Ames dwarf و Snell dwarf و GHR knockout (GHR KO) ، إشارات GH منعت ولها عمر طويل. تتميز هذه الفئران القزمة بأنماط ظاهرية مماثلة لفئران CR ، بما في ذلك إشارات GH / IGF1 المكبوتة ، وانخفاض مستويات هرمون الغدة الدرقية ، والأنسولين والجلوكوز ، وانخفاض درجة حرارة الجسم ، وانخفاض السمنة. ومع ذلك ، يختلف ملف تعريف جينات الكبد بشكل كبير بين الفئران GHR KO والفئران CR [8]. ذكرنا أيضًا أن جزءًا من ملف تعريف التعبير الجيني في الأنسجة الدهنية البيضاء (WAT) لفئران CR يختلف اختلافًا كبيرًا عن ذلك الموجود في الفئران القزمة مدى الحياة التي تحمل GG transgens antisense [9].
بونكووسكي وآخرون. ذكرت أن CR يزيد من حساسية الأنسولين ويزيد متوسط العمر المتوقع في الفئران من النوع البري ، ولكن ليس في الفئران GHR KO [10]. لذلك ، اقترحوا أن تأثير زيادة عمر CR يعتمد على قمع إشارات GH / IGF1. في الفئران القزمة والجرذان القزمة التي تحمل الجينات المعدلة وراثيا المضادة للحساسية ، زاد CR من متوسط العمر المتوقع [11 ، 12]. تشير هذه البيانات إلى أنه يمكن تنظيم الإجراءات المضادة للشيخوخة وزيادة متوسط العمر المتوقع CR على حد سواء بشكل مستقل عن إشارة GH / IGF1 وبشكل مستقل.
تتكون عوامل نسخ FOXO في الثدييات من أربعة أشكال متشابهة ، أي FOXO1 و 3 و 4 و 6. تمتلك الفئران FOXO1 KO (مع خروج من هذا الجين) عمر CR ممتدًا ، ولكن لم يكن هناك تأثير مضاد للورم مرتبط CR [13]. على العكس ، في فئران FOXO3 KO ، أدت إضافة CR إلى تثبيط تكوين الورم ، ولكن لم تكن هناك زيادة ناتجة عن CR في فترة العمر [14]. قد تترافق هذه الاختلافات مع نمط التنشيط التفاضلي في الأنسجة و / أو خلايا الأشكال الإسوية الأربعة لعوامل النسخ التي يسببها CROX FOXO.
البروتين BMAL1 هو عامل نسخ يشارك في تنظيم الإيقاع اليومي. في الفئران BMAL1 KO (خرج من هذا الجين) ، زاد تناول الطعام ، وانخفض وزن الجسم ، وتسارع الأنماط الظاهرية الشيخوخة. في نفس الفئران ، لم يخفض CR مستويات الأنسولين و IGF1 ولم يزيد متوسط العمر المتوقع. مما يشير إلى مشاركة BMAL1 في التأثير المفيد لل CR ويؤثر هذا التأثير المفيد على إرسال إشارات GH / IGF1 [15].
إنذار mTOR
تم تحديد كيناز mTOR ، كيناز سيرين / ثريونين ، على أنه الجزيء المستهدف للراباميسين. يتكون من مجمعين منفصلين متعدد البروتينات ، يعرف باسم mTORC1 و mTORC2. من المعروف أن MTORC1 يتم تنشيطه بواسطة الأحماض الأمينية وعوامل النمو (مثل الأنسولين و IGF1). تنشيط mTORC1 يعزز تخليق البروتين عبر كيناز بروتين الريبوزوم S6 1 ، تخليق الأحماض الدهنية عن طريق بروتين الربط التنظيمي الستيرويدي (SREBP) 1 ، وتمايز الخلايا الشحمية بواسطة مستقبلات منشط البيروكسيزوم (PPARγ). يمنع mTORC1 البلعمة الذاتية والتوليف الحيوي لليزوزومي من خلال عامل النسخ EB (TFEB). إن وظيفة mTORC2 غير مفهومة جيدًا ، ولكن يُعتقد أنها تشمل زيادة الإجراءات الابتنائية وقمع الإجراءات التقويضية ، مثل mTORC1 [16].
أعطيت الفئران تنظيم سلبي للراباميسين mTORC1 لفترة طويلة بعد منتصف العمر زيادة في متوسط العمر المتوقع [17]. وفقًا لهذا الاكتشاف ، تعيش الفئران المعدلة وراثيًا مع التعبير الزائد عن بروتين TSC1 ، الذي ينظم سلبيًا mTORC1 ، أطول من الفئران البرية [18]. بالإضافة إلى ذلك ، عاودت الفئران بالضربة القاضية مع بروتين كينوز S6 1 وفئران متحولة mTOR فترة أطول من الفئران البرية [19 ، 20].
على حد علمنا ، لم يتم دراسة التأثيرات المفيدة لـ CR في الفئران مع وظيفة mTORC1 المعيبة. ومع ذلك ، في الخميرة مع تثبيط وراثي ، لم يزيد mTOR CR عمر [21]. يتم تعزيز البلعمة الذاتية عن طريق تثبيط mTORC1. في الديدان الخيطية ناقصة في الجينات المرتبطة بالبلعمة الذاتية ، لم يزيد CR من العمر الافتراضي [22]. استنادًا إلى هذه البيانات ، من المحتمل أن يرتبط انخفاض نشاط mTOR وتفعيل جهاز البلعمة الذاتية بتأثير إيجابي لـ CR.
Sirtuins
تم اكتشاف Sir2 كجينة جديدة تشارك في قمع النسخ في الخميرة. بعد ذلك ، أفيد أنه يلعب دورًا رئيسيًا في إطالة العمر في CR [23 ، 24]. تم تحديد سبعة جينات سرتوين لتقويم العظام ، sirtuins Sirt1 - Sirt7 ، في الثدييات. يتم تحديد البروتينات SIRT1 و 6 و 7 بشكل أساسي في النواة ، و SIRT2 في النواة والسيتوبلازم ، و SIRT 3 و 4 و 5 بشكل رئيسي في الميتوكوندريا. تعمل Sirtuins على تحفيز تفاعلات نزع الأمينات من بروتينات مختلفة ، بما في ذلك الهستونات ، اعتمادًا على NAD [25].
من بين سبعة sirtuins الثدييات ، تم الإبلاغ عن SIRT1 و 3 و 6 للمشاركة في الفيزيولوجيا المرضية المرتبطة بالعمر وتنظيم العمر [26]. الفئران المعدلة وراثيا التي تم فيها زيادة إفراز البروتين SIRT1 بشكل انتقائي في الخلايا العصبية تحت المهاد لها عمر أطول من الفئران البرية. [27]. كان لدى الفئران المعدلة وراثيا التي تم فيها زيادة إفراز بروتين SIRT6 عمر أطول من الفئران البرية [28]. في الفئران المسنة ، زاد CR من تعبير SIRT6 وحسّن الفشل الكلوي لمدة 6 أشهر. بالإضافة إلى ذلك ، في حين أن الإفراط في التعبير عن SIRT6 يقمع شيخوخة الخلايا عن طريق تقليل نشاط عامل النسخ المرتبط بالالتهاب NF-κB ، فإن تسارع خروج المغلوب SIKT6 يسرع شيخوخة الخلية [29]. في الفئران SIRT3 KO ، لوحظت سابقًا العديد من الأمراض المرتبطة بالعمر [30]. على الرغم من أن CR منع فقدان السمع المرتبط بالعمر في الفئران من النوع البري ، لم يلاحظ هذا التأثير في SIRT3 KO الفئران [31].
عامل النسخ NRF2
يرتبط NRF2 بعناصر الاستجابة المضادة للأكسدة للحث على التعبير عن الجينات المستهدفة استجابة للإجهاد التأكسدي ويعزز التعبير عن الجينات المشاركة في الاستجابات المضادة للأكسدة وإزالة السموم. في الظروف الفسيولوجية ، يرتبط NRF2 ببروتين Keap1 في السيتوبلازم ، حيث يتحلل. تحت الضغط ، بما في ذلك الإجهاد التأكسدي ، بعد أن يتم التقاط Keap1 بواسطة p62phosphorylated ، ينتقل NRF2 إلى النواة ، ويرتبط بعناصر الاستجابة المضادة للأكسدة ، وينشط نسخ الجينات المضادة للأكسدة [32].
بما أن التعبير عن NRF2 ينخفض مع الشيخوخة في القوارض ، فمن المفترض أن مستويات أنواع الأكسجين التفاعلية ومخاطر السرطان المختلفة تزداد. ومع ذلك ، فإن CR يمنع الانخفاض المرتبط بالعمر في القدرة المضادة للأكسدة عن طريق زيادة التعبير عن الجينات المشاركة في مضادات الأكسدة وإزالة السموم. في الديدان الخيطية ، لا غنى عن Skn-1 ، وهو تجانس NRF2 ، لعمل CR لزيادة عمرها. تظهر الفئران بالضربة القاضية NRF2 انخفاضًا في التعبير عن الجينات المشاركة في الاستجابة المضادة للأكسدة وإزالة السموم ، مما يؤدي إلى تسارع تكوين الأورام. تم التحقيق في دور NRF2 في الآثار المفيدة ل CR باستخدام الفئران NRF2 KO. أظهرت النتائج أن NRF2 مهم للتأثير المضاد للورم من CR ، لكنه لا يشارك في التأثيرات المرتبطة بالعمر المتوقع وزيادة حساسية الأنسولين CR [33].
Neuropeptide Y (NPY)
في الثدييات ، الخلايا العصبية في النواة المقوسة تحت المهاد تستشعر حالة الطاقة من مستويات الدورة الدموية الهرمونية. يزيد توازن الطاقة السلبية المرتبط بـ CR والانخفاض اللاحق في كتلة الدهون من دوران مستويات الغريلين والأديبونيكتين ويقلل من مستويات لبتين الدم والأنسولين و IGF1. تعمل هذه التغيرات الهرمونية على تنشيط الخلايا العصبية NPY في النواة المقوسة تحت المهاد. معظم هذه الخلايا العصبية توليف بروتين Agrp ، مما يضعف نشاط الخلايا العصبية POMC في النواة المقوسة. يمنع التغيير في نشاط الخلايا العصبية الأولية الخلايا العصبية الثانوية التي تفرز هرمون السوماتوتروبين والجونادوتروبين والهرمون المطلق للثيروتروبين وتنشط الخلايا العصبية التي تفرز هرمون الإفراج عن الكورتيكوتروبين. يمنع هذا التغيير تحت المهاد إشارات GH / IGF1 ، ووظيفة الغدة الدرقية ، والتكاثر وينشط وظيفة الكورتيزون. لوحظ معظم هذه الإفرازات العصبية المعدلة في الفئران والجرذان مع CR [34].
في NPY KO طرقت الفئران ، لم تضيف إضافة CR متوسط العمر المتوقع ، وتسببت في تحمل الإجهاد التأكسدي في الكبد ، وغيرت ملف إفراز الخلايا العصبية. ومع ذلك ، انخفض CR مستويات الأنسولين في الدم و IGF1 ، وزاد مستويات الأديبونيكتين والكورتيكوستيرون في الدم ، وقلل التعبير عن الجينات المشاركة في أكسدة بيتا في الكبد. وبالتالي ، يجب أن يكون NPY عاملاً رئيسيًا مرتبطًا بإجراءات CR المستقلة GF / IGF1 [35].
طفرة الحمض النووي للميتوكوندريا (mtDNA)
ويعتقد أن تراكم طفرات mtDNA هو أحد العوامل الرئيسية في الأمراض المرتبطة بالعمر. تحمل الفئران PolgA D257A / D257A طفرة في جاما mtDNA polymerase وتظهر تطورًا سابقًا للتراكم المرتبط بالعمر لطفرات mtDNA والأنماط الظاهرية للعمر في الأنسجة المختلفة [36]. في الفئران PolgA ، لم يمدد D257A / D257A CR العمر الافتراضي ، ولم يؤثر على تراكم حذف mtDNA في العضلات الهيكلية ، ولم يحسن وظيفة القلب ، وساهم ذلك في تسمم الدم. تشير هذه البيانات إلى أن تراكم طفرات mtDNA يمكن أن يمنع الآثار المفيدة لـ CR [37].
نتائجنا الجديدة: إعادة تشكيل الأنسجة الدهنية CR
السمنة الحشوية المصاحبة لمرض السكري وفرط شحميات الدم وارتفاع ضغط الدم ، والمعروفة مجتمعة باسم "متلازمة التمثيل الغذائي" ، هي عامل خطر معروف لتطور أمراض تصلب الشرايين التي تهدد الحياة ، بما في ذلك احتشاء عضلة القلب واحتشاء دماغي. تم وصف الأنسجة الدهنية ، التي كان يُعتقد في الأصل أنها مرتبطة فقط بوظيفة الطاقة ، مؤخرًا على أنها عضو الغدد الصماء التي تفرز جزيئات نشطة بيولوجيًا مختلفة تسمى الأديبوكينات. تزيد الخلايا الشحمية الكبيرة التي تتراكم الدهون الثلاثية (TG) بشكل مفرط من إفراز الأديبوكينات الالتهابية ، بما في ذلك عامل نخر الورم α (TNF-α) وإنترلوكين 6 (IL-6) ، وتقلل إفراز الأديبونيكتين مقارنة بالخلايا الدهنية الصغيرة ، التي تتراكم أقل TG. وتشارك ملفات إفراز الأديبوكين مباشرة في الأمراض المرتبطة بالعمر ، بما في ذلك مقاومة الأنسولين وارتفاع ضغط الدم وتصلب الشرايين [38]. بالإضافة إلى ذلك ، تم الإبلاغ عن الأنسجة الدهنية والأديبوكينات مؤخرًا باعتبارها لاعبين رئيسيين في تنظيم العمر. على سبيل المثال ، أظهرت الفئران المصابة بالضربة القاضية لمستقبلات الأنسولين في الخلايا الشحمية انخفاضًا في السمنة ، وزيادة في التكون الحيوي للميتوكوندريا ، وعمر أطول من الفئران البرية [39]. أظهرت الفئران المعدلة وراثيا مع الإفراط في التعبير عن الأديبونيكتين في الكبد بقاء أكبر من السيطرة [40]. وتشارك عوامل النسخ PPARγ و CCAAT / بروتينات ربط المحسن α (C / EBPα) و β (C / EBP involved) في تمايز الخلايا الشحمية. أظهرت الفئران مع تحلل الجين C / EBPβ في موضع C / EBP تكوين حيوي محسن للميتوكوندريا وعمر أطول [41]. في المقابل ، طرحت PPARγ KO الفئران التي لها عمر أقصر من تلك التي تسيطر عليها [42].
تم الإبلاغ عن CR لزيادة الشكل النشط للأديبونيكتين في الفئران في أي عمر. يعتمد هذا التنظيم المرتبط بـ CR للأديبونيكتين على إشارات GH / IGF1 [43 ، 44]. قمنا بتحليل التغيير المرتبط CR في الترتيب الزمني وحصلنا على النتائج التالية. زاد CR التعبير عن الجينات و / أو البروتينات المشاركة في التخليق الحيوي للأحماض الدهنية (FA) والتكوين الحيوي للميتوكوندريا في الأنسجة الدهنية بعد المرحلة المبكرة من CR. حدث التغيير المرتبط بـ CR في الغالب في الأنسجة الدهنية منه في الأنسجة أو الأعضاء الأخرى. بعد ذلك ، حدثت تغييرات شكلية ، بما في ذلك انخفاض في حجم الخلايا الشحمية والتغيرات الأيضية في الكبد [45]. لتوضيح التغيرات الأيضية المتعلقة CR في الأنسجة الدهنية التي تحدث بشكل مستقل عن إشارة GH / IGF1 ، قمنا بعد ذلك بمقارنة ملف تعريف الجين لـ CR في الأنسجة الدهنية للجرذان من النوع البري مع الفئران المعدلة وراثيًا مع إعطاء libitum (AL). أظهرت نتائجنا أن CR يعزز التعبير عن الجينات المشاركة في التخليق الحيوي للأحماض الدهنية ، على وجه الخصوص ، في عامل النسخ الرئيسي للتركيب الحيوي للأحماض الدهنية ، الجينات التنظيمية SREBP-1 ، بشكل مستقل عن GH / IGF1 [9].
لذلك ، قارنا بعد ذلك تأثير CR مع معلمات مختلفة ، بما في ذلك العمر بين الفئران المعطلة SREBP-1c KO والفئران من النوع البري. كان لدى SREBP-1c KO عمر أقصر قليلاً من الفئران البرية. في الفئران من النوع البري مع عمر طويل ، زاد CR من التعبير عن البروتينات المشاركة في التركيب الحيوي للأحماض الدهنية والتكوين الحيوي للميتوكوندريا والضغط التأكسدي المكبوت. وقد لوحظت معظم هذه التغييرات بشكل رئيسي في الأنسجة الدهنية ، وليس في الأنسجة الأخرى. في المقابل ، لم يلاحظ تمديد الحياة المرتبطة CR وتغيرات الأنسجة الدهنية في الفئران SREBP-1c KO. تم الإبلاغ عن بروتين PGC-1α ليكون منظمًا رئيسيًا للتكوين الحيوي للميتوكوندريا الناجم عن CR [46]. لاحظنا أن SREBP-1c يرتبط بالمحفز لجين Pgc-1α ، مما يشير إلىأن SREBP-1c ينظم مباشرة نسخ Pgc-1α [47]. علاوة على ذلك ، أظهرت نتائج تحليل البروتين من الأنسجة الدهنية أن CR ينشط دورة البيروفات / malate [48]. في الواقع ، تم الإبلاغ عن CR لتنشيط التخليق الحيوي للحمض الدهني في الأنسجة الدهنية ، ولكن ليس في الكبد [45]. تشير هذه البيانات إلى أن الفئران SREBP-1c KO لا يمكنها استخدام الدهون بكفاءة في ظروف CR. وبالتالي ، لا يمكن أن تعمل الأنسجة الدهنية كنسيج لتخزين الطاقة فحسب ، بل يمكنها أيضًا أن تلعب دور تحويل الجلوكوز إلى حمض دهني أكثر كثافة في استخدام الطاقة عبر SREBP-1c تحت ظروف CR.ولكن ليس في الكبد [45]. تشير هذه البيانات إلى أن الفئران SREBP-1c KO لا يمكنها استخدام الدهون بكفاءة في ظروف CR. وبالتالي ، لا يمكن أن تعمل الأنسجة الدهنية كنسيج لتخزين الطاقة فحسب ، بل يمكنها أيضًا أن تلعب دور تحويل الجلوكوز إلى حمض دهني أكثر كثافة في استخدام الطاقة عبر SREBP-1c تحت ظروف CR.ولكن ليس في الكبد [45]. تشير هذه البيانات إلى أن الفئران SREBP-1c KO لا يمكنها استخدام الدهون بكفاءة في ظروف CR. وبالتالي ، لا يمكن للنسيج الدهني أن يعمل فقط كأنسجة لتخزين الطاقة ، ولكن يمكنه أيضًا لعب دور تحويل الجلوكوز إلى حمض دهني أكثر كثافة في استهلاك الطاقة عبر SREBP-1c تحت ظروف CR.CR
في عام 1989 ، أوضح هوليدي آثار مكافحة الشيخوخة ومتوسط العمر المتوقع من CR من وجهة نظر تطورية للكائنات التي طورت أنظمة استجابة تكيفية لزيادة البقاء على قيد الحياة خلال فترات نقص الغذاء [49 ، 50]. بناءً على وجهة النظر التطورية هذه ، قمنا بتقسيم الإجراءات المفيدة للعلاقات العامة إلى نظامين ؛ "الأنظمة التي يتم تنشيطها في ظل ظروف كافية من موارد الطاقة" و "الأنظمة التي تعمل في ظل ظروف غير كافية من موارد الطاقة". يتم تنشيط الأول في الجسم الحي ، والذي يوفر للحيوانات استخدامًا مجانيًا للطاقة من خلال توفير تغذية وفيرة. وبعبارة أخرى ، عندما يكون هناك الكثير من الطعام للاستخدام المجاني للطاقة ، تنمو الحيوانات بشكل جيد ، وتتكاثر أكثر وتخزن الطاقة الزائدة مثل TG في الأنسجة الدهنية لاستخدامها لاحقًا.ولكن ليس كثيرًا لدرجة أنهم يعانون من السمنة. يتم تنشيط النظام الثاني في البيئة الطبيعية ، والذي لا يسمح بالاستخدام المجاني للطاقة بسبب نقص الغذاء. وبعبارة أخرى ، عندما لا تكون هناك فائدة من الاستخدام الحر للطاقة ، فإن الحيوانات تقمع النمو والتكاثر وتستخدم الطاقة المحفوظة من النمو والتكاثر للحفاظ على الوظيفة البيولوجية. التكيف مع التغيرات البيئية الطبيعية هو أولوية قصوى لبقاء الحيوان.تمنع الحيوانات النمو والتكاثر وتستخدم الطاقة المحفوظة من النمو والتكاثر للحفاظ على الوظيفة البيولوجية. التكيف مع التغيرات البيئية الطبيعية هو أولوية قصوى لبقاء الحيوان.تمنع الحيوانات النمو والتكاثر وتستخدم الطاقة المحفوظة من النمو والتكاثر للحفاظ على الوظيفة البيولوجية. التكيف مع التغيرات البيئية الطبيعية هو أولوية قصوى لبقاء الحيوان.بناءً على فرضية الاستجابة التكيفية والنتائج الأخيرة المذكورة أعلاه ، نقترح مجموعة من الآليات للتأثيرات المفيدة لل CR.نظرًا لأن ظروف CR التجريبية يمكن أن تحاكي ظروف طاقة غير كافية ، افترضنا أن CR يقمع "الأنظمة التي تم تنشيطها في ظل ظروف طاقة كافية" وينشط "الأنظمة التي يتم تنشيطها في ظل ظروف طاقة غير كافية" ويحث بشكل إضافي على إجراءات مكافحة الشيخوخة وزيادة العمر الافتراضي. تتضمن المجموعة الأولى من الأنظمة إشارات GH / IGF1 و FOXO و mTORC و adiponectin و BMAL1 ، ويبدو أن CR يثبط هذه التفاعلات الابتنائية. تتضمن المجموعة الثانية من الأنظمة الإشارات SREBP-1c / mitochondria و SIRT و NPY ، وربما ينشط CR هذه التفاعلات للاستخدام الأمثل لموارد الطاقة غير الكافية. علاوة على ذلك ، يمكن للإشارات و / أو العوامل المختلفة أن تساهم في التأثيرات المضادة للشيخوخة وإطالة عمر CR بدرجات متفاوتة مع مضادات الأكسدة ومضادات الالتهاب ،مضاد للورم وأفعال أخرى في الأنسجة المختلفة.فيما يتعلق بنماذج التدخل الغذائي ، لم يتم تطبيق CR فقط ، ولكن أيضًا تقييد الطاقة المتقطع (IER) وتقييد وقت التغذية (TRF) [2]. يشمل IER عادة الصوم كل يومين أو 2-3 أيام في الأسبوع. عادة ما ينطوي TRF ، الذي هو أكثر شيوعًا في أبحاث السمنة من أبحاث علم الأحياء الحيوية ، على الحد من الوصول إلى الطعام (عالي الدهون) لعدة ساعات في اليوم. تتشابه الآثار المفيدة التي تسببها IER أو TRF جزئيًا مع تلك التي يسببها CR. ومع ذلك ، على حد علمنا ، لم تستخدم أي دراسات خطط بحثية صارمة ، بما في ذلك جداول التغذية ، لمقارنة التدخلات الغذائية الثلاثة. لذلك ، قد تكون هناك حاجة لدراسات مقارنة CR و IER و TRF في المستقبل.الآفاق
تظهر الدراسات التي تستخدم القرود أن التأثيرات المفيدة لمرض CR يمكن أن تحدث أيضًا في البشر والثدييات الأخرى [51]. تركز دراسات CR الحالية على موضوعين ، وهما ، تحديد الآليات الجزيئية ل CR ، وكذلك على تطوير الاستعدادات المحاكاة ل CR. نعتقد أن تطوير عقاقير جديدة تعمل مثل CR يمكن أن يكون صعبًا دون فهم الآليات الجزيئية لـ CR. لتطوير مثل هذه الأدوية التي تنطبق على البشر ، هناك حاجة إلى مزيد من الدراسات للآليات الجزيئية ل CR ، وخاصة في الرئيسيات. في هذا التقرير ، نقترح تصنيف ومناقشة الآليات الجزيئية للتأثيرات المفيدة لشيكا اعتمادًا على ما إذا كانت تعمل في ظروف موارد الطاقة الغنية أو غير الكافية. يجب أيضًا أن تأخذ الدراسات الإضافية للآليات الجزيئية لفوائد CR في الاعتبارمدى مساهمة الإشارات / العوامل المعنية في الإجراءات المضادة للأكسدة والمضادة للالتهابات والمضادة للورم وغيرها من CR في كل نسيج أو عضو ، وبالتالي تؤدي إلى تجديد الشباب وزيادة العمر المتوقع. تظهر الدراسات على الحيوانات المعدلة وراثيًا والتي تركز على أحد النظامين المذكورين أعلاه اختلافات في درجة التأثيرات التي يسببها CR في الفئران ذات الأصل المختلف وتلك التي تقارن التأثيرات المفيدة لل CR مع عوامل IER أو TRF ستساعد ليس فقط في توضيح الآليات الجزيئية الإضافية لل CR ولكن أيضًا تلك المتعلقة بمتوسط العمر المتوقع.وبالتالي تؤدي إلى التجديد وزيادة متوسط العمر المتوقع. تظهر الدراسات على الحيوانات المعدلة وراثيًا والتي تركز على أحد النظامين المذكورين أعلاه اختلافات في درجة التأثيرات التي يسببها CR في الفئران ذات الأصل المختلف وتلك التي تقارن التأثيرات المفيدة لل CR مع عوامل IER أو TRF ستساعد ليس فقط في توضيح الآليات الجزيئية الإضافية لل CR ولكن أيضًا تلك المتعلقة بمتوسط العمر المتوقع.وبالتالي تؤدي إلى التجديد وزيادة متوسط العمر المتوقع. تظهر الدراسات على الحيوانات المعدلة وراثيًا والتي تركز على أحد النظامين المذكورين أعلاه اختلافات في درجة التأثيرات التي يسببها CR في الفئران ذات المنشأ المختلف وتلك التي تقارن التأثيرات المفيدة لل CR مع عوامل IER أو TRF ستساعد ليس فقط في توضيح الآليات الجزيئية الإضافية لل CR ولكن أيضًا تلك المتعلقة بمتوسط العمر المتوقع.التي تتعلق بمتوسط العمر المتوقع.التي تتعلق بمتوسط العمر المتوقع.من إعداد أليكسي رزيشيفسكي.المصدر:
Hoshino S ، Kobayashi M ، Higami Y. آليات التأثيرات المضادة للشيخوخة وإطالة العمر للحد من السعرات الحرارية: أدلة من دراسات على الحيوانات المعدلة وراثيا. الشيخوخة (ألباني نيويورك). 2018 سبتمبر 16.