يميل الباحثون إلى إيلاء المزيد والمزيد من الاهتمام للعمليات الالتهابية في الدماغ في الأمراض التنكسية ، سواء في دور السبب الجذري أو في دور العامل الثانوي الناجم عن تلف الأنسجة العصبية. قد يتحول الالتهاب العصبي إلى العمليات المركزية في شيخوخة الجسم.
من الصعب جدًا تحديد الالتهاب العصبي في سياق الأمراض العصبية التنكسية ، على سبيل المثال ، مع التصلب المتعدد (مرض مناعي ذاتي لا علاقة له بالتصلب المنزلي) هذا ليس صعبًا. في الحالة الأخيرة ، تخترق الخلايا اللمفاوية والخلايا الأحادية الزائدة ما وراء الحاجز الذي يفصل النسيج العصبي عن مجرى الدم ، مما يتسبب في خلل وظيفي.
مع الأمراض التي تشمل مرض الزهايمر ، والذي ربما تعرفه من حالة الكاتب تيري براتشيت قبل وفاته ، مرض باركنسون ، الذي عانى منه الرسام سلفادور دالي في سنواته الأخيرة ، التصلب الجانبي الضموري ، والذي أصبح معروفًا فيما يتعلق بحالة الفيزيائي ستيفن هوكينج ، يتم تنفيذ الوصف وفقًا للتفاعل ، معبرًا عنه في تغيير شكل وبنية الخلايا الدبقية - الخلايا النجمية والدبق الصغير. تظهر العديد من هذه الأمراض في سن أكبر ، وترتبط بالشيخوخة وربما تسببها. يمكن أن يؤدي فهم الالتهاب العصبي وأسبابه وعواقبه إلى تحسين علاج العديد من الأمراض ، والتي يتم علاج بعضها فقط من خلال الأعراض.
لفهم ظاهرة الالتهاب العصبي ، تحتاج أولاً إلى فهم ما هو الالتهاب. يبلغ عمر السؤال المقترح أكثر من 2000 عام ، لكن تعريف الالتهاب ، الذي سيقود العلماء والأطباء في جميع أنحاء العالم إلى توافق في الآراء ، لم يتم اقتراحه بعد.
ما هو الالتهاب؟
"Rubor، et tumor، cum calore et dolore." احمرار وتورم بالحمى والألم - هكذا يصف الطبيب الروماني القديم كورنيليوس سيلسوس الالتهاب. يفتقر هذا التعريف إلى التفاصيل الهامة التي أوضحها زميله الجراح جالينوس بعد حوالي 100 عام من سلفه - functio laesa أو ضعف الوظيفة.
معا ، هذه العلامات الخمس الموصوفة تنقل باختصار جوهر مظاهر الالتهاب ، وفي شكل لم يتغير تقريبا يصل إلى أيامنا. طلاب الطب لا يزالون أول شيء يتذكرون إعصار اللسان اللاتيني عند الإجابة على الامتحان.
لكن هذا التعريف لا يناسبنا بشكل قاطع ، لأنه لا يقول أي شيء عن آليات تطور علم الأمراض وسببه. مع الكشف عن تفاصيل هذا الأخير ، كان على علماء الفسيولوجيا العبث. يتذكر التاريخ العديد من النظريات التي كانت تتعلق في المقام الأول بدور الأوعية الدموية في تطور الالتهاب ، ومع ذلك ، ظهر فهم أكثر أهمية بعد لفت إيليا مشنيكوف الانتباه إلى الخلايا واستمد تعريفه:
"يجب اعتبار الالتهاب بأكمله رد فعل بلعم للجسم ضد الشخصيات المزعجة ؛ يتم تنفيذ هذا التفاعل إما عن طريق تحريك الخلايا البلعمية بمفردها ، أو بعمل الخلايا البلعمية الوعائية أو الجهاز العصبي ".
كانت الخلايا البالعة ، الخلايا القادرة على امتصاص وتدمير الجزيئات الأجنبية الضارة ، هي المحور الرئيسي لعمل Mechnikov. وبناءً على ذلك ، كان السبب الرئيسي لانتقاد تعريفه هو عدم الاعتراف بدور البروتينات المذابة في سوائل الجسم ، والتي ، كما هو معروف الآن ، لها تأثير كبير على العملية. لقد أعجبنا بهذا التعريف بسبب ذكر الجهاز العصبي ، دع Mechnikov وإضافته فقط للتعرف على التنظيم العصبي لجدار الأوعية الدموية ، والذي يعدل أيضًا مسار الالتهاب.
مع تعريف الالتهاب العصبي ، الأمور سيئة حقًا. إذا فتحت ويكيبيديا ، يمكنك معرفة أن "التهاب العصب العصبي هو التهاب في النسيج العصبي". هنا مثل هذه الدورة في definiendo ، وهو خطأ منطقي يتم فيه استنتاج العبارة من نفسها.
رابطيمكن العثور على تعريف مثير للاهتمام في العمود التحريري لعلم الأعصاب الكيميائي ACS ، والذي يعرف الالتهاب العصبي على أنه عمليات الخلايا غير المستقلة التي تسبب موت الخلايا ، أو خلل وظيفي ، أو استعادة الخلايا العصبية والخلايا قليلة التغصُّن خلال مرض تنكس عصبي.
"العمليات غير الخلوية المستقلة التي تملي موت خلايا الجهاز العصبي المركزي ، أو خلل وظيفي ، أو الشفاء للخلايا العصبية والخلايا قليلة التغصُّن خلال مسار الأمراض التنكسية العصبية."
رابطهذا تعريف جيد للغاية ، يصف الجوانب الجيدة والسيئة من التهاب العصب العصبي ، ومع ذلك فإنه يقصر هذه العملية على نطاق مرض الأعصاب. فماذا يحدث قبل أن يلاحظ الشخص الزهايمر أو الشلل الرعاش ، لا يمكن أن يكون لديه التهاب في دماغه؟
لهذا ، لا تزال مسألة التعريف مفتوحة. النظر في الحقائق وتفسير البحث في هذا المجال.
لماذا الالتهاب ضروري؟
إذا لم يكن هناك تجديد ، فستكون الحياة مستحيلة.
إذا تجدد كل شيء ، سيكون الموت مستحيلاً.
"إذا لم يكن هناك تجديد ، لن تكون هناك حياة.
إذا تجدد كل شيء فلن يكون هناك موت ".
- ريتشارد جوس
ما هو جوهر الالتهاب؟ صديق أم عدو؟ - صديق أم عدو؟ - كما تكتب المنشورات العلمية الدولية وبوابات العلوم الشعبية في رغبتها في إيصال القارئ إلى تعقيد العمليات الجارية للظاهرة الموصوفة.
الهدف الرئيسي لعملية مثل الالتهاب هو إبلاغ الجسم بأي ضرر أو كسر. والهيئة بالفعل "يجب أن تتخذ قراراً وتتصرف وفقاً لذلك". في معظم الأحيان ، يتم اتخاذ هذا القرار من قبل تعاونية من الخلايا المناعية المحلية والجهازية ، والتي تزيل أولاً العامل الضار ، ثم تستعيد بشكل جماعي التوازن في الأنسجة المصابة بقدر نجاحها.
تأخذ الأحداث مثل هذا المنعطف ، على سبيل المثال ، مع الأضرار المؤلمة للأنسجة العصبية. في اللحظات الأولى بعد مجموعة من الظروف المؤسفة أو العمل المختبري المخطط له في الفقاريات ، هناك موت هائل للخلايا المتضررة من الصدمة.
الموجة الأولى من موت الخلايا بسبب النخر واستماتة الخلايا (انتحار الخلية المبرمج الذي تعرض لإصابات لا تتوافق مع الحياة) تنحسر بعد بضع ساعات ، تليها موجة ثانية أطول ، ربما بسبب عمل منتجات الاضمحلال على الأنسجة المحيطة. في هذه الحالة ، يمكن إزعاج تفاعل الأنسجة العصبية والأوعية الدموية ، ونتيجة لذلك تحدث انقطاعات في إمدادات الطاقة والأيونات والمواد الضرورية.
يحدث تنشيط الخلايا الدبقية الصغيرة استجابةً للضرر على الفور. تؤدي الخلايا الميكروية ، هذه البلاعم الصغيرة ، مباشرة "رد الفعل البلعم للجسم ضد الأشكال المزعجة" ، كما وصفه Mechnikov.
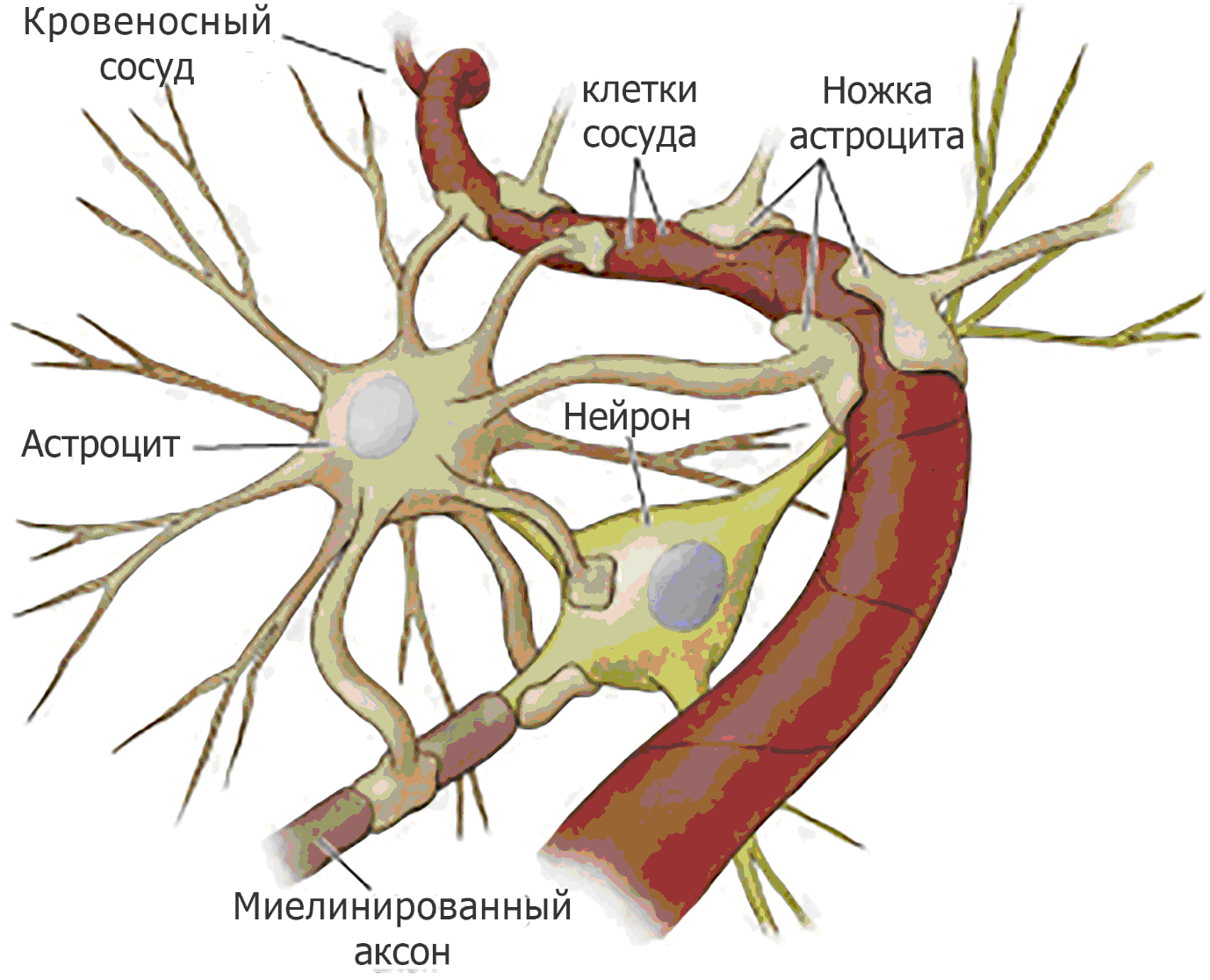 تمثيل تخطيطي لخلية نجمية وخلايا عصبية بالقرب من الأوعية الدموية
تمثيل تخطيطي لخلية نجمية وخلايا عصبية بالقرب من الأوعية الدمويةويقومون باستمرار بفحص المنطقة المحيطة بحثًا عن المواد التي قد تشير إلى تلف الخلايا العصبية أو تهدد سلامتها. في غياب إشارات الخطر هذه ، يتم كبت نشاط البلاعم في الأنسجة العصبية بواسطة الببتيدات التي تفرزها الخلايا العصبية ، والتي لا تهددها. خلاف ذلك - عند حدوث إصابة - يتم تنشيط الخلايا الدبقية الصغيرة في غضون دقائق! ينعكس هذا في شكلها ووظيفتها. تصبح الخلايا أكثر حركة ، ويمكن أن تبدأ في الانقسام ، وتعرض العديد من المستقبلات على الغشاء الخارجي لتقييم أكثر دقة للحالة. عند تفعيلها ، تقوم بإخراج البروتينات والكيميوكينات المكملة في الفضاء بين الخلايا ، والتي تجذب المزيد من الخلايا المناعية ، السيتوكينات التي تتسبب في استجابة الجيران للحالة ، والإنزيمات المحللة للبروتين لتحطيم بروتينات المصفوفة خارج الخلية ، وزيادة مساحة المناورة ، بالإضافة إلى الأشكال النشطة الأكسجين والنيتروجين من أجل نشر إشارة الخطر.
رابطالخلايا النجمية ليست بعيدة عن نظيراتها الدبقية. كونها ممثلة بأكبر فئة في عدد الخلايا في الجهاز العصبي المركزي ، فإنها تحتل موقعًا استراتيجيًا بين الخلايا البطانية للأوعية الدموية والخلايا العصبية ، وتنظيم عمل الحاجز بين الدم والدماغ. بعد الإصابة ، يستجيبون إما لإشارات الخطر التي تأتي من الخلايا العصبية ، أو للمواد التي تطلقها الخلايا الدبقية المنشطة. ثم تزيد الخلايا النجمية في الحجم ، تضخم ، إطلاق الببتيدات التنظيم العصبي ، على سبيل المثال ، BDNF (عامل التغذية العصبية المشتقة من الدماغ) أو عامل التغذية العصبية في الدماغ ، مما يساهم في بقاء الخلايا العصبية التالفة. كما أنها تنتج وتفرز البروتينات الليفية التي تعيد المصفوفة خارج الخلية وتشكل ندبة الدبقية. من ناحية ، هذا أمر جيد ، حيث أن موقع الضرر معزول ، من ناحية أخرى ، في هذا المجال ، سيكون تجديد الخلايا العصبية أمرًا صعبًا.
 هجرة خلايا الدم البيضاء إلى موقع الإصابة
هجرة خلايا الدم البيضاء إلى موقع الإصابةتلعب الخلايا الدبقية الصغيرة والخلايا النجمية دور الطليعة في الإصابة الرضحية ، لكن هذا السيناريو له مشهد جماهيري واسع النطاق. في أقصر وقت بعد التلف ، تتحرك الكريات البيض حرفيا في مكان العمل (هذا هو شكل حركتها الطبيعي على طول البطانة مع التهاب). من بين مجموعة كاملة من الكريات البيض ، فإن العدلات هي أول من يصل ، والتي تبدأ في إفراز السيتوكينات المؤيدة للالتهابات وأنواع الأكسجين التفاعلية والببتيدات التي تحفز الخلايا على موت الخلايا المبرمج. إن إقامتهم في مكان الإصابة مؤقتة ، بعد مرور 48 ساعة لم يتم ملاحظتهم ، ومع ذلك ، فإن مظهرهم هو أحد الأحداث المبكرة المهمة.
وراءها ، يتم تنشيط الخلايا الدبقية الصغيرة ، ويتم تجنيد الخلايا الليمفاوية T و B ، والتي تستجيب لتغيرات البروتين الناتجة عن التلف. في المراحل المبكرة ، تتلف خلايا الدم الحمراء والصفائح الدموية في بعض الأحيان. كما أنهم يشاركون بنشاط كبير في تنظيم الالتهاب العصبي ، على الرغم من أن هذا لا يحدث إلا عندما يتلف جدار الأوعية الدموية. تنتج هذه الخلايا عامل تنشيط الصفائح الدموية ، والذي يشارك في تنظيم تنشيط الخلايا الدبقية ، بالإضافة إلى ما قد يبدو غير متوقع ، فهي مصدر إضافي للسيروتونين (يتم إنتاجه ليس فقط داخل الجهاز العصبي ، ولكن أيضًا أبعد من ذلك). يساعد السيروتونين في هذه الحالة على وقف تدفق الدم من الأوعية الدموية وبقاء الخلايا العصبية والحفاظ على اللدونة.
www.sciencedirect.com/science/article/pii/S0889159118305786؟via٪3Dihubلا يتم استعادة الخلايا العصبية؟
كما سانتياغو رامون كاهل ، مؤسس علم الأعصاب الحديث ، الذي افترض في بداية القرن العشرين ، لا يتم استعادة الخلايا العصبية في جسم الشخص البالغ. لابد أنك سمعت هذا البيان أكثر من مرة في شكل عبارة "لا يتم استعادة الأعصاب المفقودة". ومع ذلك ، في الستينيات من القرن الماضي ، أعلن جوزيف التمان اكتشاف انقسام الخلايا العصبية في الحصين لخنازير غينيا الناضجة.
رابطلم يؤخذ هذا الدليل على تكوين الخلايا العصبية البالغة على محمل الجد حتى التسعينات من القرن الماضي. أدت البيانات المتراكمة حول التكون العصبي للأنواع المختلفة ، بما في ذلك الرئيسيات ، إلى تحول نموذجي.
رابطأكد الباحثون أن تكوين الخلايا العصبية يحدث بالفعل في أدمغة الحيوانات البالغة المختلفة ، ووجدوا في النهاية آثارًا للخلايا العصبية المشكلة حديثًا في دماغ شخص بالغ. تشير التقديرات إلى أن المئات من هذه الخلايا يتم إنتاجها كل يوم في الحصين ، حيث تساعد على تشكيل الذاكرة والمهارات الجديدة. هذا المفهوم مقبول على نطاق واسع من قبل العلماء ، ويمكنك حتى العثور على أنظمة غذائية وتمارين خاصة من المفترض أن تقويها. كما هو متوقع ، يمكنك أن تجد حتى حديث TED عن هذه الظاهرة.
هذه هي المشكلة فقط: قد لا يكون هذا التجديد للخلايا العصبية في الواقع. تستمر الدراسات التي دحضت وجود تكوين عصبي بالغ في الظهور حتى اليوم. تم نشر آخر دراسة رئيسية من هذا القبيل في 15 مارس من هذا العام في مجلة Nature. في ذلك ، استنتج علماء من معهد كاليفورنيا في سان فرانسيسكو أنهم لم يتمكنوا من اكتشاف أي آثار في عشرات الحصين التي تم الحصول عليها من أدمغة البالغين الذين تركوا أجسادهم للعلم. وفقا للباحثين ، لم يجدوا أي علامات حتى في أفضل العينات المحفوظة.
رابطكالعادة ، من الصعب جدًا إثبات أن شيئًا ما مفقود بالفعل ، والعديد من العلماء يشككون في نتائج العمل. يشير الكثيرون إلى أن العد تم بشكل غير مباشر - عن طريق وجود البروتينات التي تنتجها عادة الخلايا الصغيرة المنقسمة حديثًا. يمكن أن تتحلل هذه البروتينات بسهولة بعد وقت قصير من وفاة الجسم.
من المحتمل جدًا أن يستمر الجدل أكثر من ذلك ، ولن يتم تسليم الكلمة الأخيرة في هذا الأمر إلا عندما يتم تطوير طرق مراقبة الخلايا العصبية في دماغ الأشخاص الأحياء.
في دماغ سمكة الزرد ، الخلايا العصبية في جدار البطين الجانبي قادرة على الانقسام ، ثم تنتقل إلى المنطقة المصابة ، لتشكيل الخلايا العصبية الصغيرة لتحل محل الميت. لم تعد الخلايا المقابلة للفئران الأقرب إلينا قادرة على مثل هذا التركيز ، على الرغم من أنه عند وضعها في المختبر ، يتم استعادة القدرة. ويعتقد أن البيئة الدقيقة في موقع الإصابة في هذه الحيوانات المتطورة للغاية هي التي تعوق تطور الخلايا العصبية الجديدة.
رابطفي حالة تلف الأنسجة ، يتم تكوين البيئة الدقيقة بسبب تحلل منتجات البروتينات والجزيئات الكبيرة الأخرى التي تتكون منها ، وكذلك من المواد التي تفرزها الخلايا المحيطة. تعتمد الإجراءات المحددة للخلايا الدبقية ودورها في الترميم بشدة على طبيعة الإصابة. مع التنشيط المفرط والمستمر لداء الخلايا الدبقية الصغيرة ، تصبح المواد التي تفرزها بتركيزات عالية سامة للخلايا المحيطة ، وتعطل السيتوكينات المنتجة عمل الخلايا العصبية ؛ تمنع البروتينات الليفية التي تفرزها الخلايا النجمية تكوين روابط وظيفية.
كمية عالية من الإنترلوكين 1 ، أحد الوسطاء الرئيسيين للالتهاب ، خاصةً شكل بيتا ، مع عامل نخر الورم ، الإنترلوكين 6 و 10 الناتج في الجهاز العصبي المركزي عند تلفه ، يمكن أن يؤدي إلى الصداع والصداع النصفي.
يجب أن نتذكر أن هذه السيتوكينات المؤيدة للالتهابات ضرورية لاستعادة الأنسجة المصابة ، على الرغم من حقيقة أنها بدورها يمكن أن تسبب موت الخلايا وتتسبب في تلف الأنسجة الثانوية. على سبيل المثال ، عامل نخر الورم ألفا سام للخلايا العصبية في المراحل الأولى من الالتهاب ، لكنه يعزز التجدد في المراحل اللاحقة.
التهاب الأعصاب في مرض الزهايمر
كما هو واضح من التعريف الوارد أعلاه ، فإن التهاب العصب العصبي هو رفيق متكرر للأمراض العصبية التنكسية. تتميز هذه الأمراض بفقدان البنية والوظيفة وعدد الخلايا العصبية.
المرض ، الذي وصفه أولاً الطبيب النفسي الألماني ألويس الزهايمر ، يصيب عادةً الأشخاص الذين تزيد أعمارهم عن 65 عامًا ، على الرغم من وجود أشكال أخرى في بعض الأحيان. مع تطور المرض ، يفقد المرضى القدرة على تذكر المعلومات ، وفي الحالة القصوى ، يفقدون ذاكرتهم طويلة المدى ، والقدرة على التحدث والتنقل والعناية بأنفسهم. سبب العديد من العيوب المعرفية في هذا المرض هو تدهور الخلايا العصبية والمشابك ، مما يؤدي إلى ضمور القشرة الدماغية.
تصبح الخلايا الدبقية الصغيرة واحدة من المشاركين الرئيسيين في الالتهاب العصبي نشطًا بعد التعرض لأحد المحفزات العديدة ، وهي نقص الأكسجة والصدمة والسكتة الدماغية جنبًا إلى جنب مع عوامل مثل الفيروسات والبكتيريا والسموم. يتم تنشيط الخلايا أيضًا عندما تظهر لويحات الأميلويد ومجموعات بروتينات تاو. هذان العاملان - التشابك الليفي العصبي لبروتين تاو والالتهاب العصبي - هما علامتان رئيسيتان لمرض الزهايمر.
رابطلوحظت الخلايا الدبقية المنشطة بشكل زائد في دماغ المريض عند فحصها من قبل أخصائي علم الأمراض بعد الوفاة. على ما يبدو ، في وجود السيتوكينات المؤيدة للالتهابات ، تفقد البلاعم في الدماغ القدرة على البلعمة لتراكم خارج الخلية من بيتا النشواني ، وهي مجموعة من الببتيدات التي تشكل لوحة مميزة. بالإضافة إلى ذلك ، فإن زيادة تركيز السيتوكينات ، مثل بيتا interleukin 1 ، يمنع تكوين المشابك ، مما يفسر فقدانها في العملية المرضية.
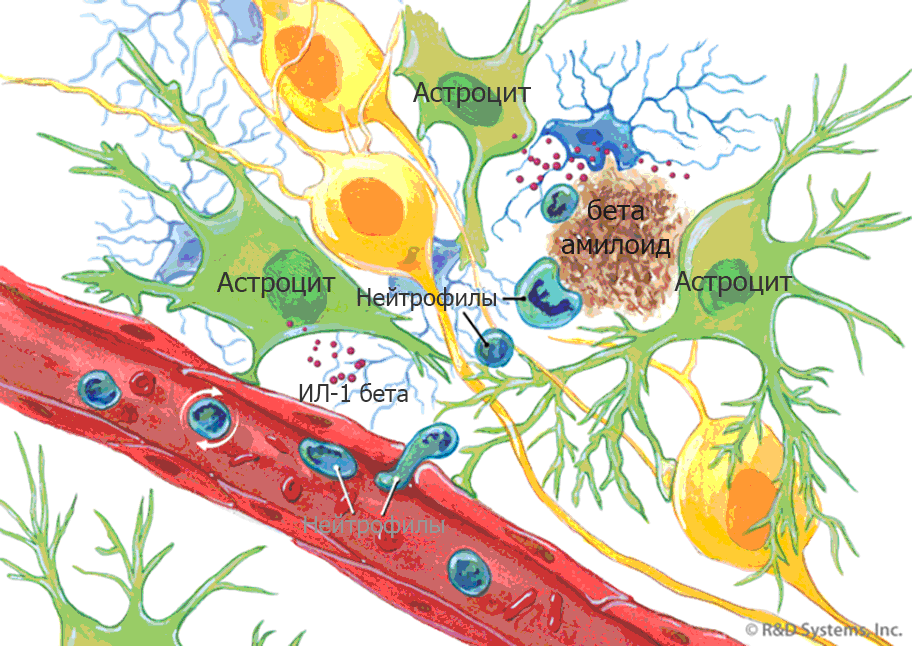 التهاب الأعصاب في مرض الزهايمر
التهاب الأعصاب في مرض الزهايمرنظرًا للضرر الهائل الذي لحق بالدماغ بسبب الالتهاب المزمن ، فقد اقترح أن المواد التي تقمع الالتهاب يمكن أن تعالج المرض أو على الأقل تقلل من احتمالية نموه. هناك أدلة على أن الأدوية غير الستيرويدية المضادة للالتهابات (مثل مضادات الالتهاب غير الستيروئيدية) ، مثل الأيبوبروفين ، يمكن أن تقلل الالتهاب الناجم عن لويحات الأميلويد ، لكن التجارب السريرية لم تكتمل بسبب ارتفاع مخاطر الآثار الجانبية. لا تعتبر مضادات الالتهاب غير الستيروئيدية مفيدة حاليًا في علاج مرض الزهايمر ، ولم تكتمل أي من التجارب السريرية لإثبات قدرة مضادات الالتهاب غير الستيروئيدية على منع أو تقليل خطر الإصابة بالمرض.
وقد ألقت الدراسات الحديثة الشكوك بشكل عام على فوائد تناول جرعات منخفضة من الأسبرين ومضادات الالتهاب غير الستيروئيدية الأخرى المحتملة يوميًا. لم تؤكد دراسة نشرت في واحدة من أكثر المجلات الطبية تأثيرًا في مجلة لانسيت ، حيث قام الأطباء والعلماء بمراقبة أكثر من 12000 مريض يعانون من خطر معتدل من الإصابة بأمراض القلب ، أي فائدة في تناول هذا الدواء.
رابطمرض باركنسون
ولكن بالنسبة لأمراض الأعصاب المتبقية؟
في مرض باركنسون ، الذي يتميز بالموت الجماعي للخلايا العصبية من العقد القاعدية التي تفرز الدوبامين ، فإن الالتهاب العصبي هو المكون الرئيسي للمرض تقريبًا.يفقد الأشخاص المصابون بمرض باركنسون السيطرة على حركاتهم ، وتبدأ أيديهم في الاهتزاز ، وتتفاقم خطتهم اليدوية. يبدأ المرضى في المشي ببطء أكبر ، ويجدون صعوبة في المشي. كل هذه المظاهر المبكرة للمرض. بمرور الوقت ، يتدهور التفكير التجريدي والتحكم في الانتباه وتظهر الهلوسة. ما يقرب من 50٪ ممن تم تشخيصهم مصابون بالثاني.تكشف الدراسات المبكرة للدماغ بعد الوفاة مجموعة كاملة من السيتوكينات المؤيدة للالتهابات ، بما في ذلك إنترلوكينز 1 ، 2 ، 6 ، إنترفيرون جاما ، عامل نخر الورم ألفا ، وغيرها. لوحظت نفس المجموعة في السائل النخاعي للمرضى. تم الكشف أيضا عن تركيزات عالية من أكسيد النيتريك وأكسيد ، والتي يمكن أن تسبب بشكل مباشر وغير مباشر وفاة الخلايا العصبية.رابطومع ذلك ، على الرغم من النجاحات الكبيرة في دراسة علم الأمراض المقدم ، يجد الباحثون صعوبة في التأكد مما إذا كان الالتهاب العصبي هو سبب أو نتيجة المرض. شيء واحد مؤكد: بمجرد تورط الالتهاب في اللعبة ، يصبح لاعبًا رئيسيًا. هذا ما تؤكده الدراسات الوبائية. على عكس مرض الزهايمر ، يمكن لمضادات الالتهاب غير الستيروئيدية ، باستثناء الأسبرين ، تقليل خطر الإصابة بمرض باركنسون وفقًا لتحليل تلوي أُجري في عام 2010.Linkالسمة المميزة للعديد من الأمراض التنكسية العصبية هي أن خطر تطورها يزداد مع تقدم العمر. من هذا يمكن افتراض أن الالتهاب العصبي والشيخوخة مرتبطان أيضًا بطريقة أو بأخرى.التهاب عصبي في الشيخوخة
خلايا الدماغ تعيش وتموت ، هذه دورة حياة طبيعية. يتم استبدال الخلايا العصبية تدريجيًا بالخلايا النجمية ، ويتم طرد السيتوكينات أثناء الالتهاب والتحكم في الموت. وهكذا ، في أي وقت محدد ، يوجد مستوى معين من السيتوكينات المؤيدة للالتهابات في الدماغ. ومع ذلك ، مع تقدم العمر ، تصبح علامات الالتهاب في الخلايا الدبقية أكبر ، بالإضافة إلى أنها تساهم في الاستجابة المناعية المفرطة أثناء التحفيز. تصبح الخلايا الدبقية الصغيرة مفرطة النشاط.مع التقدم في السن ، هناك أيضًا اضطرابات في الوظائف المعرفية - الذاكرة والكلام والتفكير المجرد - على الرغم من أنها بدرجة أقل من الأمراض العصبية التنكسية. بشكل عام ، يمكن اعتبار الشيخوخة خطرًا رئيسيًا للضعف الإدراكي المعتدل.غالبًا ما تظهر على كبار السن علامات ضعف إدراكي أثناء أو بعد الإصابة أو الإجهاد. تم تأكيد هذه الملاحظات في التجارب المختبرية على الفئران ، والتي يمكن أن يحدث ضعف إدراكي بسبب إعطاء عديد السكاريد الدهني (أحد مكونات الجدار البكتيري الذي تتطور إليه الاستجابة المناعية) ، ولكن يمكن تخفيفه باستخدام ريسفيراترول ، وهو عامل قوي مضاد للالتهابات.رابطشيخوخة الحُصين
يبدأ أي وصف لشيخوخة الجهاز العصبي المركزي دائمًا بالحُصين ، منطقة الدماغ المسؤولة عن تكوين الذكريات. يتأثر في الشيخوخة الطبيعية وفي مرض الزهايمر. بالإضافة إلى الذاكرة ، فإن الحُصين يلفت انتباه الباحثين بآثار الإجهاد. نظرًا لأن الحصين عنصر تغذية مرتدة مهم مسؤول عن إيقاف إنتاج الكورتيزون ، فإن تأثير الضغط المزمن على الشيخوخة يخضع لفحص دقيق.في الدراسات المبكرة لشيخوخة الحُصين ، تبين أن لدى كبار السن خسارة كبيرة في عدد الخلايا العصبية. ومع ذلك ، في دراسات لاحقة باستخدام تقنيات دقيقة ، وجد علماء الفسيولوجيا اختلافات طفيفة بين عدد الخلايا العصبية في الحصين من الشباب والكبار.تطور وضع مشابه جدًا مع حجم الحُصين ، كما تم قياسه بواسطة التصوير بالرنين المغناطيسي. من المعروف بشكل موثوق أنه كلما كان حجم الحصين أصغر ، كلما كانت ذاكرة الشخص المسن أسوأ. لحسن الحظ ، هناك دراسات تظهر أن التدريب الهوائي المعتدل يساعد في الحفاظ على حجم الحصين. آثار الكورتيزول على أجزاء من الدماغ تحت الضغطلأن الخلايا العصبية الحصينية تحتوي على كمية كبيرة من مستقبلات القشرانيات ، فهي عرضة للإجهاد لفترات طويلة. في الأشخاص الذين يعانون من إجهاد مؤلم شديد وطويل الأمد ، يتدهور الحُصين بشكل أسرع من بقية الدماغ.لوحظت آثار مماثلة في اضطراب ما بعد الصدمة والفصام والاكتئاب. من المثير للاهتمام ، يمكن أن يتباطأ ضمور الاكتئاب عن طريق تناول مضادات الاكتئاب حتى لو لم تساعد في التعامل مع الأعراض الأخرى.
آثار الكورتيزول على أجزاء من الدماغ تحت الضغطلأن الخلايا العصبية الحصينية تحتوي على كمية كبيرة من مستقبلات القشرانيات ، فهي عرضة للإجهاد لفترات طويلة. في الأشخاص الذين يعانون من إجهاد مؤلم شديد وطويل الأمد ، يتدهور الحُصين بشكل أسرع من بقية الدماغ.لوحظت آثار مماثلة في اضطراب ما بعد الصدمة والفصام والاكتئاب. من المثير للاهتمام ، يمكن أن يتباطأ ضمور الاكتئاب عن طريق تناول مضادات الاكتئاب حتى لو لم تساعد في التعامل مع الأعراض الأخرى.التهاب الأعصاب في الاضطرابات النفسية
بشكل عام ، تتشكل صورة مثيرة للاهتمام حول الاكتئاب. أسبابه لا تزال مجهولة. يتم انتقاد نظرية السيروتونين الأكثر شيوعًا باستمرار. في الوقت نفسه ، غالبًا ما تظهر على المرضى المصابين بالتهاب مزمن علامات وأعراض الاكتئاب. نُشر هذا العام عمل حدد فيه العلماء أن الضغط النفسي الناجم عن عوامل اجتماعية ، من بين عوامل أخرى ، يزيد من مستوى الالتهاب في دماغ الفئران. التقى الفئران بشكل دوري مع رجل عدواني لمدة 10 أيام. تسبب هذا الإجهاد في زيادة كمية الإنترلوكين 1 وعامل النخر في الورم الذي تفرزه الخلايا الدبقية المنشطة في قشرة الفص الجبهي ، وهي منطقة الدماغ المسؤولة عن اتخاذ القرار. أدى هذا الانتهاك في نهاية المطاف إلى نوبات من الاكتئاب الشديد ، والتي يمكن معالجتها عن طريق تحييد الالتهاب.يتسبب اضطراب النوم الموصوف في الظروف التجريبية في تنشيط نفس مستقبلات المناعة الفطرية مثل الإجهاد الاجتماعي.رابطيرجع ذلك إلى حقيقة أن neuroinflammation قد تلعب دورا رئيسيا في الاضطرابات النفسية - الاكتئاب وانفصام الشخصية والاضطراب الثنائي القطب - تصبح ظاهرة مثيرة للاهتمام للغاية بسبب نتائج هذه التجارب في أعقاب استنتاج مفاده أن هذه الأمراض يمكن الوقاية منها قبل فترة طويلة من تصحيح نمط الحياة مظهرهم والنظام الغذائي وأنماط النوم.رابطالشيخوخة تحت المهاد
على عكس الحصين ، الذي تفسر تغيراته حدوث ضعف الإدراك المعرفي مع تقدم العمر ، من المحتمل أن تحت المهاد تتحكم في الشيخوخة.هذا الهيكل في الدماغ ، يشبه اللوزتين ، هو جسر بين الجهاز العصبي والغدد الصماء في جسم الإنسان. يساعد في تنظيم السلوك والاحتياجات الأساسية العديدة ، مثل الجوع والنوم والخوف والعدوان. وفقًا لذلك ، مع التقدم في العمر ، يتم تعطيل توازن الخلايا العصبية المفرزة التي تتكون تحت المهاد ، وتظهر المظاهر المرتبطة بالشيخوخة.تتعلق عمليات البحث الأولى في هذا الاتجاه بإنشاء سلاسل تغذية مرتدة من هرمونات مختلفة ، غالبًا جنسية. ومع ذلك ، فإن اضطرابات التغذية المرتدة وظهور مقاومة للإستروجين والأنسولين وهرمون النمو والجزيئات التنظيمية الأخرى هي نتيجة وليست سببًا. الآليات الخلوية والجزيئية التي تفسر فقدان التوازن لا تزال غير مفهومة جيدًا.على مدى السنوات القليلة الماضية ، تم فحص العديد من المسارات الجزيئية والجينات التي ترتبط ببداية وتطور العمليات التنكسية التي تعتمد على العمر. من بينها كانت تحظى بشعبية كبيرة الآن بين الباحثين sirtuins ، SIRT ، الثدييات المستهدفة للراباميسين ، mTOR ، عامل النسخ NF-kB وغيرها.mTOR هو إنزيم ينتمي إلى عائلة بروتين كيناز ، وهو هدف عقار رابامايسين المضاد للسرطان. نتيجة لدراسات حول الهزات والديدان والذباب وبعض الثدييات ، تبين أن الراباميسين قادر على إطالة عمر هذه الكائنات النموذجية. لذا اكتسب mTOR سمعة باعتباره المحدد المركزي والمحافظ تطوريًا لمتوسط العمر المتوقع.mTOR حساس جدًا للأنسولين وعوامل النمو ؛ يتحكم في عملية التمثيل الغذائي للخلية ونموها وبقائها. ومع ذلك ، مع التحفيز العالي المزمن ، يؤدي العمل المفرط لـ mTOR إلى الإجهاد التأكسدي ، وتراكم التلف والشيخوخة في الخلية - وكلها علامات على الاستجابة الالتهابية للخلية.يساهم تنشيط عامل النسخ NF-kB في زيادة تطوير الاستجابة الالتهابية ، لأنه يتحكم في الجينات المسؤولة عن صيانتها. أظهرت الأبحاث العلمية الحديثة أن الزيادة المستمرة في السعرات الحرارية في الطعام يمكن أن تساهم في تطوير الاستجابات الالتهابية في منطقة ما تحت المهاد.التهاب الأعصاب الزائد
العناصر الغذائية الزائدة لها "تأثير الدومينو". بادئ ذي بدء ، تعاني الشبكة الإندوبلازمية منه - شبكة واسعة من التجاويف والحويصلات والأنابيب ، المرتبطة بعدد كبير من وظائف التمثيل الغذائي: نقل البروتينات والدهون ، وتراكم الكالسيوم ، وما إلى ذلك. عندما يعاني هذا الجهاز العضوي المهم من الإجهاد في الخلايا الدبقية في الوطاء ، يتم تنشيط NF-kB في هذه الخلايا. الخلايا الميكروجينية في اتصال مستمر مع الخلايا العصبية من خلال السيتوكينات المؤيدة للالتهابات ، مثل عامل نخر الورم ألفا وبيتا 1 إنترلوكين.زيادة في التعبير عنها تنشط NF-kB في إفراز الخلايا العصبية ، وتمنع إنتاج هرمون موجهة الغدد التناسلية ، هرمون يتحكم في إنتاج هرمونات الغدد التناسلية النخامية ، وتعزيز مقاومة الأنسولين واللبتين.مع مرور الوقت ، يضعف هذا التوازن الوطائي. ويرتبط خلل التنظيم هذا بالشيخوخة الجهازية وتطور أمراض تعتمد على العمر - السكري والسمنة وأمراض القلب والأوعية الدموية والخرف والخلل التناسلي.www.ncbi.nlm.nih.gov/pmc/articles/PMC2586330www.ncbi.nlm.nih.gov/pmc/articles/PMC3756938www.ncbi.nlm.nih.gov/pubmed/23636330www.ncbi.nlm.nih .gov / pmc / articles / PMC4313775الخلايا الجذعية والتهاب الأعصاب
في عام 2013 ، اكتشف باحثون من كلية ألبرت أينشتاين للطب الخلايا الجذعية في منطقة ما تحت المهاد ، والتي في رأيهم قادرة أيضًا على التحكم في شيخوخة الجسم. وذكروا أن عدد الخلايا الجذعية تحت المهاد ينخفض بمرور الوقت في الفئران التي كانت موضوع الدراسة. في عمر سنتين - عمر الفئران القديمة - لم تعد تمتلك معظم هذه الخلايا.قام المجربون بزرع الخلايا الجذعية إلى الفئران العادية ، وكذلك إلى الفئران التي سبق لها تدمير الخلايا الجذعية تحت المهاد. أظهرت المجموعتان علامات على تأخر الشيخوخة. اتضح أن miRNAs المحددة كانت العامل الرئيسي في هذه الظاهرة. تختلف هذه المجموعة من الجزيئات عن الحمض النووي الريبي العادي في أنها لا تشارك في عملية تخليق البروتين ، ولكنها تشارك بدلاً من ذلك في تنظيم التعبير عن الجينات الأخرى في الخلايا. يمكن للخلية أن تفرز microRNA في حاويات خاصة - exosomes.لتأكيد فرضيتهم ، قام المجربون بعزل exosomes للخلايا الجذعية تحت المهاد وحقنها في الفئران والفئران السائلة النخاعية الطبيعية التي تم فيها تدمير الخلايا الجذعية المهاد. تجاوزت النتيجة جميع التوقعات: مرة أخرى ، كبرت مجموعتا الفئران بشكل أبطأ - قاموا بتقييم قوة العضلات والتنسيق الحركي والسلوك الاجتماعي والقدرات المعرفية.Link علىالرغم من أن العديد من الجزيئات الدقيقة التي تلعب دورًا مهمًا في الالتهاب ، مثل miR-107 و miR-155 و miR-223 ، معروفة بالفعل ، لم تتم دراسة هذا الجزيء الدقيق أي الجزيء الحمض النووي الريبي كان مسؤولًا عن إبطاء الشيخوخة.لا تزال دراسات MicroRNA فقط في بداية الرحلة ، وقد تكون رؤى حول كيفية استخدامها لزيادة متوسط العمر المتوقع الصحي في انتظارنا في المستقبل القريب.الخلاصة
كما ترون الآن ، يعد التهاب العصب العصبي عملية معقدة للغاية. مع ذلك ، لا توجد مظاهر كلاسيكية للالتهاب التي وصفها سيلسوس ، وهي الاحمرار والتورم بالحرارة والألم. ومع ذلك ، في الالتهاب العصبي ، فإن الآليات الجزيئية والخلوية هي نفسها جزئيًا كما هو الحال في الالتهاب. في كلتا الحالتين ، يتم تضمين جزيئات الإشارة أو السيتوكينات ، مثل الإنترلوكينات والكيماوكينات وعامل نخر الورم. كل من العملية والأخرى لها جوانب إيجابية وسلبية.
مفتاح هذه العمليات هو محاولة الجسم لإصلاح الأنسجة التالفة بالطرق المتاحة لها. هناك اختلافات. البلاعم المقيمة في أنسجة المخ هي خلايا ميكروغيلية. لم يتم العثور عليها في أنسجة أخرى من الجسم. بدلاً من الندبة المعتادة ، تشكل الأنسجة العصبية دبقية بسبب تنشيط الخلايا النجمية.
ليس من المستغرب أن يكون للالتهاب في الأنسجة العصبية ، وخاصة الجهاز العصبي المركزي ، عواقب بعيدة المدى. يشارك الالتهاب العصبي في الشيخوخة والأمراض المرتبطة بالعمر والسمنة وبعض أنواع الخرف.
على الرغم من حقيقة أن الكثير في الصحة يعتمد على علم الوراثة ، فإن سلوكنا يحدد جزئيًا أيضًا كيف نعيش ونكبر. النشاط البدني المعتدل ، ومرة أخرى ، اتباع نظام غذائي معتدل وصحي ومتنوع ، والنوم الصحي يمكن أن يقلل من الالتهاب العصبي ، وكذلك إطالة صحة الدماغ والجسم. من الضروري أيضًا طلب المساعدة من الأطباء في الوقت المناسب ، حتى لو كان "نوعًا من الاكتئاب" وسيمر من تلقاء نفسه. وأيضًا لا تتدخل في التطبيب الذاتي ورواية الثروة من خلال النشر ، الذي جاء إلى مجتمعنا ليحل محل تشخيص Google.
www.ncbi.nlm.nih.gov/pmc/articles/PMC4588685www.ncbi.nlm.nih.gov/pubmed/25527485المؤلف فاسيلي تسفيتكوف