زيادة الوقت بين الوجبات وتقييد السعرات الحرارية يطيل العمر
في سبتمبر 2018 ، نُشرت دراسة أجراها أطباء أمراض الشيخوخة الأمريكية من المعهد الوطني للشيخوخة (NIH) حول تأثير الوقت بين الوجبات على متوسط العمر المتوقع في مجلة Cell Metabolism. تم تقسيم الفئران التجريبية إلى مجموعتين. المجموعة الأولى لديها نظام غذائي مع التغذية الطبيعية (كمية مخفضة من الكربوهيدرات المكررة والدهون ، وزيادة محتوى البروتينات والألياف). على العكس من ذلك ، تم وضع مجموعة أخرى من القوارض على نظام غذائي "غير صحي" - مع زيادة كمية الكربوهيدرات والدهون البسيطة ، ومجموعة مخفضة - البروتينات والألياف. بالإضافة إلى ذلك ، تم تقسيم الفئران في كل مجموعة إلى ثلاث مجموعات فرعية ، بناءً على عدد المرات التي يحصلون فيها على الطعام. تمكنت المجموعة الفرعية الأولى من الفئران من الوصول إلى الطعام على مدار الساعة. تم تغذية المجموعة الفرعية الثانية من الفئران مرة واحدة في اليوم ، وكان عدد السعرات الحرارية في حصتها هو نفس عدد الفئران من المجموعة الفرعية الأولى ، أي لا جردت. تم تغذية المجموعة الفرعية الثالثة بنظام غذائي انخفض بنسبة 30 ٪ من السعرات الحرارية.
كان لدى المجموعتين الفرعيتين الثانية والثالثة ، وفقًا للعلماء ، شهية أقوى وأكلوا بسرعة الطعام الذي جلبوه ، مما أدى إلى فترات يومية أطول من الصيام لكلا المجموعتين.
 الرقم من المقال.
الرقم من المقال.
أول مجموعة فرعية من الفئران ( ad libitum ) - تتغذى على الشبع ، مع إمكانية الحصول على الطعام على مدار 24 ساعة في اليوم
المجموعة الفرعية الثانية من الفئران ( التي تتغذى على الوجبة ) - تتلقى الطعام مرة واحدة في اليوم ، دون قطع السعرات الحرارية.
المجموعة الفرعية الثالثة من الفئران ( CR ، تقييد السعرات الحرارية ) - حصلت على نظام غذائي منخفض السعرات الحرارية بنسبة 30 ٪.خلال الدراسة ، قام العلماء بتتبع صحة التمثيل الغذائي للفئران حتى الموت الطبيعي ، ثم قاموا بفحصها بعد وفاتها. اتضح أن الفئران من مجموعتين فرعيتين ، تم إطعامهما مرة واحدة يوميًا ومحدودية السعرات الحرارية ، حسنت الصحة العامة. ما يتضح من التأخيرات مع الأضرار العامة المرتبطة بالعمر للكبد والأعضاء الأخرى ، بالإضافة إلى زيادة متوسط العمر المتوقع. كما أظهرت الفئران المقيدة بالسعرات الحرارية تحسنًا ملحوظًا في مستويات الجلوكوز في الدم والأنسولين مقارنة بالمجموعات الأخرى. بشكل عام ، كان لدى الفئران مثل هذه المؤشرات لمتوسط العمر المتوقع. عاشت الفئران التي تتغذى بشكل طبيعي ، دون قيود ، 104-110 أسابيع ، مع وجبة يومية لمرة واحدة - 115-117 أسبوعًا ، مع تقييد السعرات الحرارية - 132-135 أسبوعًا.
كما أظهر تشريح الجثة ، كان لجميع المجموعات الثلاث من الفئران نفس الأمراض ، ولكن فترات مختلفة من تطورها. كان داء النشواني هو آفة الأنسجة غير الورمية الرئيسية ، وكانت تراكمات الأميلويد أكثر اتساعًا في الفئران طويلة العمر التي تم تغذيتها بتقييد السعرات الحرارية. يعزو العلماء هذه الحقيقة إلى عمر أطول لهذه الفئران.
يشار إلى أنه وفقًا لملاحظة الباحثين ، لم يكن لتركيبة النظام الغذائي تأثير كبير على متوسط العمر المتوقع في المجموعات الفرعية مع الوجبات لمرة واحدة وتقييد السعرات الحرارية. أرجع العلماء ذلك إلى حقيقة أن الفترات الفاصلة بين الوجبات سمحت للجسم باستخدام آليات التعافي بشكل أكثر كفاءة: "أدت الزيادة في الصيام اليومي دون تقليل السعرات الحرارية وبغض النظر عن نوع النظام الغذائي المستهلك إلى تحسن شامل في الصحة والبقاء في الفئران الذكور. ربما تسمح لك هذه الفترة اليومية الممتدة على معدة فارغة باستعادة الآليات التي ستكون غائبة أثناء التعرض لفترات طويلة للطعام والحفاظ عليها ". [3]
النظام الغذائي المتوسطي يقلل من خطر السكتة الدماغية لدى النساء
يمكن لنظام غذائي متوسطي أن يقلل من خطر الإصابة بالسكتة الدماغية لدى النساء الأكبر من 40 عامًا ، ولكن ليس لدى الرجال ، تم الحصول على هذه البيانات في دراسة جديدة أجراها أطباء القلب الإنجليز.
يصف مقال في عدد سبتمبر 2018 من مجلة الجمعية الأمريكية لأمراض القلب نظامًا غذائيًا عاليًا في الأسماك والفواكه والخضروات والمكسرات والفاصوليا ، وعدد أقل من اللحوم ومنتجات الألبان ، ويقلل من خطر الإصابة بالسكتة الدماغية بين النساء المعرضات لخطر الإصابة بأمراض القلب. أمراض الأوعية الدموية. هذه الدراسة ، وفقًا للعلماء ، هي واحدة من أكبر وأطول ، تهدف إلى تقييم الفوائد المحتملة لنظام غذائي على الطراز المتوسطي في الحد من خطر الإصابة بالسكتة الدماغية. يظهر أن مثل هذا النظام الغذائي يمكن أن يكون فعالًا بشكل خاص في النساء فوق سن 40 ، بغض النظر عن حالة انقطاع الطمث أو العلاج بالهرمونات البديلة.
قام علماء من جامعات إيست أنجليا وأبردين وكامبريدج ، كجزء من دراسة EPIC في نورفولك على مدى 17 عامًا ، بدراسة الأنظمة الغذائية لـ 23،232 مشاركًا ومقارنة خطر السكتة الدماغية اعتمادًا على النظام الغذائي للمشاركين.
انخفض خطر الإصابة بالسكتة الدماغية لدى 22٪ من النساء و 6٪ من الرجال.
"تبين لنا هذه الدراسة أن اتباع نظام غذائي على الطراز المتوسطي غني بالأسماك والفواكه والمكسرات والخضروات والفاصوليا ، بالإضافة إلى عدد أقل من اللحوم ومنتجات الألبان ، يمكن أن يقلل من خطر الإصابة بالسكتة الدماغية لدى النساء فوق سن الأربعين. لكن اتباع نظام غذائي صحي ومتوازن مهم للجميع ، الصغار والكبار على حد سواء. ليس من الواضح لماذا وجدنا اختلافات بين النساء والرجال ؛ فمن الممكن أن المكونات الغذائية قد تؤثر على الرجال بشكل مختلف عن النساء. نحن نعلم أيضًا أن الأنواع الفرعية المختلفة للسكتة الدماغية قد تختلف بين الجنسين. وكتب الباحثون أن دراستنا كانت صغيرة جدًا لاختبار هذا ، لكن كلا الاحتمالين يستحقان مزيدًا من الدراسة في المستقبل.
وتركز جمعية القلب الأمريكية أيضًا في توصياتها على نظام غذائي مشابه لنظام البحر الأبيض المتوسط: "توصي جمعية القلب الأمريكية بأسلوب حياة صحي ونظام غذائي يتضمن العديد من الفواكه والخضروات والحبوب الكاملة ومنتجات الألبان قليلة الدسم والأسماك والدواجن والفاصوليا وغير الاستوائية. الزيوت النباتية والمكسرات ، وكذلك الحد من الدهون المشبعة والدهون المتحولة والصوديوم واللحوم الحمراء والحلويات ومشروبات السكر. هذه المكونات الغذائية تقلل من عوامل الخطر لأمراض القلب والسكتة الدماغية "[4]
MicroRNA-141-3p ، جزيء الإشارة SDF-1 وخلل العظام المرتبط بالعمر
في أغسطس 2018 ، تم نشر مقال في مجلة علم الشيخوخة حول علاقة microRNA-141-3p ، وجزيء الإشارة SDF-1 (عامل مشتق من الخلايا -1 Stromal) ، وشيخوخة العظام.
وفقا للصندوق الدولي لهشاشة العظام ، حوالي 30 في المائة من النساء بعد سن اليأس في الولايات المتحدة وأوروبا مصابات بهشاشة العظام. يتعرض 40٪ على الأقل من هؤلاء النساء وحوالي 30٪ من الرجال من نفس العمر لخطر الإصابة بالكسور بسبب هشاشة عظامهم لدى الآخرين.
يمكن للخلايا الجذعية الوسيطة أن تتمايز إلى المكونات الرئيسية للهيكل العظمي لدينا: بانيات العظم ، الخلايا العظمية المكونة للعظام ، خلايا الغضروف ، الخلايا الغضروفية. وكذلك الخلايا الدهنية والخلايا الدهنية. أظهرت الدراسات أن SDF-1 هو جزيء إشارة رئيسي ينظم تمايز الخلايا الجذعية في هذه الخلايا. يحتوي SDF-1 أيضًا على العديد من الوظائف الأخرى ، بما في ذلك مساعدة الخلايا الجذعية الوسيطة على الوصول إلى المكان الصحيح أثناء تكوين أو استعادة العظام. بالإضافة إلى ذلك ، يعمل SDF-1 كمضاد للأكسدة ، يحمي الخلايا من الآثار الضارة للإجهاد التأكسدي.
إن أهمية SDF-1 في الحفاظ على صحة العظام الطبيعية ، وحقيقة أن مستوى هذا الجزيء انخفض مع التقدم في العمر ، جعل العلماء مهتمين بكيفية تنظيمه. اقترح العلماء أن انخفاض مستويات SDF-1 في واحد على الأقل من المسارات يعتمد على miRNA-141-3p.
أظهرت الدراسات السابقة أن دور miRNA-141-3p يمكن أن يكون سلبيًا. وقد وجد أن هذا الـ miRNA يمنع نشاط ناقل فيتامين C ، والذي لم يسمح للفيتامين بالتغلغل في الخلايا. فيتامين ج مهم أيضًا لصحة العظام ، وبدون وسائل نقل كافية ، يبدأ الفيتامين بدلاً من ذلك بالتراكم خارج الخلية ، حيث يسبب الإجهاد التأكسدي. أظهرت الدراسات على الحيوانات أن الإجهاد التأكسدي في الخلايا الجذعية الوسيطة يقلل من مستوى SDF-1. جمع الباحثون جميع البيانات المتاحة معًا ، واقترحوا ثم وجدوا أن الإجهاد التأكسدي الأعلى يزيد من التعبير عن miRNA-141-3p ، والذي بدوره يقلل من مستويات SDF-1.
في كل من الفئران والخلايا الجذعية الوسيطة البشرية ، وجد أن مستويات miRNA-141-3p أقل في الخلايا الصغيرة. وفي الخلايا القديمة ، زاد مستوى هذا الحمض النووي الريبي بمقدار 3 مرات أو أكثر. بالنسبة لمستويات جزيء SDF-1 ، تم العثور على ظاهرة معاكسة بشكل أساسي - انخفاض متعدد مع تقدم العمر. أدت إضافة microRNA-141 إلى الخلايا الجذعية إلى انخفاض مستويات SDF-1. وتشمل عواقب ذلك تحولاً عمرياً آخر: إنتاج المزيد من بانيات العظم ، على حساب بانيات العظم. ولوحظ أيضًا أن الخلايا الجذعية الوسيطة اختلفت أكثر في الخلايا الدهنية ، والتي ترتبط أيضًا عادةً بالعمر.
كجزء من اختبار شامل لفرضيتهم ، أضاف العلماء لأول مرة miRNA-141-3p إلى الخلايا ، وساءت وظيفة أنسجة العظام الملحوظة ، ثم استخدموا مثبطًا لهذا الحمض النووي الريبي الصغير ، ولوحظ تحسن.
وفقًا للباحثين ، يمكن أن تكون الأدوية السريرية ، مثل الدواء المستخدم لتثبيط miRNA-141-3p ، يومًا ما وسيلة فعالة لمساعدة الخلايا الجذعية الوسيطة على البقاء فعالة ، بغض النظر عن العمر أو الحالات الأخرى: "يعمل المانع على تطبيع الوظيفة عظام. نحن نعتقد أن مثبط المستوى السريري يمكن أن يساعدنا على فعل الشيء نفسه عند البشر ".
في الخطوة التالية ، يخطط العلماء للتحول إلى النماذج الحيوانية وإلقاء نظرة على العديد من العوامل الأخرى المشاركة في شيخوخة العظام. واكتشف أيضًا ما إذا كانت المستويات الأعلى من النشاط البدني ، والتي تميل إلى الانخفاض مع التقدم في العمر ، يمكن أن تساعد في استعادة توازن صحي لـ miRNA-141-3p و SDF-1. ومن المقرر أيضًا دراسة أفراد آخرين من عائلة microRNA-141 لمشاركتهم في عملية الشيخوخة [5].
كيف تكسب البكتيريا "السيئة" في الأمعاء
في سبتمبر 2018 ، مقال لعلماء إنجليزيين نشر في مجلة PLOS Pathogens ، التي وصفت آلية الاستعمار عن طريق البكتيريا المعوية المسببة للأمراض بعد تناول المضادات الحيوية.
من المعروف بالفعل أن المضادات الحيوية تعطل النباتات الواقية الطبيعية في الأمعاء ، مما يجعل الأشخاص عرضة للبكتيريا Clostridium difficile. تتسبب العدوى بهذا العامل الممرض (CDI) في معظم حالات تفشي الإسهال المرتبطة بالعلاج بالمضادات الحيوية ويمكن أن تؤدي إلى أمراض ومضاعفات قد تهدد الحياة. يمكن أن يتسبب داء المطثية العسيرة في فقدان الوزن بشكل خطير وإضعافه لفترة قصيرة من الزمن. وهناك الآن حاجة كبيرة لفهم أفضل لكيفية تأثير المطثية العسيرة على الكائنات الحية الدقيقة المعوية وتعطيل التوازن المعوي. يحدث تكاثر هذه البكتيريا في الظروف التي تقتل فيها المضادات الحيوية مسببات الأمراض الأخرى.
C. difficile هو مادة لاهوائية تشكل جراثيم إيجابية الجرام تعرضت لظروف قاسية لفترات طويلة من الزمن. العلاج بالمضادات الحيوية الموجهة ضد هذه البكتيريا لا يعطي النتيجة المرجوة. 35٪ من المرضى معرضون مرة أخرى لتكرار الإصابة بالعدوى العسيرة. دفعت هذه الحقائق العلماء إلى إلقاء نظرة فاحصة على هذه البكتيريا من أجل فهم ما يجعلها ضعيفة للغاية.
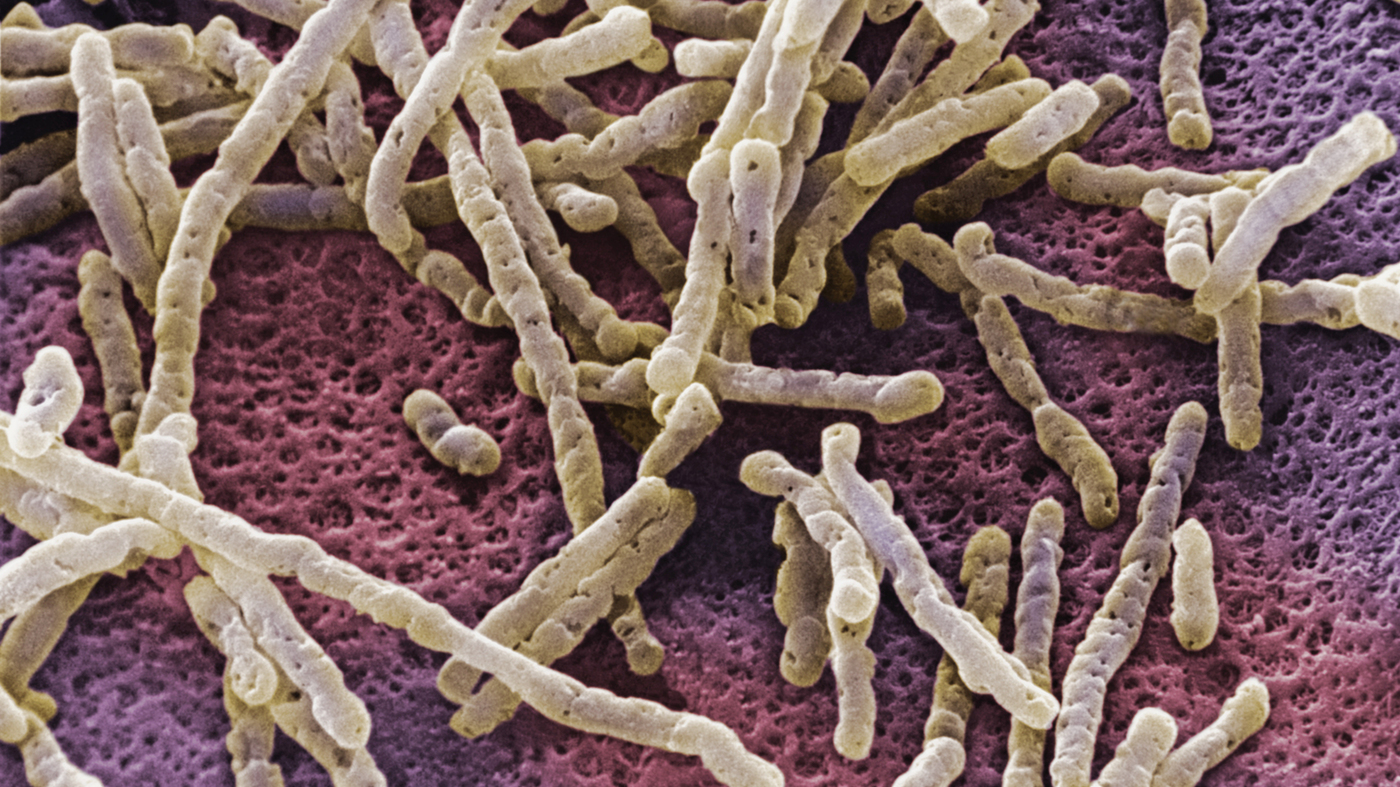 البكتيريا المطثية العسيرة
البكتيريا المطثية العسيرةاتضح أن Clostridium difficile لديه سلاح سري. واحدة من السمات المميزة لـ C. difficile بين البكتيريا المعوية الأخرى هي قدرتها على إنتاج مركب paracresol (p-cresol) عن طريق تخمر التيروزين. P-cresol له تأثير ضار على البكتيريا المعوية الطبيعية الواقية. اكتشف العلماء أن p-cresol يستهدف بشكل انتقائي بعض البكتيريا في الأمعاء ويضعف من قدرتها على النمو. وقد خلق ذلك مزايا تنافسية لـ C. difficile.
كدليل على ذلك ، قام العلماء بفحص سلالات C. difficile الطافرة التي لم تستطع إنتاج p-cresol. كانت هذه البكتيريا أقل قدرة على التنافس مع الأنواع الأخرى من الجراثيم المعوية ، وبالتالي كانت أقل قدرة على إعادة استعمار الأمعاء بعد الإصابة الأولية. "تقدم دراستنا فهمًا جديدًا لتأثيرات إنتاج p-cresol على البكتيريا المعوية الصحية وكيفية مساهمتها في بقاء الكلوستريديوم الصعب. وجدنا أن الممرض المعوي الرئيسي Clostridium difficile ينتج عامل جراثيم paracresol ، مما يساعد على التحكم في الميكروبات المعوية ويوفر C. difficile مع فوائد النمو التنافسية ، خاصة بعد استهلاك المضادات الحيوية. يمكن أن يوفر هذا العرض الفريد للممرض هدفًا جديدًا للعقاقير لتقليل العدوى التي تسببها C. difficile "[6]
البروتين NLRP12 والبكتيريا Lachnospiraceae تحمي من السمنة ومقاومة الأنسولين
في دراسة أخرى تتعلق بالميكروبات المعوية ، وصف العلماء الوظيفة المضادة للالتهابات لبروتين NLRP12 ، والتي كان لها تأثير إيجابي على الوقاية من السمنة ومرض السكري. ساهم NLRP12 في نمو مستعمرات بكتيريا الأمعاء "الجيدة" ، Lachnospiraceae ، التي تنتج جزيئات صغيرة من الزبدات والبروبيونات. هذه المواد ، بدورها ، لها تأثير إيجابي على صحة الأمعاء وتمنع تطور السمنة ومقاومة الأنسولين.
في البشر ، يتم إنتاج NLRP12 من خلال عدة أنواع من الخلايا المناعية ويبدو أنها تعمل ككبح للالتهاب المفرط. وقد أظهر العمل السابق أن الفئران بالضربة القاضية Nlrp12 عرضة جدًا للالتهاب ، بما في ذلك التهاب القولون التجريبي (التهاب القولون) وسرطان القولون المرتبط به.
في هذه الدراسة ، قام العلماء بتغذية الفئران بالضربة القاضية للجين Nlrp12 (Nlrp12-knockout) والفئران العادية مع الأطعمة عالية الدهون لعدة أشهر. لم يأكل Nlrp12-knockout-mice ولا يشرب أكثر من نظرائه الأصحاء ، ولكن تراكم المزيد من الدهون بشكل ملحوظ واكتسب الكثير من الوزن. وأظهرت الفئران القابلة للنزع أيضًا علامات مقاومة الأنسولين ، والتي ترتبط بانخفاض القدرة على امتصاص الجلوكوز ، وكقاعدة عامة ، تتبع تطور السمنة.
أدى عدم وجود Nlrp12 في هذه الفئران إلى زيادة علامات الالتهاب في الأمعاء وترسبات الدهون ، ولكن لم يتضح كيف أدى ذلك إلى زيادة الوزن الزائد. في المرحلة التالية ، تم تقسيم الفئران بالضربة القاضية Nlrp12 إلى مجموعتين ، واحدة تم علاجها بالمضادات الحيوية. ونتيجة لذلك ، لوحظ فقدان الوزن في الفئران من هذه المجموعة ، وهذا سمح للعلماء باقتراح أن البكتيريا المعوية تشارك في تطور السمنة. أظهرت اختبارات أخرى أنه عندما تم الحفاظ على Nlrp12 الفئران بالضربة القاضية تحت ظروف خالية من البكتيريا ، لم تكتسب الفئران وزنًا ، ولم يؤثر غياب Nlrp12. وقد أظهر ذلك ، وفقًا للعلماء ، أن البكتيريا "السيئة" تسببت في زيادة الوزن الزائد أثناء اتباع نظام غذائي عالي الدهون. يشار إلى أن الفئران المغلوب عليها الحماية أيضًا من السمنة عندما عاشت مع فئران التحكم ، مما يشير إلى أن البكتيريا "الجيدة" من الفئران الضابطة قد تم القضاء عليها وساعدت في حمايتها.
قدم الباحثون أيضًا بكتيريا Lachnospiraceae المفيدة لفئران خروج المغلوب Nlrp12 ووجدوا أن هذه البكتيريا قللت من التهاب الأمعاء ، وقضت على هيمنة بكتيريا Erysipelotrichaceae الضارة ، وساهمت في زيادة تنوع الكائنات الحية الدقيقة. كما قامت Lachnospiraceae بحماية الحيوانات بشكل كبير من السمنة ومقاومة الأنسولين المرتبطة بها. تحتوي Lachnospiraceae على إنزيمات تحول الكربوهيدرات والألياف إلى جزيئات صغيرة تسمى الأحماض الدهنية قصيرة السلسلة (SCFA) وقد لاحظ العلماء أن اثنتين منها ، ولا سيما الزبدة والبروبيونات ، كانت أكبر بشكل كبير عندما زادت كمية Lachnospiraceae في الأمعاء. من المعروف أن الزبدات والبروبيونات لها خصائص مضادة للالتهابات تساهم في صحة الأمعاء. أعطى الباحثون الزبدة والبروبيونات لفئران خروج المغلوب Nlrp12 ووجدوا أنهم يحمون الحيوانات في غياب Nlrp12 وكذلك بكتيريا Lachnospiraceae.
"جميع التغيرات الالتهابية والتمثيل الغذائي التي لاحظناها في الفئران المغلوبة Nlrp12 خلال النظام الغذائي الغني بالدهون تم عكسها بشكل كبير عندما أعادنا تزويدها بـ Lachnospiraceae. تعتمد السمنة على الالتهاب ، وليس فقط على الإفراط في تناول الطعام وقلة التمرينات الرياضية ، وتشير هذه الدراسة إلى أن البكتيريا "الجيدة" الموجودة في الأمعاء تساعد على الحفاظ على وزن صحي. في الفئران ، يقلل NLRP12 من الالتهاب في الأمعاء والأنسجة الدهنية. ومن المعروف أيضًا أن الأشخاص الذين يعانون من السمنة قد قللوا مستويات تعبير NLRP12 "، يكتب الباحثون [7].
تم العثور على جزيء لديه القدرة على منع مرض باركنسون
في سبتمبر من هذا العام ، نُشر مقال لعلماء إسبان حول جزيء جديد يمكن أن يساعد في منع التنكسات العصبية في PNAS.
باستخدام فحص فحص عالي الأداء تم تطويره مؤخرًا ، حددوا SynuClean-D ، وهو مركب صغير يثبط تجمع α-synuclein ، ويدمر الليف النشواني الناضج ، ويمنع انتشار الألياف ، ويعكس انحلال الخلايا العصبية الدوبامينية في النموذج الحيواني لمرض باركنسون.تؤدي الأحداث الجزيئية التي تسبب تطور مرض باركنسون إلى تراكم غير طبيعي لبروتين سينوكلين ألفا في الخلايا العصبية الدوبامينية. تم العثور على تراكم Syn-Syn أيضًا في الخلايا قليلة التغصُّن في المرضى الذين يعانون من ضمور جهازي متعدد (MSA). α-Syn هو بروتين يتم التعبير عنه بكميات كبيرة في الدماغ. يُعتقد أن وظيفة α-Syn مرتبطة بحركة الحويصلات. هذا البروتين هو المكون الرئيسي لأجسام ليفي والعصبية في مرض باركنسون.للكشف عن SynuClean-D ، تم تطوير منهجية لفهرسة مثبطات تراكم α-synuclein بين آلاف الجزيئات المختلفة. بعد تحديد العلماء ، تم إجراء اختبار فيزيائي حيوي في المختبر للنشاط المثبط لـ SynuClean-D ، وأجريت اختبارات لتحديد آلية عمل SynuClean-D في مزارع الخلايا العصبية البشرية قبل اختبار هذه المادة في النماذج الحيوانية. تم أخذ نوعين من الديدان Caenorhabditis elegans مثل هذا النموذج. يعبرون عن α-synuclein في العضلات وفي الخلايا العصبية الدوبامينية. وقد أظهرت التجارب أن إعطاء مثبط محدد ، SynuClean-D ، انخفاض تراكم البروتين ، تحسين حركة الحيوانات ، وحمايته من الضمور العصبي."يبدو أن كل شيء يشير إلى أن الجزيء الذي حددناه ، SynuClean-D ، قد يوفر تطبيقات علاجية لعلاج الأمراض العصبية التنكسية مثل مرض باركنسون في المستقبل. بشكل عام ، يبدو أن SynuClean-D هو جزيء واعد للتدخل العلاجي في مرض باركنسون ". [8].β-hydroxybutyrate يبطئ شيخوخة الأوعية الدموية
في سبتمبر ، نشر مقال للعلماء الأمريكيين حول الوقاية من أمراض القلب والأوعية الدموية المرتبطة بالعمر في مجلة Molecular Cell. وفقًا لدراسة أجرتها جامعة جورجيا ، فإن الجزيء ، الذي يتم إنتاجه أثناء الصيام أو تقييد السعرات الحرارية ، له تأثير مضاد للشيخوخة على نظام الأوعية الدموية ، والذي يمكن أن يقلل من حدوث وشدة الأمراض البشرية المرتبطة بالأوعية الدموية.عندما يتقدم الناس في العمر ، يصبحون أكثر عرضة للإصابة بأمراض مثل السرطان أو أمراض القلب والأوعية الدموية أو مرض الزهايمر. العمر هو أهم عامل خطر للأمراض البشرية. أهم جزء من الشيخوخة هو شيخوخة الأوعية الدموية. مع تقدم العمر ، تصبح الأوعية الدموية حساسة للغاية للإصابات المختلفة ، لذا فإن دراسة شيخوخة الأوعية الدموية مهمة جدًا.في هذا العمل ، بحث العلماء في الآلية غير المعروفة للتأثير الإيجابي لتقييد السعرات الحرارية (تقليل الطعام أو المجاعة الكاملة) على العمليات المرتبطة بالعمر. حدد الباحثون جزيءًا صغيرًا مهمًا يتم إنتاجه أثناء الإجهاد ونقص التغذية - β-hydroxybutyrate. هذه المادة هي نوع من جسم الكيتون ، وينتجها الكبد من الأحماض الدهنية خلال فترات تناول الطعام المنخفض ، والنظام الغذائي الذي يحد من الكربوهيدرات ، والصوم والتمارين الرياضية المكثفة لفترات طويلة.قام الباحثون بتتبع سلسلة كاملة من الآثار الإيجابية لـ β-hydroxybutyrate. في البداية ، عمل على البروتين النووي الريبوني A1 (hnRNP A1) كهدف ربط مباشر. في الخطوة التالية ، عزز hnRNP A1 تعبير عامل النسخ Oct4. حسنًا ، عززت Oct4 مستويات Lamin B1 ، وهو عامل رئيسي في مواجهة تلف الحمض النووي المعتمد على العمر. تنشيط الصيام والحقن داخل الصفاق من β-hydroxybutyrate Oct4 و Lamin B1 في العضلات الملساء الوعائية وفي الخلايا البطانية في الفئران في الجسم الحي. استنتج العلماء أن β-hydroxybutyrate له تأثير مضاد للشيخوخة في خلايا الأوعية الدموية عن طريق تنشيط مسار Lamin B1 عن طريق حث hnRNP A1 و Oct4. [9]يزيد استهلاك الكحول المنخفض للغاية والمفرط من خطر الإصابة بالخرف
في أغسطس 2018 ، تم نشر مقال للباحثين الفرنسيين والإنجليز حول تأثير جرعات مختلفة من الكحول على تطور الخرف. تم تقسيم 9087 مشاركًا تتراوح أعمارهم بين 35-55 عامًا ، واستغرقت ملاحظتهم 23 عامًا في دراسة وايتهول 2 ، والتي فحصت تأثير العوامل الاجتماعية والسلوكية والبيولوجية على الصحة طويلة المدى ، إلى ثلاث مجموعات. تتألف المجموعة الأولى من المشاركين من الأشخاص الذين لا يشربون الكحول عمليًا (صنّفهم العلماء على أنهم خراجات ، أي الامتناع عن ممارسة الجنس). استهلكت المجموعة الثانية من المشاركين من 1 إلى 14 وحدة كحول قياسية (وحدة) في الأسبوع. يبلغ متوسط وحدة الكحول حوالي 12 جرامًا من الكحول النقي. فيما يتعلق بالمشروبات الكحولية ، اتضح أن المجموعة الثانية ، التي يشرب باعتدال ، تتناول زجاجة من البيرة أو كأس من النبيذ يوميًا.واستهلكت المجموعة الثالثة أكثر من 14 وحدة كحول في الأسبوع.كما أظهرت نتائج الملاحظات على المدى الطويل ، فإن الأشخاص الأكثر عرضة لخطر الإصابة بالخرف هم إما الأشخاص الذين لم يشربوا الكحول تقريبًا (فئة الخراج) أو شربوا أكثر من 14 وحدة أسبوعيًا. إذا كان الاتصال بمجموعة الشرب منطقيًا وقابل للتفسير ، فإن الوقوع في فئة المخاطر لتطوير أمراض الأعصاب لغير المدخنين كان مفاجأة للعلماء.أظهر التحليل أن الخطر الزائد من الخرف المرتبط بالامتناع عن الكحول في مرحلة البلوغ تم تفسيره جزئيًا بأمراض القلب والأوعية الدموية ، والتي كانت عاملاً مصاحبًا لغير المدخنين. يؤكد المؤلفون على أن نتائجهم لا يجب أن ينظر إليها على أنها دعوة لغير المدخنين لبدء شرب الكحول: "تعزز نتائجنا الدليل على أن الإفراط في استهلاك الكحول هو عامل خطر للخرف ويشجع على استخدام عتبات منخفضة للكحول في المبادئ التوجيهية لتعزيز الصحة المعرفية في الشيخوخة. ويجب ألا تحفز النتائج التي توصلنا إليها الأشخاص الذين لا يشربون على بدء الشرب ، نظرًا للعواقب السلبية المعروفة لشرب الكحول فيما يتعلق بالوفيات والاضطرابات العصبية والنفسية ،تليف الكبد والسرطان "[1]إلى جانب ذلك ، في أغسطس من نفس العام تم نشر مقال آخر وصف أنه ، على الأرجح ، لا توجد جرعة آمنة من الكحول. كجزء من دراسة واسعة النطاق لدراسة العبء العالمي للأمراض والإصابات وعوامل الخطر لعام 2016 ، قام العلماء بتحليل البيانات الواردة في 694 ورقة علمية حول استهلاك الكحول على مستوى الأفراد والسكان ، بالإضافة إلى 592 دراسة مستقبلية واستعادة لخطر استهلاك الكحول. أظهرت البيانات التي تم الحصول عليها أنه من أجل تحسين الصحة ، من الأفضل عدم الشرب على الإطلاق: "كان مستوى استهلاك الكحول ، الذي قلل من الضرر على الصحة ، صفرًا". [2]
من إعداد أليكسي رزيشيفسكي.المراجع
- Séverine Sabia, Aurore Fayosse, Julien Dumurgier, Aline Dugravot, Tasnime Akbaraly, Annie Britton, Mika Kivimäki, Archana Singh-Manoux. Alcohol consumption and risk of dementia: 23 year follow-up of Whitehall II cohort study. BMJ, 2018;
- GBD 2016 Alcohol Collaborators. Alcohol use and burden for 195 countries and territories, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. Lancet. 2018 Sep 22;392(10152):1015-1035.
- Mitchell SJ, Bernier M et al… Daily Fasting Improves Health and Survival in Male Mice Independent of Diet Composition and Calories. Cell Metab. 2018 Aug 24. pii: S1550-4131(18)30512-6.
- Katherine E. Paterson, Phyo K. Myint Amy Jennings, Lucy KM Bain,Marleen AH Lentjes, Kay-Tee Khaw, and Ailsa A. Welch. The Mediterranean Diet Reduces Risk of Incident Stroke in a Population with Varying Cardiovascular Disease Risk Profiles. Stroke, September 20, 2018.
- Sudharsan Periyasamy-Thandavan, John Burke, Bharati Mendhe, Galina Kondrikova, Ravindra Kolhe, Monte Hunter, Carlos M Isales, Mark W Hamrick, William D Hill, Sadanand Fulzele. MicroRNA-141-3p negatively modulates SDF-1 expression in age dependent pathophysiology of human and murine bone marrow stromal cells. The Journals of Gerontology: Series A, 2018
- Ian J. Passmore, Marine PM Letertre, Mark D. Preston, Irene Bianconi, Mark A. Harrison, Fauzy Nasher, Harparkash Kaur, Huynh A. Hong, Simon D. Baines, Simon M. Cutting, Jonathan R. Swann, Brendan W. Wren, Lisa F. Dawson. Para-cresol production by Clostridium difficile affects microbial diversity and membrane integrity of Gram-negative bacteria. PLOS Pathogens, 2018; 14 (9): e1007191
- Truax AD, Chen L et al. The Inhibitory Innate Immune Sensor NLRP12 Maintains a Threshold against Obesity by Regulating Gut Microbiota Homeostasis. Cell Host Microbe. 2018 Sep 12;24(3):364-378.e6.
- جوردي بوجولز ، صامويل بينيا دياز ، ديانا ف. لازارو ، فرانشيسكا بيكاتي ، فرانسيسكا بينهيرو ، دانيلو جونزاليس ، أنيتا كاريجا ، سوزانا نافارو ، ماريا كوندي-جيمينيز ، خيسوس غارسيا ، سلفادور جواردياف ، إرنست غافيير جاف ، إكس Tiago Fleming Outeiro، Esther Dalfó، Salvador Ventura. يثبط الجزيء الصغير تجمع ألفا سينوكلين ، ويعطل الليف النشواني ، ويمنع انحلال الخلايا العصبية الدوبامينية. Proc Natl Acad Sci US A. 2018 سبتمبر 24. pii: 201804198.
- Han YM ، Bedarida T ، Ding Y ، Somba BK ، Lu Q ، Wang Q ، Song P ، Zou MH. β-Hydroxybutyrate يمنع الشيخوخة الوعائية من خلال hnRNP A1- بوساطة Upregulation من Oct4. خلية مول. 2018 سبتمبر 20؛ 71 (6): 1064-1078.e5.