تسمى الخلايا السينية (القديمة) اليوم الخلايا التي يتم فيها إيقاف دورة الخلية تحت تأثير عوامل مختلفة (الإجهاد أو استنفاد مورد الانقسام). ونتيجة لذلك ، لا تنقسم هذه الخلايا ولا يتم تحديثها.
أعطى مؤتمر الشيخوخة في السرطان والشيخوخة في جامعة كامبريدج التعريف التالي لشيخوخة الخلية: "
تشير الشيخوخة الخلوية إلى التوقف المستمر للانتشار الناجم عن المحفزات الجزيئية المختلفة ، بما في ذلك تنشيط الأورام السرطانية ، وكذلك الانقسامات المفرطة للخلايا. بالإضافة إلى ذلك ، تتميز الخلايا الشيخوخة بإفراز عدد من منظمات اللحمة والمنظم الالتهابي (ما يسمى "مرتبط بشيخوخة النمط الظاهري المصلي") ، والتي تؤثر على عمل الخلايا المجاورة ، بما في ذلك الخلايا المناعية. يشير عدد من الحقائق المقنعة إلى أن شيخوخة الخلايا هي آلية فعالة لقمع نمو الورم. وفي الوقت نفسه ، قد تسهم شيخوخة الخلايا في شيخوخة الأنسجة والكائن الحي بأكمله . "
بسبب الآليات السببية المختلفة ، يتم تمييز ثلاثة أنواع من شيخوخة الخلايا.
تم اكتشاف الشيخوخة الأولى في أوائل الستينيات من القرن الماضي. في العمل المشهور بالفعل ، أثبت علماء الشيخوخة الأمريكيون L. Hayflick و P. Moorhead ، في تجارب مع الخلايا الليفية البشرية المستنبتة ، أن الخلايا لا تنقسم إلى أجل غير مسمى وهناك حد لتقسيم الخلايا (يُطلق عليه لاحقًا حد Hayflick أو حده) [1]. بعد 10 سنوات ، قدم عالم الأحياء السوفياتي أليكسي أولوفنيكوف تفسيرًا منطقيًا لهذه الظاهرة ، وربط حد انقسامات الخلايا بالاختصار التدريجي للأجزاء النهائية من الحمض النووي ، التيلوميرات. هذا يرجع إلى حقيقة أن إنزيم التيلوميراز ، القادر على زيادة التيلوميرات بعد تقصيرها ، غير نشط في معظم الخلايا الجسدية. بعد تقصير التيلوميرات إلى مستوى حرج ، تحدث استجابة تلف الحمض النووي (DDR) ، ونتيجة لذلك تتوقف دورة الخلية وتصبح الخلية شيخوخة. من المعروف أن العوامل الخارجية التي تؤثر سلبًا على الصحة وطول العمر (السمنة ، وعدم ممارسة الرياضة ، والإجهاد) لها أيضًا تأثير سلبي على تقصير التيلومير [2]. أيضا ، لوحظ تسارع الحد من طول التيلومير في المرضى الذين يعانون من أمراض التنكس العصبي ، مثل مرض الزهايمر [3].
بالنسبة لمعظم الخلايا ، يُعتقد أن حد Hayflick هو حوالي 50 قسمًا ، وبعد ذلك تتوقف الخلية عن الانقسام. لتمييز شيخوخة الجسم ككل عن شيخوخة الخلايا ، قدم Hayflick و Moorhead مصطلحًا خاصًا للثورة العلمية ، والتي تشير إلى شيخوخة الخلايا - الشيخوخة (على عكس الشيخوخة - الشيخوخة).
بالإضافة إلى الشيخوخة التكرارية ، يمكن أن يحدث شيخوخة الخلايا أيضًا بسبب عوامل أخرى تحفز شيخوخة الخلايا قبل الأوان بغض النظر عن طول التيلومير. تشكل هذه العوامل النوعين الثاني والثالث من شيخوخة الخلايا.
وبالتالي ، فإن تنشيط الجينات الورمية مثل RAS و RAF يتسبب في شيخوخة الخلية التي تسمى الشيخوخة الخلوية التي يسببها الأورام. يرتبط هذا النوع من شيخوخة الخلايا بقمع الورم. تظهر الدراسات المقارنة الجينومية للخلايا ذات الشيخوخة التكاثرية وشيخوخة OIS أنه على الرغم من وجود بعض التغييرات العامة في التعبير الجيني بين هذين النوعين مقارنة بالخلايا المتكاثرة ، إلا أن هناك أيضًا اختلافات كبيرة [4]. من المعروف أن تلف الحمض النووي المرتبط بأنواع الأكسجين التفاعلية (ROS) يلعب دورًا مهمًا في آليات شيخوخة OIS. يشارك ERK kinase أيضًا بنشاط في حدوث OIS ، مما يحفز تدهور البروتينات اللازمة لتطور دورة الخلية. لم يتم توضيح دور استجابة تلف الحمض النووي (DDR) في هذا النوع من الشيخوخة الخلوية. من المعروف أن للجينات المسرطنة ، مثل H-Ras G12V ، القدرة على تنشيط المسارات الجزيئية لشيخوخة الخلايا المرتبطة بـ p38 MAPK kinase وعامل النسخ NF-kB ، بغض النظر عن تلف الحمض النووي. يمكن لجين راس الورم أن يساهم أيضًا في زيادة تنظيم p53 عبر p19ARF وشيخوخة الخلايا بغض النظر عن تلف الحمض النووي. [5]. لذلك ، لا يتم استبعاد تحفيز شيخوخة OIS الخلوي حتى في غياب تلف الحمض النووي.
النوع الثالث من شيخوخة الخلايا ، وهو مستقل أيضًا عن طول التيلومير ، هو الشيخوخة المبكرة الناتجة عن الإجهاد (SIPS). ينشأ استجابة لعوامل الإجهاد ذات الطبيعة المختلفة: الإشعاع المؤين والأشعة فوق البنفسجية ، زيادة في مستوى ROS ، أدوية العلاج الكيميائي. على عكس شيخوخة OIS ، يعتمد حدوث SIPS بشكل كامل على الاستجابة لتلف الحمض النووي (DDR). من الناحية الظاهرية ، تتشابه SIPS والشيخوخة التكرارية للخلايا إلى حد كبير ، ولكنها قد تختلف على مستوى تعبير البروتين. دور SIPS في الشيخوخة العامة للجسم لا يزال غير واضح تمامًا - زيادة التعبير عن مضادات الأكسدة وقمع ROS ، العوامل الرئيسية في حدوث SIPS ، لم يؤد إلى زيادة في العمر الافتراضي [6].
يتم دراسة الآليات الجزيئية لوقف دورة الخلية في الخلايا المتقدمة بنشاط اليوم. من المعروف أن درجة تلف الحمض النووي تؤثر على دورة الخلية بطرق مختلفة. لذا ، يمكن أن يؤدي تلف الحمض النووي المعتدل إلى توقف مؤقت للنمو ، ويتسبب تلف الحمض النووي الواسع النطاق في موت الخلية المبرمج ، وتلف الحمض النووي المستمر يسبب شيخوخة الخلية. المحددات الجزيئية (العوامل الرئيسية) التي تحكم الانتقال من التعليق المؤقت للنمو إلى توقف الدورة الذي لا رجعة فيه للدورة معقدة ولم يتم وصفها بالكامل بعد. من المعروف أن تلف الحمض النووي ينشط في البداية مسار p53-p21 ، الذي يوقف دورة الخلية. ثم ، إذا لم يتم إصلاح تلف الحمض النووي ، فإن الخلية إما تذهب إلى موت الخلايا المبرمج أو تصبح الشيخوخة. في الحالة الثانية ، يتم لعب الدور الرئيسي بواسطة بروتين p16 INK4a ، الذي ينظم الحفاظ طويل الأمد على توقف دورة الخلية من خلال مسار إشارات pRb-E2F (بروتين ورم أرومي شبكي ، عامل النسخ pRb –E2F) والتغيرات في بنية الكروماتين [7].
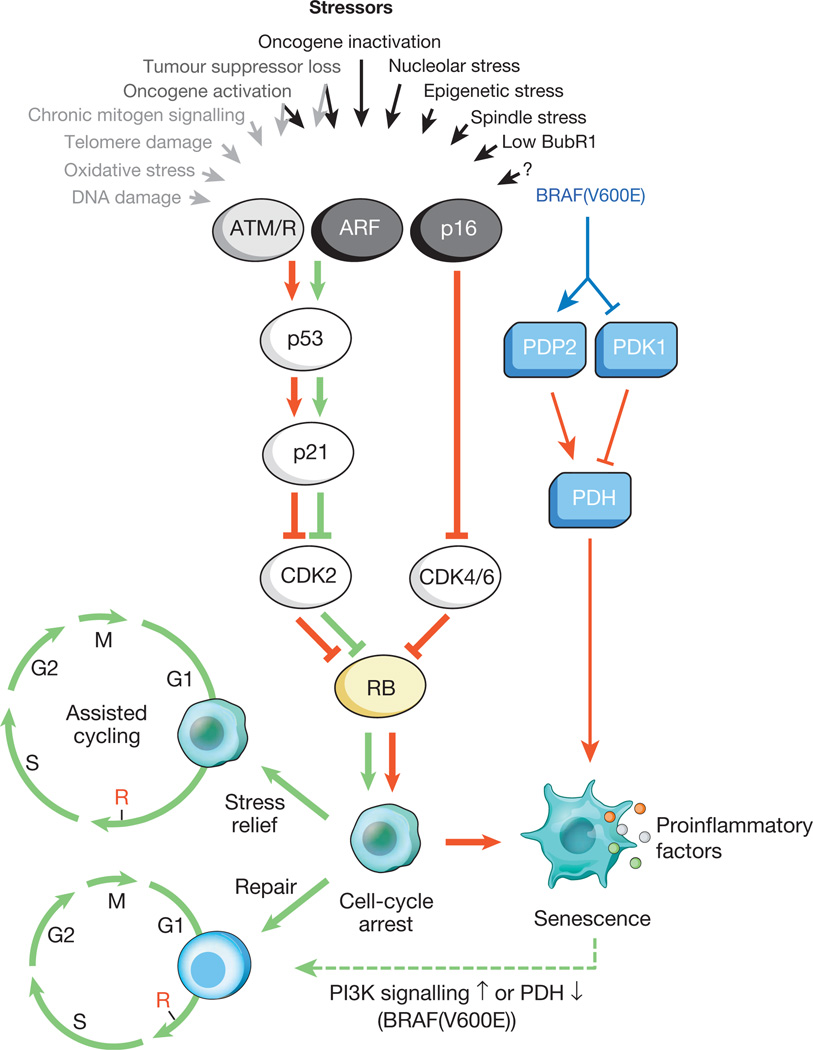
الشكل 1.
المحفزات التي تسبب شيخوخة الخلايا ومسارات المستجيب الرئيسييمكن لمجموعة متنوعة من الضغوط داخل الخلايا والخارجية تنشيط برنامج الشيخوخة الخلوية. تلتقط هذه الضغوطات العديد من سلاسل الإشارات الخلوية ، وتنشط في النهاية p53 و p16 INK4a. يشار إلى أنواع الإجهاد التي تنشط إشارات p53 عبر DDR بالنص الرمادي والسهام (ROS (ROS) تتسبب في استجابة تلف الحمض النووي (DDR) ، وتعطيل النسخ الجيني وتكرار الحمض النووي ، وكذلك تقصير التيلوميرات). يحث p53 المنشط p21 ، مما يسبب توقف مؤقت لدورة الخلية عن طريق تثبيط cyclin E-Cdk2. يمنع p16 INK4a أيضًا تقدم دورة الخلية ، ولكنه يفعل ذلك من خلال استهداف مجمعات cyclin D-Cdk4 و cyclin D-Cdk6. يعمل كل من p21 و p16 INK4a على منع تعطيل Rb ، مما يؤدي إلى استمرار قمع الجينات المستهدفة E2F اللازمة لبداية المرحلة S. مع الضغط الشديد (الأسهم الحمراء) ، تدخل الخلايا المحظورة مؤقتًا في مرحلة الإيقاف لدورة الخلية. يمكن استعادة الخلايا المعرضة للتلف البسيط بنجاح واستئناف الدورة الطبيعية. وبالتالي ، يمكن للمسار p53-p21 أن يعادي أو يتآزر مع p16 INK4a في الشيخوخة اعتمادًا على نوع ومستوى الإجهاد. يرتبط BRAF (V600E) بالشيخوخة من خلال مسار المستجيب الأيضي. يقوم BRAF (V600E) بتنشيط PDH عن طريق تحفيز PDP2 وتثبيط التعبير عن PDK1 ، مما يشجع على التحول من التحلل السكري إلى الفسفرة التأكسدية ، مما يسبب إجهاد الأكسدة والاختزال. تحرض الخلايا التي تخضع للشيخوخة نسخة التهابية بغض النظر عن الإجهاد المحرض المرتبط بالشيخوخة (تمثل النقاط الملونة عوامل SASP مختلفة). يشير السهمان الأحمر والأخضر ، على التوالي ، إلى النشاط الذي يعزز الشيخوخة و "مكافحة الشيخوخة". يشير السهم الأخضر المتقطع إلى آلية "تغير الشيخوخة".من المعروف أن الخلايا السنية تؤثر بنشاط على بيئتها الدقيقة (الأنسجة المحيطة بها) ، وتفرز عددًا من الجزيئات النشطة: السيتوكينات المؤيدة للالتهابات ، والكيميوكينات ، وعوامل النمو ، والبروتياز (ما مجموعه حوالي 40 نوعًا مختلفًا من الجزيئات). تم دمج هذه المواد في مجموعة واحدة - النمط الظاهري الإفرازي المرتبط بالشيخوخة (SASP) المرتبط بشيخوخة الخلايا. من المعروف أن عوامل SASP تشارك بنشاط في إعادة تشكيل الأنسجة في التطور الجنيني. علاوة على ذلك ، تحت تأثيرهم ، يتم إعادة بناء كل من جسد الأم والجنين. يعتقد أن الطبيعة التطورية لـ SASP ترتبط بعدد من آليات الدفاع: قمع الورم ، التعافي من الصدمة ، وتجديد الأنسجة.
يمكن وصف التأثير الفسيولوجي المبسط لـ SASP على النحو التالي. تشكل الجزيئات الموالية للالتهابات التي يتم إفرازها بؤرة للالتهاب حول الخلايا المسنة لإزالة. ما يجذب خلايا الجهاز المناعي إلى هذا المكان للقضاء على خلايا الشيخوخة. مصفوفة SASP metalloproteases (MMP-1 ، MMP-10 ، MMP-3) و البروتياز سيرين يعيد تشكيل المصفوفة خارج الخلية لتسهيل اختراق خلايا الجهاز المناعي إلى خلايا الشيخوخة. وأخيرًا ، تحفز عوامل النمو المفرزة تكاثر الخلايا المجاورة لتحل محل الخلايا الشيخوخة النائية.
يوصف كيف يجب أن تعمل آلية SASP بشكل طبيعي ، في جسم شاب وصحي. ولكن مع تقدم العمر والانحرافات ، يمكن أن تنخفض فعاليته بشكل كبير ، مما يتسبب في تراكم الخلايا الشيخوخة في الأنسجة ، ونتيجة لذلك ، إفراز مطول لعوامل SASP المؤيدة للالتهابات. والذي يصاحبه حدوث بؤر الالتهاب المزمن. بالإضافة إلى ذلك ، من المعروف أن نشاط SASP المطول بمثابة عدوى على الخلايا الطبيعية. تدخل الجزيئات النشطة التي تفرزها الخلايا المتقدمة في الفضاء خارج الخلية ، وتعمل على توقيف دورة الخلية وتوقيف الانتشار ، بناءً على الخلايا الطبيعية المجاورة. مما يسرع إلى حد كبير من تطور الشيخوخة الخلوية في الأنسجة.
بالإضافة إلى ذلك ، يرتبط الإفراز لفترات طويلة لعوامل SASP بواسطة خلايا الشيخوخة بتطور الأمراض المرتبطة بالعمر. وبالتالي ، يحفز إفراز الخلايا المصابة بالميتالبروتيس المصفوفة المعدنية تطور أمراض القلب التاجية وهشاشة العظام وهشاشة العظام. تشارك خلايا العضلات الملساء السينية في تطور تصلب الشرايين ، من خلال إفراز عدد كبير من السيتوكينات المؤيدة للالتهابات. إن الإفراز المطول للعامل المؤيد للالتهابات TNF-α بواسطة الخلايا التائية السينية متورط في العمليات المرتبطة بخلل العظام. بالإضافة إلى ذلك ، من المعروف أن الزيادة في مستوى IL-6 المؤيد للالتهابات ترتبط بمقاومة الأنسولين ومرض السكري وتصلب الشرايين وأمراض الكبد. للإشارة إلى كل هذه العمليات المرتبطة بالالتهاب المزمن الجهازي والشيخوخة ، حيث تلعب عوامل SASP دورًا رئيسيًا ، تم إدخال مصطلح خاص - الالتهاب. بالإضافة إلى ذلك ، تم وصف الدور المزدوج لـ SASP في سرطنة - نشاطها في تثبيط الورم وتعزيز الورم [8].
فيما يتعلق بالدور المزدوج لشيخوخة الخلايا الموصوفة أعلاه في الصغار والكبار ، يعتبر بعض العلماء شيخوخة الخلايا كمثال على تضخم الأوعية الدموية المتضاد ، والذي لا يزال يتم صياغته بشكل فكاهي بعبارة "استخدم الآن - ادفع لاحقًا". وفقًا لهذه النظرية ، فإن العمليات التي أصبحت راسخة في التطور لزيادة بقاء الكائنات الحية الصغيرة يمكن أن يكون لها تأثيرات ضارة تراكمية لدى كبار السن. لذا ، فإن الآليات المرتبطة بالخلايا الشيخوخة في سن مبكرة تشارك في الحمل والتعافي من الإصابات والحماية من الأورام. في سن متأخرة ، تسبب الآليات نفسها التهابًا جهازيًا ، وانحطاط الأنسجة وتطور الأمراض [9].
من بين مجموعة خلايا الجسم الشيخوخة ، يسلط مؤلفو مفهوم SENS الضوء على نوعين مرتبطين بأنسجة دهنية: الخلايا قبل الخلايا وخلايا الأنسجة الدهنية الحشوية. وهذا ليس من قبيل المصادفة ، لأنه من المعروف اليوم أن الدهون الحشوية نشطة في التمثيل الغذائي وتطلق عددًا من الجزيئات النشطة - الأديبوكينات. وهذا بدوره يرتبط بتطور عدد من الأمراض المرتبطة بالعمر (مقاومة الأنسولين ، السكري ، أمراض القلب والأوعية الدموية). يركز مؤلفو SENS أيضًا على تدهور جهاز المناعة المرتبط بالعمر. في رأيهم ، هذا يرجع إلى الحمل الزائد للجسم من قبل خلايا الشيخوخة ، وكإجابة على ذلك ، الإفراط في إنتاج القتلة التائية التي تدمر الخلايا الشيخوخة على حساب أنواع أخرى من الخلايا المناعية. ما الذي يجعل جسم الشيخوخة عرضة للإصابة بالعدوى المختلفة.
يرى مؤلفو SENS حلًا لمشكلة تراكم الخلايا السينية في اتجاهين. الأول هو تطوير عقاقير سامة للخلايا القديمة ، أو تسبب موت الخلايا المبرمج ، ولكنها غير ضارة للخلايا السليمة والصحية. والاتجاه الثاني هو البحث عن المنشطات للجهاز المناعي للبحث الانتقائي في الخلايا المستهدفة الشيخوخة وقتلها. الطريقة الأكثر ترجيحًا لمهاجمة هذه الخلايا غير الطبيعية بشكل انتقائي ، وفقًا لمطوري SENS ، هي استخدام الجزيئات المميزة الموجودة على أسطحها. في الواقع ، هناك أنواع مختلفة من الخلايا لديها اختلافات في أسطحها. لذلك ، فإن الخطوة الأولى هي تحديد وتوجيه علامات سطح الخلية الخاصة بالخلايا المتقدمة المراد إزالتها. هذه الاستراتيجية ليست مجردة ، لكنها تشكل بالفعل أساسًا لبعض علاجات السرطان التي تمنع نمو الخلايا وتجذب الخلايا المناعية لتدميرها [10].
وقد أظهرت الدراسات أن الخلايا المسنة تتراكم مع تقدم العمر في الأنسجة المختلفة [11]. كما تم وصف أن القضاء على الخلايا المتقدمة التي تتراكم في نموذج من الفئران التي تتقدم في العمر بسرعة يمنع ظهور ثلاثة أنماط رئيسية من الشيخوخة (إعتام عدسة العين ، ساركوبينيا ، فقدان الدهون تحت الجلد) [12]. في هذا الصدد ، من الواضح تمامًا أن هناك حاجة لتحديد مؤشرات حيوية موثوقة وفعالة لشيخوخة الخلايا. وهي ضرورية في المقام الأول لتتبع آثار الأدوية الكيسية المحتملة.
في معظم الأحيان ، يستخدم بيتا غالاكتوزيداز المرتبط بالشيخوخة ، SA-β-Gal ، كمؤشر حيوي لخلايا الشيخوخة. إنزيم gal-galactosidase هو هيدرولاز lysosomal الذي يكسر جلاكتوز بيتا الطرفي من المركبات التي تحتوي عليه (اللاكتوز ، كبريتات الكيراتين ، سفينغوليبيدات ، إلخ). مرة أخرى في عام 1995 ، تم وصف أن تعبير SA-β-Gal زاد بشكل كبير في خلايا الشيخوخة. يتم استخدام طريقة المناعية لتحديد محتواها في أنسجة الشيخوخة. كطريقة بديلة لتحديد نشاط SA-β-gal في الخلايا ، يتم استخدام قياس التدفق الخلوي باستخدام 5-dodecanoylaminofluorescein di-β-D-galactopyranoside كركيزة.
ومع ذلك ، فإن استخدام SA-β-Gal كمؤشر حيوي لشيخوخة الخلايا له قيوده الخاصة ، حيث أن هذا الإنزيم يمكن أن يعطي نتائج إيجابية خاطئة ، مما يزيد من التعبير ليس فقط في الخلايا الشيخوخة ، ولكن أيضًا في الخلايا "الصغيرة" ، والتي ، لأسباب مختلفة ، يكون الانتشار محدودًا. لذلك ، يُنصح اليوم باستخدام SA-β-Gal مع العلامات الأخرى لشيخوخة الخلايا.
في عام 2017 ، طور علم الخلايا الإسرائيلي تقنية جديدة أكثر كفاءة تعتمد على قياس التدفق الخلوي باستخدام مقياس الخلايا ImageStreamX. سمحت هذه الطريقة بالكشف عن SA-β-Gal في الأنسجة بكفاءة أكثر من 80 ٪. لزيادة كفاءة التحليل ، حدد العلماء ، جنبًا إلى جنب مع SA-β-Gal ، العديد من المؤشرات الحيوية الأخرى لشيخوخة الخلايا - البروتينات HMGB1 و γH2AX. HMGB1 هو بروتين من مجموعة البروتينات النووية غير الهيستونية HMG ، في الخلايا المتقدمة يترك النواة وينتقل إلى الفضاء خارج الخلية. γH2AX ، وهو شكل فسفوري من الهيستون H2AX ، هو علامة معترف بها لتلف الحمض النووي المبكر وشيخوخة الخلايا. بالإضافة إلى ذلك ، فإن طريقة جديدة من قبل العلماء الإسرائيليين جعلت من الممكن تحديد خلايا الشيخوخة من خلال زيادة حجمها. وفقًا للباحثين ، يمكن استخدام تكنولوجيتهم بسرعة وتحديد فعالية المركبات الصيدلانية الجديدة التي سيتم تصميمها خصيصًا للقضاء على خلايا الشيخوخة من الأنسجة. [13].
قد تكون بؤر هيتروكروماتين (SAHF) المرتبطة بالشيخوخة الخلوية أيضًا علامة بيولوجية أخرى للشيخوخة. SAHFs هي هياكل خاصة غير متجانسة تتشكل في نوى الخلايا الشيخوخة. يرتبط تكوينها بالكروماتين غير المتماثل غير القابل للانعكاس المرتبط بتعطيل الجينات المشاركة في دورة الخلية الموجودة في هذا الموقع (MCM3 ، PCNA ، Cyclin A). يمكن رؤية SAHF تحت المجهر بعد تلوينه بصبغة DAPI خاصة. بالإضافة إلى ذلك ، تم وصف زيادة التعبير عن بروتين سرطان الدم بروميلوسيتيك (PML) في خلايا الشيخوخة ، والتي يمكن أيضًا أن تكون علامة إضافية لشيخوخة الخلايا [14].
وصف باحثون أمريكيون بروتين P16 INK4a من خلايا T المحيطية البشرية كعلامة بيولوجية لشيخوخة الخلايا. p16 INK4a ، كما هو موضح أعلاه ، يأخذ دورًا نشطًا في إيقاف دورة الخلية للخلايا الشيخوخة. يتم زيادة التعبير عن p16 INK4a في الخلايا المتقدمة ، وكما اتضح ، ارتبط بشكل كبير بالتدخين والخمول البدني. بالإضافة إلى ذلك ، ارتبط التعبير عن p16 INK4a بتركيز البلازما IL-6 ، وهو مؤشر للالتهاب المرتبط بالعمر. وفقا للعلماء ، فإن التعبير عن p16 INK4a هو مؤشر حيوي للدم المحيطي يسهل قياسه لتحديد شيخوخة الخلايا [15].التذييل 1.المؤشرات الحيوية لشيخوخة الخلايا.1. يرتبط مع شيخوخة الخلايا β-galactosidase (بيتا غالاكتوزيداز المرتبطة الشيخوخة ، SA-β-Gal).2. البروتين HMGB1 (بروتين مجموعة عالية الحركة B1).3. هيستون فسفوريلاتيد γH2AX.4. يرتبط بؤر الشيخوخة الخلوية غير المتجانسة (SAHF).5. اللوكيميا بروميلوسيتيك بروتين (PML).6. بروتين ص 16 INK4a.المؤلف: أليكسي رزيشيفسكي.المراجع1. L.HayflickP.S.Moorhead. The serial cultivation of human diploid cell strains. Exp Cell Res. 1961 Dec;25:585-621.
2. Epel ES, Blackburn EH, Lin J, Dhabhar FS, Adler NE, Morrow JD, Cawthon RM. Accelerated telomere shortening in response to life stress. Proc Natl Acad Sci US A. 2004 Dec 7;101(49):17312-5.
3. Panossian LA, Porter VR, Valenzuela HF, Zhu X, Reback E, Masterman D, Cummings JL, Effros RB. Telomere shortening in T cells correlates with Alzheimer's disease status. شيخوخة نيوروبيول. 2003 Jan-Feb;24(1):77-84.
4. Nelson DM1, McBryan T, Jeyapalan JC, Sedivy JM, Adams PD. A comparison of oncogene-induced senescence and replicative senescence: implications for tumor suppression and aging. Age (Dordr). 2014 Jun;36(3):9637.
5. Palmero I, Pantoja C, Serrano M. p19ARF links the tumour suppressor p53 to Ras. Nature. 1998 Sep 10; 395(6698):125-6.
6. Pérez VI1, Van Remmen H, Bokov A, Epstein CJ, Vijg J, Richardson A. The overexpression of major antioxidant enzymes does not extend the lifespan of mice. Aging Cell. 2009 Feb;8(1):73-5.
7. Narita M, Nũnez S, Heard E, Narita M, Lin AW, Hearn SA, Spector DL, Hannon GJ, Lowe SW. Rb-mediated heterochromatin formation and silencing of E2F target genes during cellular senescence. Cell. 2003 Jun 13; 113(6):703-16.
8. .., .., .., .. « » : SASP ? Acta Naturae, 2018, 10(1). .4-15.
9. Shankar J. Chinta, Georgia Woods, Anand Rane, Marco Demaria, Judith Campisi, and Julie K Andersen. Cellular senescence and the aging brain. Exp Gerontol. 2015 Aug; 68: 3–7.
10. ApoptoSENS: Removing dysfunctional cells.
11. Jeyapalan JC, Ferreira M, Sedivy JM, Herbig U. Accumulation of senescent cells in mitotic tissue of aging primates. Mech Ageing Dev. 2007 Jan;128(1):36-44.
12. Baker DJ, Wijshake T, Tchkonia T, LeBrasseur NK, Childs BG, van de Sluis B, Kirkland JL, van Deursen JM. Clearance of p16Ink4a-positive senescent cells delays ageing-associated disorders. Nature. 2011 Nov 2;479(7372):232-6.
13. Anat Biran, Lior Zada, Paula Abou Karam, Ezra Vadai, Lior Roitman, Yossi Ovadya, Ziv Porat, and Valery Krizhanovsky. Quantitative identification of senescent cells in aging and disease. Aging Cell. 2017 Aug; 16(4): 661–671.
14. Bruno Bernardes de Jesus and Maria A. Blasco. Assessing Cell and Organ Senescence Biomarkers. Circ Res. 2012 Jun 22; 111(1): 97–109.
15. Yan Liu, Hanna K. Sanoff, Hyunsoon Cho, Christin E. Burd, Chad Torrice, Joseph G Ibrahim, Nancy E. Thomas, and Norman E. Sharpless. Expression of p16INK4a in peripheral blood T-cells is a biomarker of human aging. Aging Cell. 2009 Aug; 8(4): 439–448.