مرحباً هبر! اليوم نواصل القصة الأخيرة حول الحمض النووي. في ذلك ، تحدثنا عن
مقدار ما يحدث ، وكيف يتم تخزين الحمض النووي وسبب أهميته . سنبدأ اليوم بخلفية تاريخية وننتهي بأساسيات معلومات الترميز في DNA.
القصة
تم عزل الحمض النووي نفسه في عام 1869 بواسطة يوهان فريدريش ميشر من خلايا الدم البيضاء التي تلقاها من القيح. خلايا الدم البيضاء هي خلايا الدم البيضاء التي تؤدي وظيفة وقائية. هناك الكثير منها في الصديد ، لأنها تميل إلى تلف الأنسجة ، حيث تأكلها الخلايا البكتيرية. عزل مادة تحتوي على النيتروجين والفسفور. في البداية كان يطلق عليه النوكلين ، عندما اكتشف الخصائص الحمضية ، تم تغيير الاسم إلى الحمض النووي. كانت الوظيفة البيولوجية للمادة المكتشفة حديثًا غير واضحة ، وكان يعتقد لفترة طويلة أن الفوسفور تم تخزينه فيه. حتى في بداية القرن العشرين ، اعتقد العديد من علماء الأحياء أن الحمض النووي لا علاقة له بنقل المعلومات ، لأن بنية الجزيء ، كما بدا آنذاك ، كانت رتيبة للغاية ولا يمكنها ترميز الكثير من المعلومات.
بحلول عام 1901 ، عزل ألبريشت كوسيل قواعد النيتروجين الخمس التي يتكون منها DNA و RNA ووصفها. وبعد ذلك بقليل ، وجد بيتر لوفين أن مكون الكربوهيدرات في الأحماض النووية هو deoxyribose و ribose. تسمى الأحماض النووية ، التي تشمل الريبوز ، أحماض ريبونوكليكية أو باختصار حمض نووي ريبيزي ، وأولئك الذين احتوا على deoxyribose أو deoxyribonucleic acids أو DNA.
الآن ، طرح السؤال حول كيفية ترابط الروابط الفردية. لهذا ، يجب تدمير حبلا الحمض النووي والنظر في ما سيحدث بعد التدمير. لهذا ، تم تحلل بوليمر الحمض النووي. ومع ذلك ، قام لوفين بتغيير طريقة التحلل المائي. الآن ، بدلاً من الغليان لساعات عديدة في بيئة حمضية ، استخدم الإنزيمات. هذه المرة ، لم يتم فقط عزل الأدينين ، والجوانين ، والثيمين ، والسيتوزين ، و deoxyribose وحمض الفوسفوريك من hydrolysates ، ولكن أيضًا أجزاء أكبر ، على سبيل المثال ، مركبات القواعد النيتروجينية مع الكربوهيدرات أو الكربوهيدرات مع حمض الفوسفوريك. في الوقت نفسه
، لم يتم العثور على مركبات تتكون من قاعدتي نيتروجين أو مركبات من نوع حمض الفوسفوريك الأساسي في هيدرو حمضات النواة . أي ، أصبح من الواضح أن حمض الفوسفوريك يتحد مع السكر ، وبالتالي ، مع قاعدة نيتروجينية. تم اقتراح مركبات القواعد النيتروجينية مع الكربوهيدرات ليتم تسميتها النيوكليوسيدات ، واسترات الفوسفوريك من النيوكليوسيدات تسمى النيوكليوتيدات.
نتيجة لهذه الأعمال ، خلص لوفين إلى أن الأحماض النووية هي بوليمرات. تعمل النيوكليوتيدات كمونومرات. يبدو أن محتوى كل من النيوكليوتيدات الأربعة في الحمض النووي ، أو RNA ، وفقًا للتحليل الكيميائي في ذلك الوقت ، متساوٍ مع ليفين. لذلك ، اقترح لوفين النظرية التالية لهيكل الأحماض النووية: إنها بوليمرات تكون مونومراتها عبارة عن كتل من أربعة نيوكليوتيدات متصلة في سلسلة.
بدت نظرية بنية رباعي النوكليوتيد في ذلك الوقت مبررة تمامًا ، بعد أن دخلت جميع الكتب المدرسية في فترة ما قبل الحرب. ومع ذلك ، ظلت مسألة وظيفة الحمض النووي غير واضحة. استغرق الأمر ما يقرب من نصف قرن لتوضيح هذه القضية.
وحدثت فترة تراكم خلالها علماء الأحياء معلومات حول توزيع الأحماض النووية في أنواع مختلفة من الأنسجة الحيوانية والنباتية ، في البكتيريا والفيروسات ، في بعض الكائنات وحيدة الخلية.
في ذلك الوقت ، اعتقد المجتمع العلمي بجدية أن البروتينات هي المسؤولة عن تخزين المعلومات الجينية. لم تسمح لنا الفكرة التقليدية للدور الأساسي للبروتينات في عملية الحياة أن نفكر في أن مادة مهمة مثل مادة الوراثة يمكن أن تكون أي شيء سوى البروتين. كانت البروتينات متنوعة للغاية في البنية ، والتي لم تستطع بعد ذلك قول الأحماض النووية. حسب عالم الوراثة السوفياتي الشهير ن.ك. كولتسوف أنه من خلال تغيير تسلسل 20 من الأحماض الأمينية التي تشكل جزيء البروتين ، يمكن إنشاء تريليونات من البروتينات المختلفة.
إذا أردنا أن نطبع في الشكل الأكثر بساطة كيفية طباعة الجداول اللوغاريتمية ، فإن هذا الترليون جزيء سيوفر جميع دور الطباعة الموجودة في العالم لهذه الخطة ، وينتج 50000 مجلد من 100 ورقة مطبوعة سنويًا ، فعندئذٍ سيكون قد مر الكثير من الوقت قبل نهاية العمل المضطلع به ، كم مر منذ فترة الأرتش في أيامنا.
حقا الكثير ... 20 في العشرين ... لكن التسلسلات أطول بكثير من 20 من الأحماض الأمينية.
وهذا ما يكتبه A. R. Kizel عن هذا - أحد أكثر الكيميائيين الحيويين في ذلك الوقت.
من وجهات النظر التي أعطيت للتو حول دور الحمض النووي ... يستتبع ذلك أنه لا يشارك في بنية الجينات ويترتب على ذلك أن الجينات تتكون من بعض المواد الأخرى. ما زلنا لا نعرف هذه المواد بشكل موثوق ، على الرغم من حقيقة أنها تسمى في معظم الحالات بروتين.
جاء النجاح الأول من علم الأحياء الدقيقة. في عام 1944 ، تم نشر نتائج تجارب Avery والعاملين (الولايات المتحدة الأمريكية) على تحول البكتيريا. بضع كلمات حول التحول.
تم اكتشاف التحول نفسه في عام 1928 من قبل عالم الأحياء الدقيقة جريفيث.
عمل غريفيث مع مستنبتات المكورات الرئوية (المكورات الرئوية) ، العامل المسبب لأحد أشكال الالتهاب الرئوي. بعض سلالات هذه البكتيريا شديدة ، وتسبب الالتهاب الرئوي. خلاياهم مغلفة بكبسولة عديد السكاريد التي تحمي البكتيريا من عمل الجهاز المناعي. في الثقافة ، تشكل هذه البكتيريا مستعمرات ناعمة كبيرة ذات شكل كروي منتظم. ونتيجة لذلك ، يطلق عليها سلالات S (من الإنجليزية السلس - السلس).
هناك العديد من السلالات الخبيثة للمكورات الرئوية ، وتختلف في الأجسام المضادة التي يتم إنتاجها في الجسم عندما تدخلها البكتيريا. يطلق عليها IS ، IIS ، IIIS ، إلخ. من وقت لآخر ، تتحول بعض خلايا سلالات S الخبيثة ، وتفقد القدرة على تركيب غشاء عديد السكاريد ، وتصبح عديمة الفوعة. في الثقافة ، يشكلون مستعمرات خشنة صغيرة الشكل غير منتظم ، ولهذا السبب يطلق عليهم سلالات R (من الإنجليزية الخام - الخام). في بعض الأحيان تحدث الطفرات العكسية ، واستعادة القدرة على تركيب غشاء عديد السكاريد ، ولكن فقط في مجموعات من السلالات المقابلة:
IIS - IIR
IIIS - IIIR
هذا يشير إلى أن سلالات R الفائقة تتوافق دائمًا مع سلالة S الخبيثة الأصلية.
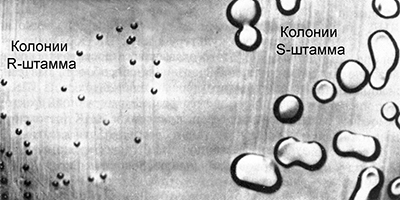
قدم جريفيث مجموعات مختلفة من الفئران المعملية وهي سلالة ضارية وعنيفة من المكورات الرئوية. في المجموعة الضابطة الأولى ، أدى حقن سلالة خبيثة من IIIS إلى موت الحيوانات. ظلت حيوانات المجموعة الضابطة الثانية على قيد الحياة بعد حقن السلالة الفيروسية IIR. بعد ذلك ، قام Griffith بتسخين الحل مع ثقافة السلالة الخبيثة IIIS عند درجة حرارة 60 درجة مئوية ، مما أدى إلى وفاة البكتيريا. قدم البكتيريا التي قتلت بالتسخين إلى المجموعة الثالثة من الفئران التجريبية. ظلت الحيوانات على قيد الحياة ، وهو أمر متوقع من حيث المبدأ. ومع ذلك ، هذا ليس كل شيء. قدم أجزاء من الفئران الباقية على قيد الحياة إلى بكتيريا السلالة الفيروسية IIR.
يبدو أن هذا لا يمكن أن يؤدي إلى أي عواقب رهيبة على الفئران. ومع ذلك ، على عكس التوقعات ، ماتت الحيوانات. عندما تم عزل البكتيريا من أجسامها وزرعت في الثقافة ، اتضح أنها تنتمي إلى السلالة الخبيثة IIIS.

حقيقة أن الخلايا التي تسببت في موت الفئران صنعت غشاء عديد السكاريد من النوع الثالث ، بدلاً من الثاني ، أشارت إلى أنها لم تكن قد نشأت نتيجة للتحول العكسي IIR - IIS. من هذا ، توصل جريفيث إلى نتيجة مهمة للغاية. يمكن أن تتحول البكتيريا العارية من السلالة IIR إلى بكتريا خبيثة بطريقة ما تتفاعل مع بكتيريا سلالة IIIS المميتة للحرارة والتي لا تزال باقية في جسم الفئران. بمعنى آخر ، تتلقى البكتيريا العارية من السلالة IIR عاملاً من البكتيريا الميتة من السلالة IIIS التي تحولها إلى سلالات خبيثة. ومع ذلك ، ما هو هذا العامل ، لم يعرف جريفيث.
في الواقع ، كانت هذه الظاهرة تسمى التحول البكتيري. إنه انتقال أحادي الاتجاه للصفات الوراثية من خلية بكتيرية إلى أخرى.
نعود الآن إلى تجارب Avery. تصميم تجاربهم يشبه إلى حد ما تجارب غريفيث. تعيين Avery والموظفين أنفسهم مهمة معرفة الطبيعة الكيميائية لعامل التحويل. لقد دمروا تعليق المكورات الرئوية وإزالة البروتينات ، وعديد السكاريد المحفوظ و RNA من المستخلص ، ومع ذلك ، ظل نشاط التحويل للمستخلص. لم يضيع نشاط التحويل للدواء أثناء معالجته بالتربسين البلوري أو الكيموتربسين (تدمير البروتينات) ، ريبونوكلياز (يدمر الحمض النووي الريبي). كان من الواضح أن الدواء لم يكن البروتين ولا الحمض النووي الريبي. ومع ذلك ، فقد نشاط التحويل للدواء تمامًا عندما تم علاجه باستخدام deoxyribonuclease (إتلاف DNA) ، وتسببت كميات ضئيلة من الإنزيم في تعطيل كامل للدواء. وهكذا ، وجد أن عامل التحول في البكتيريا هو DNA النقي. كان هذا الاستنتاج اكتشافًا مهمًا ، وكان Avery على دراية بذلك. كتب أن هذا هو بالضبط ما حلمت به الوراثة ، وهو مادة الجين. هنا يبدو أنه دليل. ولكن الإيمان بالبروتين ، باعتباره مادة وراثة ، كان قويًا جدًا. يعتقد البعض أن التحول يمكن أن يسبب وتلك الشوائب البروتينية غير المهمة التي بقيت في الدواء.
كان الدليل الجديد على الدور الجيني المباشر للحمض النووي تجربة علماء الفيروسات هيرشي وتشيس. لقد عملوا مع البكتيريا T2 (البكتيريا - فيروسات البكتيريا) ، التي تصيب بكتيريا
الإشريكية القولونية (E. coli).
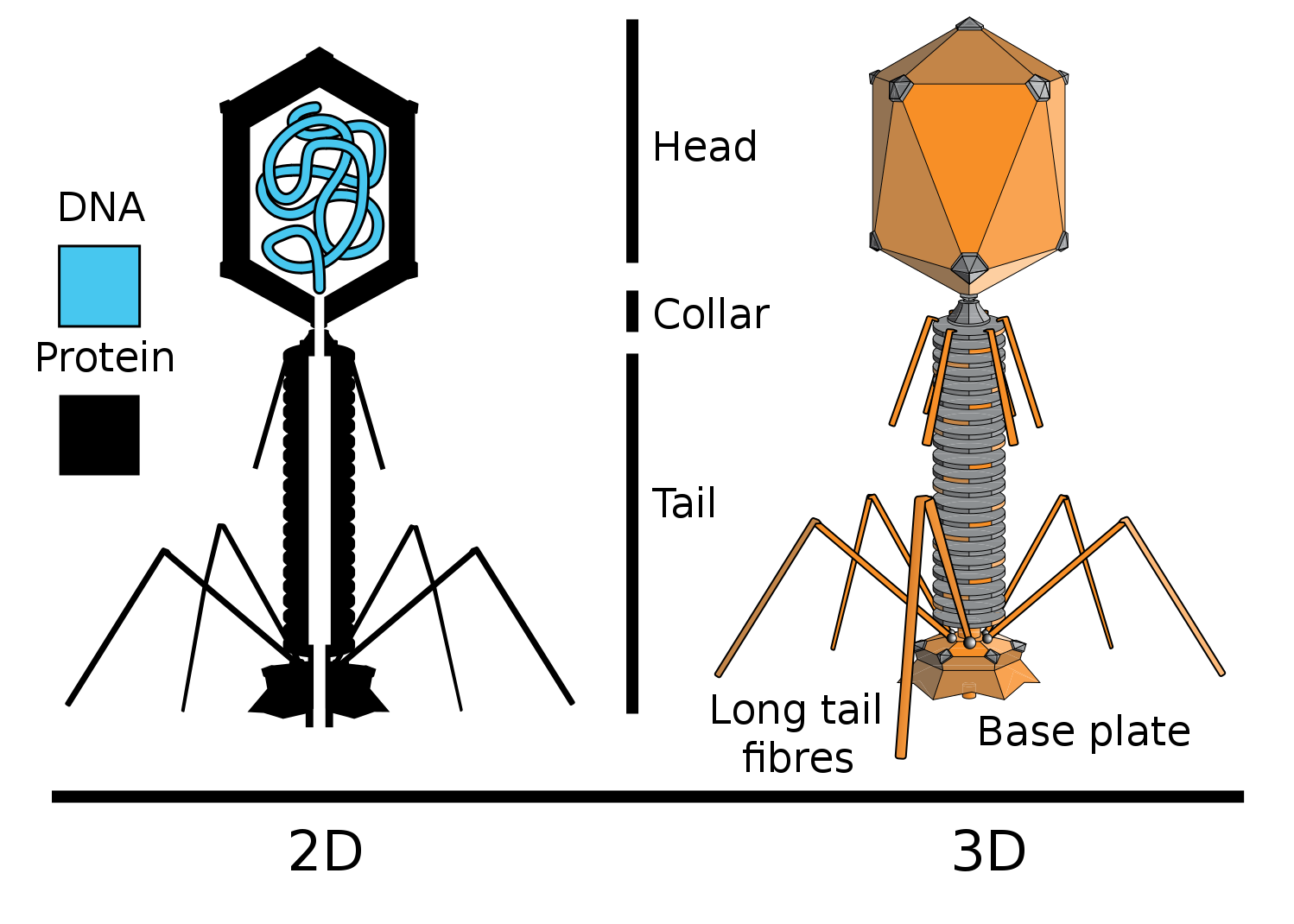
في الواقع ما فعلوه. تضمنت الفوسفور المشع في تكوين الحمض النووي لبعض البكتيريا (P32) ، ونظائر الكبريت في تكوين بروتينات أخرى (S35). لهذا ، نمت بعض البكتيريا على وسيط مع إضافة الفوسفور المشع في أيون الفوسفات ، بينما نمت أخرى في وسط مع إضافة الكبريت المشع في أيون الكبريتات. بعد ذلك ، تمت إضافة البكتيريا T2 إلى هذه البكتيريا ، والتي تتضاعف في الخلايا البكتيرية ، وتضمنت تسمية مشعة في حمضها النووي (P في DNA ، ولكن ليس في البروتينات) ، أو البروتينات (S في البروتينات ، ولكن ليس في DNA).
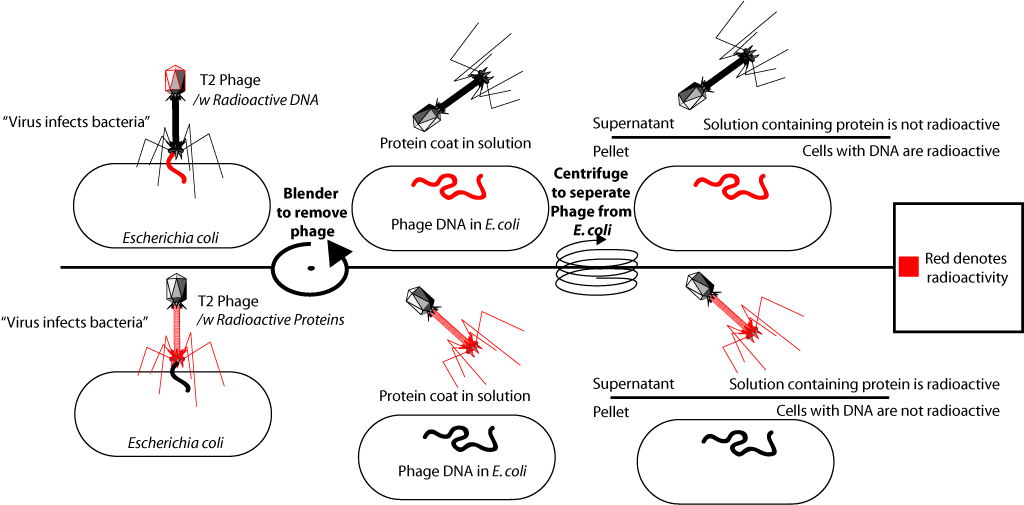
بعد عزل البكتيريا المصنفة إشعاعيًا ، تمت إضافتها إلى ثقافة البكتيريا الطازجة (الخالية من النظائر). مما أدى إلى إصابة هذه البكتيريا. يرتبط الجراثيم بالخلية البكتيرية و "تضخ" حمضها النووي. بعد ذلك ، تم اهتزاز الوسط مع البكتيريا بقوة في خلاط خاص (تبين أنه في هذه الحالة تم فصل أغشية الملتهمة من سطح الخلايا البكتيرية) ، ثم تم فصل البكتيريا المصابة عن الوسط. عندما أضيفت البكتيريا في التجربة الأولى إلى البكتيريا الملصقة بالفوسفور -32 ، اتضح أن الملصق المشع كان في الخلايا البكتيرية. عندما أُضيفت البكتيريا في التجربة الثانية المسمى بـ sulfur-35 إلى البكتيريا ، تم العثور على الملصق في جزء من الوسط بطبقات بروتينية ، ولكنه لم يكن في الخلايا البكتيرية. هذا يؤكد أن المادة التي أصابت البكتيريا كانت DNA. بما أن الجسيمات الفيروسية الكاملة التي تحتوي على بروتينات الفيروس تتشكل داخل البكتيريا المصابة ، فقد أصبحت هذه التجربة واحدة من الأدلة الحاسمة على حقيقة أن المعلومات الجينية (معلومات عن بنية البروتينات) موجودة في الحمض النووي.
أثرت هذه الاكتشافات بشكل كبير على العديد من علماء الأحياء في ذلك الوقت. على وجه الخصوص على الشهير لقواعده ، Chargaff. كان يعتقد أن أفيري اكتشفت بشكل أساسي "لغة جديدة" ، أو على الأقل أظهر مكان البحث عنها.
بدأ Charguff في البحث عن اختلاف في تكوين النوكليوتيدات وترتيب النوكليوتيدات في مستحضرات DNA التي تم الحصول عليها من مصادر مختلفة. وبما أنه لم تكن هناك طرق لإعطاء التوصيف الكيميائي للحمض النووي بدقة ، في ذلك الوقت ... كان عليه أن يأتي بها. وقد تبين أن نظرية رباعي النوكليوتيد القديمة في بنية الأحماض النووية غير صحيحة. يختلف DNA في الكائنات الحية المختلفة في التركيب والبنية. في الوقت نفسه ، تم اكتشاف حقائق جديدة لم تكن مثبتة مسبقًا للبوليمرات الطبيعية الأخرى ، وهي انتظام نسبة القواعد الفردية في تكوين جميع الحمض النووي المدروس. الآن حتى أطفال المدارس يعرفونهم بقواعد Chargaff.
- كمية الأدينين تساوي كمية الثيمين والجوانين إلى السيتوزين: A = T، G = Ts.
- عدد البيورينات يساوي عدد البيريميدينات: A + G = T + C.
- يتدفق من الأول والثاني. عدد القواعد ذات المجموعات الأمينية في الموضع 6 يساوي عدد القواعد مع مجموعات الكيتو في الموضع 6: A + C = T + G.
لقد تطرقنا إلى الآلية
في المقالة الأخيرة ، لذلك لن أتطرق إليها هنا.
ببطء اقتربنا من شخصين أسطوريين اكتشفوا بنية الحمض النووي. التقى فرانسيس كريك وجيمس واتسون لأول مرة في عام 1951. ثم قرر واتسون معالجة بنية الحمض النووي. كعالم أحياء ، أدرك أنه عند اختيار بنية معينة من الحمض النووي ، يجب على المرء أن يأخذ في الاعتبار وجود مبدأ بسيط لمضاعفة جزيء الحمض النووي المضمّن في هيكله. في الواقع ، أحد أهم خصائص الجينات هو نقل المعلومات الوراثية.
أنشأ كريك نظرية حيود الأشعة السينية عن طريق اللوالب ، والتي تسمح للمرء بتحديد ما إذا كان الهيكل قيد الدراسة في التشكيل اللولبي أم لا. في ذلك الوقت ، كانت الصور الشعاعية للحمض النووي موجودة بالفعل. تم استقبالهم في لندن من قبل موريس ويلكينز وروزاليند فرانكلين.
من خلال طبيعة الأشعة السينية للحمض النووي ، أدرك واتسون وكريك أن الهيكل قيد الدراسة كان في شكل حلزوني. لقد عرفوا أيضًا أن جزيء DNA هو سلسلة بوليمر خطية طويلة تتكون من مونومرات النوكليوتيدات. العمود الفقري الفوسفوديوكسيريبوز لهذا البوليمر مستمر ، وترتبط القواعد النيتروجينية بجانب بقايا deoxyribose. لبناء النماذج ، بقي حل مسألة عدد سلاسل البوليمر الخطي المكدسة في هيكل مضغوط.
استنادًا إلى الأشعة السينية للحمض النووي على شكل B ، اقترح واتسون وكريك أن جزيء الحمض النووي يتكون من سلسلتين خطيتين متعدد النوكليوتيدات مع العمود الفقري الفوسفوديوكسيريبوز خارج الجزيء والقواعد النيتروجينية داخله. والذي تم تأكيده فيما بعد. بقي فقط لحل مسألة ترتيب القواعد النيتروجينية للسلسلتين داخل اللولب.
بالنظر إلى التوليفات المحتملة لأزواج القواعد النيتروجينية ، وجد واتسون أن أزواج الأدينين - الثيمين والجوانين - السيتوزين هي نفس الحجم ويتم تثبيتها بواسطة روابط الهيدروجين. تم شرح قواعد Chargaff على الفور: إذا كان الأدينين في سلسلة حلزونية مزدوجة من سلسلة واحدة يرتبط دائمًا بالثيمين من سلسلة أخرى ، ويقترن الجوانين دائمًا بالسيتوزين ، فيجب أن يكون الأدينين في الحمض النووي دائمًا مثل الثيمين ، والجوانين - بقدر كم السيتوزين. كان من الواضح أيضًا كيف يجب أن يحدث مضاعفة جزيء DNA. كل خصلة تكمل الأخرى ، وفي عملية تكرار الحمض النووي ، يجب أن تنفصل خيوط اللولب المزدوج ويجب أن تكتمل كل خصلة مكملة لها على كل خيط متعدد النوكليوتيدات. كانت هناك أيضًا العديد من النظريات ، ولكن حولها في أسبوع ، في المقالة التالية.
معلومات الترميز
لذا ، نعلم أن الحمض النووي هو ناقل للمعلومات ، ونعرف ما تتكون منه. لكن كيفية تشفير المعلومات لا تزال غير واضحة.
دعنا نذهب من المهمة. يشفر DNA 20 حمضًا أمينيًا (يمكننا القول أن 21 حمضًا ، ولكن حتى الآن لا نلمس selenocystenin). هناك 4 خيارات للنيوكليوتيدات. أي أن النيوكليوتيد الواحد يمكنه ترميز 4 متغيرات ، 2 - 16 ، 3 - 64. من المنطقي أن نفترض أن الشفرة ثلاثية (أي أن ثلاث قواعد تشفر حمض أميني واحد). يمكنك أن تقرأ عن التأكيد التجريبي
هنا . أخشى أن هناك بالفعل الكثير من التاريخ ...
في الواقع ، لدينا 64 متغيرًا و 20 حمضًا أمينيًا. يمكن ترميز الأحماض الأمينية بواسطة كودونات مختلفة. هناك أيضًا رموز بدء تشغيل وإيقاف تبدأ منها القراءة.
لا تنسَ أن الحمض النووي يقرأ أولاً في الحمض النووي الريبي ، والذي يقرأه بالفعل في البروتين.
يوضح الجدول أدناه مطابقة كودونات RNA للأحماض الأمينية. تذكر أنه لا يوجد ثايمين في الحمض النووي الريبي ، ولكن يتم استخدام اليوراسيل بدلاً من ذلك.

إذا لم تجد رمز البدء في الجدول ، فابحث عن AUG. إنه يشفر الميثيونين وهو أيضًا البداية. عند ترجمة جينات بدائيات النوى وجينات البلاستيد والميتوكوندريا ، فإن الحمض الأميني الأولي هو N-formylmethionine (هذا فقط للإشارة)).
إذا كنت ترسم كل شيء من DNA إلى البروتين ، فإننا نحصل على شيء مثل هذا.
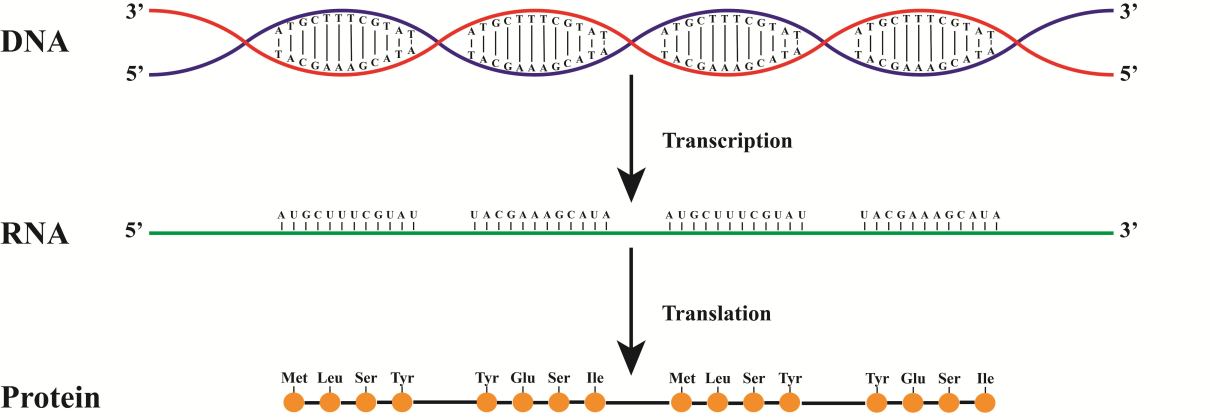
في هذا الشكل ، يكون التوليف من السلسلة الحمراء. نتيجة لذلك ، سيتزامن الحمض النووي الريبي مع السلسلة الزرقاء (لا تنس استبدال T بـ Y)
كما قلت ، يمكن للعديد من الكودونات ترميز كل حمض أميني. للوهلة الأولى ، لا يبدو أن هذا من الآثار الجانبية الضرورية بشكل خاص لتكرار الكودون. لكنه في الواقع يلعب دورًا مهمًا جدًا.
هنا سنتطرق إلى الطفرات قليلاً. يأتون في أنواع مختلفة. من الكروموسومات ، عندما تتم إزالة قطع كاملة من الكروموسومات من الجينوم ، متبادلة ، مكررة ، إلى تلك المنقطة ، عندما يتم استبدال قاعدة نيتروجينية بأخرى. ركز على الطفرات النقطية.
ما الذي يمكن أن تؤدي إليه الطفرات؟
قد يبدأ الكودون في ترميز حمض أميني آخر ، وهو ليس دائمًا مخيفًا. تسمى هذه الطفرات الطفرات الخاطئة (أي مع تغيير المعنى). يمكن أن يؤثر ذلك على بنية البروتين.
على سبيل المثال ، إذا تم استبدال حمض أميني موجب الشحنة بحمض سلبي ، فقد يؤدي ذلك إلى جعل البروتين غير مستقر ، أو يؤدي إلى ثنيه في شكل مختلف (نعم ، التسلسل الخطي للأحماض الأمينية عادة ما يطوى إلى شكل معين) ولا يمكن أن يؤدي وظائفه (أو يبدأ في القيام بذلك) أفضل ، هو بالفعل صفات التطور).على وجه التحديد ، يحتوي الهيموجلوبين S على تغيير واحد في النوكليوتيدات (A إلى T) في جين الترميز. ونتيجة لذلك ، يتم استبدال غلوتامات التشفير الثلاثي GAG بواسطة ترميز THG. يمكن للهيموغلوبين S أيضًا نقل الأكسجين ، لكنه يجعله أسوأ من الهيموغلوبين العادي.في جزيء الهيموغلوبين الهيكاري ، يتم استبدال الأسباراجين باللايسين ، ومع ذلك ، لا يزال من الجيد نقل الأكسجين.كمثال لفقدان الوظيفة ، ضع في اعتبارك الهيموجلوبين م.تؤدي طفرة نقطة أخرى في جين الهيموغلوبين إلى فقدان كامل للوظيفة (تغييرات الهيستدين إلى التيروزين في المركز النشط).بالمناسبة ، يبدو طي البروتين مثل هذا إذا حذفت كل الفروق الدقيقة. ماذا يمكن أن يحدث؟يمكن أن يؤدي استبدال قاعدة نيتروجينية واحدة إلى ظهور كودون توقف في وسط التسلسل ، أو العكس ، يختفي كودون التوقف في النهاية. سيكون الناتج إما دائرة غير مكتملة أو دائرة طويلة للغاية ، على أي حال لن تكون قادرة على العمل بشكل طبيعي. تسمى هذه الطفرات هراء.
ماذا يمكن أن يحدث؟يمكن أن يؤدي استبدال قاعدة نيتروجينية واحدة إلى ظهور كودون توقف في وسط التسلسل ، أو العكس ، يختفي كودون التوقف في النهاية. سيكون الناتج إما دائرة غير مكتملة أو دائرة طويلة للغاية ، على أي حال لن تكون قادرة على العمل بشكل طبيعي. تسمى هذه الطفرات هراء.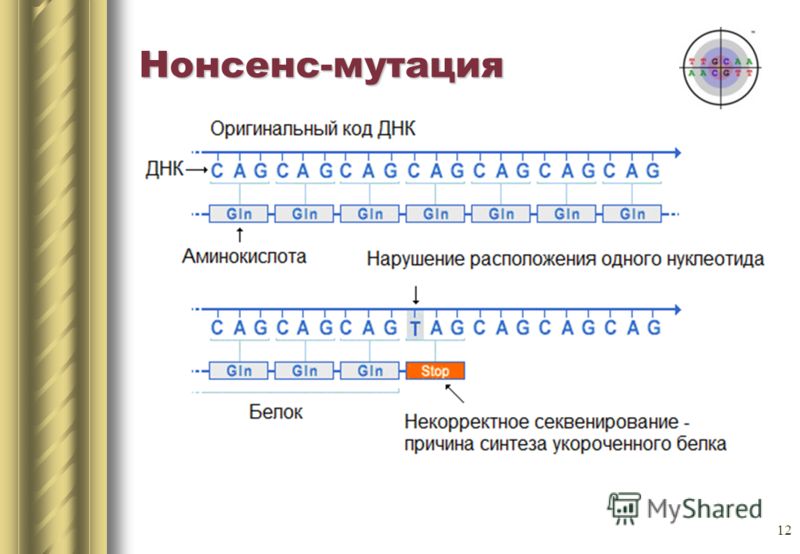 هناك نوع ثالث من الطفرات - إسكات الطفرة. في الواقع ، يتم استبدال الكودون بتشفير آخر لنفس الحمض الأميني. لا تتغير خصائص البروتين.لتلخيص المخطط العام.
هناك نوع ثالث من الطفرات - إسكات الطفرة. في الواقع ، يتم استبدال الكودون بتشفير آخر لنفس الحمض الأميني. لا تتغير خصائص البروتين.لتلخيص المخطط العام.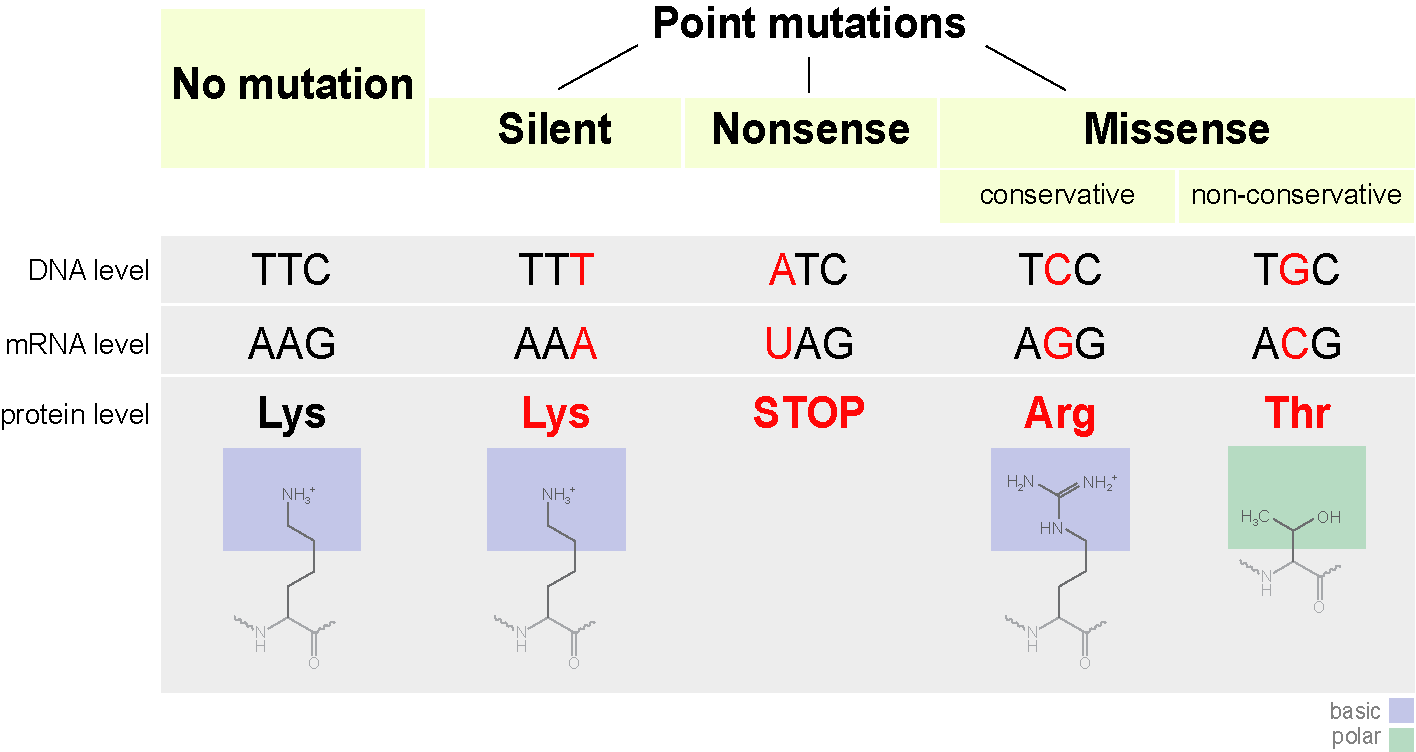 في الختام ، أود أيضًا أن أتحدث عن ميزة واحدة مثيرة للاهتمام. يمكن ترميز حمض أميني واحد بواسطة العديد من الكودونات. هذا ما نعرفه. لكن ماذا يعني ذلك؟ يستخدم الجسم جميع الكودونات في وقت واحد للترميز. ولكن البعض في كثير من الأحيان ، والبعض أقل.قارن بين البشر و ... E. coli ( Escherichia coli ) في تواتر استخدام كودونات ترميز السيستين.يتم ترميزه بواسطة كودوني UGU و UGC. UGUHuman10.6UGC 12.6Escherichia coli (سلالة O127: H6)UGU 19.1UGC 0.0Digits هو حدوث ثلاثي لكل ألف. يمكن ملاحظة أننا نستخدم كلا الكودون بنفس التردد تقريبًا ، بينما لا تستخدم E. coli أي كود UGC تقريبًا.يجب تذكر هذه الميزة ، خاصة عندما تكون منخرطًا في الهندسة الوراثية وترغب في إنتاج المنتج الجيني لكائن حي في كائن آخر. إذا حاولت إدخال جين بشري مع تكرار تكرار كود UGC في الإشريكية القولونية من هذه السلالة ، فستصاب بخيبة أمل. في الخلية ، ترتبط الأحماض الأمينية بنقل الحمض النووي الريبي ، كل منها يتوافق مع كودونها الخاص. لذا ، فإن الحمض الريبي النووي النقال المناظر لكود UGC سيكون صغيرًا جدًا ، مما سيؤدي إلى إبطاء التوليف بشكل كبير.إذا كنت مهتمًا ، يمكنك هنا رؤية الاختلافات في تكوين الكودون للكائنات الحية المختلفة.يمكن أن يختلف تكوين الكودون بشكل كبير بين الكائنات الحية من أنواع مختلفة وسلالات مختلفة. كذلك لديك القولونيةO157: H7 EDL933 أقل بشكل متزايد حتى من حيث UGC و UGU. أو هنا مثال آخر. سلالات عصيات درنة معزولة في بلدان مختلفة لها أيضًا تكوين رمز مختلف .
في الختام ، أود أيضًا أن أتحدث عن ميزة واحدة مثيرة للاهتمام. يمكن ترميز حمض أميني واحد بواسطة العديد من الكودونات. هذا ما نعرفه. لكن ماذا يعني ذلك؟ يستخدم الجسم جميع الكودونات في وقت واحد للترميز. ولكن البعض في كثير من الأحيان ، والبعض أقل.قارن بين البشر و ... E. coli ( Escherichia coli ) في تواتر استخدام كودونات ترميز السيستين.يتم ترميزه بواسطة كودوني UGU و UGC. UGUHuman10.6UGC 12.6Escherichia coli (سلالة O127: H6)UGU 19.1UGC 0.0Digits هو حدوث ثلاثي لكل ألف. يمكن ملاحظة أننا نستخدم كلا الكودون بنفس التردد تقريبًا ، بينما لا تستخدم E. coli أي كود UGC تقريبًا.يجب تذكر هذه الميزة ، خاصة عندما تكون منخرطًا في الهندسة الوراثية وترغب في إنتاج المنتج الجيني لكائن حي في كائن آخر. إذا حاولت إدخال جين بشري مع تكرار تكرار كود UGC في الإشريكية القولونية من هذه السلالة ، فستصاب بخيبة أمل. في الخلية ، ترتبط الأحماض الأمينية بنقل الحمض النووي الريبي ، كل منها يتوافق مع كودونها الخاص. لذا ، فإن الحمض الريبي النووي النقال المناظر لكود UGC سيكون صغيرًا جدًا ، مما سيؤدي إلى إبطاء التوليف بشكل كبير.إذا كنت مهتمًا ، يمكنك هنا رؤية الاختلافات في تكوين الكودون للكائنات الحية المختلفة.يمكن أن يختلف تكوين الكودون بشكل كبير بين الكائنات الحية من أنواع مختلفة وسلالات مختلفة. كذلك لديك القولونيةO157: H7 EDL933 أقل بشكل متزايد حتى من حيث UGC و UGU. أو هنا مثال آخر. سلالات عصيات درنة معزولة في بلدان مختلفة لها أيضًا تكوين رمز مختلف .لتلخيص
هذه المرة كان هناك الكثير من التاريخ وعلم الأحياء قليل نسبيًا. هذا لن يحدث مرة أخرى. تحدثنا عن كيف أصبح من الواضح أن الحمض النووي هو وسيط المعلومات ، وكيف يتم تخزينه في الحمض النووي نفسه. تحدثنا عن تكرار كود الجين وما يؤدي إليه. تأثرت الطفرات والاختلاف في وتيرة استخدام كودونات معينة بشكل طفيف.في المرة القادمة سنتحدث عن تكرار الحمض النووي.ملاحظة: سيكون هناك أيضا تاريخ ، ولكن أقل من ذلك بكثير. سأحاول ألا أوقف هذه التوقفات كتابة بعد الآن.