بدأت قصة المؤشرات الحيوية اللاجينية في عام 2013. ثم قدم رائد في هذا الاتجاه ، متخصص في مجال علم الوراثة والإحصاء الحيوي ، وهو موظف في جامعة كاليفورنيا في لوس أنجلوس ، ستيف هورفاث ، طريقته الثورية الجديدة لتحديد العمر البيولوجي ، تسمى "الساعة اللاجينية". كما يوحي الاسم ، كانت هذه الطريقة تعتمد على التغيرات في epigenome ، وهي مثيلة DNA.
مثيلة الحمض النووي هي واحدة من الآليات الجينية لتنظيم التعبير الجيني. أثناء المثيلة ، ترتبط مجموعة الميثيل من الإنزيمات الخاصة بـ CH3 بإحدى قواعد الحمض النووي ، السيتوزين. ونتيجة لذلك ، يتم تكوين 5-ميثيل سيتوزين ويتم تعطيل التعبير الجيني - يتم حظر عملية النسخ. كما تعلمون اليوم ، مثيلة DNA هي عملية ديناميكية. يمكن أن يتغير تحت تأثير العوامل الخارجية ، ويرتبط بتطور عدد من الأمراض ، ويمكن أن يرثه العديد من الأجيال القادمة. تلعب المثيلة دورًا رئيسيًا في تعطيل الحمض النووي الأجنبي ، وكذلك في عمليات التنمية والشيخوخة. تم وصف التغيرات المرتبطة بالعمر في المثيلة الموصوفة ب "الانحراف اللاجيني". لذلك ، مع التقدم في العمر ، لوحظ نقص هيدرومتر (نزع الميثيل) وعدم استقرار الكروموسومات. بالإضافة إلى ذلك ، مع الشيخوخة ، تحدث العملية العكسية أيضًا - فرط مثيلة بعض مناطق المروج ، بما في ذلك جينات معينة لقمع الورم ، والتي ترتبط بتطور الأمراض [1]. بشكل عام ، يعتقد اليوم أن تغيرات المثيلة تلعب دورًا رئيسيًا في الشيخوخة.
استنادًا إلى حقيقة أن العمر الزمني مرتبط بالتغيرات المتوقعة في epigenome ، hypo- و hypermethylation في العديد من المناطق في جميع أنحاء الجينوم ، تم تطوير الجيل الأول من العلامات الحيوية الشيخوخة اللاجينية القائمة على مثيلة DNA. في عام 2011 ، أظهر أول مقال لعلماء في جامعة كاليفورنيا ، لوس أنجلوس ، بعنوان "مؤشر جيني للعمر" ، أن مثيلة الحمض النووي لها علاقة واضحة مع العمر. في عام 2013 ، حدد ستيف هورفات ، باستخدام تقنية التعلم الآلي بمساعدة الكمبيوتر ، 353 موقع مثيلة ترتبط ارتباطًا وثيقًا بالعمر الزمني للشخص ، والتي شكلت أساس "الساعة اللاجينية" الأولى أو "الساعة الكرواتية" [2].
من الصعب المبالغة في أهمية هذا الاكتشاف. يجب أن يقال أن قصة نجاح S. Horvat مليئة بالدراما التي لم تخترع. وفقا لمذكرات هورفات نفسه ، لم يرغبوا في البداية في قبول مقالته عن طريقة جينية جديدة لقياس العمر في أكثر من مجلة. كان عليه باستمرار أن يسمع من المراجعين نفس العبارة التي تقول "من الجيد أن تكون حقيقية". لكن هورفاث لم يستسلم وكرس كل وقته لوضع اللمسات الأخيرة على الطريقة الجديدة: "لقد كتبت في كل وقت فراغ ، كما لو كانت آخر مرة أكمل فيها مقالتي". قبل الانتهاء من العمل في العائلة الكرواتية مباشرة ، حدثت كارثة - توفيت ابنته المولودة حديثًا. لكن هذا لم يزعج العالم العنيد. تم رفض أحدث طبعة من مقاله من قبل Genome Biology. وبعد تلقي تعليق نقدي آخر من المراجعين ، قام هورفاث ، في ذكرياته ، بثلاثة أشياء لا ينبغي القيام بها: "بعد قراءة تعليقات المراجعين ، أمضيت الدقائق العشر التالية في القيام بثلاثة أشياء لا يجب القيام بها أبدًا. أولاً ، ذهبت إلى الثلاجة وشربت ثلاث زجاجات من البيرة بأسرع ما يمكن. ثانيًا ، عدت إلى الكمبيوتر وكتبت رسالة إلى المحرر. ثالثا ، لقد أرسلته ". وهذه المرة ، ابتسم له الحظ ، قبلت مقالته.

كيف يمكن أن تكون "الساعة اللاجينية" مفيدة؟ وفقًا لمؤلف الاكتشاف ، يمكن أن تلعب هذه الطريقة دورًا كبيرًا في تقييم فعالية التدخلات المضادة للشيخوخة ، لأنها يمكن أن تقلل بشكل كبير من فترة انتظار النتائج. بالإضافة إلى ذلك ، من المفترض أن مواقع المثيلة التي حددتها كرواتيا ليست مجرد علامات ، ولكنها أيضًا مشاركة نشطة في الشيخوخة (على الأقل بعضها). ما يمنح الباحثين هدفًا علاجيًا محتملاً في مكافحة الشيخوخة والأمراض المرتبطة بالعمر. أيضا ، يمكن أن تكون هذه الطريقة الجديدة مفيدة في الإجراءات الجنائية ، عندما تكون عينات العمر مطلوبة من عينات الأنسجة. ولكن ، بالطبع ، اكتسبت "الساعة اللاجينية" الأهمية الكبرى لاحقًا في التنبؤ بالأمراض وزيادة خطر الوفاة.
كما اتضح أن "الساعة اللاجينية" أظهرت قيمة "صفر" في الساق الجنينية والخلايا متعددة القدرات المستحثة ، الحيوانات المنوية ، خلايا البويضة وخلايا المشيمة. وخلال السنوات الخمس الأولى من الحياة - دورة سريعة مرتبطة بتطور الجسم. وبحلول سن 21 عامًا ، تباطأت "الساعة اللاجينية" تدريجيًا ، ثم سارت بسرعة موحدة تقريبًا ، غيرت أدائها تحت تأثير العوامل الخارجية. علاوة على ذلك ، اتضح أن الأنسجة المختلفة تتقدم في العمر بسرعات مختلفة. كانت أنسجة الثدي لدى النساء هي الأكثر عرضة لعمليات الشيخوخة. من وجهة نظر علم الوراثة اللاجينية ، يشيخ الدماغ بشكل أبطأ ، بينما تظهر خلايا الدم والعظام شيخوخة متسارعة قليلاً [3].
في نفس عام 2013 ، نشر علماء صينيون وأمريكيون مقالًا عرض نسخة أخرى من "الساعة اللاجينية" - "ساعة هانوم". درس جريجوري هانوم ، مهندس بيولوجي بجامعة كاليفورنيا بجامعة كاليفورنيا في سان دييجو ، وزملاؤه ملامح مثيلة الحمض النووي لـ 450،000 CpG ثنائي نوكليوتيدات من خلايا الدم لدى الأشخاص الذين تتراوح أعمارهم بين 19 و 101 عامًا ، وحددوا 71 موقع مثيلة يرتبط ارتباطًا وثيقًا بالعمر [4]. الاختلاف الرئيسي بين "ساعة هانوم" و "ساعة هورفات" هو خصوصيتها: تؤخذ عينات من الحمض النووي من خلايا الدم ، وليس من أي نسيج ، مثل الطريقة الكرواتية.
وسرعان ما أصبحت القيمة الرئيسية لـ "الساعة اللاجينية" واضحة. إن مقارنة تقدمهم بالعمر الزمني ذات قيمة تنبؤية كبيرة لتقييم خطر الوفاة من جميع الأسباب وتطور العديد من الأمراض. إذا كانت "الساعة اللاجينية" في عجلة من أمرها - فهناك أمراض وتسارع الشيخوخة وتقصير العمر الافتراضي. إذا كانت أبطأ من العمر الزمني ، فهناك فرص جيدة لطول العمر. أظهرت الدراسات أن "الساعة اللاجينية" ترتبط ارتباطًا وثيقًا بالوفيات من جميع الأسباب والأمراض المرتبطة بالعمر.في عام 2015 ، أجرى هورفات وزملاؤه دراسات لتحديد العلاقة بين سرطان الرئة والعمر اللاجيني. بعد تحليل بيانات 2029 شخصًا ، تبين أن تسارع عمر التولد الجيني كان مرتبطًا بزيادة خطر الإصابة بسرطان الرئة ، وكانت هذه العلاقة أقوى لدى المدخنين والأشخاص فوق 70 عامًا: "أظهرت النتائج أن المؤشرات المعيارية لتسريع عمر التولد الجيني (IEAA) كانت يرتبط بشكل كبير مع حدوث سرطان الرئة (HR: 1.50 ، P = 3.4 × 10 -3). بالإضافة إلى ذلك ، أظهرنا أن الارتباط قد يكون أقوى بين كبار السن (70 عامًا أو أكثر) أو أولئك الذين هم مدخنون حاليًا. بشكل عام ، تظهر نتائجنا أن وكالة الطاقة الدولية يمكن أن تكون علامة حيوية مفيدة لتقييم القابلية للإصابة بسرطان الرئة من وجهة نظر الشيخوخة البيولوجية "[5].
في العام نفسه ، أنشأت مجموعة أخرى من الباحثين علاقة "العمر اللاجيني" بخطر الوفاة من جميع الأسباب لدى الأشخاص الذين تزيد أعمارهم عن 60 عامًا. للتحليل ، أخذنا بيانات من أربع دراسات (إجمالي 4658 شخصًا) ، كان متوسط عمر المشاركين منها 79.1 و 69.5 و 66.3 و 72.9 سنة على التوالي. تم تحديد العمر اللاجيني من خلال طريقتين: "الساعة الكرواتية" (استنادًا إلى 353 موقع CpG مثيلة) و "ساعة هانوم" (بناءً على 71 موقع مثيلة CpG). أظهرت كلتا الطريقتين ارتباطًا قويًا مع بعضهما البعض ، على الرغم من أن المجموعات الأساسية كان لها تطابق فقط على 6 مواقع CpGs. أوضحت نتائج الدراسة أن تسارع "العمر الوراثي اللاجيني" مقارنة بالتسلسل الزمني بمقدار 5 سنوات زاد من خطر الوفاة عند الأشخاص بنسبة 16٪. وخلص المؤلفون إلى أن "معدلات الشيخوخة المتسارعة المشتقة من مثيلة الحمض النووي هي عوامل موروثة تتنبأ بالوفيات ، بغض النظر عن الحالة الصحية أو عوامل نمط الحياة أو العوامل الوراثية المعروفة. لذلك ، يمكن الافتراض أن العمر المتوقع لميثيل الحمض النووي هو "ساعة لا جينية" تقيس العمر البيولوجي الذي يسير معًا ، ولكن ليس دائمًا بالتوازي مع العمر الزمني ، ويمكن أن يعطي تنبؤات لمتوسط العمر المتوقع "[6].
في عام 2016 ، أجرى علماء الأورام الألمان دراسة تصف العلاقة بين الشيخوخة اللاجينية المتسارعة والوفيات الناجمة عن السرطان وأمراض القلب والأوعية الدموية وجميع الأسباب الأخرى. من أجل عملهم ، استخدموا "الساعة اللاجينية" لهورفاث وهانوم. تم تقييم عمر مثيلة الحمض النووي في مجموعة من 1863 من كبار السن المشاركين في دراسة ESTHER بمتوسط عمر 62.5 سنة. وأظهرت النتائج أن عمرًا لا جينيًا أكبر من التسلسل الزمني ارتبط بارتفاع معدل الوفيات. أدى تسارع 5 سنوات من "العمر اللاجيني" الذي حددته الطريقة الكرواتية إلى زيادة معدل الوفيات بنسبة 22٪ ، وبنسبة 16٪ باستخدام طريقة هانوم [7].
في عام 2016 ، أجرى فريق دولي كبير من الباحثين بقيادة ستيف هورفاث تحليلًا تلويًا واسع النطاق تم فيه فحص البيانات من 13،089 شخصًا من ثلاث مجموعات عرقية / عرقية: أبيض ، من أصل إسباني ، وأمريكي من أصل أفريقي. تم تحديد العصر اللاجيني هنا أيضًا من خلال طريقتين: "الساعة الكرواتية" و "ساعة هانوم". أظهر هذا العمل أن تسارع "الساعة اللاجينية" بمقدار سنة واحدة (مقارنة بالعمر الزمني) يزيد من خطر الوفاة من جميع الأسباب إلى 4٪. علاوة على ذلك ، لوحظ التأثير المعاكس أيضًا: أدى تباطؤ "الساعات اللاجينية" إلى انخفاض خطر الوفاة. بالإضافة إلى ذلك ، سجل الباحثون ظاهرة مثيرة للاهتمام: "وجدنا أن 5 بالمائة من الناس لديهم مسار أسرع من العمر البيولوجي ، مما يؤدي إلى فترة حياة أقصر. يزيد الشيخوخة المتسارعة من خطر وفاة هؤلاء الأشخاص بنسبة 50 بالمائة في أي عمر بالغ ". [8 ، 9].
هناك أيضًا عدد من العوامل الخارجية التي تؤثر على مسار "الساعة اللاجينية" معروفة بالفعل. في عام 2017 ، وصف هورفاث وزملاؤه العلاقة بين النظام الغذائي والكحول والتعليم وممارسة الرياضة مع مسار الوقت اللاجيني. وفقًا للمؤلفين أنفسهم ، أكد عملهم الحقيقة المعروفة منذ فترة طويلة: اتباع نظام غذائي يحتوي على الخضار والأسماك واللحوم الخالية من الدهن واستهلاك الكحول المعتدل والنشاط البدني والتعليم يبطئ مسار الوقت اللاجيني ويساهم في إطالة العمر. إن المستويات المرتفعة من الأنسولين والجلوكوز والبروتين التفاعلي C والدهون الثلاثية ، بالإضافة إلى الوزن الزائد وضغط الدم المرتفع يسرع شيخوخة epigenome. في نفس الدراسة ، لم يجد العلماء تأثيرًا إيجابيًا للدواء الميتفورمين المضاد للأساسيات على مسار الوقت اللاجيني [10]. في نفس العام ، أظهر الباحثون الفنلنديون مرة أخرى علاقة السمنة مع الشيخوخة اللاجينية المتسارعة [11]
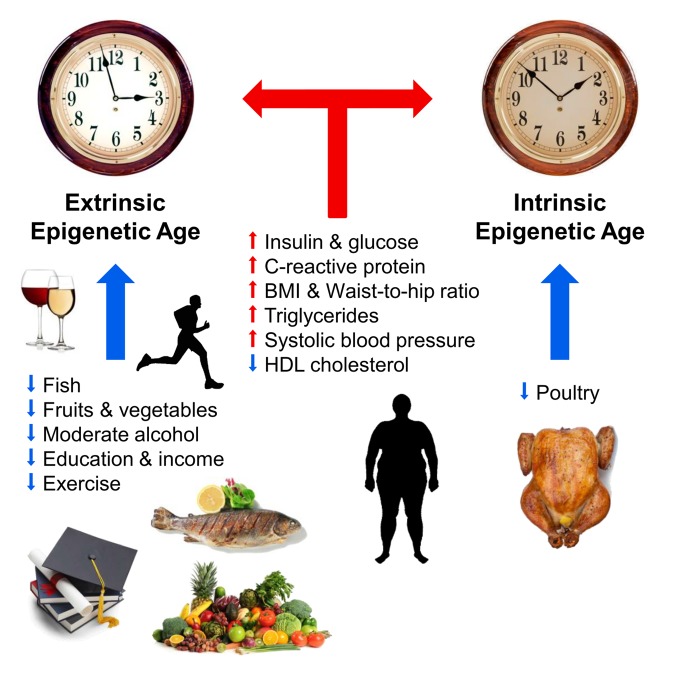
التين. 1
العوامل المؤثرة على العمر اللاجيني (من [10]).
يشير السهمان الأزرق والأحمر إلى العوامل التي تبطئ الشيخوخة وتسرعها ، على التوالي. ترمز الساعة إلى الساعة اللاجينية الخارجية (الساعة اللاجينية الخارجية ، نسخة موسعة من طريقة هانوم) والساعة اللاجينية الداخلية (الساعة اللاجينية الذاتية ، الساعة الكرواتية). التأثيرات الإيجابية على مسار الوقت اللاجيني (التباطؤ): الأسماك والدواجن والخضروات والفواكه والبروتينات الدهنية عالية الكثافة والكحول المعتدل والتكوين والنشاط البدني. يؤثر سلبًا على مسار الوقت اللاجيني (التسارع): مستويات مرتفعة من الأنسولين والجلوكوز والبروتين التفاعلي سي ، والدهون الثلاثية ، وارتفاع ضغط الدم ، وزيادة وزن الجسم ونسبة غير صحيحة من الخصر والوركين.قامت فرق بحثية مختلفة بعمل يصف العلاقة بين مسار الوقت اللاجيني والوظائف الجسدية والمعرفية ومتلازمات داون وفيرنر وعدوى فيروس العوز المناعي البشري ومرض الزهايمر وانقطاع الطمث [12-17]. تم أيضًا توضيح علاقة واضحة بين طول العمر وتباطؤ "الساعة اللاجينية" باستخدام مثال المعمرين الإيطاليين الذين يبلغون من العمر 100 عامًا [18]. لفترة طويلة ، لم يستطع ستيف هورفاث استخدام طريقته للتنبؤ بالمسار المتسارع للعصر البيولوجي خلال Hutchinson-Guildford progeria. ولكن تم حل هذه المشكلة هذا العام: فقد ابتكر هو وزملاؤه "ساعات لا جينية" خاصة على أساس الخلايا الليفية ، تتكون من 391 موقعًا لـ CpG ، تسمى "ساعات الدم والجلد" [19].
كانت الخطوة التالية في عمل S. Horvat هي تطوير مؤشر حيوي أكثر فعالية للشيخوخة ، مع قدرات تشخيصية محسنة تتنبأ بخطر الوفاة من أسباب مختلفة وتطور الأمراض المرتبطة بالعمر. كان العيب في "الساعات اللاجينية" السابقة ، وفقًا لهورفاث ، هو أن استخدام العمر الزمني كمعيار لتحديد انحرافات العمر يمكن أن يستبعد مواقع CpG التي لا تظهر ملفات مثيلة لها تغييرات قوية تعتمد على الوقت. بدلاً من ذلك ، يظهرون فقط التناقض بين العمر البيولوجي والكرونولوجي. وبالتالي ، من المهم ليس فقط التقاط CpGs التي تعرض الفرق مع الوقت الزمني ، ولكن أيضًا تلك التي تظهر اختلافات في المخاطر والحالة الفسيولوجية بين الأشخاص من نفس العمر الزمني. في عام 2018 ، تم وضع علامة حيوية جديدة تسمى DNAm PhenoAge ، تم إنشاء.
في المرحلة الأولى ، قام فريق S. Horvath بتحليل عينة كبيرة من الأشخاص ، 9926 شخصًا ، والمشاركين في دراسة NHANES III ، والعلاقة بين 42 من المؤشرات الحيوية السريرية والعمر الزمني مع خطر الوفيات. ونتيجة لذلك ، تم تحديد 9 مؤشرات حيوية للتنبؤ بعمر النمط الظاهري:
1. الزلال
2. الكرياتينين
3. الجلوكوز
4. بروتين سي التفاعلي
5. نسبة الخلايا الليمفاوية
6. متوسط حجم خلايا الدم الحمراء
7. عرض توزيع خلايا الدم الحمراء
8. تعداد خلايا الدم البيضاء
9. الفوسفاتيز القلوي.ثم قاموا بالتحقق من صحة المؤشرات الحيوية المختارة - فحصوا نموذج عمرهم الظاهري في عينة أخرى من الأشخاص (6209 شخصًا). أظهر الفحص وجود علاقة بين الزيادة في العمر المظهري وزيادة خطر الوفاة من جميع الأسباب: ارتبطت الزيادة في عام واحد في العمر المظهري بزيادة 9 ٪ في خطر الوفاة من جميع الأسباب ، وزيادة بنسبة 9 ٪ في خطر الوفاة من الأمراض المرتبطة بالشيخوخة ، و 10 ٪ زيادة في خطر الوفاة من أمراض القلب. أمراض الأوعية الدموية ، وزيادة خطر الوفاة من السرطان بنسبة 7٪ ، وزيادة مخاطر الوفاة بسبب مرض السكري بنسبة 20٪ ، وزيادة مخاطر الوفاة من أمراض الجهاز التنفسي بنسبة 9٪.
في المرحلة الثانية من الدراسة ، ربط المؤلفون مثيلة DNA مع عمر النمط الظاهري. حدد العلماء مواقع GpC المثيلة المرتبطة بهذه المؤشرات الحيوية السريرية التسعة التي تتنبأ بعمر النمط الظاهري. حددوا 513 CpGs من هذه المواقع التي توقعت العمر الظاهري. تم تسمية علامة جينية جديدة DNAm PhenoAge. أظهر الاختبار دقة عالية إلى حد ما للمؤشر الحيوي الجديد: بين عامي 1998 و 2007 ، كان متوسط التغيير في DNAm PhenoAge 8.51 عامًا ، في حين كان متوسط التغيير في عمر النمط الظاهري السريري 8.88 عامًا.
بعد ذلك ، قام الباحثون "باختبار" العلامة الحيوية الجديدة للعلامة باستخدام بيانات من 4 دراسات كبيرة ، مبادرة صحة المرأة (ن = 4207) ، دراسة فرامنغهام للقلب (ن = 2553) ، دراسة الشيخوخة المعيارية (ن = 657) ودراسة جاكسون للقلب (ن = 1747). أظهرت النتائج أن DNAm PhenoAge ارتبط بشكل كبير بخطر الوفيات اللاحق في جميع الدراسات (بغض النظر عن العمر الزمني): ارتبطت الزيادة لمدة عام واحد في DNAm PhenoAge بزيادة 4.5٪ في خطر الوفاة لجميع الأسباب.
أظهر التحليل الجيني لـ DNAm PhenoAge أن مواقع 513 CpG المستخدمة فيها تحتوي على 41 CpGs مطابقة للساعة الكرواتية و 6 CpGs مماثلة لساعة Hannum. تم العثور على خمسة CpGs متطابقة في جميع الطرق الجينية الثلاثة. توجد 149 CpGs من DNAm PhenoAge في مجموعات من CpG dinucleotides (جزر CpG).
أظهرت جميع البيانات التي تم الحصول عليها خلال الدراسة التي قام بها ستيف هورفاث وفريقه أن المرقم الحيوي الجديد له قيمة تنبؤية كبيرة في تحديد مخاطر الأمراض المرتبطة بالعمر وخطر الوفاة. "
باستخدام عملية مبتكرة من خطوتين ، طورنا مرمزًا حيويًا جينيًا جديدًا للشيخوخة ، وهو DNAm PhenoAge ، والذي تجاوز بكثير المؤشرات الحيوية السابقة من حيث التنبؤ لمجموعة متنوعة من عوامل الشيخوخة ، بما في ذلك الوفيات من جميع الأسباب ، والسرطان ، والصحة العامة ، والأداء البدني ، ومرض الزهايمر. على الرغم من أن هذا المرمز الحيوي تم تطويره باستخدام بيانات الدم الكامل ، إلا أنه يرتبط بقوة بالعمر في كل نسيج وخلية تم اختبارها. , , / , . , » [20].
: .
- Vayserman A.M.، Voitenko V.P.، Mekhova L.V. علم الأوبئة الوراثي للأمراض المرتبطة بالعمر. التوليد 2011.42 ، 1-21 ؛
- هورفاث S. عمر مثيلة الحمض النووي للأنسجة البشرية وأنواع الخلايا. جينوم بيول. 2013.14 ، R115.
- جوش ميتيلدورف. ساعة الشيخوخة المثيلة: تحديث. 14 فبراير 2018.
- هانوم ، ز ؛ غيني ، ي. Zhao ، L ؛ Zhang ، L ؛ هيوز ، جي ؛ Sadda، S؛ كلوتزل ، ب ؛ Bibikova ، م ؛ مروحة ، JB ؛ قاو ، ذ ؛ Deconde ، R ؛ تشين ، م ؛ Rajapakse ، أنا ؛ صديق ، س ؛ Ideker ، T ؛ زانج ، ك. (2013). تكشف ملامح المثيلة على نطاق الجينوم عن وجهات نظر كمية لمعدلات الشيخوخة البشرية. خلية مول. 49: 359-367.
- Morgan E. Levine, H. Dean Hosgood, Brian Chen, Devin Absher, Themistocles Assimes and Steve Horvath. DNA methylation age of blood predicts future onset of lung cancer in the women's health initiative. Aging (Albany NY). 2015 Sep; 7(9): 690–700.
- Riccardo E Marioni, Sonia Shah, et al. DNA methylation age of blood predicts all-cause mortality in later life. Genome Biol. 2015 ؛ 16(1): 25.
- Laura Perna, Yan Zhang, Ute Mons, Bernd Holleczek, Kai-Uwe Saum, and Hermann Brenner. Epigenetic age acceleration predicts cancer, cardiovascular, and all-cause mortality in a German case cohort. Clin Epigenetics. 2016; 8: 64.
- Brian H. Chen, Riccardo E. Marioni et al. DNA methylation-based measures of biological age: meta-analysis predicting time to death Aging (Albany NY). 2016 Sep; 8(9): 1844–1859.
- Epigenetic clock predicts life expectancy. ScienceDaily. 28 September 2016.
- Quach A1, Levine ME1 et al. Epigenetic clock analysis of diet, exercise, education, and lifestyle factors. Aging (Albany NY). 2017 Feb 14;9(2):419-446.
- Nevalainen T, Kananen L, Marttila S, Jylhävä J, Mononen N, Kähönen M, Raitakari OT, Hervonen A, Jylhä M, Lehtimäki T, Hurme M. Obesity accelerates epigenetic aging in middle-aged but not in elderly individuals. Clin Epigenetics. 2017 Feb 14;9:20.
- Marioni RE, Shah S, McRae AF, Ritchie SJ, Muniz-Terrera G, Harris SE, Gibson J, Redmond P, Cox SR, Pattie A, Corley J, Taylor A, Murphy L, et al.. The epigenetic clock is correlated with physical and cognitive fitness in the Lothian Birth Cohort 1936. Int J Epidemiol. 2015 ؛ 44:1388–96.
- Horvath S, Garagnani P, Bacalini MG, Pirazzini C, Salvioli S, Gentilini D, Di Blasio AM, Giuliani C, Tung S, Vinters HV, Franceschi C. Accelerated epigenetic aging in Down syndrome. Aging Cell. 2015 ؛ 14:491–95.
- Horvath S, Levine AJ. HIV-1 Infection Accelerates Age According to the Epigenetic Clock. J Infect Dis. 2015 ؛ 212:1563–73.
- Maierhofer A, Flunkert J, Oshima J, Martin GM, Haaf T, Horvath S. Accelerated epigenetic aging in Werner syndrome. Aging (Albany NY). 2017; 9:1143–52.
- Levine ME, Lu AT, Bennett DA, Horvath S. Epigenetic age of the pre-frontal cortex is associated with neuritic plaques, amyloid load, and Alzheimer's disease related cognitive functioning. Aging (Albany NY). 2015 ؛ 7:1198–211
- Levine ME, Lu AT, Chen BH, Hernandez DG, Singleton AB, Ferrucci L, Bandinelli S, Salfati E, Manson JE, Quach A, Kusters CD, Kuh D, Wong A, et al.. Menopause accelerates biological aging. Proc Natl Acad Sci USA. 2016; 113:9327–32.
- Horvath S, Pirazzini C, Bacalini MG, Gentilini D, Di Blasio AM, Delledonne M, Mari D, Arosio B, Monti D, Passarino G, De Rango F, D'Aquila P, Giuliani C, et al.. Decreased epigenetic age of PBMCs from Italian semi-supercentenarians and their offspring. Aging (Albany NY). 2015 ؛ 7:1159–70.
- Steve Horvath, Junko Oshima et al. Epigenetic clock for skin and blood cells applied to Hutchinson Gilford Progeria Syndrome and ex vivo studies. Aging. Volume 10, Issue 7, pp 1758—75.
- 20. Morgan E. Levine, Ake T. Lu, et al. An epigenetic biomarker of aging for lifespan and healthspan. Aging (Albany NY). 2018 Apr; 10(4): 573–591.