على مدار العقود الماضية ، حقق العلم تطورات كبيرة في علاج السرطان ، وعلى الرغم من أننا لا نزال بعيدين عن هزيمة هذا المرض الرهيب تمامًا ، إلا أن الأطباء لديهم المزيد والمزيد من الأدوات لتدمير الأورام أو الحد من نموها. الشيء الرئيسي هو أنهم يمنحون مرضى السرطان الفرصة للعيش لفترة أطول.
واحدة من هذه الأدوات هي تفعيل مناعة الشخص لمحاربة الخلايا السرطانية. هناك مجال كامل مخصص لهذا - علم الأورام المناعي. يتركز الكثير من الاهتمام على ذلك ، وفي هذا المجال يتم إجراء معظم الأبحاث اليوم ويتم تطوير الأدوية الواعدة.
نحن في
الطب 24/7 نستخدم العلاج المناعي بنشاط - ونرى أنه يعطي نتائج جيدة. صحيح أننا نواجه حقيقة أن العديد من المرضى لا يعرفون طريقة العلاج هذه على الإطلاق أو يعتبرونها غير مدروسة بشكل كافٍ وغير جديرة بالثقة.
في هذا المنشور ، سنحاول توضيح الأسئلة: ما هو العلاج المناعي ، وكيف يعمل ومن يمكنه المساعدة.
 جودي بيركنز. كان لديها سرطان الثدي النهائي الذي تم علاجه تماما مع أحدث طريقة العلاج المناعي.تهديد خفي. كيف السرطان
جودي بيركنز. كان لديها سرطان الثدي النهائي الذي تم علاجه تماما مع أحدث طريقة العلاج المناعي.تهديد خفي. كيف السرطانخلايا السرطان متمردة متحولة تمكنت من هزيمة النظام.
في عملية الحياة ، تمر جميع خلايا الجسم بمراحل محددة بدقة من التطور ، وتؤدي وظائف محددة ، وتتكاثر وفقًا لقواعد صارمة ، وتنتهي في العمر وتموت. هذه عملية طبيعية. الموت المبرمج للخلايا القديمة التي تراكمت عليها الكثير من الضرر يسمى موت الخلايا المبرمج.
ومع ذلك ، وتحت تأثير الوراثة أو العوامل الخارجية الضارة ، فإن بعض الخلايا تتراكم الأخطاء الجينية و "التمرد": فهي ترفض العيش وفقًا للخوارزمية التي تحددها الطبيعة ، أو تبدأ في التكاثر بشكل لا يمكن السيطرة عليه أو لا تموت في الوقت المحدد. هذا ليس غير شائع. من المحتمل أن الخلايا السرطانية قد تظهر بشكل دوري في كل منها - وهذا أمر طبيعي. تقريبًا دائمًا ما يتم قتل هؤلاء "المبتدئون" على يد جهاز الأمن الداخلي بالجسم -
الحصانة .
تلعب الخلايا اللمفاوية التائية أحد الأدوار الرئيسية في هذه العملية ، أو ببساطة
الخلايا التائية . يستجيبون
لمستضد (مادة غريبة على الجسم) ، يعترفون ويدمرون الأعداء المحتملين: على سبيل المثال ، الميكروبات أو المواد المانحة غير المناسبة. عادةً ، تقتل الخلايا اللمفاوية التائية خلايا الجسم ، والتي بدأت في التحور والتصرف ليس وفقًا للقواعد. لذلك ، لا يحدث السرطان لدى الجميع - في الغالب ، تتكيف المناعة مع الاضطرابات قبل أن تنتشر.
لكن السرطان يسعى للبقاء على قيد الحياة وتحاول خلايا الورم الاستيلاء على أكبر عدد ممكن من الموارد ، لتصبح "أكثر نجاحًا". فهي تتضاعف بشكل أسرع ، وتفرز عامل نمو الأوعية الدموية (لجذب المزيد من الدم والمواد الغذائية إلى الورم) ، وتطور مقاومة للأدوية ، وتجبر الخلايا الجذعية على زيادة نمو أنسجة الورم (إرسال إشارات خادعة مع طلب التجديد).
تحقق الخلايا السرطانية نجاحًا خاصًا في التنكر: بعضها يزيل بروتينات المستضد الخاصة من سطحها والتي تستطيع بها الخلايا التائية التعرف عليها. يفرز البعض الآخر جزيئات خاصة تعمل على تثبيط الجهاز المناعي ، وبعضها يكوّن مهجنًا باستخدام البلاعم (أحد أنواع الخلايا المناعية) - وتصبح قوىً خارقةً حرفيًا!
فمن ناحية ، تساعدهم القرابة بالخلايا الطبيعية في الجسم في ذلك - وهو نوع من التنكر الخلقي. من ناحية أخرى ، فإن التباين الوراثي للخلايا السرطانية يمنحها قدرة متزايدة على التكيف. وكلما زاد عدد الطفرات التي تراكمت في الحمض النووي للخلية في وقت حدوث الورم الخبيث (التحويل إلى الورم الخبيث) ، زادت فرصها في التغلب على الاستجابة المناعية ووضع خطة التقاط ناجحة.
صحوة السلطة. تاريخ اكتشافات نوبلإن الحصانة الإنسانية هي في الحقيقة جيش حقيقي من القتلة القتلة ، وبعد كل "عملية قتالية" لتحييد عدو آخر ، يجب طمأنتهم ونقلهم من الجيش إلى موقع سلمي. تعمل هذه الآلية على تقليل درجة الحرارة إلى القيم الطبيعية وتوقف الالتهاب عند مرور الخطر وهزيمة العدوى.
في عام 2018 ، منحت جائزة نوبل في علم وظائف الأعضاء أو الطب للأمريكيين جيمس إليسون والياباني تاسوك هونجو عن اكتشافاتهم المستقلة في نفس المجال: كيف يحدث هذا التحول بالضبط من الوضع العدواني إلى الوضع الهادئ.
لم يفكر أي من العلماء في البداية في علاج السرطان. أراد كلاهما فهمًا أوضح لكيفية عمل الاستجابة المناعية. بحلول ذلك الوقت ، كان من الواضح أنه على سطح الخلايا التائية وعلى سطح الخلايا التي تقدم المستضدات (
APC ) توجد جزيئات مستقبلية تعمل على بعضها البعض ، مما يؤدي إلى إبطاء أو إبطاء الجهاز المناعي. تم اكتشاف
TCR - مستقبلات الخلايا التائية التي تتعرف بها الخلايا التائية على بروتينات "العدو" المكشوفة في APC.
لقد وجدنا معقد التوافق النسيجي الرئيسي MHC (معقد التوافق النسيجي الرئيسي) ، بمساعدة من APC التي تقدم قطعًا من البروتينات الغريبة لتحديد الخلايا التائية. تلقى بيتر دوهرتي ورولف زينكيرنال جائزة نوبل لاكتشافهما هذا السيناريو.
لقد فهم العلماء أن المستقبلات الموجودة على سطح الخلايا التائية تعمل بالتزامن مع المنشطات المشتركة على سطح APC. تم
عزل البروتين
CD28 من سطح الخلايا التائية في
عام 1980 ، وسرعان ما تم العثور على جزيء B7 على سطح APC. خلال التجارب ، نقل باحثو مجموعة إليسون جين
B7 إلى خلايا سرطانية ، وبدأوا في الرفض بواسطة أنسجة صحية. اتضح أن B7 يرتبط CD28 على الخلية التائية ، وبالتالي يبدأ عمله: الخلية التائية تدمر خلية الورم ، والتي على سطحها البروتين B7 "يخرج".
في عام
1987 ، اكتشف إليسون
مستضد الخلايا اللمفاوية التائية السامة للخلايا -4 CTLA-4 (مستضد الخلايا اللمفاوية التائية السامة للخلايا -4) - ووجد أن بنية هذا البروتين تشبه بنية CD28 المعروفة منذ فترة طويلة ، كما أنها قادرة على الارتباط بـ B7. هذا يعمل بالطريقة المعاكسة تمامًا: إنه يوقف الاستجابة المناعية.
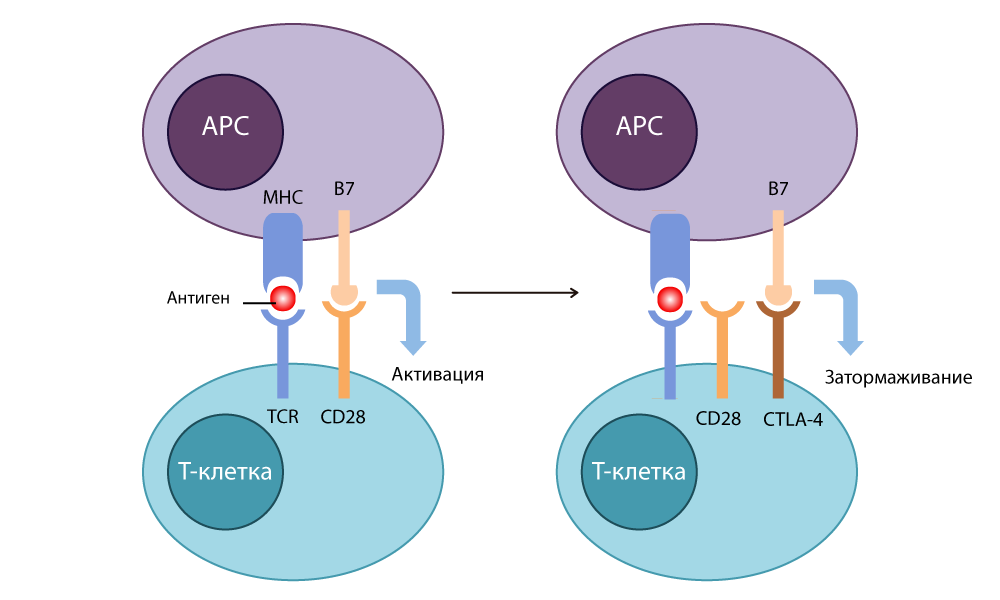 عمل CTLA-4
عمل CTLA-4أولاً ، كان الأطباء يستخدمون هذا "المكبح" لمحاربة أمراض المناعة الذاتية (عندما تبدأ المناعة في مهاجمة خلايا الجسم الصحية). لكن أليسون توصلت إلى شيء رائع: لا تضغط على الفرامل ، بل أطفئها.
قام بتطوير جسم مضاد مثبط (مفتاح) يرتبط بـ CTLA-4 ويمنعه من الإغلاق باستخدام B7 لإيقاف الاستجابات المناعية. جزيئات B7 الحرة المرتبطة CD28 ، تم تنشيط الخلية التائية وكانت جاهزة للقتل مرة أخرى. عندما أجرى تجارب على فئران السرطان المصابة بالسرطان في عام 1995 ، أصبح من الواضح أنه حتى الخلايا السرطانية الماكرة لا يمكنها أن تختبئ من الخلايا اللمفاوية التائية مع إيقاف الفرامل. في عام 2010 ، أجريت دراسات ناجحة على مرضى ميؤوس منهم. في بعض المرضى ، اختفى سرطان الجلد مع النقائل - نتيجة لا تصدق!
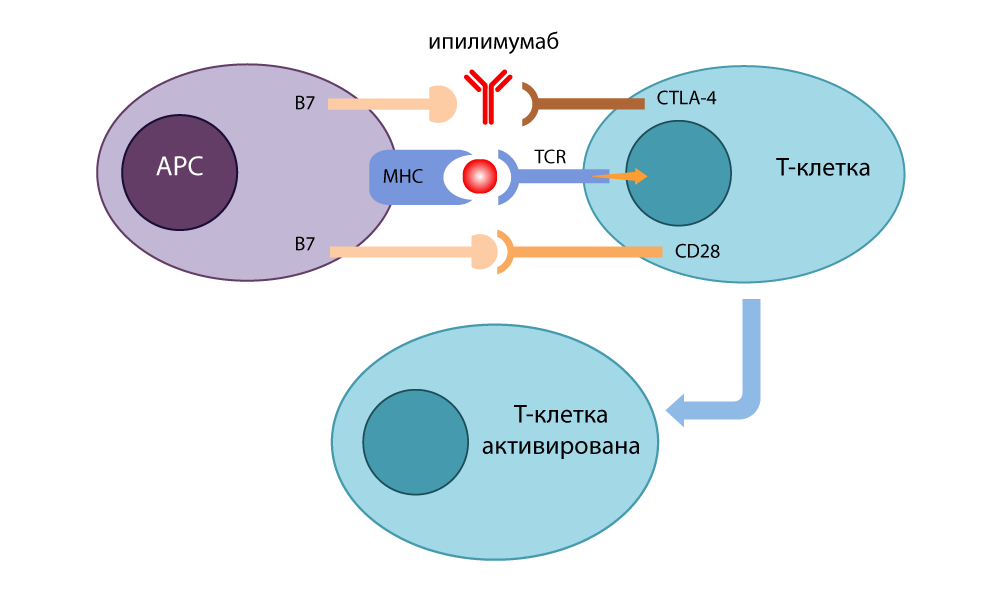 عمل مثبط CTLA-4 - ipilimumab
عمل مثبط CTLA-4 - ipilimumabفي الوقت نفسه ، في كيوتو ، عثر
تاسوكو هونجو على جزيء مستقبِل آخر على سطح الخلية التائية:
PD-1 (خلية بروتينية موت بروتينية -1 ، بروتين موت خلوي قابل للبرمجة -1). خلال التجارب (مرة أخرى على الفئران التي طالت معاناتها) ، وجد اليابانيون أن تعطيل الجين الذي يشفر هذا البروتين يثير أعراض مرض المناعة الذاتية لدى الفئران - أي أن تثبيط PD-1 قد أوقف أيضًا "الفرامل" للخلايا اللمفاوية التائية وجعلها عدوانية ونشطة.
اكتشف Honjo أن PD-1 يضع الخلية T في وضع السكون عندما يرتبط ببروتين PD-L1 / PD-L2 على سطح خلية تقدم المستضد (APC). فتح مثبط PD-1 هذا الرابط وقام بتنشيط الخلايا التائية مرة أخرى. كان عمل هذا "الفرامل" مشابهاً لعمل CTLA-4 ، لكنه اتخذ مسارا مختلفا.
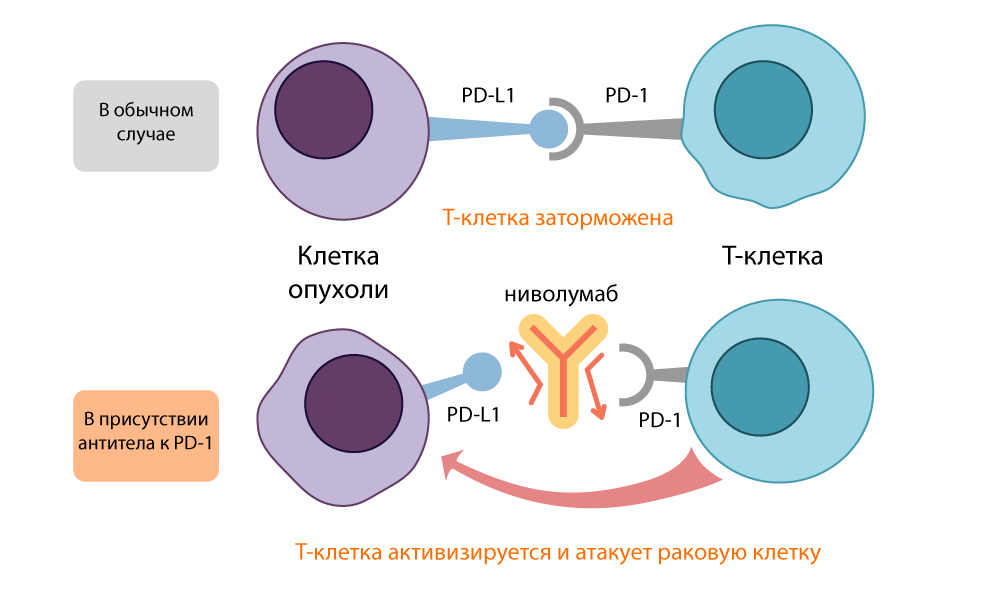 عمل مثبط PD-L1 - نيفولوماب
عمل مثبط PD-L1 - نيفولومابسميت كل من جزيئات "المثبطة" المفتوحة ، CTLA-4 و PD-1 ،
بنقاط التحكم المناعية (نقاط التفتيش) - إن عددها ونشاطها هو ما يجعل الخلايا التائية تقرر ما إذا كانت ستهدأ أو تبدأ القتال.
اتضح أن حاصرات CTLA-4 تنشط المناعة بشكل عام ، وجميع الخلايا التائية ، ويعمل مثبط PD-1 بشكل أكثر تحديداً على الأورام ، لأن تحمل العديد من الخلايا السرطانية "قطعة اللغز الثانية" ، جزيء PD-L1 / PD-L2. وبسبب هذا ، فإن العلاج بمثبطات PD-1 يقلل من خطر حدوث مضاعفات.
الحصانة الضربات الظهر. ما مثبطات نقطة تفتيش مساعدةقدمت أليسون وهونجو ليس فقط مساهمة جادة في فهم العمليات الفسيولوجية ، ولكن أيضا أطلقت موجة من البحوث العملية الجديدة بشكل أساسي في الطب التطبيقي.
إن اكتشاف تثبيط نقاط التحكم المناعي (ICT) يفتح مجالًا جديدًا بشكل أساسي لإيجاد الحلول. قبل ذلك ، كانت طرق مكافحة السرطان: الجراحة والإشعاع والعلاج الكيميائي - موجهة مباشرة إلى الورم نفسه ، إلى تدمير الخلايا السرطانية. الآن لدى الأطباء مجال ضخم للبحث في اتجاه مختلف تمامًا: تغيير تفاعل خلايا السرطان مع بيئتها.
بالمناسبة ، كان هذا الاختلاف الأساسي هو الذي أعطى الأطباء طفرة حقيقية. حتى الآن ، وقد تأثر الورم اعتمادا على موقعه. بالنسبة لسرطان الثدي ، فإن دواء واحد ، لسرطان المعدة ، مختلف تمامًا. وتم تسجيل مثبط تكنولوجيا المعلومات والاتصالات pembrolizumab في عام 2017 لأول مرة في تاريخ الأورام كدواء لعلاج أي سرطان في أي عضو - إذا أكدت الاختبارات فقط أن للورم خاصية خاصة: عدم استقرار السواتل الصغرية. وهذا هو ، الحمض النووي لها عرضة بشكل خاص للطفرات. في السابق ، لم يكن من الممكن إجراء علاج للسرطان لبعض الأعراض الشائعة. هذا إنجاز عظيم.
كانت الثورة نتائج استخدام عقاقير جديدة ضد أكثر أنواع السرطان عدوانية: واعتبر سرطان الجلد المنتشر في المرحلة الرابعة غير قابل للشفاء. وتلقى المرضى الذين يعانون من هذا التشخيص الذي خضع للدواء ipilimumab (حاصرات CTLA-4) في عام 2010 - سنة إضافية من الحياة - لذلك توقف تطور الورم. في 58 ٪ منهم ، انخفض الورم بنسبة الثلث.
في علاج سرطان الرئة ذو الخلايا غير الصغيرة باستخدام مثبطات النيفولوماب (مثبط PD-1) ، انخفض خطر وفاة المرضى بنسبة 40٪.
أظهر Pembrolizumab (وهو أيضًا مثبط PD-1) انخفاضًا بنسبة 43٪ في نمو الورم في المجموعة التي عولجت من سرطان الجلد. عاش 74 ٪ من المرضى دون تدهور خلال العام ، لمدة 18 شهرا كان هناك 71 ٪. من المهم أن يفوق تأثير وصف الدواء الآثار الجانبية في جميع مراحل تطور المرض.
اليوم ، تعالج مثبطات CTLA-4 و PD-1 سرطان الجلد (بما في ذلك غير القابل للتشغيل) ، وسرطان الرئة ذو الخلايا غير الصغيرة ، وسرطان الخلايا الحرشفية في الرأس والعنق ، وسرطان الخلايا الكلوية ، وأنواع معينة من الأورام اللمفاوية ، وسرطان المستقيم ، والمثانة ، والأورام مع عدم استقرار السواتل
من الدراسات ذات الأهمية الخاصة الدراسات التي تظهر فعالية
العلاج المركب مع كل من الأدوية المضادة لـ PD-1 و anti-CTLA-4.
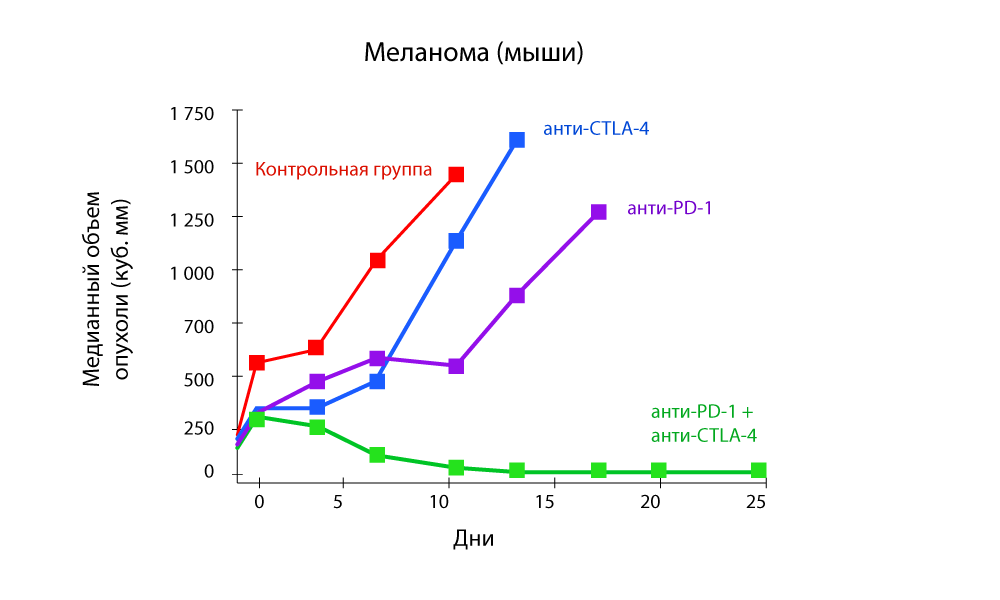 تغيير حجم الورم - انخفاض حاد مع مزيج من الأدوية المضادة لل PD-1 ومضادة CTLA-4
تغيير حجم الورم - انخفاض حاد مع مزيج من الأدوية المضادة لل PD-1 ومضادة CTLA-4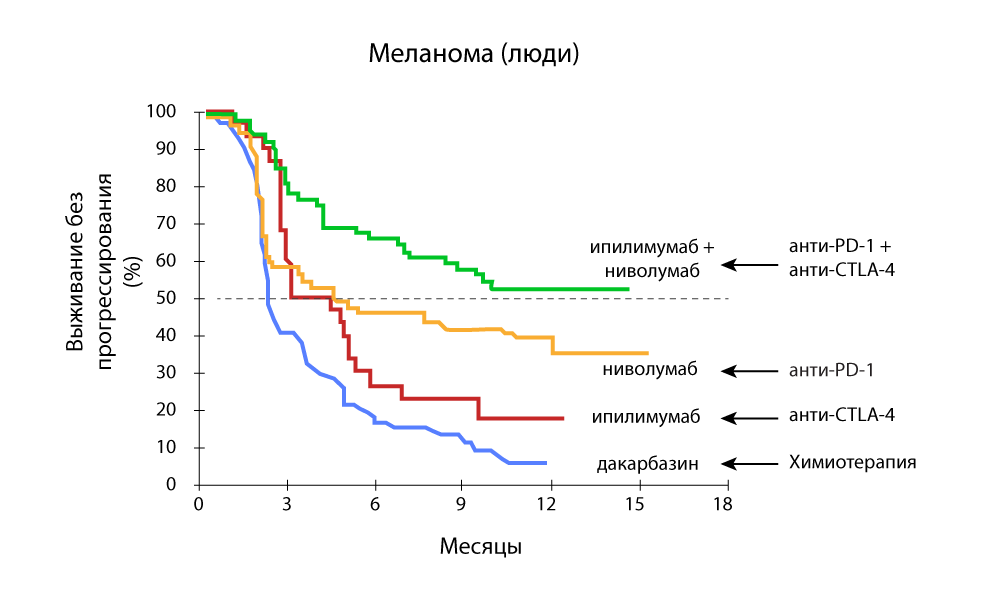 البقاء على قيد الحياة بدون تقدم - يعتبر مزيج الأدوية المضادة لـ PD-1 و Anti-CTLA-4 أكثر فعالية
البقاء على قيد الحياة بدون تقدم - يعتبر مزيج الأدوية المضادة لـ PD-1 و Anti-CTLA-4 أكثر فعاليةفي الطب 24/7 ، تم بنجاح استخدام pembrolizumab و nivolumab منذ أن تم تسجيلهما في الاتحاد الروسي. تابعنا جميع الأبحاث الأجنبية ونتطلع إلى تجديد الترسانة.
هجوم من الحيوانات المستنسخة. مناعة معدلة وراثيامثبطات نقاط التحكم المناعي مستحقة في دائرة الضوء ، ولكن هذه الآلية لا تزال غير مثالية ولا يمكنها علاج أي سرطان. من الجيد أن مجالات البحوث المتعلقة بالعلاج المناعي تتطور بنشاط. واحدة من أكثر واعدة هو
العلاج CAR-T .
الحرف T في اسم الأسلوب هو كل الخلايا التائية غير الثابتة من المناعة لدينا. CAR (مستقبلات مولد الضد الخيمري) هي مستقبلات مولد الضد الخيمري. لماذا يسمى مستقبلات خيالية؟ لأنه يتم تجميعها من عدة أجزاء مأخوذة من خلايا مختلفة - باستخدام مهارات المهندسين الوراثية.
تحتوي الخلايا التائية العادية على مستقبلات
TCR محددة
(مستقبلات الخلايا التائية) . إنه "يشعر" بجميع خلايا الجسم في طريقه ، وإذا أحس ببعض الجزيئات الغريبة على سطح الخلية ، فإنه يرسل إشارة تنشيط إلى الخلية التائية. هذا ، بدوره ، إما يتعامل مع الأجنبي غير المرغوب فيه نفسه ، أو يطلق مواد فعالة خاصة (السيتوكينات) ويدعو الخلايا المناعية الأخرى إلى "فرزها". قتل الخلايا التائية بكفاءة عالية.
صحيح ، ليست دقيقة جدا. لدينا عدد أقل بكثير من أنواع TCR من المستضدات. لذلك ، يمكن أن تتعرف الخلايا التائية على العديد من المستضدات بواسطة TCR ، ولكن تقريبًا فقط. غالبًا ما تستغل الخلايا السرطانية هذا الضعف في نظامنا الأمني وتتظاهر بأنها "خاصة بها".
حل Evolution المشكلة بأفضل طريقة ممكنة: في جسم الإنسان ، هناك آلية أخرى لتحديد الغرباء:
الأجسام المضادة . هذه بروتينات خاصة تفرزها فئة أخرى من الخلايا المناعية: الخلايا الليمفاوية ب. الخلايا البائية ، بخلاف الخلايا التائية ، لها مقاربة فردية لكل "عميل".
الجسم المضاد عبارة عن بنية بروتينية على شكل حرف Y. على طرفي "الشوكة" هناك مواقع ترتبط بالمولد الضد. يمكن أن تتغير هذه الأقسام في كل جيل جديد من الأجسام المضادة لتناسب بشكل أكبر المستضد - مثل اختيار قطع الألغاز. عندما يتم الكشف عن مستضد أجنبي ، تفرز الخلايا البائية مليارات من الأجسام المضادة ، من بينها يتم التحديد الأكثر تطابقًا مع المستضد. والنتيجة هي جسم مضاد مرجعي ، "مدرّب" على وجه التحديد من أجل التعرف الدقيق للغاية على "مستضد" أجنبي - محدد.
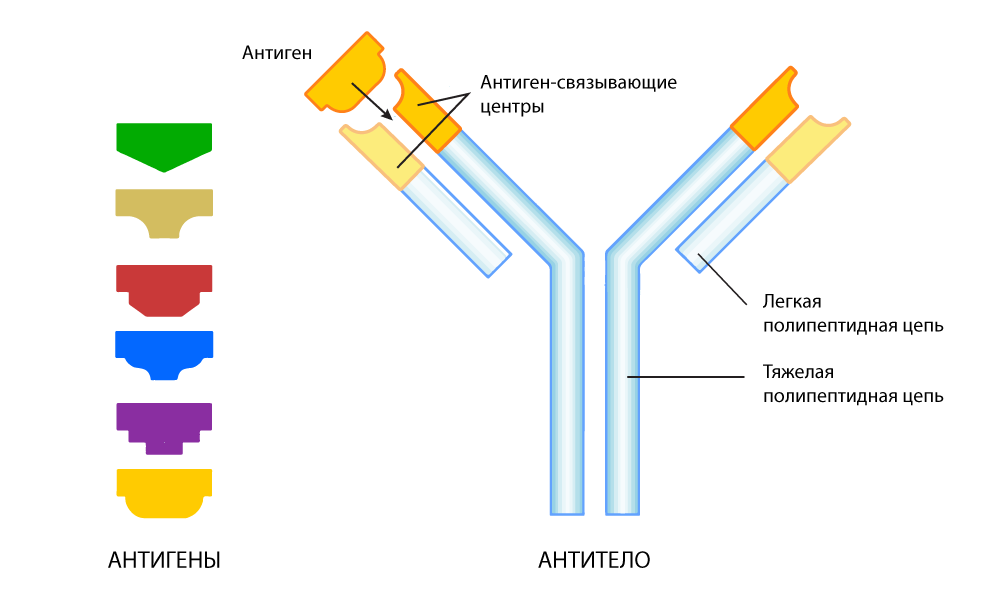 الأجسام المضادة تتكيف مع العثور على مستضد معين
الأجسام المضادة تتكيف مع العثور على مستضد معينالاعتراف ، ومع ذلك ، لا يعني دائما تحييد. مع هذا ، تواجه الأجسام المضادة صعوبات - يمكنها وحدها أن تدمرها بعيدًا عن "العدو" بأي حال من الأحوال في جميع الحالات.
لذلك ، في عام 1989 ، توصل الكيميائي الإسرائيلي وعالم المناعة زليج آخار
إلى مزيج من القوة المميتة للخلايا التائية الأعمى والقناص الذي يهدف إلى الأجسام المضادة. لقد عزل الأجزاء الطرفية للأجسام المضادة للبروتين القادرة على ربط مستضد بعض الخلايا السرطانية بإحكام ، و "زرعها" في الخلية التائية - استبدلت جزء TCR المسؤول عن التعرف على المستضدات.
بعد ذلك ، بدأ العمل مع زميله الأمريكي ، ستيفن روزنبرغ ، وتمكنوا من جعل مستقبلات خيالية التصميم أكثر كفاءة ، حساسة وانتقائية على حد سواء.
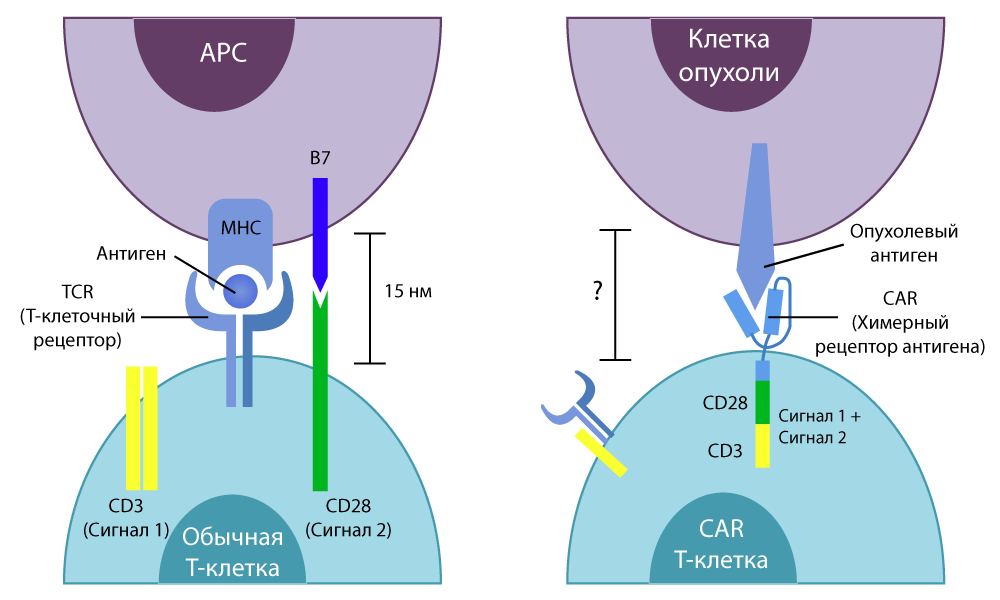 الفرق بين خلايا T التقليدية وخلايا CAR-T
الفرق بين خلايا T التقليدية وخلايا CAR-Tفي الدراسات المختبرية أظهرت نتائج جيدة. ثم عالج العلماء الفئران مرة أخرى ، ثم نقلوا هذه التقنية بشق الأنفس إلى البشر.
مع مرور الوقت ، أدى العلاج CAR-T إلى نظرة حديثة.
- أولاً ، بمساعدة الاختبار الجزيئي الجزيئي ، يتم تحديد طفرات معينة في الخلايا السرطانية البشرية ، والتي يمكن "ضبطها" على الأجسام المضادة.
- ثم يأخذ الشخص خلايا T الخاصة به ، ويتغير باستخدام أساليب الهندسة الحيوية ، بدلاً من TCR "زرع" CAR ، ضبطها على الطفرات المحددة.
- ثم تتكاثر خلايا CAR-T المعدلة في المختبر ويتم إدخالها مرة أخرى في جسم الإنسان ، حيث تتعرف على الخلايا السرطانية وتقتلها بنجاح.
في التجارب السريرية التي بدأت في عام 2010 ، تم الحصول على نتائج مشجعة على الفور: في علاج سرطان الغدد الليمفاوية ، أظهر 12 من أصل 13 مريضا تحسنا ، وبدأ 4 مغفرة. في علاج سرطان الدم ، حدثت مغفرة في 17 من 33 شخصا.
في عام 2018 ،
ظهر مقال لعلماء الأورام الأمريكيين في مجلة Nature Medicine ، التي ذكرت أنها منذ عامين تراقب المريض الذي يتمتع بصحة جيدة بعد العلاج CAR-T. تم علاجها من سرطان الثدي النقيلي مع النقائل. يتم تقديم هذه الصورة لها في قوارب الكاياك في بداية المقالة: بعد العلاج ، عادت إلى العمل وتذهب إلى المخيم.
أمل جديد. هل سيكون العلاج المناعي حلا سحريا؟مثل علاجات السرطان الأخرى ، فإن العلاج المناعي له حدوده. على الرغم من حقيقة أنه في بعض الحالات ، يعطي المرضى استجابة جيدة جدًا للعلاج بمثبطات نقطة التحكم المناعي ، في 60٪ من الحالات المكتسبة أو تتطور المقاومة الأولية لمضادات PD-1 أو مضادات CTLA-4: الورم ببساطة لا يستجيب لتلقي العلاج أو تتكيف بسرعة ويتعلم "الالتفاف" عليه.
بالإضافة إلى PD-1 و PD-L1 / 2 و CTLA-4 و CD28 و B7 ، هناك العديد من المستقبلات الأخرى على أسطح الخلايا التائية والخلايا السرطانية ، والتي لم تتم دراسة آثارها بعد وكذلك على عمل نقاط التحكم ، لكنها تؤثر أيضًا للاستجابة المناعية. أحد مجالات العمل هو التأثير على هذه المستقبلات المشاركة.
بالإضافة إلى ذلك ، يُستكمل العلاج بتكنولوجيا المعلومات والاتصالات بإدخال اللقاحات ، السيتوكينات ، حاصرات بيتا - وهذا النهج يعمل أيضًا بشكل جيد في
بعض الحالات .
لا يزال علاج CAR-T مكلفًا للغاية ولا يزال في مرحلة الاستخدام التجاري فقط: هناك تطورات جارية في المجموعات العلمية من Eshhar و Rosenberg ، باحثين آخرين - كل مجموعة من المجموعات تنشئ أنواعًا خاصة من CAR-T مع إجراء موجه ضد نوع معين من السرطان. ولكن حتى الآن هذا هو البحث والاختبار والاختبار فقط. سوف يستغرق الأمر عدة سنوات قبل أن يتحول هذا إلى طريقة راسخة للعلاج الشامل - ولكن حتى ذلك الحين لن يكون من الممكن تقديم ضمانات 100 ٪.
ولكن بينما يجري العلماء أبحاثًا ، يقدم الأطباء أنظمة علاجية تجريبية باستخدام تلك الإنجازات الموجودة بالفعل. والتأثير الأكثر وضوحا هو الجمع بين العلاج المناعي مع "الركائز الثلاث" الكلاسيكية لعلم الأورام: الإشعاع والعلاج الكيميائي ، الجراحة. عند الجمع بين هذه الأساليب ، يتم دائمًا الحصول على التآزر: تعمل معًا بكفاءة أكبر من دورها.
, ( ) , , , : .
. , ,
. , , , , . . , 50% . , .
. 3 , 3 «», , , .
– . , , . , 2-3 . , , , . , .
.
« 24/7» , , - . , . – . – . III-IV . , , .
, – . , , , . , , . , . .