لقد أخبرناك بالفعل عن تعميم الرنا الميكروي ، لكن هناك شيئًا رائعًا بنفس الدرجة - الحمض النووي المنتشر خارج الخلية (الحمض النووي الخالي من الخلايا الإنجليزية ، الحمض النووي المنتشر). تم افتتاحه في عام 1948. الآن ازداد الاهتمام بها ، وهذا هو ، في الواقع ، الأمر.
تم العثور على الحمض النووي خارج الخلية (cfDNA) في العديد من سوائل الجسم: في البلازما والمصل ، والبول ، واللعاب ، الزليلي ، السائل البريتوني والشوكي.
سننظر في ميزات cfDNA في اثنين من السوائل: الدم والبول. من الواضح أنه أكثر ملاءمة للتشخيص.
مصادر [كدنا] في الجسم
كما أصبح معروفًا ، فإن cfDNA ينتشر في الدم كجزء من الأجسام الأبوطوزية ، الميكروفيات ، النيوكليوسومات ، الإكسوسومات ، مجمعات البروتين النووي مع بروتينات الدم ، وفي شكل حر ، على ما يبدو.
يُعتقد أن أسباب cfDNA في الدم هي عمليات موت الخلايا ، ونضج خلايا الدم الحمراء ، وإفراز الحمض النووي بواسطة الخلايا ، وكذلك البكتيريا والفيروسات. نلاحظ على الفور أن المصدر الأخير ، الحمض النووي للبكتيريا والفيروسات ، يقدم مساهمة ضئيلة للغاية في إجمالي مجموعة الحمض النووي الدائر ، ومستوى الحمض النووي الخارجي أثناء العدوى لا يتجاوز عدة عشرات من كلغ / مل. حيث أنه ، وفقًا للبيانات الحديثة ، فإن المستوى الطبيعي للـ cfDNA في الجسم السليم هو 3-44 نانوغرام / مل في البلازما و 50-100 نانوغرام / مل في مصل الدم.
من المحتمل أن ينجم جزء كبير من cfDNA في الجسم عن موت الخلايا أثناء موت الخلايا المبرمج ، والنخر ، والتهاب الشبكية. تموت حوالي مئة مليار خلية يوميًا في شخص بالغ من خلال موت الخلايا المبرمج (موت الخلايا المبرمج) ، ونتيجة لذلك يتحلل حوالي 1 غرام من الحمض النووي في اليوم.
في عملية موت الخلايا المبرمج ، يتم تقطيع الحمض النووي النووي بواسطة إنزيم خاص هو DNase. بعد ذلك ، تظهر شظايا الحمض النووي بطول نواة متعددة (180 - 200 نبضة في الثانية ، أزواج النكليوتيدات) ، والتي يجب التخلص منها بواسطة البلاعم كجزء من الأجسام الأبوطوزية (عبوة خاصة بعد موت الخلايا المبرمج). يعلم الجميع أن أزواج النوكليوتيدات (أدينين ثيمين وجوانين سيتوزين) في الحمض النووي لدينا تتكرر ثلاثة مليارات مرة. Nucleosomes هي هياكل خاصة في الكروماتين ، وتتألف من بروتينات هيستون ، والتي يتم فيها تقطع حبلا الحمض النووي مرة واحدة ونصف دورة.
ثم يحدث شيء غريب. لأسباب غير معروفة ، يتجنب جزء من الحمض النووي للخلايا الميتة الالتقاء بالبلاعم ويدخل مجرى الدم. في أوقات مختلفة ، أجريت تجارب تؤكد طبيعة موت الخلايا المبرمج [cfDNA].
عندما يتم فصل cfDNA من المتبرعين الأصحاء عن طريق الرحلان الكهربائي الهلامي ، يتم الكشف عن العصابات المقابلة لأطوال الشظايا البالغة 180 - 200 نبضة. والأطوال التي هي مضاعفات هذا العدد ، والذي يتوافق مع الانقسام الداخلي للكروماتين أثناء موت الخلايا المبرمج. إن اكتشاف الحمض النووي للجنين في دم الأم يتحدث أيضًا عن موت الخلايا المبرمج كمصدر للـ cfDNA [3].
عادةً ما يقدم النخر مساهمة أقل أهمية في ظهور cfDNA ، مما يزيد من عدد الإصابات الشديدة. تم الكشف عن cfDNA الناخر في البلازما في شكل شظايا أطول - أكثر من 10 آلاف سنة مضت. باستخدام PCR (تفاعل البلمرة المتسلسل) ، يمكن التمييز بين الشظايا الطويلة من cfDNA الناتجة عن النخر وشظايا أقصر بسبب موت الخلايا المبرمج.
بالإضافة إلى موت الخلايا المبرمج والنخر ، هناك نوع آخر غير معروف من موت الخلايا ، والذي يعد مصدرًا ل cfDNA - netosis (NETosis).
مع التعرق الخلوي ، تقوم خلايا العدلات بإخراج هياكل خاصة تشبه الشبكة ، وفخاخ العدلات خارج الخلوية (NET ، Neutrophil Extracellular Trap) ، التي تتمثل مهمتها في إلغاء تنشيط الممرض الذي دخل الجسم: الفيروسات والفطريات والبكتيريا. في هذه الحالة ، تموت العدلة ، وتلقي الحمض النووي ، هيستون ، البروتينات المختلفة والإنزيمات في الفضاء خارج الخلية. من المعروف أنه في بعض الأحيان تكون عملية NET مرضية بطبيعتها ، حيث تساهم في تطور الخثار وأمراض القلب والأوعية الدموية وأمراض المناعة الذاتية ، وكذلك السرطان.
في الآونة الأخيرة ، في عام 2018 ، تم اكتشاف أنه في حالة الإصابة بفيروس نقص المناعة البشرية ، تحدث العدلات المفرطة النشاط ، وآلية NET ، والتعرق. ونتيجة لذلك ، كان هناك موت واسع النطاق للخلايا المناعية التي استولت عليها شبكات العدلات ، وخلايا CD4 + و CD8 + T ، والخلايا B وحيدات الخلايا ، وتطوير أمراض القلب والأوعية الدموية المصاحبة لها [4].
مصدر آخر محتمل من [كدنا] هو إفراز الحمض النووي عن طريق الخلايا السرطانية العادية. مرة أخرى في عام 1972 ، تم الحصول على أدلة على الإطلاق النشط للحمض النووي بواسطة الخلايا اللمفاوية في الوسط خارج الخلية [5].
وجود مثل هذه الظاهرة مثل إطلاق الحمض النووي للخلايا في الوسط خارج الخلوي يدل على وجود آليات خاصة لنقل الحمض النووي من خلال غشاء الخلية. في أثناء الدراسات ، وجد أن إطلاق الحمض النووي من الخلايا اللمفاوية يحدث مع النشاط الفعال للتربسين والبروناز والبلازمين على خلفية نقص أيونات Ca2 + و Mg2 +. فائض أيونات الكالسيوم يمنع خروج الحمض النووي من الخلية [6].
وفقًا للكيميائيين الحيويين الروسيين من جامعة ولاية قازان ، قد يكون مصدر آخر محتمل لـ cfDNA في الدم شكلاً غير معروف تمامًا من الحمض النووي السيتوبلازمي ، يختلف عن الحمض النووي النووي والميتوكوندريا - الحمض النووي المرتبط بغشاء الخلايا اللمفاوية ثنائية التبلور البشرية ) [7].
على الرغم من حقيقة أن هذا النوع من الحمض النووي قد اكتشف في عام 1971 ، فإنه لا يزال غير مستكشف ، ولا يوجد سوى القليل من الأعمال التي قام بها المؤلفون أنفسهم ، رغم وجودها في PNAS و Nature.
وفقًا لافتراض أبراموفا ز. وآخرون ، يمكن تشكيل جزء من cfDNA من هذا الحمض النووي الخلوي ، كما يتضح من السمات المميزة لبعض شظايا cfDNA ، تختلف عن النووية والميتوكوندريا [6].
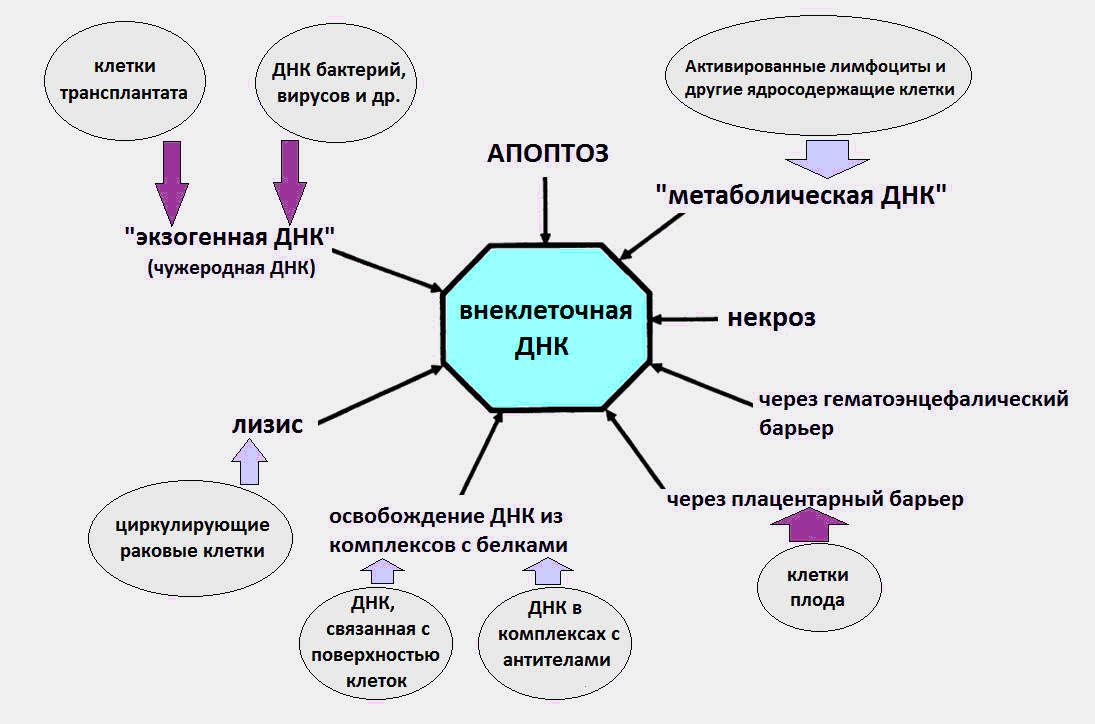 الشكل 1: الطرق المختلفة التي تدخل بها cfDNA في الدورة الدموية.
الشكل 1: الطرق المختلفة التي تدخل بها cfDNA في الدورة الدموية.يمكن العثور على مزيد من التفاصيل حول جميع جوانب بيولوجيا cfDNA (الآثار المناعية واستقبال cfDNA على سطح الخلية ، وما إلى ذلك) في مراجعة مفصلة للأستاذ كوزلوف ف. (معهد بحوث علم المناعة السريرية SB RAMS) [8].
الحمض النووي خارج الخلية باعتباره علامة حيوية لمختلف الأمراض
يشير المنطق إلى أن مستويات cfDNA يجب أن تتغير مع الأمراض التي تصاحب موت الخلايا الجماعية. أظهر عدد من الدراسات زيادة كبيرة في مستويات cfDNA مع تطور أمراض المناعة الذاتية (الذئبة الحمامية الجهازية ، تصلب الجلد النظامي ، التهاب المفاصل الروماتويدي ، إلخ) ، وأن هناك ميزات مميزة ل cfDNA نموذجية لبعض أمراض المناعة الذاتية [8-10].
ومن المعروف أيضًا أنه في حالة احتشاء عضلة القلب الحاد ، الذي يصاحب موت خلايا القلب بنوع كل من النخر وموت الخلايا المبرمج ، تزداد أيضًا مستويات cfDNA. وكان هذا ذا قيمة تشخيصية محتملة ، لأن المرضى الذين طوروا مضاعفات لديهم مستويات أعلى من أولئك الذين كانوا يتعافون بشكل أفضل [11].
في المرضى الذين عانوا من سكتة دماغية حادة ، يرتبط تركيز cfDNA في بلازما الدم ، المقاس في غضون 24 ساعة ، بخطورة السكتة الدماغية ويمكن أن يكون بمثابة مؤشر على الوفيات وشدة النتيجة حتى في أولئك المرضى الذين ليس لديهم تغييرات مرئية تم اكتشافها بواسطة طرق التصوير العصبي [١٢.١٣] .
من المعروف أن cfDNA يتميز بوجود عدد كبير من متواليات جوانين السيتوزين (GC) ، والتي هي أكثر مقاومة للتدمير من قبل النيوكليز من شظايا الحمض النووي الأدينين. وهكذا ، فإن محتوى تسلسل جينوم محدد من الجينوم - المنطقة المنقولة لتكرار الريبوسوم - في cfDNA أعلى عدة مرات من محتوى هذا التكرار في الحمض النووي النووي [14].
وفي الأمراض المزمنة المصحوبة بتنشيط موت الخلية (مرض الشريان التاجي وارتفاع ضغط الدم الشرياني وأمراض المناعة الذاتية) ، يزداد محتوى تسلسل علامات GC الغنية في الدم fcDNA بمقدار 10 مرات أو أكثر [15]. هذا يجعل من الممكن استخدام المعلمات من الحمض النووي الريباسي المخصب GC كجزء من [كدنا] كمؤشر حيوي لعملية المرضية التي تحدث بشكل مزمن.
في مكافحة السرطان ، تتمثل المهمة في اكتشاف ورم في أقرب وقت ممكن. هنا ، [كدنا] ذات أهمية قصوى كمؤشر بيولوجي للأورام.
تم الكشف عن طفرات نقطة في الورم fcDNA في دم المرضى قبل وقت طويل من إجراء التشخيص [16].
حول مستويات cfDNA في علم الأورام ، البحث عن طفرات خاصة بـ ccDNA في التسرطن ، مثل الجينات المسرطنة KRAS ، HER2 ، BRCA1 ، APC ، PIK3CA ، BRAF ، وما إلى ذلك ، باستخدام الحمض النووي للميتوكوندريا كعلامة في ccDNA ، دراسة التغيرات الجينية واللاجينية المميزة cfDNAs ، مثل hypomethylation لعناصر Alu motile ، في حالة الأورام ، يمكن العثور على "cfDNA" (دليل النزاهة) والجوانب الأخرى في أعمال Vasilieva et al. و Gonzalez-Masia et al. [17 ، 18].
لقد ثبت أن cfDNA يتميز بحالة أكسدة أقوى بكثير تحت تأثير أنواع الأكسجين التفاعلية (ROS) من الحمض النووي النووي.
وبالتالي ، فإن محتوى علامة أكسدة الحمض النووي المعروفة ، 8-ohodG ، في تكوين الحمض النووي النووي بشكل طبيعي ولمختلف الأمراض ، يتراوح من 1 إلى 10 لكل مليون نيوكليوتيدات ، ومحتوى هذه العلامة في cfDNA هو 300 أو أكثر لكل مليون نيوكليوتيدات [19].
تم إنشاء زيادة حادة في محتوى 8-ohdG في cfDNA في أمراض الأورام وأمراض القلب والأوعية الدموية ، والتي تترافق مع الإجهاد التأكسدي ، ويمكن أن تصل إلى قيم 3000 8 oxodG لكل مليون نيوكليوتيدات [20].
بشكل عام ، يُعتقد أن مستويات 8-ohdG في cfDNA هي علامة حساسة لإجهاد التأكسد الكلي في الجسم.
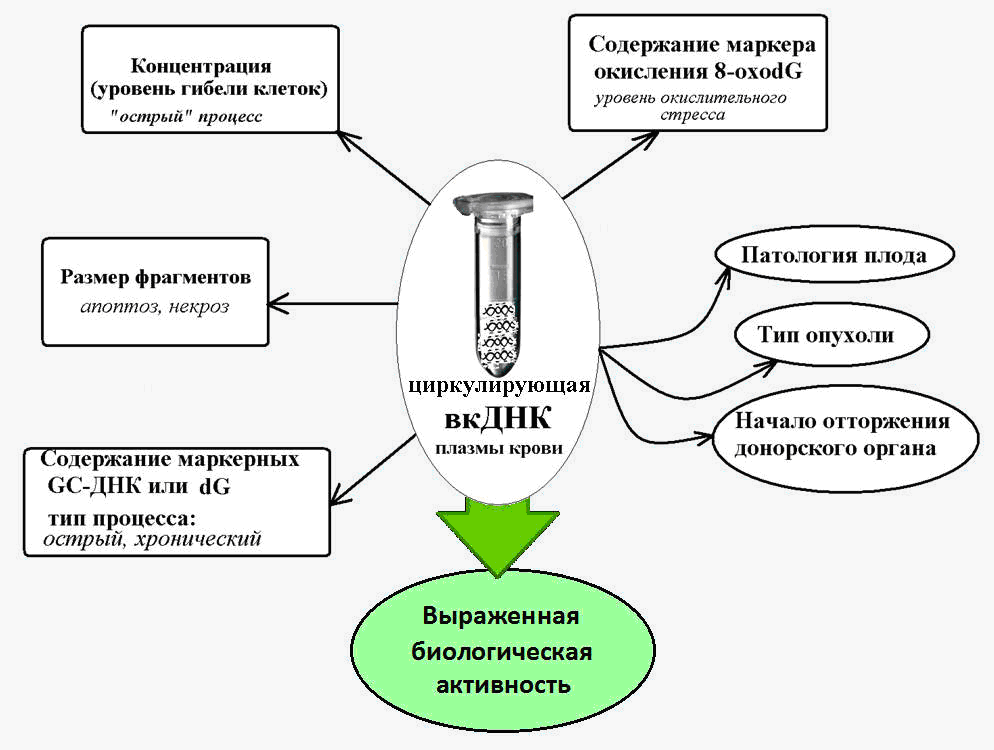 شكل 2. تعميم الحمض النووي خارج الخلية - علامة في الظروف المرضية المختلفة ، يرافقه زيادة موت الخلايا.
شكل 2. تعميم الحمض النووي خارج الخلية - علامة في الظروف المرضية المختلفة ، يرافقه زيادة موت الخلايا.الحمض النووي خارج الخلية كعنصر متنقل
حدث تقدم كبير ومهم للغاية في دراسات دور cfDNA في العمليات الداخلية قبل 3 سنوات. في عام 2015 ، قامت مجموعة من الباحثين باكتشاف مثير ، أظهر أن [كدنا] ، مثل العناصر الوراثية المتنقلة ، قادر على غزو الحمض النووي النووي ويسبب طفرات في الجينوم [21]. كل هذا مثير للدهشة.
في الأعمال السابقة ، تبين بالفعل أن الحمض النووي للورم من الدم قد يكون لديه القدرة على الاندماج في الحمض النووي النووي. وضعت الخلايا الليفية بالماوس في بلازما مأخوذة من مرضى سرطان القولون ، وبعد ذلك تم اكتشاف جينات K-ras وجينات بروتين p53 المتورط في موت الخلايا المبرمج في الحمض النووي لخلايا الفأر ، والخلايا نفسها تحولت إلى الورم (تسبب السرطان في الفئران السليمة) [22] ]. هذا يدل على أن الحمض النووي من البلازما تم امتصاصه وتكامله بواسطة الخلايا الموضوعة فيه. قد تكون هذه الظاهرة المزعومة - امتصاص الخلايا السليمة من الجينات المسرطنة من vcDNA المنتشرة في الدم - مسؤولة عن عملية ورم خبيث وتسمى "جينوميساسيس".
في عمل آخر ، تم تقديم بيانات حول امتصاص وتكامل شظايا الجينة DYS14 الخاصة بالكروموسوم Y في دماغ امرأة تحمل جنينًا ذكريًا [23].
في دراسة أجريت عام 2015 ، قام العلماء بتتبع كيف تم بسهولة إدخال cfDNAs المسمى الفلورسنت المأخوذة من مرضى السرطان والأشخاص الأصحاء في الحمض النووي النووي للأورام الليفية الفئران في التجارب المختبرية (أي خارج كائن حي في الثقافات الخلوية). علاوة على ذلك ، تم ترجمة cfDNA البشري في نوى خلايا الفأر لعدة دقائق ، وأظهر ما يقرب من 100 ٪ من نوى خلايا الماوس إشارات الفلورسنت لمدة 30 دقيقة.
أظهر تسلسل كامل جينوم خلايا الماوس وجود شظايا من الحمض النووي البشري فيها ، بما في ذلك العناصر المتنقلة المميزة لـ Alu. بالإضافة إلى ذلك ، وجد الباحثون تحريض بؤر γ-H2AX الناشئ عن تلف الحمض النووي ، وكذلك زيادة في نشاط caspase-3 والتعبير عن جينات ATM و p53 و p21 و GADD-34 و DNA ligase. وهو ما يشير جميعًا إلى زيادة عدم استقرار الجينوم وتفعيل الاستجابة لتلف الحمض النووي وموت الخلايا المبرمج.
ثم اختبر المؤلفون تأثير الـ vcDNA الغريب في الجسم الحي على الكائن الحي. تم حقن الفئران عن طريق الوريد مع [كدنا] الإنسان ، والتي وجدت شظاياها في القلب والرئتين والكبد والدماغ من الفئران التي تم التضحية بها بعد 7 أيام من الحقن.
علاوة على ذلك ، فإن جزيئات الحمض النووي البشري التي تدار على الفئران كانت قادرة على عبور حاجز الدم في الدماغ واختراق الدماغ. كما في حالة الخلايا في الثقافة ، تسبب الإعطاء الوريدي للـ cfDNA في تحريض γ-H2AX و casapase 3 proapoptotic وتفعيل الاستجابة لتلف الحمض النووي. ووفقًا للعلماء ، فإن الاستجابة لتلف الحمض النووي هي التي تلعب دورًا رئيسيًا في تكامل الحمض النووي الريبي النووي في الحمض النووي.
ينظر الدنا النووي إلى إدخال خارج الخلية على أنه تمزق مزدوج تقطعت به السبل ويبدأ في "ترقيع" نفسه ، ويدمج الحمض النووي المتداول في تركيبته: "إن تنشيط الاستجابة لتلف الحمض النووي يجمع بين عدة cfDNAs غير المتجانسة وكروماتين مجزأ في أطراف متزامنة طويلة من خلال اتصال غير متماثل للنهايات".
ونتيجة لذلك ، توصل الباحثون إلى استنتاج مفارقة: "كون كل مكان موجود باستمرار ، فإن تلف الحمض النووي الناجم عن الحمض النووي خارج الخلية يمكن أن يكون السبب الرئيسي للشيخوخة المرتبطة بتشوهات الشيخوخة والموت النهائي للجسم. وبالتالي ، فإن الحمض النووي ، ربما ، يلعب دورًا متناقضًا باعتباره حارس أسس الحياة ومدمّر الحياة نفسها ".
وغني عن القول أن هذا الاستنتاج يتناقض تمامًا مع جميع الأفكار المتعلقة بالشيخوخة اليوم.
يشير المنطق إلى أن هذه الفرضية سوف تتوافق مع التبعية التالية: كلما طالت مدة حياة أي نوع من الحيوانات ، قل الفرد من هذا النوع من الحمض النووي و / أو أنه أقل خطورة على هذا النوع.
ولكن حتى يتم الانتهاء من هذه الدراسة المقارنة ، يبقى أن نفترض أنه في الأنواع طويلة العمر (البشر) و (cfDNAs) قصيرة العمر يتم إنتاجها ، من المفترض ، بكميات قابلة للمقارنة نسبياً. وعلى العكس من ذلك ، فإن اكتشاف تركيزات متزايدة من هذه الجزيئات في كبار السن قد يكون نتيجة لعملية الشيخوخة وليس سببها.
على الرغم من أن هذه نتيجة يمكن أن تعزز القضية. اقرأ مقال بيليكوف.
بالإضافة إلى ذلك ، يقترح مؤلفو الاكتشاف نسب cfDNA إلى فئة أخرى من العناصر الوراثية المتنقلة. وبعد ذلك ، ربما ، فإن المشاركة الواسعة في تطور عملية مثل نقل الجينات الأفقي ، في كل من اللافقاريات وممثلي الفقاريات في عالم الحيوان ، ستحصل على تفسير. بفضل ذلك ، وفقًا لأحد أحدث البيانات ، يمكن للجينوم البشري استعارة عشرات الجينات من الأنواع الأخرى [24]
لا يزال هناك سؤال مهم للغاية مفتوح: كيف بالضبط cfDNAs تدخل الخلية؟ تشمل الفرضيات الحالية اقتراحًا مفاده أن الجزيئات التي تحتوي على الحمض النووي يمكنها اختراق الخلايا من خلال المسام الموجودة في الغشاء ، وكذلك من خلال أنواع مختلفة من التقرحات البطانية أو كثرة الخلايا الفطرية التي تعتمد على البروتوكليكان ، أو عند التفاعل مع البروتينات الغشائية.
الحمض النووي خارج الخلية للسمنة والالتهابات والأشعة السينية والضغط من مختلف الأنواع
اكتشاف آخر مثير للاهتمام تم إجراؤه بعد عام من قبل باحثين يابانيين. لقد كانوا قادرين على وصف المشاركة الفعالة لـ cfDNA ، والتي ظهرت في الدم كنتيجة لوفاة الخلايا الشحمية في الأشخاص الذين يعانون من السمنة المفرطة ، في تطور الالتهاب ومقاومة الأنسولين. كان العامل الرئيسي الذي يتفاعل مع cfDNA في هذه العمليات هو جزيء المناعة الفطرية مثل مستقبلات تول 9 (TLR9) [25].
ليس من دون دسيسة من جانب العلماء الروس من معهد الفيزياء الحيوية النظرية والتجريبية للأكاديمية الروسية للعلوم. ووجدوا أن تشعيع الأشعة السينية والميتفورمين المضاد لمرض السكر يسببان زيادة في إفراز البول من [كدنا] (النووي والميتوكوندريا) في الفئران.
أظهرت بياناتهم أنه قبل التجارب ، كانت كمية الحمض النووي الريبي النووي أعلى بنسبة 40 ٪ ، وأن الحمض النووي الريبي الميتوكوندريا أعلى بنسبة 50 ٪ في بول الفئران المسنة مقارنة مع الفئران الشابة.
بعد 12 ساعة من التشعيع ، زاد محتوى i-fcDNA و mt-fcDNA في بول الفئران الشابة بنسبة 200 ٪ و 460 ٪ ، على التوالي ، مقارنة مع السيطرة ، بينما في بول الفئران المسنة زاد بنسبة 250 ٪ و 720 ٪.
بعد 6 ساعات من إعطاء الميتفورمين لفئران أخرى ، زادت كمية i-cfDNA و mt-fcDNA في بول الفئران الشابة بنسبة 25 ٪ و 55 ٪ وبنسبة 50 ٪ و 160 ٪ في بول الفئران المسنة.
وفقا للمؤلفين ، تشير هذه البيانات إلى أن الأشعة السينية والميتفورمين تسبب زيادة كبيرة في cfDNA في بول الفئران (خاصة القديمة منها) ، والناجمة عن موت الخلية النشط في الأنسجة. تشير هذه النتائج أيضًا إلى أن الميتفورمين قد يعمل كحلول للبول ، مما يؤدي إلى موت الخلايا القديمة التي تحتوي على اضطرابات هيكلية ووظيفية [26].
في أكتوبر من العام الماضي ، تتبع العلماء العلاقة بين مستويات cfDNA والإجهاد العقلي والنشاط البدني لدى الشباب الذين تتراوح أعمارهم بين 18 و 36 عامًا. أظهرت النتائج زيادة مضاعفة في cfDNA بعد إجهاد المختبر النفسي الاجتماعي الحاد (TSST) وزيادة خمسة أضعاف في cfDNA بعد التمرين على المطحنة (مع تحقيق استنفاد المطحنة).
كما تم تسجيل كمية متزايدة من شظايا أقصر من [كدنا] ، سمة من موت الخلايا المبرمج ، في الدم بعد الإرهاق البدني.
وأظهرت الحمض النووي خارج الخلية الميتوكوندريا نفس الزيادة بعد كل من الأحمال الإجهاد. بالإضافة إلى ذلك ، كانت ملفات تعريف مثيلة cfDNA المستخدمة في هذا العمل كعلامة للأصول الخلوية المختلفة مختلفة اختلافًا كبيرًا في اختبارات الإجهاد المختلفة.
لتحليل المثيلة ، اختار العلماء جين HOXA5 المتورط بنشاط في التطور الجنيني بسبب خصوصية مثيلة في أنواع مختلفة من الخلايا. لذلك ، يتميز بفرط الميثيل في خلايا العضلات ، نقص الميثيل في خلايا المخ ، من خطوط الخلايا الحصين والخلايا العصبية المستنبتة ، والميثيل التفاضلي في خلايا الدم.انخفض ميثيل الجين HOXA5 في cfDNA مباشرة بعد الإجهاد النفسي والاجتماعي وزاد بعد الإجهاد البدني ، والذي يشير ، حسب المؤلفين ، إلى مصادر خلوية مختلفة لإطلاق الدنا النووي النشط. [27]الحمض النووي خارج الخلية والشيخوخة
الآن الشيء الرئيسي. دعونا دراسة العلاقة بين المستويات والميزات المحددة من [كدنا] مع الشيخوخة.نُشرت الأعمال الأولى التي أظهرت هذه العلاقة في 2011-2013. درس علماء الأحياء المجهرية وعلماء المناعة الفنلنديون من جامعة تامبيري قيم cfDNA في كبد طويل العمر يتجاوز عمره 90 عامًا ، والمشاركون في دراسة Vitality 90+ والشباب (الذين تتراوح أعمارهم بين 22 و 37 عامًا) كمجموعة مراقبة.أظهرت نتائج عملهم أن تركيز [كدنا] في كبد طويل كان أعلى بكثير من الشباب. كانت هناك أيضًا اختلافات مميزة في cfDNA: في كبار السن كانت ممثلة أكثر بشظايا منخفضة الوزن الجزيئي ، وفي الشباب كانت ممثلة بشظايا أكثر وزنًا جزيئيًا مرتفعًا ، أي لفترة أطول.في الدراسات التالية ، أظهرت نفس المجموعة أن مستويات cfDNA لها علاقة واضحة مع علامات الالتهاب (ترتبط إيجابيا بمستويات البروتين التفاعلي C ، الأميلويد A (SAA) ، وما إلى ذلك) والوفيات عند الأشخاص الذين تزيد أعمارهم عن 90 عامًا. وكذلك حقيقة أن المستويات الأعلى من الحمض النووي الكبدي الكلي الكلي الناقص الميثيل كانت مرتبطة بالتهاب جهازى وتطور الوهن الخرفى (الوهن) [28-30].أظهرت اثنتان من الدراسات الحديثة على cfDNA والشيخوخة تغيرات جينية مميزة في هذا الحمض النووي.في أحدهم ، قام فريق من العلماء بتحليل كيفية تغير مثيلة العناصر الجينية المتنقلة LINE-1 و Alu في cfDNA للأشخاص الأصحاء الذين تتراوح أعمارهم بين 23 و 61 مع تغير العمر.يبلغ طول عنصر LINE-1 حوالي 6 آلاف نقطة أساس ، بينما يبلغ حجم شظايا cfDNA عالية الوزن الجزيئي ، مقارنةً ، أكثر من 10 آلاف برميل في اليوميشير السطر 1 إلى التراجع ، أي إلى العناصر المتنقلة التي تستخدم النسخ العكسي لتكاثرها ، ونقل المعلومات الجينية من الحمض النووي الريبي إلى الحمض النووي. LINE-1 هو العنصر المتحرك الوحيد للجينوم المعروف اليوم والذي يحتفظ بالقدرة على إعادة إنتاج ونقل نسخته في الجينوم. هذا أيضًا هو الأكثر عددًا من الهياكل البشرية المتنقلة: تشغل نسخ LINE-1 نسبة كبيرة من الحمض النووي - أي خمس الجينوم بأكمله.العنصر الثاني ، Alu ، لا يمكن أن يتكاثر ويدخل إدخالات جديدة في الجينوم من تلقاء نفسه ، وفي هذه العملية يعتمد على الجهاز الوراثي لعنصر LINE-1 (لمزيد من التفاصيل حول عناصر الجينوم الرجعية ، راجع مقالة في الميكانيكا الشعبية " Retroviruses:" العمود الخامس من الحمض النووي ").أظهرت نتائج الدراسة أنه مع التقدم في العمر ، يوجد انخفاض كبير في مثيلة موانع التجاعيد LINE-1 و Alu ، وكانت هذه العملية أكثر كثافة بشكل ملحوظ عند المدخنين.كما وجد اليوم ، فإن نشاط عنصري LINE-1 و Alu ، القادران على إدراج نسخهما في الجينوم ، يسهمان في جزء كبير من الأمراض الوراثية البشرية والسرطان. أكثر من 100 إدخال (LINE-1) بوساطة (إدراجات) التي تؤدي إلى الأمراض الوراثية البشرية معروفة ، والعديد من LINE-1 يدرج أن يقاطع جينات كبت الورم ويثير السرطان [31].في دراسة ثانية ، أكد العلماء انخفاض في مثيلة لعناصر LINE-1 و Alu في cfDNA مع تقدم العمر. علاوة على ذلك ، من بين 4 مجموعات في الدراسة (كبد طويل صحي أكثر من 100 ، كبد طويل غير صحي يزيد عمره عن 100 عام ، كبار السن (71 عامًا) وشباب (25 عامًا)) ، كبد طويل صحي يتمتع بصحة الشباب وكبار السن ذوي كبد طويل غير صحي له خصائص مماثلة:"باستمرار في دراستنا ، لاحظنا وجود تشابه أكبر في ملفات cfDNA ، على الصعيدين العالمي والمحلي ، بين الشباب والكبد طويل الأجل بصحة جيدة ، على عكس كبار السن الطويلة وغير الصحية. لذلك ، تشير دراستنا إلى أن استخدام ملفات تعريف fcDNA يمكن استخدامه ليس فقط كمؤشر حيوي للعمر ، ولكن أيضًا كمؤشر للصحة العامة. " [32]وهكذا ، تبين أن الدنا المنتشر خارج الخلية يرتبط ارتباطًا وثيقًا بالحالة الصحية والعمليات التي تحدث في الجسم أثناء الشيخوخة: الإجهاد التأكسدي والالتهابات والأمراض المرتبطة بالعمر.تسمح طرق البحث الحديثة ، مثل PCR الكمي في الوقت الفعلي ، باستخدام cfDNA كعلامة حيوية حساسة للغاية للعمليات المتعلقة بالشيخوخة.أظهرت الدراسات القيمة المحتملة الكبيرة لتحليل cfDNA في تشخيص السرطان ، وزرع الأعضاء ، وأمراض القلب والأوعية الدموية والكلى ، والتليف ، والتشخيص قبل الولادة (أثناء الحمل) ، والإصابات وتعفن الدم ، وكذلك الطب الرياضي.إن البيانات التي يمكن أن تظهر بها cfDNA خواص عنصر متنقل وتندمج في الدنا النووي ، مما يؤثر على تطور الأمراض المرتبطة بالطفرات والشيخوخة بشكل عام ، هي أيضًا موضع اهتمام بلا شك.كل هذا يتطلب المزيد من البحث والصقل.تم إعداد المراجعة من قبل: أليكسي Rzheshevsky وقليلا ميخائيل باتنالمراجع- Jahr S, Hentze H, Englisch S, Hardt D, Fackelmayer FO, Hesch RD, Knippers R. DNA fragments in the blood plasma of cancer patients: quantitations and evidence for their origin from apoptotic and necrotic cells. Cancer Res. 2001 Feb 15;61(4):1659-65.
- Deligezer U1, Yaman F, Erten N, Dalay N. Frequent copresence of methylated DNA and fragmented nucleosomal DNA in plasma of lymphoma patients. Clin Chim Acta. 2003 Sep;335(1-2):89-94.
- Bishoff FZ, Dang D., Horne C., Marquez-Do D., Brincley WR, Levis DE Fetal DNA in maternal plasma circulates as apoptotic bodies: elucidations of structural nature of fetal DNA for non-invasive prenatal genetic diagnosis // Am. J. Hum. Genet. 2003. V. 73. P. 189.
- Sivanandham R, Brocca-Cofano E, Krampe N, Falwell E, Venkatraman SMK, Ribeiro RM, Apetrei C, Pandrea. Neutrophil extracellular trap production contributes to pathogenesis in SIV-infected nonhuman primates. J Clin Invest. 2018 Nov 1;128(11):5178-5183.
- Rogers JC, Boldt D., Kornfeld S. Excretion of deoxyribonuclein acid by lymphocytes stimulated with phytohemagglutinin or antigen // Proc. Nat. Acad. Sci. USA. 1972. V. 69, No 7. P. 1685–1689.
- ., .. . 2007. . .149, .23-32.
- Lerner RA, Meinke W., Goldstein DA Membrane-associated DNA in the cytoplasm of diploid human lymphocytes // Proc. Nat. Acad. Sci. USA. 1971. V. 68, No 6. P. 1212–1216.
- .. . . 2013;15(5):399-412.
- Galeazzi M, Morozzi G, Piccini M, Chen J, Bellisai F, Fineschi S, Marcolongo R. Dosage and characterization of circulating DNA: present usage and possible applications in systemic autoimmune disorders. Autoimmun Rev 2003;2:50-5.
- Leon SA, Revach M, Ehrlich GE, Adler R, Petersen V, Shapiro B. DNA in synovial fluid and the circulation of patients with arthritis. Arthritis Rheum 1981;24:1142-50.
- Destouni A, Vrettou C, Antonatos D, Chouliaras G, Traeger-Synodinos J, Patsilinakos S, et al. Cell-free DNA levels in acute myocardial infarction patients during hospitalization. Acta Cardiol 2009;64:51-7.
- Rainer TH, Wong LKS, Lam W, Yuen E, Lam NYL, Metreweli C, Lo YMD. Prognostic Use of Circulating Plasma Nucleic Acid Concentrations in Patients with Acute Stroke. Clin Chem 2003; 49:562-9.
- Lam NY, Rainer TH, Wong LK, Lam W, Lo YM. Plasma DNA as a prognostic marker for stroke patients with negative neuroimaging within the first 24 h of symptom onset. Resuscitation 2006; 68:71-8.
- .., .., .., .., .., .., .., .., .., .., — , , 2008, : 54(1), 78-93.
- Bulicheva, N. et al. Effect of cell-free DNA of patients with cardiomyopathy and rDNA on the frequency of contraction of electrically paced neonatal rat ventricular myocytes in culture. Ann NY Acad Sci. 2008. V. 1137. P. 273-277.
- Lecomte, T. Circulating free tumor DNA and colorectal cancer/ T. Lecomte, N. Ceze, E.
- Dorval, P. Laurent-Puig // Gastroenterol Clin Biol. 2010. V. 34. № 12. P. 662- 681.
- ., .. . . 2013.-N 6.-.673-681
- Gonzalez-Masia, JA et al. Circulating nucleic acids in plasma and serum (CNAPS): applications in oncology. Onco Targets Ther. 2013. V. 8. № 6. P. 819-32.
- Ermakov, AV et al. Oxidized extracellular DNA as a stress signal in human cells. Oxid Med Cell Longev. 2013. V. 2013. P. 649-747.
- Loseva, P. et al. Extracellular DNA oxidation stimulates activation of NRF2 and reduces the
- production of ROS in human mesenchymal stem cells. Expert Opin. Biol. Th. 2012. V.12. № 1. P. 85-97.
- Mittra I, Khare NK, Raghuram GV, et al. Circulating nucleic acids damage DNA of healthy cells by integrating into their genomes. J Biosci. 2015;40(1):91–111.
- Garcia‐Olmo DC, Dominguez C, Garcia‐Arranz M, Anker P, Stroun M, Garcia‐Verdugo JM, Garcia‐Olmo D (2010) Cell‐free nucleic acids circulating in the plasma of colorectal cancer patients induce the oncogenic transformation of susceptible cultured cells. Cancer Res. 70, 560–567
- Chan W, Gurnot C, Montine TJ, Sonnen JA, Guthrie KA, Lee Nelson J (2012) Male Microchimerism in the Human Female Brain. PLoS ONE 7, e45592.
- Crisp A, Boschetti C, Perry M, et al.: Expression of multiple horizontally acquired genes is a hallmark of both vertebrate and invertebrate genomes. Genome Biol. 2015;16:50. 10.1186/s13059-015-0607-3
- Sachiko Nishimoto, Daiju Fukuda et al. Obesity-induced DNA released from adipocytes stimulates chronic adipose tissue inflammation and insulin resistance. Sci Adv. 2016 Mar; 2(3): e1501332.
- Gaziev A, Abdullaev S, Minkabirova G, Kamenskikh K. X-rays and metformin cause increased urinary excretion of cell-free nuclear and mitochondrial DNA in aged rats. J Circ Biomark. 2016 Oct 25; 5:1849454416670782.
- Hummel EM, Hessas E, Müller S, Beiter T, Fisch M, Eibl A, Wolf OT, Giebel B, Platen P, Kumsta R, Moser DA Transl Psychiatry. 2018 Oct 29;8(1):236.
- Jylhävä J1, Kotipelto T, Raitala A, Jylhä M, Hervonen A, Hurme M. Aging is associated with quantitative and qualitative changes in circulating cell-free DNA: the Vitality 90+ study.
- Mech Ageing Dev. 2011 Jan-Feb;132(1-2):20-6.
- Jylhävä J1, Jylhä M, Lehtimäki T, Hervonen A, Hurme M. Circulating cell-free DNA is associated with mortality and inflammatory markers in nonagenarians: the Vitality 90+ Study. Exp Gerontol. 2012 May;47(5):372-8.
- Jylhävä J1, Nevalainen T, Marttila S, Jylhä M, Hervonen A, Hurme M. Characterization of the role of distinct plasma cell-free DNA species in age-associated inflammation and frailty. Aging Cell. 2013 Jun;12(3):388-97.
- Lars Erichsen,a Agnes Beermann et al. Genome-wide hypomethylation of LINE-1 and Alu retroelements in cell-free DNA of blood is an epigenetic biomarker of human aging. Saudi J Biol Sci. 2018 Sep; 25(6): 1220–1226.
- Teo YV, Capri M, Morsiani C, Pizza G, Faria AMC, Franceschi C, Neretti N. Cell-free DNA as a biomarker of aging. Aging Cell. 2019 Feb;18(1):e12890.