مسألة جهاز الرؤية هي جزء ملحوظ من البيولوجيا العصبية. يتم تخصيص مجلدات ضخمة من الأدب وأربعة جوائز نوبل لهذه المسألة ، ولكن في هذه الحالة لا يسع المرء إلا أن يلاحظ أن جهاز رؤية الثدييات الموصوف في الكتب المدرسية لا يتعامل مع المهمة. الغرض من هذا المقال هو إظهار مجموعة من الأسباب التي تجعلك يجب ألا تغض الطرف عن هذا. في الواقع ، سيتم تقديم صورة لسر الرؤية ، تتراوح من مجموعة متنوعة من التفاصيل الصغيرة في بداية تدفق المعلومات المرئية في الثدييات ، والتهديد بتجاهلها ، وتنتهي بمجموعة من المشاكل في فهم معالجة الدماغ في نهاية المسار.
جهاز نظام الرؤية
في نظر أي كتاب مدرسي عن الرؤية ، نرى في ثلاث مراحل. المرحلة الأولى: يدخل الضوء في شبكية العين ويتحول إلى الإثارة العصبية لمستقبلات الضوء - الخلايا العصبية الحسية للشبكية. بالإضافة إلى ذلك ، العين تطبيع النقيض والسطوع ، وتركز الصورة.
المرحلة الثانية: العملية في شبكية العين ، عندما تتحول خريطة الإثارة العصبية لمستقبلات الضوء إلى دفق معلومات موازٍ ، يشفر كل عنصر منها جانبه الخاص من المعلومات المرئية. خلايا العقدة ، التي تشكل محاور عصبها البصري ، في شبكية العين أصغر بكثير من مستقبلات الضوء ، يحدث أول ضغط للمعلومات. قد تكون إحدى خلايا العقدة مسؤولة عن تشفير إشارة من عدة في الوسط إلى مئات وآلاف مستقبِلات الضوء الموجودة على محيط شبكية العين. (الشكل 1) تنقسم خلايا العقدة إلى نوعين رئيسيين ، وهذا يتوقف على المسار من العصب البصري ، حيث تدخل الإشارة إلى قشرة نصفي الكرة المخية. نوع واحد سائد من الناحية الكمية (80 ٪ في الناس) يعطي حدة البصر العالية وتصور اللون ، تباين الصورة مستقرة أمر مهم بالنسبة لهم. لأسباب تاريخية ، يطلق عليها خلايا الكمبيوتر أو الخلايا القزمة ، حيث أن الإشارة الصادرة منها تمر عبر الطبقات الخلوية (الخلية الصغيرة) للأجسام الكرنكية الجانبية. النوع الثاني من خلايا MC ، تمر إشاراتها عبر الطبقات الخلوية (الكبيرة) من الأجسام الكرنكية الجانبية. إنهم مسؤولون عن تصور الحركة ، لأن لديهم حساسية متزايدة تجاه الصور التي تومض أو تتحرك.


 الشكل 1. قياس خصائص الحقول تقبلا. (A) يتم التحكم في استجابة الخلايا العصبية (سلسلة من إمكانات العمل أو "التصاقات") عن طريق تسجيل خارج الخلية لحيوان مخدر بواسطة القطب في جسم العمود المرفقي الوسيط (LGN). يتم تسليم المحفزات إلى جزء من المجال البصري المقابلة للخلايا العصبية. (ب) جدول الاستجابات الشرطية لأنواع مختلفة من الخلايا العصبية. يوضح كل عمود استجابة نوع واحد من الخلايا العصبية. يعرض كل صف ردودًا على نوع واحد من التحفيز. على سبيل المثال ، لا تتفاعل الخلايا العصبية التي تكون انتقائية في اتجاه الحركة (العمود الثاني) إلا عندما يتحرك الحافز عبر الحقل الاستقبالي من اليسار إلى اليمين. الخلايا العصبية التي تحتوي على حقول مستقبلات قياسية "مركز / بيئة" متسامحة مع حجم وحركة التحفيز. تظهر الأنواع غير القياسية من الخلايا العصبية متطلبات تحفيز لا هوادة فيها.
الشكل 1. قياس خصائص الحقول تقبلا. (A) يتم التحكم في استجابة الخلايا العصبية (سلسلة من إمكانات العمل أو "التصاقات") عن طريق تسجيل خارج الخلية لحيوان مخدر بواسطة القطب في جسم العمود المرفقي الوسيط (LGN). يتم تسليم المحفزات إلى جزء من المجال البصري المقابلة للخلايا العصبية. (ب) جدول الاستجابات الشرطية لأنواع مختلفة من الخلايا العصبية. يوضح كل عمود استجابة نوع واحد من الخلايا العصبية. يعرض كل صف ردودًا على نوع واحد من التحفيز. على سبيل المثال ، لا تتفاعل الخلايا العصبية التي تكون انتقائية في اتجاه الحركة (العمود الثاني) إلا عندما يتحرك الحافز عبر الحقل الاستقبالي من اليسار إلى اليمين. الخلايا العصبية التي تحتوي على حقول مستقبلات قياسية "مركز / بيئة" متسامحة مع حجم وحركة التحفيز. تظهر الأنواع غير القياسية من الخلايا العصبية متطلبات تحفيز لا هوادة فيها.يحتوي كلا النوعين من هذه الخلايا على نوع مركز / بيئة منظمة: استراتيجية ترميز عالمية من المفترض للمعلومات المرئية. (الشكل 2) إن أفضل حافز لتحقيق الاستجابة الأكثر نشاطًا من خلايا العقدة هو وجود بقعة صغيرة وصغيرة إلى حد ما في شبكية العين ، وكلما تبرز بشكل مكثف ضد الخلفية المحيطة (نقطة مضيئة أو مظلمة) ، كلما كانت استجابة الخلية أكثر نشاطًا.
المرحلة الثالثة: تتم معالجة الإشارة في الدماغ. من وجهة نظر مقبولة بشكل عام ، تبدأ العمليات الرئيسية لمعالجة الدماغ في القشرة البصرية الأولية. تحدث عملية إعادة ترميز مهمة أخرى ، حيث لا تستجيب الخلايا العصبية للبقع الداكنة والخفيفة على سطح شبكية العين فحسب ، بل تصبح أيضًا حساسة بشكل انتقائي لحدود التباين الموجه والمقاطع الموجهة للخطوط وأطرافها. هناك تكوينات أكثر تعقيدًا للمنبهات ، عندما تستجيب الخلايا العصبية بدقة لحد التباين بصرف النظر عن الموقع ، إذا كانت فقط في منطقة مسؤولية الخلية. يتم استخدام هذه المعالجة "المعقدة" في القشرة البصرية كمستوى ثانٍ من التجريد في إدراك صورة ثابتة ، حيث وصل التعرف إلى مستوى جديد أكثر عمومية لتصور الحدود بغض النظر عن موضعها. ونتيجة لذلك: أولاً ، تنقل شبكية العين إشارات بسيطة إلى القشرة الدماغية. ثانياً ، تستخدم الخلايا العصبية للقشرة البصرية الأولية هذه الإشارات البسيطة للكشف عن الحدود والخطوط المتناقضة ؛ وثالثا ، يتم استخدام كتل البناء الأساسية هذه لتحديد حدود الكائنات بأكملها وإنشاء تصور مرئي.
ربما لم يفترض أحد أن وجهة النظر هذه ستتحول إلى عقيدة أساسية من الجرانيت. أصبح اكتشاف الحافة كما لو كان هو السبيل الوحيد للثدييات لمعرفة كيف وجد التطور الحل الأمثل لمشكلة الإدراك الفعال للصورة. في هذا المقال ، سيتم طرح وجهة النظر هذه موضع تساؤل وسيتم طرح أسئلة غير مريحة حول طبيعة الرؤية. لقد أثيرت بالفعل أكثر من مرة واحدة في تاريخ دراسة الرؤية ولا تقترح إجابات بسيطة. المهمة الآن هي التركيز على هذه القضايا ، وجمع أسباب الشك في الفهم الحديث لجهاز الرؤية.
ترسل شبكية جميع الثدييات إشارات غير قياسية إلى المخ
تؤكد الدراسة الشاملة لمسار التدفق البصري من العينين إلى القشرة الدماغية في الرئيسات بشكل قطعي ، كما هو الحال في الأنواع الأخرى من الثدييات ، أن العديد من القنوات الموازية تقدم مساهمة وظيفية في التدفق البصري للقرود [1-4]. (الشكل 2) تتجاهل بعض هذه القنوات القشرة البصرية الأولية وتذهب على الفور إلى أقسام التسلسل الهرمي الأعلى [5]. ذُكر الكثير من هذا في الدراسات الكلاسيكية لتشريح القطط والقرود [6-10] ، لكن تم تجاهلها من قبل رواد علم الأعصاب في دراسة القشرة البصرية. جعل الاستخدام العدواني لمبدأ Occam للحلاقة من الممكن إعطاء معنى لخصائص الخلايا العصبية القشرية ، لأنها تبني وظيفتها المتمثلة في التعرف على الخطوط أو الحدود فقط على أساس المدخلات من خلايا العقدة مع المنظمة "مركز / بيئة" المنظمة [11]. تم التخلص من خلايا العقدة ذات التنظيم غير القياسي ، حيث يوجد عدد قليل نسبيًا من الرئيسات في شبكية العين. ما سيتم وصف دورهم في الإدراك البصري أدناه ، ومن وجهة نظر ممارسي البيولوجيا العصبية ، تجدر الإشارة إلى أنه من خلال الإدخال التعسفي للإلكترود في العصب البصري ، فإن احتمال مواجهة محور عصبي لخلية العقدة غير القياسية صغير جدًا. نظرًا لأن الخلايا غير القياسية نادرة ، فقد اختار معظم المجربين اتباع مسار أقل مقاومة ، وخلق طرق لإظهار المنبهات البصرية على شبكية العين الأكثر ملاءمة لدراسة خلايا المركز / البيئة ، والتي حولت الخلايا غير القياسية إلى "انفجار" إحصائي في البيانات التجريبية.
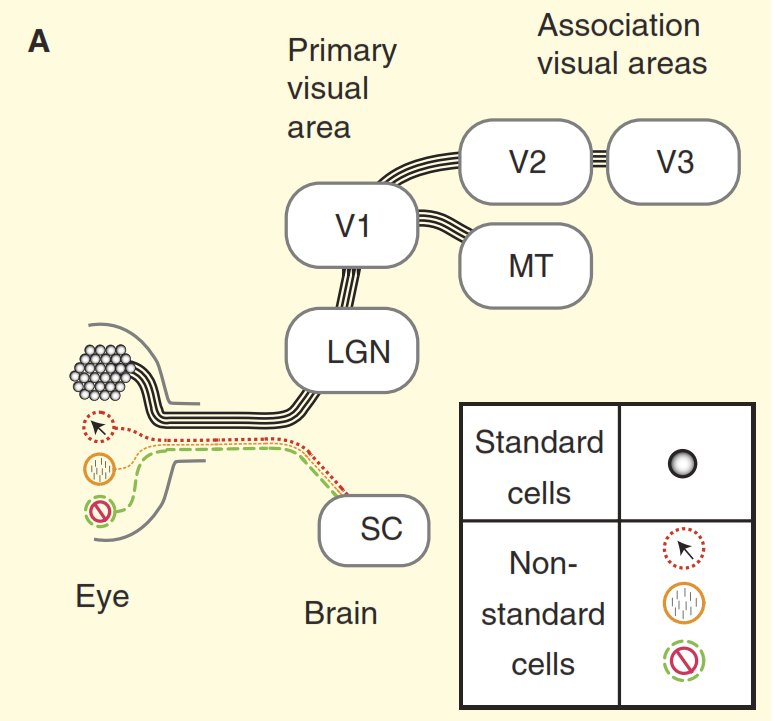
 الشكل 2. تصورات النظام البصري.
الشكل 2. تصورات النظام البصري.
(أ) وجهة نظر من الكتب المدرسية على تصميم النظام البصري للقرود بمثال المكاك. تمتلئ شبكية العين بعدد كبير من خلايا العقدة القياسية التي تشكل محاورها العصب البصري. تحتوي شبكية العين أيضًا على عدد صغير من خلايا العقدة غير القياسية التي تستجيب للضوء بطرق أخرى ، لكن يُفترض تقليديًا أنها تُسقط فقط في المراكز المستقلة من الدماغ المتوسط ، وهي dicollis المتفوقة (SC). تبرز الخلايا المركزة في نواة التتابع في المهاد ، وهو الجسم الكرنك الوسيط (LGN) ، والذي بدوره ينقل الإشارات إلى القشرة البصرية الأولية (V1). وتنقل الخلايا المعيارية عبر الجسم الكرنك الوسيط (LGN) إشارة إلى القشرة البصرية الأولية (V1) ثم إلى الأقسام العليا من القشرة البصرية (V2 ، V3 ، MT).
(ب) رؤية أكثر واقعية للنظام البصري الرئيسيات. تسمم بعض خلايا العقدة غير القياسية الإشارة مباشرة إلى الجسم الكرنك المتوسط (LGN) ، ثم إلى القشرة البصرية الأولية. بالإضافة إلى ذلك ، فإن الصمام الثنائي العلوي ليس اتجاهًا مسدودًا ، ومن هناك تذهب الإشارة إلى الجسم الكرنك الوسيط (LGN) وما بعده. ولكن هذا ليس كل شيء ، بدءًا من الجسم الكرنك المتوسط (LGN) ، لم يعد التدفق المرئي أحادي الاتجاه ، ومكونه العكسي أقوى من المكون المباشر.يوضح الشكل 3 المشكلة الثانية. يوضح الرسم البياني العلوي للشكل استجابة خلية "الوسط / البيئة". نظام التفاعل الأساسي مألوف جدًا لدى أخصائيي البيولوجيا العصبية: تُظهر خلايا العقدة المركزية / البيئة القياسية منحنى خط الاستجابة للتردد المكاني - يحدث الحد الأقصى للاستجابة عندما تتزامن فرقة الشبكة في العرض تمامًا مع القسم الأوسط من الحقل المتلقي للخلية المركزية / الخلية البيئة. " ولكن الآن النظر في استجابة واحدة من الخلايا غير القياسية في العصب البصري التي تم الحصول عليها في نفس التجربة (الشكل 3 ب). هذه المرة ، تنتمي الخلية إلى ما يسمى بالخلايا المخروطية للخلايا العقدية ، وهي مجموعة مركبة من أنواع الخلايا غير القياسية ، والتي يتم تعميمها عادة ، على كل حال ، على أنها "المسار الأزرق". تحتوي هذه الخلية على تنظيم من نوع "قمع على النقيض" [6،7،12،13] ، في هذه التجربة ردها هو عكس تماما تماما لاستجابة "خلية / مركز" الخلية القياسية. عند الأخذ في الاعتبار الاختلاف في حدة البصر لدى القرود والقطط ، فإن خلايا العقدة من "القمع على النقيض" تتصرف بشكل مماثل [١٢.١٣].
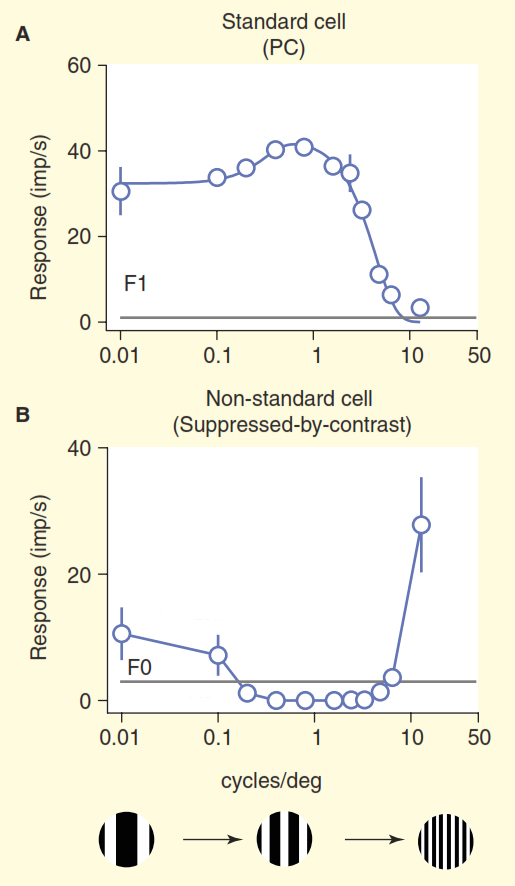 الشكل 3. مقارنة بين الحقول تقبلا القياسية وغير القياسية. تم تحفيز الخلايا عن طريق الانجراف مقضب مع تردد مكاني متغير (يتم التعبير عن التردد هنا كما عرض مجموع شريطين من الأسود والأبيض في مقضب في درجة زاوية المشاهدة). تتصرف خلية العقدة "الوسط / البيئة" القياسية (أ) كما هو متوقع: عندما يكون عرض شريط الشبكة قريبًا من عرض مركز الحقل المتلقي ، تعطي الخلية استجابة قوية. الخلية غير المعيارية ذات "منع التباين" (B) صامتة بدلاً من إثارة ، طالما أنها قادرة على التمييز بين خطوط سوداء وبيضاء.
الشكل 3. مقارنة بين الحقول تقبلا القياسية وغير القياسية. تم تحفيز الخلايا عن طريق الانجراف مقضب مع تردد مكاني متغير (يتم التعبير عن التردد هنا كما عرض مجموع شريطين من الأسود والأبيض في مقضب في درجة زاوية المشاهدة). تتصرف خلية العقدة "الوسط / البيئة" القياسية (أ) كما هو متوقع: عندما يكون عرض شريط الشبكة قريبًا من عرض مركز الحقل المتلقي ، تعطي الخلية استجابة قوية. الخلية غير المعيارية ذات "منع التباين" (B) صامتة بدلاً من إثارة ، طالما أنها قادرة على التمييز بين خطوط سوداء وبيضاء.لا يمكننا إلا أن نفترض أن هذه الخلايا تتعرف على ملء رتابة في منطقة مسؤوليتها ، على سبيل المثال ، سماء زرقاء صافية ، لأنه عندما يتناقص عرض القضبان البيضاء والسوداء للشبكة تحت درجة دقة العين البشرية ، فإنها تندمج لتصبح رمادية صلبة. لا يتم تقديم فهم حقيقي لترميز المعلومات المرئية لهذه الخلايا في نموذج الرؤية القياسية.
جميع غير الرئيسيات ترى جيدا باستخدام الخلايا غير القياسية
يمكن أن يشير دعاة نموذج الرؤية المقبول عند النظر في الرئيسيات إلى عدد صغير نسبيًا من الخلايا غير القياسية ، لكن هذا لا ينطبق على شبكية العين من الأرانب والقطط والفئران والفئران [7،8،14-16]. بالإضافة إلى ذلك ، في الأعداد المطلقة (حوالي 100000) ، فإن عدد الخلايا غير القياسية في شبكية الرئيسيات يقترب من العدد الكلي للخلايا في شبكية العين من الفئران أو القطط [17]. حدة البصر في القطط والأرانب والفئران والفئران أقل مما كانت عليه في الرئيسات ، ولكن هذا ليس كل شيء. تسمح لك رؤية كل هذه المخلوقات بالتعامل بنجاح مع الحياة في البرية. تتم دعوة أي شخص يشك في ذلك لمحاولة التسلل على الأرنب في الحقل أو التقاط الماوس دون استخدام مصيدة فئران (مهمة بسيطة لقطة عادية).
 الشكل 4. الإدراك البصري مع انخفاض التفاصيل.
الشكل 4. الإدراك البصري مع انخفاض التفاصيل.
يتعرف المراقبون على دراية بالأشخاص الموجودين في الصورة على الرغم من قلة التفاصيل. عند طمس صورة ، تظل المعلومات المرئية المفيدة كافية للشخص. من اليسار إلى اليمين: الأمير تشارلز ، وودي آلن ، وبيل كلينتون ، وصدام حسين ، وريتشارد نيكسون ، والأميرة ديانا.من الواضح ، لأسباب طبية فقط ، سبب تركيز علماء الأعصاب على شبكية العين عند الرئيسيات. لكن هذا التركيز الانتقائي عند محاولة فهم الرؤية يؤدي إلى حقيقة أن المجربين يجلبون وينقلون نتائج الإدراك الذاتي إلى تفسير نتائج البحث. إن التعبئة الكثيفة لخلايا العقدة الرئيسيات مناسبة تمامًا للكشف عن الفاكهة الصالحة للأكل على شجرة ، أو لقراءة العدد الأخير من صحيفة نيويورك تايمز ، ولكن لا يوجد سبب محدد للنظر في مهام مثل رؤية summum bonum (lat.: good good). في الصورة التطورية العامة ، يمكن اعتبار هذه حدة البصر المرتفعة للغاية بمثابة تكيف محدد للكشف عن الأجسام عالية التباين على مسافة كبيرة. معظم الثدييات في شبكية العين ليس لديها نقرة (الحفرة المركزية في شبكية العين) - وهي منطقة متخصصة ذات حدة بصرية عالية موجودة في الرئيسيات - ولكن الرؤية بدون مليون خلية من العقدة شديدة الكثافة تظل وظيفية بالكامل. يوضح الشكل 4 الدليل ، فالناس قادرون بسهولة على التعرف دون حدة البصر المعتادة [18]. في الثدييات غير الرئيسة ، تمت دراسة تشفير المحفزات البصرية بشكل خاص على الأرانب [19-23]. الأرانب لها عيون كبيرة ، والنظام البصري أفضل من أنواع كثيرة من الرئيسات ، ولديها أيضًا خلايا عقيدية مركزية / مركزية في شبكية العين. ومع ذلك ، فإن هذه الخلايا المعيارية تشكل فقط ربع سكان خلايا العقدة الشبكية بأكملها ، ويمثلها حوالي 12 نوعًا وظيفيًا وتشريحيًا [14 ، 21]. من الواضح أن كل واحد من هذه الأنواع الاثني عشر من الخلايا يسجن بالتطور تحت محفزاته البصرية. ولكن أهمية هذه الحقيقة تكمن في حقيقة أن قنوات من خلايا العقدة غير القياسية تسود في التدفق البصري الذي يتدفق إلى دماغ الأرنب. هذه المعلومات ليست جديدة: الابتكار هو دليل على أن شبكية العين لجميع الثدييات تنقل مجموعة متنوعة من قنوات الترميز المرئية إلى الدماغ [4 ، 13 ، 24 ، 25] وأنه ينبغي إدراج هذا التنوع في أي عرض واقعي للجهاز البصري.
ومن الأمثلة المعروفة هي الخلايا التي تستجيب بشكل انتقائي لاتجاه حركة التحفيز. نوع واحد منهم يرسل إشارة مباشرة إلى نواة جذع الدماغ المرتبطة بحركة العين [26]. لكن هناك نوعًا آخر من هذه الخلايا غير معروف جيدًا ، حيث لا تنتقل الإشارة منه إلى الدماغ المتوسط فحسب ، بل وأيضًا من خلال الأجسام الكرنكية الجانبية إلى القشرة البصرية الأولية [19]. هذه الخلايا ليست نادرة جدًا ، ولكن لا يوجد ذكر لها في الكتب المدرسية عند وصف جهاز الرؤية. تصل إشارة خلايا العقدة غير القياسية بشكل لا لبس فيه إلى القشرة البصرية ، لكن كيف تستخدمها؟
النوع الثاني من الخلايا غير القياسية (المحددة في الأرانب والقطط والفئران) هو ما يسمى بالكشف عن الحافة المحلية. مثل الخلايا التي تستجيب بشكل انتقائي لاتجاه الحركة ، تم اعتبارها أيضًا خلايا نادرة من العقدة ، لكننا نعلم الآن أن هذا يرجع إلى حدوث خطأ عند استخدام الأقطاب الكهربائية: فهي على الأرجح تشكل حوالي 15٪ من جميع خلايا العقدة [23]. تصل إشارات هذه الخلايا أيضًا إلى القشرة المرئية الأساسية ، لكن استجاباتها تتجاوز بكثير الاستجابات المرئية القياسية [8،22،23]. تستجيب هذه الخلايا بشكل أفضل لأهداف صغيرة بطيئة الحركة ، مثل حيوان مفترس أو حيوان مفترس ، يتحرك على مسافة بعيدة. ومع ذلك ، إذا كان هناك العديد من الكائنات الصغيرة ، كما هو الحال في حقل محكم ، فإن الخلايا تتوقف عن الاستجابة. بمعنى آخر ، تتفاعل الخلايا مع جسم متحرك صغير ، ولكن فقط عندما يكون وحده.
يبدو أن كاشف الحافة المحلي هو أكثر أنواع خلايا العقدة الشبكية في الأرانب ، ولكنه لم يكن مدرجًا في نموذج الرؤية القياسي. يمكن لهذه الخلايا تشكيل نظام تحليل الحركة على مسافات بعيدة؟ كيف إشارات عملية القشرة البصرية من هذه الخلايا؟ كيف ترى أنواع الثدييات الأخرى العالم بخلايا العقدة القياسية وكاشفات الحافة المحلية - أو حتى الخلايا التي بها ضغط آخر للمعلومات البصرية التي لا يزال يتعين اكتشافها؟
القشرة البصرية أكثر ذكاءً مما تتعرف عليه الكتب المدرسية
حتى لو افترضنا أن التدفق البصري بأكمله يتم تشفيره فقط بواسطة خلايا الشبكية القياسية ، فمن المعروف حاليًا أن المعالجة في القشرة المرئية الأولية لا تحدث بشكل حصري وفقًا للطريقة المقترحة أصلاً باستخدام الخلايا العصبية "البسيطة" ، "المعقدة" ، "شديدة التعقيد" ، ولكن أيضا الخلايا العصبية "مع تثبيط المحطة الطرفية". أعطيت مناقشة هذه الحقيقة مساحة كبيرة في الأدب المتخصص [27-30].
تبدأ المشاكل بحقيقة واضحة أخرى وهي أن جميع الخلايا العصبية تقريبًا في القشرة الدماغية غير خطية ، مما يلقي ظلالًا من الشك على فائدة المخططات الهرمية مع افتراضات خطية في تفسير وظيفتها [31،32].
ثانياً ، إن فكرة الأنواع الرئيسية الثلاثة للخلايا - "البسيطة" و "المعقدة" و "شديدة التعقيد" - هي عبارة عن تجريد خام لمجموعة متنوعة غنية من أنواع الخلايا من القشرة البصرية الأولية المحددة بالطرق التشريحية [33،34]. ثالثًا ، لا تعتمد الخلايا العصبية في القشرة المرئية على التدفق المرئي الوارد فحسب ، بل تعتمد أيضًا على الإشارات السياقية المختلفة لجيرانها ، بحيث يمكن أن يختلف رد الفعل على نفس المنبهات التي تشكل جزءًا من الصورة اليومية والتي تم إنشاؤها من قِبل المُجربين بشكل مصطنع [27 ، 35].
لا يتم حتى إصلاح استجابات الخلايا العصبية القشرة البصرية في الوقت المناسب: إزالة جزء صغير من شبكية العين ، مما يؤدي إلى ظهور بقعة عمياء ، يسمح للخلايا العصبية التي تركت دون عمل لتغيير منطقة مسؤوليتها ومعالجة المعلومات البصرية من أقسام العمل في شبكية العين الأقرب إلى النقطة العمياء [36].من وجهة نظر علم التشريح ، لا شيء مما سبق يثير الدهشة. فقط ما يصل إلى 10 ٪ من مدخلات الخلايا العصبية الفردية تأتي من قنوات التدفق البصري [37] ، والباقي يأتي من الخلايا العصبية المجاورة أو من الخلايا العصبية الموجودة في الأجزاء العليا البعيدة من القشرة الدماغية ، حيث لا تزال الخلايا العصبية البصرية غير مفهومة بشكل جيد وتفسير وظائفها مهمة صعبة.وبالتالي ، يصبح من الواضح أن الرؤية القياسية لجهاز الرؤية عالقة في مستنقع العقائد. ما هي الخطوات التي يجب اتخاذها للخروج منه؟الخطوة 1: مراجعة الأساسيات
آخر الأخبار السارة هي أن تقنيات تصوير خلايا الشبكية مرت بثورة غير واضحة على مدار السنوات الخمس الماضية ، لذلك أصبح من السهل الآن تصورها بأعداد كبيرة وبجودة غير مسبوقة من الدقة في صورة صورة ثلاثية الأبعاد. يتم بسهولة حل مشكلة العثور على نقاط الاشتباك العصبي والموضع النسبي للخلايا ؛ والآن يمكن تصنيفها ليس فقط "بالعين" ، ولكن أيضًا باستخدام طرق التصنيف الموضوعية [15،16]. تُظهر درجة مراسلات الكتابة المورفولوجية مع الكتابة الفسيولوجية للخلايا الشبكية علاقة مباشرة (تمت مناقشتها في [24]). وهكذا ، فإن الأنواع الهيكلية للخلايا العقدة الشبكية تحدد بدقة عدد القنوات الوظيفية في التدفق البصري.في جميع النظم البصرية للثدييات التي تمت دراستها حتى الآن ، تشير البيانات التشريحية إلى أن عدد القنوات الوظيفية يبلغ حوالي اثني عشر. في القرد وشبكية القط ، يتم فهم وظائف حوالي نصف هذه القنوات جيدًا. في الأرنب ، تبلغ هذه النسبة حوالي الثلث ؛ تبقى شبكية الفأر والفأر ، على الرغم من ميزتها الواضحة للبحث الوراثي ، غير مستكشفة إلى حد كبير.وبالتالي ، قد يكون من المفيد العودة ، المسلح بالأساليب الحديثة ، إلى الأعمال التي لم تنته في السبعينيات [38]. تتمثل المهمة في إكمال تحديد وظائف خلايا العقدة ، المرحلة الأولى من ضغط المعلومات المرئية - التخلص من النقاط العمياء في البداية - وتحديث أهدافك في بقية النظام المرئي.خطوة إصلاح الحوافز
لماذا ، بعد أكثر من نصف قرن من البحث ، تكون معرفة فسيولوجيا الرؤية متأخرة حتى الآن عن علم التشريح ، وما الذي يمكن فعله لتحسين الوضع؟ إذا وضعنا جانباً مشكلة انتقائية البحث باستخدام قطب كهربائي ، تظل المشكلة الرئيسية هي اختيار طرق لإيجاد الحافز الصحيح.إن فهم سبب استخدام خلايا العقدة في شبكية العين والخلايا العصبية في القشرة البصرية الأولية في نظام الرؤية - ما هو التكيف مع خصائص البيئة المرئية - هو أصعب بكثير مما اقترحه رواد علم الأعصاب. كانت تقنية البحث الكلاسيكية هي أن المجربين استمعوا إلى إشارة تضخيم من القطب مغمورة عشوائيًا في العصب البصري أو في القشرة الدماغية أثناء تحريك المحفز المسقط يدويًا على شبكية العين بحثًا عن منطقة مسؤولية الخلية التي لمسها القطب. طريقة سريعة وفعالة ، ولكن تعاني من الذاتية وعدم استنساخها. المنبهات الشبكية البسيطة والتحليل الجهازي الخطي فعالان للغاية للخلايا القياسية [38،39] ، ولكن ، كما ذكرنا سابقًا ،هذه الطريقة غير مناسبة لدراسة الخلايا غير القياسية والخلايا العصبية غير الخطية للقشرة البصرية الأولية. تعد المحاولات الجديدة لتحديد مجموعات المحفزات الصحيحة مثيرة للاهتمام [40] ، ولكن لا يوجد إجماع حتى الآن.يعتمد البديل على استراتيجية الارتباط العكسي [41-43] ، حيث يتم تقديم حافز تم اختياره عشوائيًا بواسطة المجرب عدة مرات ، ويتم استخدام استجابة الخلية لحساب المتوسط العكسي. وبالتالي ، يمكن للمجرب بناء تمثيل للحافز المتوسط مما يؤدي إلى استجابة الخلية الأكثر نشاطا. الميزة الكبيرة لهذه الطريقة هي أنها لا تعني أي توليف محدد للخلية لتحفيز الاختبار. لكل من الأسباب النظرية والتحليلية ، عادةً ما يتم اختيار حافز الاختبار على أنه "عشوائي": لوح شطرنج خفقان أو شكل آخر من أشكال الضوضاء البصرية. هذه الإستراتيجية أنيقة من الناحية المفاهيمية ، ولكن تقتصر إلى حد كبير على تحليل الخلايا مع منظمة مركز / البيئة القياسية ،منذ يتم ضبط الخلايا غير القياسية (بحكم التعريف) إلى ميزات غير عشوائية للغاية من المعلومات المرئية.بديل آخر يستخدم نهج أكثر راديكالية. تتمثل الإستراتيجية في البحث عن الارتباط العكسي لاستجابة الخلية للصورة الملتقطة على الفيديو في بيئة يومية وعرضها على شاشة الشاشة [27،44]. الفكرة هي أن الباحث يتوقع إشارة من الخلية عندما يظهر حافز مهم لها. لقد تم إثبات كفاءة مثل هذه الطريقة بشكل تجريبي ، لكن يبقى السؤال هو كيف يجب أخذ صورة ثنائية الأبعاد طبيعية في الاعتبار ، وكيف ستأخذ هذه الطريقة في الاعتبار آثار اللاخطية والسياق ، وحتى كيفية تفسير النتائج.النظرية العامة الجديدة للرؤية؟
يمكن اعتبار المقارنة العكسية للعالم المحيط بالإشارات الموجودة في الدماغ تجريبية ، يتم أخذها إلى أقصى الحدود. لكن ما الذي يمكن لمنظري علم الأعصاب أن يقدموه على عكس زملائهم المجربين؟ لديهم الفرصة لتجاوز الأسلوب الشعبي الحالي بنجاح ، من وجهة نظر رسمية ، والتي ليست سوى إعادة صياغة للنتائج التجريبية. على الرغم من ربع قرن من الجهد ، فإن معظم العمل المنجز لا يمكنه اجتياز اختبار الزمن ولا يمكن تأكيده في حقائق تجريبية جديدة. على الرغم من أن الصيغ الدقيقة والمدمجة للنتائج التجريبية مهمة ، فإنها نادراً ما تؤدي إلى تخليق معرفة جديدة ، والرغبة في ملاءمة التقييم الرياضي للبيانات يمكن أن تفرض قيودًا غير مرئية على التجارب. تم تقديم مثال محدد مسبقًا:إذا كانت الطريقة التجريبية مقصورة على تقديم حواجز شبكية متغيرة العرض في شكل محفز ، فإن خلية العقدة مع تنظيم نوع "القمع على النقيض" تظهر فقط باعتبارها "فورة" في البيانات التجريبية ، والتي لا يمكن للباحث أن يقول أي شيء آخر عنها.كيف يمكن إذن أن يساعد علماء النظريات؟ يجب أن يتعاملوا مع الجوانب غير المريحة للحساب من الجهاز العصبي الحقيقي. على سبيل المثال ، يعرف علماء الفيزيولوجيا التجريبية جيدًا أن الأجهزة الحسية خطية فقط عندما يجبرهم المجرب على أن يكون كذلك [27،38،45]. التغطية الواسعة لنظرية الرؤية ضرورية للتعامل مع مهام مثل فهم مزايا الترميز الزائد والمتفرق في النظم البصرية ، والحاجة إلى مد الجسور بين دراسات الرؤية في اللافقاريات والفقاريات [46،47]. والسؤال هو ما إذا كانت إعادة التفكير في المرحلة الأولى في ضغط المعلومات المرئية في شبكية العين ستؤدي إلى نتيجة [46،48-50]. تم التأكيد سابقًا على مجموعة متنوعة من القنوات الوظيفية للتدفق المرئي ، والتي تخدمنا بكل تنوعها في شكل مثل هذا الشعور المألوف - الرؤية.نتيجةً لذلك ، ستظل المهمة الرئيسية هي معرفة كيف يمكننا ببساطة "رؤية" وكيف يمكن أن نفهم هذا بشكل عام؟المراجع1. Casagrande VA (1994). A third parallel visual pathway to primate area V1. Trends Neurosci. 17, 305–310.
2. Hendry SHC, and Reid RC (2000). The koniocellular pathway in primate vision. Ann. Rev. Neurosci. 23, 127–153.
3. White AJR, Solomon SG, and Martin PR (2001). Spatial properties of koniocellular cells in the lateral geniculate nucleus of the marmoset Callithrix jacchus. J. Physiol. 533, 519–535.
4. Dacey DM, Peterson BB, Robinson FR, and Gamlin PD (2003). Fireworks in the primate retina: in vitro photodynamics reveals diverse LGN-projecting ganglion cell types. Neuron 37, 15–27.
5. Sincich LC, Park KF, Wohlgemuth MJ, and Horton JC (2004). Bypassing V1: a direct geniculate input to area MT. Nat. Neurosci. 7, 1123–1128.
6. Rodieck RW (1967). Receptive fields in the cat retina: a new type. Science 157, 90–92.
7. Stone J. and Hoffmann K.-P. (1972). Very slow-conducting ganglion cells in the cat's retina: a major, new functional type? Brain Res. 43, 610–616.
8. Cleland BG, Levick WR, Morstyn R., and Wagner HG (1976). Lateral geniculate relay of slowly-conducting retinal afferents to cat visual cortex. J. Physiol. 255, 299–320.
9. DeMonasterio FM (1978). Properties of ganglion cells with atypical receptive-field organization in retina of macaques. J. Neurophysiol. 41, 1435–1449.
10. Yukie M., and Iwai E. (1981). Direct projection from the dorsal lateral geniculate nucleus to the prestriate cortex in macaque monkeys. J. Comp. Neurol. 201, 81–97.
11. Hubel DH, and Wiesel TN (1977). Ferrier lecture. Functional architecture of macaque monkey visual cortex. Proc. R. Soc. Lond. Ser. B Biol. Sci. 198, 1–59.
12. Troy JB, Einstein G., Schuurmans RP, Robson JG, and Enroth-Cugell CH (1989). Responses to sinusoidal gratings of two types of very nonlinear retinal ganglion cells of cat. Visual Neurosci. 3, 213–223.
13. Tailby C., Solomon SG, Dhruv NT, Majaj NJ, Sokol SH, and Lennie P. (2007). A new code for contrast in the primate visual pathway. J. Neurosci. 27, 3904–3909.
14. Rockhill RL, Daly FJ, MacNeil MA, Brown SP, and Masland RH (2002). The Diversity of ganglion cells in a mammalian retina. J. Neurosci. 22, 3831–3843.
15. Badea TC, and Nathans J. (2004). Quantitative analysis of neuronal morphologies in the mouse retina visualized by using a genetically directed reporter. J. Comp. Neurol. 480, 331–351.
16. Kong JH, Fish DR, Rockhill RL, and Masland RH (2005). Diversity of ganglion cells in the mouse retina: Unsupervised morphological classification and its limits. J. Comp. Neurol. 489, 293–310.
17. Wassle H. (2004). Parallel processing in the mammalian retina. Nat. Rev. Neurosci. 5, 747–757.
18. Sinha P. (2002). Recognizing complex patterns. Nat. Neurosci. 5 Suppl, 1093–1097.
19. Levick WR, Oyster CW, and Takahashi E. (1969). Rabbit lateral geniculate nucleus: sharpener of directional information. Science 165, 712–714.
20. DeVries SH, and Baylor DA (1997). Mosaic arrangement of ganglion cell receptive fields in rabbit retina. J. Neurophysiol. 78, 2048–2060.
21. Roska B., and Werblin F. (2001). Vertical interactions across ten parallel, stacked representations in the mammalian retina. Nature 410, 583–587.
22. Zeck GM, Xiao Q., and Masland RH (2005). The spatial filtering properties of local edge detectors and brisk-sustained retinal ganglion cells. Eur. J. Neurosci. 22, 2016–2026.
23. van Wyk M., Taylor WR, and Vaney DI (2006). Local edge detectors: a substrate for fine spatial vision at low temporal frequencies in rabbit retina. J. Neurosci. 26, 13250–13263.
24. Masland RH (2001). Neuronal diversity in the retina. Curr. Opin. Neurobiol. 11, 431–436.
25. Dacey DM, Liao HW, Peterson BB, Robinson FR, Smith VC, Pokorny J., Yau KW, and Gamlin PD (2005). Melanopsinexpressing ganglion cells in primate retina signal colour and irradiance and project to the LGN. Nature 433, 749–754.
26. Simpson JI (1984). The accessory optic system. Ann. Rev. Neurosci. 7, 13–41.
27. Carandini M., Demb JB, Mante V., Tolhurst DJ, Dan Y., Olshausen BA, Gallant JL, and Rust NC (2005). Do we know what the early visual system does? J. Neurosci. 25, 10577–10597.
28. Olshausen BA, and Field DJ (2004). Sparse coding of sensory inputs. Curr. Opin Neurobiol. 14, 481–487.
29. Simoncelli EP, and Olshausen BA (2001). Natural image statistics and neural representation. Ann. Rev. Neurosci. 24, 1193–1216.
30. Olshausen BA, and Field DJ (2005). How close are we to understanding v1? Neural. Comput. 17, 1665–1699.
31. Ferster D., and Miller KD (2000). Neural mechanisms of orientation selectivity in the visual cortex. Ann. Rev. Neurosci. 23, 441–471.
32. Anderson JS, Lampl I., Gillespie DC, and Ferster D. (2001). Membrane potential and conductance changes underlying length tuning of cells in cat primary visual cortex. J. Neurosci. 21, 2104–2112.
33. Lund JS, and Yoshioka T. (1991). Local circuit neurons of macaque monkey striate cortex: III. Neurons of laminae 4B, 4A, and 3B. J. Comp. Neurol. 311, 234–258.
34. Cauli B., Audinat E., Lambolez B., Angulo MC, Ropert N., Tsuzuki K., Hestrin S., and Rossier J. (1997). Molecular and physiological diversity of cortical nonpyramidal cells. J. Neurosci. 17, 3894–3906.
35. Zipser K., Lamme VA, and Schiller PH (1996). Contextual modulation in primary visual cortex. J. Neurosci. 16, 7376-7389.
36. Gilbert CD, Sigman M., and Crist RE (2001). The neural basis of perceptual learning. Neuron 31, 681–697.
37. Douglas RJ, and Martin KA (2004). Neuronal circuits of the neocortex. Ann. Rev. Neurosci. 27, 419–451.
38. Troy JB, and Shou T. (2002). The receptive fields of cat retinal ganglion cells in physiological and pathological states: where we are after half a century of research. Prog. Ret. Eye Res. 21, 263–302.
39. Lennie P., and Movshon JA (2005). Coding of color and form in the geniculostriate visual pathway. J. Opt. Soc. Am. 22, 2013–2033.
40. Victor JD (2005). Analyzing receptive fields, classification images and functional images: challenges with opportunities for synergy. Nat. Neurosci. 8, 1651–1656.
41. Srinivasan MV, Jin ZF, Stange G., and Ibbotson MR (1993). 'Vector white noise': a technique for mapping the motion receptive fields of direction-selective visual neurons. Biol. Cybern. 68, 199–207.
42. Meister M., and Berry MJ (1999). The neural code of the retina. Neuron 22, 435–450.
43. Kara P., Reinagel P., and Reid RC (2000). Low response variability in simultaneously recorded retinal, thalamic, and cortical neurons. Neuron 27, 635–646.
44. Ringach DL, Hawken MJ, and Shapley R. (2002). Receptive field structure of neurons in monkey primary visual cortex revealed by stimulation with natural image sequences. J. Vision 2, 12–24.
45. Schwartz O., and Simoncelli EP (2001). Natural signal statistics and sensory gain control. Nat. Neurosci. 4, 819–825.
46. Horridge A. (2000). Seven experiments on pattern vision of the honeybee, with a model. Vision Res. 40, 2589-2603.
47. Srinivasan MV (2006). Honeybee vision: in good shape for shape recognition. Curr. Biol. 16, R58–60.
48. Marr D. (1982). Vision: A Computational Investigation in the Human Representation and Processing of Visual Information (New York: WH Freeman).
49. Barlow HB (1997). The knowledge used in vision and where it comes from. Phil.Trans. Roy. Soc. Lond. B 352, 1141–1147.
50. Riesenhuber M., and Poggio T. (2000). Models of object recognition. Nat. Neurosci. 3, 1199–1204.