منين ايليا الكسيفيتش ، الشركة التونسية للملاحة
imoninpgd@gmail.com
نموذج الذرة مع نواة كبيرة قابلة للمقارنة مع حجم الذرة ككل.
في الوقت الحالي ، في الفيزياء ، يُعتبر نموذج ذرة راذرفورد-بوهر معترفًا به عالميًا ، حيث تحيط نواة صغيرة ثقيلة ذات شحنة موجبة بقذائف إلكترونية شبه معدومة الوزن ، في حين أن حجم قذائف الإلكترون أكبر 1000 مرة من حجم النواة.
يشتمل نموذج ذرة رذرفورد-بوهر على العديد من العيوب المتأصلة منذ 100 عام منذ إنشائها.
الشيء الوحيد الذي يفسر نموذج ذرة راذرفورد-بوهر هو تجربة تشتت تدفق جسيمات ألفا على رقائق رقيقة من الذهب. استُخلص منه استنتاج حول الحجم الصغير التلاشي للنواة الإيجابية في تكوين ذرة ضخمة مملوءة بخلو قذائف الإلكترون.
وكيف يفسر نموذج رذرفورد وجود المواد الصلبة ذات الكثافة الثابتة؟
ولا يفسر بأي شكل من الأشكال أي مواد حقيقية معروفة لنا من الحياة اليومية.
كان لهذا السبب اضطررت إلى تكوين نموذجي الخاص بهيكل الذرة.
لا يمكن لأي من النماذج الحالية شرح كل شيء مرة واحدة.
في نموذجي ، لا أشرح تناثر جسيمات ألفا في تجربة راذرفورد.
حسنًا ، يشرح نموذج راذرفورد تجربة واحدة فقط لتشتت جزيئات ألفا على ورق ذهبي ، لكن لا يمكنه تفسير أي شيء آخر.
لكن نموذجي يفسر وجود المواد الصلبة والسوائل والغازات وجميع مراحل الانتقال بينهما.
في نموذج Rutherford-Bohr ، من غير المفهوم تمامًا ما هي القوى التي توجد بها المواد الصلبة ، والتي تتكون منها كل الكائنات المحيطة بنا ، والانتقال من الحالة الصلبة إلى الحالة السائلة ومن الحالة السائلة إلى الحالة الغازية لمادة غير مفهوم.
لقد حان الوقت لمحاولة إعادة التفكير في نموذج هيكل Atom وإنشاء مفهوم جديد قادر على شرح قوة المواد الصلبة ومرونة الغازات النادرة.
يُقترح نموذج Atom جديد للنظر فيه ، تتمثل أهمها في الأطروحات التالية:
- تتزامن نواة الذرة عملياً في الحجم مع الحدود الخارجية للذرة ؛
- النواة الذرية ليست مجموعة من الفوضوية الفوضوية (النيوترونات والبروتونات) ، ولكن لديها بنية هيكلية واضحة للغاية ، وهي المسؤولة عن جميع الخصائص الفيزيائية والكيميائية لمادة بسيطة معينة من الجدول الدوري ؛
- تتلامس الذرات في المواد الصلبة مباشرة مع نواتها الصلبة ؛
- يتم الانتقال إلى المراحل المختلفة (الصلبة والسائلة الغازية) مع تغيير في الموضع النسبي للنكليونات الفردية (أو عناصرها) في بنية النواة ؛
- يتم استبعاد مفهوم "Atom Shell" الإلكتروني من نموذج Atom الجديد ، ويتم تنفيذ جميع تفاعلات الذرات من خلال الاتصال المباشر بنواة النواة ومن خلال الحقول الكهروستاتيكية والمغناطيسية المعروفة المرتبطة بنواة معينة في النواة.
- لا يوجد جسيم منفصل "الكترون" في هذا النموذج الذري.
تتزامن نواة الذرة عملياً في الحجم مع الحدود الخارجية للذرة. إن تزامن حجم النواة مع الأبعاد الخارجية للذرة يتيح للمرء إعطاء تفسيرات للعديد من حالات الطور غير المبررة سابقًا ، أي المواد الصلبة والسائلة والغازات.
يتم شرح المواد الصلبة في المفهوم الجديد بواسطة ذرات صلبة نواة مباشرة في اتصال مع بعضها البعض. علاوة على ذلك ، تتحدد قوة الشد من خلال جذب الذرات الفردية على مستوى القوى المغناطيسية قصيرة المدى في النواة الذرية. حسنًا ، يتم تحديد قوة الضغط على وجه الحصر بواسطة قوة النواة الذرية الكثيفة نفسها. تميل القوة الضاغطة إلى ما لا نهاية ، وهو ما يتجلى في حقيقة وجود أجسام عملاقة مضغوطة بقوة بالجاذبية ، مثل النجوم والكواكب.
حالة الضغط أحادي الجانب لا تخلق الظروف لضغط شامل ، وبالتالي تبدأ الذرات في الانزلاق على طول بعضها البعض تحت تأثير قوى القص في الاتجاه العمودي من قوة الضغط المؤثرة. إنه بالتحديد احتمال حدوث مثل هذا التحول الذي تستند إليه جميع تقنيات تشكيل المعادن (الضغط ، وتزوير ، وختم) ، عندما يكون من الممكن لف الفراغ المعدني إلى رقائق رقيقة للغاية في فجوة ضيقة بين الأسطوانة ، أو أنه من الممكن تسطيح الفراغ بين القالب وكمة في منتج يشبه الزجاج. هذا هو بالضبط كيف تصنع العلب البيرة رقيقة الجدران من الفراغات الكريات الألومنيوم عن طريق ختم.
تحتوي نواة الذرة على بنية هيكلية واضحة وفريدة من نوعها ، وهي مسؤولة عن جميع الخصائص الفيزيائية والكيميائية لمادة بسيطة معينة من الجدول الدوري.
يسمح لنا الانتقال إلى النظر في التفاصيل "الصغيرة" لهيكل النواة بالانتقال من السمة العددية الضئيلة الموجودة لعدد النكليونات وحجم الشحنة وفقًا للجدول الدوري إلى الخاصية النوعية الإخبارية لهيكل بنية النواة ، والتي ينبغي أن تحمل مجموعة الخصائص الكيميائية والفيزيائية لمادة بسيطة.
يحدث الانتقال إلى الحالات التجميعية المختلفة (الصلبة السائلة الغازية) عندما يتغير الموضع النسبي للنكليونات الفردية في بنية النواة أو تتغير النوكليونات نفسها في العناصر الغذائية.
في نموذج Rutherford-Bohr Atom ، كانت النواة أصغر بآلاف المرات من حجم Atom ، وبالتالي لم يكن تأثير النواة الصغيرة على تحولات الطور الخارجي في الاعتبار. مع زيادة مقدارها ألف مرة في حجم النواة ، يزداد دورها زيادة حادة في التأثير على جميع الخواص الفيزيائية للمادة ، بما في ذلك انتقال المرحلة إلى حالات التجميع المختلفة. عند التماس المباشر لنواة ذرات متعددة النوى الكبيرة ، ينشأ نوع جديد من التفاعل ، يعتمد على القوى المغناطيسية والكهروستاتيكية المعروفة منذ زمن طويل.
بالاتصال الوثيق بالنواة ، الموسع إلى الحدود الخارجية للذرة ، تبدأ الظاهرة المهملة سابقًا "التفاعل الكهروستاتيكي والمغناطيسي للترتيب القصير المدى" ، أي تفاعل الشحنات المغناطيسية والكهربائية القوية للنواة على مسافات قريبة من حجم النواة وحجم النواة الفردية.
اعتبر النموذج السابق الذرة محايدة كهربائياً ، ولم يؤخذ في الاعتبار الفصل بين الشحنة السالبة لقذيفة الإلكترون والنواة الموجبة.
في النموذج الجديد ، يمكن اعتبار تفاعل الذرات النووية على مستوى التأثير المحلي للتقارب الوثيق بين القطبين اللذين يحملان الاسم نفسه للنواة ثنائية القطب الداخلية متباعدة. مثل هذا النهج يجعل من الممكن إنشاء نموذج للصلب على قوى الجذب المغناطيسي ، وكذلك نموذج لحالات الغاز الثابت على قوى التنافر الإلكتروستاتيكي. تشتمل الحالة الوسيطة في نموذج الطور السائل على عناصر من الطور الصلب والغازي ، والتي تتعارض مع بعضها في فجوة ضيقة بين الذرات.
يوجد الغاز على قوى تنافرية تحمل نفس الاسم الشحنات الإلكتروستاتية في ثنائيات أقطاب النواة الفردية ، عندما يتم تحويل جميع الأقطاب الكهربائية للذرة إلى الخارج بنفس الاسم الخاص بالقطب الكهربائي. في هذه الحالة ، يتم ذرات جميع ذرات الغاز المجاورة بنفس أقطاب ثنائي القطب الكهربائي (في المجموع تظل الذرة محايدة) ، مما يخلق تنافرًا متبادلًا للكهرباء الساكنة. (الشكل 1 ، الشكل 2 ، الشكل 3).
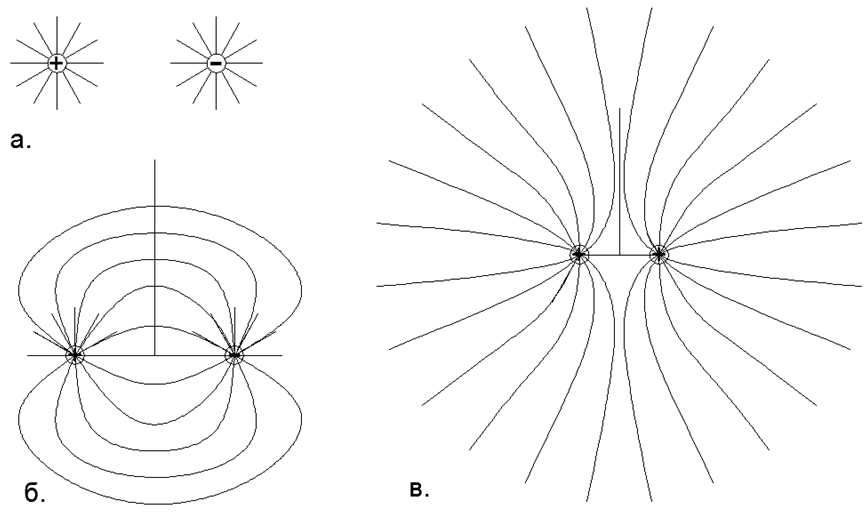 الشكل 1. تفاعل حقول شحنة النقط وفقًا لمبدأ التراكب: أ) شحنتان معزولتان معاكسان بحقل كهربائي منتظم (نصف كروي) موجه شعاعيًا ، حيث يتم توزيع خطوط القوة بشكل متساوٍ وتمتد شعاعيًا إلى ما لا نهاية ، أي في الحقول المجردة لا تتفاعل ؛ ب) الشكل الحقيقي لخطوط القوة المكونة من شحنتين متقابلتين متقاربتين ، حيث وفقًا لمبدأ التراكب ، يتم إغلاق خطوط القوة لشحنة موجبة عند شحنة سالبة ، وفي اللانهاية ، يتم اعتبار الشحنة الكلية لهذا النظام صفراً ولا تنتقل خطوط القوة من ثنائي القطب إلى اللانهاية ؛ ج) الشكل الحقيقي لخطوط القوة من شحنتين متماثلتين متماثلتين أحادية البعد ومتماثلتين ، حيث وفقًا لمبدأ التراكب ، لا تتقاطع خطوط القوة الخاصة بالشحنات ذاتها ، ولكن يتم نقلها إلى مسافات نصف منفصلة ، وعند اللانهاية ، يتم اعتبار الشحنة الكلية لهذا النظام تهمة مزدوجة القيمة.
الشكل 1. تفاعل حقول شحنة النقط وفقًا لمبدأ التراكب: أ) شحنتان معزولتان معاكسان بحقل كهربائي منتظم (نصف كروي) موجه شعاعيًا ، حيث يتم توزيع خطوط القوة بشكل متساوٍ وتمتد شعاعيًا إلى ما لا نهاية ، أي في الحقول المجردة لا تتفاعل ؛ ب) الشكل الحقيقي لخطوط القوة المكونة من شحنتين متقابلتين متقاربتين ، حيث وفقًا لمبدأ التراكب ، يتم إغلاق خطوط القوة لشحنة موجبة عند شحنة سالبة ، وفي اللانهاية ، يتم اعتبار الشحنة الكلية لهذا النظام صفراً ولا تنتقل خطوط القوة من ثنائي القطب إلى اللانهاية ؛ ج) الشكل الحقيقي لخطوط القوة من شحنتين متماثلتين متماثلتين أحادية البعد ومتماثلتين ، حيث وفقًا لمبدأ التراكب ، لا تتقاطع خطوط القوة الخاصة بالشحنات ذاتها ، ولكن يتم نقلها إلى مسافات نصف منفصلة ، وعند اللانهاية ، يتم اعتبار الشحنة الكلية لهذا النظام تهمة مزدوجة القيمة. أي من ذرات البيئة الكلية البعيدة ، تبدو الذرات المحايدة محايدة بشكل موحد ، بينما في حالة المدى القصير مع الذرات المجاورة ، يتم الاحتفاظ بالغازات في حالة متساوية بشكل ثابت على قوى تحمل نفس اسم التنافر الإلكتروستاتيكي.
في نموذج "التفاعل الكهروستاتيكي للترتيب القصير المدى" ، تتوقف جزيئات الغاز عن الحركة بسرعات هائلة ، وتبقى في حالة من الراحة الشديدة كهربائياً ، وتحدد درجة حرارتها فقط من خلال قوة المجال الكهروستاتيكي في ترتيب التفاعل قصير المدى. يتم تحقيق تغيير سلس في درجة حرارة الغاز عن طريق تغيير متزامن سلس في طول أكتاف ثنائيات أقطاب النواة الداخلية في الاتجاه الشعاعي للذرة. كلما كان ذراع ثنائي القطب أقصر ، كلما كان طول بتلات التاج الكهروستاتيكي أقصر.
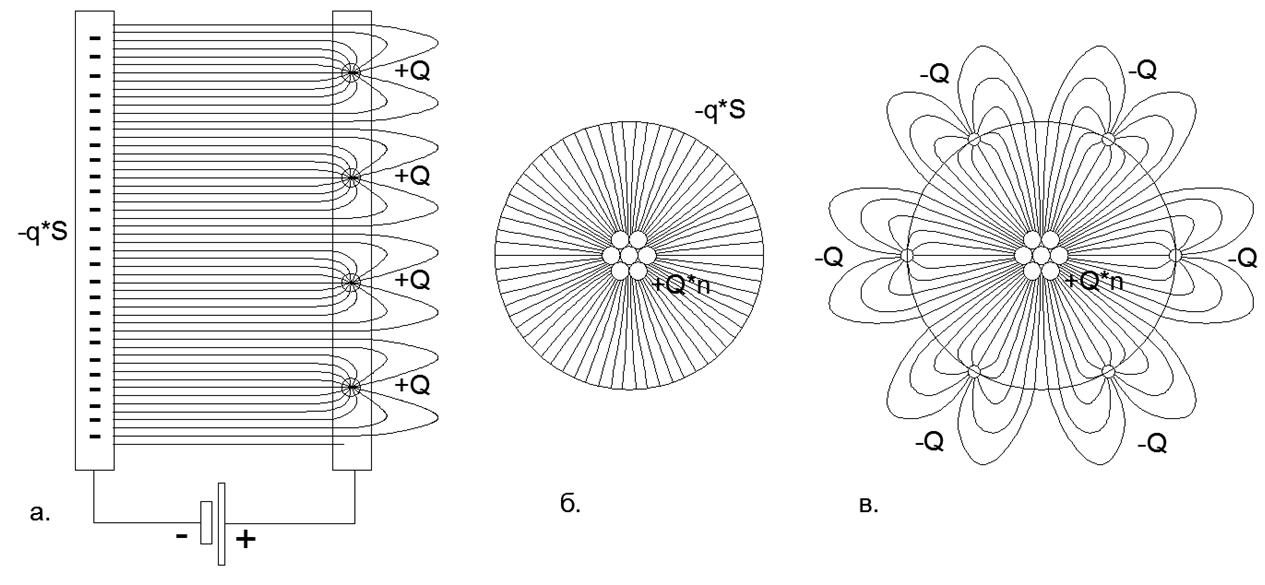 الشكل 2: توزيع خطوط الحقل الإلكتروستاتيكي على ألواح المكثف مع الشحنات الموزعة والنقطة: أ) المكثف المسطح ذو الشحن الموزع لألواح Minus (لا يتقاطع الحقل مع المجال) وشحن النقطة الواحدة على لوحة Plus (يغلق الحقل خارج الفجوة بين الألواح) ؛ ب) مكثف كروي مع شحنة موزعة على البطانة ناقص ورسوم نقطة واحدة على بطانة زائد ؛ ج) المكثف الكروي مع الشحنات ذات النقطة الواحدة على البطانة الزائدة والشحنات ذات النقطة الواحدة على البطانة ناقص (إغلاق الحقل على الشحنات الخارجية يخلق بتلات خط الحقل الطويلة التي تمتد إلى مسافة أبعد من البطانة الكروية الخارجية الصلبة للمكثف).
الشكل 2: توزيع خطوط الحقل الإلكتروستاتيكي على ألواح المكثف مع الشحنات الموزعة والنقطة: أ) المكثف المسطح ذو الشحن الموزع لألواح Minus (لا يتقاطع الحقل مع المجال) وشحن النقطة الواحدة على لوحة Plus (يغلق الحقل خارج الفجوة بين الألواح) ؛ ب) مكثف كروي مع شحنة موزعة على البطانة ناقص ورسوم نقطة واحدة على بطانة زائد ؛ ج) المكثف الكروي مع الشحنات ذات النقطة الواحدة على البطانة الزائدة والشحنات ذات النقطة الواحدة على البطانة ناقص (إغلاق الحقل على الشحنات الخارجية يخلق بتلات خط الحقل الطويلة التي تمتد إلى مسافة أبعد من البطانة الكروية الخارجية الصلبة للمكثف).
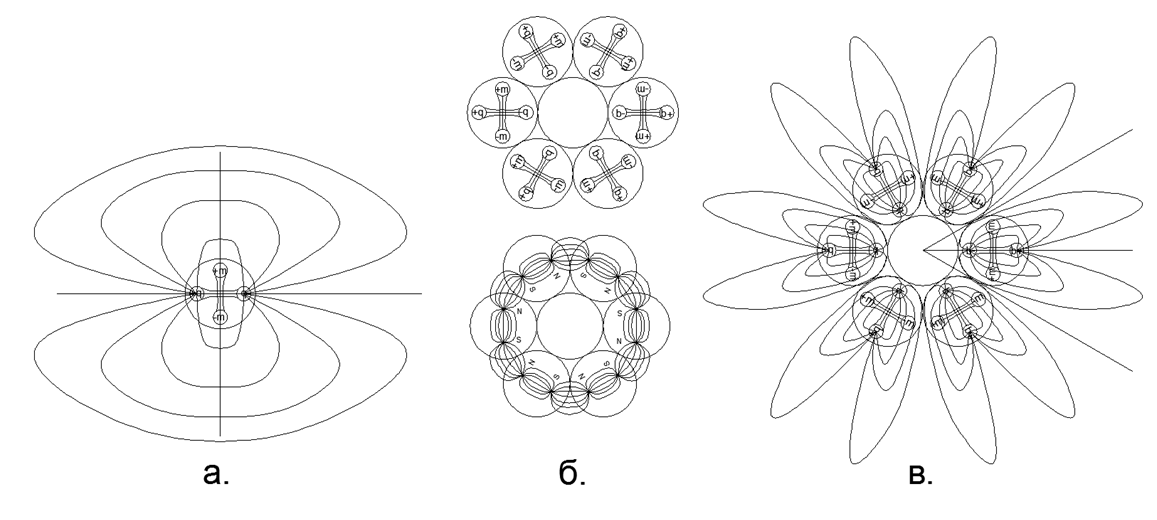 الشكل 3. منظر للحقل الكهربائي للثنائي القطب في تكوين نواة حرة ؛ ب) الاحتفاظ بقوى مغناطيسية لسلسلة مكونة من 6 نيوكليونات مغلقة في حلقة ، في حين أن خطوط القوة المغناطيسية مغلقة تمامًا داخل الحلقة ولا تدخل في الفضاء الخارجي ؛ ج) المجال الكهربائي لثنائيات حلقة النكليون ، مكونًا "التاج" الإلكتروستاتي (في هذه الحالة ، بتلات خطوط القوة لـ "الإكليل" الكهربائي تتجاوز حدود أبعاد الذرة).
الشكل 3. منظر للحقل الكهربائي للثنائي القطب في تكوين نواة حرة ؛ ب) الاحتفاظ بقوى مغناطيسية لسلسلة مكونة من 6 نيوكليونات مغلقة في حلقة ، في حين أن خطوط القوة المغناطيسية مغلقة تمامًا داخل الحلقة ولا تدخل في الفضاء الخارجي ؛ ج) المجال الكهربائي لثنائيات حلقة النكليون ، مكونًا "التاج" الإلكتروستاتي (في هذه الحالة ، بتلات خطوط القوة لـ "الإكليل" الكهربائي تتجاوز حدود أبعاد الذرة).يفسر تأثير التنافر قصير المدى الإلكتروستاتيكي في الغازات والجاذبية المغناطيسية للنواة في الطور السائل (الصلب) جيدًا عملية التبخير أثناء التسخين التدريجي والحالات الحرجة لتشبع البخار. لذلك ، يحدث التبخر (الخروج من الطور الصلب أو السائل إلى الحالة الغازية) عندما ، عندما يتم تسخين ذرة ، فإن ثنائيات القطب الكهروستاتيكي من النوكليونات تدور حولها بنفس الأقطاب إلى الحد الذي يصبح فيه التنافر الإلكتروستاتيكي أكبر من قوة الجذب المغناطيسي للذرات المجاورة. يحدث التكثيف بالترتيب العكسي: يؤدي تبريد الذرة إلى انخفاض في شدة التنافر الإلكتروستاتيكي عند تحويل الأقطاب الثنائية الكهربائية إلى وضع محايد.
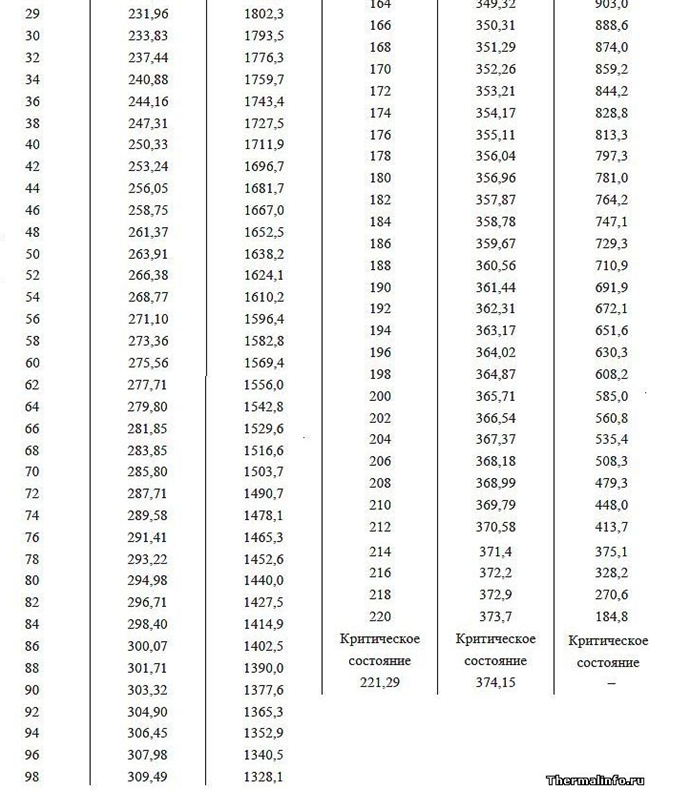
وظيفة العمل (طاقة التبخير) هي طاقة الحقل الإضافية التي تنفقها ذرة أثناء تمدد الهالة الإلكتروستاتيكية في مساحة غاز فارغة. يجب أن تنخفض طاقة الخرج (حرارة التبخير) مع زيادة ضغط الغاز عند درجة حرارة متساوية من السائل والغاز فوقها ، وهو ما يؤكده مثال الاعتماد على قيمة حرارة التبخير في ضغوط هواء مختلفة حولها (انظر بيانات الجدول الخاصة بالضغطات تحت 1 atm في الجبال العالية). أيضًا ، مع زيادة الضغط ونقطة غليان الماء (بيانات جدولية لنقطة غليان الماء عند ضغوط مختلفة أعلى من 1 atm) ، تتناقص وظيفة العمل ، وهو ما يفسر بانخفاض الفرق في أحجام المسافات بين الجزيئات في المراحل السائلة والغازية ، مما يقلل من حجم الحقل الكهربائي في كورونا ، والذي يمتص بالإضافة إلى ذلك الطاقة عندما تفتح بعد ترك المياه الكثيفة في مرحلة الغاز المتعثرة.
الانتقال من حالة البخار إلى الحالة الجليدية في درجات حرارة سلبية يجب أن يمر عبر مرحلة الماء السائل. في نفس الوقت ، تتشكل الطبقة الأرفع من الطور السائل من الماء بدرجة حرارة أعلى من الصفر المئوي على سطح الجليد المتصلب بالفعل ، حيث يتم توزيع التدفق الحراري من طي حقل جزيئات الماء المتكثف. كلما زاد الفرق في درجة حرارة الجليد بالنسبة إلى 0 درجة مئوية ، كلما كانت طبقة الماء أرق على السطح ، حيث إن الفرق في درجة الحرارة الكبيرة يزيد من معدل نقل الحرارة في طبقة الجليد السائل ، مع انخفاض نسبي في سمك طبقة المياه لإجراء تدفق الحرارة المطلوب من جزيء الماء المكثف.
تخلق الطبقة الأرفع من الماء على سطح الجليد عند التفاعل مع الدعم من الحمل الخارجي (وحيد التمهيد أو عداء الزلاجات) الظروف لظهور "خط هيدرولي" حتى عند سرعات حمولة نسبية تقارب الصفر بالنسبة إلى الجليد. طبقة نحافة من المياه بسماكة عدة صفوف جزيئية ببساطة ليس لديها وقت للضغط من فجوة رقيقة ، في حين أن لزوجة الماء السائل منخفضة للغاية ، مما يخلق إمكانية الانزلاق الوحيد على الجليد على شحم الماء "هيدروكلين".
إذا ارتبط سمك الخط الهيدرولي بانخفاض درجة الحرارة بالنسبة إلى 0 درجة مئوية ، فيجب أن ينخفض زلق الجليد مع زيادة الصقيع. هذا هو بالضبط سلوك الجليد الذي يمكن تتبعه في الممارسة العملية ، عندما يكون أكبر انزلاق على الطرق ملحوظًا عند درجات حرارة قريبة من الصفر. في الصقيع الشديد ، عندما تتحرك على الجليد ، يكون التلامس المباشر مصنوعًا من مادة صلبة صلبة ، بدون تكوين هيدروكلين عمليًا ، كما لو كان هناك وضع جزيئي فوري للجليد مع وجود (الإطار) مع تجميد دعامة الجليد.
وفقًا لبعض التقارير ، فإن سماكة غشاء الماء على سطح الجليد ، التي تساوي -5 درجة 100 نانومتر ، تتناقص بمقدار عشر مرات عند -35 درجة إلى 10 نانومتر ، وفي -170 درجة تتكون عمومًا من طبقة واحدة من الجزيئات. لذلك ، يقول سكان منطقة القطب الشمالي إن سحب الزلاجات على الجليد في درجات حرارة منخفضة للغاية هو نفسه سحبها على الرمال (بعد كل شيء ، لا يوجد ما يكفي من التشحيم في هذه الحالة).
 الشكل 4: رسم تخطيطي للمنطقة الحدودية للاتصال بمراحل مختلفة من الغاز السائل (الماء والهواء) في حالة النظرية الكهروستاتيكية للغاز: أ) الغاز عند ضغط 1 atm. فوق الماء السائل (المسافة بين مراكز الجزيئات أكبر بحوالي 10 مرات من الطور السائل) ؛ ب) نفس الغاز فوق الماء في نفس درجة الحرارة ، ولكن عند ضغط 10 أمتار ، بينما تقل المسافة بين مراكز جزيئات الغاز بمقدار 10 ^ 1/3 = 2.15 مرة. يمكن للمرء أن يرى بوضوح تشوه التاج الكهربائي أحادي القطب لذرات الغاز مع اقتراب الجزيئات من بعضها البعض. لا يمكن أن تتقاطع خطوط القوة ، وبالتالي فهي مضطرة للتشوه ، مع حجم أصغر ، مما يؤدي إلى زيادة قوى التنافر المتبادل (زيادة في ضغط الغاز).علامة التبويب 1. حرارة التبخير للمياه ، وهذا يتوقف على الضغط ودرجة الحرارة.
الشكل 4: رسم تخطيطي للمنطقة الحدودية للاتصال بمراحل مختلفة من الغاز السائل (الماء والهواء) في حالة النظرية الكهروستاتيكية للغاز: أ) الغاز عند ضغط 1 atm. فوق الماء السائل (المسافة بين مراكز الجزيئات أكبر بحوالي 10 مرات من الطور السائل) ؛ ب) نفس الغاز فوق الماء في نفس درجة الحرارة ، ولكن عند ضغط 10 أمتار ، بينما تقل المسافة بين مراكز جزيئات الغاز بمقدار 10 ^ 1/3 = 2.15 مرة. يمكن للمرء أن يرى بوضوح تشوه التاج الكهربائي أحادي القطب لذرات الغاز مع اقتراب الجزيئات من بعضها البعض. لا يمكن أن تتقاطع خطوط القوة ، وبالتالي فهي مضطرة للتشوه ، مع حجم أصغر ، مما يؤدي إلى زيادة قوى التنافر المتبادل (زيادة في ضغط الغاز).علامة التبويب 1. حرارة التبخير للمياه ، وهذا يتوقف على الضغط ودرجة الحرارة.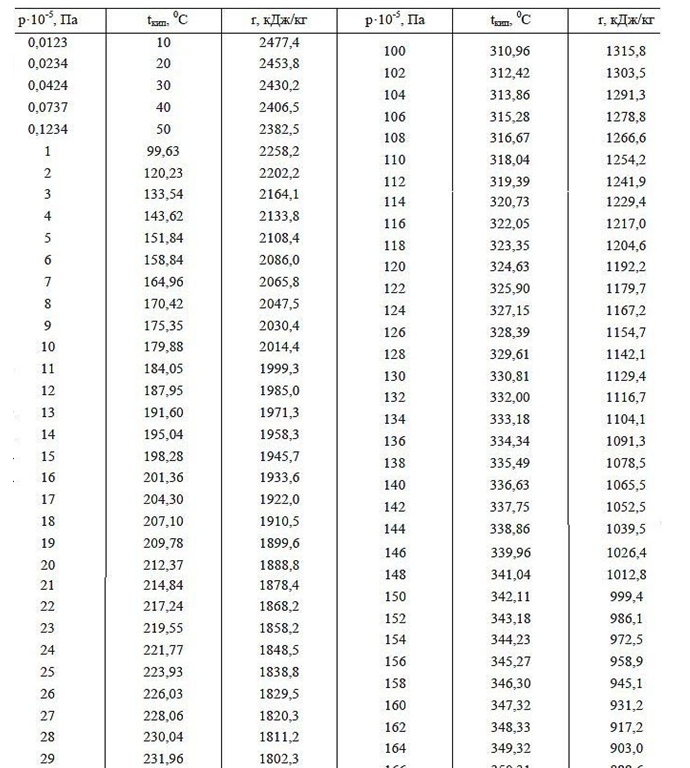
تصف المعادلات الحالية لحالة الغاز المثالي (قانون بويل ماريوت) الغازات في ضغوط منخفضة (ظروف طبيعية) ودرجات حرارة عالية. لكن في ظل ضغوط شديدة ، لا يسمح لنا هذا القانون المثالي بوصف التحولات إلى السائل ، أو حتى الحالة الصلبة.
يحاول قانون Van der Waltz تصحيح التناقضات من خلال إدخال عوامل إضافية ، مما يلائم المنحنى النظري للاعتماد الذي تم الحصول عليه تجريبياً. في هذه الحالة ، يحدث رفض خفي لنموذج ذرة رذرفورد-بوهر ، حيث يتم تمثيل الذرة في معادلة فان دير فالس بواسطة كرة صلبة تملأ كامل الحجم عند حدودها الخارجية.
في الوقت نفسه ، لا يتم شرح طبيعة تفاعل الكرات الذرية نوعيًا ، تاركًا تفسيرات على مستوى أصداف الإلكترونات الإحصائية التي لا وزن لها على نواة صغيرة ، كما تم طرحه وفقًا لنموذج راذرفورد-بور.
في حالة النموذج المقترح ، حيث يحدث تنافر الأسطح المشحونة ، يصبح من الممكن النظر في فهم النموذج الثابت ، حيث يكون لكل عنصر من عناصر النموذج تجسيد مادي مفهوم ومعنى مادي.
لذلك يتم التعبير عن تفاعل ثنائي القطب من خلال أبسط صيغة للتفاعل المباشر بين الزوجين لشحنات أربع نقاط يتم جمعها في أزواج في ثنائيات أقطاب قوية ميكانيكيًا مع كتف L ومسافة R بين الأطراف القريبة من ثنائي القطب:
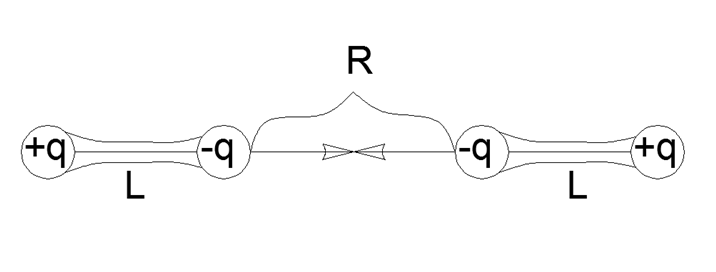
F = K q2 (1 / R2 - 2 / (R + L) 2 + 1 / (R + 2L) 2)
يؤدي إلى قاسم مشترك وفتح الأقواس في البسط ، نحصل على تعبير أكثر تعقيدًا:
F = K q2 (2R2L2 + 12RL3 + 4L4) / (R2 (R + L) 2 (R + 2L) 2)
تتمثل إحدى ميزات نموذج الحساب للثنائيات في أن وظيفة التنافر للثنائيات تميل إلى إنفينيتي بعيدًا عن مركز الذرة ، وبشكل أدق عند الحافة الخارجية ، حيث يكون التماس المباشر للذرات ممكنًا تحت تأثير أقوى قوى الجذب الذري المغناطيسي. إن الاتصال بين اثنين يتغيران بشكل حاد في القيمة والعكس في قوى الإشارة على الحدود الذرية هو الذي يسمح لنا بإنشاء نموذج من الذرات المتوازنة لجذب الذرات فيما بينها.
عندما تكون R >> L ، يتم تبسيط وظيفة التنافر الكهربائي للثنائيات على الشكل:
F = K q2 2L2 / R4
, .
بالطبع ، من الواضح أنه في الواقع لا توجد قوى كبيرة بلا حدود ، ولكن يوجد حد معين للقيم القصوى (على سبيل المثال ، يمكن تقدير القوى الجذابة للذرات عن طريق القياس المباشر لقوة الشد في بلورة واحدة من مادة ما ، ويتم تحديد دقة قوى التفاعل الكهروستاتيكي بواسطة الطاقة الثابتة أثناء إبادة الإلكترون والبوزيترون). عندما تتحد ذرتان ، تتوقف القوى البغيضة في مرحلة ما عن النمو بسرعة وتصل إلى قيمة محددة محددة. وبالتالي ، لا توجد قيمتان كبيرتان لا تضاهى لجاذبية وتوازن التنافر عند نقطة معينة من التوازن المتبادل ، والتي يمكن العثور عليها عند تقاطع الرسوم البيانية لهاتين الوظيفتين ، عند رسم الرسوم البيانية في نظام إحداثي واحد. (انظر الرسم البياني 1)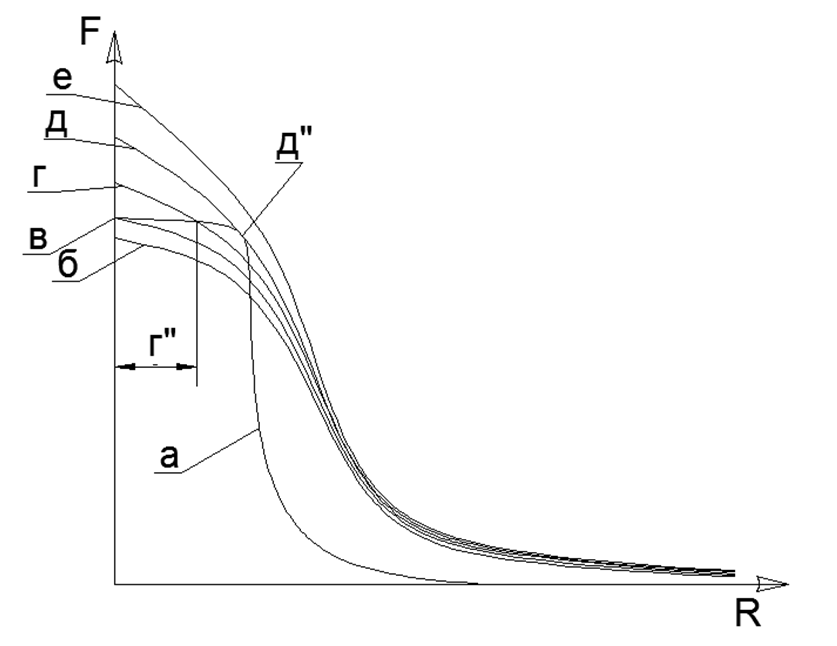 .1. () : (); (), () (''); - () (''); (). R- . (-) () , - , ( ) ( ) (R max - ). ترسم معادلة Van der Waltz صورة متشابهة للغاية ، ولكنها لا تفسر المعنى المادي لقوى الجذب والتنافر ، بينما تتحرك بمهارة في منطقة النمو غير المقارب للوظيفة إلى المنطقة غير القابلة للتحقيق لمركز الذرة.الحالة السائلة لمادة ما هي اللحظة التي بدأت عندها تسخين ثنائيات القطب الكهروستاتيكي بالفعل عند التسخين ، لكن هذا التنافر لا يستطيع بعد كسر رابطة الجاذبية المغناطيسية للذرات. نتيجة لذلك ، تنشأ فجوة صغيرة بين الذرات (g "في الرسم البياني 1) ، مما يؤدي إلى زيادة حادة في الحركة المتبادلة للذرات على طبقة" زيوت التشحيم "الكهرومغناطيسي.تتشكل طبقة حدود الغاز الصلب عند ملامسة مادة صلبة مغناطيسية مع ذرات غاز مضغوطة كهربائيا. لا يمكن لذرات الغاز أن تنطلق من مادة صلبة ذات هالة إلكتروستاتيكية غير معلنة من الذرات وتضغط على سطح صلب. وبالتالي ، يتم تشكيل طبقة حدود من ذرات الغاز ، ويتم ضغطها على سطح مادة صلبة. في هذه الحالة ، لا تزال طبقة الغاز الحدودي قادرة على صد ذرات الغاز الأخرى من نفسها ، نظرًا لأن طبقة الغاز الحدودي تظل مضغوطة كهربائيًا إلى الدرجة اللازمة. يفسر مثل هذا الضغط لطبقة الحدود للغاز (الهواء) في المعدن الصلب المظهر شبه التلقائي لأكاسيد الفلز على السطح. يتم بالفعل إجراء اتصال إضافي لطبقة حدود الغاز مع طبقة واقية صلبة من الأكاسيد على سطح المعدن ،يحمي الطبقة الأساسية من المعدن النقي من المزيد من الأكسدة.
.1. () : (); (), () (''); - () (''); (). R- . (-) () , - , ( ) ( ) (R max - ). ترسم معادلة Van der Waltz صورة متشابهة للغاية ، ولكنها لا تفسر المعنى المادي لقوى الجذب والتنافر ، بينما تتحرك بمهارة في منطقة النمو غير المقارب للوظيفة إلى المنطقة غير القابلة للتحقيق لمركز الذرة.الحالة السائلة لمادة ما هي اللحظة التي بدأت عندها تسخين ثنائيات القطب الكهروستاتيكي بالفعل عند التسخين ، لكن هذا التنافر لا يستطيع بعد كسر رابطة الجاذبية المغناطيسية للذرات. نتيجة لذلك ، تنشأ فجوة صغيرة بين الذرات (g "في الرسم البياني 1) ، مما يؤدي إلى زيادة حادة في الحركة المتبادلة للذرات على طبقة" زيوت التشحيم "الكهرومغناطيسي.تتشكل طبقة حدود الغاز الصلب عند ملامسة مادة صلبة مغناطيسية مع ذرات غاز مضغوطة كهربائيا. لا يمكن لذرات الغاز أن تنطلق من مادة صلبة ذات هالة إلكتروستاتيكية غير معلنة من الذرات وتضغط على سطح صلب. وبالتالي ، يتم تشكيل طبقة حدود من ذرات الغاز ، ويتم ضغطها على سطح مادة صلبة. في هذه الحالة ، لا تزال طبقة الغاز الحدودي قادرة على صد ذرات الغاز الأخرى من نفسها ، نظرًا لأن طبقة الغاز الحدودي تظل مضغوطة كهربائيًا إلى الدرجة اللازمة. يفسر مثل هذا الضغط لطبقة الحدود للغاز (الهواء) في المعدن الصلب المظهر شبه التلقائي لأكاسيد الفلز على السطح. يتم بالفعل إجراء اتصال إضافي لطبقة حدود الغاز مع طبقة واقية صلبة من الأكاسيد على سطح المعدن ،يحمي الطبقة الأساسية من المعدن النقي من المزيد من الأكسدة.- . , – (, ) . , .
, , - . - , - .
يتم تجميع نموذج كل ذرة من عدد النكليونات المحددة في الجدول الدوري (بما في ذلك جميع النظائر المستقرة). يتم إنشاء إعادة بناء النماذج من كرات مغناطيسية نيوديميوم بقطر 5 مم. في الوقت الحالي ، تُباع هذه الكرات المغناطيسية كألعاب ألغاز تسمى Neocub ، والتي تتضمن 216 كرة مغناطيسية من نفس الحجم (6 × 6 × 6 قطع مكعب).استنادًا إلى الميزات الهندسية التي تم الحصول عليها من النماذج الذرية لكل مادة بسيطة ، سنحاول العثور على الروابط المنطقية بين شكل النموذج الذري وخصائص المادة الحقيقية على المستوى الكلي.. , . , , - - (..5). ( - ) , , (.6).
- :
- الاتجاهات المرتبطة التدفقات المغناطيسية
- الاتجاه المعاكس للتدفق المغناطيسي
يمنح الاتجاه المتزامن للتدفقات المغناطيسية اتصالًا أكثر إحكاما وصغيرًا لسلاسل الكرات (توجد الكرات في رؤوس مثلثات متساوية الساقين). تؤدي التدفقات المغناطيسية المعاكسة إلى وجود الكرات على قمم المربعات ، مما يوفر تعبئة أقل كثافة وأقل تحملاً لكرات النوكليون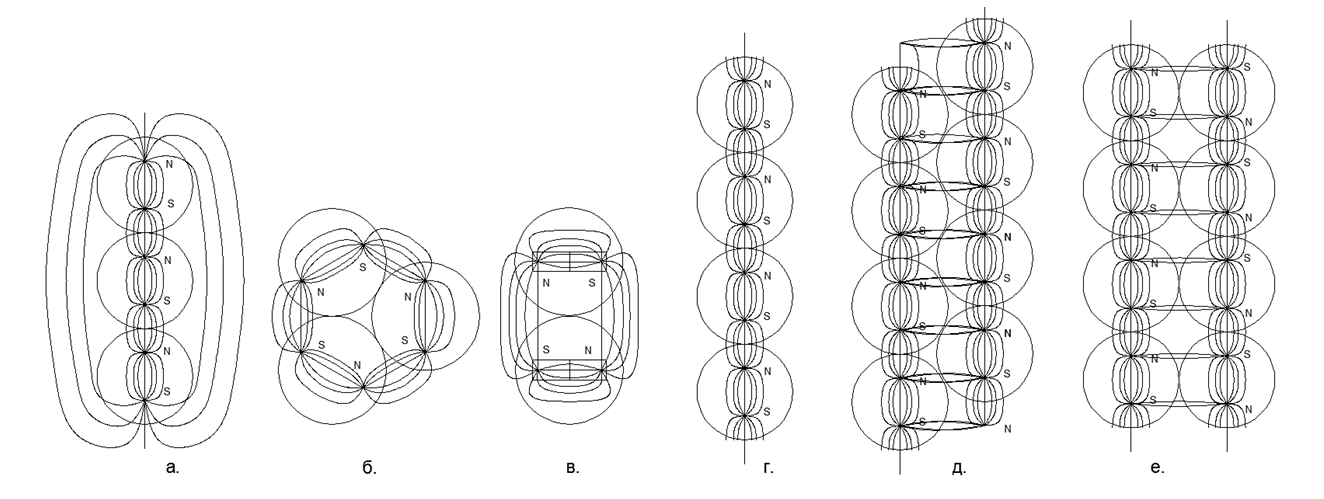 .5. :
.5. :
. 3- ();
. 3- ();
. 2- (), (.);
. - ;
. - , , ;
. - , , . .
 .6. 6- :
.6. 6- :
. ;
. .
- . 6- , .
.
, . , .
, . , . (.6.).
, , (.7- ). , , . , .
على العكس من ذلك ، يجب أن تحتوي المواد التي تحتوي على غازات في ظروف طبيعية على حلقة من النوكليون المشحونة في الدائرة الخارجية ، مما يوفر تنافرًا إلكتروستاتيكيًا من نفس النوع من ذرات الغاز ، في حين يمكن وضع عدد كبير من النكليونات داخل الحلقة المشحونة ، مما يخلق سلسلة نظيرية واسعة من هذا العنصر.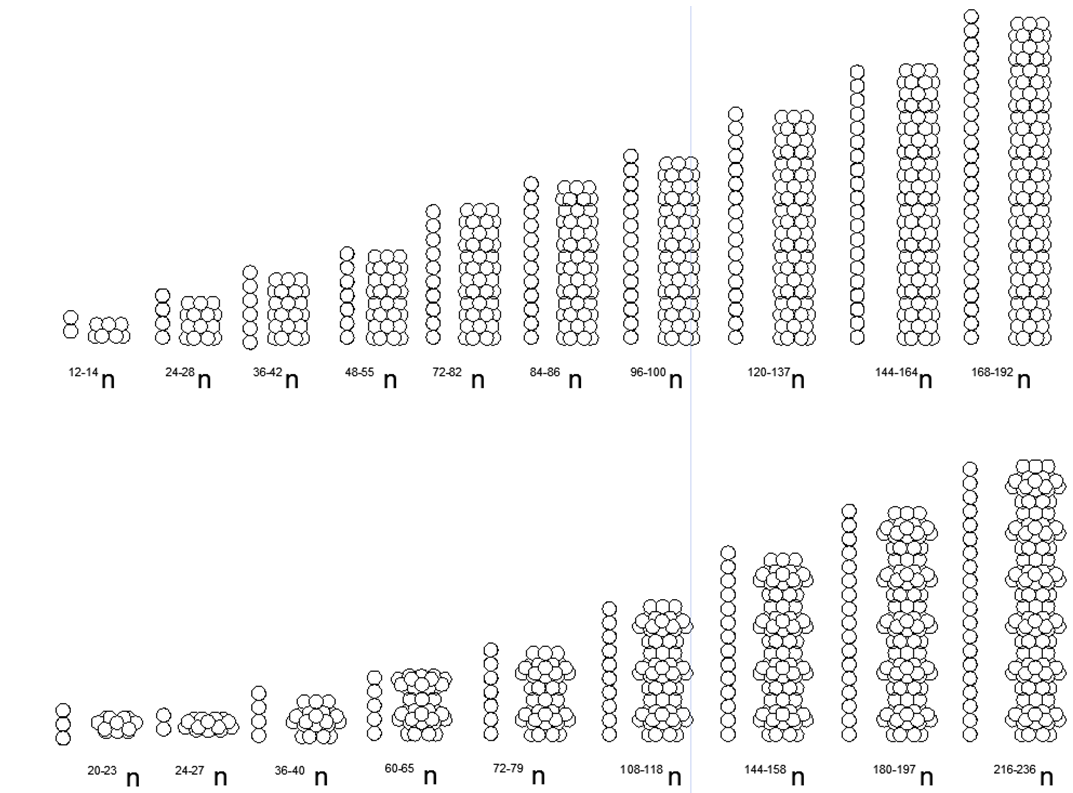 .7. - ( — ) ( - ) . , , . , , .
.7. - ( — ) ( - ) . , , . , , . 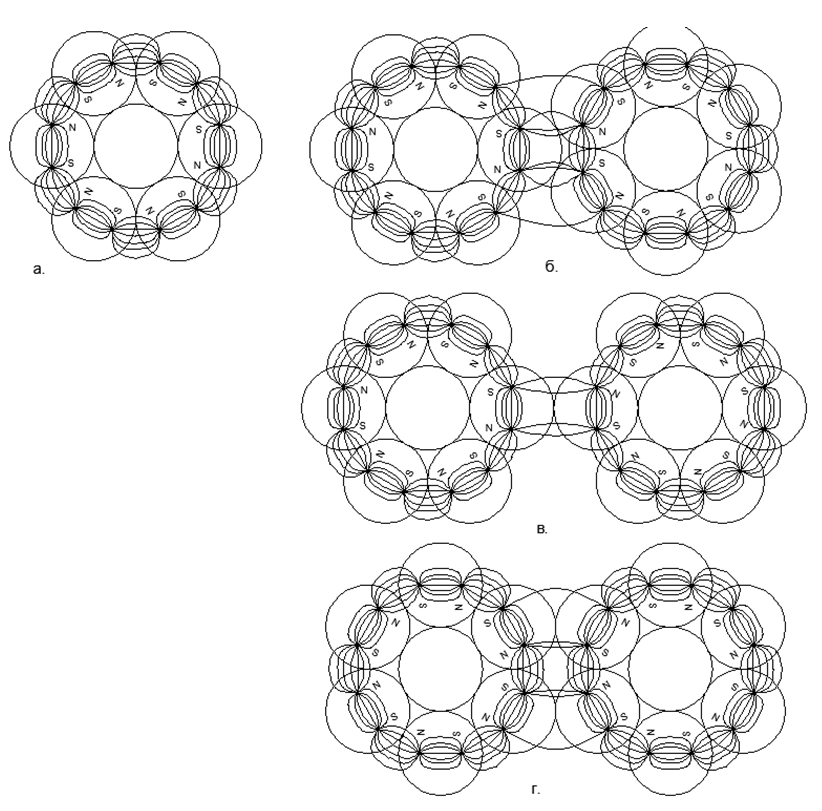 .8. «» :
.8. «» :
. 6- ;
. 6- , , ;
. 6- . , , , (.).
. 6- . , . 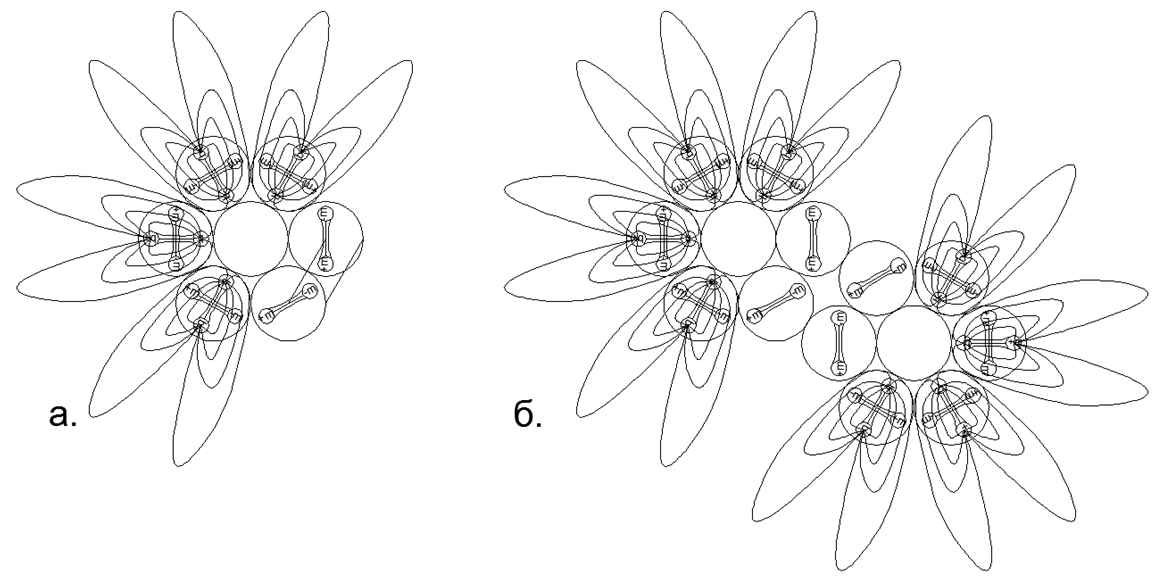 .9. ) , ( N2, 2 ..),; ) , .
.9. ) , ( N2, 2 ..),; ) , . -
- (, , , ..).
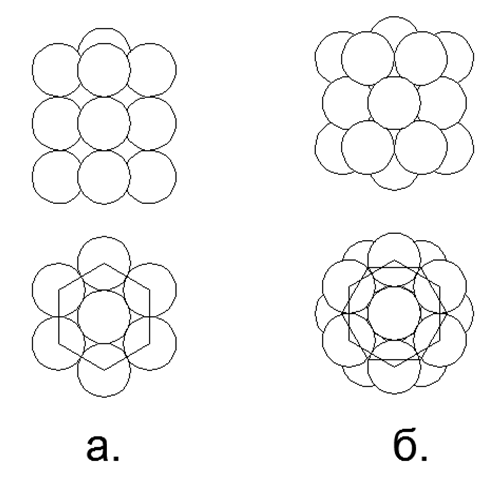
1-2-3 () , , (.2).
.2. 1-2-3- .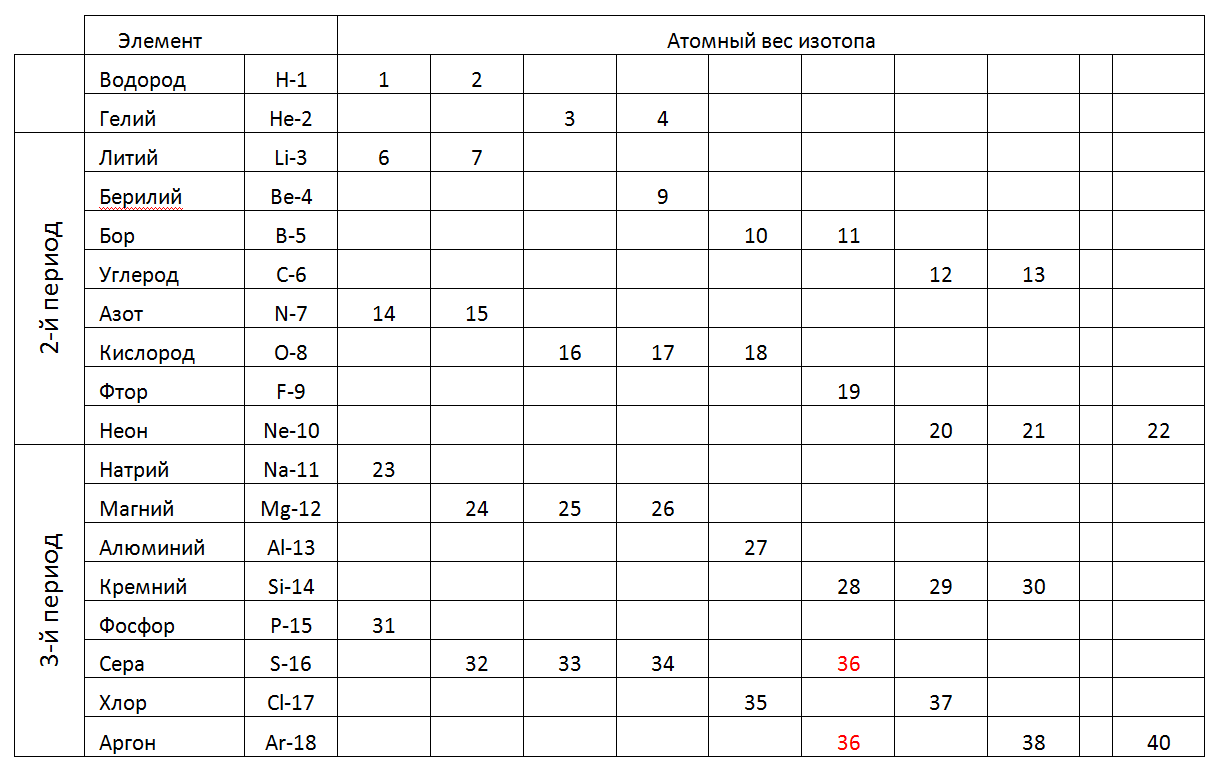 في الفترة الأولى والثانية (الصف الكامل الأول من الجدول) يحتوي الجدول الدوري على عناصر تحتوي على عدد صغير من النكليونات. تسمح لنا الذرات صغيرة الحجم في هذه الفترات بالنظر في هذه النماذج المكانية التي تتوافق مع الأشكال الفريدة التي يمكن أن تحدد اتجاه بناء النماذج الذرية لجميع الفترات اللاحقة (انظر الشكل 7). علاوة على ذلك ، يمكن اعتبار خيار المحاكاة الأكثر عقلانية زيادة تدريجية في طول حلقة Atom الرئيسية المشحونة ، مما يكمله بتكوين نووي أقصى من النوكليونات الخارجية (المعدنية) داخل الحلقة (غير المعدنية) وفقًا لحالتها الكيميائية ، ثم ابحث عن تناظرية من جدول مراسلات النوكليون للعناصر الكيميائية .
في الفترة الأولى والثانية (الصف الكامل الأول من الجدول) يحتوي الجدول الدوري على عناصر تحتوي على عدد صغير من النكليونات. تسمح لنا الذرات صغيرة الحجم في هذه الفترات بالنظر في هذه النماذج المكانية التي تتوافق مع الأشكال الفريدة التي يمكن أن تحدد اتجاه بناء النماذج الذرية لجميع الفترات اللاحقة (انظر الشكل 7). علاوة على ذلك ، يمكن اعتبار خيار المحاكاة الأكثر عقلانية زيادة تدريجية في طول حلقة Atom الرئيسية المشحونة ، مما يكمله بتكوين نووي أقصى من النوكليونات الخارجية (المعدنية) داخل الحلقة (غير المعدنية) وفقًا لحالتها الكيميائية ، ثم ابحث عن تناظرية من جدول مراسلات النوكليون للعناصر الكيميائية .1. الهيدروجين (11H) 1proton (1p). المادة الحرة لها شكل H2.
لا يتطلب بناء ذرة الهيدروجين أي جهد ، لأنه يتكون ببساطة من كرة بروتون واحدة. بسبب التدفق المغناطيسي المفتوح ، يكون الهيدروجين الأحادي نشطًا للغاية ، مما يتسبب في تفاعله مع أقرب المواد الحرة أو الاتصال بذرات الهيدروجين الأخرى لحالة حلقة مغلقة مستقرة.
الديوتيريوم (21D) 1 بروتون + 1 نيوترون (1p + 1n) - النموذج أيضًا لا لبس فيه على شكل كراتين تلتصق ببعضهما البعض.
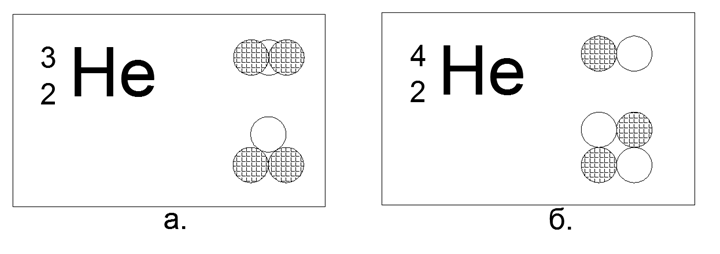
2. الهيليوم (42He) 2 البروتونات + 2 النيوترونات (2p + 2n)
بالنسبة إلى الهيليوم ، من الممكن بالفعل بناء العديد من الخيارات لنماذج هيكل النواة:
- خطي - أربعة نيوكليونات متتالية ،
- Flat (Square) - أربعة نكليونات في زوايا مربع مسطح ،
- المكاني (رباعي السطوح) - أربعة النوكليونات في زوايا متعدد السطوح رباعي السطوح الحجمي.
في هذه الحالة ، من بين 4 كرات مغناطيسية ، من الممكن فقط بناء شكل مربع مسطح من اللب. شكل رباعي السطوح على القوى المغناطيسية لا يحمل ، يتحول على الفور إلى مربع.
في المستقبل ، سوف نركز فقط على الأشكال المكانية للذرات ، لأن المتغيرات الخطية في الذرات الأكثر كثافة لن تكون قادرة على إعطاء أي تجسيد ذي معنى.
نظير الهيليوم النادر (32) 2 بروتون + 1 نيوترون (2p + n)
في هذا التكوين ، فقط مثلث مسطح ممكن.
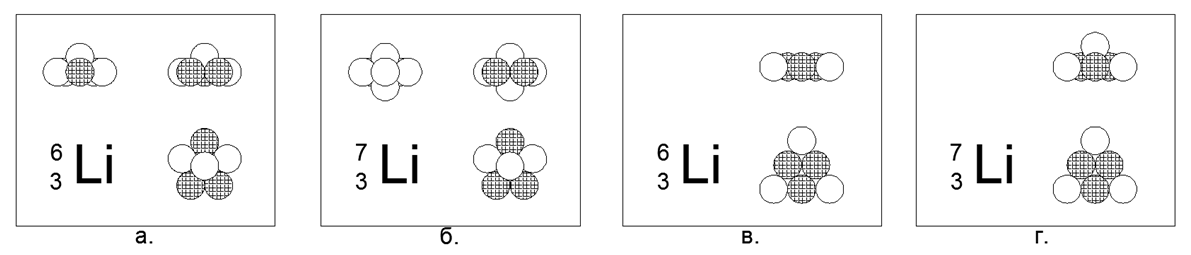
3. الليثيوم (73Li) -7 النوكليونات (3p + 4n)
بالنسبة إلى Lithium ، من الممكن إنشاء نموذج مسطح وثلاثي الأبعاد للذرة.
النموذج المسطح عبارة عن مسدس به نواة واحدة في المنتصف ، ونموذج الحجم عبارة عن خماسي مسطح به كرتان عند القطبين (البولنديون عبارة عن نقاط في نهايات محور دوران الجزء الرئيسي غير المتماثل من نموذج النواة الذرية). معدن الليثيوم ، خفيف جدًا (0.534 جم / سم 3) ، ذوبان منخفض نسبيًا (Tm = 454K). يمكن على غرار النظير المستقر النادر الليثيوم (63Li) -6 النوكليونات (3p + 3n) في كلا النموذجين ، لذلك لا يمكن اتخاذ القرار لصالح أي نموذج.
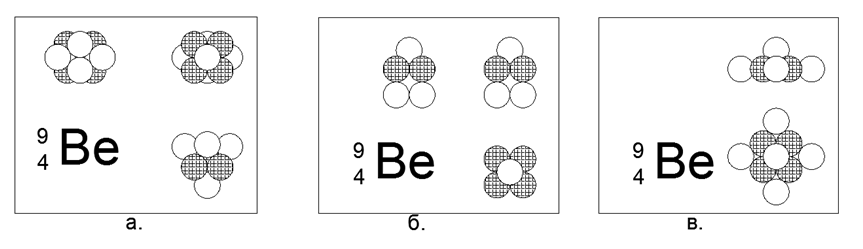
4. البريليوم (94Be) - 9 نيوكليونات (4p + 5n).
النظير الوحيد المستقر طويل العمر. هناك نظير طويل العمر نسبيًا البريليوم (104Be) - 10 نكليونات (4p + 6n) مع عمر نصف يبلغ 1.4 مليار سنة. العديد من التطبيقات ممكنة. الشكل الأكثر ثباتًا وصغرًا في الأحاسيس يشبه شكل نجمة من مثلثين متصلين بالطائرات في المنشور ، حيث يتم تثبيت كرة واحدة على الوجوه الجانبية للمنشور الثلاثي. البريليوم معدن ، خفيف (1.848 جم / سم 3) ، حراري نسبياً (Tm = 1551K). في المستقبل ، سيتم تتبع شكل النجوم في معظم المعادن. عند إضافة الكرة العاشرة إلى الهيكل الناتج ، يتم تعديل الشكل نفسه إلى شكل آخر على شكل نجمة ، ولكن غير متماثل في المستوى. يمكن وصف الشكل الجديد بنجمة سداسية الأضلاع ذات مركز ممتلئ ، إلى المستوى الجانبي الذي رست فيه مثلث من كرات النوكليون. عند النظر على طول محور "النجمة" على كلا نظري نظائر البريليوم ، يكون النجم ثلاثي الاتجاه من نوع واحد مرئيًا بوضوح ، والذي يحدد الخصائص الخارجية الأساسية للمواد البسيطة.
5. البورون (115Be) - 11 نيوكليونات (5p + 6n).
النظائر المستقرة الطويلة 10B و 11B. يتكون التكوين المكاني 10B من حلقتين خماسية متصلة في نفس الوقت في الاتجاه المتزامن أو المعاكس للتدفق المغناطيسي. يتبع التكوين المكاني 11B هيكل 10B ، يضاف نيوترون واحد فقط على طول محور الحلقات.
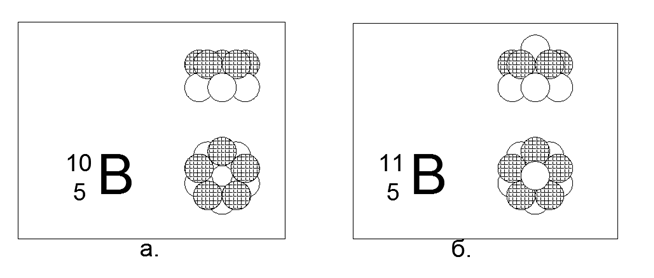
وبالتالي ، يمكن افتراض أن المواد غير المعدنية تختلف عن المعدن في شكله الخارجي الرئيسي: غير المعدن عبارة عن أسطوانة من حلقات من نفس النوع ، والمعدن شكل معين على شكل نجمة (شكل قرص).
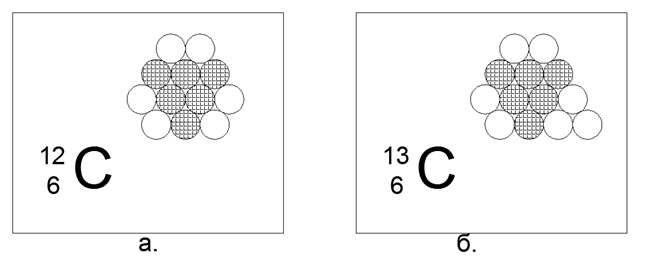
6. الكربون (126 درجة مئوية) - 12 نيوكليونا (6p + 6n).
النظائر المستقرة طويلة العمر 12 درجة مئوية (98.93٪) و 13 درجة مئوية (1.07٪) ، بالإضافة إلى النظائر المشعة 14 درجة مئوية. عنصر مثير للاهتمام للغاية ، وهو واسع الانتشار ولديه مجموعة لا نهائية من الأشكال الهيكلية في الطبيعة (الجرافيت والماس والفحم والسخام والبنى التحتية النانوية ، وما إلى ذلك) يتطلب هذا المحتوى المكون من بنية بنية مكونة من 12 كرة تحتوي على بعض الخصائص الخاصة المذهلة. قد يتحول مثل هذا الهيكل إلى مسدس مسطح غير متساوي الأضلاع به ثلاث كرات في الوسط.
يتم ترتيب النوكليونات المشحونة في مثلث ، على جانبيها ثلاثة أزواج من النيوترونات متصلة. والنتيجة هي تناسق ثلاثي الشعاع ، حيث يوجد على محاور التناظر نيوترونات خارجية جاهزة للتوصيل المغناطيسي للذرات الأخرى. يتم وضع طبقات الجرافيت ، أو سطح الأنابيب النانوية والهياكل الكبيرة من الهياكل المغلقة للفوليرين ، بسهولة من هذه السداسي.
 شكل منظر لطبقة من الجرافين (الجرافيت) تتكون من ذرات الكربون المستوية السداسية C12.
شكل منظر لطبقة من الجرافين (الجرافيت) تتكون من ذرات الكربون المستوية السداسية C12.بين المواد غير المعدنية ، يتم تمييز المواد التي تعتبر غازات في الظروف العادية بشكل خاص. هذه هي الغازات الخاملة أحادية الذرة (النبيلة) ، النيتروجين والأكسجين في الغلاف الجوي ثنائي الذرة ، والهالوجين ثنائي الهالوجين الفعال.
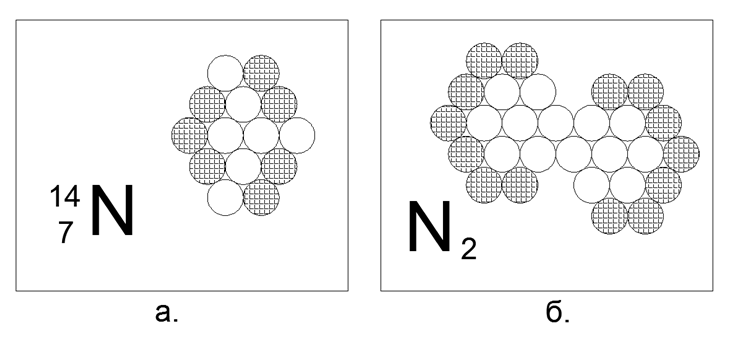
7. النيتروجين (147N) - 14 نكليون (7p + 7n).
النظائر المستقرة الطويلة العمر 14N و 15N. في حالة الحر في ظل ظروف طبيعية ، يكون النيتروجين غاز ثنائي الذرة ، مع نشاط ضئيل للغاية. الغلاف الجوي لكوكبنا هو 78 ٪ من النيتروجين. لامتلاك خاصية الغاز تحت Nu تتطلب الذرة وجود نيكلونات مشحونة على المحيط الخارجي ، دون انقطاع في النيوترونات المقترنة. ولكن نظرًا لأن الغاز ليس سوى جزيء ثنائي الذرة ، فهذا يعني أنه في بنية الذرة توجد منطقة نشطة مغناطيسيًا مكونة من اثنين أو ثلاثة نيوترونات متتالية على الحدود الخارجية ، حيث ترتبط ذرات النيتروجين بجزيء N2. يتم تجميع هذا الشكل المكون من 14 ذرة بسهولة في شكل مسدس غير متساوي الأضلاع ، على غرار المعين ، حيث تكون المؤامرة التي تحتوي على ثلاثة نيوترونات متتالية على محيط خارجي للذرة طبيعية حقًا. الرابطة في جزيء N2 قوية للغاية بحيث يبقى الغاز في الحالة الجزيئية حتى عند 5000 درجة مئوية.
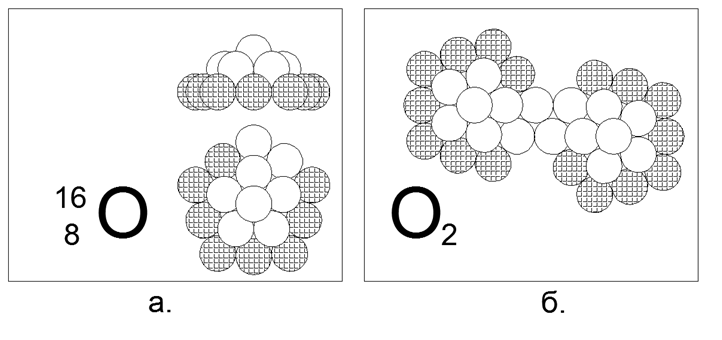
8. الأكسجين (168) - 16 النوكليونات (8p + 8n).
النظائر المستقرة الطويلة العمر 17 و 18. الشكل المفترض لنظير 16 الأكثر شيوعًا (99.7٪) هو 5 غرات من عشرة نوكلونات (8 مشحونة ، 2 محايدة) ، مع وجود فجوة تلامس مغناطيسي محايد مغناطيسي واضح في الحلقة الخارجية ذات العشر ذرات. تتكون الطبقة الداخلية من حلقة ذات 5 نيوكليونات مع نيوكليون إضافي سادس عشر في الوسط. لا يمكن ضم حلقات 10 و 5 النوكليون في الطائرة ، وبالتالي إنشاء شكل القبة المكانية. يتم إنشاء النظائر عن طريق التقاط نيوترونات إضافية في الوسط تحت "القبة". يضمن وجود فجوة خارجية ثنائية النوكليون في الحلقة إنشاء جزيء ثنائي أكسيد O2. قوة الرابطة داخل جزيء O2 أضعف بكثير من النيتروجين ، وبالتالي الأكسجين أكثر نشاطًا بكثير ويدخل تفاعل الأكسدة (الاحتراق) في درجات حرارة منخفضة إلى حد ما.
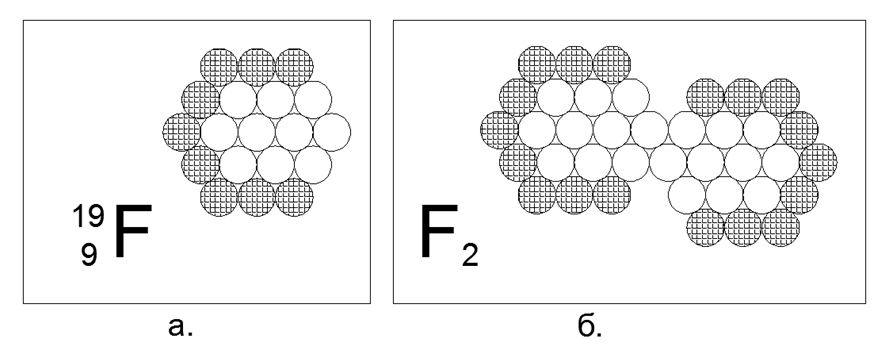
9. الفلور (199F) - 19 نوكليونات (9p + 10n).
لا يوجد سوى نظير مستقر واحد ، يعيش بشكل غير مستقر من كسور من الثواني إلى وحدات من الساعات. الشكل المفترض للهيكل: مسدس مسطح يتكون من 12 حلقة و 6 حلقات نيوكليون ونوكليون 19 في الوسط. يؤدي عدم وجود نيوكليونات مشحونة في الحلقة الخارجية إلى إنشاء منطقة جذب مغناطيسي مكونة من ثلاثة نيوكليونات محايدة ، مما يجعل من الممكن إنشاء جزيء ثنائي الذرة F2 ، وبعد ذلك تعرض المادة خصائص الغاز في ظل الظروف العادية. غاز الفلورين -2 المبرد ، أي أنه يصبح سائلاً فقط في درجات حرارة منخفضة للغاية (85K أو -188 C) ، مما يجعله مشابهًا لخصائص الغازين الثنائيين السابقين.
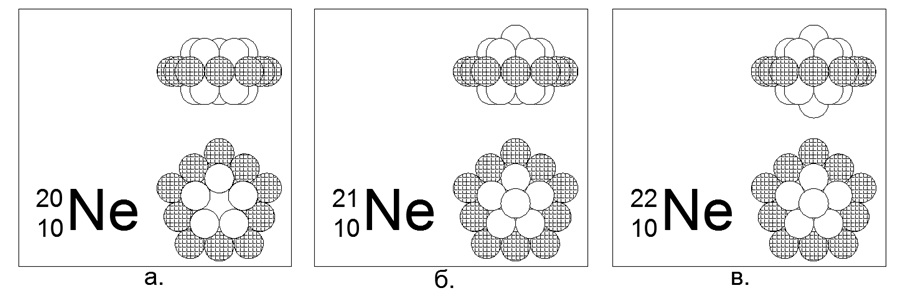
10. نيون (2010He) - 20 نيوكليون (10p + 10n) محتوى بطبيعته 90.47 ٪.
نظائر مستقرة طويلة العمر 21He (9.25 ٪) و 22He (0.27 ٪). الهيكل الأساسي المقدر: الحلقة الخارجية المشحونة بـ 10 نيكل بالإضافة إلى حلقتين داخليتين متداخلتين من 5 نيوكليونات.
يتم إنشاء النظائر 21 و 22 عن طريق إضافة نواة واحدة إلى مركز واحدة من حلقات النوكليون 5 على طول المحور.
في الجدول 1 ، المواد ذات النظير المستقر الفردي هي الأكثر أهمية ، لأن تركيبتها الفريدة لا ينبغي أن تسمح للنواة الإضافية بامتصاصها دون إدخال تشوهات في الشكل الخارجي. وتشمل هذه المواد Beryllium-9 Metals (الشكل 7) و Sodium-23 (الشكل 6) ، والألمنيوم 27 ، وكذلك الفلور 19 غير الفلزي ، والفوسفور -31.
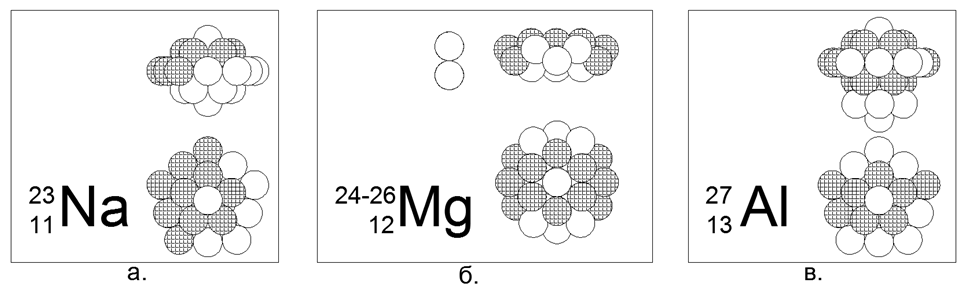
11. الصوديوم (2311Na) - 23 نوكليون (11p + 12n) - هذا هو النظير المستقر الوحيد في الطبيعة ، والذي يسمح لنا باختيار تكوين نيوكليون فريد لذلك.
من 23 كرة ، كان من الممكن إنشاء نسخة واحدة فقط من هيكل مستقر مغناطيسي كثيف متماثل على شكل قرص نجم. يتم جرح حلقة مكونة من 10 نيكلونات حول الجزء المركزي من حلقتين من 5 نيوكليونات عالقة معًا بواسطة الطائرات. داخل الجزء المركزي بين الحلقتين 5-nucleon ، يتم قيادة nucleon المركزي. هناك نواة أخرى (22 و 23) متصلة بالجانبين من الجزء المركزي على طول المحور المركزي. بشكل عام ، تشبه النواة صفارًا في شكل عدس محدب. نظرًا لحقيقة أن الحلقات ذات 5 النوكليونات والنيكلون 10 لا يمكن أن تصطف في المستوى ، فإن شكل الحلقة ذات 10 النوكليونات يتخذ شكل متعرج ، في حين أن الحلقات الداخلية ذات الـ5 نيوكليونات متباعدة قليلاً ، والتي تسمح بـ 21 نيوكليون.
12. المغنيسيوم (12Mg) - 24 ، 25 ، 26 النوكليونات.
النظائر لها انتشار 78.6 ٪ - 10.1 ٪ -11.3 ٪ ، على التوالي. وبالتالي ، فمن الواضح أن الشكل الرئيسي هو بنية تشبه القرص من حلقتين 6 نيكلون في الجزء المركزي وجرح حلقة 12 نيكلون حولها. يتم إنشاء النظائر عن طريق دفع واحد أو اثنين من النيوترونات في الأنبوب المركزي للقرص ، والذي في الحلقة ذات 6 نيكلونات تتوافق تمامًا مع حجم كرة النوكليون.
13. الألومنيوم (2713Al) - 27 نوكليون (13p + 14n) - هذا هو النظير المستقر الوحيد في الطبيعة ، والذي يسمح لك باختيار تكوين نيوكليون فريد من نوعه.
من بين 27 كرة ، تم إنشاء نسخة غير متناظرة من هيكل مستقر مغنطيسي كثيف لشكل قرص نجمة مع تعدد الحلقة 5 نيوكليونات: تم إنشاء عمود مركزي يتكون من ثلاث حلقات نيكلون وخاتم نوويون 10 خارجي ، واثنان من النوكليونات في نهاية الأنبوب المركزي. يبلغ عمر النصف للنظائر 28 و 29 نصف دقيقتين و 6 دقائق على التوالي. النظير 26 - له T1 / 2 = 717 ألف سنة ، ويتحلل بشكل طبيعي إلى مغنسيوم ثابت -26 عن طريق التقاط الإلكترون (التقاط بيتا). يحدث التوليف المستمر لـ Al-26 في الغلاف الجوي أثناء تصادم البروتونات السريعة الكونية مع ذرات الأرجون.

14. السيليكون (14Si) - 28 ، 29 ، 30 نوكليون.
النظائر لها انتشار 92.2 ٪ - 4.7 ٪ -3.1 ٪ ، على التوالي. السيليكون غير معدني. في ظل الظروف العادية ، يوجد السيليكون بأشكال مختلفة ، وكلها مواد صلبة. في شكل بلوري ، يعتبر السيليكون أشباه الموصلات ، مما يجعله يشبه الكربون من الفترة السابقة.
بالنسبة لـ 28 نكليون ، لم تكن هناك أشكال منتظمة من صف أسطواني ، مما جعل من الممكن البحث عن نموذج ذرة محتمل في سلسلة من الألواح متعددة السطوح ، مثل الكربون والنيتروجين. يتم الحصول على 28 نيوكليون من ذرتين من النيتروجين سداسي مستو متصلين بالطائرات.
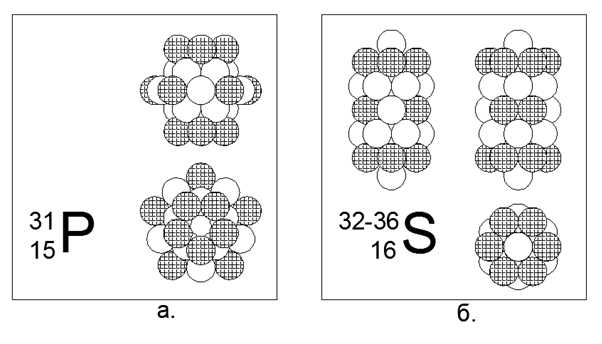
15. الفوسفور (3115P) - 31 نواة.
النظير المستقر الوحيد. غير المعدنية. الهيكل المقدر: أربع حلقات من 5 نيوكليونات في الأنبوب المركزي وحلقة خارجية من 10 نيوكليونات في منتصف الأنبوب المركزي ، والتي تعطي 30 نيوكليون ، و 31 نيوكليون يتم توجيهها إلى وسط الحلقة ذات 10 نيوكليونات ، حيث ينشأ تجويف بسبب الالتحام غير المستوي 10 حلقات 5 و 5 النوكليون. توجد التهم على 5 قطع في نهايات الأنبوب المركزي وخمس مرات بالتساوي حول الحلقة الخارجية ذات النواة العشرة.
16. الكبريت (16S) - لديه أربعة نظائر مستقرة 32 و 33 و 34 و 36 نواة.
النظائر لها انتشار 95.013 ٪ - 0.75 ٪ -4.215 ٪ -0.017 ٪ ، على التوالي. الكبريت غير معدني. نحن نفترض أن الشكل الرئيسي هو هيكل أسطواني من خمس قطع من 6 حلقات نيكلون ، في النفق المركزي الذي توضع فيه نواة نظيرية إضافية. بالنسبة إلى النظير النادر للكبريت -36 ، يصبح الهيكل غامضًا ، نظرًا لأن نويوتين أخريين بالكاد يصلحان داخل الأنبوب المركزي. لا يملأ الكبريت - 36 الأنبوب الداخلي للأسطوانة تمامًا فحسب ، بل يملأ أيضًا النواة خارج حدود الجزء الخارجي الأسطواني. يعطي هذا التكوين عادةً خصائص غير معدنية للمادة ، أي بنقاط انصهار وغليان معتدلة نسبيًا بالقرب من الظروف العادية.
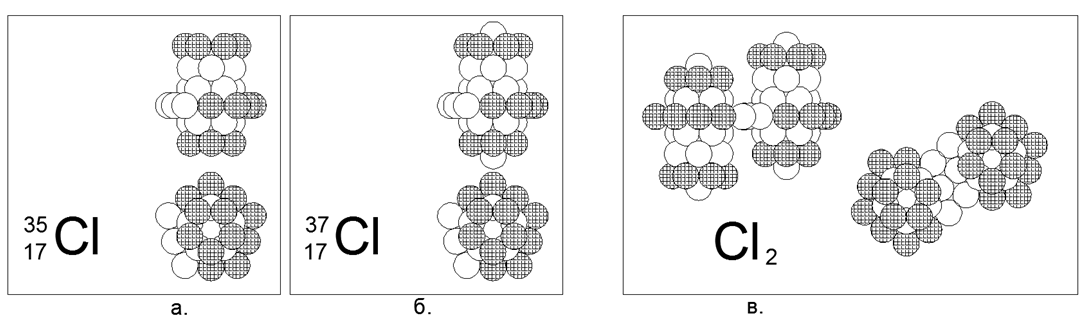
17. الكلور (17Cl) - لديه اثنين من النظائر مستقرة من 35 و 37 نيوكليونات.
النظائر لها انتشار 75 ٪ و 25 ٪ ، على التوالي. الكلور هو غاز غير دياتومي وثنائي الغاز في ظل ظروف طبيعية. نحن نفترض أن الشكل الرئيسي للغاز هو حلقة واسعة ذات 10 نكليونات مشحونة بشكل غير كامل مع بنية أسطوانية متداخلة من ثلاث حلقات نيوكليون على طول المحور حيث يتم شحن حلقات نهاية الأنبوب بالكامل. بالنسبة للنظير الثقيل Chlor-37 ، يتم ربط نواة واحدة أيضًا بنهايات الأسطوانة الرئيسية. الكلور - 36 مشع بنسبة T1 / 2 = 301 ألف سنة. الكلور -36 غير المستقر ممكن في كلا الإصدارين مع وجود نيوكليون في الطرف المفتوح للأنبوب المركزي ، مع حلقة من 10 نيوكليونات يتم توجيهها إلى الوسط. مع قرب أعداد الكتلة من الكلور والكبريت ، فإنه حتى مع وجود تقاطعات متبادلة بين أعداد النظائر (إيزوبار) ، فإن بنية النواة مختلفة اختلافًا جذريًا. وينعكس الفرق في بنية النواة أيضًا في الاختلاف القوي في الخواص الكيميائية والفيزيائية.
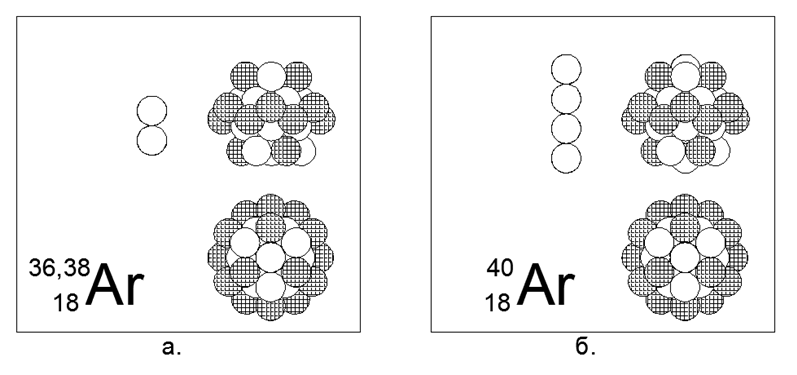
18. الأرجون (18Ar) - لديه ثلاثة نظائر مستقرة 36 و 38 و 40 نواة.
يبلغ معدل انتشار النظائر على الأرض 0.337 ٪ - 0.063 ٪ - 99.6 ٪ ، على التوالي ، على الرغم من أن التوزيع في الفضاء مختلف تماما. على الأرض ، كل الأرجون 40 مشتق من البوتاسيوم 40 المشع المتحلل. الأرجون هو غاز خامل. يمكن افتراض أن الشكل الرئيسي عبارة عن هيكل أسطواني مكون من أربع قطع من 6 حلقات نيكلون ، في النفق المركزي الذي يوضع فيه 2 أو 4 نيوكليونات إضافية من النظائر الضخمة ، وتوضع حلقة مشحونة بالكامل بـ 12 نيوكليون أعلى الأنبوب المركزي. حلقة خارجية مشحونة بالكامل Fully Charged هي سمة مميزة للغازات الخاملة ، وفقًا للنموذج النظري المطوّر لـ Atom-Nucleus.
Argon-36 هو isobar إلى Sulfur-36 (الزوج الثاني في الجدول الدوري) ، ولكن هياكل النموذج الرئيسي مختلفة بشكل كبير. يمكن افتراض أن أحد الفلزات القلوية التالية ، وهي البوتاسيوم أو الكالسيوم ، سيتضح أنه قريب من الأرجون في بنية النواة.
المجاميع.
الزيادة التدريجية في الكتلة الذرية مع الزيادة الخطية في عدد النكليونات المشحونة وفقًا للجدول الدوري مكنت من بناء سلسلة متسقة من الحلول الهيكلية للهياكل الذرية - هياكل العناصر الكيميائية المرتبطة بخصائصها الفيزيائية والكيميائية. تشمل نماذج الذرات النووية للعناصر كشرط إلزامي القدرة على بناء جميع النظائر المستقرة دون تغيير جذري في شكل الذرة.
الاستنتاج الرئيسي الذي تم الحصول عليه في هذه المرحلة هو الفكرة التالية:
على الرغم من الاختلاف في الخصائص الكيميائية للمواد الموجودة عن قرب في الجدول (على سبيل المثال: الغاز الخامل والمعادن القلوية التي تتبعه) ، فإنها تختلف هيكليا فقط في موقع النكليونات المشحونة على المحيط الخارجي للذرة أو في الصفوف الداخلية. وبالتالي ، يرتبط التغير الدوري في الخواص بالانتقال السلس لتركيز النكليونات المشحونة من المنطقة الداخلية للنواة إلى الخارج.