يتم تعريف شيخوخة الإنسان حاليًا على أنها نقص فسيولوجي في الوظائف البيولوجية في الجسم مع تكيف مستمر مع الضرر الداخلي والخارجي. يلعب نظام الغدد الصماء دورًا مهمًا في تنظيم التفاعلات الخلوية والتمثيل الغذائي والنمو والشيخوخة. وقد أظهرت العديد من الدراسات ، من الديدان إلى mishas ، أن قمع هرمون النمو / عامل نمو يشبه الأنسولين -1 / الأنسولين (GH / IGF-1 / الأنسولين) قد يكون نشاط المسار مفيدًا لإطالة عمر الشخص ، في حين أن النتائج في البشر متناقضة. في هذا الاستعراض ، نناقش الدور المحتمل لنظام IGF-1 في تعديل طول العمر ، بافتراض أن التكيف مع الغدد الصماء والتمثيل الغذائي لوحظ في المعمرين والثدييات مع تقييد السعرات الحرارية قد يكون استراتيجية فسيولوجية لزيادة متوسط العمر المتوقع بسبب تباطؤ نمو الخلايا / التمثيل الغذائي ، واستخدام أفضل للاحتياطيات الفسيولوجية ، والتحول في التمثيل الغذائي الخلوي من تكاثر الخلايا إلى الإجراءات التجددية وانخفاض في تراكم خلايا الشيخوخة.
مقدمة.تُعرَّف الشيخوخة بأنها انخفاض فسيولوجي في الوظائف البيولوجية في الجسم مع انخفاض تدريجي أو فقد للتكيف مع الضرر الداخلي والخارجي. في البشر ، النمط الظاهري للشيخوخة غير متجانس للغاية ويمكن وصفه بأنه فسيفساء معقد ناتج عن تفاعل العديد من الأحداث العشوائية والبيئية والتغيرات الوراثية والجينية المتراكمة طوال الحياة. على الرغم من تعقيدها الهائل ، إلا أن الأساس الجزيئي للشيخوخة محدود بسبب الآليات البيولوجية المحافظة القليلة التطورية المسؤولة عن الحفاظ على الجسم واستعادته (1).
على مدار العقود الثلاثة الماضية ، كان أحد أكثر المواضيع التي تمت مناقشتها في علم الشيخوخة هو دور هرمون النمو (GH) / عامل النمو الشبيه بالأنسولين -1 (IGF-1) / نظام الأنسولين في تنظيم طول العمر. تشير البيانات المتراكمة إلى أن هذا المسار يلعب دورًا مهمًا في التسبب في عدد من الأمراض المرتبطة بالعمر ، بما في ذلك السرطان والخرف وأمراض القلب والأوعية الدموية والتمثيل الغذائي (2-4).
في النماذج الحيوانية ، ثبت أن تثبيط نظام الأنسولين GH / IGF-1 / يزيد بشكل كبير من العمر الافتراضي. ومع ذلك ، في البشر البيانات متناقضة (5 ، 6).
تصف هذه المراجعة التطورات الحديثة في دراسة نظام IGF-1 وتعديل طول العمر ، وتفترض أن تكيف الغدد الصماء والتمثيل الغذائي لوحظ في المعمرين والثدييات خلال تقييد السعرات الحرارية قد يكون استراتيجية فسيولوجية لزيادة متوسط العمر المتوقع بسبب تباطؤ نمو الخلايا / التمثيل الغذائي ، تحكم أفضل في نقل الإشارات وقدرات الاحتياطي الفسيولوجي ، وتقليل تراكم خلايا الشيخوخة.
نظام IGF-1 والمتانة في النماذج الحيوانية
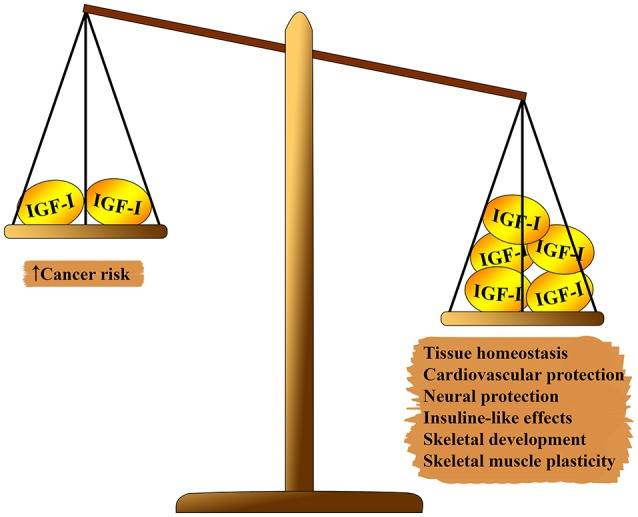 الشكل 1: تأثير متعدد التأثيرات من IGF-1 على الجسم. على جانب واحد من المقياس ، الذي يفوق: توازن الأنسجة ، والآثار القلبية والوقاية العصبية ، والآثار الشبيهة بالأنسولين ، والمشاركة في تشكيل الهيكل العظمي وتجديد العضلات. على الجانب الثاني من التوازن: خطر التسرطن.
الشكل 1: تأثير متعدد التأثيرات من IGF-1 على الجسم. على جانب واحد من المقياس ، الذي يفوق: توازن الأنسجة ، والآثار القلبية والوقاية العصبية ، والآثار الشبيهة بالأنسولين ، والمشاركة في تشكيل الهيكل العظمي وتجديد العضلات. على الجانب الثاني من التوازن: خطر التسرطن.يحتوي نظام IGF-1 على العديد من التأثيرات متعددة التأثيرات على الشيخوخة البيولوجية (انظر الشكل 1). يلعب IGF-1 دورًا مهمًا في نمو الجنين ونموه في مرحلة الطفولة والمراهقة وتوازن أنسجة البالغين. بالإضافة إلى ذلك ، IGF-1 ، على ما يبدو ، له تأثير تصلب الشرايين ، وتأثير وقائي عصبي شبيه بالأنسولين (بتركيزات عالية) ، وينظم استقلاب العظام وتجديد العضلات. ومع ذلك ، فإن IGF-1 عامل خطر رئيسي في تطور عدة أنواع من الأورام بسبب نشاطها التكاثري القوي ، ويرجع ذلك أساسا إلى تعديل دورة الخلية ، موت الخلايا المبرمج وبقاء الخلية (7 - 9). يتم التوسط في معظم هذه الآثار من خلال التفاعل مع ركيزة مستقبلات الأنسولين (IRS) -1 و -2 وتعديل المسار المستهدف للراباميسين PI3K / AKT / الثدييات (mTOR) (انظر الشكل 2)
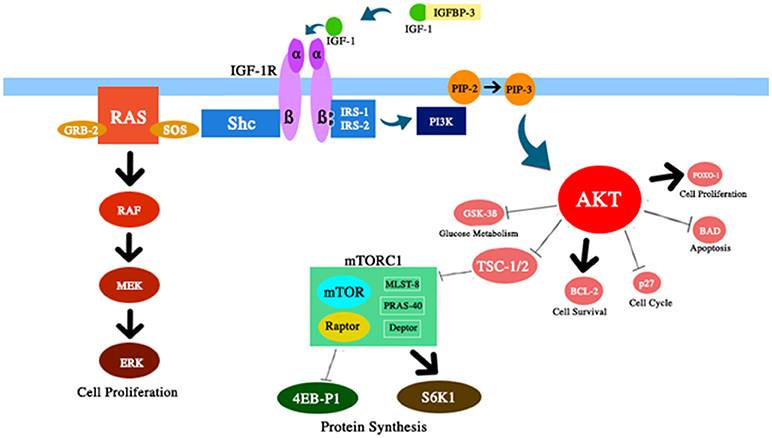 الشكل 2 الشكل 2. تمثيل تخطيطي للعديد من مكونات مسار IGF-1 / PI3K / AKT / mTOR التي نوقشت في هذا الاستعراض. يعزز IGF-1 نشاط AKT مع التأثيرات المقابلة على بقاء الخلية وانتشارها ، وأيض الجلوكوز ، وتخليق البروتين.
الشكل 2 الشكل 2. تمثيل تخطيطي للعديد من مكونات مسار IGF-1 / PI3K / AKT / mTOR التي نوقشت في هذا الاستعراض. يعزز IGF-1 نشاط AKT مع التأثيرات المقابلة على بقاء الخلية وانتشارها ، وأيض الجلوكوز ، وتخليق البروتين.
ذكرت العديد من الدراسات قبل السريرية أن الطفرات في الجينات التي تتحكم في مسار إشارات GH / IGF-1 / الأنسولين يمكن أن تزيد بشكل كبير من العمر في كل من النماذج الحيوانية للفقاريات والفقاريات (5 ، 6).
نماذج اللافقاريات.في اللافقاريات ، يتم تنظيم سلسلة الأنسولين / التي تشبه IGF بواسطة العديد من الببتيدات القادرة على التفاعل مع مستقبلات الأنسولين / IGF-1 الشائعة.
في المسار الخيطي Caenorhabditis elegans ، يتكون المسار الذي يشبه الأنسولين / IGF من عدة بروتينات مشفرة بواسطة جينات daf-2 ، العمر 1 (تشفير الوحدة الفرعية الحفزية PI3K) ، akt-1 ، akt-2 ، pdk-1 ، sgk-1 ) ، daf-16 ، skn-1 و daf-18 (PTEN ، الفوسفاتيز المتورط في تثبيط مسار إشارة AKT). لقد تبيّن أن النشاط المنخفض للجينات daf-2 ، والعمر 1 ، و akt-1 ، و akt-2 ، و pdk-1 ، و sgk-1 يقمع هذا المسار ، وقد تم الإبلاغ عن عمر الحيوانات التي بها هذه الطفرات ببطء أكبر وتمتد فترة حياتها تصل إلى 300 ٪. في المقابل ، فإن تحفيز مسار الأنسولين / مثل IGF يقلل من عمر الديدان الخيطية (10 ، 11).
في ذبابة الفاكهة ذبابة الفاكهة السوداء ، تتكون إشارة تشبه الأنسولين / IGF من DINR (بروتين يشبه مستقبلات الأنسولين / IGF-1) ، ركيزة مستقبلات الأنسولين CHICO ، PI3K Dp110 / p60 ، و PK3 PI3K. وأفيد أن الذباب مع طفرة في هذه الجينات زاد بشكل كبير متوسط العمر المتوقع (12 ، 13).
والمثير للدهشة أن نفس الآليات الجزيئية في الأنسجة المختلفة لا تؤثر على الشيخوخة بنفس الطريقة. أظهرت العديد من الدراسات التي أجريت على النيماتودا وذباب الفاكهة أن النقص في الإشارات التي تشبه الأنسولين / IGF في الأنسجة العصبية والأنسجة الدهنية تلعب دورًا رئيسيًا في تنظيم طول العمر (14 ، 15). على الرغم من أنه قد تبين في نماذج اللافقاريات أن هذا الشلال مهم لتعديل عمر الإنسان ، إلا أن تأثيرات إشارة تشبه الأنسولين / IGF على عمر الإنسان أكثر تعقيدًا في الفقاريات لأنها تحتوي على جزيئات الأنسولين وجزيئات IGF المحددة وظيفيًا وبروتينات ربط IGF (IGFBPs) ) ، IGFBP ، البروتياز GH ، مستقبلات متعددة ، وعدة آليات لنقل إشارة داخل الخلايا مع تعبير مختلف الأنسجة محددة (16).
نماذج الفقارياتتم تصميم العديد من الفئران متحولة GH / IGF-1 مع أهداف مختلفة. يتم وصف النماذج الأكثر حداثة أدناه.
الفئران سنيل و أميس.الفئران Snell و Ames نوعان من سلالات الماوس مع طفرات في الجينات PIT-1 و PROP-1 ، على التوالي (17 ، 18). نظرًا لأن كلا البروتينين PIT-1 و PROP-1 ضروريان للتمايز بين الخلايا النخامية التي تنتج هرمون GH والبرولاكتين والغدة الدرقية ، فإن كلا الفئران المتحولة متماثل الزيجوت يفتقران إلى الهرمونات الثلاثة (18). أظهرت هذه النماذج زيادة كبيرة في متوسط العمر المتوقع (42-70 ٪ أكثر من الفئران من النوع البري) ، وزيادة حساسية الأنسولين وتكرار الورم أقل (19 ، 20). عندما تم تقييد الفئران أميس في السعرات الحرارية ، زاد عمرهم أكثر (21). على الرغم من أن هذه الحيوانات تفتقر إلى ثلاثة هرمونات ، فقد ثبت أن زيادة طول العمر يعتمد بشكل رئيسي على نقص هرمون النمو (22).
مضاءة / مضاءة الماوسالفئران المضاءة / المضاءة لديها نقص هرمون النمو وطفرة في الجين الذي يشفر مستقبلات هرمون هرمون النمو (GHHR). كانت هذه الحيوانات الأقزام ، وزادت الأنسجة الدهنية ، وانخفاض معدلات الورم ، والعمر المتوقع بنسبة 23-25 ٪ (19).
GH-Release Hormone-Knockout (GHRH-KO) الماوس.يعيش هرمون الإفراج عن هرمون النمو (GHRH-KO) في الفئران القاضية بنسبة 43٪ (عند الإناث) و 51٪ (عند الذكور) لفترة أطول من الحيوانات البرية وله العديد من الخصائص المظهرية لفئران أميس ، مثل فرط الحساسية ل الأنسولين ، انخفاض في مستويات الدهون الثلاثية في الكوليسترول في الدم ومستويات الكوليسترول في الدم ، وزيادة في الأنسجة الدهنية ، وارتفاع مستويات هرمون الليبتين في البلازما ومستويات الأديبونيكتين (23).
GH-Receptor-Knockout Mice (GHR-KO)الفئران بالضربة القاضية لمستقبلات GH (GHR-KO) لديها مستويات مرتفعة من GH في الدم ومستويات IGF-1 منخفضة جدًا. وأفيد أيضًا أن هذه السلالة من الفئران عاشت ما بين 38 إلى 55٪ أطول من النوع البري (24) وأظهرت انخفاضًا في الإجهاد التأكسدي ، وكذلك ظهور انخفاض أو تأخير في الأورام القاتلة (25). وقد لوحظت نتائج مماثلة في الفئران df / KO ، عبرت خيطين من ميشا ، GHR-KO و Ames dwarfs ، التي كانت تفتقر إلى مستقبلات GH و GH واستمرت في زيادة متوسط العمر المتوقع (26). على عكس الأشقاء البرية أميس والفئران القزمية ، لم يؤدي تقييد السعرات الحرارية إلى زيادة عمر الفئران في GHR-KO ، مما يشير إلى أن محور GH / IGF-1 وتقييد السعرات الحرارية قد يكون لهما آليات مماثلة أو متداخلة جزئيًا لتمديد عمر المستخدم (27) .
GH Receptor Antagonism (GHA)لا تظهر جميع النماذج الحيوانية مع قمع نظام GH / IGF-1 زيادة في متوسط العمر المتوقع. سلالة GHA من الفئران هي مثال واحد من هذه الأمثلة. GHA ، الذي تم إنشاؤه باستبدال أحد الأحماض الأمينية ، قادر على ربط مستقبلات GH بنفس درجة تقارب GH ، لكنه لا يسبب إشارات داخل الخلايا. لم العمر المتوقع من الفئران GHA لا زيادة كبيرة (28).
IGF-1R +/– الفئرانبينما تموت معظم الفئران التي لها مستقبل IGF-1 غير نشط (IGF-1R - / -) عند الولادة ، أظهرت الحيوانات غير المتجانسة بالنسبة للأليل المتحور لمستقبلات IGF-1 (IGF-1R ±) مستويات منخفضة جدًا من المصل IGF-1 ، حوالي 10 ٪ أصغر و 33 ٪ أطول من العمر المتوقع في الإناث و 16 ٪ في الذكور. ومع ذلك ، في هذه الدراسة ، نجا الضوابط من النوع البري إلى 19 شهرا ، مما يهدد تفسير النتائج (29). أظهرت دراسات حديثة تقيّم متوسط العمر المتوقع في خط IGF-1R a زيادة طفيفة في متوسط العمر المتوقع بنسبة 5-10 ٪ ، ولكن فقط عند الإناث (30 ، 31). بالإضافة إلى ذلك ، يبدو أن سلالة الخلفية الرئيسية تؤثر على درجة امتداد الحياة في العديد من نماذج الماوس (32).
A IGF1-R +/− الخاص بالدماغعاشت IGF1-R +/− الفئران المتحولة الخاصة بالدماغ لفترة أطول بنسبة 9٪ من النوع البري ، وهو ما يؤكد الدور المقابل للجهاز العصبي في تعديل طول العمر (33).
الفئران تعطلت IGF-1 الخاصة بالكبد (LI-IGF-1 - / -).الفئران التي تعاني من ضعف إنتاج IGF-1 (LI-IGF-1 - / -) لديها مستويات مصل منخفضة جدًا من IGF-1 ومستويات عالية من GH في مصل الدم بسبب عدم تنشيط جين IGF-1. LI-IGF-1 - / - لقد خفضت الفئران بشكل ملحوظ السمنة ، ونتيجة لذلك ، كان الوزن أقل بنسبة 25 ٪ من الفئران من النوع البري. وأظهرت الإناث فقط LI-IGF-1 - / - الفئران زيادة في متوسط العمر المتوقع من 16 ٪ مقارنة مع الفئران السيطرة (34).
بابا - / - الفئران.Pappa - / - الفئران لديها خروج المغلوب من الجينات لبروتين البلازما المرتبطة بالحمل A ، PAPP-A ، PAPPA ، بروتياز معين لبروتينات الربط IGF. وكان متوسط عمر هذه السلالة الماوس 38 ٪ أطول مقارنة مع الضوابط من النوع البري. كانت الفئران Pappa - / - أقزام ، ولكن مستويات الجلوكوز في الدم والأنسولين و IGF-1 و GH لم تختلف عن تلك الموجودة في أدوات التحكم من النوع البري ، مما يوحي بأن PAPPA يتصرف بشكل أساسي على مستوى autocrine أو paracrine. بالإضافة إلى زيادة متوسط العمر المتوقع ، أظهرت الفئران Pappa - / - انخفاض معدل الإصابة بالأورام ، وكذلك الآفات التنكسية المرتبطة بالعمر (35 ، 36).
IRS Disrupted (IRS1 - / -) الماوس.يعتبر IRS-1 و -2 وسطاء مهمين للأنسولين وكذلك لإشارات IGF-1. كانت الفئران IRS1 - / - مقاومة للأنسولين ، مع وجود عيب في انتقال إشارات الأنسولين بشكل رئيسي في الأنسجة العضلية ، وحوالي 30 ٪ أقصر من النوع البري ، والإناث فقط لديهم عمر أطول بنسبة 18 ٪ مقارنة بالحيوانات البرية (37) ). ).
كانت الفئران IRS2 - / - أيضًا مقاومة للأنسولين ، ولكن على عكس الفئران IRS1 - / ، أظهروا عيوبًا تشير إلى الأنسولين في المزيد من الأنسجة ، بما في ذلك الكبد والأنسجة الدهنية والعضلات الهيكلية. وضعت هذه الفئران مرض السكري ، وكان عمرهم أقصر بكثير من عمر الفئران من النوع البري والفئران IRS2. حسنت الفئران IRS2 +/− حساسية الأنسولين وزيادة متوسط العمر المتوقع (+ 18 ٪) مقارنة مع الفئران من النوع البري. بالإضافة إلى ذلك ، تم الإبلاغ عن أن الفئران الخاصة بالدماغ IRS2 ± و IRS2 - / - تقاومان الأنسولين وتعيشان بنسبة 18٪ و 14٪ أطول من عناصر التحكم في النوع البري ، على التوالي (38).
كلوثو الفئران المعدلة.يثبط بروتين KLOTHO الأنسولين وإشارات IGF-1 ، ربما عن طريق تعطيل تفاعل المستقبلات / يجند. تم الإبلاغ عن أن الفئران المصابة بالإفراط في التعبير KLOTHO كانت ذات حجم طبيعي ، وتم تطوير مقاومة الأنسولين عند الذكور ، وزاد متوسط العمر المتوقع عند كل من الذكور والإناث زيادة كبيرة (+18 و + 30 ٪ ، على التوالي) (39 ، 40).
P66shc Disrupted Mouse (P66shc - / -).P66shc هو بروتين يتوسط إشارات IGF-1 بعد المستقبلات عن طريق تنشيط مسار MAPK. P66shc - / - كان لدى الفئران النمط الظاهري العادي ، ولكنها عاشت 28 ٪ أطول من الضوابط من النوع البري (41). ومع ذلك ، لم يتم تأكيد هذه البيانات في دراسة حديثة (42).
تمت دراسة دور إشارات GH / IGF-1 / الأنسولين في الشيخوخة وطول العمر في جميع هذه النماذج الحيوانية. في حين أن اللافقاريات ، كان تأثير كبت مسار IGF-1 / الأنسولين على متوسط العمر المتوقع واضحًا وهامًا ، في نماذج الماوس ضعفت ولم تكن قابلة للتكرار في بعض الحالات ، كما هو الحال في خطوط IGF-1R ± و P66shc - / - الفئران. ومع ذلك ، فقد أظهرت معظم هذه النماذج بعض الميزات الشائعة بين الفئران طويلة العمر ، مثل انخفاض مستويات تعميم IGF-1 والأنسولين وزيادة حساسية الأنسولين ، والتي من المحتمل أن تقلل من الإصابة بالسرطان ، وتحسن من مقاومة الإجهاد وتطيل العمر. . يمكن للتغيرات الوراثية التي يمكن أن تعطل نظام IGF-1 أن تبقي الحيوانات في صحة جيدة لفترات أطول ويمكن أن تؤخر أو تخفف بعض الأمراض المرتبطة بالعمر. في هذه العملية ، تلعب الأنسجة العصبية والدسمة دورا هاما.
بالإضافة إلى ذلك ، هناك حاجة إلى بيانات إضافية لتحديد أفضل نقطة زمنية خلال فترة الحياة للتدخل في قمع نظام IGF-1 للحصول على تأثير إيجابي على فترة الحياة. في الفئران IGF f / f C57B l / 6 ، زاد نقص IGF-1 المنتشر ، بدءًا من 5 أشهر من العمر أو قبل ذلك ، متوسط العمر المتوقع بنسبة 15٪ فقط في الإناث مع انخفاض عدد الأعضاء المصابة بأمراض في نهاية العمر مقارنة مع مجموعة التحكم . بالإضافة إلى ذلك ، أدى نقص IGF-1 المتأخر (15 شهرًا) إلى تقليل خطر الإصابة بالسرطان ، ولكن لم يكن له تأثير إيجابي على متوسط العمر المتوقع (43). تؤكد هذه البيانات على أهمية نقص IGF-1 في سن مبكرة لزيادة متوسط العمر المتوقع. من ناحية أخرى ، ماو وآخرون. (44) أبلغت مؤخرًا أن الإدارة المتأخرة لفئران CB6F1 البالغة من العمر 18 شهرًا مع الجسم المضاد أحادي النسيلة الموجه ضد مستقبلات IGF-1 قد مددت عمر الإناث بنسبة 9٪ وحسنت بعض جوانب الصحة.
نظام IGF-1 في حياة الناس
يعتبر المئويون المئويون أفضل نموذج إنساني لدراسة المحددات البيولوجية لطول العمر ، والتي وصلت إلى أكثر القيم تطرفًا في متوسط العمر المتوقع عند الإنسان (45).
قارنت العديد من الدراسات مستويات الأنسولين المتداولة و IGF-1 في الكبد الطويل مع تلك الموجودة في عناصر التحكم الشابة (46).
إعادة عرض الأيض المرتبطة بالعمر هي عملية فسيولوجية تحدث في جميع السكان. غالبًا ما يرتبط الشيخوخة بانخفاض في تحمل الجلوكوز ، وهو ما يرتبط بزيادة مقاومة الأنسولين (47) ، ولكن الأشخاص طويل العمر لديهم استثناء. لقد وجد (48) أن مقاومة الأنسولين تزداد مع تقدم العمر وتنخفض لدى الأشخاص الذين تزيد أعمارهم عن 90 عامًا في جنوب إيطاليا. في الواقع ، أظهرت الموضوعات طويلة العمر حساسية أعلى للأنسولين ووظيفة خلايا بيتا أفضل من الأشخاص الأصغر سنًا. هذا الاختلاف أيضا لا يعتمد على العوامل البشرية الرئيسية والتمثيل الغذائي. في المرضى الذين يبلغون من العمر 100 عام ، كان تركيز الجلوكوز في البلازما لمدة ساعتين أقل منه في كبار السن (متوسط العمر 78 عامًا). في الكبد الطويل ، كان استهلاك الجلوكوز الذي يتوسط فيه الأنسولين أعلى منه في المرضى المسنين أثناء امتصاص الجلوكوز القبيح ، والذي حافظ على تحمل الجلوكوز المحفوظ وعمل الأنسولين في هذه المجموعة طويلة العمر (49 ، 50). وقد لوحظت نتائج مماثلة تؤكد أفضل حساسية للأنسولين لدى السكان الآخرين في الكبد الطويل (51 ، 52).
بالإضافة إلى ذلك ، أظهر الكبد الطويل التأثير المحفوظ للأنسولين ليس فقط على أيض الجلوكوز ، ولكن أيضًا على الأنسجة الدهنية. في الواقع ، عادة ما يرتبط تسريب الأنسولين بتثبيط انحلال الدهون ، وبالتالي ، مع انخفاض كبير في تركيز الأحماض الدهنية الحرة والدهون الثلاثية في البلازما. في الكبد الطويل ، كان النشاط المثبط للأنسولين أثناء تحلل الدهون أعلى منه في المشاركين الضابطين (متوسط العمر 78 سنة) (50).
تجدر الإشارة إلى أنه في الكبد الطويل ، مقارنةً بعناصر التحكم الخاصة بالبالغين ، لوحظ أيضًا انخفاض في درجة التعاطف ، والتي قد تترافق مع عمل أفضل للأنسولين ، وبالتالي بمستوى منخفض من الأنسولين الصائم في البلازما (53 ، 54).لا تزال البيانات الموجودة على نظام IGF-1 المتعلقة بالعمر المتوقع متناقضة في المواد طويلة العمر (46). باوليسو وآخرون. (55) وصفت زيادة نسبة IGF-1 / IGFBP-3 في البلازما في كبد طويل صحي مقارنة مع كبار السن. اقترحوا أن هذه النسبة المتزايدة تشير إلى توفر بيولوجي أعلى لـ IGF-1 ، مما يساهم في تحسن عمل الأنسولين في الكبد الطويل. بوناف وآخرون. أبلغ (56) أن الأشخاص الذين لديهم أليل A على الأقل من جين مستقبلات IGF-1 (G / A ، الكودون 1013) لديهم مستويات بلازما منخفضة من IGF-1 مجانًا وكانوا أكثر انتشارًا بين الأفراد الذين عاشوا لفترة طويلة. أراي وآخرون. (57) وصف مستويات منخفضة نسبيا من مصل الدم IGF-1 في السكان اليابانيين الذين يعيشون في كبد طويل. في هذه الفئة من السكان ، ارتبطت أدنى معدلات IGF-1 و IGFBP-3 بزيادة الوفيات (58).هذه النتائج المتضاربة ربما تعكس تعقيد نظام IGF والاختلافات العرقية في عدد السكان المسجلين. بالإضافة إلى ذلك ، تم مقارنة المعمرين في كثير من الأحيان مع مجموعة مراقبة من الموضوعات الأصغر سنا. وبالتالي ، في معظم هذه الدراسات ، كان من المستحيل استنتاج ما إذا كانت الفروق بين IGF-1 في كلا المجموعتين ترتبط مع متوسط عمر مختلف أو تعكس انخفاضًا يعتمد على العمر في فسيولوجي IGF-1. في الواقع ، هناك العديد من القيود المفروضة على دراسة الكبد الطويل: (1) انتشار منخفض (1 مئوية لكل 5-10000 نسمة) ، (2) ضعف بسبب العمر الشديد (حوالي 95 ٪ من الكبد الطويل لديه على الأقل معيار واحد للوهن) ، (3) ) عدم وجود مجموعة تحكم من نفس العمر (45 ، 59). بسبب هذه القيود ، فإن هذا النموذج البشري غير مناسب لدراسة المتغيرات المرتبطة بالعمر ،والتي قد تشارك في تعديل متوسط العمر المتوقع.أحفاد المعمرين نموذج آخر مثير للاهتمام لتحديد العوامل ذات الصلة المرتبطة طول العمر البشري والشيخوخة الصحية. تشير مجموعة متناسقة من الملاحظات في مختلف البلدان إلى أن أحفاد الكبد الطويل أكثر صحة من ممثلي نفس المجموعات السكانية (51 ، 60 ، 61) وأقل بيولوجيًا (جينيًا) من عمرهم الزمني (62). بشكل عام ، تبين هذه الدراسات أن أقارب المعمرين هم أكثر عرضة للعيش لفترة أطول ولديهم صحة جيدة (60 ، 63). بالإضافة إلى ذلك ، تتميز دراسة ذرية الكبد الطويل بميزة وجود مجموعة تحكم مناسبة ديموغرافيًا مختارة تتكون من ذرية من العمر المماثل ، حيث ولد كلا الوالدين في نفس المجموعة من المعمرين ، لكنهم ماتوا قبل بلوغ العتبة.بعد ذلك يتم تصنيف الناس على أنهم "المعمرين". هذه الاستراتيجية ضرورية لمنع آثار الفوج. وهكذا ، فإن نموذج ذرية الكبد الطويل يمكنه التغلب على بعض القيود التي توجد في دراسة الكبد الطويل (الندرة والضعف وانعدام التحكم المناسب) (60).في العديد من الدراسات ، تم تمييز نظام IGF-1 / الأنسولين في أحفاد كبد طويل وفي مجموعة التحكم المقابلة.قمنا بتقييم النشاط الحيوي المتداول لـ IGF-1 ، المقاس باستخدام مقايسة مبتكرة لتفعيل مستقبلات كيناز (KIRA) تم إجراؤها على كبد طويل ، أحفاد كبد طويل ، وذرية تحكم قابلة للمقارنة. كان لذرية الكبد الطويل والكبد الطويل نشاط بيولوجي منخفض نسبياً لـ IGF-1 مقارنةً بمجموعة الضبط. ومن المثير للاهتمام ، أن النشاط البيولوجي لـ IGF-1 في أحفاد كبد طويل كان مرتبطًا عكسياً بحساسية الأنسولين (51).سوه وآخرون. (64) تقييم مستويات المصل IGF-1 في أحفاد المعمرين اليهود الأشكنازي وفي ضوابط قابلة للمقارنة العمر. في الأطفال الإناث طويل العمر ، كان المصل IGF-1 أعلى بنسبة 35 ٪ من المشاركين في السيطرة. قد يمثل هذا الاختلاف استجابة تعويضية لانخفاض في إشارات مستقبلات IGF-1. بالإضافة إلى ذلك ، وصف الوجود اليهودي لأوسطاء الأشكنازي الوجود المفرط للطفرات غير المتجانسة في جين مستقبلات IGF-1 جنبًا إلى جنب مع مستويات IGF-1 في المصل عالية نسبيًا ونقص نشاط مستقبلات IGF-1 مقارنةً بمجموعة التحكم دون طول عمر الأسرة.لدراسة طول العمر ، فحص مؤلفون آخرون الإخوة والأخوات البالغ من العمر تسعين عامًا وذريتهم. في دراسة ليدن عن طول العمر ، تم اختيار 421 أسرة ، تتألف من صحفيين وشقيقين وشقيقات على الأقل ، وأحفادهم وشريكهم من أحفادهم. في هذه المجتمعات ، كانت نسبة الجلوكوز في الدم والأنسولين والدهون الثلاثية هي أفضل علامة بيولوجية للشيخوخة الصحية (كانت مستويات الجلوكوز والأنسولين المنخفضة تعتبر صحية) (65). وارتبط الذين يبلغون من العمر تسع سنوات في أدنى نسبة IGF-1 / IGFBP-3 في مجرى الدم مع بقاء أفضل (66). أظهر أحفاد الأطفال في سن التاسعة حساسية أفضل للأنسولين مقارنة بشركائهم ، بينما لوحظت مستويات مماثلة من مصل الصيام IGF-1 و IGFBP-3 في كلا المجموعتين الصائمتين (67). ومن المثير للاهتمام،أن إفراز هرمون النمو الكلي لمدة 24 ساعة كان أقل بنسبة 28 ٪ في النسل مقارنة مع السيطرة (68).هناك طريقة أخرى تم اتباعها لدراسة طول العمر عند البشر وهي اختيار المكونات العائلية لطول العمر الاستثنائي والشيخوخة الصحية استنادًا إلى معايير صارمة ، مثل دراسة العائلة الطويلة في الحياة ، وهي مقياس لمدى الحياة الأسرية. وتمت مقارنة هذه الأسر ، التي تم اختيارها من أجل متوسط العمر المتوقع الاستثنائي ، مع مجموعة مراقبة دون تاريخ عائلي من طول العمر (69). في هذه الفئة من السكان ، أثبتت المستويات المتداولة لـ IGF-1 أنها علامة بيولوجية موثوقة مرتبطة بالعمر (70).لدعم الدور المحتمل لنظام الأنسولين GH / IGF-1 في طول عمر الإنسان ، هناك العديد من الدراسات الجينية. في الواقع ، لقد وجد أن العديد من المواقع الوراثية ترتبط بمستويات متداولة من IGF-1 و IGFBP-3 وقد تكون قادرة على التأثير على الشيخوخة (71). أظهر تحليل على نطاق الجينوم للجمعيات التي أجريت في سن تسعين عامًا والسكان المرضى الذين تقل أعمارهم عن 60 عامًا وجود صلة واضحة بين التباين الوراثي للجينات المشاركة في مسار الأنسولين / IGF-1 وعمر الإنسان (72). في دراسة استطلاعية لكبار السن ، أظهرت النساء ذوات الشخصية الوراثية ، التي تشير إلى انخفاض في نشاط إشارات الأنسولين / IGF-1 ، أن العمر الافتراضي أطول (73).في أربعة مجموعات مستقلة من الأشخاص الذين عاشوا لفترة طويلة ، تم مؤخراً وصف زيادة خطية في انتشار متلازمات متلازمة هرمون الغدد التناسلية الخارجية الخارجية (G3R) مع تقدم العمر. زاد وجود النمط الوراثي d3 / d3 من العمر المتوقع بحوالي 10 سنوات (74).IGF-1
واحدة من أكثر الملاحظات إقناعا في بيولوجيا الشيخوخة هي القدرة على الحد من السعرات الحرارية لمنع أو تأخير بعض الأمراض المرتبطة بالعمر وزيادة العمر المتوقع للثدييات (75 - 78). الآليات البيولوجية لهذه الظاهرة ليست واضحة تمامًا ، ولكن تم تقديم اقتراح بشأن المشاركة المحتملة للتغيرات المقابلة في استقلاب الطاقة ، ونظام الغدد الصماء والأضرار المؤكسدة.
تقييد السعرات الحرارية يسبب العديد من التغييرات الهرمونية. في القوارض ، كبح السعرات الحرارية دون المجاعة قمع مستويات الدورة الدموية من IGF-1 والأنسولين بما يتناسب مع مستوى التقييد ، وزيادة حساسية الأنسولين ومقاومة الإجهاد والسمية ، وخفض خطر الإصابة بالسرطان (79 ، 80). ومن المثير للاهتمام ، أن معظم هذه الخصائص التي لوحظت في الفئران من النوع البري أثناء تقييد السعرات الحرارية تشبه تلك التي أبلغ عنها في الفئران التي تعيش لفترة طويلة بسبب ضعف وراثي للإشارة GH / IGF-1 / الأنسولين ، كما هو موضح سابقا.
أظهرت التجارب السريرية المعشاة على البشر أن تقييد السعرات الحرارية لا يقلل من IGF-1 في الدم ما لم يتم تقليل تناول البروتين (81 ، 82). ومع ذلك ، فقد أظهر تحليل تلوي حديث لتقييم تأثير القيود الغذائية على المؤشرات الحيوية المعترف بها للشيخوخة الصحية انخفاضًا في مستويات IGF-1 البشرية في الدم (83).
وقد لوحظت تغييرات هرمونية أخرى ، مثل انخفاض مستويات الأنسولين ، وهرمونات الغدة الدرقية ومستويات الليبتين ، وكذلك زيادة في حساسية الأديبونيكتين والأنسولين ، خلال تقييد النظام الغذائي (85 ، 86).
يمكن أن يلعب هذا التكيف الهرموني دورًا مهمًا في إطالة الحياة من خلال عدة آليات:
1) انخفاض معدل الأيض ، تكاثر الخلايا والضغط التأكسدي. في الواقع ، IGF-1 هو عامل نمو قوي ، وهرمون الغدة الدرقية هو منبه قوي لمعدل الأيض الأساسي والتمثيل الغذائي المؤكسد. بالإضافة إلى ذلك ، تشير أنماط النسخ إلى أن تقييد السعرات الحرارية المعتدل المزمن عند البالغين يؤدي إلى إبطاء عملية الشيخوخة ، مما يحول عملية التمثيل الغذائي للخلايا من النمو إلى الصيانة والإنعاش (84).
2) الحد من تراكم خلايا الشيخوخة. تبين أن شيخوخة الخلايا هي الوسيط الرئيسي للشيخوخة (87). مع مرور الوقت ، يقل توازن البروتين ويتراكم الضرر. ومن المثير للاهتمام ، يمكن تأخير بعض الأمراض المرتبطة بالعمر من خلال إضعاف تراكم خلايا الشيخوخة (88 ، 89). عادة ، يتم تنشيط مسار mTOR من خلال العديد من الإشارات ، بما في ذلك العناصر الغذائية ، IGF-1 ، والأنسولين (الشكل 2). رفع تحرير هذا المسار ، والذي تم الإبلاغ عنه بعد تقييد السعرات الحرارية ، زاد من عمر بعض الكائنات. هذا التأثير ، على ما يبدو ، ثانوي لزيادة الالتهام الذاتي ، وهي عملية الهضم الخلوي. في الواقع ، تعد الالتهام الذاتي عملية معالجة للخلايا يمكنها إزالة المكونات الخلوية القديمة أو التالفة ، مما يمنع تراكم خلايا الشيخوخة (90 ، 91).
3) مواجهة الالتهابات. يمكن للتدخل الغذائي في كل من الحيوانات والبشر أن يبطئ عملية الشيخوخة ، ويضعف الحالة الالتهابية بدرجة ضعيفة (83 ، 92). الآليات الكامنة وراء النشاط المضاد للالتهابات من القيود الغذائية ليست محددة بوضوح. يُعتقد أن هذا التأثير ناتج عن انخفاض في كتلة الدهون والدهون المضادة للالتهابات ، بالإضافة إلى تحسن في سلامة الحاجز المعوي الذي لوحظ خلال التدخل الغذائي (93 ، 94).
من المثير للاهتمام أن نلاحظ أن الملف الكيميائي الحيوي للغدد الصماء الذي لوحظ في المواضيع أثناء تقييد السعرات الحرارية يشبه ذلك في المعمرين ، مما يؤكد الدور المحتمل لنظام الغدد الصماء في تعديل متوسط العمر المتوقع. بالإضافة إلى زيادة حساسية الأنسولين وخفض مستويات IGF-1 في البلازما / المصل ، أظهرت العديد من الدراسات زيادة مستويات الأديبونيكتين المنتشرة وانخفاض مستويات هرمونات الليبتين والدرقية في الأشخاص الذين عاشوا لفترة طويلة مقارنة بالأشخاص الأصغر سنًا.
الأنسجة الدهنية هي عضو من أعضاء الغدد الصماء التي تنتج العديد من السيتوكينات المشاركة في العمليات ذات الصلة ، مثل استقلاب الطاقة ، والتوازن الدهني والجلوكوز ، وتعديل الاستجابة الالتهابية. تلعب الأنسجة الدهنية الحشوية دورًا رئيسيًا في تطور أمراض الأيض (95). يرتبط الشيخوخة بزيادة كتلة الدهون وإعادة توزيع الأنسجة الدهنية ، التي تتميز بفقدان الدهون تحت الجلد الطرفية وتراكم الدهون الحشوية. في كبار السن ، تم وصف التغييرات في إفراز وتوليف ووظيفة الأديبوكينات ، ربما بسبب الخلل في وظيفة الخلايا وحجمها وعددها وعددها (86). أديبونيكتين هو خلوى من الأنسولين ومضادة للالتهاب ومضادة للشرايين. يدور الأديبونيكتين في الدم بعدة أشكال: القاطع ، السداسي ، متعدد الأوزان الجزيئي العالي (HMW) والأديبونيكتين الكروي (شكل مشقوق بروتينيًا). يُعتقد أن HMW المتعدد الأشكال يكون أكثر نشاطًا من أديبونيكتين للحماية من مقاومة الأنسولين ومرض السكري (96). يرتبط الأديبونيكتين المنتشر بشكل مستقل وسلبي بجوانب متلازمة التمثيل الغذائي ، بما في ذلك مقاومة الأنسولين ووزن الجسم وضغط الدم والدهون في الدم. يتم إنتاج اللبتين بشكل رئيسي في تحت الجلد وبدرجة أقل في الأنسجة الدهنية البيضاء الحشوية. هذا السيتوكين ينظم تناول الطعام ، إنفاق الطاقة ، وتصلب الشرايين. يبتين يعزز فقدان الوزن عن طريق الحد من الشهية وتحفيز عملية التمثيل الغذائي ولها خصائص مؤيدة للالتهابات (97).
ذكرت العديد من الدراسات أن الكبد الطويل يحتوي على مستويات أعلى من أديبونيكتين في البلازما وتركيز اللبتين أقل من الضوابط الأصغر (53 ، 98 - 102). تمت زيادة جميع أشكال أديبونيكتين بشكل ملحوظ في الكبد الطويل ، لكن HMW المتعدد كان أعلى بكثير (99). في الكبد الطويل ، اتضح أن تركيزات أديبونيكتين عالية تكون مستقلة عن مؤشر كتلة الجسم أو وظائف الكلى أو القلب والأوعية الدموية وترتبطت مع النمط الظاهري الأيضية المواتية (مستويات أعلى من HDL-C ، وانخفاض الهيموغلوبين السكري ، والأنسولين ، HOMA-IR والدهون الثلاثية) (98 ، 99). كما تم العثور على مستويات مرتفعة من الأديبونيكتين في ذرية المواد طويلة العمر (أكثر من 95 عامًا) (103).
من الواضح أن انخفاض مستوى هرمونات الغدة الدرقية هو سمة من سمات الكبد الطويل. ماريوتي وآخرون. (104) ذكر أن الأشخاص المعمرين الأصحاء لديهم مستويات TSH و FT3 مصل أقل ومستويات مصل أعلى rT3 مقارنة بتلك التي لوحظت في مجموعات الضبط الأخرى. في مجتمع إيطالي آخر من كبد طويل ، كانت قيم T4 الإجمالية أقل من المعدل الطبيعي في 60 ٪ من فحص (105). بارانوفسكايا وآخرون. ذكرت أن مستويات T3 في مصل الدم في الذين تتراوح أعمارهم بين كانت أقل من تلك في النساء المسنات والشابات في وقت مبكر (52). لقد وصفنا مؤخرًا المظهر الوظيفي للغدة الدرقية في مجموعة إيطالية تضم 672 مريضًا (تتراوح أعمارهم بين 52-113 عامًا). ولوحظ انخفاض المرتبطة بالعمر في مستويات FT3 ونسب FT3 / FT4 ، في حين أن FT4 و TSH زيادة مع التقدم في السن (106). في عائلات المعمرين الصينيين ، يبدو أن انخفاض وظيفة الغدة الدرقية (ارتفاع TSH وانخفاض تركيز FT3) يرتبط بالعمر ، وهذا النمط الظاهري وراثي (107).
كورسونيلو وآخرون. (108) وجد أن الأقارب المصاحبة (ذرية أو بنات / أبناء أخ) مصابون بأمراض أقل مصاحبة ، ومستويات FT3 ، و FT4 ، و TSH أكثر من الضوابط المتطابقة مع تقدم العمر والتي لم تكن أقرباء للكبد الطويل. في مجتمع إيطالي آخر ، لوحظ انخفاض مستوى البلازما FT4 في أحفاد من كبد طويل مقارنة مع مجموعة مراقبة من نفس العمر (60).
بشكل عام ، تكون الكبد الطويلة رفيعة (109) وتتمسك بعادات الأكل الصحية (110). على غرار الموضوعات أثناء تقييد السعرات الحرارية ، لاحظت الكبدات الطويلة نمو الخلايا / التمثيل الغذائي بشكل أبطأ ، والتحكم بشكل أفضل في نقل الإشارة وزيادة الالتهام الذاتي. من خلال تحليل مثيلة الحمض النووي في جميع أنحاء الجينوم في المعمرين وذريتهم ، حددنا الجينات والمسارات المعدلة جينيا والتي يحتمل أن تشارك في الشيخوخة وطول العمر. تشير نتائجنا إلى أن هؤلاء السكان قد تميزوا بحفظ أفضل لحالة مثيلة الحمض النووي ونمو الخلايا / التمثيل الغذائي بشكل أبطأ والتحكم بشكل أفضل في نقل الإشارات من خلال الآليات اللاجينية (111). احتفظت الكبدات الطويلة الأجل بوظيفتها الحيوية بسبب تضخم الميتوكوندريا ، والتي يمكن أن تعوض عن العيوب الوظيفية (112). بالإضافة إلى ذلك ، فإن الكبد الطويل الصحي يتمتع بمستويات عالية من الالتهام الذاتي ، كما يتضح من ارتفاع مستويات المصل بيكلين -1 مقارنة مع كل من المرضى الشباب الذين يعانون من احتشاء عضلة القلب والضوابط الصحية (113). وقد لوحظت زيادة في نشاط البلعمة الذاتية في الأشخاص الذين ينتمون إلى أسر ذات طول عمر استثنائي (114).
تحدث الظاهرة المقابلة فيما يتعلق بالحالة الالتهابية ، التي تضعف في الأشخاص بعد تقييد السعرات الحرارية (115 ، 116) وتكون مرتفعة في الكبد الطويل (117 - 119). مع تقدم العمر ، هناك حالة من الأمراض الالتهابية الخفيفة والمزمنة (التهاب مرتبط بالعمر) وزيادة انتشار عدد من الأمراض ، مثل أمراض القلب والأوعية الدموية وتصلب الشرايين والأورام والضعف الإدراكي والتهاب المفاصل والسكري (120 ، 121). لذلك ، فإن إضعاف الحالة الالتهابية المزمنة بعد تقييد السعرات الحرارية له تأثير مفيد. يظهر المئويون المئويون علامات الالتهاب ، ولكن في الوقت نفسه ، على ما يبدو ، يدخر آثاره الضارة. يمكن تفسير هذه المفارقة الواضحة من خلال حقيقة أن الكبد الطويل له توازن معقد وغريب بين العوامل المؤيدة للالتهابات والعوامل المضادة للالتهابات ، مما يؤدي إلى تطور أبطأ وأكثر محدودية ومتوازنة من الالتهاب مقارنة مع كبار السن الذين يتميزون باستجابة غير فعالة لمواجهة الالتهاب المزمن (120 ، 121).
هذه البيانات تشير إلى الآليات العامة لزيادة طول العمر وتأخير الأمراض المرتبطة بالعمر الموجودة في الكبد الطويل والثدييات خلال اتباع نظام غذائي مقيد السعرات الحرارية.
رأي المؤلفين.قدمت النماذج قبل السريرية نظرة أعمق في عملية الشيخوخة باستخدام بيانات متسقة تأخذ في الاعتبار دور نظام الأنسولين GH / IGF-1 في تعديل متوسط العمر المتوقع. على الرغم من أنه من المعروف جيدًا أن زيادة الحساسية للأنسولين وانخفاض مستويات الأنسولين مرتبطة بتحسين البقاء على قيد الحياة ، إلا أن هناك بعض الأدلة التي توضح أن ضعف محور GH / IGF-1 يمكن أن يكون له تأثير مفيد على زيادة متوسط العمر المتوقع عند البشر. ومع ذلك ، لا يزال من غير المعروف ما هي المستويات المثلى لـ IGF-1 طوال الحياة للعيش حياة أطول وتكون أكثر صحة. بالإضافة إلى ذلك ، لم يتم تقييم حساسية مستقبلات IGF-1 وتفعيل مسار ما بعد المستقبل في معظم الدراسات التي تشمل موضوعات طويلة العمر. لذلك ، لا يمكن تحديد الحالة الفعلية لتفعيل إشارات مستقبلات IGF-1 بجرعة بسيطة من مستويات IGF-1 المتداولة. هذا يجعل من الصعب تحديد الاستراتيجيات الدوائية أو البيئية التي تستهدف هذا النظام لزيادة طول العمر وتعزيز الشيخوخة الصحية. يظل الفهم الشامل لهذه الجوانب هو المشكلة الرئيسية لتحديد التدخلات التي تهدف إلى إبطاء شيخوخة الإنسان واستخدامها في طب إعادة التأهيل. ينبغي أن تقيّم الدراسات المستقبلية الحالة الوظيفية لإشارات مستقبلات IGF-1 ، بما في ذلك استخدام التنميط النسخي وتحليل الشبكات الوظيفية المتعلقة بالجينات المنظمة IGF-1 في موضوعات طويلة العمر.
النتائجتم وصف أوجه التشابه المذهلة فيما يتعلق بمظهر الغدد الصماء بين الكبد الطويل والأشخاص الذين يتناولون نظامًا غذائيًا مقيد السعرات الحرارية. يمكن أن يكون تكيف الغدد الصماء والتمثيل الغذائي الذي لوحظ في كلا النموذجين استراتيجية فسيولوجية لزيادة متوسط العمر المتوقع بسبب تباطؤ نمو الخلايا / التمثيل الغذائي ، وفقدان أبطأ للاحتياطي الفسيولوجي الطبيعي ، وانتقال الأيض الخلوي من تكاثر الخلايا إلى نشاط التجدد ، وتقليل تراكم الخلايا المتقادمة. على ما يبدو ، يتم التوسط في هذه الآليات ، جزئيًا على الأقل ، عن طريق تعديل نظام الأنسولين GH / IGF-1 /.
مراجع- Franceschi C، Valensin S، Bonafè M، Paolisso G، Yashin AI، Monti D، et al .. الشبكة ونظريات إعادة عرض الشيخوخة: الخلفية التاريخية ووجهات النظر الجديدة. إكسب جيرونتول. (2000) 35: 879-96. 10.1016 / S0531-5565 (00) 00172-8.
- Bartke A و Darcy J. GH والشيخوخة: مطبات ورؤى جديدة. أفضل الممارسات الدقة كلين Endocrinol Metab. (2017) 31: 113–25. 10.1016 / j.beem.2017.02.005
- Vitale G و Salvioli S و Franceschi C. الاكسدة ونظام الغدد الصماء المتقادم. نات القس Endocrinol. (2013) 9: 228–40. 10.1038 / nrendo.2013.29
- Vitale G، Cesari M، Mari D. شيخوخة نظام الغدد الصماء وتأثيره المحتمل على التسمم العضلي. Eur J Intern Med. (2016) 35: 10-15. 10.1016 / j.ejim.2016.07.017
- ريدي SSK ، Chaiban JT. الغدد الصماء من الشيخوخة: مفتاح طول العمر "توقعات كبيرة". الممارسة الصماء. (2017) 23: 1107–16. 10.4158 / EP171793.RA
- Junnila RK، List EO، Berryman DE، Murrey JW، Kopchick JJ. محور GH / IGF-1 في الشيخوخة وطول العمر. نات القس Endocrinol. (2013) 9: 366–76. 10.1038 / nrendo.2013.67
- Yakar S، Adamo ML. عامل نمو يشبه الأنسولين 1 فسيولوجيا: دروس من نماذج الماوس. Endocrinol Metab Clin North Am. (2012) 41: 231–47. 10.1016 / j.ecl.2012.04.008 [المقالة المجانية لـ PMC] [PubMed] [CrossRef] [الباحث العلمي من Google]
- Higashi Y و Sukhanov S و Anwar A و Shai SY و Delafontaine P. IGF-1 والضغط التأكسدي وتصلب الشرايين. اتجاهات الغدد الصماء Metab. (2010) 21: 245-54. 10.1016 / j.tem.2009.12.005 [المقالة المجانية لـ PMC] [PubMed] [CrossRef] [الباحث العلمي من Google]
- Belfiore A، Malaguarnera R، Vella V، Lawrence MC، Sciacca L، Frasca F، et al .. مستقبلات الأنسولين في علم وظائف الأعضاء والمرض: منظر محدث. مراجعة Endocr (2017) 38: 379-431. 10.1210 / er.2017-00073 [المقالة المجانية لـ PMC] [PubMed] [CrossRef] [الباحث العلمي من Google]
- Kenyon C ، و Chang J ، و Gensch E ، و Rudner A ، و Tabtiang RAC ... elegans mutant التي تعيش ضعف طول النوع البري. Nature (1993) 366: 461-4. 10.1038 / 366461a0 [PubMed] [CrossRef] [الباحث العلمي من Google]
- Kimura KD، Tissenbaum HA، Liu Y، Ruvkun G. Daf-2 ، وهو جين يشبه مستقبلات الأنسولين الذي ينظم طول العمر و diapause في Caenorhabditis elegans. العلوم (1997) 277: 942-6. 10.1126 / science.277.5328.942 [PubMed] [CrossRef] [الباحث العلمي من Google]
- التتار M ، Kopelman A ، Epstein D ، Tu MP ، Yin CM ، Garofalo RS ، وآخرون. متحول مستقبلات الأنسولين ذبابة الفاكهة متحولة التي تمتد على مدى الحياة ويضعف وظيفة الغدد الصم العصبية. العلوم (2001) 292: 107-10. 10.1126 / science.1057987 [PubMed] [CrossRef] [Google Scholar]
- Clancy DJ، Gems D، Harshman LG، Oldham S، Stocker H، Hafen E، et. .. إطالة العمر الافتراضي بفقدان CHICO ، وهو بروتين مستقبلات الأنسولين Drosophila. العلوم (2001) 292: 104-6. 10.1126 / science.1057991 [PubMed] [CrossRef] [Google Scholar]
- Libina N، Berman JR، Kenyon C. أنشطة خاصة بالأنسجة لـ C. elegans DAF-16 في تنظيم عمر الإنسان. الخلية (2003) 115: 489-502. 10.1016 / S0092-8674 (03) 00889-4 [PubMed] [CrossRef] [Google Scholar]
- إشارة Broughton S، Partridge L. Insulin / IGF تشبه الجهاز العصبي المركزي والشيخوخة. Biochem J. (2009) 418: 1-12. 10.1042 / BJ20082102 [PubMed] [CrossRef] [Google Scholar]
- Reindl KM، Sheridan MA. تنظيم محيطي لنظام عامل نمو يشبه هرمون النمو في الأسماك والفقاريات الأخرى. شركات Biochem Physiol A Mol Integr Physiol. (2012) 163: 231–45. 10.1016 / j.cbpa.2012 / 08 / 08.003 [PubMed] [CrossRef] [الباحث العلمي من Google]
- Snell GD. قزم ، شخصية مندلية جديدة من الفأرة المنزل. Proc Natl Acad Sci USA. (1929) 15: 733–4. 10.1073 / pnas.15.9.733 [مقالة مجانية عن PMC] [PubMed] [CrossRef] [الباحث العلمي من Google]
- Berryman D، Christiansen JS، Johannsson G، Thorner MO، Kopchick JJ. دور محور GH / IGF-1 في العمر الافتراضي و healthspan: دروس من النماذج الحيوانية. هرمون النمو IGF Res. (2008) 18: 455–71. 10.1016 / j.ghir.2008.05.005 [المقالة المجانية لـ PMC] [PubMed] [CrossRef] [الباحث العلمي من Google]
- Flurkey K، Papaconstantinou J، Miller RA، Harrison DE. تمديد عمر وتأخر الشيخوخة المناعية والكولاجين في الفئران متحولة مع وجود عيوب في إنتاج هرمون النمو. Proc Natl Acad Sci USA. (2001) 98: 6736–41. 10.1073 / pnas.111158898 [المقالة المجانية لـ PMC] [PubMed] [CrossRef] [الباحث العلمي من Google]
- Brown-Borg HM، Borg KE، Meliska CJ، Bartke A. Dwarf الفئران وعملية الشيخوخة. الطبيعة (1996) 384: 33. 10.1038 / 384033a0 [PubMed] [CrossRef] [Google Scholar]
- Bartke A، Wright JC، Mattison JA، Ingram DK، Miller RA، Roth GS. تمديد عمر الفئران طويلة العمر. Nature (2001) 414: 412. 10.1038 / 35106646 [PubMed] [CrossRef] [Google Scholar]
- Panici JA، Harper JM، Miller RA، Bartke A، Spong A، Masternak MM. تقلل معالجة هرمون النمو المبكرة من العمر وتقلل من مقاومة الإجهاد الخلوي لدى الفئران المتحولة ذات العمر الطويل. FASEB J. (2010) 24: 5073–9. 10.1096 / fj.10-163253 [المقالة المجانية لـ PMC] [PubMed] [CrossRef] [الباحث العلمي من Google]
- Sun LY، Spong A، Swindell WR، Fang Y، Hill C، Huber JA، et al .. يمتد اضطراب هرمونات إفراز هرمون النمو إلى إطالة العمر وينظم الاستجابة لتقييد السعرات الحرارية في الفئران. Elife (2013) 2: e01098. 10.7554 / eLife.01098 [المقالة المجانية لـ PMC] [PubMed] [CrossRef] [الباحث العلمي من Google]
- Coschigano KT، Clemmons D، Bellush LL، Kopchick JJ. تقييم معلمات النمو والعمر الافتراضي للفئران الجينية التي تعطلت الجين / BP. علم الغدد الصماء (2000) 141: 2608-13. 10.1210 / endo.141.7.7586 [PubMed] [CrossRef] [Google Scholar]
- Ikeno Y، Hubbard GB، Lee S، Cortez LA، Lew CM، Webb CR، et al. تقليل حالات الإصابة وتأخر حدوث أمراض الأورام القاتلة في مستقبلات هرمون النمو المستقبلة / فئران خروج المغلوب بالبروتين. J Gerontol A Biol Sci Med Sci. (2009) 64: 522-9. 10.1093 / gerona / glp017 [المقالة المجانية لـ PMC] [PubMed] [CrossRef] [الباحث العلمي من Google]
- Gesing A، Wiesenborn D، Do A، Menon V، Schneider A، Victoria B، et. فأر طويل العمر يفتقر إلى كل من هرمون النمو ومستقبلات هرمون النمو: نموذج حيواني جديد لدراسات الشيخوخة. J Gerontol A Biol Sci Med Sci. (2017) 72: 1054–61. 10.1093 / gerona / glw193 [المقالة المجانية لـ PMC] [PubMed] [CrossRef] [الباحث العلمي من Google]
- Bonkowski MS، Rocha JS، Masternak MM، Al Regaiey KA، Bartke A. تتداخل الاضطرابات المستهدفة لمستقبلات هرمون النمو مع الإجراءات المفيدة لتقييد السعرات الحرارية. Proc Natl Acad Sci USA. (2006) 103: 7901-5. 10.1073 / pnas.0600161103 [المقالة المجانية لـ PMC] [PubMed] [CrossRef] [الباحث العلمي من Google]
- Coschigano KT، Holland AN، Riders ME، List EO، Flyvbjerg A، Kopchick JJ. يؤدي حذف مستقبلات هرمون نمو الفأر ، وليس الخصوم ، إلى انخفاض شديد في أوزان الجسم والأنسولين وعوامل النمو التي تشبه الأنسولين ومستويات زيادة العمر الافتراضي. علم الغدد الصماء (2003) 144: 3799-810. 10.1210 / en.2003-0374 [PubMed] [CrossRef] [الباحث العلمي من Google]
- Holzenberger M، Dupont J، Ducos B، Leneuve P، Géloën A، Even PC، et al .. ينظم مستقبل IGF-1 العمر ومقاومة الإجهاد التأكسدي لدى الفئران. Nature (2003) 421: 182–7. 10.1038 / nature01298 [PubMed] [CrossRef] [Google Scholar]
- Bokov AF، Garg N، Ikeno Y، Thakur S، Musi N، DeFronzo RA، et al. هل خفض إشارات IGF-1R في الفئران Igf1r +/−؟ Plos ONE (2011) 6: e26891. 10.1371 / journal.pone.0026891 [المقالة المجانية لـ PMC] [PubMed] [CrossRef] [الباحث العلمي من Google]
- Xu J ، Gontier G ، Chaker Z ، Lacube P ، Dupont J ، Holzenberger M. تأثير طول العمر لـ IGF-1R +/− الطفرة يعتمد على تنشيط مستقبلات وراثية خاصة بالخلفية. خلية الشيخوخة (2014) 13: 19-28. 10.1111 / acel.12145 [المقالة المجانية لـ PMC] [PubMed] [CrossRef] [الباحث العلمي من Google]
- مولفي L ، سنكلير A ، Selman C. Lifespan التحوير في الفئران والآثار مربكة من الخلفية الوراثية. J Genet Genomics (2014) 41: 497-503. 10.1016 / j.jgg.2014.06.002 [المقالة المجانية لـ PMC] [PubMed] [CrossRef] [الباحث العلمي من Google]
- Kappeler L، De Magalhaes Filho C، Dupont J، Leneuve P، Cervera P، Périn L، et al. تتحكم مستقبلات الدماغ IGF-1 في نمو الثدييات وعمرها من خلال آلية الغدد الصم العصبية. PLOS Biol. (2008) 6: e254. 10.1371 / journal.pbio.0060254tt [مقالة مجانية عن PMC] [PubMed] [CrossRef] [الباحث العلمي من Google]
- Svensson J، Sjögren K، Fäldt J، Andersson N، Isaksson O، Jansson JO، et al. ينظم IGF-1 المشتق من الكبد متوسط العمر في الفئران. PLoS ONE (2011) 6: e22640 10.1371 / journal.pone.0022640 [مقالة مجانية باسم PMC] [PubMed] [CrossRef] [الباحث العلمي من Google]
- Conover CA, Bale LK. Loss of pregnancy-associated plasma protein A extends lifespan in mice. Aging Cell (2007) 6:727–9. 10.1111/j.1474-9726.2007.00328.x [PubMed] [CrossRef] [Google Scholar]
- Conover CA. Role of PAPP-A in aging and age-related disease. Exp Gerontol. (2013) 48:612–3. 10.1016/j.exger.2012.06.017 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Selman C, Lingard S, Choudhury AI, Batterham RL, Claret M, Clements M, et al.. Evidence for lifespan extension and delayed age-related biomarkers in insulin receptor substrate 1 null mice. FASEB J. (2008) 22:807–18. 10.1096/fj.07-9261com [PubMed] [CrossRef] [Google Scholar]
- Taguchi A, Wartschow LM, White MF. Brain IRS2 signaling coordinates life span and nutrient homeostasis. Science (2000) 317:369–72. 10.1126/science.1142179 [PubMed] [CrossRef] [Google Scholar]
- Kuro M, Matsumura Y, Aizawa H, Kawaguchi H, Suga T, Utsugu T, et al. Mutation of the mouse Klotho gene leads to a syndrome resembling ageing. Nature (1997) 390:45–51. 10.1038/36285 [PubMed] [CrossRef] [Google Scholar]
- Kurosu H, Yamamoto M, Clark JD, Pastor JV, Nandi A, Gurnani P, et al.. Suppression of aging in mice by the hormone Klotho. Science (2005) 309:1829–33. 10.1126/science.1112766 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Migliaccio E, Giorgio M, Mele S, Pelicci G, Reboldi P, Pandolfi PP, et al. The p66 Shc adaptor protein controls oxidative stress response and life span in mammals. Nature (1999) 402:309–13. 10.1038/46311 [PubMed] [CrossRef] [Google Scholar]
- Ramsey JJ, Tran D, Giorgio M, Griffey SM, Koehne A, Laing ST, et al.. The influence of Shc proteins on life span in mice. J Gerontol A Biol Sci Med Sci. (2014) 69:1177–85. 10.1093/gerona/glt198 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Ashpole NM, Logan S, Yabluchanskiy A, Mitschelen MC, Yan H, Farley JA, et al.. IGF-1 has sexually dimorphic, pleiotropic, and time-dependent effects on healthspan, pathology, and lifespan. Geroscience (2017) 39:129–45. 10.1007/s11357-017-9971-0 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Mao K, Quipildor GF, Tabrizian T, Novaj A, Guan F, Walters RO, et al.. Late-life targeting of the IGF-1 receptor improves healthspan and lifespan in female mice. Nat Commun. (2018) 9:2394. 10.1038/s41467-018-04805-5 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Franceschi C, Passarino G, Mari D, Monti D. Centenarians as a 21st century healthy aging model: a legacy of humanity and the need for a world-wide consortium (WWC100+). Mech Ageing Dev. (2017) 165(Pt. B):55–8. 10.1016/j.mad.2017.06.002 [PubMed] [CrossRef] [Google Scholar]
- Vitale G, Barbieri M, Kamenetskaya M, Paolisso G. GH/IGF-I/insulin system in centenarians. Mech Ageing Dev. (2017) 165:107–114. 10.1016/j.mad.2016.12.001 [PubMed] [CrossRef] [Google Scholar]
- Ferrannini E, Vichi S, Beck-Nielsen H, Laasko M, Paolisso G, Smith U. For European Group for the Study of Insulin Resistance (EGIR). Insulin action and age. Diabetes (1996) 45:947–53. 10.2337/diab.45.7.947 [PubMed] [CrossRef] [Google Scholar]
- Paolisso G, Barbieri M, Rizzo MR, Carella C, Rotondi M, Bonafè M, et al. Low insulin resistance and preserved beta-cell function contribute to human longevity but are not associated with TH-INS genes. Exp Gerontol. (2001) 37:149–56. 10.1016/S0531-5565(01)00148-6 [PubMed] [CrossRef] [Google Scholar]
- Paolisso G, Gambardella A, Ammendola S, D'Amore A, Balbi V, Varricchio M, et al.. Glucose tolerance and insulin action in healty centenarians. Am J Physiol. (1996) 270:E890–4. 10.1152/ajpendo.1996.270.5.E890 [PubMed] [CrossRef] [Google Scholar]
- Paolisso G, Gambardella A, Ammendola S, Tagliamonte MR, Rizzo MR, Capurso A, et al.. Preserved antilipolytic insulin action is associated with a less atherogenic plasma lipid profile in healthy centenarians. J Am Geriatr Soc. (1997) 45:1504–9. 10.1111/j.1532-5415.1997.tb03203.x [PubMed] [CrossRef] [Google Scholar]
- Vitale G, Brugts M, Ogliari G, Castaldi D, Fatti L, Varewijck A, et al.. Low circulating IGF-I bioactivity is associated with human longevity: findings in centenarians' offspring. Aging (2012) 4:580–89. 10.18632/aging.100484 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Baranowska B, Wolinska-Witort E, Bik W, Baranowska-Bik A, Martynska L, Broczek K, et al.. Evaluation of neuroendocrine status in longevity. Neurobiol Aging (2007) 28:774–83. 10.1016/j.neurobiolaging.2006.03.014 [PubMed] [CrossRef] [Google Scholar]
- Paolisso G, Manzella D, Barbieri M, Rizzo MR, Gambardella A, Varricchio M. Baseline heart rate variability in healthy centenarians: differences vs. aged subject. Clin. الخيال العلمي. (1999) 97:579–84. 10.1042/cs0970579 [PubMed] [CrossRef] [Google Scholar]
- Paolisso G, Tagliamonte MR, Rizzo MR, Carella C, Gambardella A, Barbieri M, et al. Low plasma Insulin like growth factor-1 concentrations predict worsening of insulin mediated glucose uptake in the elderly. J. Am. Geriatr. شركة نفط الجنوب. (1999) 47:1312–8. 10.1111/j.1532-5415.1999.tb07431.x [PubMed] [CrossRef] [Google Scholar]
- Paolisso G, Ammendola S, Del Buono A, Gambardella A, Riondino M, Tagliamonte MR, et al.. Serum levels of insulin-like growth factor-I (IGF-I) and IGF-binding protein-3 in healthy centenarians: relationship with plasma leptin and lipid concentrations, insulin action, and cognitive function. J Clin Endocrinol Metab. (1997) 82:2204–9. 10.1210/jcem.82.7.4087 [PubMed] [CrossRef] [Google Scholar]
- Bonafè M, Barbieri M, Marchegiani F, Olivieri F, Ragno E, Giampieri C, et al.. Polymorphic variants of insulin-like growth factor I (IGF-I) receptor and phosphoinositide 3-kinase genes affect IGF-I plasma levels and human longevity: cues for an evolutionarily conserved mechanism of life span control. J Clin Endocrinol Metab. (2003) 88:3299–304. 10.1210/jc.2002-021810 [PubMed] [CrossRef] [Google Scholar]
- Arai Y, Hirose N, Yamamura K, Shimizu K, Takayama M, Ebihara Y, et al.. Serum insulin-like growth factor-1 in centenarians: implications of IGF-1 as a rapid turnover protein. J Gerontol A Biol Sci Med Sci. (2001) 56:M79–82. 10.1093/gerona/56.2.M79 [PubMed] [CrossRef] [Google Scholar]
- Arai Y, Takayama M, Gondo Y, Inagaki H, Yamamura K, Nakazawa S, et al.. Adipose endocrine function, insulin-like growth factor-1 axis, and exceptional survival beyond 100 years of age. J Gerontol A Biol Sci Med Sci. (2008) 63:1209–18. 10.1093/gerona/63.11.1209 [PubMed] [CrossRef] [Google Scholar]
- Herr M, Jeune B, Fors S, Andersen-Ranberg K, Ankri J, Arai Y, et al.. Frailty and associated factors among centenarians in the 5-COOP countries. Gerontology (2018) 64:521–31. 10.1159/000489955 [PubMed] [CrossRef] [Google Scholar]
- Bucci L, Ostan R, Cevenini E, Pini E, Scurti M, Vitale G, et al.. Centenarians' offspring as a model of healthy aging: a reappraisal of the data on Italian subjects and a comprehensive overview. Aging (Albany. NY). (2016) 8:1–11. 10.18632/aging.100912 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Gueresi P, Miglio R, Monti D, Mari D, Sansoni P, Caruso C, et al.. Does the longevity of one or both parents influence the health status of their offspring? Exp Gerontol. (2013) 48:395–400. 10.1016/j.exger.2013.02.004 [PubMed] [CrossRef] [Google Scholar]
- Horvath S, Pirazzini C, Bacalini MG, Gentilini D, Di Blasio AM, Delledonne M, et al.. Decreased epigenetic age of PBMCs from Italian semi-supercentenarians and their offspring. Aging (2015) 7:1159–70. 10.18632/aging.100861 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Caselli G, Pozzi L, Vaupel JW, Deiana L, Pes G, Carru C, et al.. Family clustering in Sardinian longevity: a genealogical approach. Exp Gerontol. (2006) 41:727–36. 10.1016/j.exger.2006.05.009 [PubMed] [CrossRef] [Google Scholar]
- Suh Y, Atzmon G, Cho MO, Hwang D, Liu B, Leahy DJ, et al.. Functionally significant insulin-like growth factor I receptor mutations in centenarians. Proc Natl Acad Sci USA. (2008) 105:3438–42. 10.1073/pnas.0705467105 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Deelen J, van den Akker EB, Trompet S, van Heemst D, Mooijaart SP, Slagboom PE, Beekman M. Employing biomarkers of healthy ageing for leveraging genetic studies into human longevity. Exp Gerontol. (2016) 82:166–74. 10.1016/j.exger.2016.06.013 [PubMed] [CrossRef] [Google Scholar]
- van der Spoel E, Rozing MP, Houwing-Duistermaat JJ, Slagboom PE, Beekman M, de Craen AJ, et al.. Association analysis of insulin-like growth factor-1 axis parameters with survival and functional status in nonagenarians of the Leiden Longevity Study. Aging (2015) 7:956–63. 10.18632/aging.100841 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Rozing MP, Westendorp RG, Frölich M, de Craen AJ, Beekman M, Heijmans BT, et al.. Human insulin/IGF-1 and familial longevity at middle age. Aging (2009) 1:714–22. 10.18632/aging.100071 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- van der Spoel E, Jansen SW, Akintola AA, Ballieux BE, Cobbaert CM, Slagboom PE, et al.. Growth hormone secretion is diminished and tightly controlled in humans enriched for familial longevity. Aging Cell (2016) 15:1126–31. 10.1111/acel.12519 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Sebastiani P, Sun FX, Andersen SL, Lee JH, Wojczynski MK, Sanders JL, et al.. Families enriched for exceptional longevity also have increased health-span: findings from the long life family study. Front Public Health (2013) 1:38. 10.3389/fpubh.2013.00038 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Sebastiani P, Thyagarajan B, Sun F, Honig LS, Schupf N, Cosentino S, et al.. Age and sex distributions of age-related biomarker values in healthy older adults from the long life family study. J Am Geriatr Soc. (2016) 64:e189–94. 10.1111/jgs.14522 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Teumer A, Qi Q, Nethander M, Aschard H, Bandinelli S, Beekman M, et al.. Genomewide meta-analysis identifies loci associated with IGF-I and IGFBP-3 levels with impact on age-related traits. Aging Cell (2016) 15:811–24. 10.1111/acel.12490 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Deelen J, Uh HW, Monajemi R, van Heemst D, Thijssen PE, Böhringer S, et al.. Gene set analysis of GWAS data for human longevity highlights the relevance of the insulin/IGF-1 signaling and telomere maintenance pathways. Age (2013) 35:235–49. 10.1007/s11357-011-9340-3 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- van Heemst D, Beekman M, Mooijaart SP, Heijmans BT, Brandt BW, Zwaan BJ, et al.. Reduced insulin/IGF-1 signalling and human longevity. Aging Cell (2005) 4:79–85. 10.1111/j.1474-9728.2005.00148.x [PubMed] [CrossRef] [Google Scholar]
- Ben-Avraham D, Govindaraju DR, Budagov T, Fradin D, Durda P, Liu B, et al.. The GH receptor exon 3 deletion is a marker of male-specific exceptional longevity associated with increased GH sensitivity and taller stature. Sci Adv. (2017) 3:e1602025. 10.1126/sciadv.1602025 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- McKiernan SH, Colman RJ, Lopez M, Beasley TM, Aiken JM, Anderson RM, et al.. Caloric restriction delays aging-induced cellular phenotypes in rhesus monkey skeletal muscle. Exp Gerontol. (2011) 46:23–9. 10.1016/j.exger.2010.09.011 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Colman RJ, Anderson RM, Johnson SC, Kastman EK, Kosmatka KJ, Beasley TM, et al. Calorie restriction delays disease onset and mortality in rhesus monkeys. Science (2009) 325:201–4. 10.1126/science.1173635 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Willcox DC, Willcox BJ, Todoriki H, Curb JD, Suzuki M. Caloric restriction and human longevity: what can we learn from the Okinawans? Biogerontology (2006) 7:173–7. 10.1007/s10522-006-9008-z [PubMed] [CrossRef] [Google Scholar]
- Mattison JA, Roth GS, Beasley TM, Tilmont EM, Handy AM, Herbert RL, et al.. Impact of caloric restriction on health and survival in rhesus monkeys from the NIA study. Nature (2012) 489:318–21. 10.1038/nature11432 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Dunn SE, Kari FW, French J, Leininger JR, Travlos G, Wilson R, et al.. Dietary restriction reduces insulin-like growth factor I levels, which modulates apoptosis, cell proliferation, and tumor progression in p53-deficient mice. Cancer Res. (1997) 57:4667–72. [PubMed] [Google Scholar]
- Berrigan D, Perkins SN, Haines DC, Hursting SD. Adult-onset calorie restriction and fasting delay spontaneous tumorigenesis in p53-deficient mice. Carcinogenesis (2002) 23:817–22. 10.1093/carcin/23.5.817 [PubMed] [CrossRef] [Google Scholar]
- Redman LM, Veldhuis JD, Rood J, Smith SR, Williamson D, Ravussin E, et al.. The effect of caloric restriction interventions on growth hormone secretion in nonobese men and women. Aging Cell (2010) 9:32–9. 10.1111/j.1474-9726.2009.00530.x [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Fontana L, Villareal DT, Das SK, Smith SR, Meydani SN, Pittas AG, et al.. Effects of 2-year calorie restriction on circulating levels of IGF-1, IGF-binding proteins and cortisol in nonobese men and women: a randomized clinical trial. Aging Cell (2016) 15:22–7. 10.1111/acel.12400 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Lettieri-Barbato D, Giovannetti E, Aquilano K. Effects of dietary restriction on adipose mass and biomarkers of healthy aging in human. Aging (2016) 8:3341–55. 10.18632/aging.101122 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Mercken EM, Crosby SD, Lamming DW, JeBailey L, Krzysik-Walker S, Villareal DT, et al.. Calorie restriction in humans inhibits the PI3K/AKT pathway and induces a younger transcription profile. Aging Cell (2013) 12:645–51. 10.1111/acel.12088 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Arai Y, Kojima T, Takayama M, Hirose N. The metabolic syndrome, IGF-1, and insulin action. Mol Cell Endocrinol. (2009) 299:124–8. 10.1016/j.mce.2008.07.002 [PubMed] [CrossRef] [Google Scholar]
- Redman LM, Ravussin E. Endocrine alterations in response to calorie restriction in humans. Mol Cell Endocrinol. (2009) 299:129–36. 10.1016/j.mce.2008.10.014 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Franceschi C, Garagnani P, Vitale G, Capri M, Salvioli S. Inflammaging and 'Garb-aging'. Trends Endocrinol Metab. (2017) 28:199–212. 10.1016/j.tem.2016.09.005 [PubMed] [CrossRef] [Google Scholar]
- Qian M, Liu B. Pharmaceutical Intervention of Aging. Adv Exp Med Biol. (2018) 1086:235–54. 10.1007/978-981-13-1117-8_15 [PubMed] [CrossRef] [Google Scholar]
- Baker DJ, Wijshake T, Tchkonia T, LeBrasseur NK, Childs BG, van de Sluis B, et al.. Clearance of p16Ink4a-positive senescent cells delays ageing-associated disorders. Nature (2011) 479:232–6. 10.1038/nature10600 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Derous D, Mitchell SE, Wang L, Green CL, Wang Y, Chen L, et al.. The effects of graded levels of calorie restriction: XI. Evaluation of the main hypotheses underpinning the life extension effects of CR using the hepatic transcriptome. Aging (2017) 9:1770–824. 10.18632/aging.101269 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Madeo F, Tavernarakis N, Kroemer G. Can autophagy promote longevity? Nat Cell Biol. (2010) 12:842–6. 10.1038/ncb0910-842 [PubMed] [CrossRef] [Google Scholar]
- Cevenini E, Monti D, Franceschi C. Inflamm-ageing. Curr Opin Clin Nutr Metab Care. (2013) 16:14–20. 10.1097/MCO.0b013e32835ada13 [PubMed] [CrossRef] [Google Scholar]
- Meydani SN, Das SK, Pieper CF, Lewis MR, Klein S, Dixit VD, et al.. Long-term moderate calorie restriction inhibits inflammation without impairing cell-mediated immunity: a randomized controlled trial in non-obese humans. Aging (2016) 8:1416–31. 10.18632/aging.100994 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Ott B, Skurk T, Hastreiter L, Lagkouvardos I, Fischer S, Büttner J, et al.. Effect of caloric restriction on gut permeability, inflammation markers, and fecal microbiota in obese women. Sci Rep. (2017) 7:11955. 10.1038/s41598-017-12109-9 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Unamuno X, Gómez-Ambrosi J, Rodríguez A, Becerril S, Frühbeck G, Catalán V. Adipokine dysregulation and adipose tissue inflammation in human obesity. Eur J Clin Invest. (2018) 48:e12997. 10.1111/eci.12997 [PubMed] [CrossRef] [Google Scholar]
- Liu M, Liu F. Regulation of adiponectin multimerization, signaling and function. Best Pract Res Clin Endocrinol Metab. (2014) 28:25–31. 10.1016/j.beem.2013.06.003 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Balaskó M, Soós S, Székely M, Pétervári E. Leptin and aging: Review and questions with particular emphasis on its role in the central regulation of energy balance. J Chem Neuroanat. (2014) 61–62:248–55. 10.1016/j.jchemneu.2014.08.006 [PubMed] [CrossRef] [Google Scholar]
- Arai Y, Nakazawa S, Kojima T, Takayama M, Abihara Y, Shimizu K, et al. High adiponectin concentration and its role for longevity in female centenarians. Geriatr Gerontol Int. (2006) 6:32–9. 10.1111/j.1447-0594.2006.00304.x [CrossRef] [Google Scholar]
- Bik W, Baranowska-Bik A, Wolinska-Witort E, Kalisz M, Broczek K, Mossakowska M, et al.. Assessment of adiponectin and its isoforms in Polish centenarians. Exp Gerontol. (2013) 48:401–7. 10.1016/j.exger.2013.01.015 [PubMed] [CrossRef] [Google Scholar]
- Meazza C, Vitale G, Pagani S, Castaldi D, Ogliari G, Mari D, et al.. Common adipokine features of neonates and centenarians. J Pediatr Endocrinol Metab. (2011) 24:953–7. 10.1515/JPEM.2011.373 [PubMed] [CrossRef] [Google Scholar]
- Baranowska B, Bik W, Baranowska-Bik A, Wolinska-Witort E, Szybinska A, Martynska L, et al.. Neuroendocrine control of metabolic homeostasis in Polish centenarians. J Physiol Pharmacol. (2006) 57 (Suppl. 6):55–61. [PubMed] [Google Scholar]
- Miura Y, Hashii N, Tsumoto H, Takakura D, Ohta Y, Abe Y, et al.. Change in N-glycosylation of plasma proteins in Japanese semisupercentenarians. PLoS ONE (2015) 10:e0142645. 10.1371/journal.pone.0142645 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Atzmon G, Pollin TI, Crandall J, Tanner K, Schechter CB, Scherer PE, et al.. Adiponectin levels and genotype: a potential regulator of life span in humans. J Gerontol A Biol Sci Med Sci. (2008) 63:447–53. 10.1093/gerona/63.5.447 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Mariotti S, Barbesino G, Caturegli P, Bartalena L, Sansoni P, Fagnoni F, et al.. Complex alteration of thyroid function in healthy centenarians. J Clin. Endocrinol Metab. (1993) 77:1130–4. 10.1210/jcem.77.5.8077303 [PubMed] [CrossRef] [Google Scholar]
- Maugeri D, Russo MS, Di Stefano F, Receputo G, Rosso D, Rapisarda R, et al.. Thyroid function in healthy centenarians. Arch Gerontol Geriatr. (1997) 25:211–7. 10.1016/S0167-4943(97)00012-5 [PubMed] [CrossRef] [Google Scholar]
- Ostan R, Monti D, Mari D, Arosio B, Gentilini D, Ferri E, et al.. Heterogeneity of thyroid function and impact of peripheral thyroxine deiodination in centenarians and semi-supercentenarians: association with functional status and mortality. J Gerontol A Biol Sci Med Sci. (2018). 10.1093/gerona/gly194. [Epub ahead of print]. [PubMed] [CrossRef] [Google Scholar]
- He Y, Chen X, Yan D, Xiao F, Liu Y, Lin R, et al.. Thyroid function decreases with age and may contribute to longevity in chinese centenarians' families. JAGS (2015) 63:1474–6. 10.1111/jgs.13553 [PubMed] [CrossRef] [Google Scholar]
- Corsonello A, Montesanto A, Berardelli M, De Rango F, Dato S, Mari V, et al.. A cross-section analysis of FT3 age-related changes in a group of old and oldest-old subjects, including centenarians' relatives, shows that a down-regulated thyroid function has a familial component and is related to longevity. Age Ageing (2010) 39:723–7. 10.1093/ageing/afq116 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Pereira da Silva A, Matos A, Valente A, Gil Â, Alonso I, Ribeiro R, et al.. Body composition assessment and nutritional status evaluation in men and women portuguese centenarians. J Nutr Health Aging (2016) 20:256–66. 10.1007/s12603-015-0566-0 [PubMed] [CrossRef] [Google Scholar]
- Franceschi C, Ostan R, Santoro A. Nutrition and inflammation: are centenarians similar to individuals on calorie-restricted diets? Annu Rev Nutr. (2018) 38:329–56. 10.1146/annurev-nutr-082117-051637 [PubMed] [CrossRef] [Google Scholar]
- Gentilini D, Mari D, Castaldi D, Remondini D, Ogliari G, Ostan R, et al.. Role of epigenetics in human aging and longevity: genome-wide DNA methylation profile in centenarians and centenarians' offspring. Age (2013) 35:1961–73. 10.1007/s11357-012-9463-1 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Sgarbi G, Matarrese P, Pinti M, Lanzarini C, Ascione B, Gibellini L, et al.. Mitochondria hyperfusion and elevated autophagic activity are key mechanisms for cellular bioenergetic preservation in centenarians. Aging (2014) 6:296–310. 10.18632/aging.100654 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Emanuele E, Minoretti P, Sanchis-Gomar F, Pareja-Galeano H, Yilmaz Y, Garatachea N, et al.. Can enhanced autophagy be associated with human longevity? Serum levels of the autophagy biomarker beclin-1 are increased in healthy centenarians. Rejuvenation Res. (2014) 17:518–24. 10.1089/rej.2014.1607 [PubMed] [CrossRef] [Google Scholar]
- Raz Y, Guerrero-Ros I, Maier A, Slagboom PE, Atzmon G, Barzilai N, et al.. Activation-induced autophagy is preserved in CD4+ T-cells in familial longevity. J Gerontol A Biol Sci Med Sci. (2017) 72:1201–6. 10.1093/gerona/glx020 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Fontana L, Villareal DT, Weiss EP, Racette SB, Steger-May K, et al. Calorie restriction or exercise: effects on coronary heart disease risk factors. A randomized, controlled trial. Am J Physiol Endocrinol Metab. (2007) 293:E197–202. 10.1152/ajpendo.00102.2007 [PubMed] [CrossRef] [Google Scholar]
- Ravussin E, Redman LM, Rochon J, Das SK, Fontana L, et al.. A 2-year randomized controlled trial of human caloric restriction: feasibility and effects on predictors of health span and longevity. J Gerontol A Biol Sci Med Sci. (2015) 70:1097–104. 10.1093/gerona/glv057 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Bruunsgaard H, Andersen-Ranberg K, Jeune B, Pedersen AN, Skinhoj P, Pedersen BK. A high plasma concentration of TNF-α is associated with dementia in centenarians. J Gerontol A Biol Sci Med Sci. (1999) 54:M357–64. 10.1093/gerona/54.7.M357 [PubMed] [CrossRef] [Google Scholar]
- Gangemi S, Basile G, Merendino RA, Minciullo PL, Novick D, et al.. Increased circulating interleukin-18 levels in centenarians with no signs of vascular disease: another paradox of longevity? Exp Gerontol. (2003) 38:669–72. 10.1016/S0531-5565(03)00061-5 [PubMed] [CrossRef] [Google Scholar]
- Gerli R, Monti D, Bistoni O, Mazzone AM, Peri G, et al.. Chemokines, sTNF-Rs and sCD30 serum levels in healthy aged people and centenarians. Mech. Ageing Dev. (2000) 121:37–46. 10.1016/S0047-6374(00)00195-0 [PubMed] [CrossRef] [Google Scholar]
- Franceschi C, Capri M, Monti D, Giunta S, Olivieri F, Sevini F, et al.. Inflammaging and anti-inflammaging: a systemic perspective on aging and longevity emerged from studies in humans. Mech Ageing Dev. (2007) 128:92–105. 10.1016/j.mad.2006.11.016 [PubMed] [CrossRef] [Google Scholar]
- Salvioli S, Monti D, Lanzarini C, Conte M, Pirazzini C, Bacalini MG, et al.. Immune system, cell senescence, aging and longevity–inflamm-aging reappraised. Curr Pharm Des. (2013) 19:1675–9. 10.2174/1381612811319090015