قبل البدء في عرض هذه المادة ، أود أن أقول بضع كلمات عن نفسي: عضو في المجتمعات المحلية ضد الحرمان من فيروس نقص المناعة البشرية (فيروس نقص المناعة البشرية / الإيدز): في الفترة 2018-2016 ، "منشقون فيروس نقص المناعة البشرية / الإيدز وأطفالهم" ، من عام 2018 - "إنكار فيروس نقص المناعة البشرية / الإيدز والطب البديل".
رأيي - وليس فقط رأيي - هو أن معظم حالات رفض علاج فيروس نقص المناعة البشرية ناتجة عن سوء فهم عادي وهو أن هذه عدوى مزمنة محكومة ، وكذلك وصم الأشخاص المصابين بفيروس نقص المناعة البشرية - استخدام كليشيهات الشائعة التي تشير إلى أن فيروس نقص المناعة البشرية - مرض الطبقات الدنيا في المجتمع أو العكس ، "النخبة الثقافية". هذا ليس كذلك لفترة طويلة - في روسيا ، يعيش ما يقرب من 1 ٪ من السكان مع فيروس نقص المناعة البشرية ، والوضع لا يخطط للتحسن.
منذ حوالي عام ، شجعني العديد من المقالات حول هذا المورد على كتابة خمس ملاحظات حول تاريخ مكافحة الفيروسات. كان الغرض من هذه المقالات هو وصف مبادئ العمل لأنواع مختلفة من عقاقير فيروس نقص المناعة البشرية (كان الخبراء الاستشاريون متخصصون في علم الأحياء المجهرية وأخصائي الأمراض المعدية). آمل أن تستمتع ترتيب هذه الملاحظات.
حول الفيروسات
لذلك ، بضع كلمات حول الفيروسات بشكل عام: فهي تحتل موقعًا وسيطًا بين العالم الحي وغير الحي ؛ فهي غير قادرة على التكاثر المستقل ؛ ولهذا ، فإن خلايا الكائن الحي المضيف مطلوبة.
يتم تنظيم الفيروس بكل بساطة: فهو يحمل رمزًا وراثيًا ، ويكون الكود مغلقًا في قفيصة ، ويكون القفيص محاطًا في بعض الأحيان بقذيفة. يمكن تقديم الكود بعدة طرق. حامل الرمز هو الحمض النووي أو الحمض النووي الريبي ، أي الحمض النووي (NK). يمكن أن تكون سلاسل التعليمات البرمجية واحدة أو اثنتين: NK مزدوجة السلاسل وحيدة السلاسل. يمكن إغلاق السلسلة في حلقة أو خطي. في عام 1971 ، قام ديفيد بالتيمور ، وفقًا لهذه العلامات ، بتقسيم الفيروسات إلى 7 فصول. هذا التصنيف لا يزال قيد الاستخدام اليوم وسيكون مهمًا في شرح كيفية عمل بعض الأدوية.
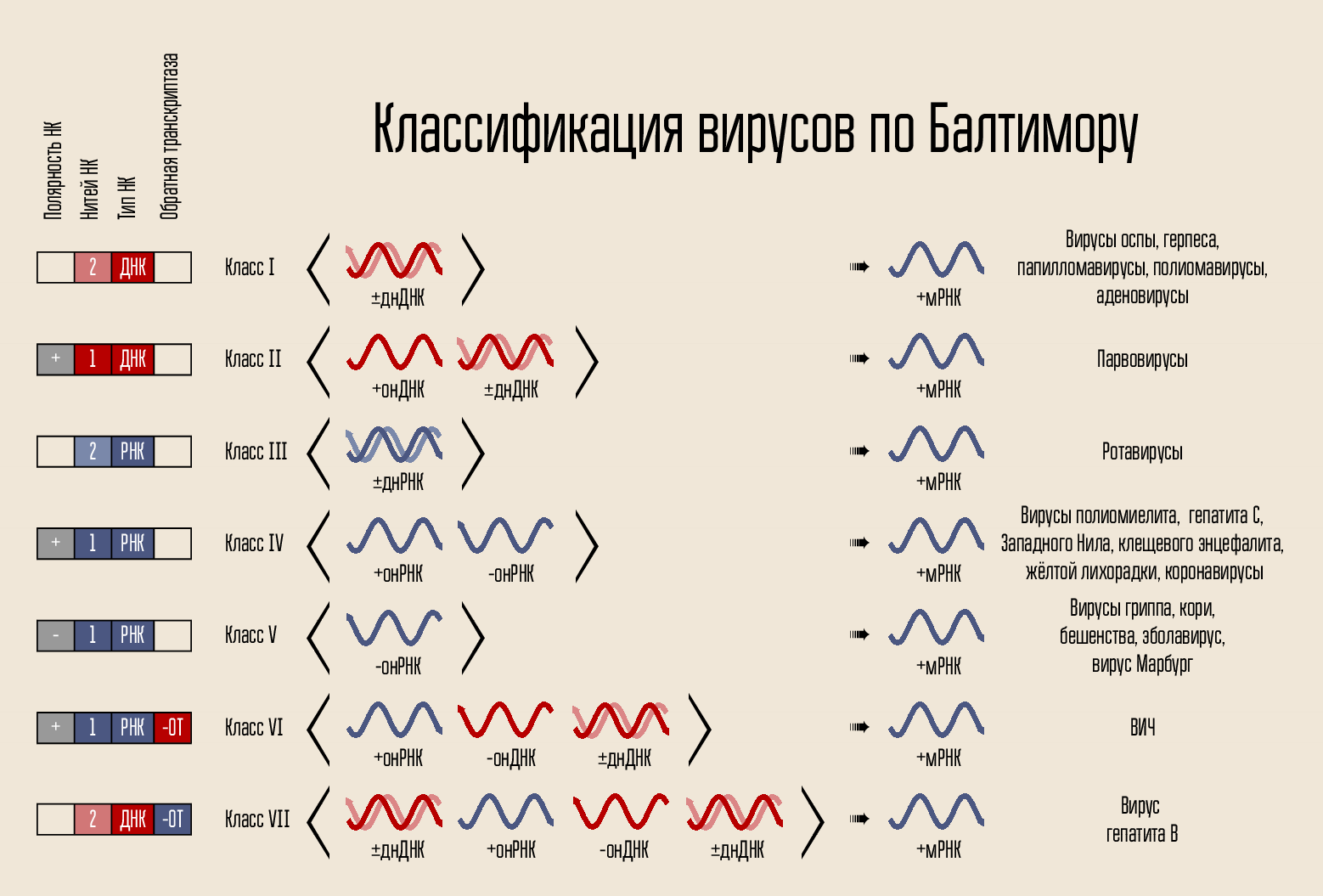
الكود نفسه لبناء فيروس جديد لا يمكن أن يخترق الخلية نفسها ؛ إنه يحتاج إلى بعض آليات الاختراق. لذلك ، هناك قشرة بروتين - كابسيد ، يحمي NK للفيروس ، ويساعد على اختراق الخلية. في بعض الحالات ، قد تحتوي الفيروسات على أغشية شحمية إضافية.
تغلغل الفيروس في الخلية

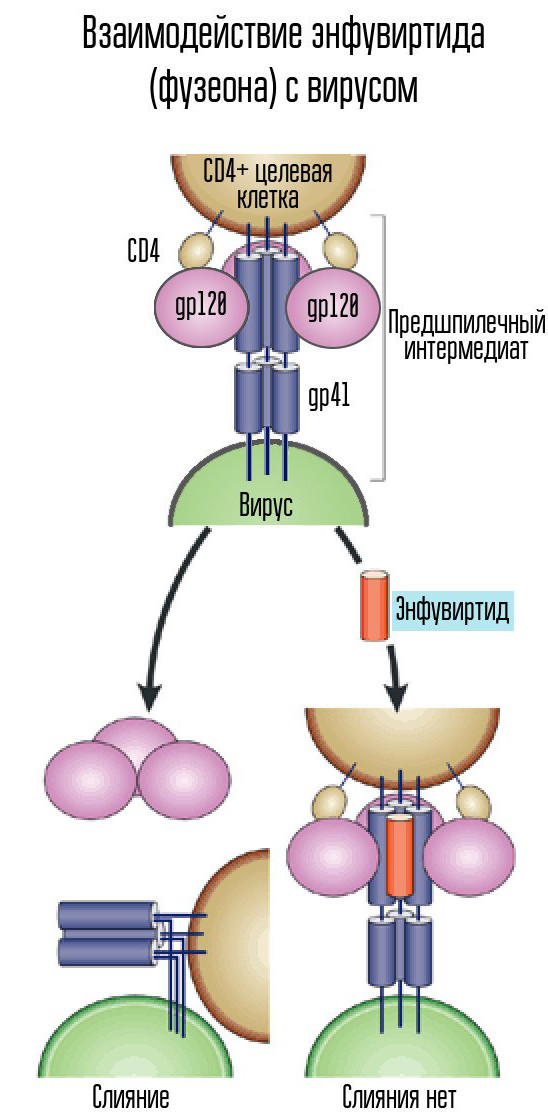
لدخول الخلية ، يجب أن يتصل الفيروس بغشاءه. للقيام بذلك ، هناك بروتينات على سطح الفيروس ترتبط ببروتينات مستقبلات الخلية المضيفة - في أماكن على سطح جدار الخلية يمكن للفيروس أن يعلق عليها. ويجب أن يكونوا ملائمين للفيروس بشكل صارم ، وإلا فلن يكون بإمكانه التمسك بالخلية.
لهذا ، يستخدم فيروس نقص المناعة البشرية مستقبلات CD4 (الخلايا التي تحتوي على مستقبلات كهذه هي خلايا المناعة في الجسم ، بما في ذلك الخلايا اللمفاوية التائية والخلايا الأحادية والبلاعم وما إلى ذلك). لا يكفي CD4 بمفرده - فأنت بحاجة إلى معالجات أساسية أخرى ، إما CCR5 أو CXCR4. يستخدم فيروس نقص المناعة البشرية بروتين غمد gp120 للانضمام. بعد ذلك ، يتغير شكل بروتين مظروف فيروس آخر ، gp41. ينحني إلى الجانب ، ويشكل دبوس الشعر ويسمح لقفيصة الفيروس بالاندماج مع الخلية.
Enfuvirtide (Fuzeon) ، مثبط لبروتين gp41 ، هو أحد العوامل المستخدمة لمحاربة الفيروس. يجمع Enfuvirtide مع هذا البروتين لمنع تكوين دبوس الشعر. وبالتالي ، لا يمكن دمج قفيصة الفيروس مع الخلية ولا تحدث العدوى. هذا الدواء هو المانع الانصهار الوحيد المطوّر والمعتمد.
تعد الفيروسات القهقرية ، التي ينتمي فيروس نقص المناعة البشرية ، هدفًا غير مريح للغاية للأدوية بسبب تنوعها. الخلايا البشرية أقل تقلبًا. من المعروف أن حوالي 1 ٪ من سكان شمال أوروبا محصنون ضد فيروس نقص المناعة البشرية: فهم حاملون لطفرة CCR5-∂32 ، مما يجعل مستقبلات CCR5 غير مناسبة للاندماج مع فيروس نقص المناعة البشرية.
لسوء الحظ ، يعد تغيير شكل هذا المستقبل إلى الأبد ، بما في ذلك الخلايا الجديدة التي لا تزال تظهر في جسم الإنسان ، مهمة صعبة للغاية (على الرغم من وجود محاولات) ، ولكن تطوير مثبط المستقبل هو دواء يرتبط بمستقبلات الخلايا ويمنع فيروس نقص المناعة البشرية من الانضمام له - ربما جدا.
كان هناك العديد من مثبطات مستقبلات CCR5 و CXCR4 قيد التطوير ، لكن الوحيد الذي تمت الموافقة عليه حتى الآن هو maraviroc ، وهو مثبط CCR5.
النسخ العكسي
ماذا يحدث بعد اندماج الفيروس مع الخلية في حالة فيروس نقص المناعة البشرية؟
فيروس نقص المناعة البشرية هو فيروس بالتيمور من الفئة السادسة ، لأنه يخزن جينومه في الحمض النووي الريبي. يوجد دنا في قلب الخلية ، لذلك يحتاج فيروس نقص المناعة البشرية إلى تحويل حمض نووي إلى آخر. يتم تنفيذ مثل هذا النسخ (NK → NK) بواسطة إنزيمات مماثلة تسمى polymerases. بالنسبة إلى بوليميريز الحمض النووي الريبي المعتمد على الحمض النووي الريبي (أي قراءة معلومات من الحمض النووي الريبي) (أي عند ظهور الحمض النووي الذي يظهر فيه) هناك اسم خاص - النسخ العكسي. يأخذ المستنسخ العكسي الديوكسينوكليوسيد المرغوب فيه (على سبيل البساطة ، فهو يشتمل في الواقع على ثلاثي فوسفات الديوكسينوكليوسيد) ويبني الحمض النووي المكمل للحمض النووي الريبي الفيروسي المقابل.
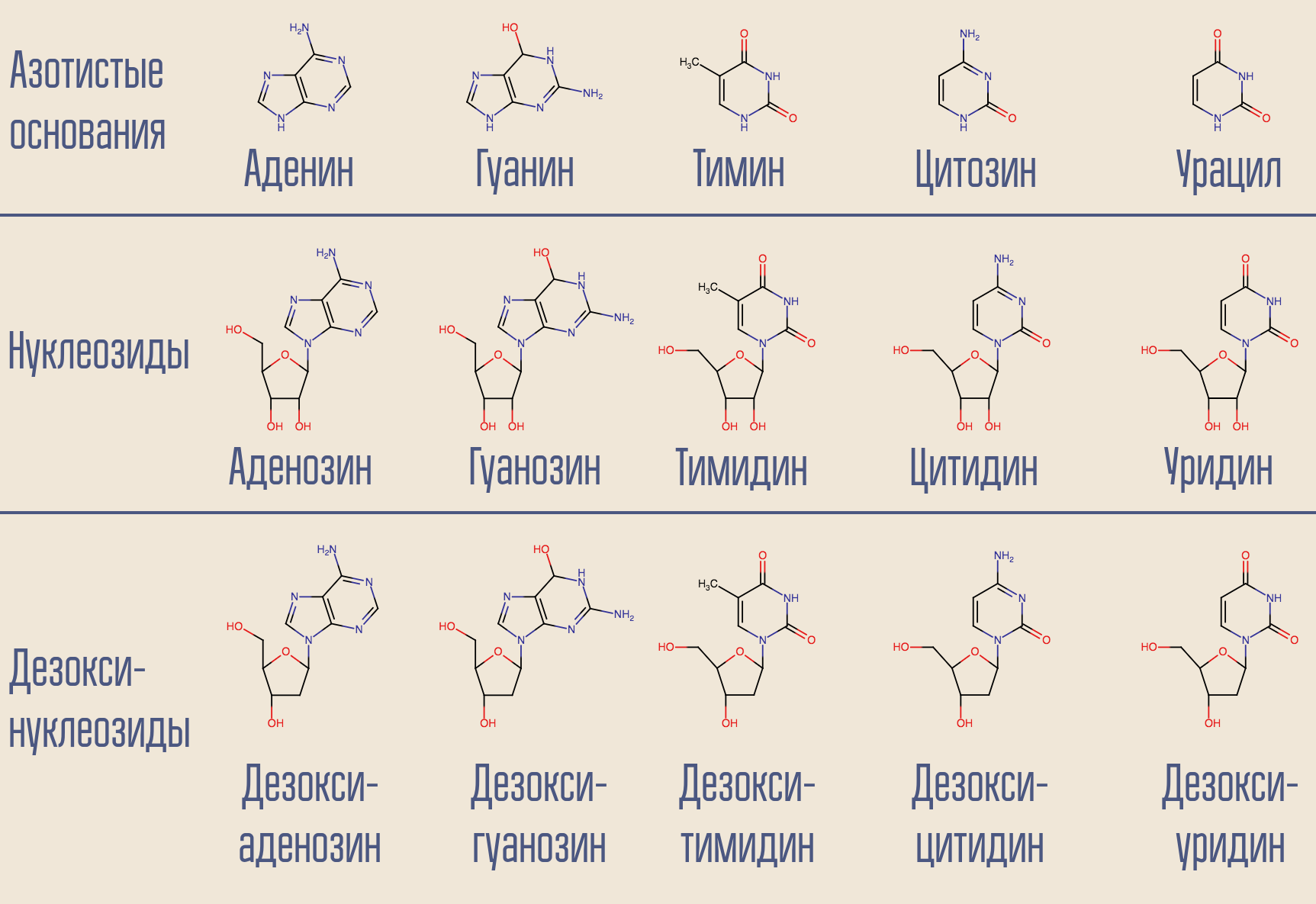
هل من الممكن مقاطعة هذه العملية؟ نعم ، لهذا تحتاج فقط أن تهدئ من نسخة منقوصة عكسيّة تشبه النوكليوسايد ولكنها ليست واحدة. هذه هي الطريقة التي يتصرف بها أول عقار لفيروس نقص المناعة البشرية ، وهو زيدوفودين (أزيدوثيميدين ، AZT). وهو مشابه ل deoxythymidine ، لكنه ليس كذلك.
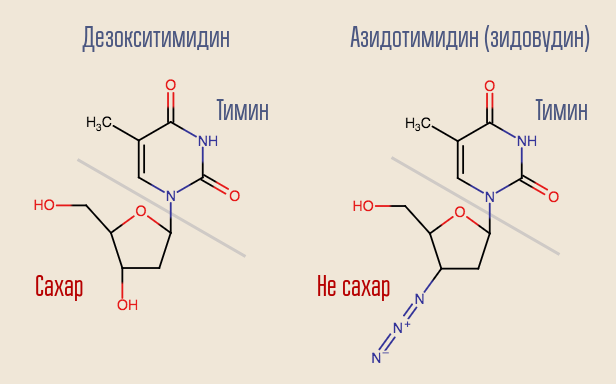
تم تطوير Azidothymidine كجزء من البحث عن المواد التي يمكن أن تكافح الأورام. كان من المفترض أنه سيكون جزءا لا يتجزأ من بناء الحمض النووي البشري العادي ، مقاطعة ذلك. وبالتالي ، فإن الدواء سيؤثر بشدة على الخلايا السرطانية التي تنقسم بسرعة أكبر. كانت هناك أسباب معينة للتفكير في ذلك - تم تصنيع عقار آخر من هذه المجموعة سابقًا ، وهو 6-ميركابتوبورين ، وكان فعالًا في علاج سرطان الدم.
لسوء الحظ ، في التجارب على الحيوانات ، ثبت أن الدواء غير فعال وتم نسيانه لبعض الوقت ، حتى عام 1984 قام عالم الفيروسات مارتي سانت كلير ، الذي كان يعمل في مختبرات مؤسسة بوروز ويلكوم ، بإجراء دراسات لفحص جميع المواد المتاحة للعلاج لديهم مرض جديد - عدوى فيروس نقص المناعة البشرية.
عكس النسخ من "زيدوفودين" المعترف به على أنه ديوكسي ثيميدين وحاول دمجه في الحمض النووي. تمت مقاطعة تخليق الحمض النووي في هذا الموقع لأن الدواء كان يشبه فقط الديوكسيثيميدين. قمع Zidovudine تماما تكاثر الفيروس ، وبدأت التجارب البشرية على الفور تقريبا.
تم تقسيم المتطوعين المصابين بفيروس نقص المناعة البشرية إلى مجموعتين ، تلقت إحداهما دواءً وهمياً ، بينما تلقت المجموعة الأخرى عقار آيز. كان الفرق بين المجموعتين مذهلاً لدرجة أن الاختبارات الأخرى اعتبرت غير إنسانية - أظهر العقار فعالية مذهلة.
دفع نجاح الزيدوفودين إلى إجراء دراسات لمثبطات النسخ العكسي الأخرى للنيوكليوزيد (NRTIs) ، وظهرت العديد من الأدوية الأخرى في وقت قصير. والأكثر إثارة للاهتمام من الأدوية الأولى هو اللاميفودين ، وهو نظير لنيسوكليوسيد آخر ، ديوكسي سيتيدين. عيب اللاميفودين هو أنه مع العلاج الأحادي لهذا الدواء ، تتطور المقاومة بسرعة كبيرة ، في غضون شهر تقريبًا. هذا يرجع إلى طفرة نقطة واحدة من فيروس نقص المناعة البشرية ، M184V. على الرغم من هذا ، كان من المرغوب فيه ترك اللاميفودين في المخطط. والحقيقة هي أن الفيروس مع هذا التحور شديد الحساسية للزيدوفودين ، وأن الطفرة نفسها تقلل من معدل تكرار الفيروس.
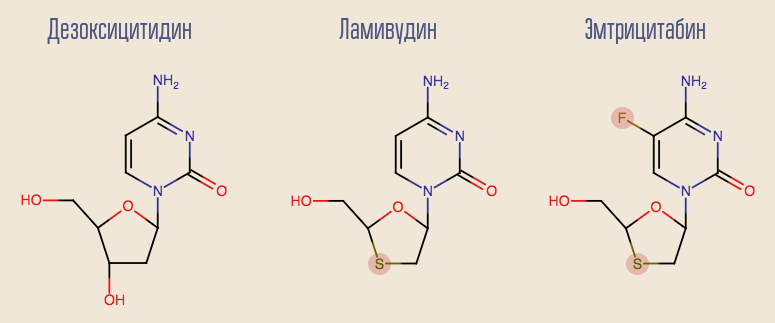
في الوقت الحالي ، بدأ اللاميفودين بالتدهور تدريجياً في الماضي ، مما أفسح المجال أمام التماثلية الأكثر حداثة ، إمتريتيتابين. أظهر كل من اللاميفودين ونظير deoxyadenosine ، adefovir ، نتائج جيدة في علاج التهاب الكبد B. لسوء الحظ ، فقد ثبت أن adefovir غير فعال في علاج فيروس نقص المناعة البشرية. ومع ذلك ، بعد تعديل بسيط لجزيئه ، ظهرت نسخة محدثة منه - tenofovir. Tenofovir و emtricitabine هي جزء من العديد من خطوط العلاج الحديثة.
إن الجمع بين اثنين من NRTIs يمكن أن يطيل حياة الأشخاص المصابين بفيروس نقص المناعة البشرية بشكل ملحوظ ، ومع ذلك ، فمن الواضح أنه من أجل قمع الفيروس بالكامل ، كان من الضروري تضمين دواء واحد على الأقل من نوع مختلف من الإجراءات ، لأن الفيروس طور عاجلاً أم آجلاً مقاومة لأي مجموعة من NRTIs. كانت إحدى المواد الأولى لنوع مختلف من العمل نوعًا آخر من مثبطات النسخ العكسي العكسي - غير النيوكليوسيد (NNRTI). على الرغم من أن النسخ العكسي العكسي (RT) يريد العمل مع شيء مثل النيوكليوسيد (النيوكليوسيد ثلاثي الفوسفات) ، يمكنك محاولة صنع مادة ترتبط بـ RT وتغيير شكلها بحيث لم تعد قادرة على أداء وظائفها.
في عامي 1996 و 1998 ، تمت الموافقة على مادتين من هذه المواد ، nevirapine و efavirenz ، على التوالي. كل واحد منهم يقمع عمل OT بشكل فعال ، وبالاشتراك مع اثنين من NRTIs ، فإنه يخلق خطة كاملة من العلاج المضاد للفيروسات الرجعية (HAART) - نشط للغاية لشخص يعيش مع فيروس نقص المناعة البشرية ليعيش حياة كاملة ، والتي لا تختلف مدتها عن حياة شخص بدون فيروس نقص المناعة البشرية .
في عام 2006 ، تمت الموافقة على أول دواء مركب للاستخدام مرة واحدة يوميًا: Atripla. يتكون Atripla من NRTIs ، إمتريتيتابين وتينوفوفير (في شكل عقار tenofovir disoproxil - عقار أولي ، شكل جرعة معدلة كيميائياً يتحول إلى دواء مباشرة في الجسم) ، وواحد NNRTI ، efavirenza. أصبح Atripla خطوة جديدة نوعيا نحو تحسين نوعية حياة المرضى. حتى الآن ، تعد الأدوية العامة لأتريبلا واحدة من أكثر الأدوية شيوعًا في العالم (في البلدان النامية).
ومع ذلك ، اليوم NNRTIs يغادرون تدريجيا السوق - الأدوية القديمة تسبب آثار جانبية مختلفة. لذلك ، على سبيل المثال ، يمكن أن يتسبب الشهرين الأولين بعد بدء تناول عقار efavirenz في حدوث الدوخة وغيرها من التأثيرات المشابهة في بعض المرضى (وليس كلهم!). بالطبع ، هذا أفضل بكثير من الموت الوشيك ؛ لا تستمر هذه الحالة لفترة طويلة ، وقد تعلموا بالفعل كيفية التعامل معها - ومع ذلك ، فإن الاتجاه الحالي هو الانتقال إلى مثل هذه الأدوية ، لا يلاحظ المريض أي آثار جانبية منها.
التكامل
إذا كان النسخ العكسي قد قام بعمله ، فهل من الممكن إيقاف دمج الحمض النووي الفيروسي في الحمض النووي للخلايا؟ ويشارك إنزيم خاص يسمى integrase في هذه العملية.
تستمر عملية دمج الحمض النووي الفيروسي في عدة مراحل. في البداية ، يرتبط الإندماج بحمض النووي الفيروسي ، ويزيل النوكليوتيدات GT من الطرف الثالث من كل حبلا. بعد ذلك يتم نقل المجمع بالكامل إلى النواة ، حيث يحفز integrase مرحلة نقل السلسلة. هذه المرحلة هي عبارة عن تفاعل transesterification (تبادل الجذور): تصبح النيوكليوتيدات DNA في الخلية مرتبطة ليس مع بعضها البعض ، ولكن مع النيوكليوتيدات في DNA الفيروسي. دمج هجمات السندات النوكليوتيد تقع على مسافة خمسة النيوكليوتيدات. وهكذا ، بعد التكامل ، لا يزال هناك: معالجة النهايات 5 'من سلاسل الحمض النووي الفيروسي ، واستكمال 5 نيوكليوتيدات مفقودة وربط (ربط اثنين من فروع NK مع ligase الإنزيم) ، والتي يتم تنفيذها بمشاركة البروتينات الخلوية [1].
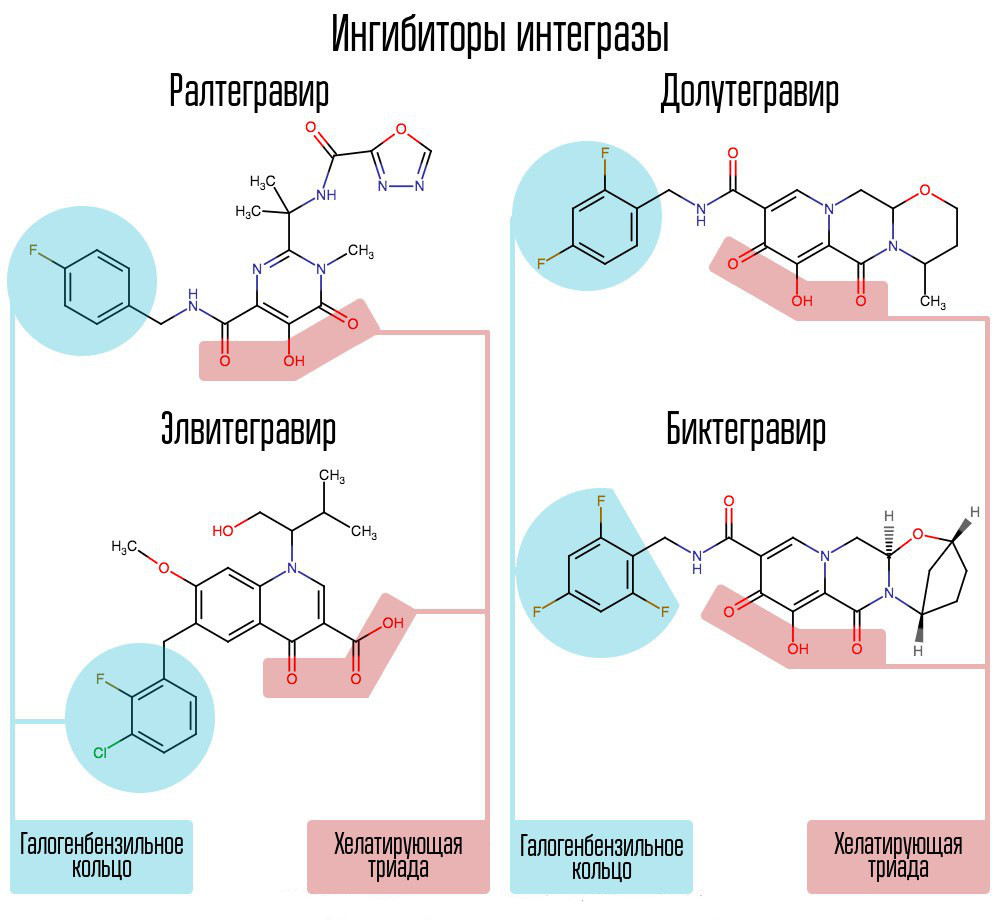
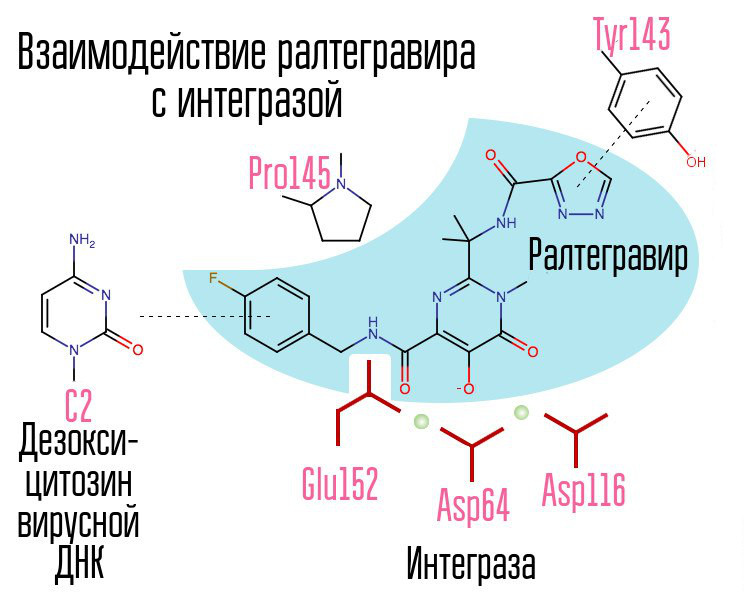
كشف حوالي 250،000 مادة في مكتبات المركبات الكيميائية عن مواد من شأنها أن تحول دون تكامل فيروس نقص المناعة البشرية. كل منهم تبين أن 2،4 مركبات ديوكسي بوتانيك حمض. لقد قاموا بتنسيق أيونات المعادن في المركز النشط للتكامل - في هذا الجزء ، والذي كان مسؤولاً عن نقل السلسلة. أدت المحاولات الإضافية لتطوير مثبطات إنزيم HIV-1 إلى ظهور مشتق من N-pyrimidinone ، وهي مادة MK-0518 ، تسمى raltegravir. [2]
من بين مثبطات raltegravir ومثبطات الانتريز اللاحقة ، ثالوث المخلّب (أيونات المعادن المنسقة) وحلقة الهالوجين - البنزيل التي تتفاعل مع الديوكسيسيتوزين قبل الأخير عند الطرف الثالث من الحمض النووي الفيروسي المرتبط بالإنزيم.
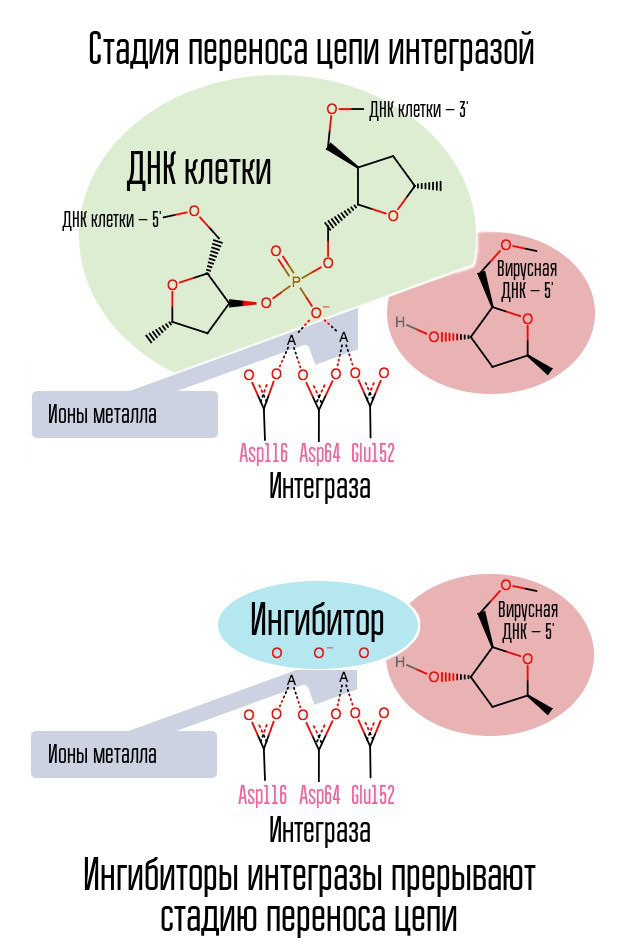
إن عملية دمج الفيروس في الخلية هي الخطوة الأخيرة التي يكون فيها العلاج الوقائي التالي للوقاية فعالاً. بعد ذلك ، تظهر الخلايا التي تحمل DNA DNA في نواتها في جسم الإنسان. النافذة الأكثر فعالية للوقاية بعد التعرض هي حوالي 6-10 ساعات.
تتفاعل حلقة الهالوجينبزيل في جزيء مثبط الانتريز مع الحمض النووي الفيروسي ، وتتفاعل مجموعة من ذرات الأكسجين مع ذرتين معدنيتين. يستخدم تكامل الفيروسات هذه الذرات المعدنية لإدخال الحمض النووي الفيروسي في الخلية. نتيجة لذلك ، يتم حظر عملية التكامل.
تمكنت الذكاء الاصطناعى الحديث ، مثل دولوتغرافير ، من التغلب على "أمراض الطفولة" في رالتغرافير المرتبطة بالتشكيل السريع للمقاومة.
التحلل البروتيني
بعد اجتياز الجينوم الفيروسي مرحلة النسخ ، يتم إرسال الحمض النووي الريبي الفيروسي المنشأ للخروج من الخلية. في عملية إنشاء الفيروس ، يوجد إنزيم فيروسي آخر يسمى البروتياز. يقطع البروتياز البروتينات الطويلة إلى بروتينات وظيفية فردية ، مما يؤدي إلى تكوين إنزيمات فيروسية وبروتينات هيكلية للفيروس.
ينشط البروتياز ليس فقط ضد بروتينات فيروس نقص المناعة البشرية ، ولكن أيضًا ضد بروتينات الخلية المضيفة ، مما قد يفسر التأثير السام للخلايا لفيروس نقص المناعة البشرية (موت الخلية).
إذا تم حظر الأنزيم البروتيني ، فلن يتمكن الفيروس من المرور بمرحلة النضج وسيظل غير فعال تمامًا. إن البروتياز HIV-1 عبارة عن بروتياز أسبارتيك ارتجاعي نموذجي مع تسلسل الحمض الأميني المميز Asp25 Thr26 Gly27 (حمض الأسبارتيك - ثريونين - جليكاين) في المركز النشط. تمت الموافقة على مثبط الأنزيم البروتيني الأول ، ساكوينافير ، من قبل إدارة الأغذية والعقاقير في 6 ديسمبر 1995. وبالتالي ، أصبح العلاج المضاد للفيروسات القهقرية النشط للغاية متاحًا لأول مرة بعد إنشاء ساكوينافير.
ممثل آخر نموذجي لهذه المجموعة من الأدوية هو لوبينافير (يستخدم بالاقتران مع ريتونافير - كاليترا - أحد أكثر أدوية فيروس العوز المناعي البشري شيوعًا في روسيا). ريتونافير هو أيضا مثبط للبروتياز ، ولكنه يستخدم كعامل مساعد - بفضل نشاطه ، يزداد تركيز الدواء الرئيسي.
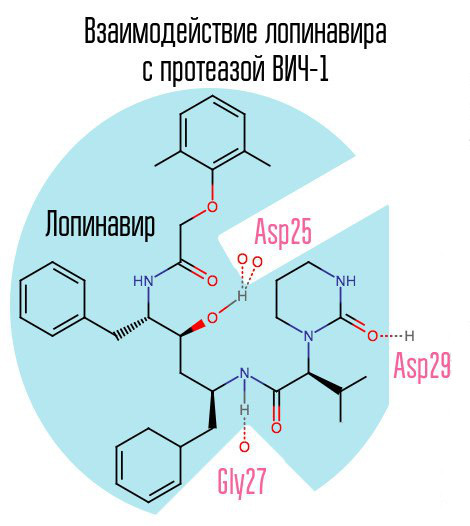
نظرًا لأن saquinavir ومثبطات الأنزيم البروتيني اللاحق (PIs) موجهة على وجه التحديد إلى المركز النشط للإنزيم ، مع تطور مقاومة أحد PI ، هناك احتمال كبير أن تحدث مقاومة ل PIs أخرى. يمكن أن يكون حل هذه المشكلة هو إنشاء مثبطات يتم توجيهها إلى مناطق البروتياز الأخرى.
إن عقار darunavir (prezista) ، الذي ظهر في عام 2006 ، قد خفف إلى حد ما من المشكلة الحادة للسلالات المقاومة لفيروس HIV-1 ، حيث شكل رابطًا غير مستخدم مسبقًا مع حمض الأسبارتيك في الموضع 30.
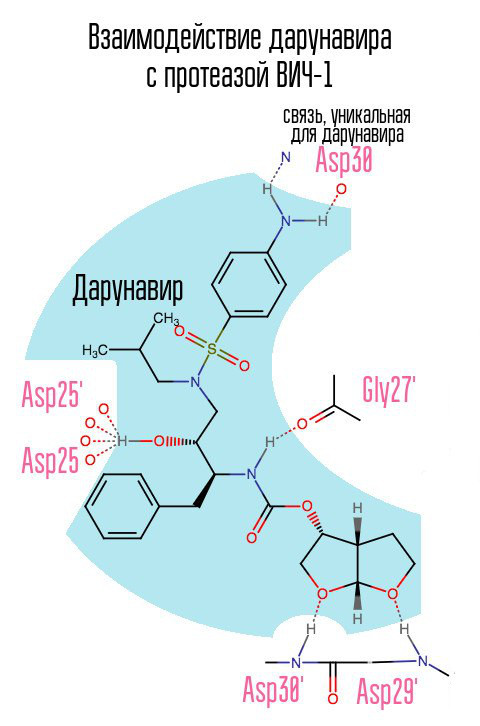
بدون البروتياز ، لا يمكن للفيروس الخضوع لعملية النضج. ترتبط المثبطات بالمركز النشط للبروتياز وتمنعه من العمل.
تكون مثبطات الأنزيم البروتيني فعالة للغاية في الحمل الفيروسي العالي: لأنه في هذه اللحظة يولد العديد من الفيروسات الجديدة في الجسم ، لا تسمح PIs لهم بالنضج ، وبالتالي تقليل الحمل الفيروسي بشكل فعال في وقت قصير. ومع ذلك ، في الوقت الحالي ، لا يتم استخدام PIs في علاج الخط الأول ، مما يفسح المجال لتكامل مثبطات (II).
كان السبب في ذلك هو الآثار الجانبية: الحقيقة هي أن الكاليترا نفسها ، على سبيل المثال ، أدت إلى تثبيط غير محدد لبروتينات البروتينات المزودة بالطعام ، ونتيجة لذلك دخلت هذه البروتينات الأمعاء الدقيقة وتسببت في حدوث الإسهال. اتباع نظام غذائي معين أو استخدام PIs جديدة ، مثل prezista ، يمكن أن يقلل من هذا التأثير إلى ما يقرب من الصفر ، ولكن تأثير آخر يرتبط بزيادة مستويات السكر غالبا ما يمنع استخدام مثبطات الأنزيم البروتيني إلى أجل غير مسمى.
نظم العلاج الحديثة
حتى الآن ، تعتبر الأحدث مخططات تتألف من مثبط انتيغرايز وواحد أو اثنين من NRTIs (dolutegravir + abacavir + lamivudine ؛ dolutegravir + lamivudine هو مخطط شائع مكون من عنصرين ، ومع ذلك ، لا يناسب الجميع). تتيح هذه المخططات للشخص أن يعيش حياة كاملة لا تختلف في المدة عن حياة شخص بدون فيروس نقص المناعة البشرية.
على الرغم من كل النجاحات ، لا يزال العلاج الكامل لفيروس نقص المناعة البشرية غير ممكن (زرع الخلايا الجذعية لنخاع العظم من متبرع مع طفرة CCR5-allows32 يسمح بتحقيق مثل هذه النتيجة ، ولكن ، على ما يبدو ، فقط في حالة حدوث تفاعل مقابل زرع المضيف ، في عدد كبير من الحالات التي تؤدي إلى وفاة المتلقي).
استنتاج
ساعدت أساليب فيروس العوز المناعي البشري المتقدمة في مكافحة الأمراض المعدية الأخرى: كما ذُكر أعلاه ، فإن اللاميفودين والتينوفوفير فعالان ضد فيروس التهاب الكبد البائي (فئة بالتيمور السابع - يمكن أن يحول بوليميريز الالتهاب الكبدي الوبائي الحمض النووي الريبي الحمض النووي الريبي النووي إلى الحمض النووي ، لذلك تكون بعض العناصر غير الفعالة فعالة في مكافحته) . ساعدت المعرفة المكتسبة على تطوير عقاقير ذات تأثير مباشر ضد التهاب الكبد الوبائي ، والتي يمكن أن تعالج اليوم هذا المرض تمامًا (لا يحتوي الالتهاب الكبدي C على مرحلة كامنة ، لذلك ، عند قمع الحمل الفيروسي ، لا يوجد مكان جديد للإصابة بالفيروسات).
[1] كوروليف ب. ، أغابكينا يو. يو ، جوتيك م. ب. مشاكل وآفاق الاستخدام السريري لمثبطات تكامل فيروس العوز المناعي البشري -1
[2] Shahgildyan V.I. مثبطات فيروس نقص المناعة البشرية المتكاملة - أساس العلاج المضاد للفيروسات القهقرية الفعال والآمن