
لا يمكن إنكار نجاحات علم الأورام السريرية الحديثة. عمليات أكثر وأكثر تعقيدًا ، أدوية جديدة ، طرق فعالة لتخفيف الألم والقضاء على الأعراض المؤلمة.
تحدثنا في مدونتنا بما فيه الكفاية عن كيف يمكن اليوم تمديد الحياة وجعلها أسهل للمرضى حتى في المراحل الأخيرة من المرض.
ولكن ، رغم ذلك ، يتعلم الآلاف من مرضى السرطان في جميع أنحاء العالم يوميًا أن الورم الذي استسلم يوم أمس لعلاج معين ينمو مرة أخرى اليوم أو يتحول إلى ورم خبيث. يجد الأطباء أنفسهم في حالة توقف تام: فقد تم تجريب جميع الأدوية الموصوفة وطرق العلاج ، ولا توجد أدوية فعالة لهذا المريض.
ومع ذلك ، حتى وسيلة للخروج من هذا المأزق يمكن العثور عليها. مع تطور علم الوراثة والبيولوجيا الجزيئية ، وجد علماء الأورام طريقة جديدة لدراسة الورم من أجل العثور على نقاط الضعف فيه.
للقيام بذلك ، استخدم الاختبارات الجينية الجزيئية - لتحديد خصائص الحمض النووي للخلايا السرطانية. الأسلوب معقد تقنيًا ، مكلف ، ويتطلب معرفة محددة من الطبيب.
تستغرق الدراسة 3 أسابيع ، وتتراوح تكاليفها من 250 إلى 670 طنًا نتيجة لذلك ، يتلقى الطبيب تقريرًا يحتوي على 30 صفحة من المعلومات المعقدة ، والتي لا يزال بإمكانه استخدامها. ولكن بالنسبة للمرضى الذين توقفوا بالفعل عن الأمل ، فإن هذا يوفر وقتًا إضافيًا في الحياة.
في
الطب 24/7 ، نلجأ بانتظام إلى البحوث الوراثية الجزيئية لعلاج شخص عندما "حاول الجميع ذلك - لا شيء آخر للقيام به." والمرضى ، الذين بدوا وكأنهم ليسوا أكثر للمساعدة ، يواصلون العيش. بعضها شهرين بدلاً من أسبوعين ، والبعض الآخر سنوات بدلاً من شهرين.
اليوم نريد أن نتحدث عن كيفية إجراء الاختبارات الجينية الجزيئية ، وفي أي الحالات يمكن أن تساعد المريض والمعرفة التي يقدمها الطبيب.
نحن جميعا المسوخ ، وهذا هو المعيار. لكن بعض الطفرات تؤدي إلى السرطانتعيش الخلايا "اللائقة" دون إزعاج الآخرين. يستخدمون كمية مخصصة من الموارد ، ويؤدون وظائفهم البيولوجية بشكل كاف ، ويموتون في الوقت المناسب ، ويمنحون الطريق للأجيال القادمة (وتسمى هذه العملية موت الخلايا المبرمج). كل 7-10 سنوات ، يتم تحديث جسم الإنسان بالكامل.
للقيام بذلك ، تنقسم باستمرار كل الخلايا الجسدية (تلك التي تشكل الجسم) ، باستثناء خلايا الدم الحمراء.
قبل الانقسام ، يتم تخزين الخلية بـ "نسخة" من المعلومات الوراثية الوراثية الموجودة في جوهرها. يتم نسخ خيوط الحمض النووي "المطوية" في الكروموسومات داخل النواة ، أي مضاعفة. وبعد ذلك ، تنقسم الخلية ، وتوزع بهدوء على كل خلية من الخلايا الابنة مجموعة متطابقة من الكروموسومات. من خلية واحدة ، اثنتان متشابهتان تمامًا ، ومعهما حقائبهما الجينية ، يحصل كل منهما على "معرفة" بكيفية عيشه ، وما هي الوظيفة التي يجب القيام بها ، وعدد المرات التي يجب مشاركتها في الحياة.
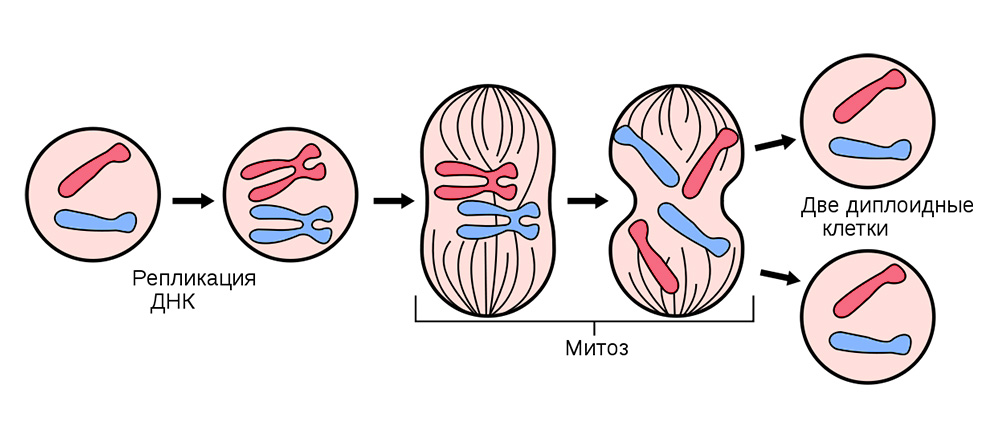 يحدث انقسام الخلايا الجسدية في جميع الأعضاء والأنسجة.
يحدث انقسام الخلايا الجسدية في جميع الأعضاء والأنسجة.في بعض الأحيان في عملية فشل التقسيم - تتحول الطفرات. إما أن تنفصل حبلا الحمض النووي ، سيتم نسخها مع وجود خطأ ، أو ستختلط أقسام الكروموسومات. يمكن أن تؤثر المئات من العوامل على هذا: من الإجهاد ودخان التبغ إلى التعرض للإشعاع.
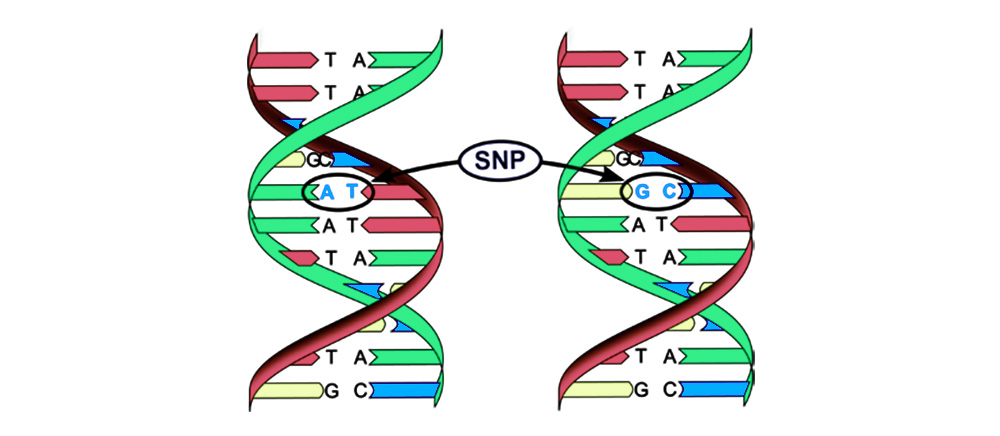
يمكن تقسيم الطفرات إلى 4 أنواع.1. استبدال زوج أساسي (تعدد الأشكال النوكليوتيد ، SNP): يتحول أحد النوكليوتيدات - "حرف" الكود الوراثي - إلى آخر. هيكل البروتين المشفر بواسطة تسلسل النيوكليوتيدات هذا قد تعطل.
 2. انحرافات الكروموسومات.الحذف
2. انحرافات الكروموسومات.الحذف - فقدان موقع كروموسوم. تحدث بسبب إنهاء الجزء الطرفي أو تمزق الحمض النووي في مكانين في وقت واحد. هذا كل شيء - لم يعد يتم التعبير عن هذا الجين على الكروموسوم.
يمكن إدخال "أجزاء" من الحمض النووي في الكروموسوم المجاور -
إدخال (أو انقلاب ، إذا حدث الإدراج بترتيب عكسي)
سينتج . في بعض الأحيان بين الصبغيات يوجد "تبادل متبادل" لأقسام الحمض النووي -
الإزفاء . والنتيجة واحدة: يتم
التعبير عن الجينات "الإضافية".
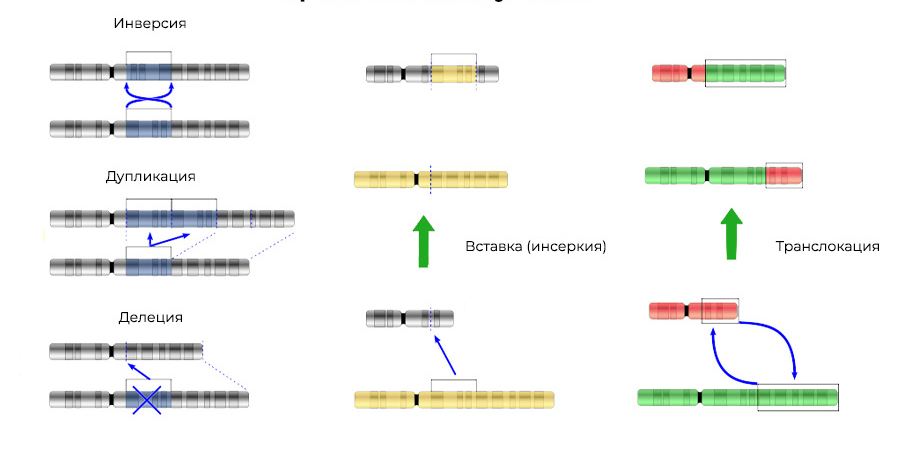 لا تغير الطفرات هيكل موقع الحمض النووي فحسب ، بل تتغير أيضًا ترتيب هذه المواقع3. اندماج الجينات
لا تغير الطفرات هيكل موقع الحمض النووي فحسب ، بل تتغير أيضًا ترتيب هذه المواقع3. اندماج الجينات - يتم "تجميع" الجين من أجزاء من الجينات الأخرى ويتم التعبير عنها (تحريكها) ككل. إن البروتين الذي يعبر عن مثل هذا الجين المخيّم يتضح أيضًا أنه غير طبيعي ، هجين ، له خصائص ضارة.
 اثنين من الجينات "عالقة معًا" أثناء الإزاحة وشكلت جينًا خيمريًا (يسبب سرطان الدم)
اثنين من الجينات "عالقة معًا" أثناء الإزاحة وشكلت جينًا خيمريًا (يسبب سرطان الدم)نحن محظوظون لأن الحمض النووي مليء بأقسام غير مهمة لا تشفر أي شيء. تحدث طفرات كثيرة في هذه المناطق - وتبين أنها غير مهمة ، وليس لها أي تأثير على عمل الخلايا الإضافي. وهذه الخلية ، مع اختلاف بسيط عن "المعيار" ، تواصل العيش ومشاركتها بشكل طبيعي.
على مدى 70 عامًا ، تحدث 100 تريليون خلية في جسم الإنسان. هذا هو 1.4 تريليون تقسيم سنويًا - هناك حالات كافية لتجميع "كتلة حرجة" من الأخطاء في الحمض النووي مع مرور الوقت ، أو حتى لا يزال هناك فشل آخر في قسم الحمض النووي الذي يشفر شيئًا مهمًا. سيؤدي ذلك إلى حدوث طفرة غير ضارة ، والتي ستصبح الخلية خبيثة (خبيثة).
تتميز الخلية الخبيثة عن اضطراب دورة الخلية العادية.يتم تنظيم دورة الخلية (حياة الخلية من الانقسام إلى الانقسام / الموت) بشكل صارم من خلال
عمل البروتينات الخاصة: الكينيز ، السيكلينات ، عوامل النمو وعوامل النسخ - هناك العشرات منها في كل خلية حية ، ولكل منها وظيفتها الخاصة ، ولكن المهمة.
إنها تنقل الإشارات بين خلايا كائن حي متعدد الخلايا ، وتنشط بعضها البعض ، وتبدأ عملية الانقسام وتتحكم في صحتها ، وتحافظ على التنشيط الصحيح للجينات ، وتؤدي وظائفها عن طريق الخلية ، "تحقق" من سلامة الجينوم ، "أمر" الخلية ببدء موت الخلايا المبرمج ، ن.
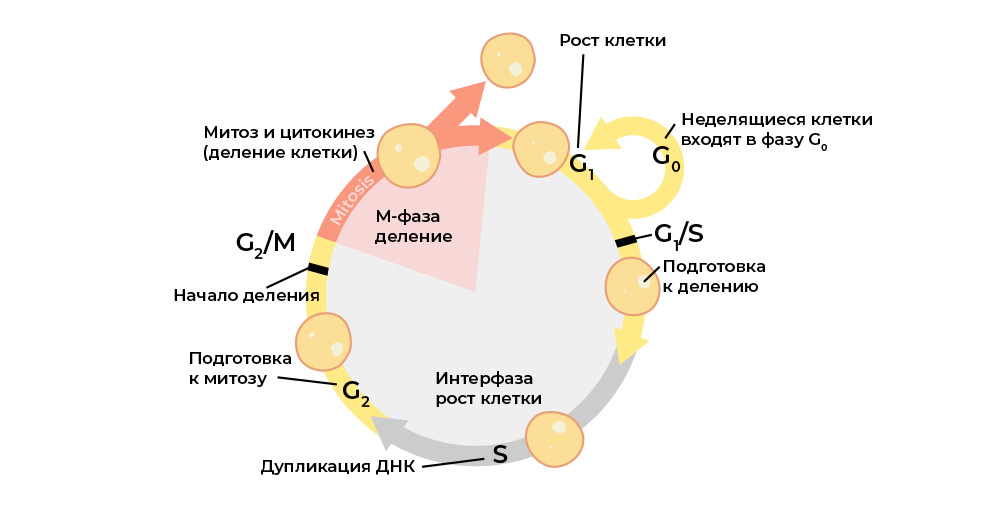 يتم التحكم في كل مرحلة من مراحل دورة الخلية بواسطة البروتينات التنظيمية.
يتم التحكم في كل مرحلة من مراحل دورة الخلية بواسطة البروتينات التنظيمية.ويتم تشفير كل من هذه البروتينات في
جزء معين من الحمض النووي - الجين. إذا خضع مثل هذا الجين لطفرة ضارة ، فسوف "يعيد إنتاج" البروتين التنظيمي المقابل بشكل غير صحيح. وسيؤدي منظم البروتين "الخطأ" إلى تعطيل دورة الخلية ، ومعها سلوك الخلية بأكملها.
على سبيل المثال ، "ينهار" جين منظم البروتين الخاص بالانتشار (نمو كتلة الخلية) - ويبدأ "المسوخ" في الانقسام أكثر مما يجب ، الخلايا السليمة "تسحق".
هذه الجينات الهامة ، والتغيرات التي يمكن أن تؤدي إلى التسرطن (ظهور السرطان) هي مجموعتان كبيرتان.جينات البروتون هي جينات "طبيعية" يمكن أن تصبح جينات
جينية بسبب التعزيز أو التغيير في وظائفها. الجينات التي يمكن أن يؤدي تعبيرها إلى ورم خبيث للخلايا وتطور الأورام تسمى
الجينات المسرطنة . في حالة حدوث طفرة ضارة في الجين الورمي ، يصبح
الجين الورمي ويمكن أن يسبب الورم.
من بين تلك التي تمت
دراستها جيدًا وتسمع على نطاق واسع:
- EGFR ، ALK ، BRAF - سرطان الرئة ذو الخلايا غير الصغيرة ؛
- BRAF - سرطان الجلد.
- HER2 - سرطان الثدي (سرطان الثدي) ؛
- KRAS - سرطان القولون والمستقيم.
علاوة على ذلك ، توجد طفرات في هذه الجينات في عدة أنواع من الأورام. على سبيل المثال ، تم العثور على زيادة التعبير عن HER2 ليس فقط في سرطان الثدي ، ولكن أيضا في سرطان الرئة والمعدة.
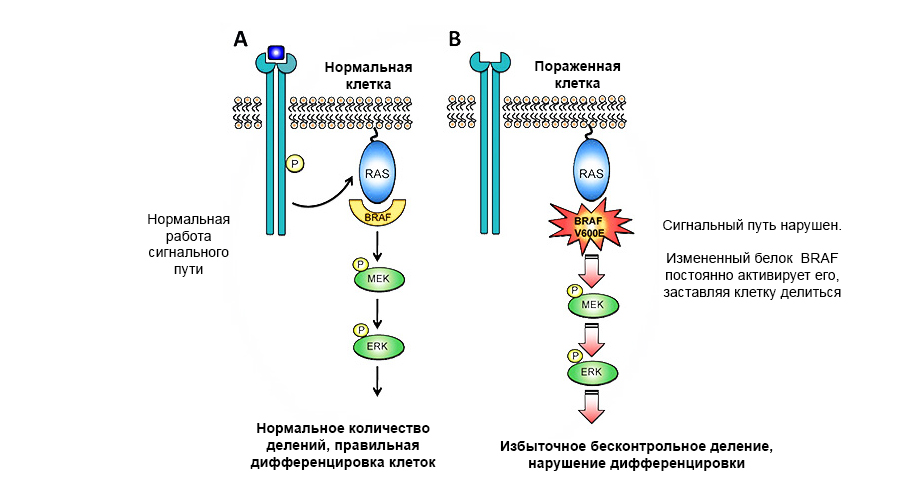 طفرة في بروتين oncogen من بروتين BRAF يؤدي إلى نمو الورم غير المنضبط.
طفرة في بروتين oncogen من بروتين BRAF يؤدي إلى نمو الورم غير المنضبط.جينات كبت الورم (مضادات الجينات) - على العكس من ذلك ، يمكنها
كبح نمو خلايا الورم أو المشاركة في إصلاح (إصلاح) الحمض النووي التالف. لكن تعطيل جينات القامع نتيجة للطفرات يزيد بشكل كبير من احتمال حدوث ورم خبيث.
على سبيل المثال:
- طفرات BRCA1 ، BRCA2 - سرطان الغدد الثديية ، المبايض.
- الطفرات p53 - ما يصل إلى 50 ٪ من أنواع مختلفة من الأورام السرطانية ، بما في ذلك ساركوما.
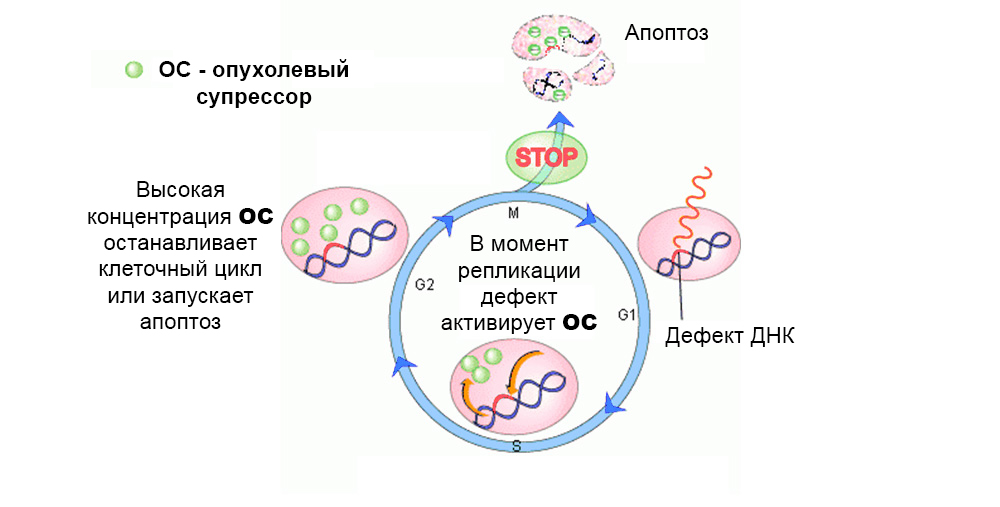 عادة ، تعمل آليات الحماية ضد تطور الخلايا المتحورة. هناك خلل في جين مثبط الورم "يطفئ"
عادة ، تعمل آليات الحماية ضد تطور الخلايا المتحورة. هناك خلل في جين مثبط الورم "يطفئ"في المجموع ، تمت دراسة تأثير عدة عشرات من الجينات المسرطنة الأولية ومثبطات الورم على التسرطن.
لماذا توجد الكثير من الصعوبات وكيف يطيل عمر المرضىكل طفرة موجودة في جين بروتيني أو جين مثبط هي سبب "القوى العظمى" للخلية السرطانية ، مثل إهمال موت الخلايا المبرمج والقدرة على الاختباء من المناعة. ولكن في الوقت نفسه - هذه هي نقطة ضعفها المحتملة.
ومع معرفة السبب وراء خصوصيات آلية تشغيل الورم ، يمكن للمرء أن يجد مادة "توحد" هذه الآلية وتقطع سلسلة التفاعلات المرضية في الخلية. أي أن طفرات معينة في الورم - تشير إلى الهدف الذي "ضرب" فيه الأطباء الدواء. وقد سمح هذا المبدأ تطوير
العلاج الموجه .
وُلد العلاج المستهدف - اسم فرع كامل من العلاج الدوائي الفعال للسرطان - من هدف الكلمة الإنجليزية. تعمل العقاقير المستهدفة "المستهدفة" على الخلايا السرطانية - لأنها فقط لديها طفرات في الجينات المقابلة. لا تتمتع الخلايا السليمة بمثل هذه الطفرات - والأدوية لا تؤثر عليها.
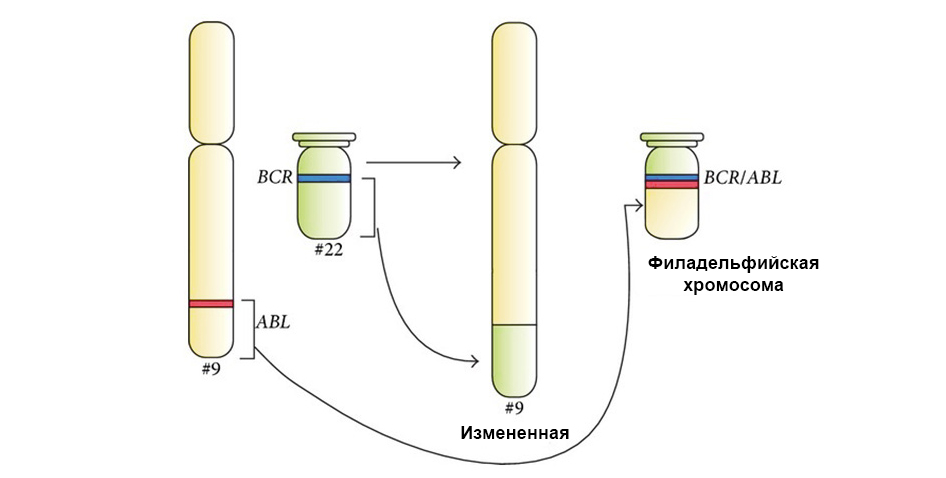
يوضح الشكل أدناه آلية عمل عقار إيماتينيب المستهدف على الخلايا السرطانية مع طفرة كروموسوم فيلادلفيا: جين الاندماج BCR-ABL. تؤدي هذه الطفرة إلى حقيقة أن آلية موت الخلايا المبرمج توقف عن العمل في الخلية - تتراكم الأخطاء في الجينوم ، وتتحول الخلية إلى خلية سرطانية.
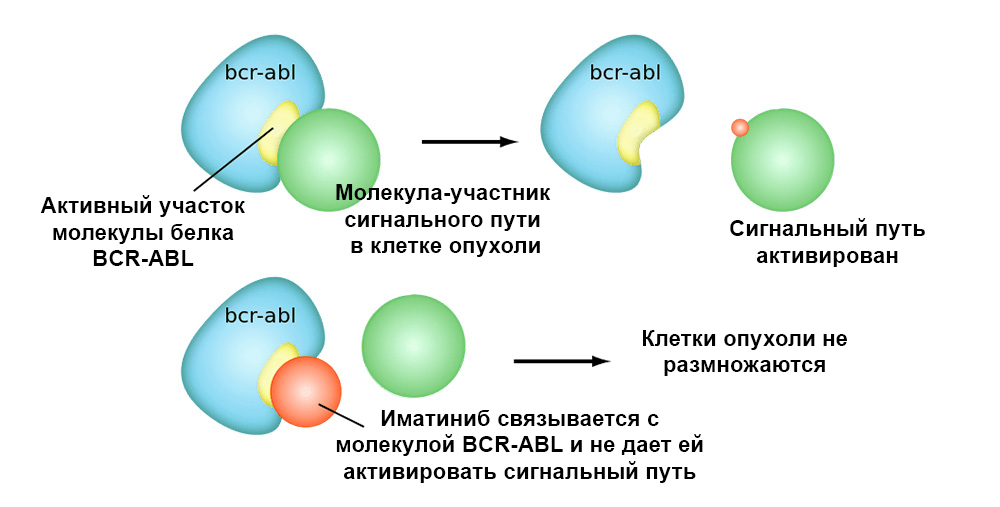 يرتبط Imatinib بالموقع النشط لجزيء البروتين BCR-ABL ، ويمنع قدرته على التفاعل مع الجزيئات الأخرى في مسارات الإشارات.حتى الأدوية المستهدفة لها 2 مزايا مهمة على العلاج الكيميائي الكلاسيكي.كفاءة أعلى.
يرتبط Imatinib بالموقع النشط لجزيء البروتين BCR-ABL ، ويمنع قدرته على التفاعل مع الجزيئات الأخرى في مسارات الإشارات.حتى الأدوية المستهدفة لها 2 مزايا مهمة على العلاج الكيميائي الكلاسيكي.كفاءة أعلى. يسمح الإجراء المستهدف للخلايا السرطانية بتحقيق "استجابة" أفضل للورم للعلاج. على سبيل المثال ، مقارنةً بالمعالجة التقليدية ، فإن إضافة عقار Trastuzumab المستهدف بالإضافة إلى العلاج الكيميائي لسرطان الثدي مع HER2 overexpression
زاد بشكل كبير من وتيرة "الاستجابات" - 81 ٪ مقابل 73 ٪ ، وتواتر مغفرة المورفولوجية الكاملة (اختفاء الورم) - 43 ٪ مقابل 23 ٪
آثار جانبية أقل. العلاج الكيميائي الكلاسيكي مع تأثير السامة للخلايا. في الأساس ، المواد السامة لقتل أو على الأقل إبطاء نمو الخلايا السرطانية. الأهم من ذلك كله أنها تعمل على الخلايا التي تنقسم بسرعة. هذا هو السبب ، على سبيل المثال ، تساقط الشعر منه: إنه أيضًا نوع من الخلايا المنقسمة بنشاط ، و "يقع تحت التوزيع". بسبب هذا الإجراء غير المستهدف للغاية ، تعطي الأدوية العلاجية آثارًا جانبية خطيرة: الجهاز الهضمي والأعضاء الأخرى تعاني أيضًا.
في ممارسة
"الطب 24/7" ، نصف غالبًا العقاقير المستهدفة كجزء من العلاج المعقد: نجمع بين العلاج الكيميائي والهدف والعلاج المناعي.
تكمن الصعوبة في أن كل ورم فريد في مجموعة طفرات "الأهداف"كما أن كل شخص لديه رمز DNA فريد ، فإن الأورام فريدة من نوعها. بعد كل شيء ، "يولدون" من خلايا الجسم الخاصة. لا توجد أورام لها نفس الخصائص الجزيئية الوراثية. لذلك ، فإن إيجاد "حبوب" عالمية للسرطان أمر مستحيل بشكل أساسي. السرطان هو مرض فردي للغاية.
لكن يجب أن يكون علاجه مناسبًا - يتم اختياره بشكل فردي لمريض معين - استنادًا إلى حقيقة أننا نحدد الطفرات في خلاياه السرطانية.
في الماضي القريب ، لا يمكن تصنيف الأورام الخبيثة إلا من خلال الأنسجة ، وهذا يتوقف على العضو الذي نشأت فيه وما تشبه الخلايا السرطانية تحت المجهر.
لاستخدام العلاج المستهدف بشكل فعال ، هذا لا يكفي. يجب أن يعرف الطبيب ما هي الطفرات الموجودة في خلايا الورم لمريض معين ، ما إذا كانت هناك علامات "أهداف" لهذا الدواء أو ذاك. الطب الشخصي كما هو.
لهذا ، نستخدم الدراسات الوراثية الجزيئية. للعثور على "الأهداف" التي تحتاج إلى ضربها بالعقاقير المستهدفة والمناعة - عليك تحديد أي الجينات التي يتم جمع الحمض النووي للورم فيها ، وأي الجينات الموجودة فيها "مكسورة". نتيجة لذلك:
- نتعلم حساسية الورم للعقاقير ؛
- معرفة ما إذا كان الورم لديه مقاومة لبعض الأدوية ؛
- اكتشاف الخصائص الجينية التي تعطي فرط الحساسية للأدوية ؛
- سنختار علاجًا جديدًا إذا توقف الورم عن الاستجابة للعلاج القياسي ؛
الكشف عن ورم / ورم خبيث في مرحلة مبكرة للغاية - عن طريق شظايا الحمض النووي في الدم ؛ - يمكننا أن نتوقع مسار إيجابي أو عدواني للمرض.
غالبًا ما تكون العينة عبارة عن أنسجة الورم ، إما تؤخذ أثناء العملية لإزالة الآفة الأولية ، أو خزعة - يتم أخذ قطعة مجهرية من الورم بإبرة طويلة رقيقة خاصة.
يمكنك البحث عن الحمض النووي للخلايا السرطانية في الدم - فأنت بحاجة إلى ما يسمى خزعة سائلة ، وأنبوبين اختبار بدم 8.5 مل لكل منهما.
أثناء الخزعة ، نواجه غالبًا حقيقة أن العديد من المرضى يخشون لمس الورم تمامًا - فهم يخشون أن يؤدي ذلك إلى نموه. حتى الآن ، لا توجد دراسات من شأنها أن تظهر هذه العلاقة. بالطبع ، يجب إجراء الخزعة بشكل صحيح. عندما نأخذ خزعة ، يقوم الأطباء في أغلب الأحيان بتحديد مكان دخول الإبرة: إما يصنعون وشمًا صغيرًا (هناك مثل هذه الأداة) ، أو يضعون شريحة (جراحية). إذا كانت هناك حاجة لإجراء عملية جراحية في وقت لاحق ، فإنها ترفع المسار بالكامل حيث كانت الإبرة - من الجلد إلى الورم - لذلك نجعل فرصة انتشار الخلايا السرطانية وراء الورم أقل.بعد ذلك ، يتم إرسال العينات إلى مختبر الدراسات الوراثية الجزيئية.هناك ، يتم عزل الحمض النووي للورم من العينة وتسلسلها. هذا هو - "يقرأون" تسلسل "الحروف" - النيوكليوتيدات. ثم يقوموا بمقارنتها بلوحة تشخيصية تم اختيارها من قاعدة بيانات المكتبات - حيث تم فك تشفير جينومات آلاف الأشخاص الآخرين بالفعل. يتم اختيار لوحة لكل مريض - مع الأخذ في الاعتبار التاريخ والبيانات السريرية. كل هذا ، بالطبع ، يتم بواسطة أجهزة التسلسل الآلي وجهاز الكمبيوتر.
وإذا كانت "قراءة" الجينوم قبل 20 عامًا قد استغرقت شهورًا ، فقد تطلب الأمر فك شفرة بطيئة ومعقدة ، اليوم في المختبر الذي نعمل معه ، يتم إجراء تحليل في غضون أيام عمل قليلة.
علاوة على ذلك ، يتم استخدام عدة طرق في وقت واحد:
تسلسل جيل جديد (NGS) ، وتسلسل Sanger وطريقة تهجين الإسفار (FISH) . تتيح لكما معًا قراءة تسلسل الحمض النووي بالكامل للورم ، ومعرفة طفرات السائق - أي تلك التي أطلقت العملية الخبيثة والتي يمكن الآن استهدافها بواسطة العلاج المستهدف - وحتى تصور النمط النووي بأكمله (مجموعة الصبغيات).
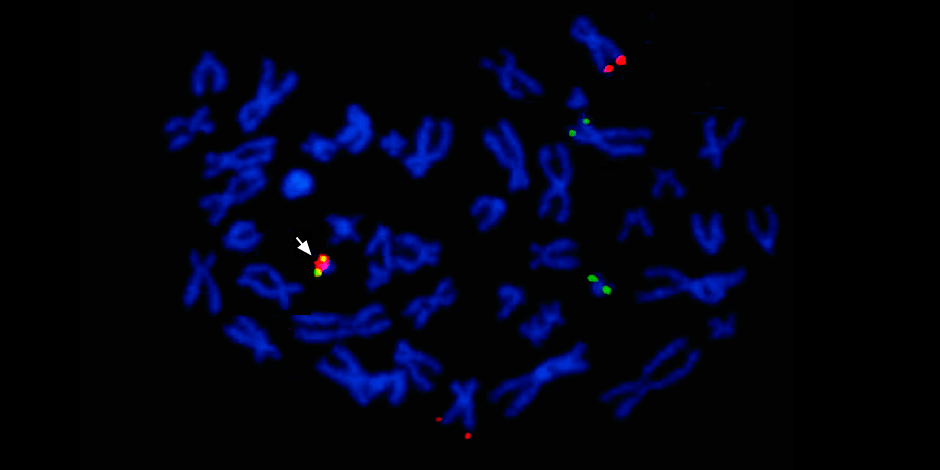 تحت السهم إلى اليسار - اندماج الإشارة الحمراء والخضراء - دليل على اندماج المادة الوراثية للكروموسومات 9 و 22 مع تكوين كروموسوم فيلادلفيا الخيم.
تحت السهم إلى اليسار - اندماج الإشارة الحمراء والخضراء - دليل على اندماج المادة الوراثية للكروموسومات 9 و 22 مع تكوين كروموسوم فيلادلفيا الخيم.بالإضافة إلى ذلك ، تحدد الدراسة الوراثية الجزيئية الكاملة
عدم استقرار القمر الصناعي (MSI ، عدم استقرار القمر الصناعي) - انتهاك لآلية إصلاح الحمض النووي ، والتي تؤدي إلى التراكم السريع للطفرات في الخلايا. يسمح لك هذا العامل بعمل تنبؤ حول المسار الإضافي للمرض.
بعد الحصول على الملف الوراثي الجزيئي للورم ، يبدأ تحليلهتقوم البرامج الخاصة بمعالجة النتائج وتقديم التوصيات تلقائيًا. ولكن بعد ذلك يتم الإشراف على هذه التوصيات يدويًا بواسطة فريق من الخبراء. يتضمن التحليل علم الوراثة ، المعلوماتية الحيوية ، أطباء الأورام ، أطباء المناعة والمعالجين الكيميائيين. في هذه المرحلة ، تحدث التحسينات والإضافات بالضرورة.
بناءً على الطلب ، يمكن أن تستغرق هذه الدراسة
من 5 إلى 15 يوم عمل : يحتاج مريض واحد فقط إلى تحديد نوع الورم وتوضيح العلاج الموصى به - فقط تحقق من وجود مجموعة أساسية من 20 طفرة في الحمض النووي وفقًا لتوصيات جمعيات السرطان العالمية. وأخرى ، مع تشخيص نادر أو مقاومة للعلاج القياسي - تحتاج إلى عمل "جواز سفر جزيئي" للورم ، ولهذا - لتسلسل 400 جين.
ونتيجة لذلك ، في الجزء الأول من التقرير ، يتم تسجيل جميع الطفرات الموجودة في ورم المريض ، والعقاقير المستهدفة التي ستكون أكثر فعالية في هذه الحالة. تمت الموافقة على
العلاج المستهدف لهذا النوع من الأورام مع الطفرات المكتشفة ، والمعالجة المستهدفة تمت الموافقة عليها لعلاج أنواع أخرى من السرطان مع نفس الطفرات. في الممارسة العملية ، كانت لدينا حالات عندما وصفت الأدوية من الدرجة الثانية ، خارج التسمية ، وتصرفت بشكل جيد.
علاوة على ذلك ، يقوم طاقم المختبر بعمل رائع في مراقبة البحث العلمي ، وهو ما قد يكون مهمًا في حالة هذا المريض.
يحتوي الجزء الثاني من التقرير على نظرة عامة على الدراسات الموجودة في ذلك الوقت مع بيانات مفصلة عن تواتر حدوث هذه الطفرة ، وعن تأثير الأدوية المختلفة وعلى إمكانية استخدام نوع أو آخر من أنواع العلاج المستهدف للطفرات المحددة. هذا يساعد على إجراء تشخيص قاسي على الأقل للمريض.
يحتوي الجزء الثالث من التقرير على الدراسات السريرية ذات الصلة التي يمكن للمريض المشاركة فيها من أجل الحصول على علاج تجريبي. هذه هي أحدث طريقة للطوارئ ، ولكن معرفة كل التفاصيل عنها مفيدة لراحة البال.
نتيجة لذلك ، من هذا التقرير ، يتلقى الطبيب الملف الوراثي الجزيئي الأكثر اكتمالا للورم الخبيث. لديه معلومات عما نعالجه بالضبط ، ما هو الانهيار المحدد في الخلية. هناك فهم "جديد" للعقاقير المعتمدة حاليًا أو المتاحة للاستخدام في التجارب السريرية.
 التقرير جميل - 30 صفحة من القراءة الخلابة
التقرير جميل - 30 صفحة من القراءة الخلابةمن يحتاج هذا؟
أولئك الذين لديهم مقاومة الورم أو التعصب لجميع الأدوية من بروتوكول العلاج القياسي.
الوضع عندما "حاول الجميع ذلك - لم يساعد.", , (NCCN), « 24/7», – « » .
, 1- – , . . – – – 2- – , . – 3- , .. «» .
, , : , «» , . – . , , . – , , .
– «», . , off-label, . , ?
- , , . – .
. , . , , 80% , 20% – . , - , 80% , 20% .
- , , . , , . , : , , , . , , 10 – 10 .
30% – . , – : 600 . , , HER2/Neu.
. - – , – . , . 600 . ., 5 – , , , . .
- . . «» . , , , , ..
, . (, , ) – , .
, , «». – .
, , .
, 48 , ( ). , . , , . .
- . , 600 . , , 250, – , .
, . EGRF – .
4 . 5 , . , , 4 , .
,
« 24/7» , – .
.