الغرض الرئيسي من استخدام الأدوية التي تبطئ عملية الشيخوخة هو إطالة حياة صحية ونشطة. ويهدف هذا الأخير ، بدوره ، إلى تحسين الرفاهية الاقتصادية لسكان الكوكب الذين يتقدمون في العمر بسرعة. حتى يتم اعتماد أي تدخل دوائي عالمياً ، يجب أن تكون الأدوية فعالة في أي شخص بالغ وأن تتمتع بملف سلامة جيد. في هذا المقال ، أظهرنا أنه بمساعدة العقاقير المعروفة بالفعل للعلم ، تمكنا من زيادة العمر المتوقع لـ C. elegans بشكل كبير. تم تحقيق الزيادة في حياة الدودة عن طريق تغيير نشاط العديد من مسارات الإشارة المحافظة تطوريًا المرتبطة بالشيخوخة. نظرًا للتأثير على مسارات الإشارات المختلفة ذات التأثير التآزري المشترك ، نأمل أن نتمكن من إبطاء عملية الشيخوخة ، ومضاعفة العمر ، وأيضًا أكثر من ضعف مدة فترة حياة صحية ، دون تغييرات تعويضية في التطور البدني والنشاط.
بقدر ما نعلم ، كان العمر المتوقع للديدان الخيطية C. elegans التي تحققت في البالغين مع المخدرات هو الأعلى في عملنا. استخدمنا الأدوية التي كانت تهدف في الأصل لعلاج أمراض البالغين المختلفة. يعتبر تطوير طريقة تعتمد على استخدام العقاقير المعتمدة بالفعل والتي تعمل في وقت واحد على عدة مسارات للإشارة المرتبطة بالشيخوخة واعدة للغاية. يمكن أن يؤدي إلى منع تطور الأمراض المرتبطة بالعمر والوهن البدني للمسنين في العالم ، والتي تتقدم في العمر بسرعة.
مقدمة
واحدة من أهم المراحل في علم الشيخوخة كانت اكتشاف مسارات الإشارات التطورية المحافظة المسؤولة عن تنظيم عمر الجسم. يمكن أن تؤدي الطفرات في الجينات التي تؤثر على مسارات الإشارات هذه إلى تمديد متوسط العمر المتوقع من 30 إلى 100٪ في الكائنات الحية النموذجية. يمكن أن تسبب طفرات الجين المركبة تأثيرًا تآزريًا يزيد من العمر الافتراضي. يكون تأثير التدخلات الدوائية عادة أضعف بكثير من تأثير الطفرات الوراثية ، حتى لو كانت تعمل على نفس مسارات الإشارة.
إن وجود تأثير تآزري مع العديد من اضطرابات الجين مجتمعة يشير إلى أن استخدام هذه الأدوية التي ستؤثر في وقت واحد على العديد من مسارات الإشارات المحافظة التطورية سيصبح اتجاهًا واعدًا ممكنًا. حتى الآن ، تم تسجيل القليل من البيانات حول التأثير التآزري لاستخدام الأدوية التي تهدف إلى زيادة متوسط العمر المتوقع. في هذه الورقة ، نقدم تقريرا عن نتائج دراسة جديدة في الجسم الحي استخدمت فيها هذه الأدوية. لقد أوضحنا كيف يمكن لمجموعة من الأدوية أن تزيد من تأثير العلاج إلى الحد الأقصى نظرًا لحقيقة أنها تعمل على عدة مسارات للإشارة ، مع وجود تأثير يعزز بعضها البعض. في نفس الوقت ، كان من الممكن تقليل تواتر ردود الفعل السلبية و ¬ مستوى الاضطرابات التعويضية في تطور الجسم ، حيث تم إجراء تغييرات النقطة في مسارات إشارة منفصلة ولكن متفاعلة. كان الهدف النهائي للدراسة هو تطوير نظام دوائي للسكان البالغين ، مع وجود تأثير مثبت على عملية الشيخوخة ، والتي كانت مساوية أو أكبر من تأثير الطفرات.
نظرًا لوجود عدد قليل من العلامات البيولوجية المعترف بها عمومًا للشيخوخة ، في الوقت الحالي ، من أجل تقييم نتائج الدراسة ، فإنها ببساطة تقارن العمر الإجمالي للكائنات. واستخدمت الخيطية من الأنواع Caenorhabditis elegans ككائن نموذج قصير الأجل. بعد ذلك ، اخترنا عدة مجموعات من الأدوية ، بحيث تم إنشاء مجموعتين من الأدوية ، في كل منها كان هناك ثلاثة أدوية. كما تم نشره سابقًا في الدراسات ، عند استخدام هذه المجموعات من الأدوية ، كان هناك اختلاف كبير في زيادة متوسط العمر المتوقع وإطالة الحياة الصحية للديدان الخيطية C. elegans.
تبين أن التأثير التآزري الذي تم الحصول عليه بمزيج من الأدوية يمكن مقارنته بما لوحظ بعد طفرات موجهة في الجينات المعروفة المرتبطة بالشيخوخة. لم نكشف عن أي اضطرابات تعويضية في تطور الكائنات الحية من تلك التي غالباً ما توجد وترتبط بالتدخل الدوائي. استطعنا أن نحدد بشكل غير مباشر أن العلاج بالعقاقير يبطئ معدل الشيخوخة الطبيعية ، حيث ارتفع مستوى بعض العلامات. بالإضافة إلى ذلك ، خلصنا إلى أن TGFβ (عامل نمو التحويل -1) كان عاملاً رئيسيًا يوفر التأثير التآزري لمسار الإشارة. بالإضافة إلى ذلك ، أظهرت الدراسة أنه في الديدان الخيطية التي عولجت بمجموعات الأدوية المذكورة أعلاه ، فإن نسبة الدهون غير المشبعة الأحادية إلى تلك غير المشبعة المتعددة قد غيرت اتجاه انتشار السابق (زيادة في نسبة MUFA إلى PUFA) ، وانخفض مستوى بيروكسيد الدهون في الغشاء. أخيرًا ، أكدنا أيضًا وجود تأثير تآزري مماثل في ذباب ثمار فصيلة ذبابة الفاكهة السوداء.
النتائج
اختيار مسارات الإشارة والأهداف في C. Elegans.استنادًا إلى الأدبيات العلمية الحديثة ، وجدنا العديد من مسارات الإشارات المحافظة التطورية والآليات المتعلقة بالشيخوخة (المادة الداعمة ، الجدول S1). من بين الأهداف والآليات التي اخترناها: كيناز بروتين منشط بـ AMP ، كيناز C-Jun-N-terminal (JNK) ، هدف rapamycin للثدييات (mTOR) والآليات المشاركة في العمليات: تقييد السعرات الحرارية (CR) ، mitogomesis (تأثير جرعات صغيرة من المواد التي بجرعات كبيرة سامة) والتمثيل الغذائي في الميتوكوندريا. تعتبر الأهداف والعمليات المذكورة أعلاه هي الأهداف الرئيسية في تنظيم مسارات الإشارة التي تطيل الحياة. لكل مسار إشارة ، تم تحديد الأدوية التي تم وصف تأثيرها على طول العمر في واحد على الأقل من الكائنات الحية المعروفة النموذج (النيماتودا ، ذباب الفاكهة أو الفئران).
الأشخاص الذين تم اختبارهم المخدرات كانت ذات أهمية خاصة بالنسبة لنا. لذلك ، فضلنا المركبات الطبية ذات الفعالية المعلنة في الثدييات أو المعتمدة في البشر. في البداية ، وجدنا 11 دواءً محتملاً يفي بالمعايير المذكورة أعلاه (الجدول المساعد S1). أضفنا allantoin إلى قائمتنا بناءً على تقرير حول قدرته على إطالة الحياة في C. elegans ونتائج تحليل النصوص. لدينا شكوك بأن آلية عملها مختلفة عن المواد الأخرى. لتجنب الأخطاء في قياس متوسط العمر المتوقع للكائنات بعد استخدام المخدرات ، قمنا أولاً باختبار المقاول باستخدام طريقة المكفوفين. كان السبب الرئيسي وراء ذلك هو حقيقة أن نتائج الدراسة يمكن أن تعتمد بشكل كبير على صحة الظروف التجريبية وتختلف بشكل كبير بين المختبرات المختلفة. استخدمنا فقط تلك الجرعات من الأدوية التي سبق وصفها في الأوراق العلمية. تم تأكيد فعالية خمسة أدوية تؤثر على متوسط العمر المتوقع في مختبرنا (الشكل 1 ، الجدول الداعم S2). كقاعدة عامة ، في دراستنا ، كانت فعالية المركبات المرتبطة بزيادة في حياة الكائنات الحية أقل قليلاً من في الأعمال المنشورة سابقًا (المخطط التكميلي 1 ، الجدول الداعم S2).
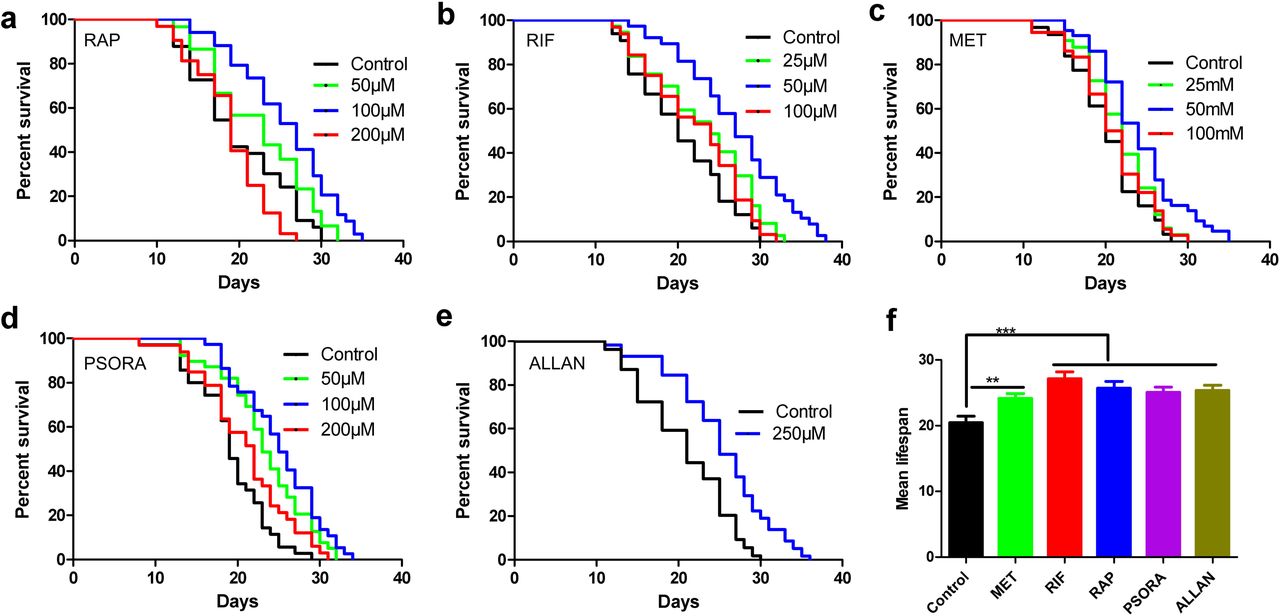 التين. 1
التين. 1نسخة والمخدرات وطول العمر
لتقييم فعالية الأدوية في الدراسة ، أجرينا تحليلًا للنصوص وحددنا الجينات المعبر عنها تفاضليًا (DEG) وقمنا بإثراء مسارات الإشارة فيما يتعلق بالتحكم. لاحظنا بعض الاختلافات في التعبير الجيني ونشاط مسار الإشارة في المجموعة التجريبية ، والتي لم تكن في المجموعة الضابطة. كانت أهم التغييرات في التعبير الجيني ومسارات الإشارات ناجمة عن عمل مجموعة دوائية واحدة تتكون من ريفامبيسين ، رابامايسين و psora-4 (PSORA) ، حيث تم إعطاء آخر دواء بعد أول دواءين. على عكس الأدوية المذكورة ، أثر الميتفورمين (MET) والألانتوين (ALLAN) على التعبير عن عدد أقل من الجينات (المخطط 2 أ ، دعم الجدول S3).
أظهر تحليل نتائج النسخ أن لكل مادة دوائية ملفها الشخصي الفريد للجينات التي غيرتها. في الوقت نفسه ، تم العثور على بعض هذه الجينات أيضًا في ملفات التعريف النصية للعقاقير المتبقية (المخطط 2 أ). وهكذا ، عمل MET على عمل العديد من الجينات "الشعبية" ، لكن عدد الجينات الفريدة المعنية كان ضئيلاً. غيرت الاستعدادات MET و PSORA نشاط الطيف الكامل للجينات "الشعبية" تقريبًا ، والتي تأثر بعضها أيضًا بشكل فردي بالعقاقير المبيّنة في المخطط 2 أ.
أثر مركب ألان على أقل عدد من الجينات ، ولكن معظمهم ينتمي إلى مجموعة فريدة من نوعها. تم تمثيل أقل من نصف جيناتها في الطيف النسخي للأدوية الأخرى. كان تأثير استخدام RIF و RAP مختلفًا تمامًا عن بعضهما وعن أي أدوية أخرى. استنادًا إلى المعايير الثلاثة لتحليل المكونات الرئيسية (PCA) ، خلصنا إلى أن RIF و RAP و PSORA كانت منفصلة تمامًا عن بقية العقاقير. في المقابل ، كانت تأثيرات ALLAN و MET أكثر متغيرًا ، ولكنها متشابهة جدًا. بالإضافة إلى ذلك ، كانت نتائجها قريبة إلى حد ما من نتائج المجموعة الضابطة.
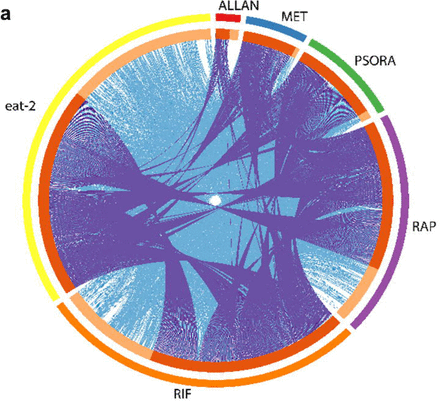
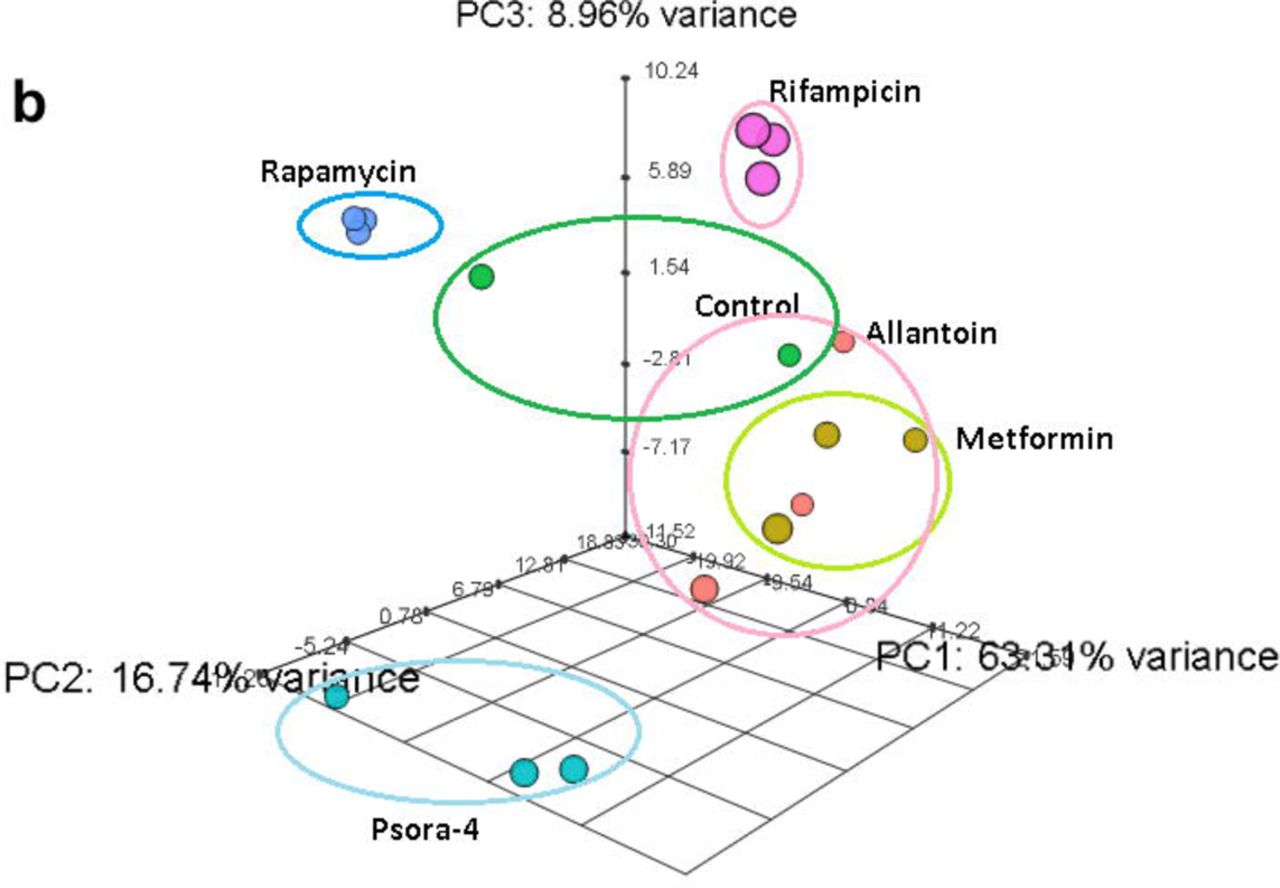
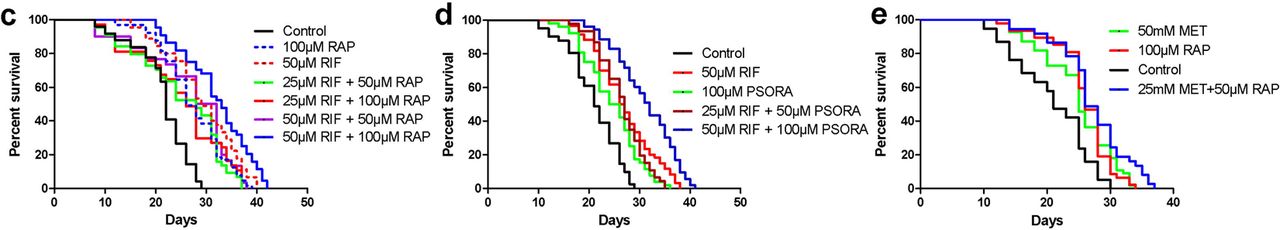

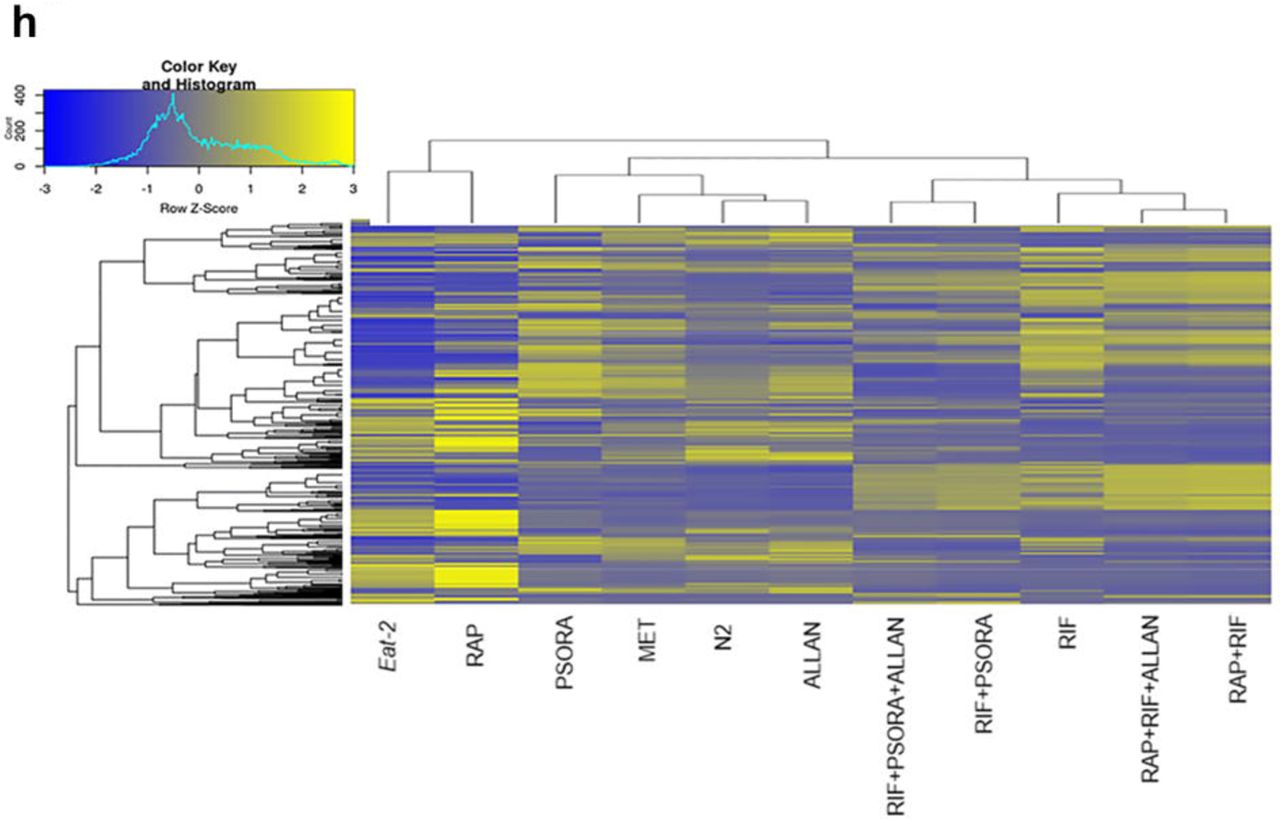 Fig.2
Fig.2في الخطوة التالية ، حددنا كيف تؤثر توليفات الأدوية المختلفة على مدة حياة النيماتودا. نظرًا لأن إجراءات MET و RAP أسهل في الانتقال إلى البشر ، فقد درسنا هذه الأدوية في المقام الأول. ومع ذلك ، اتضح أن الجمع بين MET و RAP بجرعات مثالية من 50 ملغ و 100 ملغ لم يؤد إلى إطالة عمر أطول (المخطط التكميلي 2 J ، P). أجرينا العديد من الدراسات باستخدام جميع المجموعات الممكنة من هذه الأدوية في جرعات الأمثل وشبه الأمثل (خطة إضافية 2 JP).
أدى استخدام MET و RAP في جرعاتهما شبه المثلى إلى زيادة في الحد الأقصى لمدى عمر النيماتودا (المخطط 2e ، المخطط الإضافي 2 m ، s) ، ولكن ليس متوسط العمر المتوقع (مخطط إضافي ، 2p). هذه الميزة البسيطة لـ MET و RAP تتوافق مع نتائج دراسة أخرى على الفئران. ثبت أن إضافة MET إلى RAP أطال حياة الذكور بشكل رئيسي ، وفي الإناث ، كانت النتيجة بالكاد ملحوظة (عندما تم تسجيلها على الإطلاق).
بعد ذلك ، اكتشفنا بالتتابع آثار 10 تركيبات دوائية. في كل مجموعة من الأدوية ، كان هناك اثنين من الأدوية الخمسة المحتملة (المخطط التكميلي 2 بالنيابة). تم إجراء تحليل للتأثير التآزري باستخدام نموذج HSA (نموذج النشاط الفردي العالي) ، والذي يقدر درجة نشاط أحد العقارين.
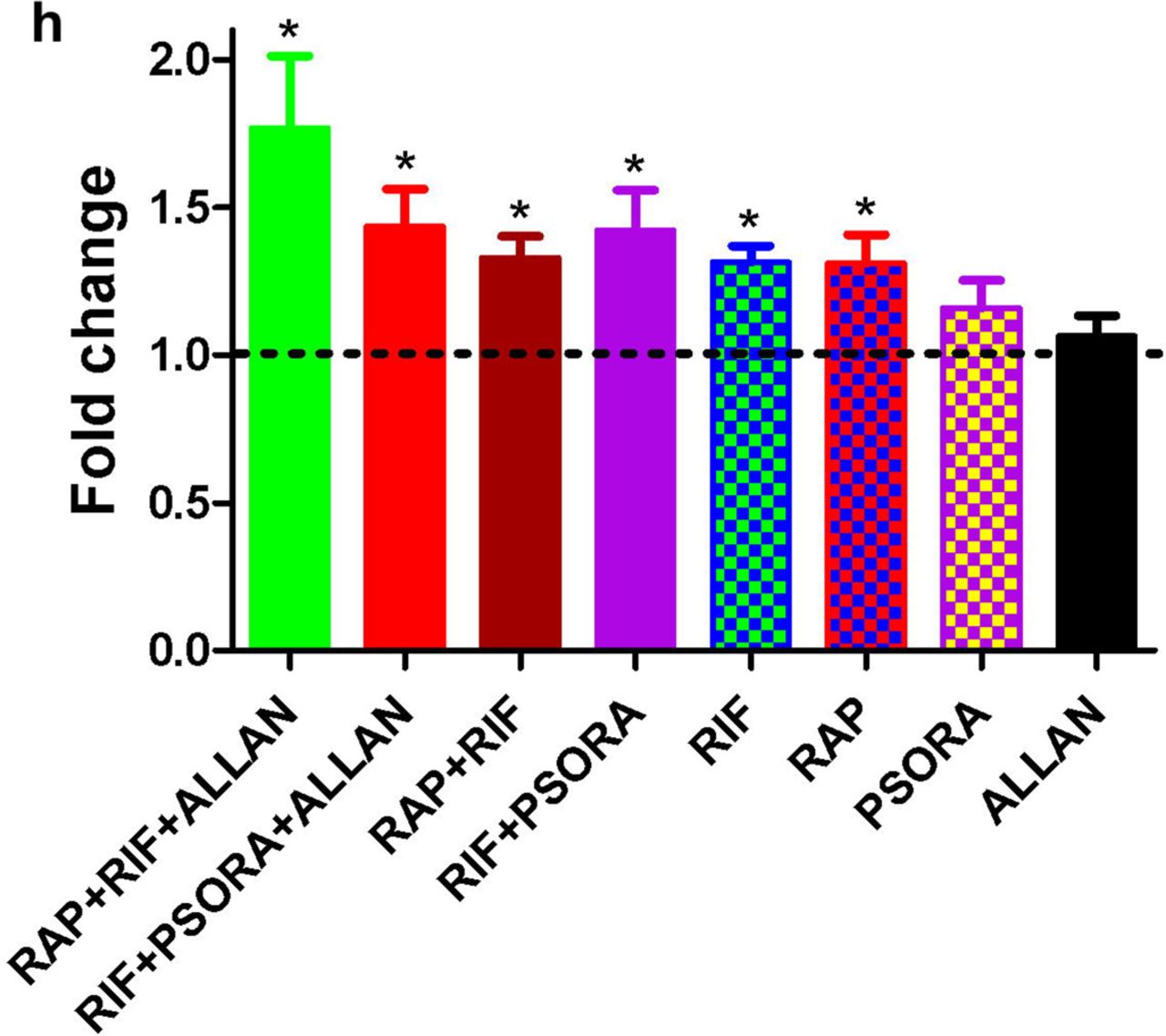
واعتبرت نتيجة الاستخدام المشترك للأدوية المختلفة تآزريًا ، شريطة أن تتجاوز بشكل كبير النتيجة التي تم الحصول عليها من فعل كل دواء بشكل منفصل وعندما تكون جرعات الأدوية هي نفسها. بالنظر إلى التعريف الوارد أعلاه ، وجدنا أن اثنين فقط من كل عشرة مجموعات من الأدوية كان لها تأثير تآزري (المخطط 2 ج ، د ، المخطط التكميلي 2 والجدول الداعم S2) ، مثبتان بمزيج من الأدوية: RIF مع RAP و RIF مع PSORA. يمكن إجراء ثلاث مجموعات مختلفة من الأدوية مع هذه الأدوية ، لكن اثنين فقط منهم كانا مختلفين عن بعضهما البعض وفقًا لتحليل PCA. في آخر اثنين تم الكشف عن تأثير تآزري (المخطط 2 ب ، مخطط إضافي 4 أ ، ب).
من بين الـ 8 أزواج المتبقية من الأدوية ، كان التأثير على العمر المتوقع في 4 هو نفسه بالنسبة للعقار الأكثر فعالية في تركيبة الدواء المقابلة. في 4 مجموعات أخرى ، استبعد تأثير دواء ما تأثير آخر بشكل متبادل. في الحالة الأخيرة ، لوحظ أيضًا عدم وجود تفاعلات سامة وزيادة في العمر الافتراضي (المخطط التكميلي 2 ، الجدول الداعم S2).
في دراستنا ، أدى استخدام مجموعتين من الأدوية ذات التأثير التآزري إلى إطالة عمر أكثر أهمية ، مقارنةً بالبيانات المنشورة سابقًا في الأدبيات العلمية. ومع ذلك ، كانت الزيادة في متوسط العمر المتوقع بعد تعاطي المخدرات أقل من تأثير مماثل من اضطرابات طفرية. في هذا الصدد ، لدينا أسئلة: هل معدلات البقاء الحقيقية هي الحد الأقصى الذي يمكن تحقيقه من خلال المعالجة الدوائية للحيوانات البالغة؟ هل سنحصل على زيادة إضافية في العمر من خلال إضافة مركبات أخرى؟ إذا كان مزيج الأدوية يتضمن ثلاثة مركبات دوائية ، فإن عدد المجموعات المحتملة يزيد إلى 30. لم تتح لنا الفرصة للتحقق من هذا العدد من مجموعات الأدوية.
لذلك ، درسنا بشكل انتقائي تأثير بعض مجموعات الأدوية الثلاثية. بادئ ذي بدء ، درسنا مجموعة من الأدوية التي كانت فيها المركبات الدوائية الثلاثة أكثر اختلافًا عن بعضها البعض بناءً على معايير طريقة PCA. كان هناك شرط آخر هو وجود تأثير تآزري للدواء عند استخدامه بالتزامن مع أدوية أخرى (RAP ، RIF و PSORA). ومع ذلك ، كان متوسط العمر المتوقع للديدان الخيطية عند استخدام مجموعة من الأدوية الثلاثة أسوأ من عند استخدام أي تركيبة دوائية مزدوجة (المخطط التكميلي 3 أ ، دعم الجدول S2). ثم اختبرنا فعالية المزيج الثلاثي للأدوية ، والذي شمل دواء ألان مع ملف تعريف فريد للجينات المعنية (قوس برتقالي فاتح ، مخطط 2 أ).
لم يتطابق ملف نشاط جينات ALLAN مع ملف الجينات النشطة للعقاقير الأخرى. كما أنه يختلف عن طيف النسخة المسخنة الأكل -2. وبالتالي ، افترضنا أن مركب ALLAN لديه آلية فريدة للعمل ، وبالتالي ، قمنا بإضافته إلى هذين الزوجين من المجموعات التي أظهرت تأثيرًا تآزريًا. في كلتا الحالتين ، لوحظ زيادة ذات دلالة إحصائية في متوسط العمر المتوقع والحد الأقصى (مخطط 2f ، ز ، مخطط إضافي 3D-f والجدول المساعد s2). كانت أفضل نتيجة هي الجمع بين ثلاثة أدوية: RAP و RIF و ALLAN ، بسبب تضاعف متوسط العمر الافتراضي للديدان ، وبلغ المتوسط والحد الأقصى 44 و 50 يومًا ، على التوالي (الجدول المساعد s2). كان التأثير الناتج مشابهًا لتأثير الاضطرابات الطفيلية. وفقًا لمعلوماتنا ، اتضح أن هذا الامتداد لعمر C. elegans هو الأكبر الذي تم نشره في الأدبيات العلمية عند استخدام العقاقير المستخدمة في البالغين.
آلية التآزر المخدرات
Daf-16 / FOXO هو عامل نسخ يلعب دورًا رئيسيًا في تنظيم عمر الكائنات الحية النموذجية ، وربما البشر أيضًا. من أجل دراسة آلية العمل التآزري لمجموعات الأدوية التي حددناها ، قررنا فعاليتها عندما كانت للديدان طفرة كانت سلبية في مسار إشارات Daf-16. كان تأثير الأدوية مثل RAP أو ALLAN ، الذي تم تناوله بشكل منفصل ، مستقلًا عن مسار الإشارة Daf-16. وبالمقارنة ، فإن تمديد العمر المتوقع باستخدام RIF كان بالكامل بسبب عمل مسار Daf-16 ، و PSORA جزئيًا (المخطط 3 أ ، مخطط إضافي 8).
اشتمل الجمع بين أدوية RAP + RIF على دواء RIF واحد ، كان تأثيره يعتمد كليا على مسار Daf-16 ، ودواء RAP آخر له تأثير مستقل عن مسار الإشارة هذا. مع الاستخدام المشترك لمستحضرات RIF + PSORA ، تم تسجيل تأثير تآزري أيضًا ، على الرغم من حقيقة أن نشاط العقاقير كان مرتبطًا بتشغيل مسار Daf-16 ، وكان للديدان الخيطية جينة Daf-16 متحولة (المخطط 3 أ ، مخطط إضافي 8).
كانت هذه النتائج غير متوقعة ، لأنه اتضح أن التأثير التآزري لم يكن سببه مسار Daf-16 فقط: لقد تحقق هذا التأثير في طفرات جينات Daf-16 الجينية باستخدام الأدوية التي تعتمد أفعالها بشكل كلي أو جزئي على عمل هذا الجين.
 الشكل (3)
الشكل (3)وفقًا للعديد من المؤلفين ، فإن العديد من الأدوية التي اختبرناها كانت تحاكي CR (تقييد السعرات الحرارية) أي المواد الطبية المماثلة للمركبات التي يتم تصنيعها بشكل طبيعي في الجسم ، المسؤولة عن انخفاض الشهية. استخدمنا طرازا C.-elegant mut-2 المتحولة لمعرفة ما إذا كانت توليفات الأدوية والعقاقير التآزرية تؤثر على مسارات إشارات السجل التجاري. فقط RIF المركب يطيل عمر نيماتودا الأكل -2 المتحولة. لذلك ، ينتمي جميع الآخرين باستثناء الاستعدادات RIF لمحاكاة CR.
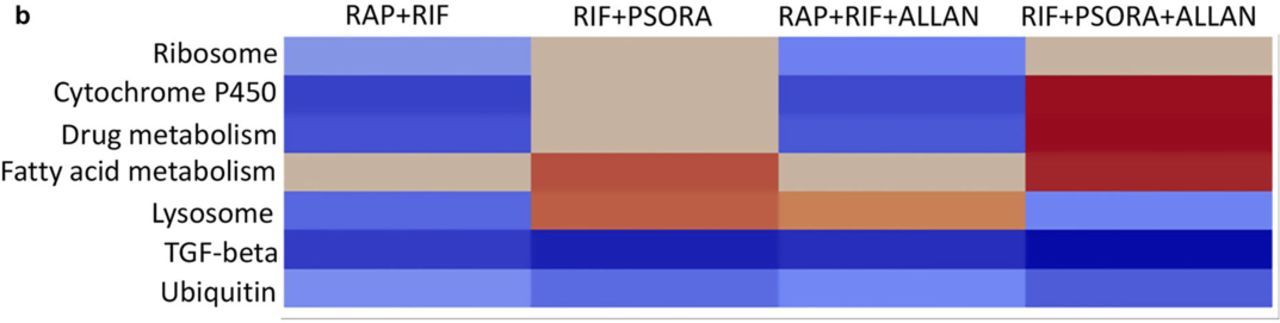
وهكذا ، في مجموعتين من الأدوية ، RAP + RIF و RIF + PSORA ، ينتمي مركب واحد إلى مقلدات CR ، ولا يعتمد تأثير الآخر على طفرة تناول -2. أدى الاستخدام المشترك لـ RIF و PSORA إلى زيادة في عمر النيماتودا ، في حين أن إضافة ALLAN لهذا المزيج من الأدوية لم يكن له أي تأثير على الزيادة في عمر الدودة. نعتقد أن هذا النمط يرجع إلى حقيقة أنه في هذا المزيج من الأدوية ، كان ALLAN هو المحاكاة CR الثانية.من أجل إجراء مزيد من الدراسة لآلية التآزر الدوائي ، قمنا بعمل ملف تعريف للمجموعات المختلطة للعقاقير مع تأثير تآزري وتوليفة دوائية بدون مثل هذا التأثير. أعطيت الديدان الخيطية واحد أو اثنين أو ثلاثة مركبات دوائية للكشف عن وجود أو عدم وجود هذا التأثير. تم تجميع نسخة من العقاقير الفردية المخصصة ل CR - المحاكاة في نفس المنطقة مثل الملف transcriptome للكائنات الحية متحولة أكل 2. على العكس من ذلك ، لم يكن لمجمع RIF نشاط يحاكي CR ، وكان نصه مختلفًا عن نتائج التحليل النسخي لطفرات الأكل -2 وأدوية أخرى (المخطط 2 ح).من المثير للاهتمام أن نلاحظ أن نسخ مجموعات الأدوية ذات التأثير التآزري متجمعة معًا وأنماط تعبيراتهم الجينية تختلف على حد سواء عن تعبيرات الأدوية الفردية المتضمنة في المجموعة وعن مسوخ تناول الطعام -2 (المخطط 2 ح ، مخطط إضافي 4 ج ، د). مقارنةً بمجموعة التحكم ، عند استخدام توليفات مضاعفة وثلاثية من الأدوية ، غالبًا ما يتم عرض مسار إشارات TFG (المخطط 4 أ ، مخطط إضافي 6 ج ، 7 أ ، جدول مساعد s4). بالإضافة إلى ذلك ، قارنا مع نسخة من مزيج من الأدوية مع نسخة من مركبات المخدرات المدرجة فيه ، وهذا الأخير في هذه الحالة بمثابة مجموعة مراقبة (انظر الأساليب). على عكس المجموعة الضابطة ، فإن مجموعات الأدوية ذات التأثير التآزري عززت نشاط TGFβ والعديد من مسارات الإشارات الأخرى.في توليفات الدواء دون عمل تآزري ، لم يتم تمثيل هذه المسارات في ملف التعريف النسخي (الجدول المساعد S5).أطال بعض مجموعات الأدوية حياة الأكل -2 إلى النيماتودا المتحولة ، لكن لا توجد أدوية فردية في هذه المجموعات. قررنا التحقق مما إذا كانت طفرات تناول الطعام 2 ستزيد من نشاط مسار TGFβ بعد التوليفات التآزرية ، على عكس دودة أكل - 2 بدون علاج دوائي. كان مسار الإشارة الوحيد الذي كان موجودًا بشكل ملحوظ في النص بعد استخدام أي من التوليفات التآزرية للعقاقير هو مسار TGFβ (مخطط إضافي 7 ب ، يدعم الجدول S6). لقد كانت مفاجأة كاملة بالنسبة لنا أن هذا المسار تم تحديده بشكل حصري من خلال عمل توليفات متآزرة من مركبات الدواء (المخطط 4 ب ، مخطط إضافي 7 أ ، ج ، جدول مساعد 7).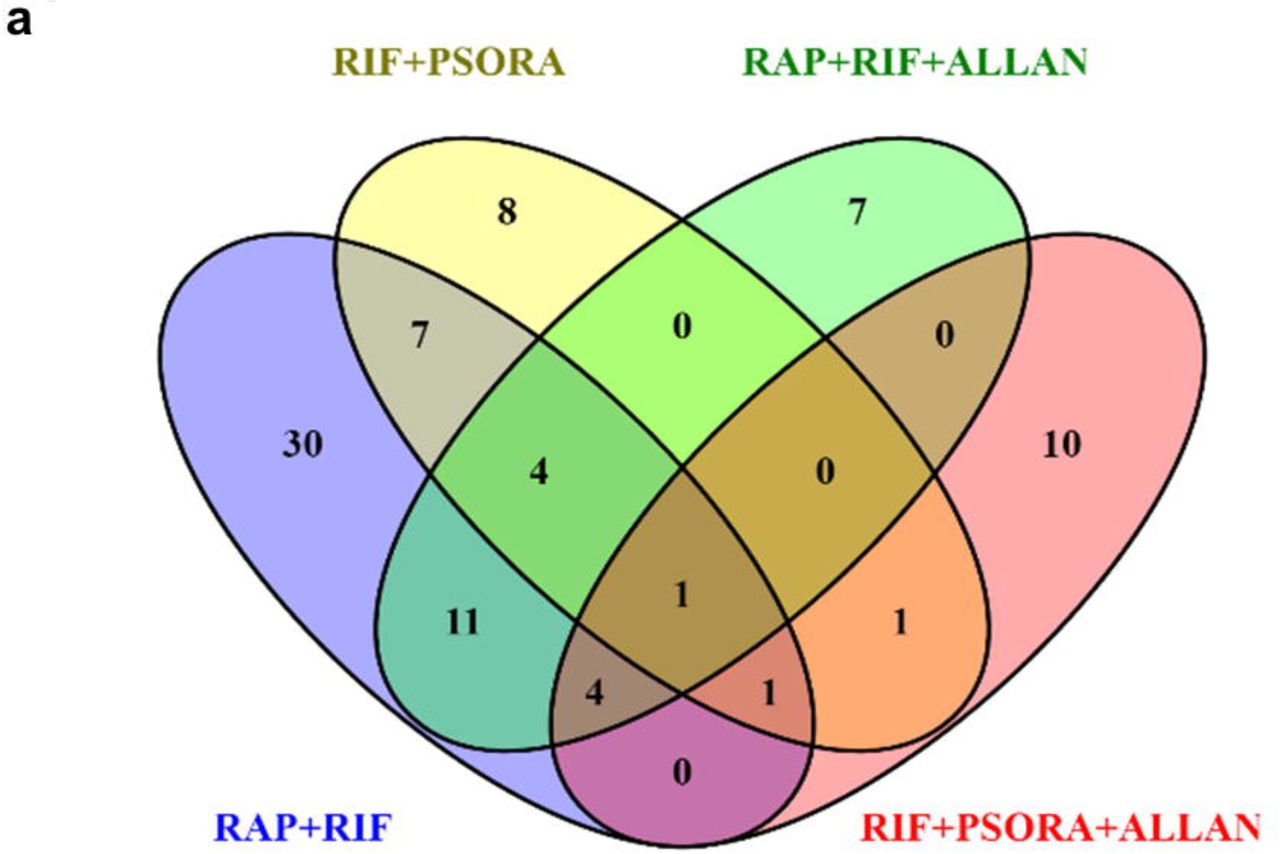


 الشكل 4
الشكل 4أهمية مسار إشارات TGFβ لتآزر الدواء
قد يكون تنشيط مسار إشارات TGFβ الذي كشفت عنه دراستنا الآلية الرئيسية التي يتم من خلالها تحقيق تأثير تآزري يمتد من عمر الكائنات الحية النموذجية. في السابق ، لاحظت الدراسات أن طفرة TGF (daf-7) أدت إلى زيادة في وقت الحياة عبر مسار إشارة الأنسولين. كما نظم كل من الوسطاء daf-2 و daf-7 نسخ الجينات المعتمدة على daf-16 (المخطط التكميلي 7 د). تساءلنا عما إذا كان من الممكن ، بمساعدة مجموعات مختارة من الأدوية ، إطالة عمر طفرات daf-2 ، على الرغم من أن متوسط العمر المتوقع للحيوانات بسبب هذه الطفرة كان بالفعل أعلى. بادئ ذي بدء ، قررنا مدى عمر النيماتودا daf-2 المتحولة بعد كل مجموعة من الأدوية.تم تسجيل الزيادة في العمر في مجموعات تحتوي على RAP: RAP + RIF و RAP + RIF + ALLAN. ومع ذلك ، كان معدل النمو هو نفسه تقريبا عند استخدام عقار RAP فقط. لم يلاحظ وجود تأثير تآزري يطيل عمر الديدان الخيطية في أي مجموعة من الأدوية (المخطط 3 ج ، المخطط 8 الإضافي ، الجدول الإضافي s2). ساهم نشاط PSORA أيضًا في زيادة عمر الديدان الطافرة daf-2 ، ولكن تركيبة العقاقير بما في ذلك هذا الدواء (RIF + PSORA و RIF + PSORA + ALLAN) كان لها تأثير محايد على طول عمر الديدان الخيطية (المخطط 3 ج ومخطط إضافي 8).في المستقبل ، اختبرنا فعالية جميع المجموعات التآزرية للعقاقير والمواد الدوائية التي تألفت منها على طفرات daf-7. في أي حال كان تم اكتشاف تأثير التآزر. لقد توصلنا إلى أن تضافر المخدرات يرجع إلى مسار الإشارة daf-7 ، على الرغم من أن هذه الأدوية الفردية في هذه المجموعة فعالة من حيث زيادة متوسط العمر المتوقع (Scheme 3d ، مخطط إضافي 8) في ظل هذه الظروف.المخدرات التآزر ، MUFA ، والحياة تمتد
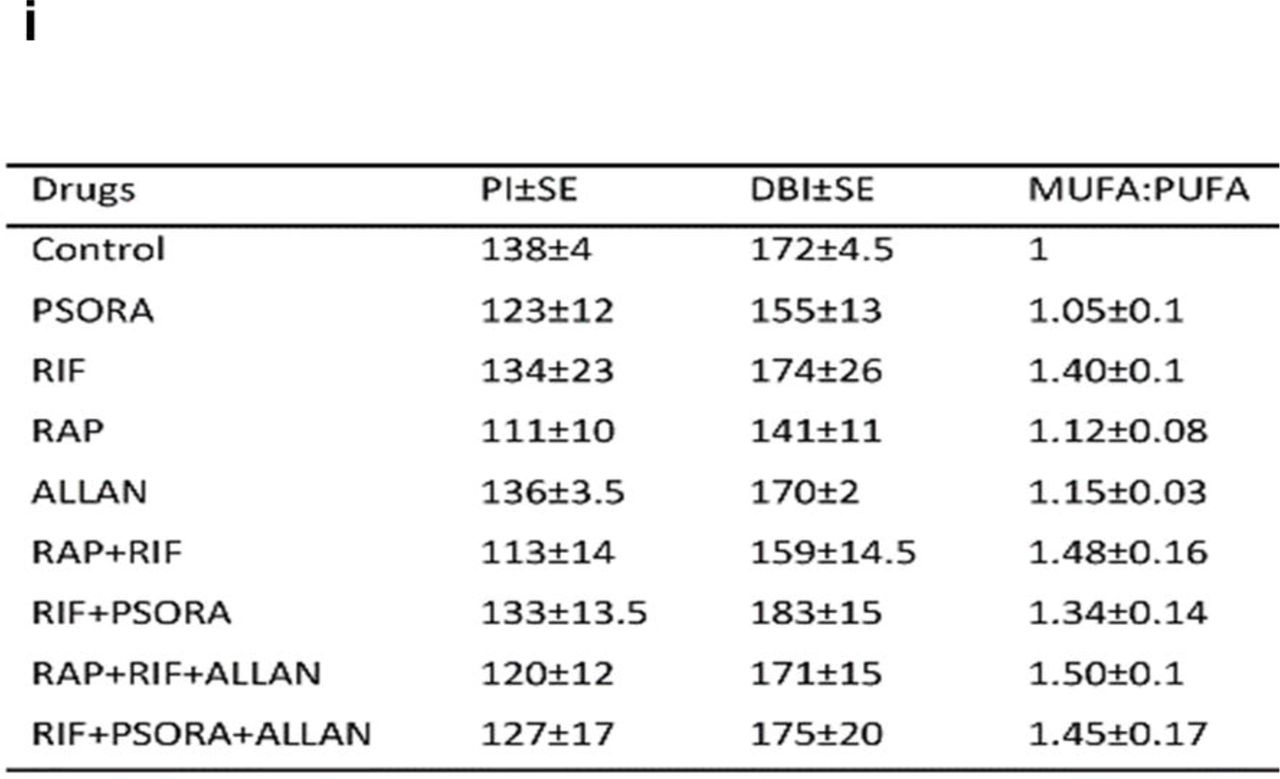
كما ورد سابقًا في الدراسات ، تحدث إعادة ترتيب الأيض في خطوط العمر الديدان وطفيلي daf-2 طويلة العمر ، مما يؤدي إلى زيادة إنتاج الدهون وتراكمها. بالإضافة إلى ذلك ، فإن مسار TGFβ / daf-7 ينظم عملية التمثيل الغذائي لثلاثي الجلسرين (TAG) ، ومن المعلوم أن طور الديدان الخيطية daf-7 المتحولة تخزن كمية أكبر من الدهون. هذه المعلومات والبيانات من عملنا أدت بنا إلى دراسة ما إذا كانت مجموعات من الأدوية التي تتميز بالتآزر تؤثر على الملف الشخصي للدهون من الديدان الخيطية مع مسار الإشارات المحظورة TGFβ (الجدول المساعد S3).في المرحلة الأولية ، أجرينا تحليلًا نسقيًا لنتائجنا من أجل إيجاد مسارات إشارات تغير تكوين الدهون ، ووجدنا أن توليفات الأدوية ذات التأثير التآزري تزيد من مستوى SREBP-1c: sbp-1 homolog في C. elegans. إنه بمثابة عامل النسخ الرئيسي الذي يتحكم في الجينات المسؤولة عن تخليق الدهون المختلفة وأنزيمات desaturase. ويشارك الأخير في تكوين الأحماض الدهنية غير المشبعة الاحادية (MUFA) (المخطط 4 ج ، و). بعد ذلك ، أجرينا تحليلًا للشحوم بواسطة قياس الطيف الكتلي للكشف عن التغيرات في المظهر الجانبي للشحوم بعد التعرض للعقاقير. في الديدان الخيطية ، بعد استخدام مجموعات تآزرية من الأدوية ، يحتفظ TAG ، ونسبة MUFA: PUFA (الأحماض الدهنية الأحادية غير المشبعة إلى متعددة غير المشبعة) ومقدار 16: 1 و 19:1 الأحماض الدهنية غير المشبعة الاحادية (مخطط 4f).نتيجة لذلك ، لوحظ انخفاض في مؤشر الرابطة المزدوجة (DBI) (يُظهر درجة عدم تشبع الأحماض الدهنية) ومؤشر بيروكسيد الدهون (PI) (المخطط 4i). يشير انخفاض PI إلى أن الدهون تحتوي على روابط ثنائية أقل بين الكربونات ، مما يقلل من قدرة الدهون على بيروكسيد. وفقا لنتائج مؤلفين مختلفين ، ارتبط انخفاض في قدرة بيروكسيد مع زيادة في متوسط العمر المتوقع ، ربما لأن الدهون كانت أقل عرضة للأكسدة في الجسم.ويعتقد أنه من خلال قمع عملية بيروكسيد ، تتحسن مقاومة الإجهاد التأكسدي. في عملنا ، في الديدان بعد تطبيق مجموعات التآزر من المخدرات ، في الواقع ، زادت هذه المقاومة (المخطط 5 هـ ، و). علاوة على ذلك ، لاحظنا زيادة في المستوى العام لل sphingomyelin في الديدان الخيطية (مخطط 4H). لقد أظهر العلماء أن هذا المؤشر تسبب في زيادة عمر الديدان من خلال زيادة الالتهام الذاتي. الرقم 5يمكن أن يؤدي إطالة استقلاب الطاقة ومنع عمل سلسلة الأغشية الخاصة بنقل الإلكترون (ETC) إلى إطالة عمر C. elegans. هذه الحقيقة لا تفسر النتائج في دراستنا ، لأنه لم يكن من الممكن للديدان الخيطية اكتشاف انخفاض ملحوظ في معدل الأيض القاعدي (المخطط 5i). تصف الأدبيات العلمية أن طول العمر غالباً ما كان مصحوبًا بعوامل مثل: تباطؤ النمو والتنمية ، بالإضافة إلى انخفاض الخصوبة. لم نجد أنه في الديدان التي أعطيت توليفات مختلفة من الأدوية ، تغيرت مدة حياة البالغين والخصوبة العامة بشكل كبير. رغم أنه بعد إضافة هذه المجموعات ، سجلت زيادة طفيفة في فترة التكاثر في النيماتودا (المخطط 5 أ-ج ، المخطط الإضافي 9 أ).في المرحلة التالية ، قررنا: مؤشرات التكيف ، ومستوى تحمل المواقف العصيبة وقابلية الديدان الخيطية. قمنا بتقييم سرعة الحركة التلقائية ، ومقاومة الصدمة الحرارية ، ومقاومة الإجهاد التأكسدي ، وحسبنا أيضًا صلاحية الديدان على مقياس الحراك التلقائي ، حسب طريقة هيردون (هيرندون). في المجموعة الضابطة ، كانت فترة الحياة النشطة تقريبًا 50٪ من إجمالي فترة حياة النيماتودا. بلغ مؤشر مماثل في الديدان تعامل مع الاستعدادات RIF + PSORA + ALLAN أو RAP + RIF + ALLAN 57 ٪ و 63 ٪ من حياتهم الطويلة ، على التوالي (مخطط 5D ، بيانات إضافية 9C). وهكذا ، زاد كل من العمر المطلق والفترة النسبية للنشاط النيماتودي الناشط زيادة كبيرة.لاحظنا أنه عندما توفي الدودة الأخيرة في المجموعة الضابطة ، في الجانب الآخر ، أظهر أكثر من نصف الأفراد المستوى الأمثل للنشاط الحيوي (المخطط 5 د ، البيانات الإضافية 9 ج). أظهر تحليل الحركات العفوية أنه في المجموعة التجريبية ، بغض النظر عن عمر الديدان ، فإن حركتها بعد عمل توليفات دوائية مثل: RIF + PSORA + ALLAN أو RAP + RIF + ALLAN كانت أعلى بكثير من نظيراتها في المجموعة الضابطة. في الواقع ، لم يختلف التنقل التلقائي للأفراد المسنين (18 يومًا من العمر) الذي استخدمت فيه الأدوية عن النشاط الحركي للديدان الشابة (7 أيام من الحياة) في المجموعة الضابطة (Scheme 5g). بالإضافة إلى ذلك ، زادت المعالجة الدوائية للديدان من مقاومتها للحرارة والإجهاد التأكسدي (التحليل السمي ، مخطط 5 هـ ، و ، مخطط إضافي 9 ب).تشير ملاحظاتنا إلى أنه بعد عمل مجموعات الأدوية التآزرية ، تطول النيماتودا فترة الحياة النشطة ، وتزيد من مقاومة عوامل الإجهاد ، وحتى تنقل الأفراد ، في حين كانت التغييرات التعويضية في تطورهم الفسيولوجي غائبة أو كانت ضئيلة.بالنظر إلى هذه النتائج ، نشك في أن الزيادة في متوسط العمر المتوقع يرجع إلى تباطؤ معدل الشيخوخة البيولوجية. يمكن التعبير عن معدل الشيخوخة كمؤشر على الوقت الذي يتضاعف فيه معدل وفيات الأفراد (MRDT أو وقت مضاعفة شدة الوفيات). باستخدام منصة Survcurv التحليلية ، حددنا هذه المعلمة في الكائنات الحية النموذجية بعد تطبيق توليفات المخدرات التآزرية. مع التأثير المشترك لعقاقير RIF + PSORA + ALLAN ، كان مستوى MRDT الخيطي أعلى بكثير من نفس المؤشر في المجموعة الضابطة (MRDT = 3.7 و 3 أيام ، P <0.0001 ، على التوالي).كان معدل الوفيات للديدان الشابة (IMR) في المجموعة التجريبية أيضًا أقل بكثير (IMR للمجموعة الضابطة = 2.7e-3 ، IMR تحت تأثير RIF + PSORA + ALLAN = 8.5e-4 ، RAP + RIF + ALLAN = 9.3e-4 ، P <0.001). لقد توصلنا إلى استنتاج مفاده أنه بفضل استخدام مجموعات التآزر من العقاقير ، تباطأت عملية الشيخوخة للديدان الخيطية وزادت مقاومة العوامل السلبية المختلفة لدى الأفراد الشباب ، مما أدى في النهاية إلى إطالة حياتهم.
الرقم 5يمكن أن يؤدي إطالة استقلاب الطاقة ومنع عمل سلسلة الأغشية الخاصة بنقل الإلكترون (ETC) إلى إطالة عمر C. elegans. هذه الحقيقة لا تفسر النتائج في دراستنا ، لأنه لم يكن من الممكن للديدان الخيطية اكتشاف انخفاض ملحوظ في معدل الأيض القاعدي (المخطط 5i). تصف الأدبيات العلمية أن طول العمر غالباً ما كان مصحوبًا بعوامل مثل: تباطؤ النمو والتنمية ، بالإضافة إلى انخفاض الخصوبة. لم نجد أنه في الديدان التي أعطيت توليفات مختلفة من الأدوية ، تغيرت مدة حياة البالغين والخصوبة العامة بشكل كبير. رغم أنه بعد إضافة هذه المجموعات ، سجلت زيادة طفيفة في فترة التكاثر في النيماتودا (المخطط 5 أ-ج ، المخطط الإضافي 9 أ).في المرحلة التالية ، قررنا: مؤشرات التكيف ، ومستوى تحمل المواقف العصيبة وقابلية الديدان الخيطية. قمنا بتقييم سرعة الحركة التلقائية ، ومقاومة الصدمة الحرارية ، ومقاومة الإجهاد التأكسدي ، وحسبنا أيضًا صلاحية الديدان على مقياس الحراك التلقائي ، حسب طريقة هيردون (هيرندون). في المجموعة الضابطة ، كانت فترة الحياة النشطة تقريبًا 50٪ من إجمالي فترة حياة النيماتودا. بلغ مؤشر مماثل في الديدان تعامل مع الاستعدادات RIF + PSORA + ALLAN أو RAP + RIF + ALLAN 57 ٪ و 63 ٪ من حياتهم الطويلة ، على التوالي (مخطط 5D ، بيانات إضافية 9C). وهكذا ، زاد كل من العمر المطلق والفترة النسبية للنشاط النيماتودي الناشط زيادة كبيرة.لاحظنا أنه عندما توفي الدودة الأخيرة في المجموعة الضابطة ، في الجانب الآخر ، أظهر أكثر من نصف الأفراد المستوى الأمثل للنشاط الحيوي (المخطط 5 د ، البيانات الإضافية 9 ج). أظهر تحليل الحركات العفوية أنه في المجموعة التجريبية ، بغض النظر عن عمر الديدان ، فإن حركتها بعد عمل توليفات دوائية مثل: RIF + PSORA + ALLAN أو RAP + RIF + ALLAN كانت أعلى بكثير من نظيراتها في المجموعة الضابطة. في الواقع ، لم يختلف التنقل التلقائي للأفراد المسنين (18 يومًا من العمر) الذي استخدمت فيه الأدوية عن النشاط الحركي للديدان الشابة (7 أيام من الحياة) في المجموعة الضابطة (Scheme 5g). بالإضافة إلى ذلك ، زادت المعالجة الدوائية للديدان من مقاومتها للحرارة والإجهاد التأكسدي (التحليل السمي ، مخطط 5 هـ ، و ، مخطط إضافي 9 ب).تشير ملاحظاتنا إلى أنه بعد عمل مجموعات الأدوية التآزرية ، تطول النيماتودا فترة الحياة النشطة ، وتزيد من مقاومة عوامل الإجهاد ، وحتى تنقل الأفراد ، في حين كانت التغييرات التعويضية في تطورهم الفسيولوجي غائبة أو كانت ضئيلة.بالنظر إلى هذه النتائج ، نشك في أن الزيادة في متوسط العمر المتوقع يرجع إلى تباطؤ معدل الشيخوخة البيولوجية. يمكن التعبير عن معدل الشيخوخة كمؤشر على الوقت الذي يتضاعف فيه معدل وفيات الأفراد (MRDT أو وقت مضاعفة شدة الوفيات). باستخدام منصة Survcurv التحليلية ، حددنا هذه المعلمة في الكائنات الحية النموذجية بعد تطبيق توليفات المخدرات التآزرية. مع التأثير المشترك لعقاقير RIF + PSORA + ALLAN ، كان مستوى MRDT الخيطي أعلى بكثير من نفس المؤشر في المجموعة الضابطة (MRDT = 3.7 و 3 أيام ، P <0.0001 ، على التوالي).كان معدل الوفيات للديدان الشابة (IMR) في المجموعة التجريبية أيضًا أقل بكثير (IMR للمجموعة الضابطة = 2.7e-3 ، IMR تحت تأثير RIF + PSORA + ALLAN = 8.5e-4 ، RAP + RIF + ALLAN = 9.3e-4 ، P <0.001). لقد توصلنا إلى استنتاج مفاده أنه بفضل استخدام مجموعات التآزر من العقاقير ، تباطأت عملية الشيخوخة للديدان الخيطية وزادت مقاومة العوامل السلبية المختلفة لدى الأفراد الشباب ، مما أدى في النهاية إلى إطالة حياتهم.الحفاظ على تأثير التآزر المخدرات في ذبابة الفاكهة
واحدة من القضايا الرئيسية في البحث في عملية الشيخوخة هي مسألة نقل النتيجة المحققة لإطالة الحياة من نوع إلى آخر. لهذا السبب ، درسنا ما إذا كان سيتم الحفاظ على تأثير التآزر الدوائي الذي يطيل عمر C. elegans في تجارب على Drosophila melanogaster. سابقا ، في الدراسات ، أظهر العلماء أن RAP زاد من حياة ذباب الفاكهة ، في حين أن MET لم تكن فعالة. لقد قمنا باستمرار بتقييم تأثير المستحضرات الفردية ومجموعاتها على فترة حياة ذباب ثمار الذكور. في البداية ، أوضحنا أن المركبات الطبية RAP و ALLAN تطيل متوسط عمر ذبابة الفاكهة ، بينما زاد RIF و PSORA فقط من الحد الأقصى لمتوسط العمر المتوقع للكائنات الحية (المخطط 6 ، دعم الجدول s2).تم الكشف عن تأثير تآزري يطيل عمر الذباب في توليفة من الأدوية بناءً على مركب RAP: RAP + RIF و RAP + RIF + ALLAN (المخطط 6 أ). لم نجد زيادة في متوسط عمر الذباب عند استخدام توليفة من الأدوية التي تحتوي على PSORA: RIF + PSORA و RIF + PSORA + ALLAN (المخطط 6 ب). ومع ذلك ، بالمقارنة مع نتائج عمل الأدوية الفردية ، أدى الجمع بين أدوية RIF + PSORA إلى تأثير تآزري يزيد من العمر الأقصى للكائنات (المخطط 6 ج). نظرًا لأن ذبابة الفاكهة Drosophila melanogaster احتفظت بتأثير التآزر الدوائي ، نعتقد أن نتائج عملنا تؤكد وجود آلية محافظة تطورية تحدد عمل هذا التأثير التآزري. الشكل (6)
الشكل (6)المناقشة
في هذا العمل ، تمكنا من العثور على العديد من مجموعات الأدوية ذات التأثير التآزري. لقد أثروا بشكل انتقائي على مسارات إشارات معينة مرتبطة بالشيخوخة وطول العمر. بالإضافة إلى ذلك ، قد تتقاطع مسارات الإشارات مع بعضها البعض. على الرغم من أن هذه التركيبات الدوائية كانت تستخدم فقط في مرحلة البلوغ ، فقد تضاعف العمر الفعلي لـ C.elegans. كان حجم تأثير التدخلات المخدرات مماثلة للتأثير بعد الطفرات الكلاسيكية التي تبطئ الشيخوخة. بقدر ما نعلم ، أصبحت هذه الدراسة الأكبر من حيث عدد وحجم التدخلات المخدرات في الحيوانات البالغة.
عند استخدام توليفات طبية تآزرية تزيد من عمر الديدان ، لم نتمكن من اكتشاف أي اضطرابات أو اضطرابات تعويضية سلبية مصاحبة في تطور الحيوان. وقد لوحظت اضطرابات مماثلة في الكائنات الحية مع طفرات في الجينات المرتبطة بالشيخوخة. أيضا ، لم يكن تأثير الدواء الإيجابي الذي لوحظ بسبب انخفاض في أداء سلسلة الغشاء من نقل الإلكترون (ETC) أو تثبيط عملية التمثيل الغذائي في الديدان. وقد تم تقييم هذه المؤشرات على أساس مستوى استهلاك الأوكسجين.
في الواقع ، تجاوزت الحيوانات التي تلقت توليفة من الأدوية من مجموعة التحكم في الكائنات الحية من حيث النشاط الحركي. كان الشكل البدني والنشاط هما نفس الشيء لدى الأفراد الأكبر سناً في المجموعة التجريبية والأصغر سناً في المجموعة الضابطة (المخطط 5 ز). أظهر تحليل الوفيات أن التأثير التآزري لمجموعات الأدوية يبطئ معدل الشيخوخة البيولوجية بحوالي 20٪ (مخطط إضافي 10). لاختبار التأثير الإيجابي للتآزر الدوائي والمحافظة التطورية ، أجرينا العديد من التجارب على ذبابة الفاكهة Drosophila melanogaster. أكد اثنان من تركيبات الأدوية الأربعة سلامة تأثير التآزر.
تطوريًا ، تكون النيماتودا أقرب إلى الثدييات أكثر من الذباب. لذلك ، فإن هذه الآليات المحافظة ومسارات الإشارة في ذباب الفاكهة والديدان الخيطية قديمة. ربما ، في البداية كانت آلية العمل التآزري موجودة في الجد المشترك بين هذه الفئات الثلاثة من الحيوانات.
من أجل دراسة آلية عمل تآزر الدواء الذي يطيل عمر الديدان ، أجرينا العديد من تجارب الرعاف (قمع الرعاف من عمل زوج من الأليلات من الجينوم بواسطة جينوم زوج غير أليلي) وتحليل النسيلة. ونتيجة لذلك ، تمكنا من العثور على أن مسارات إشارة daf-2 / daf-16 (IGF / FOXO) و TGF (daf-7) تلعب دورًا مهمًا في أداء التأثير التآزري (المخطط 4j). كما تم تأكيد العلاقة بين هذين المسارين في دراسات أخرى. يذكر مؤلفوهم أن daf-7 ينظم فترة حياة الحيوانات عبر مسار إشارة الأنسولين ، ويرتبط مسار TGF العصبي مع مدخول المغذيات وطول العمر. بالإضافة إلى ذلك ، يتحكم daf-7 في عملية التمثيل الغذائي لـ C. elegans وعملية تخزين الدهون. عملت الطفرات التي تطيل عمر C. elegans على عملية التمثيل الغذائي للدهون في الديدان عن طريق زيادة كمية الدهون غير المشبعة الأحادية وتقليل كمية الدهون غير المشبعة المتعددة.
هذه النتائج تتفق مع نتائج دراستنا. زاد التآزر الدوائي من مستوى عامل النسخ الرئيسي sbp-1 ، والذي يؤثر على استقلاب الشحوم وتوليف الدهون غير المشبعة الاحادية (مخطط 4c ، f ، مخطط إضافي 5). كشف التحليل الطيفي الشامل للورم الشحمي الشحمي ، الذي استخدم توليفات مختلفة من الأدوية ذات التأثير التآزري ، عن تغييرات في التمثيل الغذائي للدهون: تنشيط عامل sbp-1 ، وتراكم ثلاثي الجلسرين وزيادة نسبة الدهون الأحادية وغير المشبعة المتعددة في اتجاه زيادة في الشحوم السابقة (بما في ذلك في فئتين من الدهون - الفوسفاتيدكولين والفوسفاتيديليثانولامين). أخيرًا ، في الأدبيات العلمية ، يوصف أن غلبة الدهون غير المشبعة الأحادية على كثرة غير مشبعة موجودة في الصورة الدهنية لأغشية كرات الدم الحمراء للأطفال الذين نجوا والديهم من 90 سنة أو أكثر.
هناك اهتمام كبير بين العلماء في العالم حول القدرة المحتملة لـ MET ، وربما مركب RAP ، على إبطاء تطور الاضطرابات المرتبطة بالعمر والوقاية من الأمراض التي تصيب الإنسان. بالنظر إلى الاهتمام المتزايد بهذه المشكلة ، نود أن نذكر التجارب التي كانت فيها فعالية الجمع بين الاستعدادات MET و RAP في C. elegans والفئران ضعيفة. لقد أحبطت هذه النتائج العديد من العلماء.
في عملنا ، أثبتنا أن متوسط العمر المتوقع تم تحديده بواسطة مجموعة من مسارات الإشارة والجينات المتفاعلة والجزيئات الكيميائية الحيوية. يمكن أن يؤدي التأثير المتزامن لبعض مسارات الإشارات على عدة أهداف إلى تأثير إيجابي ملحوظ وأحيانًا نتيجة غير متوقعة. في هذه الدراسة ، استنادًا إلى مبدأ الأدلة ، استخدمنا العقاقير التي تعمل على مسارات الإشارة الرئيسية.
فجأة ، اكتشفنا تأثيرًا تآزريًا ، وهو الطابع العالمي والمحافظ تطوريًا. تؤكد نتائج عملنا صحة استخدام الأدوية التي تبطئ نشاط العديد من مسارات الإشارات المحافظة في وقت واحد لإبطاء معدل الشيخوخة البيولوجية. إذا تمكن العلماء من نقل مبدأ العمل هذا إلى الناس ، فسيؤدي هذا إلى زيادة كبيرة في فعالية الرعاية الطبية والرفاه الاقتصادي للمجتمع.
ترجمة: تاتيانا Gneteeva.