مع تحسن أدوات دراسة البيولوجيا ، يبدأ الباحثون في الكشف عن تفاصيل البروتينات الدقيقة ، والتي ، على ما يبدو ، هي مفتاح بعض العمليات الخلوية ، بما في ذلك تلك المتعلقة بالسرطان. تتكون البروتينات من سلاسل الأحماض الأمينية المرتبطة ، ويحتوي البروتين البشري المتوسط على حوالي 300 من بقايا الأحماض الأمينية. وفي الوقت نفسه ، تحتوي البروتينات الدقيقة على أقل من 100 من بقايا الأحماض الأمينية. لقد أظهر العلماء مؤخرًا أن أحد البروتينات الدقيقة ، PIGBOS ، الذي يتكون من 54 من الأحماض الأمينية ، يساعد على تخفيف إجهاد الخلية.
العمل عليه بواسطة Alan Saghatelian et al. تم نشره في Nature Communications.
بدأت الدراسة عندما اكتشف العلماء PIGBOS في الميتوكوندريا.
فشلت المحاولة الأولى للكشف عن بروتين PIGBOS من خلال بروتين الفلورسنت الأخضر (GFP). كان البروتين الدقيق أصغر من اللازم مقارنةً بحجم GFP. قام فريق من العلماء بحل هذه المشكلة من خلال تجربة مقاربة أقل شيوعًا تدعى GFP المشتركة ، حيث قاموا بضم جزء صغير فقط من GFP ، يطلق عليه beta ، مع PIGBOS.
تمكن الباحثون من رؤية PIGBOS ودراسة كيفية تفاعلها مع البروتينات الأخرى. عندما قاموا بتحديد موقع PIGBOS ، أدركوا أنه كان على الغشاء الخارجي للميتوكوندريا ، وعلى استعداد للتواصل مع البروتينات في العضيات الأخرى. فوجئوا برؤية PIGBOS تتفاعل مع بروتين يسمى CLCC1 ، وهو جزء من عضية تسمى شبكية الإندوبلازم.
يقول مؤلف آخر مشارك في هذا العمل ، تشيان تشو: "PIGBOS بمثابة ملتقى بين الميتوكوندريا وإير". "كنا لا نرى هذا في البروتينات الدقيقة - ونادراً ما نراه في البروتينات العادية."
وجد الباحثون أن PIGBOS يرتبط في الواقع بـ CLCC1 لتنظيم الإجهاد في ER. بدون PIGBOS ER ، من المحتمل أن تتعرض للإجهاد ، مما يؤدي إلى سلسلة من الأحداث عندما تحاول الخلية تنظيف البروتينات المشوهة السيئة (استجابة لطي البروتين غير المناسب ، UPR). إذا لم تتمكن الخلية من التخلص من هذه البروتينات ، فإنها تبدأ تسلسل التدمير الذاتي وتموت.
لم يتوقع العلماء رؤية دور بروتين الميتوكوندريا في تفاعل UPR. هذا الفهم الجديد لـ PIGBOS يفتح الباب أمام العلاجات المستقبلية التي يمكن أن تستهدف خلايا الإجهاد.
يقول كيو تشو: "في المستقبل ، يمكننا النظر في كيفية تورط PIGBOS في أمراض مثل السرطان". "في مرضى السرطان ، تكون ER أكثر إجهادًا من أي شخص عادي ، لذلك يمكن أن تكون إدارة الإجهاد ER هدفًا جيدًا."
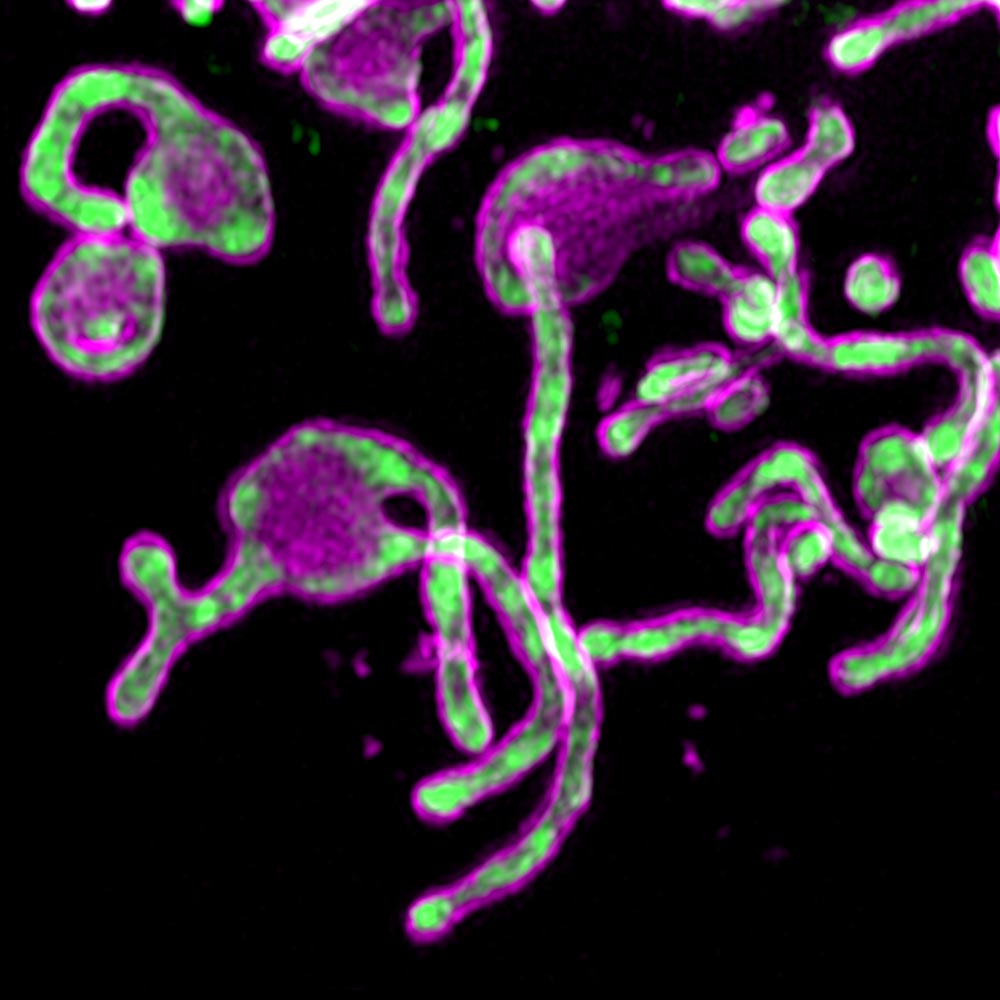 التين. 1. PIGBOS Microprotein التصويرwww.salk.edu/news-release/mysterious-microproteins-have-major-implications-for-human-disease
التين. 1. PIGBOS Microprotein التصويرwww.salk.edu/news-release/mysterious-microproteins-have-major-implications-for-human-diseaseيهتم الباحثون بدراسة دور البروتينات الأخرى في الميتوكوندريا في الإجهاد الناجم عن التعرض للطوارئ ، وكذلك كيفية عمل PIGBOS في النماذج الحيوانية. يتقدم الفريق أيضًا في توصيف مكتبة واسعة من البروتينات الدقيقة التي يمكن أن تكون حاسمة في بيولوجيا الخلية.
ما هي البروتينات الدقيقة؟
يشير مصطلح "البروتينات الدقيقة" إلى بروتينات صغيرة يتم تشفيرها بواسطة إطارات قراءة صغيرة مفتوحة (smORF). تشير التطورات في تكنولوجيا الجينوم والبروتيوم إلى أنه يعتقد أن جينومات الثدييات تحتوي على مئات إلى آلاف البروتينات الدقيقة المشفرة بواسطة smORFs. باعتبارها جزءًا كبيرًا وما زال يتم دراسته بشكل سيئ من الجينوم ، توفر البروتينات الدقيقة فرصة عظيمة لاكتساب فهم جديد للبيولوجيا الحديثة.
ليس من قبيل الصدفة أن المجلة الأمريكية "ذا ستيبست" وصفت البروتينات الدقيقة بأنها "المادة المظلمة للبروتين البشري". على الرغم من أن أولهم ، Id ، تم اكتشافه منذ حوالي 30 عامًا. من الخصائص الشائعة لعائلة بروتينات Id في الثدييات تنظيم مصير الخلية. تعمل بروتينات Id في الأنسجة والخلايا المختلفة ، بما في ذلك myoblasts ، والجهاز العصبي ، والجهاز المناعي. إلى جانب حقيقة أنها تعمل كمعدلات لآلية النسخ وتؤثر على مصير خلايا التطور ، تؤثر بروتينات Id أيضًا على التحكم في دورة الخلية ويتم التعبير عنها بشكل مفرط في مختلف الأورام البشرية. الوظيفة الجزيئية لبروتينات Id في العمليات التنموية مفهومة جيدًا ، لكن لا يُعرف الكثير حتى الآن عن وظيفة بروتينات Id في البالغين.
حتى الآن ، تتميز فقط عدد قليل من smORFs والبروتينات الدقيقة. على سبيل المثال ، سمحت لنا بعض smORFs الخاصة بالعضلات بوصف مسارات جديدة تتحكم في وظائف العضلات وتطورها. البروتينات البشرية MOTS-C ينظم التوازن الأيضي ، يتفاعل البروتين NoBody (البروتيد المفصول غير المفصل P- الجسم) مع بروتينات mRNA المشقوقة ، والتي هي المكونات الجزيئية للخطوة الأنزيمية الأولى في مسار انهيار mRNA. وينظم ميكروتين يسمى CYREN اختيار مسار إصلاح الحمض النووي خلال دورة الخلية.
الآلية المعروفة حاليا لعمل البروتينات الدقيقة هي لقمع تشكيل مجمعات البروتين. وهذا هو ما يبدو. تؤدي العديد من البروتينات وظائفها من خلال العمل كجزء من مجمعات متعددة البروتينات. يتم تنظيم تشكيل هذه المجمعات بشكل صارم والتوسط من خلال مجالات التفاعل البروتين البروتين. يمكن أن يكون لتعطيل المجمع أو قدرة البروتينات على تكوين متجانسات متجانسة أو متغايرة أو متعددة العوامل عواقب وخيمة على الوظيفة الخلوية. في هذا الصدد ، يمكن تعطيل تشكيل dimers و multimers بواسطة البروتينات الدقيقة. تتصرف البروتينات المتناهية الصغر كمنظِّمات ما بعد متعدية ، وتشكِّل ثنائيات مثليّة مع أهدافها ، وتعمل من خلال كبح السلبي لوظائف مجمع البروتين.
ببساطة ، تتداخل البروتينات الدقيقة مع العمل المعقد للبروتينات الكبيرة ، مما يعوق بعض العمليات الخلوية ويحفز الآخرين. تشير الدراسات إلى أن عمل البروتينات الدقيقة يعد تطوريًا وشائعًا لكل من الممالك الحيوانية والنباتية. تظهر نتائج الدراسات الأولية أن البروتينات الدقيقة تشارك في العمليات المناعية ، وتتحكم في تدمير جزيئات الحمض النووي الريبي المعيب ، وتحمي البكتيريا من الحرارة والبرودة ، وتملي فترة ازدهار النباتات ، وتعمل كمصدر للسموم لأنواع كثيرة من السموم الحيوانية. وفقا للعلماء ، يبدو أن البروتينات الدقيقة تشارك في جميع العمليات البيولوجية. قبل أن لا تولي اهتماما.
من المحتمل أن تتوسط أيضًا العديد من العمليات الخلوية الرئيسية بواسطة بروتينات غير موصوفة. كل من اكتشاف وتوصيف smORFs والبروتينات الدقيقة مهمة بحثية مهمة.
على الرغم من الأسرار المتبقية ، يختبر العلماء بالفعل الاستخدام المحتمل لهذه الجزيئات. تبيع إحدى الشركات المبيدات الحشرية المستمدة من البروتينات الدقيقة الموجودة في سم أتريد الأسترالي. في التجارب السريرية ، يتم اختبار عامل تباين يعتمد على بروتين صغير آخر في سم العقرب. تتمثل مهمة هذه المادة في عزل حدود الأورام بحيث يمكن للجراحين استخراجها بدقة أكبر. تبحث العديد من شركات الأدوية الآن عن بروتينات دقيقة ذات إمكانات طبية.
كيف يمكن أن تكون صغيرة لا يزال غير واضح. تحتاج ذبابة الفاكهة إلى بروتين دقيق يحتوي على 11 من الأحماض الأمينية لينمو كفوفًا طبيعية ، ويمكن لبعض الميكروبات إنتاج بروتينات أقل من عشرة أحماض أمينية. لكن حتى أكبر البروتينات الدقيقة لا تصل إلى بروتينات متوسطة الحجم ، مثل ألفا الأميليز ، وهو إنزيم حمض أميني 496 موجود في لعابنا وينهار النشا.
يرتبط الاكتشاف الأخير لكمية صغيرة من البروتينات الدقيقة بمعيار التعرف على الجينات الذي تم تأسيسه منذ حوالي 20 عامًا. عندما يقوم العلماء بتحليل جينوم الجسم ، فإنهم غالباً ما يقومون بمسح إطارات القراءة المفتوحة (ORFs). من أجل عدم الغرق في كمية هائلة من البيانات ، في الماضي ، استبعد الباحثون عمومًا أي ORS مع بروتين يحتوي على أقل من 100 من الأحماض الأمينية في حقيقيات النوى أو 50 من الأحماض الأمينية في البكتيريا. على سبيل المثال ، في الخميرة ، حصر هذا الشرط قائمة OPCs بحوالي ستة آلاف.
يوضح ضعف هذا المعيار أن الخلايا تحتوي على OPC بشكل ملحوظ. في وقت سابق من هذا العام ، حدد العلماء شظايا جينوم الميكروبات التي تعيش في أربعة أجزاء من الجسم البشري ، بما في ذلك الأمعاء والجلد. عند البحث عن OPCs الصغيرة التي يمكنها تشفير البروتينات من خمسة إلى 50 من الأحماض الأمينية ، وجد الباحثون حوالي أربعة آلاف عائلة من البروتينات الدقيقة المحتملة. ما يقرب من نصفها لا يشبه البروتينات المعروفة ، ولكن تسلسل ORS صغير يشير إلى أن البروتين المقابل يقع في الريبوسومات - وهذا يشير إلى أنه يمكن أن يلعب بعض الدور الأساسي. عندما أغفل العلماء عن OPCs الصغيرة ، لم يتم تفويت الجينات ذات الوظائف النادرة فحسب ، ولكن الجينات ذات الوظائف الأساسية.
تحتوي الخلايا الأخرى أيضًا على عدد كبير من OPCs القصيرة: الخميرة ، على سبيل المثال ، قادرة على إنتاج أكثر من 260 ألف جزيء مع طيف يتراوح من اثنين إلى 99 من الأحماض الأمينية. ولكن من شبه المؤكد أن الخلايا لا تستخدم كل هذه الإضافات ، وقد لا تعمل بعض سلاسل الأحماض الأمينية التي تنتجها.
فايسمان وآخرون. وجدت البروتينات الدقيقة بطريقة أخرى: باستخدام الطريقة التي اخترعوها ، والتي تهدف إلى تحديد أكثر انتشارا لنوع البروتينات التي تنتجها الخلايا. لتكوين أي بروتين ، تقوم الخلية أولاً بنسخ الجين إلى برنامج RNA. ثم قراءة الريبوسومات مرنا وربط الأحماض الأمينية في ترتيب معين. بتسلسل الرنا المرسال المرتبط بالريبوسومات ، يحدد فايسمان وفريقه بدقة أيًا منهم يتحول فعليًا إلى بروتينات ، ومن أين يبدأ الريبوسوم في "القراءة" على الحمض النووي الريبي. في دراسة خلوية أجريت عام 2011 ، طبق عالم مع فريقه طريقة تنميط الريبوسوم هذه ، والتي تسمى أيضًا Ribo-seq ، على الخلايا الجذعية الجنينية بالماوس ووجدت أن الخلايا تنتج الآلاف من البروتينات غير المتوقعة ، بما في ذلك العديد منها حيث سيكون عدد الأحماض الأمينية أقل من عتبة 100 وحدة. يقول فايسمان: "لقد كان واضحًا أن الكون القياسي تجاهل الكون الواسع للبروتينات ، وكان الكثير منها قصيرًا".
اتخذ ساغاتيليان وزملاؤه مقاربة ثالثة للكشف عن وفرة البروتينات الدقيقة في خلايانا. استخدم العلماء تحليل الطيف الكتلي ، حيث يتم تقسيم البروتينات إلى شظايا مرتبة حسب الكتلة ، من أجل تحديد طيف التعرف لكل بروتين. طبق ساغاتيليان وزملاؤه هذه الطريقة على مخاليط البروتينات من الخلايا البشرية ، ثم قاموا بطرح علامات الأنواع المعروفة من البروتينات منها. كشفت هذه الطريقة عن أطياف 86 من البروتينات الصغيرة التي لم تكن معروفة من قبل ، وكان أصغرها 18 من الأحماض الأمينية ، كما لاحظ العلماء في مقال في مجلة Nature Chemical Biology في عام 2013.
حجم صغير يحد من البروتين المحتملة. تتحد البروتينات الكبيرة في أشكال معقدة تهدف إلى تنفيذ وظائف معينة ، على سبيل المثال ، تحفيز التفاعلات الكيميائية. من غير المحتمل أن تشكل البروتينات التي تحتوي على 50 إلى 60 من الأحماض الأمينية مركبات. وبالتالي ، فهي ليست مناسبة لتكوين الإنزيمات أو البروتينات الهيكلية.
ومع ذلك ، صغر حجمها يفتح أيضا بعض الاحتمالات. فهي صغيرة بما يكفي لتتوافق مع زوايا البروتينات الكبيرة التي تعمل كقنوات ومستقبلات. تشترك البروتينات الصغيرة غالبًا في فترات قصيرة من الأحماض الأمينية مع شركائها الأكبر حجمًا ، وبالتالي يمكنها ربط وتغيير نشاط هذه البروتينات. يمكن للبروتينات الدقيقة المربوطة أيضًا أن توجه الجزيئات الكبيرة إلى أماكن جديدة - على سبيل المثال ، من خلال تسهيل تغلغلها في أغشية الخلايا.
بسبب جاذبيتها للبروتينات الكبيرة ، يمكن للبروتينات الأصغر أن تعطي الخلايا طريقة عكسية لتفعيل أو إلغاء تنشيط البروتينات الكبيرة. في دراسة نشرت عام 2016 في مجلة PLOS Genetics ، قام ستيفان ونكل وزملاؤه بتعديل نبات الأرابيدوبسيس وراثياً لإنتاج كمية إضافية من بروتينين صغيرين. تتفتح النباتات عادة في وقت يكون فيه اليوم طويلاً بما فيه الكفاية ، ولكن بعد ولادة كمية زائدة من نوعين من البروتينات الدقيقة ، تأخر الإزهار. أثارت البروتينات الصغيرة هذا التأخير عن طريق منع البروتينات الكبيرة المزهرة المسماة CONSTANS. فهي تربط CONSTANS بالبروتينات المثبطة الأخرى التي تطفئها.
في عام 2016 ، وجد Saghatelyan وزملاؤه أن الخلايا البشرية تنتج بروتينًا يحتوي على 68 من الأحماض الأمينية ، والتي يطلق عليها NoBody. يمكن لهذا البروتين أن يساعد في تدمير جزيئات الحمض النووي الريبي التالفة أو غير الضرورية. يعكس اسم "Nikto" دور هذا البروتين في منع تكوين أجسام معالجة ، مجموعات غامضة في السيتوبلازم ، حيث يمكن أن يحدث تدمير RNA. عندما لا يكون هناك ما يكفي من البروتين ، يتم تشكيل أجسام أكثر عملية ، مما يسرع تدمير الحمض النووي الريبي ويغير الهيكل الداخلي للخلية. "هذا يثبت أن البروتينات الصغيرة يمكن أن يكون لها تأثير كبير داخل الخلية" ، كما يقول العلماء.
تعتمد العضلات على العديد من البروتينات الدقيقة المختلفة. أثناء تطور الجنين ، تندمج خلايا العضلات الفردية في ألياف تؤدي إلى الانكماش. يتحد بروتين الأحماض الأمينية 84 Myomixer مع بروتين أكبر لربط الخلايا ، كما أظهر أولسون وآخرون في عام 2017 في عمله في مجلة Science. وبدون ذلك ، لا يمكن أن تشكل أجنة الماوس عضلات وتكون شبه شفافة.
علاوة على ذلك ، مع تطوره ، يدخل الموريغولين حيز التنفيذ ، مما يساعد على تنظيم نشاط العضلات. عندما تتلقى العضلات حافزا ، يطلق مخزن الخلايا الكالسيوم ، مما يحفز تقلص الأنسجة وإنتاج الطاقة. بعد ذلك ، تبدأ المضخة الأيونية ، وهي بروتين يسمى SERCA ، في إعادة الكالسيوم إلى التخزين ، مما يسمح للأنسجة العضلية بالاسترخاء. يرتبط الميوريغولين بـ SERCA ويمنعه. هذا التأثير يحد من تواتر تقلص العضلات ، وربما يوفر احتياطي للطاقة لحالات الطوارئ ، على سبيل المثال ، عند الفرار من المفترس. بروتين صغير آخر ، هو DWORF ، له تأثير معاكس لتفعيل SERCA وتحفيز تقلص العضلات بشكل منتظم.
حتى الكائنات الحية المدروسة بدقة ، مثل بكتيريا E. coli (Escherichia coli) ، تخفي البروتينات الصغيرة غير المتوقعة التي تلعب دورًا مهمًا. Storz et al. ذكرت في عام 2012 أن بروتين حمض أميني غير معروف سابقًا يدعى AcrZ يساعد هذا الميكروب على البقاء عند تعرضه لأنواع معينة من المضادات الحيوية عن طريق تحفيز مضخة خالية من الأدوية.
السم الذي تنتجه مجموعة متنوعة من الكائنات الحية - بما في ذلك العناكب ، سكولوبندراس والرخويات السامة - تنتشر أيضًا في البروتينات الصغيرة. تعمل العديد من مكونات السم على تجميد أو قتل أو عرقلة قنوات الصوديوم أو أيونات أخرى ضرورية لنقل نبضات الأعصاب. يقول العلماء إن البروتينات الصغيرة "تضرب هذه القنوات الأيونية بدقة مذهلة وقوة". إنها المكونات الرئيسية للسموم ، وترتبط بها معظم الآثار الدوائية والبيولوجية.
على سبيل المثال ، لا تعتمد الحشرات الأسترالية العملاقة التي تتغذى على الأسماك على الفكين الحاد وأجزاء الفم التي تشبه الذروة لهزيمة فرائسها. إنه يقدم لضحاياه جرعة تحتوي على أكثر من 130 بروتين ، منها 15 أقل من 100 من الأحماض الأمينية.
على عكس البروتينات الكبيرة ، مثل الأجسام المضادة ، يمكن للبروتينات الدقيقة التي يتم تناولها من أقراص أو حقن أن تخترق الخلايا وتعديل وظائفها. تم تطوير عقار كابتوبريل ، وهو الأول من فئة الأدوية عالية الضغط والمعروفة باسم مثبط الإنزيم المحول للأنجيوتنسين ، من البروتين الصغير الموجود في سم الحرارة المشتركة ، وهو نوع من أفعى الحفرة السامة. تم اكتشاف هذا الدواء ، الذي تمت الموافقة عليه للبيع في الولايات المتحدة في عام 1981 ، عن طريق الصدفة ، حتى قبل أن يتعرف العلماء على البروتينات الصغيرة كمجموعة منفصلة. حتى الآن ، لم يصل إلى السوق أو في تجارب سريرية سوى عدد قليل من البروتينات الدقيقة.
يحاول الباحثون في مجال السرطان استخدام البروتينات الدقيقة الموجودة في سم العقرب الأصفر ، وهو أمر شائع في إفريقيا والشرق الأوسط. ينجذب هذا الجزيء في ظروف غامضة إلى الأورام. عن طريق إضافته إلى مادة تلوين الفلورسنت ، يتوقع العلماء تسليط الضوء على حدود أورام المخ حتى يتمكن الجراحون من استئصال المناطق المصابة بالسرطان بأمان. إنه يضيء الورم. وبالتالي ، يمكنك رؤية حدودها واكتشاف وجود النقائل. في التجارب السريرية ، يقوم الباحثون الآن بتقييم ما إذا كان جزيء مزدوج سيساعد الجراحين على إزالة أورام المخ لدى الأطفال.
ما زالت أهمية البروتينات الصغيرة التي ستلعبها في الطب غير معروفة ، لكنها قد انقلبت بالفعل على عدد من ادعاءات علماء الأحياء. اكتشف نوربرت هوبنر من مركز ماكس دلبروك للطب الجزيئي في برلين وزملاؤه عشرات البروتينات الدقيقة الجديدة في خلايا القلب البشرية. كشفت المجموعة عن مصدرها غير المتوقع: تسلسلات قصيرة ضمن رنا طويلة غير مشفرة ، أي في نوع كان يعتقد في السابق أنه لا ينتج بروتينات. من خلال تحديد 169 رنا طويلة غير مشفرة ، ربما تقرأها الريبوسوم ، استخدم هوبنر وفريقه أحد أنواع الطيف الكتلي للتأكد من أن أكثر من نصفهم ينتج بروتينات دقيقة في خلايا القلب.
نشرت ورقة أدائهم هذا العام في الخلية.ويمكن أيضا العثور على تسلسل الحمض النووي من البروتينات الصغيرة الأخرى في أماكن غير تقليدية. على سبيل المثال ، بعضها في إطارات القراءة المفتوحة ، OPC ، البروتينات الأكبر. اعتقد العلماء سابقًا أن هذه التسلسلات تساعد في التحكم في إنتاج البروتينات الأكبر حجمًا ، ولكنها نادرًا ما تنتج البروتينات نفسها. تكمن بعض متواليات الترميز للبروتينات الدقيقة المكتشفة حديثًا حتى في الترميز المتسلسل للبروتينات الأخرى الأطول.تقول آن روكساندرا كارفونيس ، عالمة الأحياء التطورية بجامعة بيتسبيرج بولاية بنسلفانيا ، إن هذه المفاجآت الجينية يمكن أن تلقي الضوء على كيفية ظهور جينات جديدة. اعتقد العلماء سابقًا أن معظم الجينات تظهر عندما تتكاثر الجينات الموجودة أو تتصهر ، أو عندما تتبادل الأنواع الحمض النووي. ومع ذلك ، وفقا لكارفونيس ، تشير البروتينات الدقيقة إلى أن البروتينات يمكن أن تتشكل عندما تحدد الطفرات إشارات بدء وإيقاف جديدة في الجزء غير المشفر من الجينوم. إذا أنتج OPC الناتج بروتينًا مفيدًا ، فستبقى التسلسلات الجديدة في الجينوم وتستمر في عملية الانتقاء الطبيعي ، وتتطور أكثر إلى جينات أكبر ترميز بروتينات أكثر تعقيدًا.في دراسة أجريت عام 2012 ، وجد كارفونيس وزملاؤه أن الخميرة تحول أكثر من ألف من أملاح الإماهة الفموية القصيرة إلى بروتينات. وهذا يشير إلى أن هذه التسلسلات هي بروتينات. في دراسة جديدة ، اختبرت Carvounis وفريقها ما إذا كان ORS الشاب يمكن أن يكون مفيدًا للخلايا. لقد غيّروا الخميرة وراثياً من أجل زيادة نتيجة 285 من أملاح الإماهة الفموية المتطورة حديثًا ، ومعظمها يستهدف جزيئات أصغر من البروتينات العادية أو أكثر بقليل من ذلك. في حوالي 10 ٪ من البروتينات ، أدت زيادة مستوياتها إلى تعزيز نمو الخلايا في وسيط واحد على الأقل.يقول A. Saghatelian "البروتينات الدقيقة هي منطقة سريعة النمو". "لكنني أعتقد أن هذه الدراسة التي أجريناها قد أثرت حقًا في الفهم الحالي لتأثير البروتينات الدقيقة على الكيمياء الحيوية وبيولوجيا الخلية."الروابط :تنظيم وظيفة البروتين عن طريق "البروتينات الدقيقة" إنالكون الجديد للبروتينات الدقيقة يرفع بيولوجيا الخلية وعلم الوراثة.تنظيم استجابة الإجهاد لدى ER بواسطة بروتينات دقيقة من الميتوكوندريا