مقدمة
"تراجعت الضباب قبل الفجر على مضض على طول الوديان ، ظهرت سيقان من الجاودار ، متلألئة تحت اكتساح الرياح. تمكنت الطيور بالفعل من الابتهاج في الصباح وتجاذب أطراف الحديث أذنًا مخادعة. سقطت آخر قطرات من النوم في فنجان من القهوة العطرية. إنه لأمر ممتع أن تلتقي بقرص الشمس ، وتمتد المفاصل الفاترة وتتطلع إلى المسافة. من هذا تجمد الفكر عندما انزلق بصره على مسار يمتد من الغابة. ابتسمت ابتسامة عريضة وجهه. من الحركات الأولى تعرف عليها. هي فقط هي التي يمكن أن تتحرك بهذه النعمة ونعمة ظبية. تجمدت اليد في منتصف الطريق إلى الطاولة. استمر في الابتسامة ، فجأة تحول بحدة وتوجه إلى المطبخ. ظهر كوب آخر وصينية التوت على الطاولة. رائحة شراب الخزامى غمرت الشرفة. لقد كان يومًا جيدًا ، حسب ما اعتقد ، إفطارًا ممتعًا - بالتأكيد.
حفنة من التوت اختفت بسرعة من التوت صينية بعد التوت. وقال صوت الأنثى لطيف آخر الأخبار. خلال الأسبوع الماضي ، لم يضعوا صليبًا واحدًا في مقبرة المدينة. لقد نجا! - الزفير من الفرح انفجر من الرئتين التي تم تقصيرها بالفعل مع تقدم العمر. نعم! "أجابت عليه. هذه ربع قرن لعنة. ربع قرن لم يترك رقعة ناعمة واحدة على وجهك.
نظرت إليه بعيونه القصيرة النظر بالفعل ورأيت فيها الخطوط التي لا نهاية لها من الرسوم البيانية للطيف الكتلي ، وشهدت ذلك التعب الذي لا نهاية له والذي لم يتراجع في محاولات لوضعه في صندوق. تعامل ، صمد. لم يعد الناس يخشون حيوانًا رهيبًا من الهلاك ، وربما كان أفظع موت يمكن تخيله ... "
هذه هي بداية قصة رائعة قرأتها في وقت فراغي. وهي تصف نوعًا جديدًا من الأسلحة البيولوجية. مروعة في قوتها المدمرة. ذهل الناس عندما أدركوا مصيرهم. كان الخوف من هذه المحنة غير المرئية والحتمية أسوأ من الموت نفسه.
"سكرابي"بريطانيا العظمى ، النصف الأول من القرن الثامن عشر. الضباب يتبدد على حقول العصير الخضراء. قطيع كبير من الأغنام يتحرك ببطء نحو النهر. فجأة نلاحظ شيئا غير عادي. ما لا يقل عن خمس من الأغنام تدحرجت برفق على طول العشب وتفرك جلدها على الحجارة البارزة فوق سطح الأرض ، تاركة وراءها أجاد فوضويّة. بتمشيط ، فقد شعر الجانب المغطى بالقرح الرهيبة والتآكل. لم يعد بمقدور جزء من الغنم الحكة ، بل ببساطة ببطء ، مع مشية مرتجفة ، وطحن أسنانهم عبر الحقل ، إلى مكان الهدوء الأخير. اعتقد الرعاة أي نوع من سوء الحظ ، واصفين هذا المرض وفقا لمظاهره الرئيسية - SCRAPIE ("الحكة"). لم تنحسر هذه العدوى لعدة قرون ، بين الحين والآخر تظهر هنا وهناك ، تاركة وراءها عائلات مدمرة.
"Mozgoedki"العلماء الحقيقيون ليسوا أشخاصًا عاديين تمامًا ، يتعرفون على سيرهم الذاتية ، وغالبًا ما يدهش المرء مدى جنون برميل الثروة.
سيبدأ أحد خيوط قصتنا بسيرة دانيال كارلتون جيدوزك (1923-2008). تخيل شابًا ، يبلغ من العمر 23 عامًا ، وقد حصل للتو على درجة الماجستير من جامعة هارفارد ، ويذهب بحماس كبير للعمل في جامعة كاليفورنيا التكنولوجية ، وليس مع أي شخص آخر ، ولكن مع لينوس بولينج نفسه (مرتين حائز على جائزة نوبل). بعد ثلاث سنوات ، وافق على الدعوة وتولى منصب باحث في كلية طب الأطفال والأمراض المعدية في والدته الأم. على الرغم من هذه المهنة الناجحة ، لا يسير شيء جيدًا ولا يمنحه السلام. لم يكن يعمل لمدة 3 سنوات ، وهو يلقي كل شيء ويغادر أولاً إلى طهران في معهد باستور ، وبعد ثلاث سنوات ، في خط متعرج غريب عبر هندو كوش ، يجد نفسه في معهد والتر وإليزا هول الطبي في ملبورن. الاختزال ، وليس غير ذلك.
في أستراليا ، قدمت الرعاية الطبية لهم لمصادقة دانييل جيدوسك المشؤومة مع المسؤول الطبي فينسنت زيغاس (1920-1983) ، الذين تفاعلوا عن كثب مع قبائل بابوا غينيا الجديدة. يحكي زيغاس دانيال عن مرض مجهول ، تتجلى أعراضه الغريبة في أمة واحدة - فوريه. Gaidusek يهرع بفارغ الصبر لتعلم لغة السكان الأصليين وبعد بضعة أشهر Zigas يجلب ويمثل Gaidusek من مجموعة فوره العرقية. لمدة عام تقريبًا يعيشون بين قبيلة برية ، ويتتبعون جميع العادات والعادات. مراقبة المرضى وإجراء تشريح الجثث. [1]
إليكم كيف يصفون تسلسل تطور مرض مثير جدًا لهم في مقالتهم:
"... اللامبالاة والإرهاق الساحق يتغلب على الشخص. بعد شهر أو أكثر ، يبدأ الرجيج والارتعاش المميزين. رعاش الأطراف والجذع والرأس يصبح أكثر تميزًا وثباتًا. يفقد الشخص القدرة على الحركة. بين سنة وسنتين ، يحدث الموت. أعضاء من قبيلة Phore يسمون هذا المرض "Kuru" ، وهو ما يعني الارتعاش والفساد. وهم يعتقدون أن السبب يكمن في عين الشامان الشريرة ".
بعد تشريح الجثة ، تبين أن زيغاس وجايدوسك ، اللذين توفيا بسبب المرض ، قد حولا المخ إلى مادة إسفنجية. [2]
سمحت الإقامة الطويلة الأجل داخل القبيلة لـ Haidusek و Zigas باكتشاف سبب المرض. اتضح أن قبيلة فوره تمارس أكل لحوم البشر.
بعد وفاة أحد أقدم أعضاء الجنس ، تم نحت جسده ، وتم فتح صندوق الجمجمة وأكل المخ ، حيث كان يعتقد أن تناول الدماغ هو طقوس من آخر تكريم للمتوفى ، والشخص الذي يأكل الدماغ سوف يكتسب حكمته وشجاعته وغيرها من الصفات النبيلة ، التي يملكها. عادة ، كانت المرأة تأكل معظم المخ ، وبالتالي كان عدد الحالات أعلى منها. [3] مع القضاء على مثل هذه العادة الخبيثة ، هزم مرض كورو بالكامل تقريبًا.
للحصول على وصف لمرض كورو في عام 1976 ، حصل غايدوسيك على جائزة نوبل. وهنا دوافع لجنة نوبل ، التي لفتت انتباه فنسنت زيغاس ، ليست واضحة. في محاضرة نوبل ، تحدث غايدوسيك عن الطبيعة الفيروسية لمرض كورو. نتعلم ما إذا كان محقًا أم لا.

مريض متأثر "بالدجاجة".
"كان لدي وقت"في غضون ذلك ، بسرعة إلى الأمام إلى ألمانيا. بداية القرن العشرين ، عيادة للأمراض النفسية في بريسلاو ، وهي إدارة يقودها ألويس الزهايمر. طبيب سفينة شاب يأتي للعمل ، الذي قرر أن يصبح طبيب أعصاب. بينما يتفهم باستمرار أساسيات المهنة ، فإنه يدير للعثور على مرضى مجهولين حتى الآن. تمت مقاطعة الأبحاث بسبب الحرب العالمية الأولى ، والتي أعادت الدكتور هانز غيرهارد كروتزفيلد إلى البحرية. في عام 1920 فقط ، بعد 6 سنوات ، نشر وصفًا للمرض.
في الوصف ، نجد أن المرضى فقدوا ذاكرتهم بسرعة عالية ، وتوقفوا عن أن يكونوا على علم بأنفسهم ، وتوفوا بعد 8-12 شهرًا من ظهور المظاهر الأولى للصورة السريرية. في تحضيرات الدماغ التي تم الحصول عليها من هؤلاء المرضى ، تم العثور على "بنى إسفنجية" مميزة.
تجدر الإشارة إلى أنه كان محظوظًا بشكل لا يصدق إذا كان متأخراً بستة أشهر ، وأن ريح الزمن كانت ستبدد اسمه لعدة قرون ، ومنذ بضعة أشهر ، عمل ألفونس جاكوب مع وصف للمرض نفسه الذي وجد اسم مكتشفاته - مرض كروتزفيلد جاكوب (CJD).
ما يمكن أن يكون شائع بين scrapie ، كورو و CJK؟ هذا هو السؤال الذي بدأ العلماء في طرحه في الخمسينيات من القرن العشرين ، لأن هذه الأمراض كانت مشابهة لفترة الحضانة الطويلة التي استمرت من 5 إلى 10 سنوات والمصير المحزن الذي لا يتغير للشخص المصاب ، سواء كان حيوانًا أو شخصًا. علاوة على ذلك ، فإن الأضرار تفوقت في المقام الأول على المخ تم استدعاء هذه المجموعة من أمراض التنكس العصبي مع فترة حضانة طويلة.
الجسم الرئيسي
التجارب
مع تطور الأساليب التجريبية للكيمياء الحيوية ، أصبح من الممكن أخيرًا معالجة هذه الأمراض. كان من الصعب للغاية العثور على مصدر العدوى ، شريطة أن لا يمكن الكشف عن مظاهر المرض إلا بعد سنوات ، على الرغم من الصعوبات ، لم تتوقف محاولات اكتشاف أسباب المرض. كانت المختبرات تبحث عن طرق لتبسيط العمل التجريبي ، مما يقلل من فترة الحضانة إلى فترة مقبولة.
لذلك تمكن كل من Patison و Guiley من نقل المرض من الأغنام إلى الأغنام باستخدام مرشحات خالية من الخلايا. لبدء التجارب المعملية ، لم يتبق سوى خطوة واحدة - لنقل المرض من الأغنام إلى حيوان المختبر. يقوم تشاندلر بذلك في عام 1960 ، والذي كتب عنه مقالًا صغيرًا ولكنه مشهور جدًا في عام 1961 [4]. تمكن من إصابة فأر مختبري بمادة من دماغ حيوان مريض. علاوة على ذلك ، في الدراسات الحديثة ، كان مظهر المرض ينتظر 7 أشهر فقط. أصبح من المناسب دراسة المرض في المختبر.
تكثفت عملية البحث عن عامل معدي. لم يكن من الممكن تثبيته لفترة طويلة. في البداية بحثوا عن فيروس غير معروف ، يشبه القوباء أو التهاب الدماغ ، لكنهم لم يعثروا على شيء. كان من المفاجئ لجميع الباحثين أن القدرة على إصابة هذه المادة ، المعزولة من دماغ الحيوانات المريضة ، استمرت بعد تسخين قوي مطول ، وبعد العلاج بأسيتامين إيثيل أمين. أجريت تجارب تمت فيها معالجة المرشح باستخدام الأشعة فوق البنفسجية الصلبة والإشعاعات المؤينة. على الرغم من هذا ، احتفظ المرشح بالقدرة على الإصابة. [5] بدأت الشكوك تزحف في أن الفيروسات في هذه الحالة لا علاقة لها بذلك ، لأن الأحماض النووية (مكون لا غنى عنه في أي فيروس) تنهار ببساطة تحت هذا التأثير.
غريفيث ، في ملاحظة قصيرة على صفحة واحدة ونصف الصفحة من النص في عام 1967 ، أعربت عن فكرة هرطقة - العامل المعدي لا يحتوي على الأحماض النووية. [6] هذا بروتين قادر على التكاثر الذاتي في الخلية. كان مع هذه المذكرة التي بدأت حقبة جديدة.
بروتين معدي
لا تزال تجارب أبحاث السكاي معقدة وطويلة. بعد مرور 15 عامًا فقط ، قام ستانلي بروزينر من جامعة كاليفورنيا في سان فرانسيسكو بتحديد ووصف الوكيل الذي ، في شكله النقي ، يمكن أن يتسبب في الإصابة بمرض سكرابي. اتضح أن هذه المادة المدهشة مقاومة للحرارة ، فهي تحتفظ بعدوى معدية بالعوامل الضارة المختلفة ، مثل: البروتيناز K ، اليوريا ، كلوريد guanidine ، المنظفات ، SDS و nucleases - إنزيمات ضارة بالحمض النووي ، لكنها وجدت أيضًا أن هذا العامل المعدي حساس للأيونات المؤينة الإشعاع في وجود الأكسجين ، الذي هو سمة من البروتينات مسعور وجود تقارب عالية للدهون. [8]
صاغ بروزينر اسم العامل الذي يسبب سكرابي - "PRION" (بريون - جزيء معدي قوي). تم عزل بروتين Prion (Prione Protein PrP) بعد ذلك بقليل. تم بالفعل تطوير طرق التسلسل في ذلك الوقت بشكل جيد للغاية وسرعان ما جعل من الممكن إنشاء تسلسل PRP الأساسي. بدأ الجميع في البحث عن مصدر PrP. حير مقال نشر عام 1985 في مجلة Nature ، والذي وضع علامة على نهاية البحث ، العديد من الباحثين: تم العثور على messenger RNA (جزيء - وهو قالب يتم به توليف البروتينات) اللازم لتركيب PRP في دماغ سليم. [7]
هذا يعني شيئًا واحدًا فقط - البروتين المسؤول عن تطور المرض موجود دائمًا في الدماغ ، بغض النظر عن تطور المرض. اكتشف لاحقًا أن ترميز الجينات PrP موجود في جميع الثدييات ، وكذلك في الطيور والأسماك.
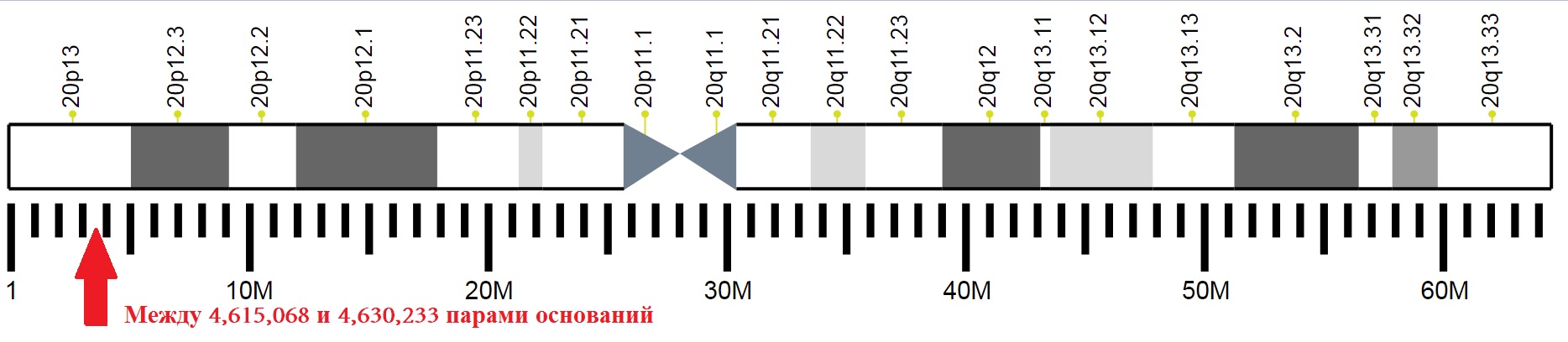
موقع المقاطع الفردية للكروموسوم العشرين لشخص يحمل علامة على موقع الجين الذي يشفر PrPC.
هيكل البروتين
ما هو هذا البروتين المدهش؟ لم يتم توضيح وظيفتها وبعد 37 سنة من لحظة الاكتشاف (تجدر الإشارة هنا إلى النموذج الغربي لعلوم المنح). من المعروف أن هذا البروتين مرتبط بغشاء الخلية. وربما مسؤولة عن التفاعلات بين الخلايا في الدماغ.
لفهم كيف يصبح البروتين العادي معديا ، تحتاج إلى إلقاء نظرة على بنية البروتينات. الهيكل الأساسي للبروتين هو تسلسل بقايا الأحماض الأمينية. هذا التسلسل هو نفسه في PRPC العادي وفي شكل العدوى من PRPSc.
تم العثور على الاختلافات على مستوى الهيكل المكاني الثانوي والثالث. في PrPC ، يتم تمثيل الهيكل الثانوي بنسبة 42 ٪ من حلزونات ألفا و 3 ٪ من هياكل β ، بينما يحتوي PRPSc في نفس الوقت على 30 ٪ من حلزونات ألفا و 43 ٪ من هياكل β. تشير هذه الحقيقة إلى أن الشكل المرضي للبروتين يتشكل عند طي غير مناسب لتسلسل الأحماض الأمينية إلى طبقات مطوية.
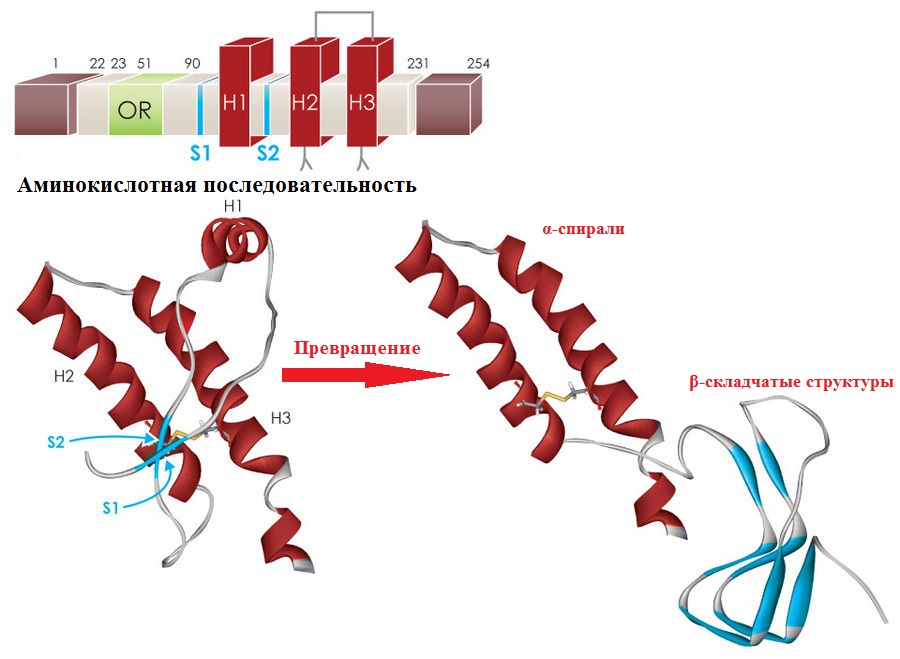
في الصورة أعلاه ، تسلسل الأحماض الأمينية لـ PrP ، مع مناطق بارزة من هياكل بروتينية مختلفة من H1 ، H2 ، P3 - α. ويرد أدناه تحول اللوالب إلى طبقات مطوية β. الصورة: بقلم أوليفيا ماي ، دكتوراه
فرضية بريون
استنادا إلى البيانات المتراكمة في عام 1991 ، تشكل Pruziner فرضية Prion ، التي تفترض ما يلي:
- العامل المعدي هو بروتين PrPSc ،
- يمكن للعامل المعدي PrPSc أن يكرر نفسه في حالة عدم وجود حمض نووي ،
- يحدث تحويل البروتين من الشكل العادي (PrPC) إلى العدوى (PrPSc) من خلال الانتقال التطابقي ،
- يمكن أن يحدث الانتقال المطابق لـ PrPC إلى PrPSc تلقائيًا ، مما يؤدي إلى أشكال متفرقة من أمراض البريون. يمكن أن يكون سبب ابتلاع الشكل المرضي ل PrPSc من الخارج (الأشكال المكتسبة من أمراض البريون) ،
- قد يحدث الانتقال بسبب طفرات في جين Prnp التي تساهم في تكوين PrPSc من PrPC (الأشكال الوراثية لأمراض البريون). [9،10].
وبالتالي ، يمكن أن تسبب أمراض البريون خللًا وراثيًا أو عدوى خارجية أو مزيجًا منها.
على الرغم من الهجمات الشديدة من جانب منتقدي هذه النظرية ، يتفق الجميع تقريبًا الآن على أن بروزينر كان على حق ، وهناك قدر كبير من الأدلة التجريبية على ذلك. على سبيل المثال ، إذا تخيلنا أن تكاثر PrPSc بعد الابتلاع يحدث من خلال نقل التشكل المرضي إلى PrPC ، فإن الكائنات التي تفتقر إلى PrPC يجب أن تكون مقاومة لعدوى البريون. تم إجراء مثل هذه التجربة باستخدام الفئران المتجانسة المعدلة وراثيا لحذف الجين Prnp (Prnp0 / 0). لم يؤد إدخال أنسجة المخ المفرطة من الفئران المريضة بمرض سكرابي إلى الفئران المعدلة وراثيا Prnp0 / 0 إلى تطور المرض بسبب عدم وجود PRP الطبيعي. علاوة على ذلك ، اتضح أنه في حالة عدم وجود PrPC ليس فقط تكاثر البريون ، ولكن أيضًا حدوث تلف للأنسجة العصبية.
منذ فترة طويلة تم كبح الإثبات النهائي لمفهوم البريونات بسبب استحالة الحصول على كمية كبيرة من PrPres ، وهو شكل من أشكال PrPSc في المختبر مقاوم لتحلل البروتينات الجزئي ويمكن أن يسبب المرض عند تناوله للحيوانات التجريبية. في الآونة الأخيرة ، تبيَّن أن جزءًا من فصيلة البروبيلين المؤتلف توليفها في أشكال الإشريكية القولونية في الألياف المختبرية ، والتي ، عند إدخالها في الفئران المعدلة وراثياً التي تعبر عن جزء البروبيلين نفسه ، تؤدي إلى تطور مرض البريون. [13]
في الآونة الأخيرة ، تم تطوير نظام من التضخيم دوري لشكل بريون من البروتين ، مما يساعد على تشكيل كمية كبيرة من PrPres (النسخة المرضية الاصطناعية من بريون) في المختبر. هذا جعل من الممكن الحصول على وإظهار العدوى من بريون توليفها بشكل مصطنع.
سوف يلاحظ القارئ اليقظ أن البريونات المتكونة في دماغ الأغنام من غير المرجح أن تكون مسببة للأمراض للبشر. وسوف تكون على حق تقريبا. من المعروف أن انتقال العدوى بريون بين أنواع الثدييات يقتصر على الحواجز بين الأنواع. على سبيل المثال ، ينتقل مرض كروتزفيلد جاكوب من شخص لآخر ومن البشر إلى الشمبانزي ؛ ينتقل سكرابي بين الأغنام والماعز ، ولكن لا ينتقل إلى الشمبانزي. في الوقت نفسه ، الحواجز بين الأنواع ليست مطلقة. لا يمكن التعبير عن الحواجز ذات النوعية المحددة في استحالة نقل العدوى إلى الحيوانات من الأنواع البعيدة ، ولكن في إطالة فترة الحضانة ، وكذلك في حقيقة أن ليس كل ، ولكن جزء من الحيوانات المصابة تجريبياً قد مرضت. يُعتقد أن الحواجز متعددة الأنواع ناتجة عن الاختلافات في البنية الأساسية لـ PRP والتعديلات في الثدييات من الأنواع المختلفة. وهذا ما أكدته الملاحظات التالية. وكانت الفئران المعدلة وراثيا التي تعبر عن PRP الهامستر حساسة للغاية للعدوى من قبل بريون الهامستر ، على عكس الفئران من النوع البري. انتقال العدوى من شخص إلى آخر لمرض كروتزفيلد جاكوب محدود بسبب الحاجز المتعدد الأنواع ، لكن الفئران المعدلة وراثيا التي تعبر عن PRP البشري عرضة للإصابة.
لا تزال هناك صعوبات في إصابة الحيوانات ببروتين البريون النقي. هذه الصعوبات يمكن تفسيرها بسهولة.
السبب الأول هو أنه في خلايا كائن عادي ، تخضع البروتينات لتعديل ما بعد متعدية ، والتي يصعب إعادة إنتاجها في ظل ظروف تجريبية.
السبب الثاني هو أن البريون عبارة عن بروتين غشائي وينبغي افتراض أن تركيبته أكثر ثباتًا في ظروف البيئة الشبيهة بالغشاء ، كما أظهرت الدراسات الحديثة.
وقد تبين لهم أن البريونات في وجود الكوليسترول والفوسفاتيديل إيثانولامين شكلت الشكل الممرض بسهولة أكبر وكان لديها عدوى أكبر بكثير.
بريون - أسلحة بيولوجية
على هذا واحد يمكن أن ينتهي الحديث عن البريونات مخيفة. ومع ذلك ، سوف يسأل القارئ بشكل شرعي: "وماذا عن الأسلحة البيولوجية؟" بعد كل شيء ، لكي تحدث العدوى ، من الضروري أن يدخل جزيء بريون الممرض إلى الدماغ. لن نقوم بعمل حج القحف لأنفسنا ".
في الواقع ، تبين أن الوضع مع وجود طرق محتملة للعدوى أسوأ بكثير مما قد يتصور المرء.
في عام 1974 ، تم وصف الحالة الأولى من مرض علاجي المنشأ (بسبب التعرض الخارجي) لمرض كروتزفيلد جاكوب ، والذي يُعتبر عادةً أمراضًا وراثية.هناك أوصاف لثلاث حالات لانتقال CJD كنتيجة لنقل الدم من متبرع تم تشخيصه بـ CJD أثناء تفشي المرض في المملكة المتحدة [28]. ماذا جاء هذا الفاشية من ... كالمعتاد بسبب الجشع. وقد تطور CJD في البشر بعد تناول لحوم البقر المصابة بريونات.في عام 1986 ، تفشى وباء مرض البريون في الأبقار في بريطانيا العظمى ، والذي يُطلق عليه أيضًا "مرض جنون البقر" ، مما أدى إلى وفاة أكثر من 160،000 رأس من الماشية [29]. وكان السبب في ذلك هو استخدام المكملات الغذائية الخاصة بلحوم اللحم والعظام ، وذلك بسبب سوء التحكم في معالجة المنتجات الثانوية الحيوانية ، وسقوط PRPSc من الأغنام المصابة بمرض السكرابي وغيرها من الماشية في علف البقر. عادة ، تشتمل تكنولوجيا إنتاج الدقيق بعد الطحن الدقيق للمواد الأولية على معالجة بمذيبات الدهون النشطة ، وكذلك المعالجة الحرارية عند درجة حرارة 130 درجة مئوية. ومع ذلك ، في أواخر سبعينيات القرن العشرين ، بعد أن قرر رواد الأعمال زيادة القيمة الغذائية للحوم والعظام ، قللوا من وضع المعالجة الحرارية إلى 110 درجة مئوية ، كما قللوا أيضًا من كمية المواد المستخلصة من الدهون.هذه التغييرات هي التي ساهمت في ظهور وتطور الوباء بين الماشية.وقد ثبت أن الوباء في الأبقار أدى إلى ظهور نوع جديد من CJD ، يسمى "CJD البديل" [15]. تم الإبلاغ عن الحالات الأولى لمرض التهاب الكبد الوبائي في عام 1995 ، عندما تم تشخيص المرض لدى مراهقين بريطانيين [16.17]. نظرًا لطول فترة الحضانة ، لم يتم تأسيس الصلة بين المرض واللحوم المصابة في المملكة المتحدة حتى تطورت حالات الأبقار إلى وباء. تم السيطرة على الوباء بعد ذبح كبير للماشية والتغيرات في تكنولوجيا الإنتاج التي قللت بشكل كبير من تلوث اللحوم بمكونات الأنسجة العصبية. في المملكة المتحدة ، يتناقص باطراد العدد السنوي للحالات الجديدة للـ cBD ، التي بلغت ذروتها في عام 2000 ، وتم تأكيد حالة واحدة فقط في عام 2013 [18].في جميع المرضى ، وضعت CJD بعد تناول اللحوم التي تم الحصول عليها من الماشية المريضة. لكن على الرغم من انتشار الوباء الذي أصاب مئات الآلاف من الماشية ، فإن عددًا قليلًا نسبيًا من الأشخاص الذين أكلوا اللحوم من الحيوانات المريضة طوروا CJD [33]. (تذكر الحاجز بين الأنواع).كانت فترة الحضانة (الفترة بين تناول لحم البقر المصاب ومظهر الأعراض) طويلة: كان معظم المرضى مصابين في أواخر الثمانينيات ، وحدثت ذروة الإصابة في أوائل عام 2000 ، أي كانت فترة الحضانة 11-12 عامًا. في آخر الحالات التي تم تشخيصها ، وصلت فترة الحضانة من 12 إلى أكثر من 20 عامًا [18.19].المظاهر السريرية لمتغير CJD تختلف عن الأشكال الأخرى من CJD. هذا المرض يصيب الشباب الذين تتراوح أعمارهم بين 30 عامًا ، وتتميز بداية ظهوره بتغيرات في الشخصية: المريض يفقد اهتماماته القديمة ، ويبتعد عن الأشخاص المقربين ، ويصاب بالقلق ، والأرق ، والاكتئاب. تحدث اضطرابات الحركة بعد حوالي ستة أشهر من ظهور المرض. الخرف يحدث في وقت لاحق مما هو عليه في الشكل الكلاسيكي ، والمريض يدرك حالته المتدهورة. بسرعة كبيرة ، يفقد القدرة على الخدمة الذاتية. ليس فقط بداية في سن أصغر ، ولكن أيضا متوسط البقاء على قيد الحياة تتجاوز 14 شهرا هي نموذجية ل cJDV [18،19]. من المحتمل أن تكون الاختلافات في البقاء على قيد الحياة بين CJD الكلاسيكية ومتغيرها مرتبطة جزئيًا بصغر سن المرضى.لذلك ، فقد أظهرت لنا الطبيعة نفسها إمكانية استخدام البريونات كأسلحة مع تأخر وقت التعرض.مما يبعث على أسفي العميق ، في عام 2011 أثناء العمل التجريبي على دراسة مرض كروتزفيلد جاكوب ، تم عرض إمكانية الإصابة المحمولة جواً بالهباء الجوي المحتوي على جزيئات بريون في الفئران.هل البريونات سلاح بيولوجي مثالي؟
ما هي المزايا الرئيسية:- المرض يتجلى في فترة متأخرة ، والمهاجم لديه الوقت لعدوى أكبر عدد ممكن من الناس. في هذه الحالة ، سيكون كل من حولك في جهل تام.
- يمكنك إيقاف العدوى ، بهدوء عند بدء تشغيله. العثور على آثار ومصدر العدوى بعد 5-7 سنوات سيكون من الصعب للغاية. علاوة على ذلك ، سوف تحتاج إلى معرفة ما الذي تبحث عنه.
- . ,
- .
- , . . , .
- .
- . , [9]
البريونات هي التكنولوجيا المثالية للإرهاب. هناك تقنية موصوفة جيدًا لتخليق الأشكال الممرضة لبروتينات البريون [13].حتى لو كان من الصعب على إرهابي عادي تنظيم مختبر للكيمياء الحيوية ، فلا أحد يزعج استخدام عدد لا يحصى من قطعان الحيوانات للحصول على كمية كبيرة من مادة الدماغ المصابة بـ CJD.لن يمنع أي شخص ولا شيء الإرهابيين من بدء التوليف الشامل لبروتينات البريون وإضافتها إلى مسحوق الحليب أو حليب الأطفال أو اللحم المفروم أو اللحم أو فضلات العظام أو وجبة فول الصويا أو أي مادة أخرى يكون مصنع إنتاجها في متناولهم.إذا تخيلنا أن عالِمًا كيميائيًا موهوبًا سوف يقع في أيدي الإرهابيين بالقوة أو لأسباب مالية وأيديولوجية وغيرها ، فلن يمنعه أحد من تصنيع هباء بروتين شحمي به جزيئات بريون. ثم رش الهباء الجوي غير القابل للكشف في أنظمة التهوية. هذه الطريقة أكثر فظاعة من تناولها ، لأن العقدة البلعومية الأنفية لها صلة وثيقة بالمخ ويزيد احتمال الإصابة به مرات عديدة.تخيل آثار العدوى. بعد 3-7 ، أو ربما كل 15 عامًا في منطقة غير محدودة ، يبدأ التطور الشامل لمرض بريون في الدماغ. الذعر والرعب والخوف والدمار. مدن كاملة من الناس هي الزومبي ، الذي يتحول دماغه حرفيًا إلى إسفنجة. لا يوجد علاج ، لا أمل ، فقط رعب الموت الوشيك المحتوم.استنتاج
استخدام هذه الأسلحة هو مجرد مسألة وقت. لذلك ، تحتاج الآن إلى اتخاذ عدد من الخطوات:- إجراء البحوث على إنشاء أنظمة موثوقة للكشف عن البريونات المرضية في الغذاء والماء والهواء وجعل هذا الاختبار إلزاميًا للاستخدام في جميع أنحاء العالم. إدخال أنظمة الكشف عن بروتين بريون.
- للحصول على إمكانية تشخيص ظهور البريونات المرضية في البشر. هناك أخبار جيدة بأنه تم تطوير طريقة حساسة للغاية للكشف عن البريونات المرضية. [12]
- ابحث عن طريقة لعلاج الشخص. الأمر الذي يبدو صعباً بشكل لا يصدق ، على الرغم من التقدم الواعد بالأجسام المضادة المضادة للبريون التي يمكنها عبور حاجز الدم في الدماغ.
- تتبع حالات الكتلة من أمراض البريون في الحيوانات على مستوى الخدمات الخاصة.
رغبة السنة الجديدة
لا أتمنى أبدًا مقابلة جزيء PrPSC واحد!سأبحث عن فرصة للحصول على اختبار تشخيصي شديد الحساسية - نظام لتحديد ما إذا كنا قد تمكنا بالفعل من إصابة لنا ...مراجع إلى المصادر1.
www.nobelprize.org/prizes/medicine/1976/gajdusek/biographical2. Gajdusek, DC; Zigas, V. (1957-11-14). «Degenerative Disease of the Central Nervous System in New Guinea». New England Journal of Medicine. 257 (20): 974–978.
3. Hussain Khan, CG Bio-medical Paradigm // Bio-social issues in health. General editor, RK Pathak. New Delhi: Northern Book Centre, 2008. — p. 15
4. Chandler RL (1961) Lancet, 1,1378–1379
5. Alper T., Cramp WA, Haig DA, and Clarke MC (1967) Nature, 214, 764–766.
6. Griffith JS (1967) Nature, 215,1043–1044.
7. Chesebro B., Race R., Wehrly K., Nishio J., Bloom M., Lechner D., Bergstrom S., Robbins K., Mayer L., Keith JM, et al. (1985) Nature,315, 331–333.
8. Prusiner SB (1982) Science, 216,136–144
9. Prusiner SB (1991) Science, 252,1515–1522
10. Prusiner SB (1993) Proc. Natl. Acad. Sci. USA Vol. 90, pp. 10962-10966, December 1993 Biochemistry
11. Saima Zafar et al., Handbook of Clinical Neurology, Vol. 165, 2019 (3rd series)
12. Serena Singh, Mari L. DeMarco JALM, January 2020
13. Nature Communications (2018) Chae Kim, Xiangzhu Xiao, Shugui Chen, Tracy Haldiman, Vitautas Smirnovas, Diane Kofskey, Miriam Warren, Krystyna Surewicz, Nicholas R. Maurer, Qingzhong Kong, Witold Surewicz & Jiri G. Safar Artificial strain of human prions created in vitro volume 9, Article number: 2166
14. Llewelyn CA, Hewitt PE, Knight RS, Amar K, Cousens S, Mackenzie J, Will RG. Possible transmission of variant Creutzfeldta Jakob disease by blood transfusion. Lancet. 2004;363:417-421.
15. Collinge J. Human prion diseases and bovine spongiform encephalopathy (BSE). Hum Mol Genet. 1997;6(10):1699-1705
16. Bateman D, Hilton D, Love S, Zeidler M, Beck J, Collinge J. Sporadic Creutzfeldt Jakob disease in a 18-year-old in the UK. Lancet. 1995; 346(8983):1155-1156.
17. Britton TC, al-Sarraj S, Shaw C, Campbell T, Collinge J. Sporadic Creutzfeldt—Jakob disease in a 16-year-old in the UK. Lancet. 1995; 346(8983): 1155.
18. Soomro S, Mohan Ch. Biomarkers for sporadic Creutzfeldt Jakob disease. Annals of Clinical and Translational Neurology. 2016;3(6):465-472.
19. Imran M, Mahmood S. An overview of human prion diseases. Virol J. 2011;8:559.