Fragen Sie Ethan Nr. 36: Ein erstaunlich rotierendes Elektron
Der Leser fragt:Als ich Ihre Antwort über Laser las, erinnerte ich mich an meine alte Frage zum Pauli-Prinzip. So wie ich es verstehe, sollten für zwei Elektronen in einem Wasserstoffmolekül die Spins entgegengesetzt sein. Bedeutet dies, dass Elektronen während der Bildung eines Moleküls ihren Spin ändern oder können nur Elektronen mit entgegengesetzten Spins ein Molekül bilden?
Dazu gibt es viel zu sagen. Beginnen wir also mit dem Prinzip von Paulis Verbot.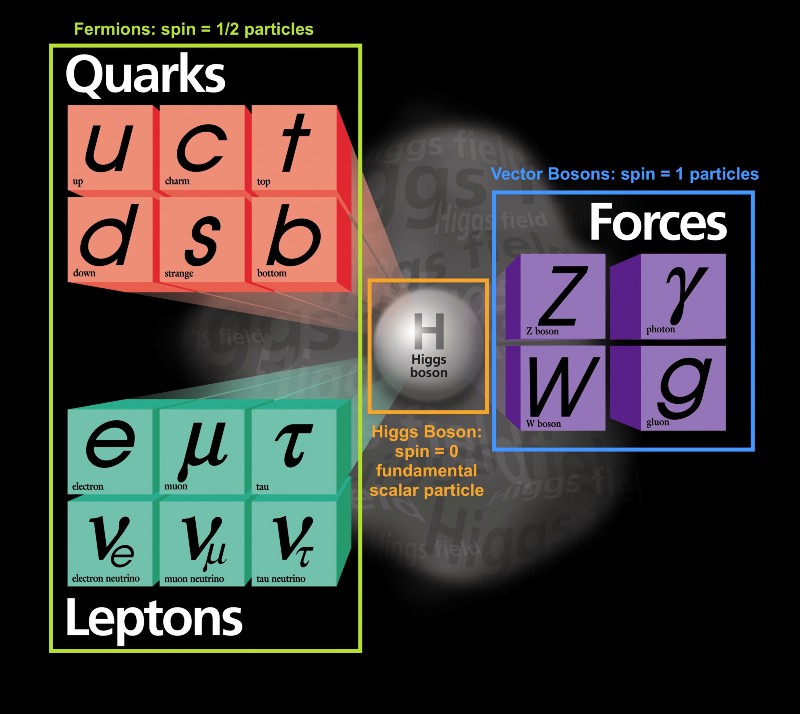 Trotz der Vielzahl verschiedener Arten von Elementarteilchen, die im Universum existieren, können sie alle in zwei Arten unterteilt werden:
Trotz der Vielzahl verschiedener Arten von Elementarteilchen, die im Universum existieren, können sie alle in zwei Arten unterteilt werden:- Fermionen sind Teilchen mit einem halben ganzzahligen Spin: ± 1/2, ± 3/2, ± 5/2, ..
- Bosonen sind Teilchen mit einem ganzen Spin: 0, ± 1, ± 2, ..
Interessanterweise verhalten sich Kompositpartikel auch entweder als Fermionen oder als Bosonen. Protonen und Neutronen verhalten sich wie Fermionen mit Spins ± 1/2 wie Elektronen. Jedes Teilchen hat eine Reihe von Quantenzuständen, die es einnehmen kann, mit diskreten Energieniveaus, Drehimpulsen, Spinrichtungen usw.Der Hauptunterschied zwischen Fermionen und Bosonen besteht darin, dass Sie, wenn Sie zwei identische Teilchen haben, dort so viele Bosonen im gleichen Quantenzustand senden können, aber identische Fermionen nicht denselben Zustand einnehmen können.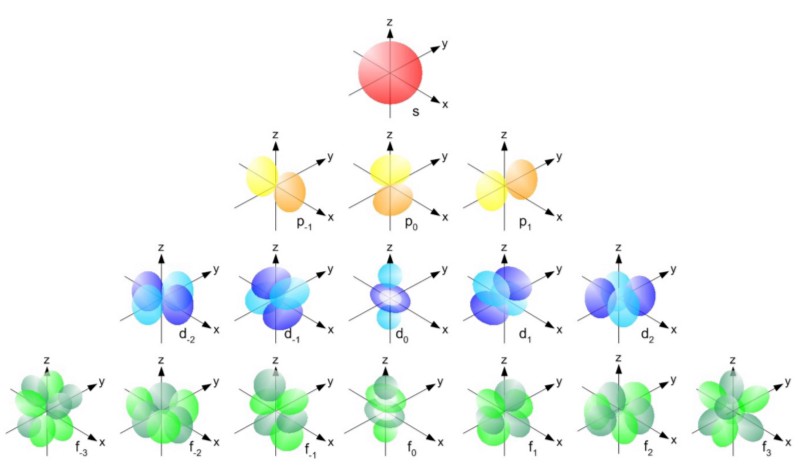 Wenn das Elektron keine Fermion, sondern ein Boson wäre, könnte jedes Atom in ein Atom mit niedrigerem Energieniveau (oben rot) eingepfercht werden. Aber ein Elektron ist eine Fermion, also gehorcht es dem Verbotsprinzip. Zwei Elektronen können das minimale Energieniveau annehmen, da sie Spins +1/2 und -1/2 haben können. Um jedoch ein drittes Elektron hinzuzufügen, müssen Sie in einen anderen Quantenzustand springen.Quantenzustände in Atomen sind so angeordnet, dass Sie zu einem höheren Energieniveau (n im Bild unten) und dann zu Zuständen mit einem höheren Drehimpuls (l) gelangen können.
Wenn das Elektron keine Fermion, sondern ein Boson wäre, könnte jedes Atom in ein Atom mit niedrigerem Energieniveau (oben rot) eingepfercht werden. Aber ein Elektron ist eine Fermion, also gehorcht es dem Verbotsprinzip. Zwei Elektronen können das minimale Energieniveau annehmen, da sie Spins +1/2 und -1/2 haben können. Um jedoch ein drittes Elektron hinzuzufügen, müssen Sie in einen anderen Quantenzustand springen.Quantenzustände in Atomen sind so angeordnet, dass Sie zu einem höheren Energieniveau (n im Bild unten) und dann zu Zuständen mit einem höheren Drehimpuls (l) gelangen können.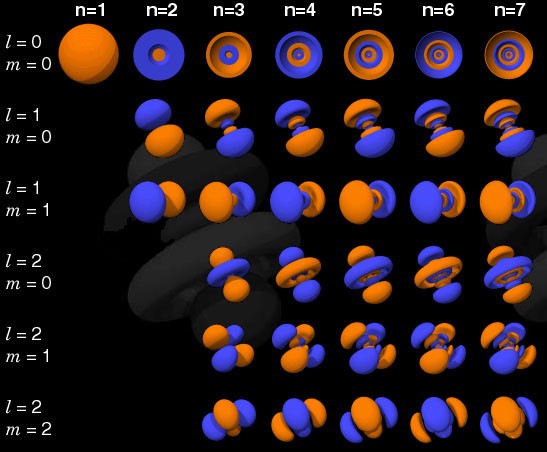 Daher sind die Zustände l = 0 s-Orbitale, l = 1 p-Orbitale, l = 2 d-Orbitale und so weiter. Daher hat das Periodensystem genau eine solche Struktur: mit zwei Elementen in der oberen Reihe (n = 1, l = 0, m = 0 und Spin = ± 1/2), 8 Elementen in der zweiten Reihe (n = 2, l = 0, m = 0 und Spin = ± 1/2 und n = 2, l = 1, m = 1,0 oder -1 und Spin = ± 1/2), 18 Elemente in der dritten Reihe usw.
Daher sind die Zustände l = 0 s-Orbitale, l = 1 p-Orbitale, l = 2 d-Orbitale und so weiter. Daher hat das Periodensystem genau eine solche Struktur: mit zwei Elementen in der oberen Reihe (n = 1, l = 0, m = 0 und Spin = ± 1/2), 8 Elementen in der zweiten Reihe (n = 2, l = 0, m = 0 und Spin = ± 1/2 und n = 2, l = 1, m = 1,0 oder -1 und Spin = ± 1/2), 18 Elemente in der dritten Reihe usw.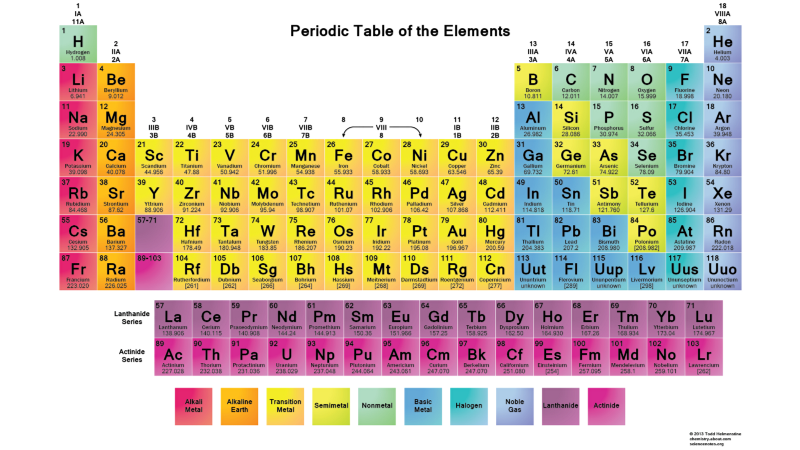 Fügen Sie daher zusätzliche 6, 10, 14 usw. hinzu. Vorkommen mit jeder neuen Zeile der Tabelle sind auf das Pauli-Prinzip zurückzuführen.Und obwohl wir ein Elektron nicht von einem anderen unterscheiden können, ist jedes Atomsystem einzigartig, da sie identisch sind. Mit anderen Worten, wenn Sie vier verschiedene Wasserstoffatome im Grundzustand haben, müssen diese keine unterschiedlichen Energieniveaus einnehmen.
Fügen Sie daher zusätzliche 6, 10, 14 usw. hinzu. Vorkommen mit jeder neuen Zeile der Tabelle sind auf das Pauli-Prinzip zurückzuführen.Und obwohl wir ein Elektron nicht von einem anderen unterscheiden können, ist jedes Atomsystem einzigartig, da sie identisch sind. Mit anderen Worten, wenn Sie vier verschiedene Wasserstoffatome im Grundzustand haben, müssen diese keine unterschiedlichen Energieniveaus einnehmen. Da Atomkerne (Protonen) sich voneinander unterscheiden (sich nicht im selben Kern befinden oder sich in irgendeiner Weise in überlappenden Quantenzuständen befinden) und Elektronen an ihr Proton gebunden sind (dh sie befinden sich nicht in überlappenden Quantenzuständen miteinander), Ein System aus freien Wasserstoffatomen ist höchstwahrscheinlich so organisiert, dass sie sich alle in einem Grundzustand befinden, etwa so:
Da Atomkerne (Protonen) sich voneinander unterscheiden (sich nicht im selben Kern befinden oder sich in irgendeiner Weise in überlappenden Quantenzuständen befinden) und Elektronen an ihr Proton gebunden sind (dh sie befinden sich nicht in überlappenden Quantenzuständen miteinander), Ein System aus freien Wasserstoffatomen ist höchstwahrscheinlich so organisiert, dass sie sich alle in einem Grundzustand befinden, etwa so: Zumindest ist es ratsam, Ihr System zunächst so einzurichten. Wenn jedoch ein Paar solcher Atome miteinander interagiert, vereinigen sie sich und bilden ein Wasserstoffmolekül. So wie ein Wasserstoffatom im Grundzustand aufgrund der Bindungsenergie etwas leichter (13,6 eV) als ein freies Proton und ein freies Elektron ist, ist ein Wasserstoffmolekül etwas leichter (4,52 eV) als zwei freie Wasserstoffatome .Aber die Frage wurde richtig gestellt. Wenn zwei verschiedene Atome versuchen, sich wieder zu verbinden, versuchen sich die Wellenfunktionen der Elektronen zu überlappen.
Zumindest ist es ratsam, Ihr System zunächst so einzurichten. Wenn jedoch ein Paar solcher Atome miteinander interagiert, vereinigen sie sich und bilden ein Wasserstoffmolekül. So wie ein Wasserstoffatom im Grundzustand aufgrund der Bindungsenergie etwas leichter (13,6 eV) als ein freies Proton und ein freies Elektron ist, ist ein Wasserstoffmolekül etwas leichter (4,52 eV) als zwei freie Wasserstoffatome .Aber die Frage wurde richtig gestellt. Wenn zwei verschiedene Atome versuchen, sich wieder zu verbinden, versuchen sich die Wellenfunktionen der Elektronen zu überlappen.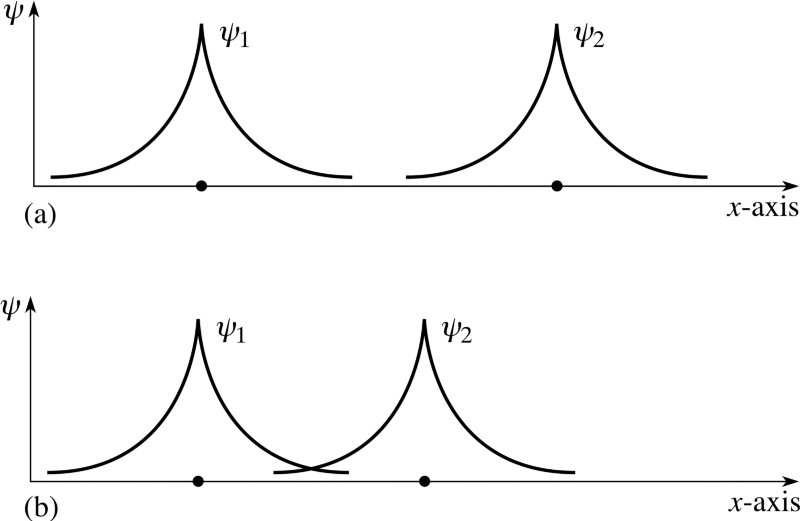 Elektronen haben aber nicht nur Spin, sondern auch räumliche Wellenfunktionen. Dies bedeutet, dass sie auf besondere Weise Platz einnehmen. Wenn ich zwei Wasserstoffatome zusammenbringe, können ihre räumlichen Wellenfunktionen wie im obigen Diagramm symmetrisch oder wie im folgenden Diagramm antisymmetrisch sein.
Elektronen haben aber nicht nur Spin, sondern auch räumliche Wellenfunktionen. Dies bedeutet, dass sie auf besondere Weise Platz einnehmen. Wenn ich zwei Wasserstoffatome zusammenbringe, können ihre räumlichen Wellenfunktionen wie im obigen Diagramm symmetrisch oder wie im folgenden Diagramm antisymmetrisch sein.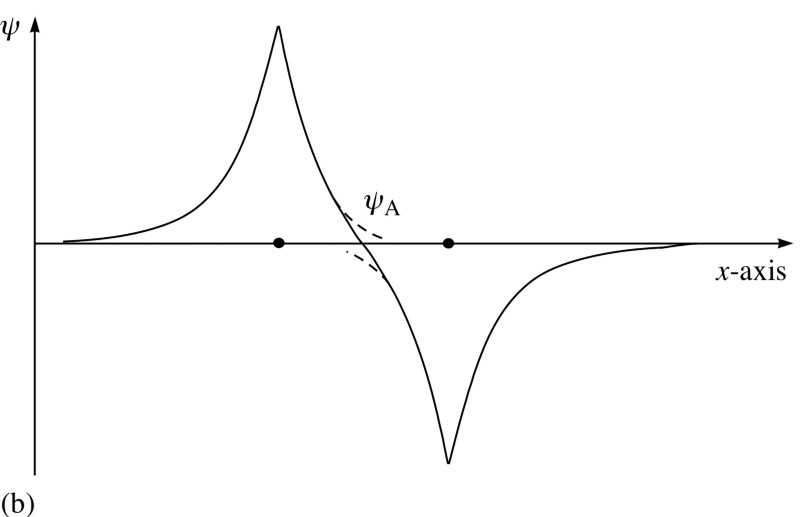 Und hier tritt das Pauli-Prinzip in Kraft.Wenn sich Wasserstoffatome symmetrischen Wellenfunktionen nähern, müssen die Spins der Elektronen antidirektional sein - wenn einer einen Spin von +1/2 hat, hat der zweite einen Spin von -1/2 und umgekehrt.Und wenn sich zwei Atome mit antisymmetrischen Wellenfunktionen nähern, sollten die Spins der Elektronen ausgerichtet sein: Wenn das erste +1/2 ist, sollte das zweite ebenfalls +1/2 haben und umgekehrt.Daher können Wasserstoffatome auf zwei Arten verbunden werden - entweder mit symmetrischen Wellenfunktionen und antidirektionalen Spins oder umgekehrt.
Und hier tritt das Pauli-Prinzip in Kraft.Wenn sich Wasserstoffatome symmetrischen Wellenfunktionen nähern, müssen die Spins der Elektronen antidirektional sein - wenn einer einen Spin von +1/2 hat, hat der zweite einen Spin von -1/2 und umgekehrt.Und wenn sich zwei Atome mit antisymmetrischen Wellenfunktionen nähern, sollten die Spins der Elektronen ausgerichtet sein: Wenn das erste +1/2 ist, sollte das zweite ebenfalls +1/2 haben und umgekehrt.Daher können Wasserstoffatome auf zwei Arten verbunden werden - entweder mit symmetrischen Wellenfunktionen und antidirektionalen Spins oder umgekehrt.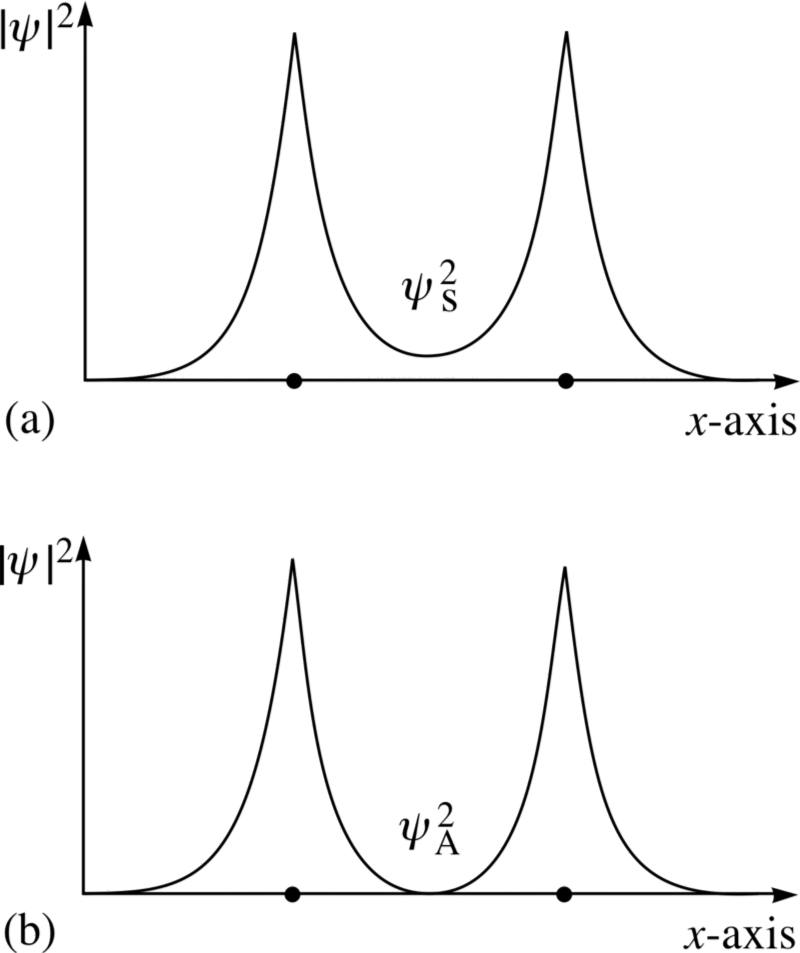 Schauen Sie sich diese beiden Kombinationen an: Oben überlappen sich die Wellenfunktionen, was eine Verbindung bedeutet, und unten überlappen sie sich nicht, was darauf hinweist, dass dieser Zustand nicht verbunden ist.Wir können berechnen, wie hoch die Bindungsenergie für diese beiden Zustände sein wird.
Schauen Sie sich diese beiden Kombinationen an: Oben überlappen sich die Wellenfunktionen, was eine Verbindung bedeutet, und unten überlappen sie sich nicht, was darauf hinweist, dass dieser Zustand nicht verbunden ist.Wir können berechnen, wie hoch die Bindungsenergie für diese beiden Zustände sein wird.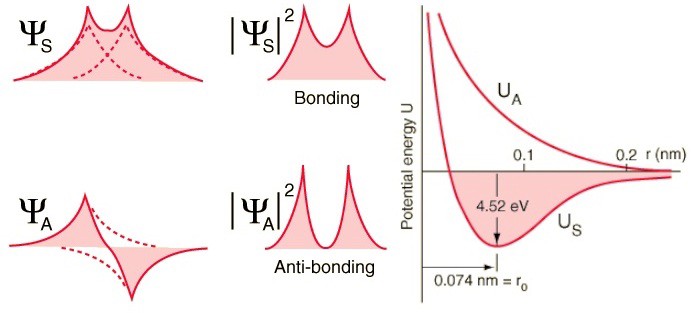 In einem antisymmetrischen Zustand, in dem die Spins der Elektronen ausgerichtet sind, bilden sich keine Atome. Nur in einem symmetrischen Zustand, in dem die räumlichen Wellenfunktionen symmetrisch und die Spins entgegengesetzt gerichtet sind, kann sich ein Wasserstoffmolekül bilden.Um ein Molekül zu bilden, benötigen Sie daher zwei Wasserstoffatome mit symmetrischen räumlichen Wellenfunktionen und multidirektionalen Spins (+1/2 und -1/2). Außerdem können Sie sehen, wie die Quantenmechanik es Ihnen verbietet, ein drittes Wasserstoffatom hineinzuschieben - daher können Sie ein H-Atom, ein H2-Molekül, aber niemals H3 herstellen.
In einem antisymmetrischen Zustand, in dem die Spins der Elektronen ausgerichtet sind, bilden sich keine Atome. Nur in einem symmetrischen Zustand, in dem die räumlichen Wellenfunktionen symmetrisch und die Spins entgegengesetzt gerichtet sind, kann sich ein Wasserstoffmolekül bilden.Um ein Molekül zu bilden, benötigen Sie daher zwei Wasserstoffatome mit symmetrischen räumlichen Wellenfunktionen und multidirektionalen Spins (+1/2 und -1/2). Außerdem können Sie sehen, wie die Quantenmechanik es Ihnen verbietet, ein drittes Wasserstoffatom hineinzuschieben - daher können Sie ein H-Atom, ein H2-Molekül, aber niemals H3 herstellen.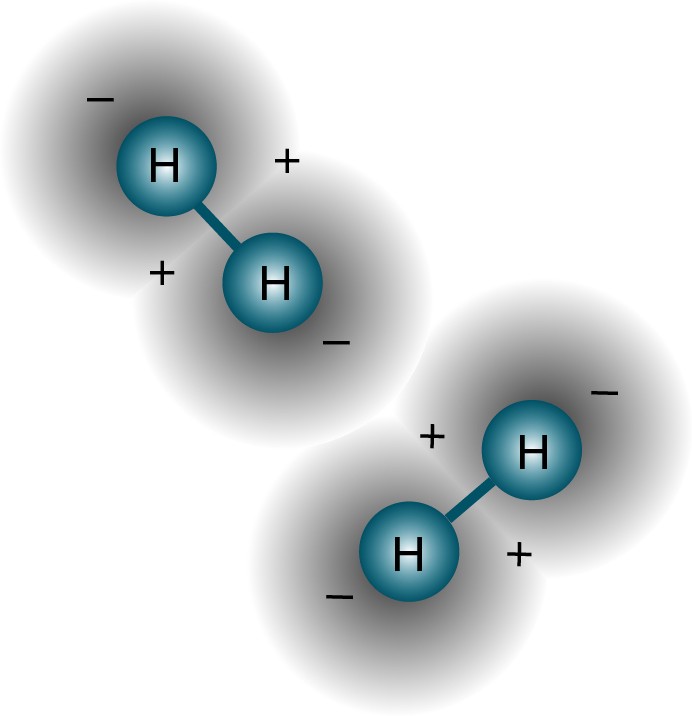
Source: https://habr.com/ru/post/de386011/
All Articles