Ist es möglich, eine essbare Energiequelle oder das Funktionsprinzip einer abiotischen Brennstoffzelle herzustellen? Teil 1: Theorie
Im Internet gibt es viele Anweisungen, wie man aus Zitronen usw. „essbare“ Batterien herstellt. Die Essbarkeit solcher Vorrichtungen ist jedoch fraglich, da die Elektroden in der Regel Metallplatten (normalerweise Zink und Kupfer) sind und nur der Elektrolyt, dessen Rolle Zitrone ist, essbar ist. Kürzlich habe ich mich gefragt, ob es möglich ist, eine vollständig essbare Batterie zu erstellen.Ich werde gleich erklären, dass die Batterie nicht aus biokompatiblen, sondern aus essbaren Komponenten bestehen sollte. Natürlich wäre es einfach, aus Aktivkohle einen essbaren Superkondensator herzustellen , aber wie Sie wissen, ist der Energieverbrauch von Superkondensatoren im Vergleich zu Batterien sehr gering.Die Hauptschwierigkeit einer solchen Idee besteht darin, geeignete Elektroden / Stromkollektoren zu finden. Erstens ist es notwendig, dass das essbare Material eine gute Leitfähigkeit besitzt, und zweitens kann es an elektrochemischen Reaktionen teilnehmen. Und das erste, was Ihnen in den Sinn kommt, wenn Sie an essbare Leiter denken, sind die Lebensmittelfarbstoffe E174 und E175, sie sind auch Lebensmittelgold und -silber. Aber in welchen elektrochemischen Reaktionen können diese Materialien verwendet werden, wenn sie in einer elektrochemischen Reihe von Spannungen nahe beieinander liegen? Aber hier müssen wir uns daran erinnern, dass Gold und Silber eine elektrokatalytische Aktivität haben. Wo werden Katalysatoren in elektrochemischen Stromversorgungen eingesetzt? In Brennstoffzellen!Wie funktioniert eine Brennstoffzelle? Wie andere elektrochemische Energiequellen haben Brennstoffzellen zwei Elektroden, die in einen Elektrolyten eingetaucht sind. Im Gegensatz zu Batterien und Superkondensatoren sind diese Elektroden jedoch keine aktiven Materialien, sondern Katalysatoren, bei denen die Oxidation von "Kraftstoff", der von außen zugeführt wird, und die Reduktion des Oxidationsmittels stattfinden. Beispielsweise ist im klassischen Beispiel einer Wasserstoffbrennstoffzelle der Brennstoff Wasserstoff und das Oxidationsmittel Sauerstoff. Im Vergleich zu anderen elektrochemischen Energiequellen, beispielsweise Batterien und Superkondensatoren, sind Brennstoffzellen übrigens am energieintensivsten, da sie arbeiten, während die Elektroden mit Reagenzien versorgt werden. Ihr Nachteil ist jedoch die geringe Leistung, die durch die Geschwindigkeit der elektrochemischen Reaktionen und die Geschwindigkeit der Zufuhr von Brennstoff und Oxidationsmittel zu den Elektroden begrenzt ist.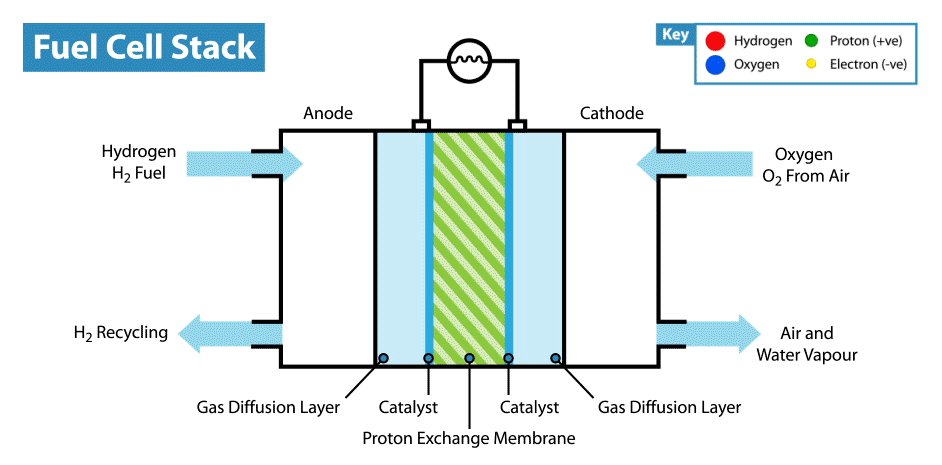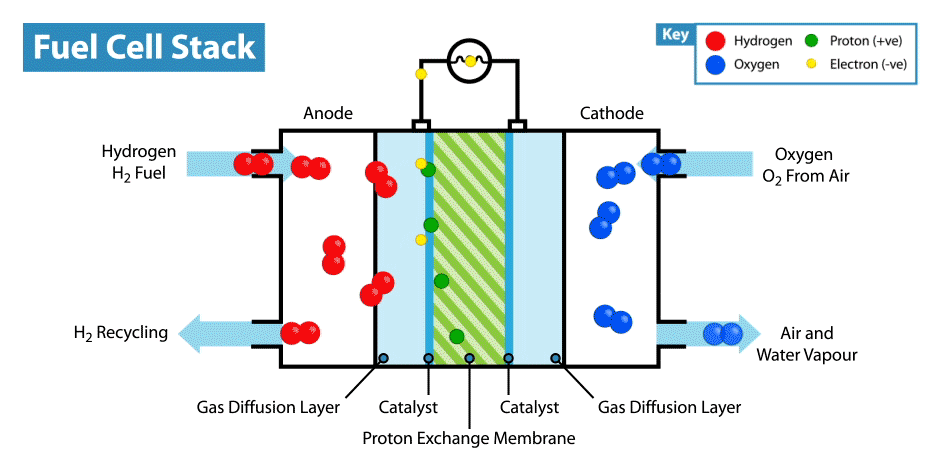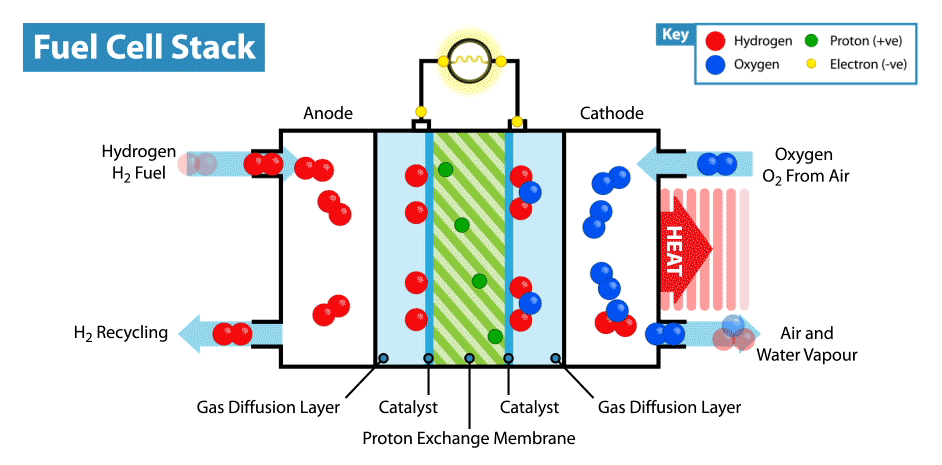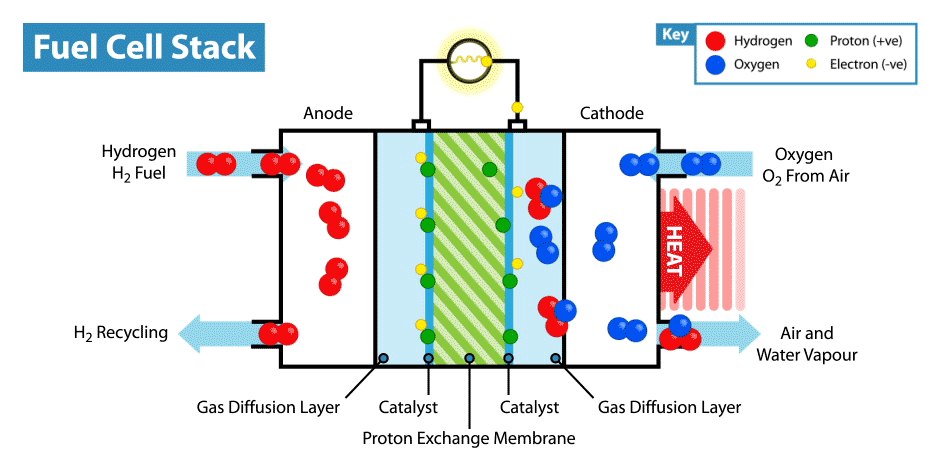

Source: https://habr.com/ru/post/de398091/
All Articles