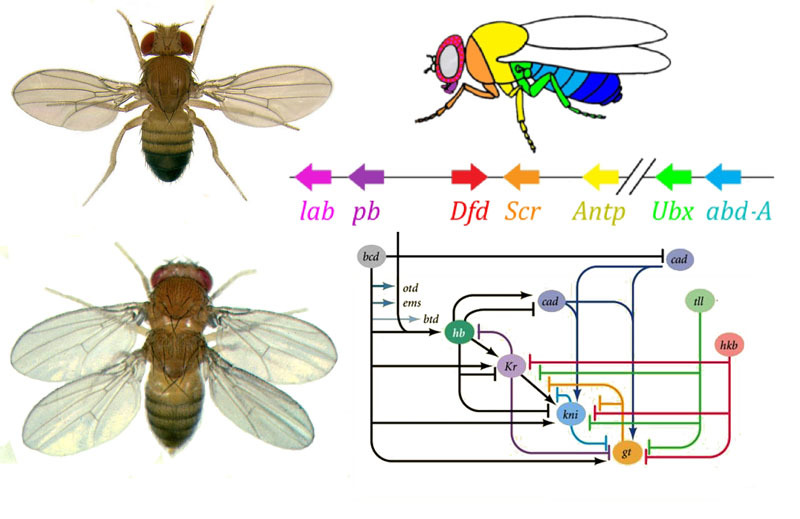
 Wie kann man aus einem Ei ein Ei in eine Larve und dann in eine erwachsene Fliege verwandeln? Eine Fliege besteht wie andere Insekten aus Segmenten. Segmente werden in drei Gruppen zusammengefasst - Kopf, Brust und Bauch. Ein Segment kann ein Paar Gliedmaßen haben. In der Brust befinden sich drei Segmente mit jeweils zwei Beinen. Das zweite Brustsegment hat ebenfalls Flügel und das dritte - den Laufkäfer (kleine Schwanzflügel, ohne Lupe fast unsichtbar). Der Bauch besteht aus acht Segmenten, auf denen sich keine Gliedmaßen befinden. Anfangs gab es sechs Segmente im Kopf, aber während der Entwicklung der Insekten wurden die Grenzen zwischen ihnen vollständig aufgehoben. Ihre Glieder sind Antennen, mit denen die Fliege schnüffelt und fühlt, und drei Paar Mundglieder. Für einen Käfer oder eine Kakerlake wären es Mandibeln, Oberkiefer und die Unterlippe, während sie für eine Fliege alle in den Rüssel übergehen.Damit alle Organe vorhanden sind, muss jede Zelle wissen, wo sie sich im Embryo befindet. In den frühen Stadien der Embryonalentwicklung, in denen sich noch keine Organe befinden und alle Zellen gleich aussehen, erscheint daher ein biochemisches „Koordinatengitter“ mit der anteroposterioren, dorsoabdominalen und links-rechts-Achse. Mutationen der Gene, die das Koordinatengitter bilden, können das Aussehen des Tieres einfach und schnell ändern - Organe an einen anderen Ort bringen, ihre Anzahl ändern und so weiter. Daher sind solche Gene für die Evolution von Tieren wichtig und werden sehr aktiv untersucht. Das Gennetzwerk zur Markierung des Embryos einer Drosophila-Fliege, dem Lieblingsspielzeug der Genetiker, ist vielleicht das am besten untersuchte unter den Gen-Netzwerken von Tieren.Der Algorithmus zum Markieren eines Eies entlang der anteroposterioren Achse ist grundsätzlich einfach:1) Bestimmen Sie, welches Ende des Eies der Kopf und welcher Schwanz sein wird.2) Teilen Sie den Embryo entlang der anteroposterioren Achse in 17 Segmente.3) Teilen Sie jedes Segment in die vordere, mittlere und hintere4) Markieren Sie den Kopf (6 Segmente), den Brustkorb (3 Segmente) und den Bauch (8 Segmente).5) Markieren Sie die individuellen Unterschiede der Segmente. DasGen-Netzwerk, das sich damit befasst, verfügt über ein modulares Gerät. Jedes Modul führt seinen eigenen Schritt des allgemeinen Algorithmus aus. Die Drosophila-Fliege erwies sich als ein sehr praktisches Objekt zur Untersuchung von Genentwicklungsnetzwerken, da sie sehr helle und aufdeckende erbliche Deformitäten aufweist. Zum Beispiel werden Antennapedia Mutation in dem die Antennen in die Beine oder transformiert
Wie kann man aus einem Ei ein Ei in eine Larve und dann in eine erwachsene Fliege verwandeln? Eine Fliege besteht wie andere Insekten aus Segmenten. Segmente werden in drei Gruppen zusammengefasst - Kopf, Brust und Bauch. Ein Segment kann ein Paar Gliedmaßen haben. In der Brust befinden sich drei Segmente mit jeweils zwei Beinen. Das zweite Brustsegment hat ebenfalls Flügel und das dritte - den Laufkäfer (kleine Schwanzflügel, ohne Lupe fast unsichtbar). Der Bauch besteht aus acht Segmenten, auf denen sich keine Gliedmaßen befinden. Anfangs gab es sechs Segmente im Kopf, aber während der Entwicklung der Insekten wurden die Grenzen zwischen ihnen vollständig aufgehoben. Ihre Glieder sind Antennen, mit denen die Fliege schnüffelt und fühlt, und drei Paar Mundglieder. Für einen Käfer oder eine Kakerlake wären es Mandibeln, Oberkiefer und die Unterlippe, während sie für eine Fliege alle in den Rüssel übergehen.Damit alle Organe vorhanden sind, muss jede Zelle wissen, wo sie sich im Embryo befindet. In den frühen Stadien der Embryonalentwicklung, in denen sich noch keine Organe befinden und alle Zellen gleich aussehen, erscheint daher ein biochemisches „Koordinatengitter“ mit der anteroposterioren, dorsoabdominalen und links-rechts-Achse. Mutationen der Gene, die das Koordinatengitter bilden, können das Aussehen des Tieres einfach und schnell ändern - Organe an einen anderen Ort bringen, ihre Anzahl ändern und so weiter. Daher sind solche Gene für die Evolution von Tieren wichtig und werden sehr aktiv untersucht. Das Gennetzwerk zur Markierung des Embryos einer Drosophila-Fliege, dem Lieblingsspielzeug der Genetiker, ist vielleicht das am besten untersuchte unter den Gen-Netzwerken von Tieren.Der Algorithmus zum Markieren eines Eies entlang der anteroposterioren Achse ist grundsätzlich einfach:1) Bestimmen Sie, welches Ende des Eies der Kopf und welcher Schwanz sein wird.2) Teilen Sie den Embryo entlang der anteroposterioren Achse in 17 Segmente.3) Teilen Sie jedes Segment in die vordere, mittlere und hintere4) Markieren Sie den Kopf (6 Segmente), den Brustkorb (3 Segmente) und den Bauch (8 Segmente).5) Markieren Sie die individuellen Unterschiede der Segmente. DasGen-Netzwerk, das sich damit befasst, verfügt über ein modulares Gerät. Jedes Modul führt seinen eigenen Schritt des allgemeinen Algorithmus aus. Die Drosophila-Fliege erwies sich als ein sehr praktisches Objekt zur Untersuchung von Genentwicklungsnetzwerken, da sie sehr helle und aufdeckende erbliche Deformitäten aufweist. Zum Beispiel werden Antennapedia Mutation in dem die Antennen in die Beine oder transformiert VROTMNENOGIproboscipedia, wenn sich ein Teil der Rüssel in Beine verwandelt. Die Bithorax-Mutation ergibt eine vierflügelige Fliege, die zusätzlich zu den üblichen Flügeln im zweiten Brustsegment ein zweites Flügelpaar im dritten Brustsegment aufweist.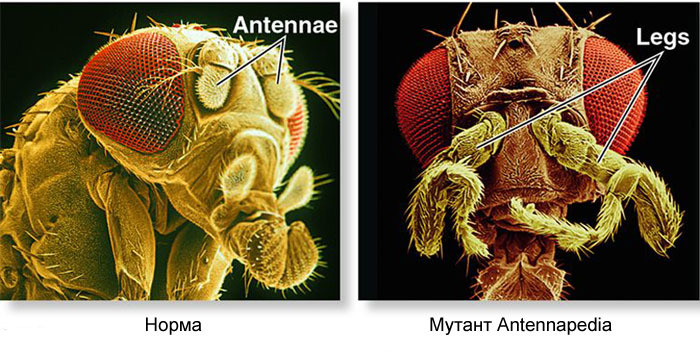
 Solche Mutationen, bei denen ein Körperteil einem anderen sehr ähnlich wird, werden als "Homöose" bezeichnet. Ausgehend von diesen Mutanten entschlüsselte die Genetik schließlich das gesamte Netzwerk von Genen, die die Entwicklung der Fliege steuern. Diese Arbeit wurde 1995 mit dem Nobelpreis ausgezeichnet.Alles beginnt mit den Eipolaritätsgenen - Bicoid und Nanos. Sie wirken bereits vor der Befruchtung des Eies, während es im Eierstock der Mutterfliege reift. Hilfszellen, die Nährstoffe in das Ei pumpen, befinden sich auf einer Seite des Eies, sodass das Ei von Anfang an zwei verschiedene Enden hat. Matrix-Bicoid-RNA sammelt sich am vorderen Ende des Eies an, wo sie anhaftet und nicht wegschwimmen kann. nanos mRNA ist ebenfalls am hinteren Ende fixiert. Nach der Befruchtung beginnen die Proteine mit diesen mRNAs zu synthetisieren. Ihre Moleküle verteilen sich im Ei. Da die Synthese von Bicoid- und Nanos-Proteinen an einem Ende des Eies stattfindet und überall zerfällt, nimmt ein Bicoid-Proteingradient ab, der vom vorderen Ende des Embryos zum hinteren Ende und der Nanos-Gradient vom hinteren zum vorderen Ende abnimmt.
Solche Mutationen, bei denen ein Körperteil einem anderen sehr ähnlich wird, werden als "Homöose" bezeichnet. Ausgehend von diesen Mutanten entschlüsselte die Genetik schließlich das gesamte Netzwerk von Genen, die die Entwicklung der Fliege steuern. Diese Arbeit wurde 1995 mit dem Nobelpreis ausgezeichnet.Alles beginnt mit den Eipolaritätsgenen - Bicoid und Nanos. Sie wirken bereits vor der Befruchtung des Eies, während es im Eierstock der Mutterfliege reift. Hilfszellen, die Nährstoffe in das Ei pumpen, befinden sich auf einer Seite des Eies, sodass das Ei von Anfang an zwei verschiedene Enden hat. Matrix-Bicoid-RNA sammelt sich am vorderen Ende des Eies an, wo sie anhaftet und nicht wegschwimmen kann. nanos mRNA ist ebenfalls am hinteren Ende fixiert. Nach der Befruchtung beginnen die Proteine mit diesen mRNAs zu synthetisieren. Ihre Moleküle verteilen sich im Ei. Da die Synthese von Bicoid- und Nanos-Proteinen an einem Ende des Eies stattfindet und überall zerfällt, nimmt ein Bicoid-Proteingradient ab, der vom vorderen Ende des Embryos zum hinteren Ende und der Nanos-Gradient vom hinteren zum vorderen Ende abnimmt.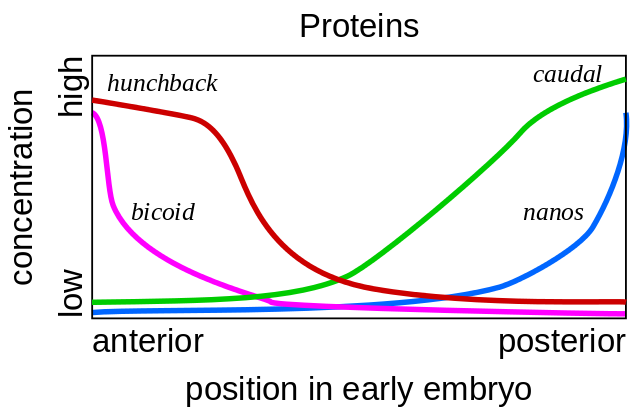 Wenn eine bicoidale mRNA mit einer Mikropipette an einer anderen Stelle im Ei eingeführt wird, wächst dort ein zweiter Kopf. Wenn die bicoidale mRNA künstlich ausgeschaltet wird, wird ein Embryo ohne Kopf und mit zwei Eseln erhalten.Ferner umfassen die Bicoid- und Nanos-Proteine die Gene des Embryos selbst, d. H. Eine neue mRNA beginnt, von ihnen gelesen zu werden. Die Gap-Gene sind die ersten, die anfangen zu arbeiten, von der englischen Lücke, der Lücke. Die ersten beiden Gene dieser Gruppe - Buckel und Schwanz - bilden Gradienten von Kopf zu Schwanz (Buckel) und von Schwanz zu Kopf (Schwanz). Ihre Gradienten sind jedoch weicher als die von Bicoid und Nanos.
Wenn eine bicoidale mRNA mit einer Mikropipette an einer anderen Stelle im Ei eingeführt wird, wächst dort ein zweiter Kopf. Wenn die bicoidale mRNA künstlich ausgeschaltet wird, wird ein Embryo ohne Kopf und mit zwei Eseln erhalten.Ferner umfassen die Bicoid- und Nanos-Proteine die Gene des Embryos selbst, d. H. Eine neue mRNA beginnt, von ihnen gelesen zu werden. Die Gap-Gene sind die ersten, die anfangen zu arbeiten, von der englischen Lücke, der Lücke. Die ersten beiden Gene dieser Gruppe - Buckel und Schwanz - bilden Gradienten von Kopf zu Schwanz (Buckel) und von Schwanz zu Kopf (Schwanz). Ihre Gradienten sind jedoch weicher als die von Bicoid und Nanos.Warum werden Gene so seltsam genannt?. . , hunchback — «», tailless — «», kruppel - — «», bithorax – « ». Sonic hedgehog , .
Die verbleibenden vier Gene der Lückengruppe bilden jeweils eine oder zwei breite (mehr als ein Segment) Banden mit ziemlich klaren Grenzen. Sie werden von Proteinprodukten höherer Gene (Bicoid, Nanos, Buckel und Caudal) eingebaut. Ein vollständiges Herunterfahren eines der Gene dieser Gruppe ergibt einen verkürzten Embryo, dem mehrere Segmente fehlen, in denen dieses Gen normalerweise funktioniert.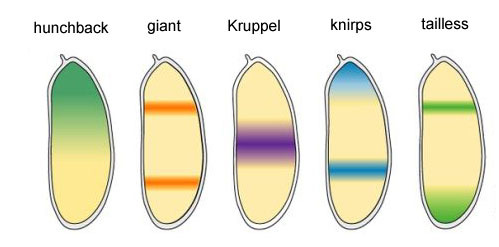 Aktivitätsbereiche der Gap-Block-GeneWarum stellt sich heraus, dass die vier Gap-Block-Gene (Kruppel, Riese, Knirps und Schwanzlos) den Embryo in Banden unterteilen, in denen jeweils eines der vier Gene funktioniert?Erstens unterdrücken sie alle die Aktivität des anderen. In einer einzelnen Zelle wäre ein Zustand stabil, in dem ein Gen aus einer solchen Gruppe aktiv arbeitet und alle anderen unterdrückt (Auslöser). Das sich entwickelnde Fliegenei ist jedoch komplexer. In diesem Moment schweben Tausende einzelner Zellkerne in der gesamten intrazellulären Flüssigkeit (Zytoplasma). Die Größe des Eies ist groß genug, so dass die Zerfallsrate von regulatorischen Proteinen mit ihrer Diffusionsrate zum anderen Ende des Eies vergleichbar ist. Mit einer Kombination aus Diffusion und gegenseitiger Unterdrückung tritt ein weiterer stabiler Zustand auf, wenn das Ei in mehrere Banden unterteilt wird, in denen jeweils ein Gen aus der Gruppe wirkt. Je langsamer die Diffusion von Proteinen oder je schneller der Abbau ist, desto kleiner sind diese Streifen oder Flecken.Die Beteiligung solcher Systeme (sie werden als Reaktionsdiffusion bezeichnet) an der Markierung des Tierkörpers wurde 1952 von Alan Turing (ja, der die "Turing-Maschine" erfunden hat) vorhergesagt. Zu dieser Zeit war wenig über Gene und Proteine bekannt, aber die Gleichungen, die gestreifte und gefleckte Strukturen beschreiben, wurden von Turing korrekt abgeleitet.Hier oder hier können Sie mit einem einfachen Reaktions-Diffusions-Modell zweier Substanzen spielen und fühlen, wie es sich verhalten kann.
Aktivitätsbereiche der Gap-Block-GeneWarum stellt sich heraus, dass die vier Gap-Block-Gene (Kruppel, Riese, Knirps und Schwanzlos) den Embryo in Banden unterteilen, in denen jeweils eines der vier Gene funktioniert?Erstens unterdrücken sie alle die Aktivität des anderen. In einer einzelnen Zelle wäre ein Zustand stabil, in dem ein Gen aus einer solchen Gruppe aktiv arbeitet und alle anderen unterdrückt (Auslöser). Das sich entwickelnde Fliegenei ist jedoch komplexer. In diesem Moment schweben Tausende einzelner Zellkerne in der gesamten intrazellulären Flüssigkeit (Zytoplasma). Die Größe des Eies ist groß genug, so dass die Zerfallsrate von regulatorischen Proteinen mit ihrer Diffusionsrate zum anderen Ende des Eies vergleichbar ist. Mit einer Kombination aus Diffusion und gegenseitiger Unterdrückung tritt ein weiterer stabiler Zustand auf, wenn das Ei in mehrere Banden unterteilt wird, in denen jeweils ein Gen aus der Gruppe wirkt. Je langsamer die Diffusion von Proteinen oder je schneller der Abbau ist, desto kleiner sind diese Streifen oder Flecken.Die Beteiligung solcher Systeme (sie werden als Reaktionsdiffusion bezeichnet) an der Markierung des Tierkörpers wurde 1952 von Alan Turing (ja, der die "Turing-Maschine" erfunden hat) vorhergesagt. Zu dieser Zeit war wenig über Gene und Proteine bekannt, aber die Gleichungen, die gestreifte und gefleckte Strukturen beschreiben, wurden von Turing korrekt abgeleitet.Hier oder hier können Sie mit einem einfachen Reaktions-Diffusions-Modell zweier Substanzen spielen und fühlen, wie es sich verhalten kann.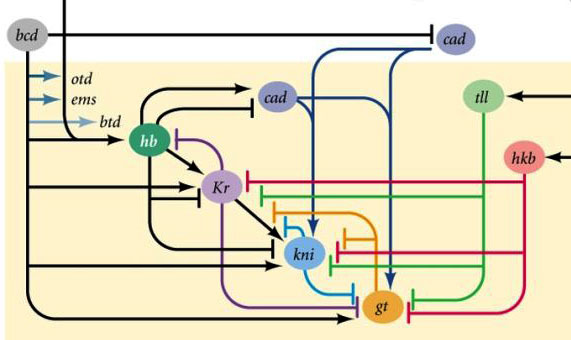 Verbindungen zwischen Gap-Genen und Eipolaritätsgenen. Bcd - bicoid, hb - bucklig, cad - kaudal, Kr - Kruppel, kni - knirps, gt - riesig, tll - schwanzlos.Die Unterdrückung der Gene des anderen allein markiert den Embryo in einige Streifen, aber die Position der Aktivitätsbanden der vier Gene relativ zueinander und den Enden des Embryos ist sehr variabel. Damit die Streifen immer an Ort und Stelle sind (zum Beispiel für Knirps - ein Streifen im Kopf, der andere in der hinteren Hälfte zwischen den Kruppel- und Riesenstreifen), benötigen wir ein zweites Steuersignal - Gradienten von Bicoid- und anderen Eipolaritätsproteinen. Die Eingabefunktionen der Gap-Gene für diese Regulatoren haben Maxima auf verschiedenen Pegeln des Eingangssignals (eine solche Eingabefunktion haben wir am Ende des zweiten Artikels abgeleitet ). Daher werden Gap-Gene jeweils durch ihren Gehalt an Bicoid-, Buckel- und Caudalproteinen aktiviert, und ihre Aktivitätszonen befinden sich auf natürliche Weise vom Kopf bis zum Schwanz des Embryos.Nachdem die Gap-Gene den Embryo grob in 7 Banden markiert haben (sie stimmen weder mit den Segmenten noch mit dem Kopf-Brust-Bauch überein), wird das nächste Modul aktiviert - Paarregel („Paarregelregeln“). Es unterteilt den Embryo bereits in Segmente, die 17 sein sollten. Das Paarregelmodul besteht aus fünf Genen, und alle unterdrücken sich, wie Sie vielleicht vermutet haben, gegenseitig. Jedes dieser Gene arbeitet entweder in allen geraden oder in allen ungeraden Segmenten - die von ihnen codierten Proteine werden schneller abgebaut als die Proteine der Gap-Gruppe, und die Streifen sind schmaler. Das Ausschalten eines Teils der Gene dieser Gruppe ergibt einen verkürzten Embryo, in dem alle geraden oder alle ungeraden Segmente verschwinden.
Verbindungen zwischen Gap-Genen und Eipolaritätsgenen. Bcd - bicoid, hb - bucklig, cad - kaudal, Kr - Kruppel, kni - knirps, gt - riesig, tll - schwanzlos.Die Unterdrückung der Gene des anderen allein markiert den Embryo in einige Streifen, aber die Position der Aktivitätsbanden der vier Gene relativ zueinander und den Enden des Embryos ist sehr variabel. Damit die Streifen immer an Ort und Stelle sind (zum Beispiel für Knirps - ein Streifen im Kopf, der andere in der hinteren Hälfte zwischen den Kruppel- und Riesenstreifen), benötigen wir ein zweites Steuersignal - Gradienten von Bicoid- und anderen Eipolaritätsproteinen. Die Eingabefunktionen der Gap-Gene für diese Regulatoren haben Maxima auf verschiedenen Pegeln des Eingangssignals (eine solche Eingabefunktion haben wir am Ende des zweiten Artikels abgeleitet ). Daher werden Gap-Gene jeweils durch ihren Gehalt an Bicoid-, Buckel- und Caudalproteinen aktiviert, und ihre Aktivitätszonen befinden sich auf natürliche Weise vom Kopf bis zum Schwanz des Embryos.Nachdem die Gap-Gene den Embryo grob in 7 Banden markiert haben (sie stimmen weder mit den Segmenten noch mit dem Kopf-Brust-Bauch überein), wird das nächste Modul aktiviert - Paarregel („Paarregelregeln“). Es unterteilt den Embryo bereits in Segmente, die 17 sein sollten. Das Paarregelmodul besteht aus fünf Genen, und alle unterdrücken sich, wie Sie vielleicht vermutet haben, gegenseitig. Jedes dieser Gene arbeitet entweder in allen geraden oder in allen ungeraden Segmenten - die von ihnen codierten Proteine werden schneller abgebaut als die Proteine der Gap-Gruppe, und die Streifen sind schmaler. Das Ausschalten eines Teils der Gene dieser Gruppe ergibt einen verkürzten Embryo, in dem alle geraden oder alle ungeraden Segmente verschwinden.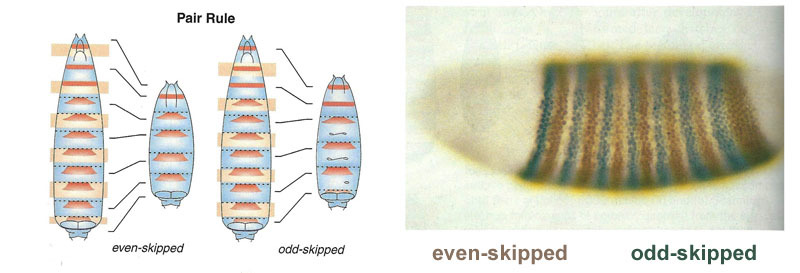 Aktivitätszonen von Genen aus der Paarregelgruppe. Das Foto rechts hat 14 Streifen, nicht 17, da die anderen drei Markierungssysteme in den ersten drei Segmenten des Kopfes funktionieren.Das Paarregelmodul selbst kann ohne die Beteiligung von Lücke und Bicoid den Embryo in schmale Streifen markieren, aber die Anzahl dieser Streifen wäre instabil: Segmente können 12, 18 und sogar 20 sein. Normalerweise sind Paarregelgene schwer zu kontrollieren Die Lücke zwischen den Genen und das erste grobe Markup (für 7 Zonen) helfen dabei, das endgültige Markup (für 14 + 3 Segmente) genau und zuverlässig zu erstellen.Der nächste Punkt im Algorithmus besteht darin, die Vorder-, Mittel- und Rückseite jedes Segments zu markieren. Dies erfolgt durch Segmentpolaritätsgene. Sie unterdrücken sich auch gegenseitig und werden von höheren Modulen des Gennetzwerks (Paarregel und Lücke) eingeschaltet. Nur die Diffusions- und Zerfallsparameter ihrer Produkte werden so gewählt, dass die Streifen sehr dünn sind - ein halbes Segment. Ihre gegenseitige Unterdrückung ist schwächer und organisierter als bei Paarregelgenen. Daher überlappen sich ihre Aktivitätsstreifen teilweise und in jedem Segment wird eine häufige "Linie" unterschiedlich überlappender Streifen erhalten.Das Ausschalten von Segmentpolaritätsgenen führt normalerweise nicht zu einer Verkürzung des Embryos und zum Verlust seiner Teile (wie es für Lücken- und Paarregeln typisch ist), sondern zu subtileren Effekten. Normalerweise wird in diesem Fall die Hälfte jedes Segments, in dem dieses Gen arbeiten sollte, zu einem Spiegelbild der anderen Hälfte. Dies ist deutlich sichtbar, da die Fliegenlarve Reihen kleiner Stacheln aufweist, die nach hinten gerichtet sind - zum bequemen Kriechen. Mutanten in den Segmentpolaritätsgenen haben nach vorne gerichtete Reihen von Stacheln.Schließlich sind die bekanntesten und zuerst entdeckten Gene dieses Netzwerks an der Reihe - das Hox-Modul. Ihre Arbeit verleiht den Segmenten Individualität, so dass die Antennen und Rüssel auf den Segmenten des Kopfes wachsen und die Beine und Flügel auf den Brustsegmenten wachsen. Die Hox-Gene hemmen im Gegensatz zu früheren Modulen nicht die Aktivität des anderen und können im selben Embryosegment zusammenarbeiten. Eine seltsame Eigenschaft von Hox-Genen, die noch nicht erklärt wurde: Sie befinden sich in einer engen Gruppe auf dem Chromosom und in derselben Reihenfolge, in der sie im Körper des Embryos wirken.
Aktivitätszonen von Genen aus der Paarregelgruppe. Das Foto rechts hat 14 Streifen, nicht 17, da die anderen drei Markierungssysteme in den ersten drei Segmenten des Kopfes funktionieren.Das Paarregelmodul selbst kann ohne die Beteiligung von Lücke und Bicoid den Embryo in schmale Streifen markieren, aber die Anzahl dieser Streifen wäre instabil: Segmente können 12, 18 und sogar 20 sein. Normalerweise sind Paarregelgene schwer zu kontrollieren Die Lücke zwischen den Genen und das erste grobe Markup (für 7 Zonen) helfen dabei, das endgültige Markup (für 14 + 3 Segmente) genau und zuverlässig zu erstellen.Der nächste Punkt im Algorithmus besteht darin, die Vorder-, Mittel- und Rückseite jedes Segments zu markieren. Dies erfolgt durch Segmentpolaritätsgene. Sie unterdrücken sich auch gegenseitig und werden von höheren Modulen des Gennetzwerks (Paarregel und Lücke) eingeschaltet. Nur die Diffusions- und Zerfallsparameter ihrer Produkte werden so gewählt, dass die Streifen sehr dünn sind - ein halbes Segment. Ihre gegenseitige Unterdrückung ist schwächer und organisierter als bei Paarregelgenen. Daher überlappen sich ihre Aktivitätsstreifen teilweise und in jedem Segment wird eine häufige "Linie" unterschiedlich überlappender Streifen erhalten.Das Ausschalten von Segmentpolaritätsgenen führt normalerweise nicht zu einer Verkürzung des Embryos und zum Verlust seiner Teile (wie es für Lücken- und Paarregeln typisch ist), sondern zu subtileren Effekten. Normalerweise wird in diesem Fall die Hälfte jedes Segments, in dem dieses Gen arbeiten sollte, zu einem Spiegelbild der anderen Hälfte. Dies ist deutlich sichtbar, da die Fliegenlarve Reihen kleiner Stacheln aufweist, die nach hinten gerichtet sind - zum bequemen Kriechen. Mutanten in den Segmentpolaritätsgenen haben nach vorne gerichtete Reihen von Stacheln.Schließlich sind die bekanntesten und zuerst entdeckten Gene dieses Netzwerks an der Reihe - das Hox-Modul. Ihre Arbeit verleiht den Segmenten Individualität, so dass die Antennen und Rüssel auf den Segmenten des Kopfes wachsen und die Beine und Flügel auf den Brustsegmenten wachsen. Die Hox-Gene hemmen im Gegensatz zu früheren Modulen nicht die Aktivität des anderen und können im selben Embryosegment zusammenarbeiten. Eine seltsame Eigenschaft von Hox-Genen, die noch nicht erklärt wurde: Sie befinden sich in einer engen Gruppe auf dem Chromosom und in derselben Reihenfolge, in der sie im Körper des Embryos wirken.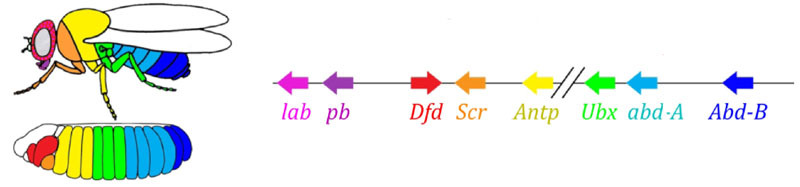 Die Markierung des Embryos basiert auf dem Prinzip „Je weiter von der Brust entfernt, desto mehr Hox-Gene und desto aktiver ist es“: Die Aktivität des Abdominal-A-Gens beginnt beim 2. Abdomensegment, wächst auf volle 4 und setzt sich in allen nachfolgenden Segmenten auf dem maximalen Niveau fort; Das Abdominal-B-Gen wirkt vom 5. bis zum 8. Segment des Abdomens und erhöht die Aktivität in jedem nachfolgenden Segment. Das Ultrabithorax-Gen ist im dritten Brustsegment in halber Stärke und im gesamten Bauchraum mit voller Kapazität enthalten. Wenn es in Bithorax-Mutanten ausgeschaltet ist, wissen Zellen des 3-Thorax-Segments nicht, dass es sich um das 3-Thorax-Segment handelt, in ihnen wirkt der gleiche Satz von Hox-Genen wie im 2-Thorax-Segment (d. H. Nur Antennapedia), und die Entwicklung des 3-Thorax-Segments schreitet voran Programm 2 Brust - mit Flügeln anstelle von Laufkäfern und kräftigen fliegenden Muskeln.Wenn Sie alle Hox-Gene in einem separaten Segment ausschalten, wird es hässlich, aber vor allem sieht es aus wie eine Brust mit Beinen und ohne Flügel. Dies liegt daran, dass die entfernten Vorfahren der Insekten wie Trilobiten oder Tausendfüßler waren. Sie hatten viele identische Segmente mit Beinen. Anschließend verkürzte sich ihr Körper, der hintere Teil verlor die Beine und wurde zum Bauch, und mehrere vordere Segmente schlossen sich dem Kopf an und ihre Beine wurden Teile des Mundapparates (Unterkiefer, Oberkiefer und Unterlippe).
Die Markierung des Embryos basiert auf dem Prinzip „Je weiter von der Brust entfernt, desto mehr Hox-Gene und desto aktiver ist es“: Die Aktivität des Abdominal-A-Gens beginnt beim 2. Abdomensegment, wächst auf volle 4 und setzt sich in allen nachfolgenden Segmenten auf dem maximalen Niveau fort; Das Abdominal-B-Gen wirkt vom 5. bis zum 8. Segment des Abdomens und erhöht die Aktivität in jedem nachfolgenden Segment. Das Ultrabithorax-Gen ist im dritten Brustsegment in halber Stärke und im gesamten Bauchraum mit voller Kapazität enthalten. Wenn es in Bithorax-Mutanten ausgeschaltet ist, wissen Zellen des 3-Thorax-Segments nicht, dass es sich um das 3-Thorax-Segment handelt, in ihnen wirkt der gleiche Satz von Hox-Genen wie im 2-Thorax-Segment (d. H. Nur Antennapedia), und die Entwicklung des 3-Thorax-Segments schreitet voran Programm 2 Brust - mit Flügeln anstelle von Laufkäfern und kräftigen fliegenden Muskeln.Wenn Sie alle Hox-Gene in einem separaten Segment ausschalten, wird es hässlich, aber vor allem sieht es aus wie eine Brust mit Beinen und ohne Flügel. Dies liegt daran, dass die entfernten Vorfahren der Insekten wie Trilobiten oder Tausendfüßler waren. Sie hatten viele identische Segmente mit Beinen. Anschließend verkürzte sich ihr Körper, der hintere Teil verlor die Beine und wurde zum Bauch, und mehrere vordere Segmente schlossen sich dem Kopf an und ihre Beine wurden Teile des Mundapparates (Unterkiefer, Oberkiefer und Unterlippe).Mathematische Modelle des genetischen Netzwerks zur Markierung von Embryonen
Im Fall des Lactose-Operons und der direkten Verknüpfungsschleifen von E. coli ist es möglich, ziemlich einfache mathematische Modelle mit einer moderaten Anzahl von Parametern zu konstruieren, die das Verhalten von Genen für beliebige Eingangssignale vorhersagen. Für ein Lactose-Operon reicht es aus:- vier Bindungskonstanten (Repressor und Aktivator mit DNA, Lactose mit Repressor, cAMP mit Aktivator)- vier stöchiometrische Parameter (4 Lactose pro 1 Repressor, 2 cAMP 1 Aktivator, 1 Repressor und Aktivator pro Operon)- zwei Regulationsparameter (die Wirkung des Repressors und des Aktivators auf die Wahrscheinlichkeit der Landung der RNA-Polymerase)- das Grundniveau der Operonaktivität (wenn kein Repressor oder Aktivator vorhanden ist)- TranskriptionsverzögerungInsgesamt 12 Parameter.Betrachten wir nun die regulatorischen Regionen von beispielsweise Hox-Genen. In der folgenden Abbildung ist einer der regulatorischen Blöcke des Abdominal-B-Gens dargestellt. Farbige Balken zeigen regulatorische Proteinbindungsstellen an. Dieser gesamte Block hat eine Größe von etwa 1700 Nukleotiden - zehnmal länger als die regulatorische Region des Lactose-Operons. Es hat 39 Pflanzstellen für 7 verschiedene regulatorische Proteine aus allen überlegenen Blöcken dieses Gennetzwerks. Und Bauch-B hat vier solche regulatorischen Blöcke. Sie schalten sich nacheinander vom 5. bis zum 8. Segment des Abdomens ein und bewirken eine schrittweise Erhöhung des Abdomens-B-Proteinspiegels in diesen Segmenten. Das heißt, für das Matmodell dieses Gens allein benötigen Sie in guter Weise mehr als 100 Bindungskonstanten, die gleiche Anzahl von Regulationsparametern und eine unbekannte Anzahl von Parametern, um die Wechselwirkung zwischen verschiedenen Eingaben zu beschreiben - im schlimmsten Fall bis zu 1.500 paarweise Wechselwirkungen zwischen allen Proteinlandeplätzen in einer Regulierungseinheit.Das heißt, das vollständige Modell dieses Gennetzwerks wird sicherlich mehr als tausend Parameter haben. Und das ist das Hauptproblem: Es gibt nicht so viele Ausgangssignale, die wir im Experiment messen können - tatsächlich nur die Spiegel jedes der 25 Proteine und ihre Verteilung entlang der Länge des Embryos. Daher hat niemand versucht, dieses Netzwerk mit der gleichen Granularität wie das Lactose-Operon zu simulieren.Sie können versuchen, die Aufgabe zu vereinfachen und die Wirkung jedes regulatorischen Proteins auf das Gen mit nur drei Parametern (Bindung, Stöchiometrie und Regulationsparameter) zu beschreiben. Sie können diese Parameter auswählen (z. B. mithilfe von Markov-Ketten), damit das Modell die realen Streifen der Genaktivität genau wiedergibt. Für die ersten beiden Blöcke des Netzwerks (Eierpolaritätsgene und Gap-Gene) werden solche Modelle sogar erstellt ( zum Beispiel ).Das Problem ist, dass unterschiedliche Starts des Auswahlalgorithmus unterschiedliche Modellparameter ergeben - aber alle funktionieren korrekt und reproduzieren die Aktivität von Genen in einer echten Fliegenknospe! Diese Modelle haben gemeinsame Merkmale (zum Beispiel unterdrücken sich alle Gap-Gene gegenseitig und werden von Mutterproteinen aktiviert), aber es gibt nicht weniger Unterschiede als Ähnlichkeiten.Und da unterschiedliche Modellierungsversuche zu unterschiedlichen Ergebnissen führen, ist es unwahrscheinlich, dass mindestens einer von ihnen mit der Realität übereinstimmt. Schlimmer noch, solche Modelle reproduzieren den normalen Betrieb, vermissen jedoch viel bei der Vorhersage der Ergebnisse von Mutationen.Im nächsten Teil werden wir darüber sprechen, warum diese Probleme bei der Untersuchung von Gennetzwerken in der Biologie unvermeidbar sind (und das Drosophila-Embryo-Markierungsnetzwerk ist eines der am einfachsten zu untersuchenden!), Was dagegen getan werden kann und welche Ingenieure von Biologen gelernt werden sollten.
Farbige Balken zeigen regulatorische Proteinbindungsstellen an. Dieser gesamte Block hat eine Größe von etwa 1700 Nukleotiden - zehnmal länger als die regulatorische Region des Lactose-Operons. Es hat 39 Pflanzstellen für 7 verschiedene regulatorische Proteine aus allen überlegenen Blöcken dieses Gennetzwerks. Und Bauch-B hat vier solche regulatorischen Blöcke. Sie schalten sich nacheinander vom 5. bis zum 8. Segment des Abdomens ein und bewirken eine schrittweise Erhöhung des Abdomens-B-Proteinspiegels in diesen Segmenten. Das heißt, für das Matmodell dieses Gens allein benötigen Sie in guter Weise mehr als 100 Bindungskonstanten, die gleiche Anzahl von Regulationsparametern und eine unbekannte Anzahl von Parametern, um die Wechselwirkung zwischen verschiedenen Eingaben zu beschreiben - im schlimmsten Fall bis zu 1.500 paarweise Wechselwirkungen zwischen allen Proteinlandeplätzen in einer Regulierungseinheit.Das heißt, das vollständige Modell dieses Gennetzwerks wird sicherlich mehr als tausend Parameter haben. Und das ist das Hauptproblem: Es gibt nicht so viele Ausgangssignale, die wir im Experiment messen können - tatsächlich nur die Spiegel jedes der 25 Proteine und ihre Verteilung entlang der Länge des Embryos. Daher hat niemand versucht, dieses Netzwerk mit der gleichen Granularität wie das Lactose-Operon zu simulieren.Sie können versuchen, die Aufgabe zu vereinfachen und die Wirkung jedes regulatorischen Proteins auf das Gen mit nur drei Parametern (Bindung, Stöchiometrie und Regulationsparameter) zu beschreiben. Sie können diese Parameter auswählen (z. B. mithilfe von Markov-Ketten), damit das Modell die realen Streifen der Genaktivität genau wiedergibt. Für die ersten beiden Blöcke des Netzwerks (Eierpolaritätsgene und Gap-Gene) werden solche Modelle sogar erstellt ( zum Beispiel ).Das Problem ist, dass unterschiedliche Starts des Auswahlalgorithmus unterschiedliche Modellparameter ergeben - aber alle funktionieren korrekt und reproduzieren die Aktivität von Genen in einer echten Fliegenknospe! Diese Modelle haben gemeinsame Merkmale (zum Beispiel unterdrücken sich alle Gap-Gene gegenseitig und werden von Mutterproteinen aktiviert), aber es gibt nicht weniger Unterschiede als Ähnlichkeiten.Und da unterschiedliche Modellierungsversuche zu unterschiedlichen Ergebnissen führen, ist es unwahrscheinlich, dass mindestens einer von ihnen mit der Realität übereinstimmt. Schlimmer noch, solche Modelle reproduzieren den normalen Betrieb, vermissen jedoch viel bei der Vorhersage der Ergebnisse von Mutationen.Im nächsten Teil werden wir darüber sprechen, warum diese Probleme bei der Untersuchung von Gennetzwerken in der Biologie unvermeidbar sind (und das Drosophila-Embryo-Markierungsnetzwerk ist eines der am einfachsten zu untersuchenden!), Was dagegen getan werden kann und welche Ingenieure von Biologen gelernt werden sollten.