 Flüssigkristalle in der nematischen Phase
Flüssigkristalle in der nematischen PhaseSie haben wahrscheinlich die Schule durchlaufen, dass eine Substanz in drei
thermodynamischen Phasen vorliegen kann : fest, flüssig und gasförmig. (Der Begriff "Phase" wird in Verbindung mit dem Begriff "Zustand" verwendet, und keiner von ihnen hat eine klare, allgemein akzeptierte Definition.) Für junge Studenten ist dies eine nützliche Vereinfachung, aber in Wirklichkeit gibt es viel mehr Phasen. In den letzten hundert Jahren haben wir die Existenz von Hunderten verschiedener fester Phasen entdeckt - einige davon werden zur Herstellung von Siliziumchips in Ihrem Computer verwendet. Darüber hinaus gibt es Dutzende von Phasen von Flüssigkristallen - einige von ihnen erzeugen Bilder auf Ihrem Bildschirm. Und wir haben noch nicht einmal wirklich exotische Dinge angesprochen: Quantenphasen, superfluide Flüssigkeiten, Quark-Gluon-Plasma, Bose-Einstein-Kondensate und so weiter. "Topologische Phasen."
Aber zuerst zurück zum Anfang und diskutieren, was die "Phase" ist. Wie viele grundlegende Konzepte lässt sich dies am besten anhand eines Beispiels erklären. Stellen Sie sich ein Glas Wasser vor, in dem einige Eiswürfel schwimmen. Es gibt nur eine Substanz in einem Glas: Wasser. Viele H
2 O-Moleküle.
Und obwohl die Eismoleküle mit den Molekülen im umgebenden Wasser identisch sind, gibt es offensichtlich einen großen Unterschied zwischen ihnen. Das offensichtlichste ist, dass einer von ihnen fest ist und seine Form beibehält, während der andere frei fließt und die Form eines Gefäßes annimmt. Es gibt auch einen Unterschied in der Dichte, der elektrischen Leitfähigkeit und einer Reihe anderer Eigenschaften. Daher sagen wir, dass flüssiges Wasser und Eis unterschiedliche Phasen derselben Substanz sind. (Wasser ist die einzige Substanz, der eine Person ständig mit drei verschiedenen Phasen begegnet. Dies ist einer der Gründe, warum Wasser eine spezielle Substanz ist.)
Wie kommt es, dass Eis und Wasser sich völlig unterschiedlich verhalten? Sie könnten versucht sein zu sagen, dass alles von der Temperatur abhängt: Das Wasser ist warm, das Eis ist kalt, und aus diesem Grund verhalten sich Wassermoleküle anders. Bei 0 ° C und normalem atmosphärischen Druck sind Eis und flüssiges Wasser jedoch stabil - das heißt, sie können unbegrenzt existieren und sich nicht ändern.
Aber wenn der Hauptunterschied nicht die Temperatur ist, was dann?
Groß und klein
Wissenschaftler diskutieren seit langem die Beziehung zwischen den makroskopischen Eigenschaften verschiedener Materialien und der mikroskopischen Anordnung der Partikel, aus denen sie bestehen. Einer der frühesten Versuche unternahm Johannes Kepler 1611 in der Arbeit mit dem schönen Titel: „Sechseckige Schneeflocke: Geschenk des neuen Jahres“. Kepler argumentierte, dass die sechsfache Symmetrie von Schneeflocken durch die Annahme erklärt werden kann, dass das Eis aus winzigen Kugeln besteht, die in hexagonalen Sätzen gepackt sind.
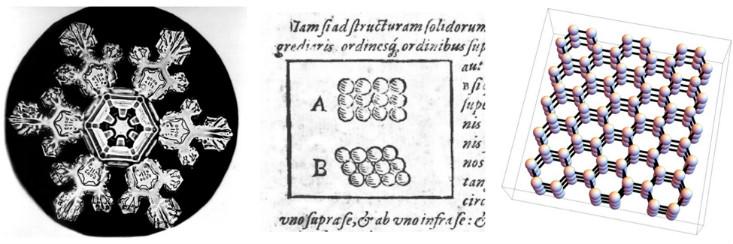
Jetzt wissen wir, dass Keplers Annahme über die spezielle Anordnung der Atome etwas falsch war - sein Schema spiegelt nicht die dreidimensionale Form und die komplexe Wechselwirkung von Wassermolekülen wider. (Nehmen wir zu seinen Gunsten an, dass die Chemie noch nicht erfunden wurde und die Existenz von Atomen fast 300 Jahre später endlich bewiesen wurde.) Er war jedoch auf dem richtigen Weg. Die sechsfache Symmetrie von Schneeflocken ergibt sich aus der Tatsache, dass sich Wassermoleküle in einer dreidimensionalen Struktur mit sechsfacher Symmetrie aneinanderreihen (und es gibt auch
dreieckige Schneekristalle , und niemand weiß genau warum).
In der Sprache der modernen Physik schlug Kepler vor, dass Schnee ein kristalliner Feststoff ist, eine Phase der Materie, die ihre Eigenschaften erhält, weil ihre Atome oder Moleküle in periodischen Reihen oder Kristallgittern angeordnet sind. Physiker verwenden das Wort „Kristall“, um die mikroskopische Struktur zu beschreiben, unabhängig davon, ob das Material wie ein Diamant, ein Sandkorn oder eine Schneeflocke aussieht. Für den Physiker sind daher viele Metalle und Keramiken Kristalle, weil ihre Atome oder Moleküle in einem periodischen Gitter angeordnet sind - in einer bestimmten dreidimensionalen Version von Keplers Zeichnungen von 1611.
Dies erklärt das Eis in einem Glas Wasser. Was ist mit flüssigem Wasser? In jeder Substanz bewegen sich die Moleküle bei Temperaturen über dem absoluten Nullpunkt (-273 ° C) nach einem starken Zusammenbruch ständig und prallen vom Wort Billardkugeln ab. Die Temperatur einer Substanz ist ein Maß für die Bewegungsgeschwindigkeit von Molekülen.
In einer Flüssigkeit ist diese zufällige thermische Bewegung stark genug, um die Kräfte zu überwinden, die die Moleküle im Gitter halten. Und ohne dieses Gitter können sich Moleküle viel freier bewegen. Dies erklärt, warum die Flüssigkeit beim Drücken mit dem Finger unterliegt und Eis nicht. Interessanterweise gibt es Substanzen, insbesondere Fensterglas, mit einer völlig zufälligen Mikrostruktur, aber auf makroskopischer Ebene verhalten sie sich dennoch wie feste. Das Verständnis ihres Verhaltens ist die wichtigste der offenen Fragen der Materialphysik.
Fantastische Phasen
In dreidimensionalen Materialien - wie echtem Eis und nicht wie in Keplers Skizzen - wird alles komplizierter, weil es in drei Dimensionen viele Möglichkeiten gibt, Moleküle in periodischen Strukturen anzuordnen. Zum Beispiel gibt es ungefähr 17 Eisphasen (ungefähr, weil diese Anzahl davon abhängt, wie sie klassifiziert sind), von denen die neueste letztes Jahr von italienischen Wissenschaftlern erstellt und untersucht wurde. Unterschiedliche Phasen treten bei unterschiedlichen Temperaturen und Drücken auf, und obwohl sie alle fest sind, hat jede ihre eigene Dichte, Stärke, Reaktion auf elektrische und magnetische Felder, Wärmeleitfähigkeit usw. Aufgrund dieser Unterschiede im makroskopischen Verhalten nennen wir sie unterschiedliche Phasen. Unter "normalen" Bedingungen - Temperatur und Druck auf der Erdoberfläche - liegt das Eis normalerweise in Form von "Eis I
h " vor. Diese stabile hexagonale Kristallform ist genau für die sechsfache Symmetrie der Schneeflocken verantwortlich.
Nach den Bezeichnungen der verschiedenen Eisphasen existiert Eis IX tatsächlich. Glücklicherweise ist es bei Temperatur und Druck auf der Erdoberfläche viel zerbrechlicher als die anderen „Eis-Neun“ - die stabile Phase, aufgrund derer die Ozeane in Kurt Vonneguts Roman „Wiege für die Katze“ katastrophal verhärtet wurden.
Und das ist noch nicht alles, selbst mit einer so vertrauten Substanz. Andere, noch nicht entdeckte Eisphasen können bei ultrahohen Drücken in den Zentren von Gasriesen wie Uranus und Neptun existieren. Unter solch extremen Bedingungen bei einem Druck von 10 Millionen atm. und mehr noch, Wasser muss sehr seltsame kristalline feste Phasen bilden. Unter ihnen befindet sich eine metallleitende Phase, die glänzend aussehen sollte, wenn Sie herausfinden, wie man sie poliert.
Zwischenoptionen
Die Verbindung zwischen Mikrostruktur und Makroeigenschaften ist die Hauptidee von Wissenschaft und Technik, sie wird bei der Entwicklung vieler Materialien verwendet. Beispielsweise sind Flüssigkristalle eine Schlüsselkomponente von Laptops, Fernsehgeräten und Smartphonebildschirmen. Flüssigkristallmoleküle haben eine ungewöhnlich lange Struktur, die einem Stab ähnelt. Aus diesem Grund können sie sich in mehreren verschiedenen Phasen befinden, deren Eigenschaften bei herkömmlichen Materialien nicht zu finden sind.
Beispielsweise sind die Moleküle bei hohen Temperaturen in Unordnung. Jeder "Stab" befindet sich an einer zufälligen Stelle, wie Moleküle in flüssigem Wasser, und ist in einer beliebigen Richtung ausgerichtet. Dies ist eine isotrope Phase. Bei niedrigeren Temperaturen können Moleküle in die nematische Phase übergehen, in der sie sich zufällig befinden, wie in flüssigem Wasser, jedoch in die gleiche Richtung gerichtet. Da kein Gitter gebildet wird, fließt die nematische Phase wie eine Flüssigkeit, aber da die Stäbe in eine Richtung gerichtet sind, hat sie eine mikroskopische Ordnung. Daher werden sie "Flüssigkristalle" genannt.
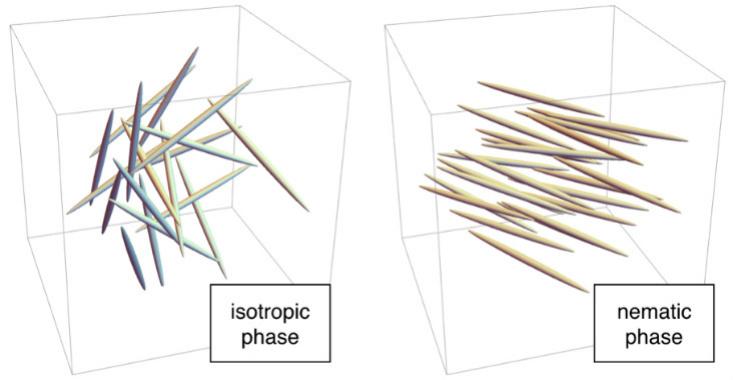
Zum Glück für moderne Menschen hat die nematische Phase ungewöhnliche Eigenschaften, die mit der Richtung verbunden sind. Wenn sie in einem elektrischen Feld getroffen werden, richten sich Moleküle entlang dieser aus. Auf LCD-Bildschirmen verhalten sich die Moleküle in der nematischen Phase wie ein Polarisationsfilter: ein Gerät, das Licht durchlässt, wenn die Moleküle auf besondere Weise ausgerichtet sind (z. B. von oben nach unten), und es verzögert, wenn sie senkrecht ausgerichtet sind. Da für solche Arbeiten ein Polarisationsfilter benötigt wird, wird der Filter in Telefonen und Displays zwischen der Lichtquelle und dem Bildschirm platziert. Im LCD erzeugen winzige Elektroden neben jedem Pixel ein elektrisches Feld, das die Position der Moleküle im Inneren und damit die Lichtemission steuert. Dieses Arbeitsschema wird in IPS-Anzeigen verwendet („In-Plane-Switching“). Es gibt andere Optionen, zum Beispiel TN-Displays, die eine noch exotischere, verdrehte nematische Phase verwenden.
Modellierung einer Miniatur
Es ist klar, dass die Mikrostruktur dabei hilft, die Eigenschaften der Materialien zu erklären, die wir treffen und herstellen. Aber können wir die mikroskopische Ordnung im wirklichen Leben sehen? Für gewöhnliche Substanzen wie Eis, Salz oder Metall ist dies schwierig, da Atome und Moleküle sehr klein sind. Ein Wassermolekül ist weniger als ein Milliardstel Meter groß - es kann mit einem herkömmlichen Lichtmikroskop nicht gesehen werden, und es ist selbst mit modernen mikroskopischen Techniken sehr schwer zu sehen.
Glücklicherweise können sich nicht nur Atome und Moleküle unabhängig voneinander in Phasen organisieren. In Chaikins Labor am Soft Materials Research Center der New York University verwenden wir kleine harte Kugeln, um die Phasen der Materie zu untersuchen. Sie werden Kolloide genannt und können aus verschiedenen Materialien wie Glas, Kunststoff oder Metall hergestellt werden. Kolloide im Labor sind 3.000-mal größer als Wassermoleküle - sie sind vergleichbar groß wie Bakterien oder tierische Zellkerne. Kolloide sind für Materialexperten so etwas wie „ideale Partikel“ - groß genug, um unter einem Mikroskop sichtbar zu sein, und klein genug, um Phasen zu bilden, ähnlich wie bei gewöhnlichen Materialien.
 Dieses Foto zeigt mit einer chemischen Zusammensetzung beschichtete Kunststoffkolloide, aufgrund derer sie sich gegenseitig abstoßen und sich auf der Wasseroberfläche befinden
Dieses Foto zeigt mit einer chemischen Zusammensetzung beschichtete Kunststoffkolloide, aufgrund derer sie sich gegenseitig abstoßen und sich auf der Wasseroberfläche befindenIn unserem Labor stellen wir Kolloide mit einer speziellen Beschichtung her, die es ihnen ermöglicht, an der Wasseroberfläche zu haften. Wenn sie an den Tröpfchen haften, können wir wunderschöne Mikrofotografien aufnehmen - wie diese. Sie können die mikroskopische Struktur der verschiedenen Phasen auf ihnen sehen und wie ihre Ausrichtung zum Auftreten von makroskopischen Eigenschaften wie Härte führt. Zum Beispiel untersuchen wir jetzt, wie sich das Verhalten unserer Partikel in Abhängigkeit von der Verwendung von kugelförmigen Tröpfchen oder flachen Wasseroberflächen ändert. Hilft oder behindert das Vorhandensein von Partikeln auf einer Kugel die Bildung von Kristallen und das Auftreten von Systemen wie einem Feststoff? Dies kann uns helfen, die Eigenschaften wichtiger Strukturen zu verstehen, die eine sphärische oder komplexere Form haben. Wenn wir zum Beispiel mehr über die Proteinbeschichtungen wissen würden, die die HIV-Gene schützen, könnten wir lernen, wie man sie abbaut und das Virus besiegt.
Wenn die Kristalle schlecht werden
Eine der wichtigsten Phasen bei der Untersuchung der mikroskopischen Ordnung ist die Untersuchung der Bedingungen, unter denen die Ordnung gestört ist. Wenn Sie beispielsweise das Bild von Kolloiden im Kristallgitter betrachten, werden Sie feststellen, dass ihre Reihenfolge heterogen ist. Sie können Unvollkommenheiten und Unregelmäßigkeiten, Mängel sehen.
 Das Bild wurde mit einem konfokalen Mikroskop aufgenommen - der Probe wird eine fluoreszierende Farbe hinzugefügt, die dann von einem Laser beleuchtet wird
Das Bild wurde mit einem konfokalen Mikroskop aufgenommen - der Probe wird eine fluoreszierende Farbe hinzugefügt, die dann von einem Laser beleuchtet wirdÄhnliche Defekte treten in Kristallen von Atomen oder Molekülen auf und spielen eine wichtige Rolle. Zum Beispiel bestimmen sie die Zerbrechlichkeit eines Materials - welche Art von Belastung es aushalten kann, bevor es bricht. Da Defekte die elektrische Leitfähigkeit eines Materials beeinträchtigen können, geben Halbleiterhersteller Milliarden von Dollar für die Herstellung von Silizium-Einkristallen aus - riesige Siliziumblöcke ohne Defekte. Andererseits sind diese mikroskopischen Mängel manchmal sehr hilfreich. Neuere Forschungen haben sich auf das Management und die Kontrolle von Graphendefekten konzentriert, um es als Filter für die Entsalzung zu optimieren.
Wir verwenden kolloidale Kristalle, um zu beobachten, wie Defekte auftreten, sich bewegen und miteinander interagieren. Wie bei Phasenstudien kann die Untersuchung kolloidaler Kristalle helfen, Defekte in anderen Materialien zu verstehen. Wie in vielen Lebensbereichen sind manchmal Unvollkommenheiten der interessanteste Teil.