In meiner vorherigen Veröffentlichung wurden zwei Fragen behandelt: die Grundlagen der Molekularbiologie und die Methoden zur Herstellung der Konstrukte, die wir für Gene benötigen, die auf Plasmidvektoren basieren. Nun müssen Sie herausfinden, wie Sie einen Plasmidvektor in eine Bakterienzelle einführen, dh eine "Transformation" durchführen. Gleichzeitig lernen wir etwas über die Struktur der Bakterienmembran und wie sie überwunden werden kann, warum einige Bakterien als kompetent bezeichnet werden, wie all dies mit bakteriellen Toxinen und bakterieller Resistenz gegen Antibiotika verbunden ist und viele andere interessante Fakten.
Wir haben also einen Plasmidvektor an unseren Händen und es gibt einen Bakterienstamm, der für diesen Vektor geeignet ist. Es bleibt, den Vektor in das Bakterium einzuführen.
In einem
früheren Artikel wurde die
Arbeit von Frederick Griffith erwähnt, die deutlich zeigt, dass DNA spontan in Bakterienzellen eindringen kann. Die Fähigkeit einer Bakterienzelle, ein Umwelt-DNA-Molekül zu absorbieren, wird als „Kompetenz“ bezeichnet (was zu vielen Witzen darüber führt, dass selbst einzellige In-vitro-Zellen kompetent sind und Ihr Laborkollege nicht). Wenn die Absorption nicht unter dem Einfluss einiger künstlich erzeugter Bedingungen erfolgt, sprechen wir von „natürlicher Kompetenz“. Wie kommt es zu einem ähnlichen DNA-Transport innerhalb eines Bakteriums?
1) Die Struktur der Zellmembran von Bakterien
Zunächst betrachten wir kurz die Struktur der Membran von grampositiven und gramnegativen Bakterien.
Die Schale eines gramnegativen Bakteriums besteht aus zwei Lipiddoppelschichten: der äußeren Membran und der inneren Membran (die innere wird auch Plasma genannt). Zwischen ihnen befindet sich der periplasmatische Raum, der mit Proteinen und Peptidoglycan gefüllt ist und wichtige Funktionen erfüllt.
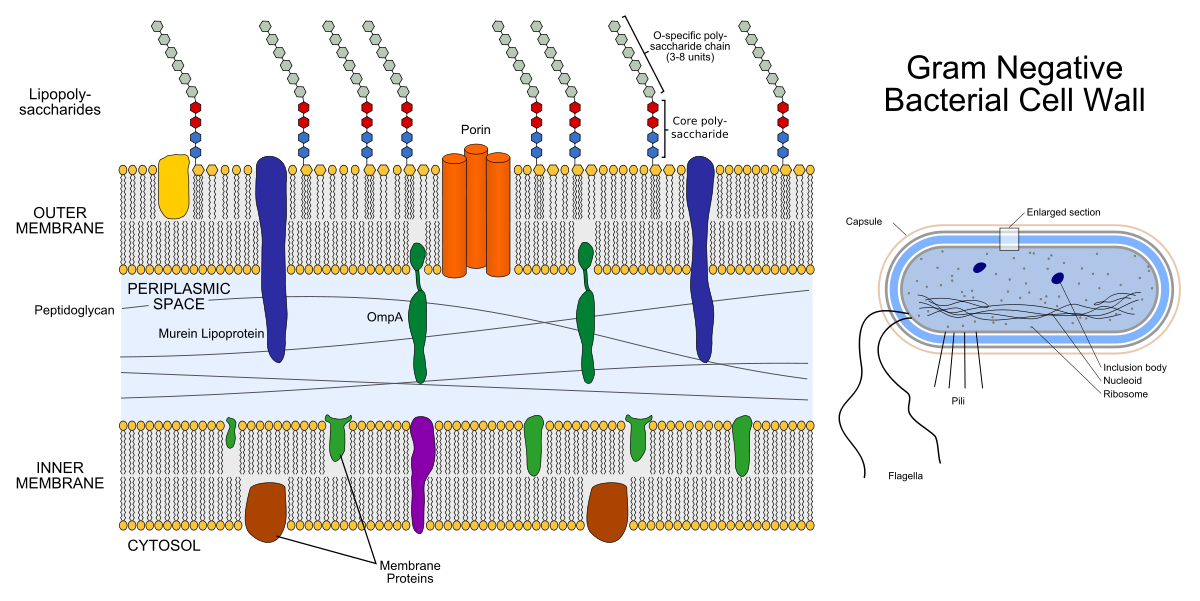 Links ist die Struktur der Membran des gramnegativen Bakteriums. Die farbigen Gizmos in den Membranen sind Membranproteine, und die hervorstehenden Ketten sind Lipopolysaccharide. Rechts ist die Struktur des gramnegativen Bakteriums selbst dargestellt.
Links ist die Struktur der Membran des gramnegativen Bakteriums. Die farbigen Gizmos in den Membranen sind Membranproteine, und die hervorstehenden Ketten sind Lipopolysaccharide. Rechts ist die Struktur des gramnegativen Bakteriums selbst dargestellt.Peptidoglycan ist ein Heteropolymer, das aus kovalent vernetztem N-Acetylglucosamin (NAG) und N-Acetylmuraminsäure (NAM) besteht. Es stellt sich heraus, die Kette ....- NAG-NAM-NAG-NAM-NAG- .... "Hetero" im Wort "Heteropolymer" bedeutet, dass das Polymer nicht aus den gleichen Elementen (wie Polyethylen) besteht, sondern aus zwei verschiedenen. Das Peptidoglycan-Syntheseenzym Transpeptidase ist ein Ziel für β-Lactam-Antibiotika (Penicillin-Antibiotika und Cephalosporine): Sie hemmen seine Aktivität, da aufgrund des Prozesses der bakteriellen Teilung nicht genügend Peptidoglycan für beide Tochterzellen vorhanden ist. Die Peptidoglycanschicht ist auch ein Ziel für das Lysozymenzym: Sie zerstört die kovalente Bindung zwischen NAG und NAM. In der Medizin wird Lysozym als Antiseptikum verwendet, zum Beispiel ist es ein aktiver Bestandteil einiger Medikamente zur Behandlung von Halsschmerzen, und in der Lebensmittelindustrie kann es als Konservierungsmittel verwendet werden (Nahrungsergänzungsmittel E1105 - dies ist Lysozym).

Die Hülle von grampositiven Bakterien besteht nur aus einer inneren (Plasma-) Membran, einem sehr dünnen periplasmatischen Raum und einer äußeren, dickeren Peptidoglycanschicht als die von gramnegativen Bakterien.
Solche Hindernisse, die einer Verbindung im bakteriellen Zytoplasma im Wege stehen, sind für alles außer Wasser sowie für kleine unpolare und hydrophobe Moleküle (molekularer Sauerstoff und Stickstoff, Kohlendioxid und andere) unüberwindbar. Das Eindringen dieser Verbindungen durch die Hülle wird als "passiver Transport" ("einfache Diffusion") bezeichnet und erfolgt immer entlang des Konzentrationsgradienten. Unpolare Moleküle können Membranen frei passieren, da das Innenvolumen der Membranen ebenfalls unpolar ist (innerhalb der Membran bestehen sie aus hydrophoben Resten von Fettsäuren) und unpolare Verbindungen sich gut in unpolaren Lösungsmitteln (Alkohol, Aceton, Fettsäuren) lösen.
Ein Comic-Bild, in dem die Hydrophobie (Hydrophobie) der Fettsäurereste in einer zweischichtigen Membran dargestellt wird.Große polare Moleküle (Aminosäuren, Monosaccharide, Nukleotide), geladene Teilchen (Ionen) und Makromoleküle (DNA, Proteine) können die Zellmembran nicht einfach so durchdringen, da sie nur in polaren Lösungsmitteln (z. B. in Wasser) gut löslich sind. . Wie gelangen dann DNA-Moleküle in eine Bakterienzelle?
2) Mechanismen des induzierten Transports von Verbindungen aus der Umwelt in Zellen
Zunächst haben wir die offensichtliche Tatsache in den Händen, dass das Bakterium nicht nur von Wasser, Sauerstoff und Kohlendioxid leben kann, sondern für sein Leben viele andere Verbindungen benötigt. Es gibt also Möglichkeiten, diese Verbindungen in die Zelle abzugeben. Solche Methoden sind "erleichterte Diffusion" und "aktiver Transport".
2.1) Lichtstreuung
Ein Beispiel für eine erleichterte Diffusion (obwohl dieser spezielle Fall im Gegenteil für Bakterien schädlich ist) ist der Transport von Kaliumionen durch die Membran einer Bakterienzelle in Kombination mit Valinomycin, einem Antibiotikum, das von einigen Pilzen synthetisiert wird. Freies Valinomycin kann nicht in die Zelle eindringen, da die polaren Gruppen extern exponiert sind. Kaliumionen sind auch ein "geschlossener Weg".
 Eine Skulptur, die die dreidimensionale Struktur eines Komplexes aus Valinomycin- und Kaliumionen darstellt (das Ion ist als Kugel in der Mitte dargestellt). Es wurde vor dem Eingang zum M. M. Shemyakin und Yu. A. Ovchinnikov-Institut für Bioorganische Chemie der Russischen Akademie der Wissenschaften (Moskau) installiert, in dem der Mechanismus der antibakteriellen Aktivität von Valinomycin und die dreidimensionale Struktur seines Komplexes mit Kaliumionen festgelegt wurden.
Eine Skulptur, die die dreidimensionale Struktur eines Komplexes aus Valinomycin- und Kaliumionen darstellt (das Ion ist als Kugel in der Mitte dargestellt). Es wurde vor dem Eingang zum M. M. Shemyakin und Yu. A. Ovchinnikov-Institut für Bioorganische Chemie der Russischen Akademie der Wissenschaften (Moskau) installiert, in dem der Mechanismus der antibakteriellen Aktivität von Valinomycin und die dreidimensionale Struktur seines Komplexes mit Kaliumionen festgelegt wurden.Nach der Bildung eines Valinomycin-Komplexes mit einem Kaliumion ändert es jedoch seine dreidimensionale Struktur, so dass seine gesamte äußere Oberfläche hydrophob (unpolar) wird und alle hydrophilen Gruppen im Inneren verborgen sind. In diesem Fall ist das Kaliumion im Valinomycinmolekül verborgen, daher kann der Valinomycin + Kaliumionenkomplex die Membran durchdringen. Der Komplex kann sich sowohl innerhalb als auch außerhalb der Zelle jederzeit in freies Valinomycin und Ion zersetzen. Eine im Allgemeinen erleichterte Diffusion von Ionen führt jedoch zu einem Ausgleich ihrer Konzentration sowohl im intrazellulären als auch im extrazellulären Raum, und die Zelle steuert den Ionentransport aus einem Grund: ihrer hohen Konzentration tödlich. Darauf beruht die antibakterielle Wirkung von Valinomycin.
Schematische Darstellung des mit Kaliumionen komplexierten Pilzantibiotikums Valinomycin.Ein weiteres Beispiel sind unkontrollierte Poren, bei denen es sich um große Transmembranproteine handelt, die es bestimmten Substanzen ermöglichen, entsprechend dem Gradienten frei durch die Membran zu gelangen. Ein Beispiel für eine solche Transmembranpore ist das α-Toxin
Staphylococcus aureus Staphylococcus aureus (ein anderer Name für das Toxin ist α-Hämolysin. Es besteht aus den Teilen „Hämo“ und „Lysin“. „Hämo“ bedeutet rote Blutkörperchen; „Lysin“ bedeutet vom Wort "Lyse", dh "Zelltod")
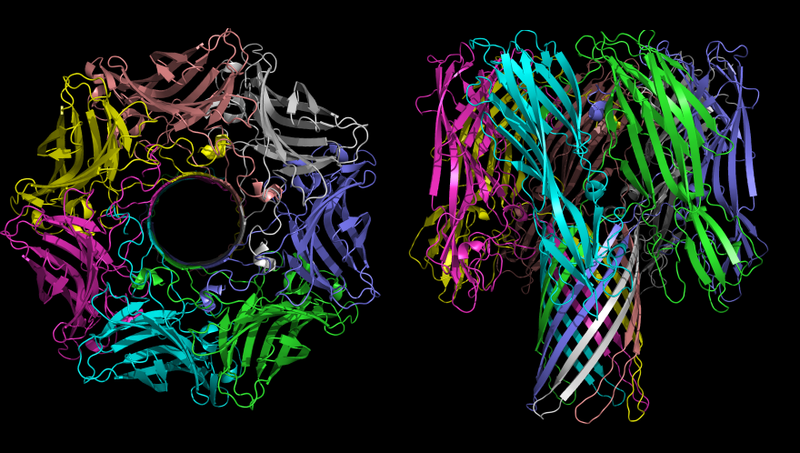 Die dreidimensionale Struktur des α-Hämolysin-Oligomers - das Toxin des Bakteriums Staphylococcus aureus. Auf dem Bild links ist die Zeit deutlich sichtbar.
Die dreidimensionale Struktur des α-Hämolysin-Oligomers - das Toxin des Bakteriums Staphylococcus aureus. Auf dem Bild links ist die Zeit deutlich sichtbar.Die Hauptfunktion von α-Hämolysin im pathogenen Prozess ist die Bildung unkontrollierter Kanäle in der Zellmembran, die abhängig von den Umgebungsbedingungen einwertige Ionen, Calciumionen oder ATP passieren können. Wie oben erwähnt, ist das Ionenungleichgewicht extrem toxisch und der Transport von ATP
aus der Zelle ist schädlich, da ATP ein unverzichtbares Bindeglied in fast allen chemischen Prozessen einer Zelle ist.
2.2) Aktiver Transport
Wie aus den obigen Beispielen ersichtlich ist, erfordert eine erleichterte Diffusion keine Energie. Im Gegenteil, aktiver Transport ist die Absorption oder Freisetzung von etwas durch eine Zelle mit dem Energieaufwand für jeden Übertragungsvorgang. Dies kann der Transport großer polarer Moleküle oder Ionen sein, und der Transport von Ionen kann sowohl entlang des Konzentrationsgradienten als auch dagegen durchgeführt werden. Natürlich ist aktiver Transport ein kontrollierter Prozess, an dem eine ganze Reihe von intrazellulären und Transmembranproteinen beteiligt ist. Daher muss die Zelle zuerst Ressourcen für die Synthese all dieser Proteine und dann wieder Energie für die Verwendung dieses Transportsystems aufwenden.
Ein Beispiel für einen aktiven Transport ist das System des energieabhängigen Transports von hydrophoben und amphiphilen Verbindungen von einer Zelle zurück in die Umwelt (Efflux).
Das System des aktiven Transports eines Antibiotikums von einer Bakterienzelle nach außen, bestehend aus drei Proteinen, die einen einzelnen Transmembrankomplex bilden. Die Abbildung spiegelt die Tatsache wider, dass das Effluxtransporterprotein (Violett) Arzneimittelmoleküle sowohl direkt im Zytoplasma als auch in der Membran „fangen“ kann.Dieses System ist von besonderem Interesse, da es die Mehrfachresistenz einiger Bakterien gegen Antibiotika verursacht: Die Zelle wird sie los, bevor sie es ernsthaft schädigen können. Darüber hinaus ist mehr als die Hälfte der Fälle von Multiresistenz gegen
Pseudomonas aeruginosa Pseduomonas aeruginosa mit dem aktiven Transport von Antibiotika verbunden. Noch wichtiger ist, dass bereits aktive Effluxsysteme für „neue“ Antibiotika entdeckt wurden, die gegen Bakterien eingesetzt werden, die gegen häufig verwendete antibakterielle Medikamente resistent sind. Beispielsweise wird das im Fall der Unwirksamkeit klassischer Antibiotika verwendete Medikament
Linezolid durch das auf den Proteinen AcrAB und TolC basierende Effluxsystem zurückgeworfen. Eine weitere interessante Tatsache ist, dass ein intelligentes Bakterium in solchen Situationen, in denen sie nicht benötigt werden, keine Energie für die Synthese von Proteinen des Effluxsystems in großem Maßstab verschwendet. Sobald jedoch für die Zelle schädliche Substanzen auftreten, wird die Synthese schnell aktiviert und das Bakterium beginnt sich aktiv zu widersetzen. Übrigens ist Efflux nicht der einzige Mechanismus zum Schutz von Bakterien vor Antibiotika. Ich werde auch einen Artikel über andere Methoden schreiben.
Die Struktur von Linezolid ist ein Antibiotikum, das gegen resistente Stämme grampositiver Bakterien eingesetzt wird.3) Kompetenz der Bakterienzellen
Daher untersuchten wir die Mechanismen des Transmembrantransports von Verbindungen, die diese Barriere ohne fremde Hilfe nicht durchdringen können. Unter natürlichen Bedingungen erfolgt der Transport von DNA in das Bakterium nur durch aktiven Transport, da ein ganzes Spektrum von intrazellulären und Transmembranproteinen zusammenarbeitet. Die uninduzierte Fähigkeit einer Zelle, DNA von außen zu absorbieren, wird als "natürliche Kompetenz" bezeichnet.
3.1) Natürliche Kompetenz von Bakterienzellen
Die fundierteste Hypothese für die Entstehung der natürlichen Kompetenz von Bakterien ist die Annahme, dass dieser Mechanismus es Bakterien ermöglicht, unter extremen Bedingungen für sie zu überleben (extreme Bedingungen für eine Zelle werden als "Stress" bezeichnet). Tatsache ist, dass Stress häufig zu einer Schädigung der „chromosomalen“ DNA eines Bakteriums führt. Wenn eine Zelle überleben will, muss sie ihr „Chromosom“ irgendwie „reparieren“ (eine solche „Reparatur“ wird als „Reparatur“ bezeichnet). Darüber hinaus ist bekannt, dass, wenn eine DNA-Sequenz in die Zelle eingeführt wird, die einem Teil der zelleigenen DNA ähnelt, dieses „neue“ Stück höchstwahrscheinlich in sein Genom integriert wird. Was passiert unter stressigen Bedingungen? Einige Zellen sterben ab und werden zu DNA-Spendern für diejenigen ihrer Brüder, die immer noch ums Leben kämpfen. In der Tat ist es innerhalb derselben Bakterienkultur sehr wahrscheinlich, dass die Genome der Vertreter sehr ähnlich sind, so dass die überlebenden Bakterien die DNA der toten Verwandten verwenden können, um ihr Genom zu reparieren.
Darüber hinaus hat unter komfortablen Bedingungen in der Zellkultur nur ein Bruchteil von ihnen natürliche Kompetenz, und der Anteil kompetenter Zellen an ihrer Gesamtzahl ist dann am größten, dann befindet sich die Kultur in einer bestimmten Wachstumsphase - der
logarithmischen Phase.
 Eine typische Darstellung von Bakterien in Kultur im Laufe der Zeit. Die logarithmische Phase ist die Wachstumsphase, gefolgt von einem Plateau und der Extinktionsphase, in der den Zellen bereits Nährstoffe fehlen und sich Toxine ansammeln.
Eine typische Darstellung von Bakterien in Kultur im Laufe der Zeit. Die logarithmische Phase ist die Wachstumsphase, gefolgt von einem Plateau und der Extinktionsphase, in der den Zellen bereits Nährstoffe fehlen und sich Toxine ansammeln.Natürlich möchte der Forscher den Prozess der Übertragung des Plasmidvektors in die Zelle so effizient wie möglich gestalten: Je effizienter der Transformationsprozess ist, desto weniger Plasmidvektor wird benötigt, um gute Ergebnisse zu gewährleisten. Daher verlassen sie sich unter Laborbedingungen normalerweise nicht auf die Zelle selbst, sondern erzeugen Zellen mit künstlicher Kompetenz.
3.2) Künstliche Kompetenz von Bakterienzellen
Es gibt zwei Hauptmethoden zur Schaffung der künstlichen Kompetenz von Bakterien: Behandlung einer Zellkultur mit zweiwertigen Ionen, gefolgt von kurzfristigem Erhitzen und der sogenannten Elektroporation.
3.2.1) Behandlung der Zellkultur mit zweiwertigen Ionen, gefolgt von kurzfristigem Erhitzen.
In der Regel gibt es im Labor einen Kühlschrank mit einer Temperatur von etwa -80 Grad Celsius (manchmal werden sie zu Ehren eines der produzierenden Unternehmen als „Kelvinatoren“ bezeichnet), der mit Reagenzgläsern mit Zellen in der
logarithmischen Phase verstopft ist. Dies geschieht, um keine Zeit damit zu verschwenden, sie jedes Mal zu erstellen, wenn sie benötigt werden (und es nimmt viel Zeit in Anspruch, es wird nicht schneller als an einem Tag funktionieren). Und damit die Zellen während der Lagerung nicht durch Gefrieren absterben, werden dem Medium Kryoprotektiva zugesetzt: Glycerin, Propylenglykol oder Dimethylsulfoxid.
Laborkühlschrank nach Ansicht des Bildautors.Wenn ein Forscher einen bestimmten Stamm transformieren muss, entfernt er die Zellen aus dem Kelvinator und legt das Röhrchen in Eis. Dann werden zweiwertige Kationen und der Plasmidvektor, den wir benötigen, zu den Zellen in der
logarithmischen Wachstumsphase hinzugefügt. Das Reagenzglas darf das Eis nicht verlassen. Ein typischer Donor solcher Kationen ist Calciumchlorid (CaCl2). In diesem Fall ist unser zweiwertiges Kation Ca2 +. Es gibt keine eindeutige Erklärung dafür, wie Ca2 + der DNA hilft, in die Bakterien einzudringen:
- Einige Quellen behaupten, dass hohe Ca2 + -Konzentrationen Lücken in der Zellmembran und DNA-Schäden verursachen, und wir haben früher festgestellt, dass DNA-Schäden ein Signal für die Kompetenz der Zelle sind;
- Anderen Quellen zufolge dienen diese Ionen als „Brücke“, die den Plasmidvektor an die Zelle bindet. Tatsache ist, dass positiv geladene Ionen gleichzeitig an negativ geladene Gruppen von Polysacchariden auf der äußeren Membran von Bakterien und an negativ geladene Gruppen von Plasmid-DNA binden. Wenn das Medium keine Ionen enthalten würde, würde die DNA aus der Zelle abgestoßen, und dies ist für den Forscher völlig nutzlos.
Es ist möglich, dass beide Hypothesen wahr sind.
Der vermutete Mechanismus der Beteiligung von Ca2 + -Ionen an der Transformation. Erstens binden sich Ionen an negativ geladene Gruppen von DNA (gelbe Kreise) und Polysacchariden, die in der Membran verankert sind (gelbe Kreise). Dann wird aufgrund des Ions eine Art Brücke gebildet: "Polysaccharid (-)" - "Ca-Ion (2+)" - "DNA (-)", die DNA auf der Zelloberfläche fixiert.Nach einer bakteriellen Inkubation bei einer Temperatur nahe Null wird der sogenannte Hitzeschock erzeugt - eine kurzfristige Erwärmung der Kultur auf 42 Grad. Typischerweise beträgt die Dauer der Wärmebehandlung 30-45 Sekunden. Danach kehrt das Reagenzglas mit den Bakterien in das Eisbad zurück (bei längerem Hitzeschock können die Zellen absterben). Mögliche Gründe für die Wirksamkeit des Hitzeschocks sind dieselben Mechanismen: Hohe Temperaturen können DNA und Proteine schädigen (dies führt zu Kompetenz) und können auch „Löcher“ in der Zellmembran erzeugen, durch die durch Calciumionen an die Membran gebundene Plasmidvektoren eindringen.
Dann werden die Zellen auf Petrischalen mit selektivem Medium ausplattiert und Kolonien wachsen darauf.
3.2.2) Elektroporation
Grundlage des
Elektroporationsverfahrens ist die Tatsache, dass das elektrische Feld die Zellmembran beschädigen kann. Das heißt, Elektroporation ist buchstäblich die Erzeugung von Poren durch ein elektrisches Feld.
Zunächst werden Bakterien und ein Plasmidvektor in ein spezielles Röhrchen (Küvette) gegeben. Dann wird die Küvette in eine spezielle Vorrichtung gegeben, die für den Bruchteil einer Sekunde eine Potentialdifferenz von 0,1 bis 10 kV erzeugt, was wiederum zu einer reversiblen Schädigung der Membranen führt und Vektoren können frei in die Zellen eindringen. Nach einiger Zeit wird die Bakterienkultur auf Petrischalen mit selektivem Medium ausgesät.
Eine wichtige Voraussetzung für das flüssige Medium, in dem sich die Zellen und der Vektor zum Zeitpunkt der Elektroporation befinden, ist eine geringe Ionenkonzentration. Andernfalls kann ein Kurzschluss auftreten.
Nachwort
Jede Kolonie auf einer Platte ist der proliferierende Nachkomme
eines einzelnen Bakteriums (das heißt, wenn wir 100 Kolonien auf einer Platte sehen, bedeutet dies, dass es anfangs 100 lebensfähige Bakterien gab, die sich dann zu teilen begannen).
Nachdem die Kolonien auf den Schalen erscheinen, wählt der Forscher eine der Kolonien aus und überträgt die Zellen von der Kolonie auf ein neues selektives flüssiges Nährmedium. Nachdem eine neue Zellkultur "aufgewachsen" ist, wird sie erneut auf eine neue Tasse mit demselben selektiven Nährmedium gepflanzt. Als Ergebnis erhalten wir eine Tasse, auf der nur die Nachkommen von Bakterien aus einer einzelnen Kolonie wachsen (das heißt, sie sind alle Klone eines einzelnen Bakteriums). Und nur diese Zellen werden in Zukunft verwendet, um das Protein zu erhalten, das wir in großen Mengen flüssigen selektiven Nährmediums benötigen.Lassen Sie uns die Zwischenergebnisse zusammenfassen:- Wir haben das Gen synthetisiert, das wir brauchen.
- Fügen Sie es in einen geeigneten Plasmidvektor ein;
- Ein geeigneter Produzentenstamm wurde ausgewählt und transformiert;
- Habe eine Klonkultur;
- Schließlich haben wir einen Teil dieser Klone auf ein großes Volumen Nährmedium übertragen, um das benötigte Protein in einem großen Volumen zu erhalten.
Der nächste Schritt: Das Protein aus der resultierenden Biomasse in möglichst reiner Form zu isolieren. Aber das ist eine ganz andere Geschichte.