
Wenn eine bestimmte Temperatur überschritten wird, wird die Zelle unbrauchbar und stirbt ab. Eine der einfachsten Erklärungen für eine solche Hitzeunverträglichkeit ist, dass die lebensnotwendigen Proteine diejenigen sind, die Energie aus Lebensmitteln oder Sonnenlicht extrahieren, sich gegen Eindringlinge verteidigen, Abfall zerstören usw. - haben oft eine überraschend genaue Form. Ausgehend von langen Strängen werden sie dann in Form von Spiralen, "Haarnadeln" und anderen Formen verdreht, die durch die Reihenfolge ihrer Komponenten vorgegeben sind. Und diese Formen spielen bei ihren Aktivitäten eine große Rolle. Aber wenn die Temperatur zu steigen beginnt, werden die Bindungen, die die Proteinstrukturen halten, aufgebrochen: zuerst die schwächsten und dann die stärksten. Es ist logisch, dass der Ausbreitungsverlust der Proteinstruktur tödlich sein sollte, aber bis vor kurzem waren die Details, wie genau dies überhitzte Zellen abtötet, unklar.
Jetzt haben Biophysiker der Schweizerischen Technischen Hochschule Zürich das Verhalten jedes Proteins in den Zellen von vier verschiedenen Organismen mit steigender Temperatur untersucht. Diese Studie und die umfangreiche Sammlung von Daten, die
in der Fachzeitschrift Science gesammelt wurden, zeigten, dass bei einer Temperatur, die für den Tod einer Zelle ausreicht - menschliche oder Escherichia coli E. coli-Zellen - nur wenige Schlüsselproteine zerstört werden. Darüber hinaus war die Häufigkeit von Proteinen in den Zellen unerwartet mit ihrer Stabilität verbunden. Studien haben es Wissenschaftlern ermöglicht, sich schnell mit den Grundregeln vertraut zu machen, nach denen die Arbeit von Proteinen und ihre Ordnung aufgebaut sind und deren Folgen, wie sich herausstellte, weit über den einfachen Tod durch Hitze hinausgehen.
Paola Piccotti , die Biophysikerin, die die Arbeit leitete, erklärte, dass die Experimente von alten und ungelösten Fragen getrieben wurden: Warum überleben einige Zellen bei hohen Temperaturen, während andere sterben? Das Bakterium Thermus thermophilus lebt glücklich in heißen Quellen und in Haushaltsheizungen [bei einer optimalen Temperatur von 65 ° C - ca. trans.], während E. coli-Zellen bei Temperaturen über 40 ° C schmachten. Überzeugende Beweise legen nahe, dass es hier um die unterschiedliche Stabilität der Proteine dieser Organismen geht. Es ist jedoch sehr unpraktisch, den Überblick über das Protein in einer lebenden Zelle zu behalten, was eine ideale Untersuchungsmethode wäre. Die Isolierung des Proteins in einem Reagenzglas gibt nicht alle Antworten, da die Proteine im Körper zusammenkleben und die Chemie des anderen beeinflussen oder sich gegenseitig in der erforderlichen Form unterstützen. Um zu verstehen, was genau und warum es auseinander fällt, ist es notwendig, die Proteine zu einem Zeitpunkt zu beobachten, an dem sie sich noch gegenseitig beeinflussen.
Wie Hitze Proteine zerstört
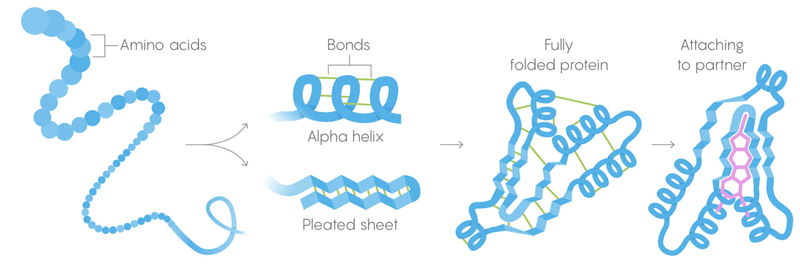 1) Die Primärstruktur von Proteinen besteht aus langen Ketten von Aminosäuren, die zu Sequenzen kombiniert werden, die von Genen gegeben sind.
1) Die Primärstruktur von Proteinen besteht aus langen Ketten von Aminosäuren, die zu Sequenzen kombiniert werden, die von Genen gegeben sind.
2) Die Sekundärstruktur ist eine Aminosäure, die sich ebenfalls in Konfigurationen faltet, die von schwachen intermolekularen Bindungen gehalten werden.
3) Tertiärstruktur - schwache Bindungen, die die Position von geraden und verdrillten Abschnitten der dreidimensionalen Struktur des Proteins stabilisieren. Ihre Position ermöglicht es dem Protein, an die gewünschten Moleküle zu binden.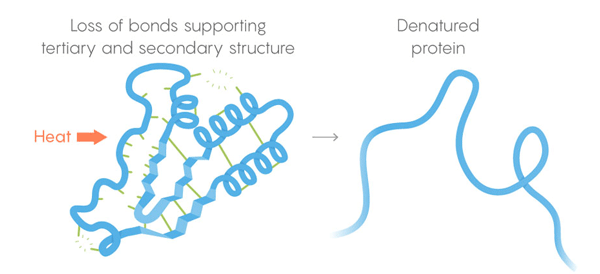 Thermischer Tod. Schwache Bindungen verlieren ihre Fähigkeit, Tertiär- und Sekundärstrukturen beizubehalten, und die Proteindenaturierung entfaltet sich, dh sie entfaltet sich. Aber nicht alle Proteine entfalten sich bei der gleichen Temperatur - die Umgebung des Proteins in der Zelle kann es zusätzlich stabilisieren.
Thermischer Tod. Schwache Bindungen verlieren ihre Fähigkeit, Tertiär- und Sekundärstrukturen beizubehalten, und die Proteindenaturierung entfaltet sich, dh sie entfaltet sich. Aber nicht alle Proteine entfalten sich bei der gleichen Temperatur - die Umgebung des Proteins in der Zelle kann es zusätzlich stabilisieren.Um die Aufgabe zu lösen, entwickelte das Team ein automatisiertes Überwachungsverfahren. Sie schneiden die Zellen und erhitzen ihren Inhalt in Stufen, wobei sie in jeder Stufe die Enzyme freisetzen, die die Proteine trennen. Diese Enzyme können besonders ungefaltete Proteine schneiden, sodass Forscher anhand der Reste der geschnittenen Proteine beurteilen können, welche Proteine bei einer bestimmten Temperatur auseinanderfallen. So konnten sie Denaturierungskurven für jedes der Tausenden untersuchten Proteine erstellen. Die Bögen der Kurven gehen von der unberührten Struktur des Proteins bei einer angenehmen Temperatur in einen vollständig entwickelten Zustand bei hoher Temperatur über. Um nach Unterschieden zwischen den Kurven verschiedener Arten von Lebewesen zu suchen, wurden Experimente an Zellen von Menschen, E. coli, T. thermophilus und Hefe durchgeführt. "Die Studie war wunderschön", sagte
Alan Drummond , Biologe an der Universität von Chicago, und bezog sich sowohl auf den Umfang als auch auf die Genauigkeit des Prozesses.
Während der Beobachtungen wurde deutlich, dass sich die Proteine aller Lebewesen mit zunehmender Temperatur nicht auf einmal abrollen. "Wir haben gesehen, dass nur eine kleine Untergruppe von Proteinen in den frühen Stadien zusammengebrochen ist", sagte Piccotti, "und dies waren Schlüsselproteine." In einem Diagramm mit der Verflechtung von Protein-Protein-Bindungen hatten die zerbrechlichsten Proteine aus dieser kleinen Untergruppe häufig eine große Anzahl von Bindungen, was bedeutet, dass sie viele Prozesse beeinflussen, die in Zellen ablaufen. "Ohne diese Proteine können Zellen nicht funktionieren", sagte Piccotti. "Wenn sie verschwinden, wird das gesamte Netzwerk zerstört." Und damit stoppt offensichtlich das Leben der Zelle.
Dieses Paradoxon - die wichtigsten Proteine erweisen sich als die zerbrechlichsten - spiegelt möglicherweise wider, wie die Evolution sie geschaffen hat, um die entsprechenden Aufgaben auszuführen. Wenn ein Protein viele Rollen hat, kann seine Instabilität und seine Tendenz zur Expansion und zum Kollaps von Vorteil sein, da es verschiedene Formen annehmen kann, die für verschiedene Aufgaben geeignet sind. "Viele dieser Schlüsselproteine haben eine große Flexibilität, was sie weniger stabil macht", erklärt Piccotti, dass sie gleichzeitig an verschiedene Zielmoleküle in der Zelle binden können. „Wahrscheinlich gehen sie so mit ihren Funktionen um. Das ist ein Kompromiss. “
Nach sorgfältiger Untersuchung von E. coli, für die die gesammelten Daten von höchster Qualität waren, fanden die Forscher einen Zusammenhang zwischen der Proteinhäufigkeit - der Anzahl der Kopien in der Zelle - und ihrer Stabilität. Je mehr Kopien ein Protein von einer Zelle macht, desto mehr Temperatur ist erforderlich, um sie zu zerstören. Es stellt sich heraus, dass eine große Anzahl von Kopien nicht mit der Kritikalität des Proteins für das Überleben korreliert. Einige Schlüsselproteine sind sehr selten. Diese Verbindung zwischen Fülle und Zuverlässigkeit bestätigt die Idee, die Drummond vor zehn Jahren aufgestellt hat - das zelluläre System, das Proteine herstellt, neigt dazu, von Zeit zu Zeit Fehler zu machen. Fehler destabilisieren normalerweise das Protein. Wenn festgestellt wird, dass dieses Protein reichlich vorhanden ist und ein solches Protein hundert- oder tausendmal am Tag in der Zelle vorkommt, können falsch gefaltete Kopien, die in großen Mengen hergestellt wurden, die Zelle verstopfen. Daher wäre es für den Körper vorteilhaft, sich so zu entwickeln, dass die am häufigsten vorkommenden Proteine auch die stabilsten sind, was durch die vom Piccotti-Team erhaltenen Daten bestätigt wird.
Um zu verstehen, welche Eigenschaften eines Proteins es stabil machen, verglichen die Forscher Daten von E. coli und T. Thermophilus. Proteine von E. coli begannen bei 40 ° C auseinanderzufallen und wurden bei 70 ° C fast vollständig abgebaut. Bei dieser Temperatur fühlten sich T. thermophilus-Proteine jedoch gerade unwohl - einige von ihnen behielten ihre Form auch bei 90 ° C bei. Das Team stellte fest, dass T. thermophilus normalerweise kürzere Proteine aufwies und einige Arten von Proteinformen und -komponenten bei den stabilsten häufiger vorkamen.
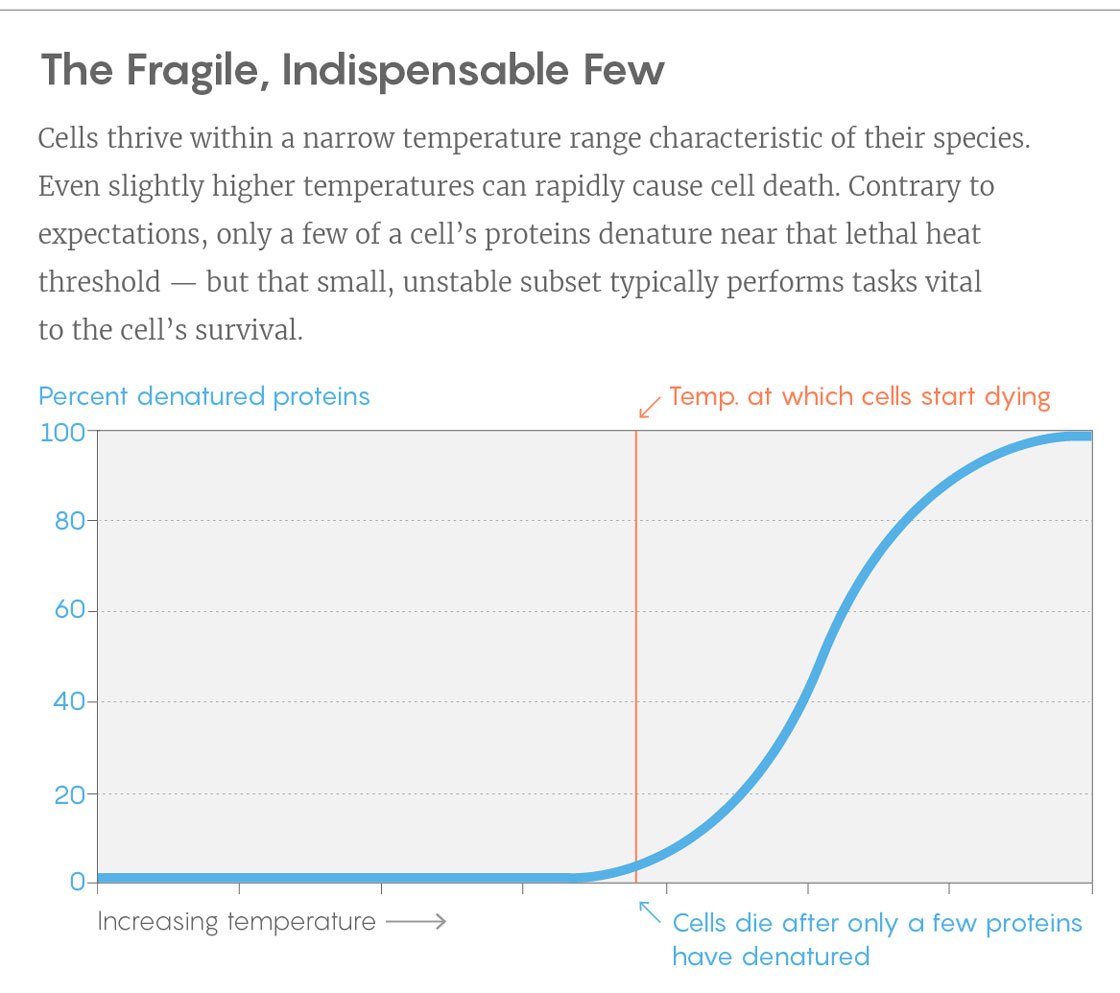 Ein Beispiel für eine Kurve aus einem Experiment. Vertikal - Prozentsatz der entfalteten Proteine, horizontal - Temperatur. Der vertikale Balken ist die Temperatur, bei der die Zellen zu sterben beginnen. Drehen Sie dazu nur einige Schlüsselproteine um.
Ein Beispiel für eine Kurve aus einem Experiment. Vertikal - Prozentsatz der entfalteten Proteine, horizontal - Temperatur. Der vertikale Balken ist die Temperatur, bei der die Zellen zu sterben beginnen. Drehen Sie dazu nur einige Schlüsselproteine um.Entdeckungen können Forschern helfen, Proteine zu entwickeln, deren Stabilität auf ihre Bedürfnisse zugeschnitten ist. In vielen industriellen Prozessen, in denen Bakterien verwendet werden, erhöht eine Erhöhung der Temperatur die Rückgabe - aber ziemlich bald beginnen die Bakterien an der Hitze zu sterben. Es wäre interessant zu wissen, ob wir Bakterien stabilisieren können, indem wir Schlüsselproteine temperaturbeständiger machen, sagte Piccotti.
Die Fülle an Informationen darüber, wie leicht sich bestimmte Proteine entfalten können, hat einige Biologen sehr erfreut. Die Wahrscheinlichkeit seiner Aggregation hängt direkt von der Stabilität des Proteins ab: dem Auftreten von Klumpen unentwickelter Proteine, die aneinander haften. Proteinaggregate können zu einem Albtraum für Zellen werden und die Umsetzung der Hauptaufgaben beeinträchtigen. Zum Beispiel wird ihnen vorgeworfen, einige schwerwiegende neurologische Probleme wie die Alzheimer-Krankheit verursacht zu haben, bei denen Plaques ungefalteter Proteine das Gehirn verstopfen.
 Paola Piccotti
Paola PiccottiDies bedeutet jedoch nicht, dass die Aggregation nur bei Organismen auftritt, die an bestimmten Krankheiten leiden. Im Gegenteil, die Forscher erkannten, dass es möglich ist, dass es ständig passiert und dass gesunde Zellen Methoden haben, mit denen sie damit umgehen. "Ich denke, dieses Phänomen wird immer häufiger", sagte Michele Vendruscolo, Biochemiker an der Universität von Cambridge. „Die meisten Proteine falten sich nicht richtig und aggregieren innerhalb der Zellen. Das Wichtigste, was das Piccotti-Team festgelegt hat, ist die Zeitspanne, in der sich ein ausgewähltes Protein im expandierten Zustand befindet. Diese Zeit bestimmt den Grad der möglichen Proteinaggregation. “ Einige Proteine drehen sich fast nie um und aggregieren nicht, andere verhalten sich unter bestimmten Bedingungen, während andere dies ständig tun. Laut dem Biochemiker wird eine detaillierte Beschreibung der Proteine in der neuen Arbeit die Untersuchung und das Verständnis dieser Unterschiede zwischen Proteinen erheblich erleichtern. Einige der Denaturierungskurven zeigen an, dass ihre Proteine nach dem Entfalten aggregieren. "Sie haben es geschafft, beide Phasen zu verfolgen - sowohl die Bereitstellung als auch die anschließende Aggregation", sagte Vendruscolo. "Das ist das Schöne an dieser Studie."
Und obwohl viele Wissenschaftler aufgrund der von ihnen verursachten Schäden an Aggregaten interessiert sind, betrachten einige dieses Phänomen aus einem anderen Blickwinkel. Drummond sagt, es wird klar, dass einige Aggregate nicht nur Müllstücke sind, die in einem Käfig hängen. Sie enthalten aktive Proteine, die weiterhin ihre Funktionen erfüllen.
Stellen Sie sich aus der Ferne vor, Sie sehen Rauch aus einem Gebäude aufsteigen, sagt Drummond. Um das Gebäude herum sehen Sie einige Figuren, und Sie stellen sich vor, dass dies Leichen sind, die aus den Ruinen stammen. Aber wenn Sie näher kommen, werden Sie vielleicht feststellen, dass es sich um lebende Menschen handelt, die aus einem brennenden Gebäude geflohen sind und auf das Ende des Vorfalls warten. Dies ist bei der Untersuchung von Aggregaten der Fall, sagt Drummond: Forscher stellen fest, dass die Proteine in den Aggregaten keine Opfer, sondern Überlebende sind. "Jetzt wächst ein neues Gebiet der Wissenschaft in einem explosiven Tempo", sagt er.
Die Verklumpung von Proteinen ist möglicherweise kein Zeichen einer Schädigung, sondern eine Möglichkeit für das Protein, seine Funktionen in einer schwierigen Situation aufrechtzuerhalten. Es kann sie beispielsweise vor der Umwelt schützen. Und wenn sich die Bedingungen verbessern, können Proteine die Aggregate verlassen und sich wieder falten. „Ihre Form ändert sich mit der Temperatur so, dass es auf den ersten Blick nicht richtig zu falten scheint“, sagt Drummond. "Aber das macht einen anderen Sinn." In einem
Artikel in der Zeitschrift Cell aus dem Jahr 2015 identifizierten er und seine Kollegen 177 Hefeproteine, die ihre Funktionen nach dem Eintritt in die Aggregate beibehielten. In einem im März veröffentlichten Artikel beschrieb dieses Team, dass wenn eines der Proteine so verändert würde, dass es nicht aggregieren könnte, dies zu ernsthaften Problemen bei der Funktion der Zelle führen würde.
Im Allgemeinen behauptet die Arbeit, dass Proteine überraschend dynamische Strukturen sind. Auf den ersten Blick mögen sie wie starre Maschinen erscheinen, die an festen Aufgaben arbeiten, für die eine bestimmte Form geeignet ist. Tatsächlich können Proteine während ihrer normalen Funktion verschiedene Formen annehmen. Und zum richtigen Zeitpunkt kann sich ihre Form so sehr ändern, dass es den Anschein hat, als würden sie sich verschlechtern, obwohl sie sich im Gegenteil verstärken. Auf molekularer Ebene kann das Leben dauerhafte Verbindungen und Trennungen von Bindungen sein.