Klassifikation von depressiven Störungen; die Rolle von Monoaminen (Dopamin, Noradrenalin und Serotonin); Wirkmechanismen von Antidepressiva; Depressionen, Stress und Neuroplastizität.
Depression (aus lat.
Deprimo - unterdrücken) - eine psychische Erkrankung, die durch eine
"depressive Triade" gekennzeichnet ist und die folgenden Störungen umfasst:
1.
Im emotionalen Bereich. Depressive Stimmung und Anhedonie - die Unfähigkeit, natürliche Dinge zu genießen: Essen, Alkohol, Geselligkeit, Sex usw.
2. In der kognitiven Sphäre. Ein negatives Selbstbild, eine negative Welterfahrung, eine negative Zukunftsvision - das ist die sogenannte
„kognitive Triade“ . Die Triade innerhalb der Triade + eine Person ist nicht in der Lage, die Situation angemessen einzuschätzen, kann die bisherigen positiven Erfahrungen bei der Lösung des Problems nicht anwenden.
3.
In der motorischen Sphäre. In der Regel motorische Hemmung, aber es kann auch zu einer Rückreaktion kommen - aufgeregte Erregung: Ein Patient in einer ruhigen Umgebung kann ständig aufspringen, die Arme schwingen, seine Haltung ständig ändern oder beispielsweise mitten in einem Gespräch aufstehen und gehen.
 Psychiatrie: Ein nationaler Leitfaden. M.: GEOTAR-Media, 2009.1000 s.
Psychiatrie: Ein nationaler Leitfaden. M.: GEOTAR-Media, 2009.1000 s.Es gibt zusätzliche Symptome: Verlust oder gesteigerter Appetit (Verlust oder Gewichtszunahme), Schlafstörungen (Schläfrigkeit oder Schlaflosigkeit), ein Gefühl der Müdigkeit, erhöhte Müdigkeit usw.
Laut WHO (Newsletter Nr. 369) leiden mehr als 300 Millionen Menschen an Depressionen, und dieser Indikator nimmt tendenziell zu. Depressionen unterscheiden sich von gewöhnlichen Stimmungsschwankungen und kurzfristigen emotionalen Reaktionen auf Probleme im Alltag. Es kann zu ernsthaften Gesundheitsproblemen, sozialer Fehlanpassung, schlechter Leistung und Lernen führen. Im schlimmsten Fall kann es zum Selbstmord kommen.
Jährlich sterben etwa 800.000 Menschen an den Folgen von Selbstmord - die zweithäufigste Todesursache bei Menschen im Alter von 15 bis 29 Jahren.
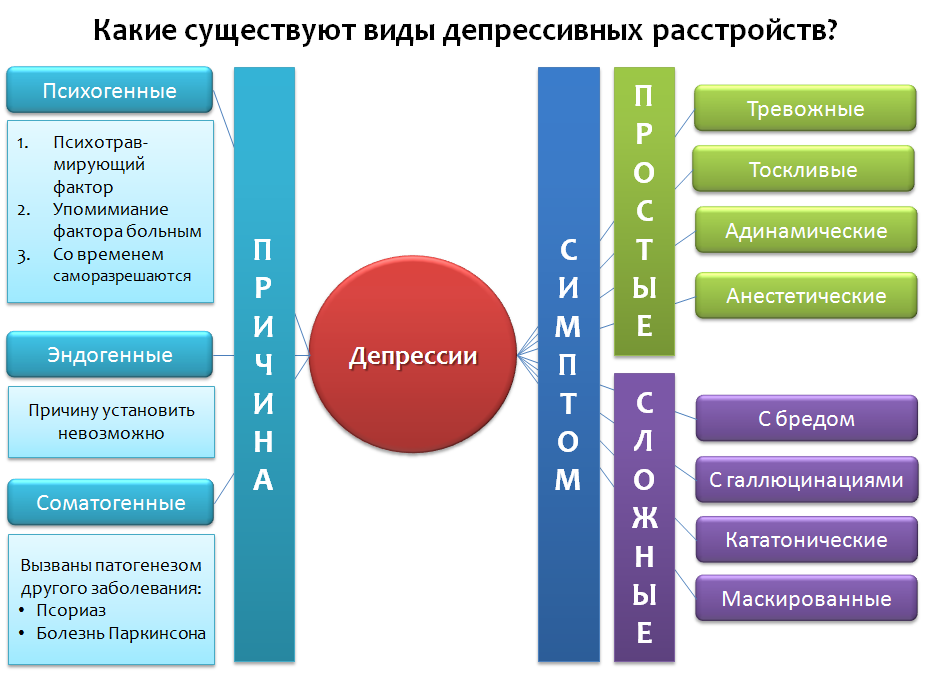 Abb. 1 Depression: Die Behandlung und Behandlung von Depressionen bei Erwachsenen (aktualisierte Ausgabe). Leicester (UK): British Psychological Society, 2010.
Abb. 1 Depression: Die Behandlung und Behandlung von Depressionen bei Erwachsenen (aktualisierte Ausgabe). Leicester (UK): British Psychological Society, 2010.Werfen wir einen Blick auf die vereinfachte Klassifizierung depressiver Störungen (Abb. 1), die nicht absolut ist, sondern grundlegende Beispiele enthält. Depressionen können aufgrund des Grundes, der sie verursacht hat (Ätiologie) und des Vorherrschens bestimmter Symptome sowie ihrer verschiedenen Kombinationen klassifiziert werden.
Im ersten Fall können drei Kategorien unterschieden werden:
1.
Psychogene (reaktive) Depression durch einen traumatischen Faktor. Dieser Faktor erscheint in der Rede des Patienten. In der Regel können sich solche Depressionen im Laufe der Zeit von selbst auflösen, wobei der Faktor „Zeit heilt“ aufhört.
2.
Endogen - Depressionen, die vermutlich interne Faktoren sind, die nicht festgestellt werden können.
3.
Somatogen - verursacht durch die Pathogenese (Mechanismus der Entwicklung der Krankheit) verschiedener Krankheiten. Es ist wichtig, sie nicht mit psychogenen zu verwechseln. Wenn eine Person beispielsweise eine Depression hat,
weil sie sich des Vorhandenseins einer Krankheit
bewusst ist, handelt es sich um eine psychogene (reaktive) Depression. Somatogen sind solche Depressionen, die durch den Mechanismus einer anderen Krankheit verursacht werden. Beispielsweise sterben bei der Parkinson-Krankheit Nervenzellen, die Dopamin produzieren, ab, was wiederum eine wichtige Rolle bei der emotionalen Reaktion spielt. Dopaminmangel in den Bereichen des Gehirns, die für die emotionale Reaktion verantwortlich sind, führt zu Depressionen. Ein zweites Beispiel ist die Psoriasis, die zu einer Verringerung der Produktion von Serotonin (einem wichtigen Stimmungsregulator) im Zentralnervensystem führen und somit das Risiko für die Entwicklung depressiver Störungen erhöhen kann.
Entsprechend dem vorherrschenden Symptom einer Depression kann es sein: ängstlich, trostlos, dynamisch, anästhetisch (Mangel an Emotionen - „emotionale Anästhesie“) - dies sind Beispiele für
„einfache Depression“ .
"Komplexe Depressionen" kombinieren die Symptome von Depressionen und anderen Psychopathologien: Depressionen mit Wahnvorstellungen, Halluzinationen, katatonischen, maskierten - die Symptome tarnen sich als Erkrankungen der inneren Organe oder "somatisieren" auf andere Weise - Kopfschmerzen, Bauchschmerzen, Herz usw.
Die Komplexität der Behandlung von depressiven Störungen ist das Fehlen einer vollständigen Genesung bei schweren oder komplizierten Formen von depressiven Störungen. Eine Selbstauflösung dieser Krankheit ist aber auch möglich, wenn der Verlauf nicht schwerwiegend ist, es keine Komplikationen in Form von Symptomen anderer Psychopathologien usw. gibt.
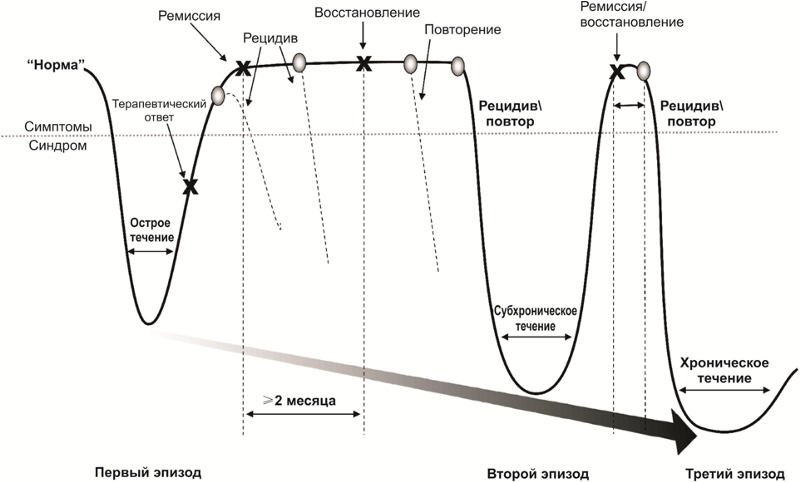 Die Art des Verlaufs depressiver Störungen
Die Art des Verlaufs depressiver StörungenNach einer erfolgreichen medikamentösen und psychotherapeutischen Behandlung beginnt eine Remissionsperiode, die entweder mit einer Schwächung (teilweise Remission) oder einem vollständigen Verschwinden der Symptome (vollständige Remission) der Krankheit einhergeht. Während der aktiven Behandlung und der teilweisen oder vollständigen Remission bleibt das Risiko bestehen, dass die Krankheitssymptome - Rückfall - wieder auftreten.
Darüber hinaus besteht das Risiko wiederholter Depressionen nach einer vollständigen Erholung von der ersten Episode. Wiederholte Episoden können durch eine Reihe anderer Symptome und einen schwereren Verlauf gekennzeichnet sein. Die Krankheit kann chronisch verlaufen. Oft ist die erste Episode einer depressiven Störung psychogen (reaktiv), und die wiederholten Episoden (falls das Problem unlösbar ist, war der traumatische Faktor zu stark oder langwierig) sind endogen.
Serotonin, Noradrenalin und Dopamin
Abbildung 2 fasst die Hauptparameter der Monoamin-Depressionstheorie zusammen.
Monoaminformeln erklären den Namen dieser Stoffgruppe - sie enthalten nur eine Aminogruppe (-NH2).
Die Rolle von Monoaminen bei der Entwicklung depressiver Symptome
 Abb. 2 Monoamin-Depressionstheorie* Eine andere NH-Gruppe von Serotonin ist keine Aminogruppe, sondern Teil des Indol-Heterocyclus.
Abb. 2 Monoamin-Depressionstheorie* Eine andere NH-Gruppe von Serotonin ist keine Aminogruppe, sondern Teil des Indol-Heterocyclus.Es wird angenommen, dass die Rolle von Monoaminen bei der Bildung einzelner Symptome einer Depression heterogen ist.
Für ein Gefühl von Schuld und Wertlosigkeit, Selbstmordgedanken sowie Appetitlosigkeit kann ein Serotoninmangel verantwortlich sein.
Dopamin und Noradrenalin sind für
Apathie, Funktionsstörungen der Exekutive und Müdigkeit verantwortlich .
Ein Mangel an
allen Monoaminen im Komplex weist auf eine
depressive Verstimmung, eine psychomotorische Dysfunktion und eine Schlafstörung hin.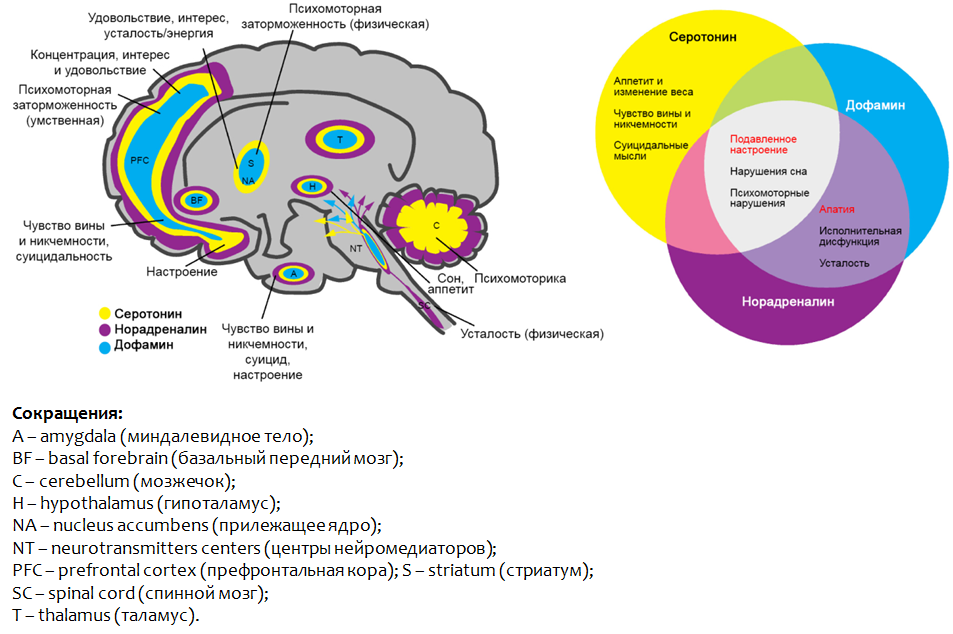 Abb. 3. Saltiel PF, Silvershein DI Major Depression: Mechanismusbasierte Verschreibung für personalisierte Medizin // Neuropsychiatr Dis Treat. 2015. 11. S. 875–88.
Abb. 3. Saltiel PF, Silvershein DI Major Depression: Mechanismusbasierte Verschreibung für personalisierte Medizin // Neuropsychiatr Dis Treat. 2015. 11. S. 875–88.Abbildung 3 zeigt die Teile des Gehirns, in denen eine Funktionsstörung der dargestellten Monoamine zur Entwicklung depressiver Symptome führt.
Wie bereits erwähnt, werden alle modernen klinisch wirksamen Antidepressiva im Rahmen der Monoamin-Theorie der Depression hergestellt.
Antidepressiva
Bedingt kann das Wirkprinzip von Antidepressiva in zwei Gruppen eingeteilt werden:
1. Mittel,
die die Konzentration von Monoaminen (hauptsächlich Serotonin und Noradrenalin) im Gehirn
erhöhen ;
2. Mittel,
die die Funktion von Monoaminen (hauptsächlich Serotonin) übernehmen und bestimmte Rezeptoren stimulieren.
 Abb. 4
Abb. 4Betrachten wir die Hauptgruppen der molekularen Mechanismen von Antidepressiva genauer. Abbildung 5 zeigt den synaptischen Kontakt zwischen zwei Nervenzellen: Oben ist das Nervenende eines Neurons (
Synapse ), unten eine andere Nervenzelle, die ein Signal empfängt.
Die wichtigsten molekularen Mechanismen von Antidepressiva im Kontext der Monoaminhypothese der Depression
 Abb. 5. Arzneimitteltherapie bei Depressionen und Angststörungen. Goodman und Gilman's Die pharmakologische Basis der Therapeutika. Zwölfte Ausgabe. 2011. Stahl SM Grundlegende Psychopharmakologie von Antidepressiva. Teil 1: Antidepressiva haben sieben unterschiedliche Wirkmechanismen // The Journal of Clinical Psychiatry. 1998. 59. Suppl 4. S. 5-14.
Abb. 5. Arzneimitteltherapie bei Depressionen und Angststörungen. Goodman und Gilman's Die pharmakologische Basis der Therapeutika. Zwölfte Ausgabe. 2011. Stahl SM Grundlegende Psychopharmakologie von Antidepressiva. Teil 1: Antidepressiva haben sieben unterschiedliche Wirkmechanismen // The Journal of Clinical Psychiatry. 1998. 59. Suppl 4. S. 5-14.Die Synthese von Neurotransmittern (Serotonin und Noradrenalin) erfolgt in Nervenzellen, mit deren Hilfe die Zellen ein Signal aneinander senden. Das Ausgangsmaterial für die Synthese sind essentielle Aminosäuren - L-Tryptophan und L-Phenylalanin. Nach der Synthese werden die Neurotransmitter in spezielle Granula -
Vesikel - gepackt, in denen sie sich zu den Nervenenden (
Synapsen ) bewegen und dort ablagern.
Nachdem die Zelle einen bestimmten Reiz erhalten hat, werden
Mediatoren vom Nervenende (Synapse) in die
synaptische Spalte - die Lücke zwischen zwei Nervenzellen - freigesetzt. Auf der Oberfläche der "empfangenden" Signalzelle befinden sich spezielle Proteinformationen -
Rezeptoren (in diesem Fall Serotonin und adrenerge Rezeptoren), die an den Mediator binden. Nach der Bindung aktiviert (stimuliert) der Mediator den entsprechenden Rezeptor, was zu einer Veränderung der Stoffwechselprozesse in der Zelle führt und dementsprechend seine Funktion verändert (verstärkt oder unterdrückt).
Nach erfolgreicher Erfüllung seiner Funktion werden 80% des Mediators zurück in die Nervenzelle eingefangen, wo ein Teil des Mediators durch das Enzym
Monoaminoxidase Typ A (MAO-A) zerstört wird und ein Teil zur Wiederverwendung wieder in Vesikel verpackt wird. Durch erneutes Einfangen des Mediators können die Energiekosten für die Synthese des Mediators aus Aminosäuren erheblich gesenkt werden.
 Abb. 6 Nachteile überwiegen und rechtfertigen die Suche nach neuen Hypothesen und Zielen.
Abb. 6 Nachteile überwiegen und rechtfertigen die Suche nach neuen Hypothesen und Zielen.Kurz darüber, wie Antidepressiva wirken

1. Verletzen Sie die Wiederaufnahme des Neurotransmitters in das Nervenende, wodurch seine Konzentration in der synaptischen Spalte erhöht und seine Wirkung auf Rezeptoren verstärkt wird. Es ist sowohl eine getrennte Verletzung der Wiederaufnahme von Serotonin (Fluoxetin, Fluvoxamin, Paroxetin) und Noradrenalin (Reboxetin, Atomoxetin) als auch eine gleichzeitige Verletzung der Erfassung beider Mediatoren (Amitriptylin) möglich.
2. Erhöhen Sie die Freisetzung von Mediatoren aus Nervenenden (Mirtazapin und
derzeit verbotenes Tianeptin).
3. Unterdrücken Sie die Aktivität des MAO-A-Enzyms und bewahren Sie dadurch den Mediator vor Zerstörung (Moclobemid).
4. Serotoninrezeptoren des 1. Subtyps (Vilazodon) werden stimuliert, deren Aktivierung mit der Linderung depressiver Symptome („gute“ Rezeptoren) verbunden ist.
5. Blockieren Sie Serotoninrezeptoren vom Typ 2 ("schlechte" Rezeptoren), die für die Entwicklung von Angstzuständen und depressiven Symptomen (Trazodon) verantwortlich sind.
Depression und Stress
Derzeit wird Stress die Rolle eines der Auslösemechanismen (Auslösemechanismen) von affektiven Störungen (Störungen der emotionalen Sphäre, Affekt), einschließlich depressiver Störungen, zugewiesen. Es wird angenommen, dass es nicht nur ein einmaliges und schweres Stressereignis ist, sondern auch eine weniger intensive und konstante Auswirkung von Stress, insbesondere alltägliche unvorhersehbare Stressereignisse. Es ist unmöglich, sich an solche stressigen Effekte anzupassen, und es führt zur chronischen Aktivierung von Abwehr- und Anpassungsmechanismen mit deren anschließender Erschöpfung.
Eine der wichtigsten Komponenten der physiologischen Reaktion des Körpers auf Stress ist die Hypothalamus-Hypophysen-Nebennieren-Achse (Abb. 7).
 Abb. 7. Varghese FP & Brown ES Die Hypothalamus-Hypophysen-Nebennieren-Achse bei schweren Depressionsstörungen: Eine kurze Einführung für Hausärzte // Begleiter der Grundversorgung des Journal of Clinical Psychiatry. 2001.3 (4). S. 151-155.
Abb. 7. Varghese FP & Brown ES Die Hypothalamus-Hypophysen-Nebennieren-Achse bei schweren Depressionsstörungen: Eine kurze Einführung für Hausärzte // Begleiter der Grundversorgung des Journal of Clinical Psychiatry. 2001.3 (4). S. 151-155.Die sukzessive Stressaktivierung der zentralen Strukturen (Mandeln - Hypothalamus - Hypophyse) führt zur Entwicklung von Hormonen der Nebennierenrinde - Glukokortikoide (Cortisol) - Stresshormone. Letztere können auf die Struktur des Gehirns einwirken (verantwortlich für die emotionale Stressreaktion (präfrontaler Kortex und Hippocampus)) und die Prozesse der Neuroplastizität stören.
Störungen der Neuroplastizität *
Verletzungen der Neuroplastizität führen zu einer Verletzung der normalen Verbindung zwischen den Strukturen des Gehirns (verantwortlich für die emotionale Reaktion).
* Neuroplastizität ist die Fähigkeit des Gehirns, sich durch Reorganisation, unter normaler Entwicklung und unter pathologischen Bedingungen an Veränderungen anzupassen.
 Abb. 8 Fuchs E., Flügge G. Neuroplastizität bei Erwachsenen: Mehr als 40 Jahre Forschung // Neuronale Plastizität. 2014. Artikel-ID 541870. Doi: 10.1155 / 2014/541870; Joyce Sh. Neuroplastizität und klinische Praxis: Aufbau von Gehirnleistung für die Gesundheit // Grenzen in der Psychologie. 7 (2016): 1118. PMC. Web 7. Mai 2017. Zilles K. Neuronale Plastizität als adaptive Eigenschaft des Zentralnervensystems // Annals of Anatomy. 1992. Vol. 174. Nein. 5. S. 383–391.
Abb. 8 Fuchs E., Flügge G. Neuroplastizität bei Erwachsenen: Mehr als 40 Jahre Forschung // Neuronale Plastizität. 2014. Artikel-ID 541870. Doi: 10.1155 / 2014/541870; Joyce Sh. Neuroplastizität und klinische Praxis: Aufbau von Gehirnleistung für die Gesundheit // Grenzen in der Psychologie. 7 (2016): 1118. PMC. Web 7. Mai 2017. Zilles K. Neuronale Plastizität als adaptive Eigenschaft des Zentralnervensystems // Annals of Anatomy. 1992. Vol. 174. Nein. 5. S. 383–391.Die wichtigsten im Zusammenhang mit depressiven Störungen sind der präfrontale Kortex, die Mandel und der Hippocampus.
Das Zusammenspiel der Gehirnstrukturen ist normal
 Abb. 9. Gorman JM, Docherty JP Eine hypothetische Rolle für den dendritischen Umbau in der Ätiologie von Stimmungs- und Angststörungen // The Journal of Neuropsychiatry and Clinical Neurosciences. 2010.22: 3. S. 256–264
Abb. 9. Gorman JM, Docherty JP Eine hypothetische Rolle für den dendritischen Umbau in der Ätiologie von Stimmungs- und Angststörungen // The Journal of Neuropsychiatry and Clinical Neurosciences. 2010.22: 3. S. 256–264Normalerweise verarbeitet der präfrontale Kortex die vom Hippocampus empfangenen Informationen (Gedächtnis, emotionale Färbung von Erinnerungen und Ereignissen), wenn eine vollständige Verbindung zwischen den Neuronen dieser Strukturen besteht. Die Mandel ist die Struktur, die für das Gefühl der Angst verantwortlich ist. Normalerweise unterdrückt der präfrontale Kortex die übermäßige Aktivität dieser Struktur.
Abb. 10Es ist bekannt, dass vor dem Hintergrund depressiver Störungen die Prozesse der Neuroplastizität gestört werden, insbesondere die Anzahl der Kontakte zwischen Nervenzellen abnimmt, sich die Geschwindigkeit der Impulsübertragung ändert und die Anzahl der Neuronen abnimmt. Zusätzlich wird vor dem Hintergrund einer Depression eine Abnahme des Volumens des Hippocampus und des präfrontalen Kortex festgestellt. Solche Änderungen tragen zur Störung der normalen funktionellen Beziehung zwischen den dargestellten Strukturen bei.
Depressive Symptome können offenbar durch diese Veränderungen vermittelt werden: Die unkontrollierte Angst, die häufig bei Patienten mit Depressionen auftritt, kann auf die fehlende Hemmung der Mandel durch den präfrontalen Kortex zurückzuführen sein.
Das Zusammenspiel von Hirnstrukturen bei Depressionen (Theorie)
 Abb. 11. Gorman JM, Docherty JP Eine hypothetische Rolle für den dendritischen Umbau in der Ätiologie von Stimmungs- und Angststörungen. Das Journal of Neuropsychiatry and Clinical Neurosciences. 2010.22 (3). S. 256–64. Kudryashov N.V. Eine experimentelle Untersuchung der psychotropen Aktivität der Pyrazolo [c] pyridinderivate GIZH-72 und Pyrrolodiazepin GMAL-24 unter Bedingungen von unvorhersehbarem chronisch mäßigem Stress / Dissertation des Kandidaten der Biowissenschaften. 14.03.06. M., 2016. 198 p.
Abb. 11. Gorman JM, Docherty JP Eine hypothetische Rolle für den dendritischen Umbau in der Ätiologie von Stimmungs- und Angststörungen. Das Journal of Neuropsychiatry and Clinical Neurosciences. 2010.22 (3). S. 256–64. Kudryashov N.V. Eine experimentelle Untersuchung der psychotropen Aktivität der Pyrazolo [c] pyridinderivate GIZH-72 und Pyrrolodiazepin GMAL-24 unter Bedingungen von unvorhersehbarem chronisch mäßigem Stress / Dissertation des Kandidaten der Biowissenschaften. 14.03.06. M., 2016. 198 p.Die Unfähigkeit, die Situation angemessen einzuschätzen und die bisherigen positiven Erfahrungen zu nutzen, ist das Ergebnis einer Verletzung der Verbindung zwischen dem präfrontalen Kortex und dem Hippocampus. Eine Verringerung des Volumens des Hippocampus kann eine pathologisch reduzierte Stimmung erklären.
Die Mechanismen der Regulation der Neuroplastizität bei depressiven Störungen
Abb. 12Ein wichtiger Regulator der Prozesse der Neuroplastizität ist der
neurotrophe Faktor des
Gehirns (BDNF - vom
Gehirn abgeleiteter neurotropher Faktor ), dessen Spiegel aufgrund von Stress und Depression abnehmen.
Stresshormone wie Cortisol, ein von der Nebennierenrinde produziertes Glukokortikosteroid, können auch als negative Regulatoren der Neuroplastizität wirken. Es ist bekannt, dass die meisten der verwendeten Antidepressiva (bei chronischer Anwendung) die BDNF-Spiegel erhöhen können, und dies ist anscheinend Teil ihrer therapeutischen Wirkung.
Eigenschaften des cerebralen neurotrophen Faktors (BDNF *) und die Aussicht auf seine Verwendung als Antidepressivum
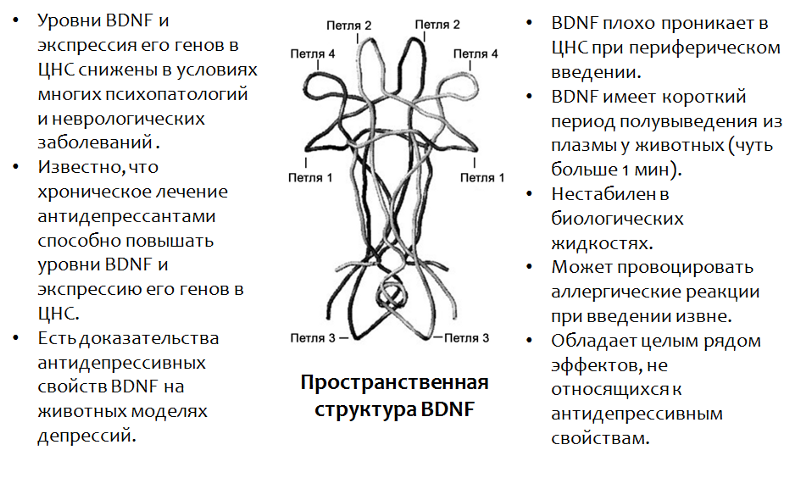 Abb. 13. Castrén E., Rantamäki T. Die Rolle von BDNF und seinen Rezeptoren bei Depressionen und Antidepressiva: Reaktivierung der Entwicklungsplastizität // Entwicklungsneurobiologie. 2010.70 (5). S. 289–97.
Abb. 13. Castrén E., Rantamäki T. Die Rolle von BDNF und seinen Rezeptoren bei Depressionen und Antidepressiva: Reaktivierung der Entwicklungsplastizität // Entwicklungsneurobiologie. 2010.70 (5). S. 289–97.* BDNF spielt eine wichtige Rolle in vielen Psychopathologien, einschließlich und Depression. Die Verwendung von BDNF selbst ist aus einer Reihe von Gründen (die in der Abbildung aufgeführt sind) nicht möglich.
Neben Antidepressiva gibt es noch andere Faktoren, die zu einem Anstieg der BDNF-Spiegel im Zentralnervensystem beitragen und mit positiven Stimuli der Neuroplastizität zusammenfallen - Training, Bewegung, neue Erfahrungen, Ernährung usw. Darüber hinaus können diese Faktoren häufig die medikamentöse Therapie bei depressiven Störungen ergänzen.
14 zeigt Daten zu einer Studie der antidepressiven Eigenschaften von BDNF selbst in Tiermodellen (Ratten). Da BDNF selbst während der peripheren Verabreichung nicht in das Gehirn (durch die Blut-Hirn-Schranke) eindringen kann, wurde BDNF in den Experimenten direkt in das Gehirn injiziert.
Die Untersuchung der antidepressiven Eigenschaften des cerebralen neurotrophen Faktors (BDNF) in Tiermodellen
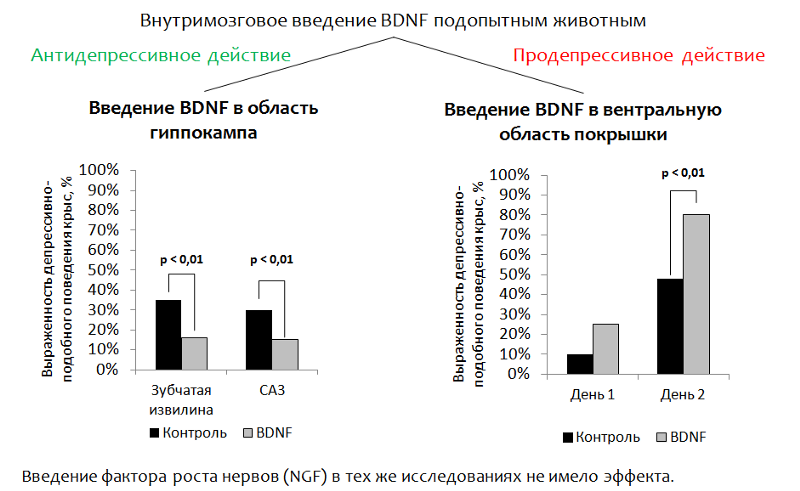 Fig. 14 Eisch AJ, Bolaños CA, de Wit J. et al. Vom Gehirn abgeleiteter neurotropher Faktor im ventralen Mittelhirn-Nucleus-accumbens-Weg: eine Rolle bei Depressionen // Biologische Psychiatrie. 2003.54 (10). S. 994-1005; Shirayama Y., Chen AC, Nakagawa S., Russell DS, Duman RS Der vom Gehirn abgeleitete neurotrophe Faktor erzeugt antidepressive Wirkungen in Verhaltensmodellen von Depressionen. Journal of Neuroscience. 2002.22 (8). S. 3251–61.
Fig. 14 Eisch AJ, Bolaños CA, de Wit J. et al. Vom Gehirn abgeleiteter neurotropher Faktor im ventralen Mittelhirn-Nucleus-accumbens-Weg: eine Rolle bei Depressionen // Biologische Psychiatrie. 2003.54 (10). S. 994-1005; Shirayama Y., Chen AC, Nakagawa S., Russell DS, Duman RS Der vom Gehirn abgeleitete neurotrophe Faktor erzeugt antidepressive Wirkungen in Verhaltensmodellen von Depressionen. Journal of Neuroscience. 2002.22 (8). S. 3251–61.1.
Einführung in den Hippocampus . Die Hauptidee war die gezielte Einführung von BDNF in den Bereich des Gehirns, der für die Neurogenese verantwortlich ist (der Gyrus dentatus des Hippocampus ist eine der sogenannten
"neurogenen Nischen" ). Nach der Verabreichung wurde das depressive Verhalten der Tiere bewertet.
(Die dysphorische Komponente der Depression wird bewertet. Tiere (Ratten oder Mäuse) werden in einen Zylinder mit Wasser gegeben, aus dem sie nicht alleine herauskommen können. Nach einiger Zeit werden die aktiven Versuche des Tieres, aus dem Zylinder herauszukommen, durch einen „Zustand der Verzweiflung“ ersetzt (das Tier befindet sich praktisch ohne Bewegungen im Wasser.)Die Verringerung der Immobilität (Immobilisierung) des Tieres wird als Korrelat der antidepressiven Wirkung angesehen. BDNF hatte eine antidepressive Wirkung nach Einführung in den Gyrus dentatus (neurogene Nische) und die CA3-Zone des Hippocampus (Neuronen dieser Zone sorgen für eine Interaktion des Gyrus dentatus mit anderen Bereichen des Hippocampus).
2.
Als BDNF in den ventralen Bereich des Reifens eingeführt wurde (die Zone, die für die Dopaminproduktion verantwortlich ist und an depressiven Störungen leidet), wurde der gegenteilige Effekt festgestellt - eine Zunahme des depressiven Verhaltens.
Mimetika
Da es nicht möglich ist, BDNF selbst als Arzneimittel zu verwenden, wird ein auf diesem Faktor basierendes Arzneimittel entwickelt. Insbesondere die aktiven Regionen des BDNF-Moleküls wurden gut untersucht (deren räumliche Struktur die Namensschleife bestimmt. Abb. 15).
Derzeit werden Mimetika (Substanzen, die die Aktivität nachahmen) von BDNF aktiv untersucht.
Entwicklung einer neuen Generation von Arzneimitteln auf der Basis des cerebralen neurotrophen Faktors (BDNF)
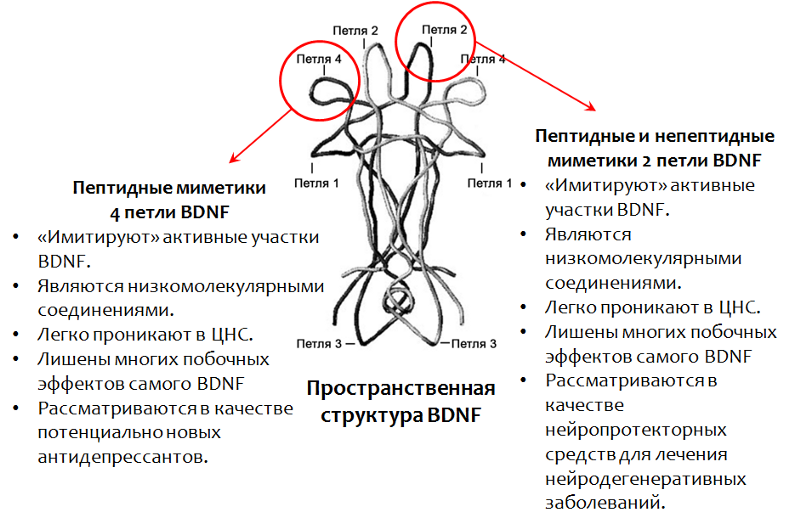 Abb. 15. Fletcher JM, Morton CJ, Zwar RA et al. Design eines konformationsdefinierten und proteolytisch stabilen zirkulären Mimetikums des aus dem Gehirn stammenden neurotrophen Faktors // The Journal of Biological Chemistry. 2008.283 (48). S. 33375–83. Massa SM, Yang T., Xie Y. et al. V BDNF-Mimetika mit kleinen Molekülen aktivieren die TrkB-Signalübertragung und verhindern die neuronale Degeneration bei Nagetieren // The Journal of Clinical Investigation. 2010.120 (5). S. 1774–85. Seredenin S.B., Voronina T.A., Gudasheva T.A. et al. Antidepressive Wirkung des ursprünglichen BDNF-Mimetikums mit niedrigem Molekulargewicht, des dimeren GSB-106-Dipeptids // Acta Naturae. 2013.4 (19). S. 116-120.
Abb. 15. Fletcher JM, Morton CJ, Zwar RA et al. Design eines konformationsdefinierten und proteolytisch stabilen zirkulären Mimetikums des aus dem Gehirn stammenden neurotrophen Faktors // The Journal of Biological Chemistry. 2008.283 (48). S. 33375–83. Massa SM, Yang T., Xie Y. et al. V BDNF-Mimetika mit kleinen Molekülen aktivieren die TrkB-Signalübertragung und verhindern die neuronale Degeneration bei Nagetieren // The Journal of Clinical Investigation. 2010.120 (5). S. 1774–85. Seredenin S.B., Voronina T.A., Gudasheva T.A. et al. Antidepressive Wirkung des ursprünglichen BDNF-Mimetikums mit niedrigem Molekulargewicht, des dimeren GSB-106-Dipeptids // Acta Naturae. 2013.4 (19). S. 116-120.Antidepressive Eigenschaften von Peptidmimetika 4 Schleifen des cerebralen neurotrophen Faktors (BDNF) - Verbindungen GSB-106
 Abb. 16. Seredenin S.B., Voronina T.A., Gudasheva T.A. et al. Antidepressive Wirkung des ursprünglichen BDNF-Mimetikums mit niedrigem Molekulargewicht, des dimeren GSB-106-Dipeptids // Acta Naturae. 2013.4 (19). S. 116-120.GSB-106 - eine Substanz der Peptidstruktur - ist ein mimetischer 4-Schleifen-BDNF (häusliche Entwicklung). Die Substanz hat in Tiermodellen unter verschiedenen Verabreichungsarten eine antidepressive Wirkung. Derzeit werden umfangreiche Studien zu den pharmakologischen Eigenschaften dieser Verbindung durchgeführt, um auf ihrer Grundlage eine neue Generation von Antidepressiva zu schaffen.
Abb. 16. Seredenin S.B., Voronina T.A., Gudasheva T.A. et al. Antidepressive Wirkung des ursprünglichen BDNF-Mimetikums mit niedrigem Molekulargewicht, des dimeren GSB-106-Dipeptids // Acta Naturae. 2013.4 (19). S. 116-120.GSB-106 - eine Substanz der Peptidstruktur - ist ein mimetischer 4-Schleifen-BDNF (häusliche Entwicklung). Die Substanz hat in Tiermodellen unter verschiedenen Verabreichungsarten eine antidepressive Wirkung. Derzeit werden umfangreiche Studien zu den pharmakologischen Eigenschaften dieser Verbindung durchgeführt, um auf ihrer Grundlage eine neue Generation von Antidepressiva zu schaffen.Neurogenese * und Depression
* Die Neurogenese ist ein mehrstufiger Prozess zur Bildung neuer Nervenzellen im reifen Zentralnervensystem, der eine adaptive Funktion des Nervensystems darstellt.
 Fuchs E., Flügge G. Neuroplastizität bei Erwachsenen: Mehr als 40 Jahre Forschung // Neuronale Plastizität. 2014. Artikel-ID 541870, doi: 10.1155 / 2014/541870Abb. 17In Abbildung 17 zeigen wir die neurogenen Zonen (Nischen) von Säugetieren:1) Der Gyrus dentatus des Hippocampus2) Die Riechkolben3) Die subventrikuläre ZoneEs wird angenommen, dass die wichtigste neurogene Nische beim Menschen der Hippocampus (Gyrus dentatus) ist.Stress, der als einer der Hauptauslöser von depressiven Störungen angesehen wird, führt zu einer Abnahme des BDNF-Spiegels und einer Zunahme des Cortisols, was wiederum die Wirkung von Glutamat auf das Zentralnervensystem verstärkt.
Fuchs E., Flügge G. Neuroplastizität bei Erwachsenen: Mehr als 40 Jahre Forschung // Neuronale Plastizität. 2014. Artikel-ID 541870, doi: 10.1155 / 2014/541870Abb. 17In Abbildung 17 zeigen wir die neurogenen Zonen (Nischen) von Säugetieren:1) Der Gyrus dentatus des Hippocampus2) Die Riechkolben3) Die subventrikuläre ZoneEs wird angenommen, dass die wichtigste neurogene Nische beim Menschen der Hippocampus (Gyrus dentatus) ist.Stress, der als einer der Hauptauslöser von depressiven Störungen angesehen wird, führt zu einer Abnahme des BDNF-Spiegels und einer Zunahme des Cortisols, was wiederum die Wirkung von Glutamat auf das Zentralnervensystem verstärkt. Abb. 18Diese Veränderungen unterdrücken insgesamt die Neurogenese des Hippocampus und führen zu einer Verringerung des Volumens des Hippocampus. Unter der Wirkung von Glutamat ist auch Apoptose (programmierter Tod von Nervenzellen) möglich. Bei Verletzung der Neurogenese kann das Gehirn den Verlust nicht vollständig kompensieren und es treten depressive Symptome auf.Glutamat ist eine der wichtigsten exzitatorischen Aminosäuren des Zentralnervensystems. Eine Verletzung der Neuroplastizität unter dem Einfluss der übermäßigen Wirkung von Glutamat ist offenbar mit einer Ausgleichsreaktion verbunden. Neuronen „entfernen“ unnötige Verbindungen und sterben ab (Apoptose), um das Zentralnervensystem vor Übererregung und nachfolgenden schädlichen Folgen dieses Prozesses zu schützen.Eine bekannte Tatsache ist die Fähigkeit von Antidepressiva, die Neurogenese zu stimulieren. Die diesem Phänomen zugrunde liegenden Mechanismen sind jedoch noch nicht vollständig untersucht worden. Es ist bekannt, dass alle Gruppen von Antidepressiva auf das Monoaminsystem des Gehirns einwirken und die funktionellen oder materiellen Defizite von Serotonin und Noradrenalin ausgleichen. Darüber hinaus erhöhen Arzneimittel dieser pharmakologischen Gruppe den Spiegel des cerebralen neurotrophen Faktors.
Abb. 18Diese Veränderungen unterdrücken insgesamt die Neurogenese des Hippocampus und führen zu einer Verringerung des Volumens des Hippocampus. Unter der Wirkung von Glutamat ist auch Apoptose (programmierter Tod von Nervenzellen) möglich. Bei Verletzung der Neurogenese kann das Gehirn den Verlust nicht vollständig kompensieren und es treten depressive Symptome auf.Glutamat ist eine der wichtigsten exzitatorischen Aminosäuren des Zentralnervensystems. Eine Verletzung der Neuroplastizität unter dem Einfluss der übermäßigen Wirkung von Glutamat ist offenbar mit einer Ausgleichsreaktion verbunden. Neuronen „entfernen“ unnötige Verbindungen und sterben ab (Apoptose), um das Zentralnervensystem vor Übererregung und nachfolgenden schädlichen Folgen dieses Prozesses zu schützen.Eine bekannte Tatsache ist die Fähigkeit von Antidepressiva, die Neurogenese zu stimulieren. Die diesem Phänomen zugrunde liegenden Mechanismen sind jedoch noch nicht vollständig untersucht worden. Es ist bekannt, dass alle Gruppen von Antidepressiva auf das Monoaminsystem des Gehirns einwirken und die funktionellen oder materiellen Defizite von Serotonin und Noradrenalin ausgleichen. Darüber hinaus erhöhen Arzneimittel dieser pharmakologischen Gruppe den Spiegel des cerebralen neurotrophen Faktors.Antidepressiva können die Neurogenese stimulieren
 Abb. 19Die Stimulierung der Neurogenese ist für Antidepressiva charakteristisch, unabhängig von ihrem Wirkmechanismus, ihrer chemischen Struktur oder Klasse. Daher sollte die Suche nach Regulationsmechanismen der Neurogenese in Eigenschaften durchgeführt werden, die allen Antidepressiva gemeinsam sind. Solche gemeinsamen Eigenschaften sind die Aktivität von Antidepressiva gegen Serotonin und Noradrenalin.Heute entsteht eine Idee über die Rolle von Serotonin bei der Regulation der Hippocampusneurogenese.
Abb. 19Die Stimulierung der Neurogenese ist für Antidepressiva charakteristisch, unabhängig von ihrem Wirkmechanismus, ihrer chemischen Struktur oder Klasse. Daher sollte die Suche nach Regulationsmechanismen der Neurogenese in Eigenschaften durchgeführt werden, die allen Antidepressiva gemeinsam sind. Solche gemeinsamen Eigenschaften sind die Aktivität von Antidepressiva gegen Serotonin und Noradrenalin.Heute entsteht eine Idee über die Rolle von Serotonin bei der Regulation der Hippocampusneurogenese.Mögliche Mechanismen der neurogenen Aktivität von Antidepressiva
 Abb. 20. Alenina N., Klempin F. Die Rolle von Serotonin bei der Neurogenese des Hippocampus bei Erwachsenen. Behavioral Brain Research. 2015. 277. S. 49–57.Erstens erhält der Gyrus dentatus des Hippocampus eine Serotoninregulation von den großen Kernen der Naht (die Ansammlung von Nervenzellen, die Serotonin produzieren; im Hirnstamm), sowohl direkt als auch über interkaläre Neuronen, die verschiedene Subtypen von Serotoninrezeptoren auf ihrer Oberfläche tragen.Zweitens wurden Serotoninrezeptoren des Subtyps 1A an Stammzellen selbst nachgewiesen , was auf die potenzielle Fähigkeit von Serotonin hinweist, Hirnstammzellen zu regulieren.
Abb. 20. Alenina N., Klempin F. Die Rolle von Serotonin bei der Neurogenese des Hippocampus bei Erwachsenen. Behavioral Brain Research. 2015. 277. S. 49–57.Erstens erhält der Gyrus dentatus des Hippocampus eine Serotoninregulation von den großen Kernen der Naht (die Ansammlung von Nervenzellen, die Serotonin produzieren; im Hirnstamm), sowohl direkt als auch über interkaläre Neuronen, die verschiedene Subtypen von Serotoninrezeptoren auf ihrer Oberfläche tragen.Zweitens wurden Serotoninrezeptoren des Subtyps 1A an Stammzellen selbst nachgewiesen , was auf die potenzielle Fähigkeit von Serotonin hinweist, Hirnstammzellen zu regulieren.Die Mechanismen der neurogenen Aktivität von Antidepressiva
 Abb. 21Wie in experimentellen Studien (an Tieren und Zellkulturen) gezeigt, können selektive Serotonin-Wiederaufnahmehemmer (SSRIs, ein klassisches Medikament aus dieser Gruppe - Fluoxetin) das Proliferationsstadium der Neurogenese im Hippocampus stimulieren.Der vorgeschlagene Mechanismus ist eine Erhöhung der Serotoninkonzentration (5-HT - Serotonin, auch als 5-Hydroxytryptamin bekannt) im Zentralnervensystem und die anschließende (verstärkte) Stimulation der Serotoninneurogenese. Rezeptoren des Serotonin-Subtyps 1A (5HT1A-Rezeptoren) können auch alspotenzielle Ziele für Antidepressiva während der Neurogenese dienen. Diese Annahmen stimmen mit Daten über die positive (therapeutische) Wirkung der Aktivierung von Serotonin-5-HT1A-Rezeptoren durch Antidepressiva (z. B. Vilazodon) vor dem Hintergrund depressiver Störungen überein.Ein weiteres Argument, das es uns ermöglicht, die Stimulation der Neurogenese als Hauptwirkungsmechanismus von Antidepressiva zu betrachten, ist die zeitliche Übereinstimmung zwischen dem durchschnittlichen Zeitpunkt des Einsetzens der therapeutischen Wirkung (2 bis 7 Wochen) und dem vollständigen Zyklus der Neurogenese (3-7 Wochen).Zusätzlich zu diesen Mechanismen zeigen SSRI-Antidepressiva auch die Fähigkeit, die BDNF-Spiegel zu erhöhen, aber die Mechanismen dieses Effekts sind unbekannt.
Abb. 21Wie in experimentellen Studien (an Tieren und Zellkulturen) gezeigt, können selektive Serotonin-Wiederaufnahmehemmer (SSRIs, ein klassisches Medikament aus dieser Gruppe - Fluoxetin) das Proliferationsstadium der Neurogenese im Hippocampus stimulieren.Der vorgeschlagene Mechanismus ist eine Erhöhung der Serotoninkonzentration (5-HT - Serotonin, auch als 5-Hydroxytryptamin bekannt) im Zentralnervensystem und die anschließende (verstärkte) Stimulation der Serotoninneurogenese. Rezeptoren des Serotonin-Subtyps 1A (5HT1A-Rezeptoren) können auch alspotenzielle Ziele für Antidepressiva während der Neurogenese dienen. Diese Annahmen stimmen mit Daten über die positive (therapeutische) Wirkung der Aktivierung von Serotonin-5-HT1A-Rezeptoren durch Antidepressiva (z. B. Vilazodon) vor dem Hintergrund depressiver Störungen überein.Ein weiteres Argument, das es uns ermöglicht, die Stimulation der Neurogenese als Hauptwirkungsmechanismus von Antidepressiva zu betrachten, ist die zeitliche Übereinstimmung zwischen dem durchschnittlichen Zeitpunkt des Einsetzens der therapeutischen Wirkung (2 bis 7 Wochen) und dem vollständigen Zyklus der Neurogenese (3-7 Wochen).Zusätzlich zu diesen Mechanismen zeigen SSRI-Antidepressiva auch die Fähigkeit, die BDNF-Spiegel zu erhöhen, aber die Mechanismen dieses Effekts sind unbekannt.Die Wirkung von Fluoxetin (Prozac) auf die Neurogenese nichtmenschlicher Primaten
 Abb. 22. Perera TD, Dwork AJ, Keegan KA et al. Notwendigkeit der Hippocampus-Neurogenese für die therapeutische Wirkung von Antidepressiva bei erwachsenen nichtmenschlichen Primaten // PLoS ONE. 2011.6 (4): e17600. doi: 10.1371 / journal.pone.0017600.Studien an Primaten (dem relevantesten Tiermodell) haben die Fähigkeit von Fluoxetin (Handelsname "Prozac") gezeigt, die Neurogenese gegen Stress zu stimulieren (in diesem Fall wurde ein Isolationsstressmodell verwendet). 22 zeigt, dass Fluoxetin die Proliferationsrate (Teilung) von Stammnervenzellen im Hippocampus von Primaten signifikant (statistisch signifikant) erhöhte.
Abb. 22. Perera TD, Dwork AJ, Keegan KA et al. Notwendigkeit der Hippocampus-Neurogenese für die therapeutische Wirkung von Antidepressiva bei erwachsenen nichtmenschlichen Primaten // PLoS ONE. 2011.6 (4): e17600. doi: 10.1371 / journal.pone.0017600.Studien an Primaten (dem relevantesten Tiermodell) haben die Fähigkeit von Fluoxetin (Handelsname "Prozac") gezeigt, die Neurogenese gegen Stress zu stimulieren (in diesem Fall wurde ein Isolationsstressmodell verwendet). 22 zeigt, dass Fluoxetin die Proliferationsrate (Teilung) von Stammnervenzellen im Hippocampus von Primaten signifikant (statistisch signifikant) erhöhte.Die Wirkung von Fluoxetin auf die Neurogenese nichtmenschlicher Primaten
 Abb. 23. Perera TD, Dwork AJ, Keegan KA et al. Notwendigkeit der Hippocampus-Neurogenese für die therapeutische Wirkung von Antidepressiva bei erwachsenen nichtmenschlichen Primaten // PLoS ONE. 2011.6 (4): e17600. doi: 10.1371 / journal.pone.0017600.Die Wirkung von Stress führte zu einer Abnahme der Granulatschicht des Gyrus dentatus des Hippocampus - der neurogenen Hauptzone des Gehirns der Primaten. Die Verabreichung von Fluoxetin vor dem Hintergrund einer stressigen Exposition verhinderte diese Änderung und hielt das Volumen dieser Struktur (Gesamtvolumen) normal.
Abb. 23. Perera TD, Dwork AJ, Keegan KA et al. Notwendigkeit der Hippocampus-Neurogenese für die therapeutische Wirkung von Antidepressiva bei erwachsenen nichtmenschlichen Primaten // PLoS ONE. 2011.6 (4): e17600. doi: 10.1371 / journal.pone.0017600.Die Wirkung von Stress führte zu einer Abnahme der Granulatschicht des Gyrus dentatus des Hippocampus - der neurogenen Hauptzone des Gehirns der Primaten. Die Verabreichung von Fluoxetin vor dem Hintergrund einer stressigen Exposition verhinderte diese Änderung und hielt das Volumen dieser Struktur (Gesamtvolumen) normal.Die Wirkung von Fluoxetin auf die Neurogenese nichtmenschlicher Primaten
Korrelation zwischen Anhedonie (depressives Verhalten) und Neurogenese
Perera TD, Dwork AJ, Keegan KA et al. Notwendigkeit der Hippocampusneurogenese für die therapeutische Wirkung von Antidepressiva bei erwachsenen nichtmenschlichen Primaten. PLOS ONE. 2011.6 (4): e17600. doi: 10.1371 / journal.pone.0017600.Es wurde festgestellt, dass ein Zusammenhang zwischen der Stimulierung der Neurogenese durch Fluoxetin und der Verhinderung der Entwicklung eines depressiven Verhaltens (Anhedonie) besteht.
Bei der Untersuchung der Wirkung von Fluoxitin auf die Neurogenese nichtmenschlicher Primaten wurde eine zuverlässige Korrelation zwischen einer Abnahme der Neurogenese (verursacht durch Stress) und einer Zunahme des depressiven Verhaltens von Primaten (Anhedonie, die durch eine Kombination von sozialen und Essstörungen bestimmt wurde) sowie einer Korrelation zwischen der Stimulation der Neurogenese mit Fluoxetin und dem Fehlen einer Depression festgestellt -ähnliches Verhalten.
Noradrenalin ist ein weiteres wichtiges Monoamin, das neben Serotonin an der Regulation der Hippocampusneurogenese beteiligt ist.
Mögliche Mechanismen der neurogenen Aktivität von Antidepressiva
 Abb. 25. Jhaveri DJ, Mackay EW, Hamlin AS et al. Norepinephrin aktiviert adulte Hippocampus-Vorläufer direkt über adrenerge β3-Rezeptoren // The Journal of Neuroscience. 2010.30 (7). Z. 2795-2806. doi: 10.1523 / JNEUROSCI.3780-09-09.
Abb. 25. Jhaveri DJ, Mackay EW, Hamlin AS et al. Norepinephrin aktiviert adulte Hippocampus-Vorläufer direkt über adrenerge β3-Rezeptoren // The Journal of Neuroscience. 2010.30 (7). Z. 2795-2806. doi: 10.1523 / JNEUROSCI.3780-09-09.In Studien an Hippocampus-Neuronenkulturen wurde gezeigt, dass Noradrenalin (im Gegensatz zu Serotonin) die Anzahl der Stammzellen erhöht. Serotonin beeinflusste, wie zuvor gezeigt, nicht die Menge, sondern die Proliferationsrate.
Neben quantitativen Veränderungen verursachte Noradrenalin auch qualitative Veränderungen - es vergrößerte die Neurosphären, was im Elektronenmikroskopbild deutlich zu sehen ist (siehe Abb. 26).
Mögliche Mechanismen der neurogenen Aktivität von Antidepressiva
 Abb. 26. Jhaveri DJ, Mackay EW, Hamlin AS et al. Norepinephrin aktiviert adulte Hippocampus-Vorläufer direkt über adrenerge β3-Rezeptoren // The Journal of Neuroscience. 2010.30 (7). Z. 2795-2806. doi: 10.1523 / JNEUROSCI.3780-09-09.
Abb. 26. Jhaveri DJ, Mackay EW, Hamlin AS et al. Norepinephrin aktiviert adulte Hippocampus-Vorläufer direkt über adrenerge β3-Rezeptoren // The Journal of Neuroscience. 2010.30 (7). Z. 2795-2806. doi: 10.1523 / JNEUROSCI.3780-09-09.Die Rolle von Gliazellen bei der Bildung depressiver Störungen
Wir haben zuvor Veränderungen in Neuronen untersucht, aber die Rolle von Gliazellen bei der Bildung depressiver Störungen ignoriert. Experimentelle und klinische Studien weisen jedoch auf eine mögliche Rolle der Gliazellenpathologie bei der Pathogenese von Depressionen hin.
Die Rolle der Glia bei der Bildung depressiver Störungen
 Abb. 27. Rajkowska G., Miguel-Hidalgo JJ Gliogenese und Glia-Pathologie bei Depressionen // ZNS & neurologische Störungen Wirkstoffziele. 2007.6 (3). S. 219-233.
Abb. 27. Rajkowska G., Miguel-Hidalgo JJ Gliogenese und Glia-Pathologie bei Depressionen // ZNS & neurologische Störungen Wirkstoffziele. 2007.6 (3). S. 219-233.Die Forscher präsentierten ein Diagramm der Pathogenese depressiver Störungen mit Glia (Abb. 27).
Eine genetische Veranlagung kann Folgendes umfassen: einen erblichen Faktor (das Vorhandensein einer depressiven Störung bei einem der Elternteile erhöht das Risiko dieser Krankheit beim Kind); Genpolymorphismus: BDNF, Serotonintransporter (der an der Wiederaufnahme von Serotonin in Nerven- und Gliazellen beteiligt ist), Serotoninrezeptoren, Serotoninsyntheseenzyme (Tryptophanhydroxylase Typ 2).
Genetische Verwundbarkeit schafft in Kombination mit Umwelt- und Stressfaktoren ein günstiges Umfeld für die Entstehung einer depressiven Störung.Wissenschaftler haben herausgefunden, dass die Rolle von Gliazellen bei jungen und älteren Patienten nicht dieselbe ist (Abb. 28). Gliazellen können eine wichtige Rolle bei der Pathogenese der frühen Stadien depressiver Störungen spielen, was zu einer deutlichen Abnahme der Anzahl pyramidaler Neuronen im Erwachsenenalter führen kann.
Die Rolle von Gliazellen bei der Bildung depressiver Störungen ist bei jungen und älteren Patienten nicht dieselbe.
 Abb. 28. Rajkowska G., Miguel-Hidalgo JJ Gliogenese und Glia-Pathologie bei Depressionen // ZNS & neurologische Störungen Drug Targets. 2007.6 (3). S. 219-233.
Abb. 28. Rajkowska G., Miguel-Hidalgo JJ Gliogenese und Glia-Pathologie bei Depressionen // ZNS & neurologische Störungen Drug Targets. 2007.6 (3). S. 219-233.Insbesondere der Verlust der Gliazellenfunktion in jungen Jahren erhöht das Risiko, im Alter wiederholt Depressionen zu entwickeln, aber es wird bereits ein Mangel an pyramidalen Neuronen anstelle von Gliazellen bestehen.
 Abb. 29. Rajkowska G., Miguel-Hidalgo JJ Gliogenese und Glia-Pathologie bei Depressionen // ZNS & neurologische Störungen Wirkstoffziele. 2007.6 (3). S. 219-233.
Abb. 29. Rajkowska G., Miguel-Hidalgo JJ Gliogenese und Glia-Pathologie bei Depressionen // ZNS & neurologische Störungen Wirkstoffziele. 2007.6 (3). S. 219-233.Diese Dynamik steht im Einklang mit einer der wichtigsten Funktionen von Gliazellen - der Absorption von überschüssigem Glutamat aus der synaptischen Spalte (Kontakt zwischen Nervenzellen). Glutamat ist einer der wichtigsten exzitatorischen Neurotransmitter des Zentralnervensystems und seine übermäßige Wirkung kann zu einer Beeinträchtigung der Neuroplastizität und Exzitotoxizität führen (Neurotoxizität in Verbindung mit übermäßiger Erregung; es scheint eine Schutzreaktion der Nervenzellen vor Übererregung zu sein - die Anzahl der Neuronen und Verbindungen zwischen ihnen nimmt ab).
In Gliazellen gibt es ein Transporterprotein, das an der Übertragung von Glutamat von der synaptischen Spalte zur Gliazelle beteiligt ist, wo Glutamat metabolisiert wird.
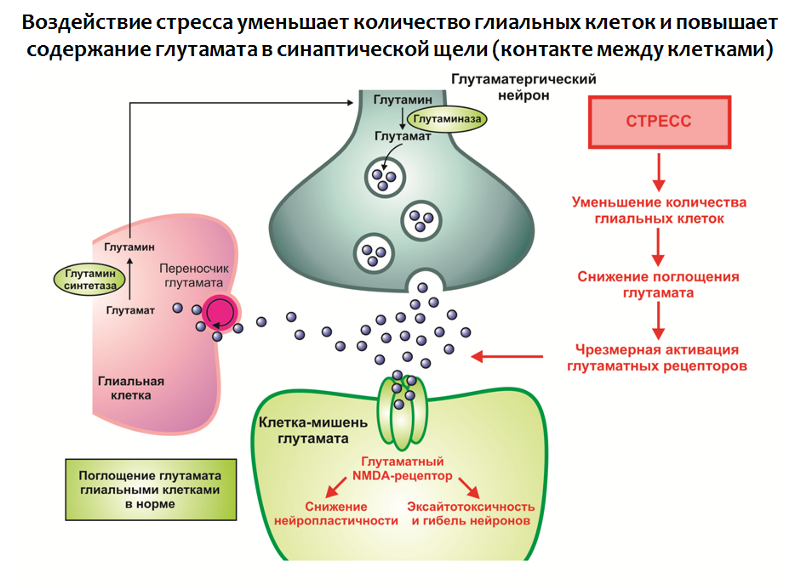 Abb. 30. Rajkowska G., Miguel-Hidalgo JJ Gliogenese und Glia-Pathologie bei Depressionen // ZNS & neurologische Störungen Arzneimittelziele. 2007.6 (3). S. 219-233.
Abb. 30. Rajkowska G., Miguel-Hidalgo JJ Gliogenese und Glia-Pathologie bei Depressionen // ZNS & neurologische Störungen Arzneimittelziele. 2007.6 (3). S. 219-233.Stress in Kombination mit anderen Faktoren führt zu:
1. Eine Abnahme der Anzahl von Gliazellen in den Strukturen des limbischen Systems des Gehirns;
2. Überproduktion von Glutamat.
Somit wird ein Überschuss dieses aufregenden Neurotransmitters gebildet, der einen negativen Modulator der Neuroplastizität darstellt (es wird angenommen, dass dies Teil einer Kompensationsreaktion sein kann, die das Nervensystem vor Übererregung schützt).
Die Funktion von Gliazellen ist nicht auf die Absorption von Glutamat beschränkt, sondern auch an der Produktion von Neurotrophinen, insbesondere BDNF, beteiligt (Abb. 31).
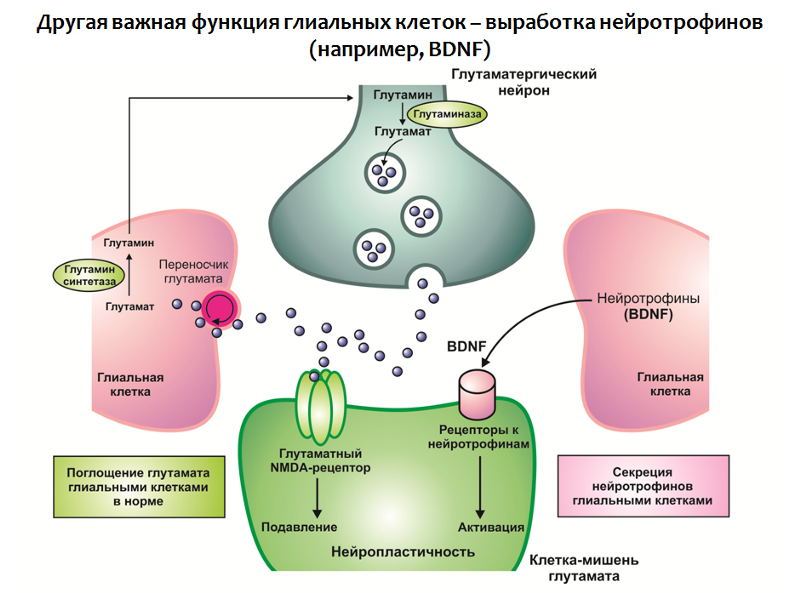 Abb. 31
Abb. 31Zusammengenommen führen ein Defizit an Neurotrophinen und ein Überschuss an Glutamat zu einer Verletzung der Neuroplastizität und depressiven Veränderungen (eine Abnahme des Volumens des Hippocampus und des präfrontalen Kortex, eine Verletzung der normalen funktionellen Verbindung zwischen den Strukturen des limbischen Kreises).
Im Rahmen dieses Konzepts lassen sich auch Erklärungen für die therapeutische Wirksamkeit von Antidepressiva finden (Abb. 32):
1. Antidepressiva können die Wirkung von Stress "mildern", indem sie die Aktivität der Hypothalamus-Hypophysen-Nebennieren-Achse normalisieren.
2. Erhöhen Sie die BDNF-Konzentration im Zentralnervensystem.
3. Stimulieren Sie die Prozesse der Neuroplastizität.
 Abb. 32
Abb. 32Abbildung 33 zeigt ein verallgemeinertes Schema für depressive Störungen, das auf dem Konzept der stressvermittelten Neurodegeneration basiert. Es ist ersichtlich, dass Antidepressiva die Nische der "Korrektoren der Auswirkungen von Stress" besetzen. Mit all den Vorteilen und dem therapeutischen Potenzial sind Antidepressiva nicht immer wirksam bei der Beseitigung depressiver Symptome.
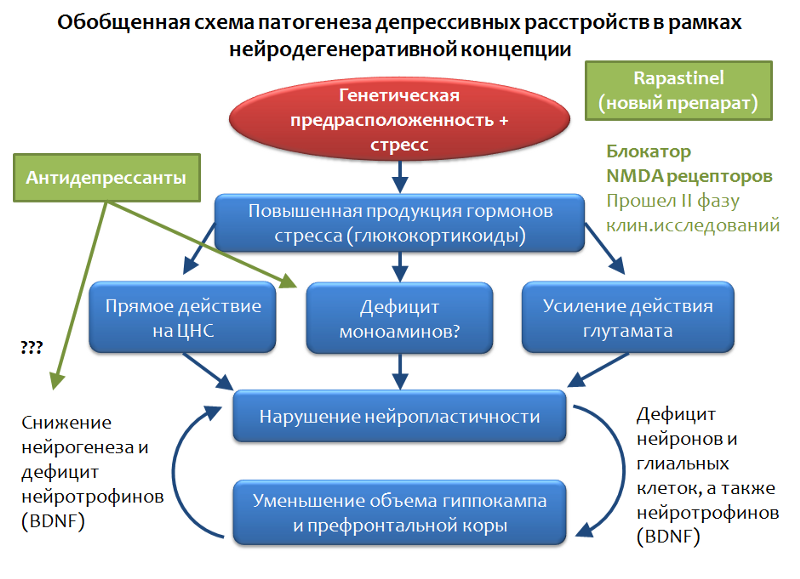 Abb. 33
Abb. 33Es gibt sogenannte pharmakotherapieresistente Formen depressiver Störungen. Sie versuchen, dieses Phänomen mit einer Vielzahl von Stressfaktoren, mit unterschiedlicher Stärke und Dauer der Belastung und mit individuellen Merkmalen (Mutation von Antidepressivum-Zielen) zu erklären. Aus dieser Situation lässt sich jedoch nur eine Schlussfolgerung ziehen: Die Suche nach grundlegend neuen Zielen für die Pharmakotherapie depressiver Störungen ist notwendig.
Neue Trends bei der Herstellung von Antidepressiva
Eine vielversprechende Richtung ist die Wirkung auf das Glutamatsystem, wenn wir diesen Neurotransmitter als eines der Schlüsselelemente bei der Pathogenese depressiver Störungen betrachten. Auf diesem Gebiet wurden bedeutende Erfolge erzielt - es wurde ein grundlegend neues Antidepressivum entwickelt, das durch seinen Mechanismus die
Glutamat-NMDA-Rezeptoren blockiert und die übermäßige Aktivität dieser Aminosäure verhindert. Rapasintel-Antidepressivum hat nun Phase I und II klinischer Studien erfolgreich bestanden, in denen es sich als hochwirksam erwiesen hat und als Behandlung für persistierende Formen depressiver Störungen gilt.
Im Rahmen der glutamatergen Theorie depressiver Störungen kann die Rolle des Haupthemmmediators des Zentralnervensystems - Gamma-Aminobuttersäure (GABA oder GABA) - betrachtet werden.
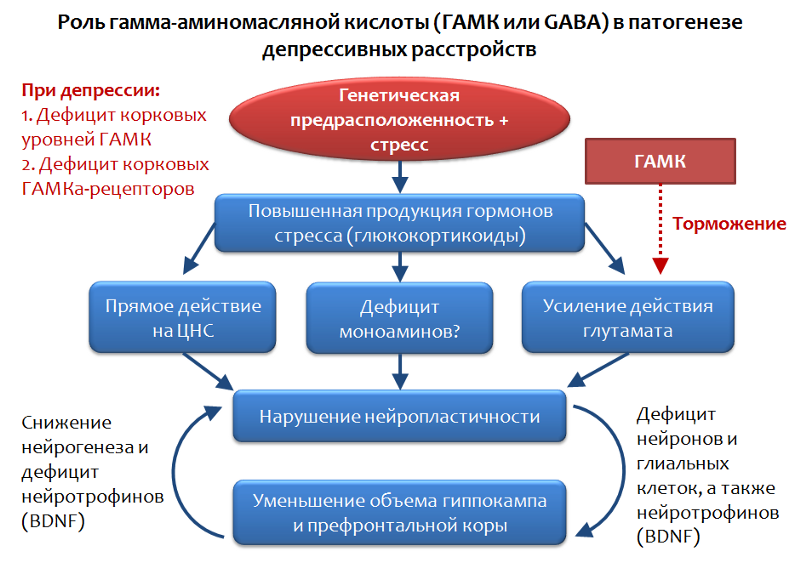 Abb. 34. Möhler H. Das GABA-System bei Angstzuständen und Depressionen und sein therapeutisches Potenzial // Neuropharmakologie. 2012. Jan. Jan. 62 (1). S. 42–53.
Abb. 34. Möhler H. Das GABA-System bei Angstzuständen und Depressionen und sein therapeutisches Potenzial // Neuropharmakologie. 2012. Jan. Jan. 62 (1). S. 42–53.GABA ist das funktionelle Gegenteil von Glutamat und kann seine stimulierende Wirkung begrenzen. Daher erscheint die Beurteilung der Rolle von GABA bei depressiven Störungen recht logisch.
Es wurde festgestellt, dass vor dem Hintergrund depressiver Störungen ein Mangel an kortikalen Spiegeln von GABA und seinen Rezeptoren beobachtet wird. Insbesondere Pyramiden-Neuronen, die Glutamat produzieren, können durch Interneurone, die GABA produzieren, gehemmt werden. GABA erkennt seine hemmende Wirkung durch Aktivierung des GABA-A-Rezeptors.
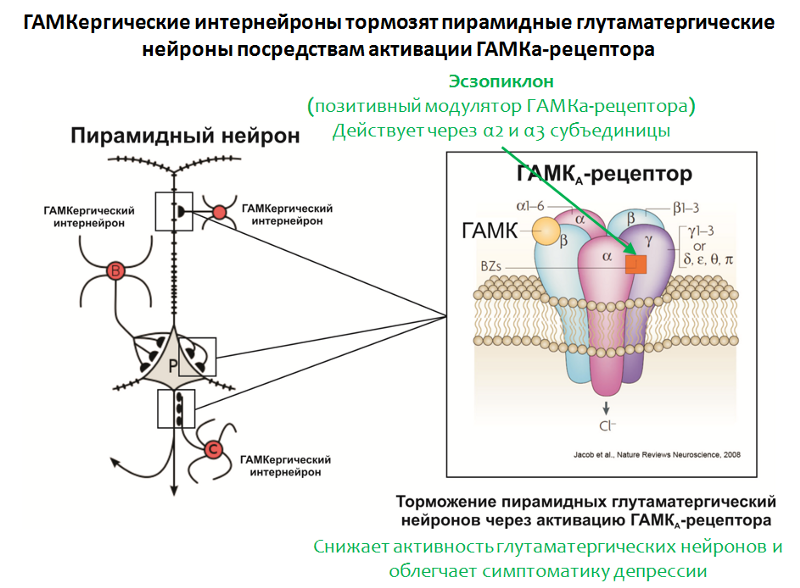 Abb. 35. Möhler H. Das GABA-System bei Angstzuständen und Depressionen und sein therapeutisches Potenzial // Neuropharmakologie. 2012. Jan. Jan. 62 (1). S. 42–53.Die Struktur des GABA-A-Rezeptors
Abb. 35. Möhler H. Das GABA-System bei Angstzuständen und Depressionen und sein therapeutisches Potenzial // Neuropharmakologie. 2012. Jan. Jan. 62 (1). S. 42–53.Die Struktur des GABA-A-Rezeptors ist in 35 gezeigt. Der Rezeptor besteht aus 5 Untereinheiten (2 & agr;, 2 & bgr; und & ggr;), jede Untereinheit hat einen Subtyp, beispielsweise sind 6 Varianten von & agr; -Untereinheiten bekannt. Die Kombination verschiedener Untereinheitenvarianten bestimmt den Subtyp des GABA-A-Rezeptors.
Zur Unterstützung der Rolle von GABA spricht auch die Wirksamkeit des positiven Modulators des GABA-A-Rezeptors Esopiclon. Das Ziel dieses Arzneimittels sind GABA-A-Rezeptoren, die in ihrer Zusammensetzung α2- und α3-Untereinheiten tragen.
Eszopiklon wird manchmal in Kombination mit Antidepressiva angewendet und lindert depressive Symptome auch nach Entzug von Antidepressiva erheblich. Es wird angenommen, dass seine therapeutische Wirkung mit einer Abnahme der Glutamatfunktion verbunden ist. Interessanterweise besitzen andere positive Modulatoren des GABA-A-Rezeptors (die die Anwesenheit anderer Varianten der α-Untereinheiten erfordern, beispielsweise
Zolpidem ) keine solche Aktivität.
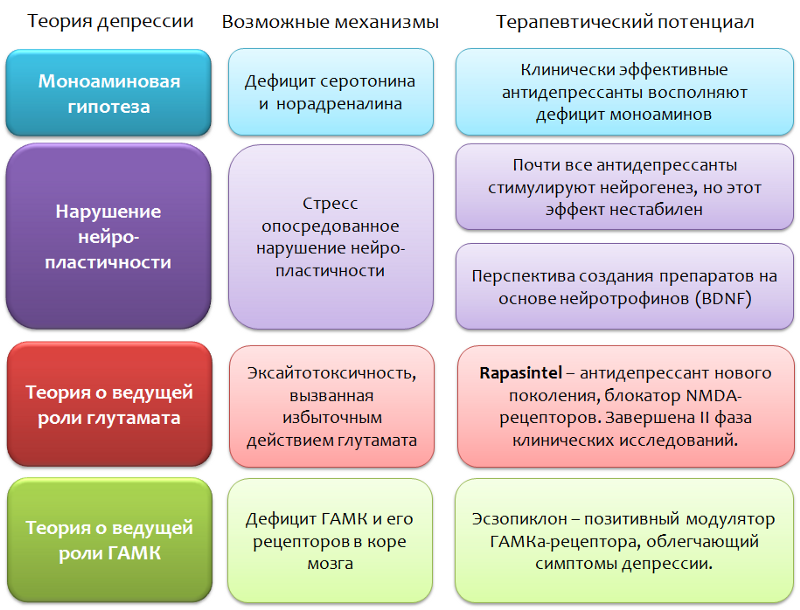 Abb. 36
Abb. 36In dem vorgestellten Schema (Abb. 37) fassen wir Daten zur Verletzung von Neuroplastizitätsprozessen und zur Entwicklung depressiver Symptome zusammen.
1) Die Unterdrückung der Prozesse der Neuroplastizität ist nicht streng spezifisch für depressive Störungen, sondern wird auch bei anderen Psychopathologien (Schizophrenie, bipolare affektive Störung) und neurologischen Erkrankungen (Multiple Sklerose, Parkinson-Krankheit, Alzheimer-Krankheit) beobachtet.
2) In Tiermodellen blockiert die Unterdrückung der Stammzellproliferation durch chemische Mittel nicht die Wirkung von Antidepressiva (im Gegensatz zu Röntgenstrahlen, bei denen der gegenteilige Effekt festgestellt wird).
3) Die Ressource der Neurogenese kann begrenzt sein und eine übermäßige Stimulation kann zu Erschöpfung führen.
4) Die Langzeiteffekte einer längeren künstlichen Stimulation der Neurogenese sind unbekannt. Besteht das Risiko, einen Tumorprozess zu entwickeln?
5) Die Verletzung der Neuroplastizität ist kein erschöpfendes Konzept für depressive Störungen. Das Konzept kann das Vorhandensein ALLER Krankheitssymptome (z. B. Somatisierung depressiver Symptome, wenn die Symptome einer Depression als Erkrankungen der inneren Organe getarnt sind - Kopfschmerzen, Schmerzen im Herzen, Bauch usw.), die Art des Verlaufs (Zyklus) und den Widerstand nicht vollständig erklären Einige Formen der Depression zur medikamentösen Therapie (trotz der Tatsache, dass Antidepressiva die Neurogenese aktivieren und den BDNF erhöhen).
Verletzung der Prozesse der Neuroplastizität und depressiven Störungen - Fehler im Konzept
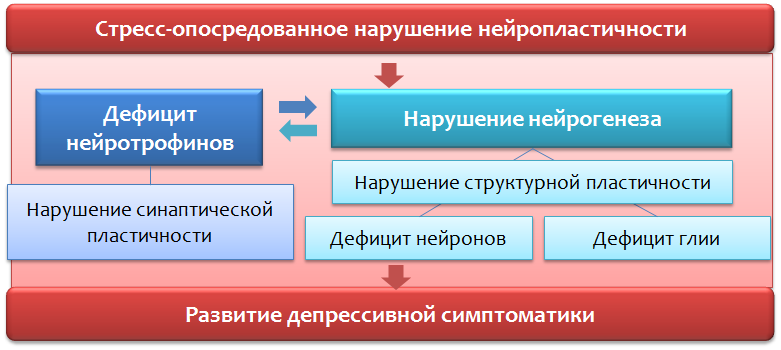 Abb. 37
Abb. 37- Die Unterdrückung von Neuroplastizitätsprozessen ist nicht spezifisch für depressive Störungen
- In Tiermodellen blockiert die Unterdrückung der Stammzellproliferation nicht immer die Wirkung von Antidepressiva
- Die Ressourcen der Neurogenese können begrenzt sein und eine übermäßige Stimulation kann zu Erschöpfung führen.
- Die langfristigen Folgen einer anhaltenden "gewalttätigen" Stimulation der Neurogenese sind nicht bekannt. Besteht das Risiko, einen Tumorprozess zu entwickeln?
- Die Verletzung der Neuroplastizität ist kein erschöpfendes Konzept für depressive Störungen.
Theorien über die Rolle der Neurotransmitter-Aminosäuren - Glutamat und GABA - sind nicht erschöpfend. Erstens können die vorgestellten Systeme (glutamatergisch und GABAergisch) nicht isoliert von anderen Faktoren betrachtet werden, weil Tatsächlich sind sie ein Zwischenglied bei der Pathogenese depressiver Störungen oder einzelner Symptome. Zweitens werden Veränderungen im glutamatergen und GABAergen System des Gehirns nicht nur bei depressiven, sondern auch bei einer Reihe anderer Störungen und Zustände (Schizophrenie, Angststörungen, Panikattacken, Epilepsie, Schmerzempfindlichkeit, Parkinson-Krankheit, Alzheimer-Krankheit) beobachtet.
 Abb. 38
Abb. 38Wenn wir den pharmakologischen Eingriff in das glutamaterge System betrachten, dann ist er zweifellos vielversprechend und sogar innovativ, weil Zuvor wirkten alle Antidepressiva ausschließlich auf das monoaminge System des Gehirns. Eine derart breite Funktion von Glutamat im Zentralnervensystem kann jedoch zur Entwicklung unerwünschter Wirkungen und einer Reihe von Kontraindikationen führen. Für Vorhersagen ist es jedoch noch zu früh. Der Glutamatrezeptorblocker muss noch klinische Phase-III-Studien durchlaufen. Das Medikament wird nicht als Ersatz für moderne Antidepressiva angesehen, sondern als Mittel zur Zusatztherapie (z. B. bei anhaltenden Formen der Depression).
Medikamente, die positive Modulatoren von GABAA-Rezeptoren sind, werden derzeit nicht als unabhängige Antidepressiva angesehen. Sie sind nützlich, um einzelne Symptome depressiver Störungen zu beseitigen.
"Ideale" Droge
Eine vielversprechende Richtung für die Entwicklung neuer wirksamer und sicherer Antidepressiva ist die Untersuchung der Stressmechanismen selbst, da der Stressfaktor (Stressereignisse) als Hauptauslöser für die Bildung depressiver Störungen angesehen wird.
Wie sollte ein vielversprechendes Medikament aussehen?
Die Suche und Schaffung eines „idealen“ Antidepressivums sollte auf zwei einfachen Prinzipien beruhen (nach Franco Borsini):
1. Das Medikament sollte die Psyche eines gesunden Menschen nicht verändern
2. Das Medikament sollte nur unter psychopathologischen Bedingungen wirken
 Abb. 39. Borsini F. Modelle für Depressionen beim Wirkstoff-Screening und in präklinischen Studien: Zukünftige Richtungen // World Journal of Pharmacology. 2012.1 (1). S. 21–29.
Abb. 39. Borsini F. Modelle für Depressionen beim Wirkstoff-Screening und in präklinischen Studien: Zukünftige Richtungen // World Journal of Pharmacology. 2012.1 (1). S. 21–29.Eine Unterbrechung der Stressmechanismen in den frühen Stadien würde all jene Änderungen verhindern, die im Kontext unseres Artikels berücksichtigt wurden. Eine solche Korrekturmethode scheint theoretisch nicht nur zur Verhinderung der Entwicklung von Depressionen am effektivsten zu sein, sondern auch zum zuverlässigen Schutz vor Rückfällen und wiederholten, schwereren Episoden.
Die medikamentöse Therapie an sich ist nicht das einzige Mittel zur Korrektur der betrachteten Psychopathologie. Der Kommunikation mit Patienten und der Ermittlung der Krankheitsursache sollte nicht weniger Bedeutung beigemessen werden. In einigen Fällen hat die Wirksamkeit der Psychotherapie auch ein hohes Potenzial Es hilft, Lösungen für das Problem zu finden, und bekämpft nicht die Krankheitssymptome, lässt das Problem ungelöst und übersetzt Depressionen in subchronische und chronische Formen.