Genexpression und Gentherapie
Das Konzept der Gentherapie existiert seit zwanzig bis dreißig Jahren. Es besteht in der Tatsache, dass der radikalste Weg zur Bekämpfung von Krankheiten darin besteht, die genetische Ursache der Krankheit und nicht ihre Folgen zu zerstören.
Der Grund kann eine Verletzung eines bestimmten Gens (Mutation) sein, das von Eltern während Erbkrankheiten übertragen wurde, oder eine Mutation eines Gens, das sich bereits im erwachsenen Organismus befindet und beispielsweise Krebs verursacht. Darüber hinaus kann die Ursache einfach eine zu hohe (oder umgekehrt niedrige) Aktivität des normalen Gens sein, was das Risiko einer chronischen Krankheit wie Diabetes oder Atherosklerose erhöht.
Der Weg, um mit diesen Veränderungen umzugehen, besteht darin, neue genetische Informationen in die Zelle einzuführen, um diejenige zu korrigieren, mit der die Krankheit verbunden ist.
Zunächst etwas tiefer in die Theorie. Das DNA-Molekül - Desoxyribonukleinsäure - ist der Träger des Codes, der die Entwicklung und Funktion aller Lebewesen steuert. DNA enthält ein Programm, das die Umwandlung einer einzelnen Quellzelle in einen harmonisch arbeitenden Organismus ermöglicht, der aus zahlreichen Zellen besteht, die zu einer Vielzahl von Geweben und Organen kombiniert sind.
Die Entschlüsselung der DNA-Struktur im Jahr 1953 war einer der Wendepunkte in der Geschichte der Biologie. Für diese Entdeckung erhielten die Wissenschaftler
James Watson, Francis Crick und Maurice Wilkins 1962 den Nobelpreis für Physiologie oder Medizin.
DNA ist ein riesiges Molekül, das aus Tausenden kleiner Moleküle besteht - Nukleotiden, vier verschiedenen Typen: Guanin (G), Cytosin (C), Thymin (T) und Adenin (A). Nukleotide binden aneinander und bilden eine Kette; Das DNA-Molekül besteht aus 2 solchen Ketten, die zu einer Doppelhelix verdreht sind.

Beim Verbinden von 2 Ketten gelten folgende Regeln: Adenin verbindet sich immer mit Thymin und Guanin - mit Cytosin. Im Gegensatz zu Thymin von einem Strang gibt es also immer Adenin von einem anderen.
Diese Anordnung ermöglichte es uns, die Mechanismen des DNA-Kopierens während der Zellteilung zu erklären. Die beiden Stränge einer Spirale gehen auseinander, und dann wird jedem von ihnen eine exakte Kopie ihres ehemaligen „Partners“ in einer Spirale hinzugefügt. Nach dem gleichen Prinzip wie beim Negativ auf dem Foto werden sie positiv gedruckt.
Die nächste Revolution in der Erforschung der DNA fand 50 Jahre später statt, im Jahr 2003, als das große Projekt "Human Genome" abgeschlossen wurde. Es erlaubte die Entschlüsselung aller 19.000 Gene unseres Körpers und eröffnete beispiellose Möglichkeiten für die Medizin.
Ein Gen ist ein Teil eines DNA-Moleküls, in dem ein Polypeptid (Teil eines Proteinmoleküls) oder eine funktionelle RNA kodiert ist. Es ist normalerweise mehrere hundert Nukleotide lang, aber es gibt Ausnahmen. Die kleinsten Gene des menschlichen Genoms - Transport-RNA-Gene - bilden nur 76 Nukleotidpaare, und das größte Gen - das Dystrophin-Protein-Gen - 2,4 Millionen.
In den am weitesten entwickelten Organismen, einschließlich des Menschen, sind Gene häufig durch Fragmente "sinnloser", nicht kodierender DNA getrennt. Menschliche DNA ist um ein molekulares Gerüst von Proteinen gewickelt, mit dem sie ein Chromosom bildet. Die gesamte menschliche DNA befindet sich auf 46 Chromosomen.
Wenn wir die Zelle mit der Pflanze vergleichen, ist die DNA eine Information von der Festplatte, die im Büro der Pflanze gespeichert ist. Damit die Anlage ihre Arbeit aufnehmen kann, müssen diese Informationen an alle Geräte in den Geschäften der Anlage übertragen werden - diese Rolle in der Zelle spielen Ribonukleinsäuren - RNA. Und schließlich sind die Produkte, die im Rahmen dieses Programms in den Läden der Pflanze gesammelt werden, zelluläre Proteine.
Der Prozess des Lesens von Informationen aus DNA wird als "Genexpression" bezeichnet.
Wenn DNA Informationen über alle Prozesse des Körpers codiert, sind Proteine die Hauptausführenden und Controller dieser Prozesse. Es gibt eine große Anzahl verschiedener Klassen von Proteinen, die an allen für den Körper wichtigen Prozessen beteiligt sind.
Es gibt Proteine, die den Verlauf chemischer Reaktionen im Körper verkürzen. eine Gebäudefunktion erfüllen - als eine Art Verstärkung geben sie Zellen und ihren Teilen Form; Schutz des Körpers durch Neutralisierung von Toxinen, pathogenen Bakterien und Viren; regulieren das Lesen von Informationen aus DNA und die Synthese der entsprechenden Proteine.
Es gibt auch Proteine, die Signale zwischen Zellen, Geweben und Organen übertragen, verschiedene Moleküle durch Zellen und verschiedene Systeme transportieren. Energie wird in Proteinen gespeichert; Proteine sind Rezeptoren - lösen eine Kaskade zellulärer Ereignisse als Reaktion auf bestimmte Signale aus der äußeren Umgebung oder aus den inneren Systemen des Körpers aus; Sie können eine motorische Funktion ausführen - sie bieten Körperbewegungen, zum Beispiel Muskelkontraktionen.

Gentherapie ist ein Eingriff in die Arbeit einer zellulären „Pflanze“ zur Produktion von Proteinen. Sie können damit sowohl die Arbeit der erforderlichen Gene aktivieren als auch die schädlichen Gene „ausschalten“. Im ersten Fall wird ein Gen an die Zelle abgegeben, aus dem das zur Behandlung der Krankheit notwendige Protein abzulesen beginnt. Und im zweiten Fall werden regulatorische RNAs in die Zelle eingeführt, die die Expression des „schädlichen“ Gens blockieren.
Am häufigsten wird eine Genblockierung aufgrund der Tatsache erreicht, dass kleine störende RNAs (siRNAs) an die Zelle abgegeben werden, die an die RNA des Gens binden, das ausgeschaltet werden muss. Die Bindung von siRNA und RNA blockiert die Proteinsynthese und führt letztendlich zum RNA-Abbau.
Dieser Prozess wird als RNA-Interferenz bezeichnet. Es wurde 1998 von den amerikanischen Wissenschaftlern
Andrew Fire und Craig Mello entdeckt und als so wichtig anerkannt, dass bereits 2006 der Nobelpreis für Physiologie und Medizin für seine Entdeckung verliehen wurde.
Gentherapie: Erfolge und Trends
Gentherapie entstand vor mehr als 25 Jahren. Die erste erfolgreiche klinische Studie (am Menschen) wurde 1989 zur Gentherapie bei schwerem kombinierten Immundefekt durchgeführt. Derzeit boomt die Gentherapie.
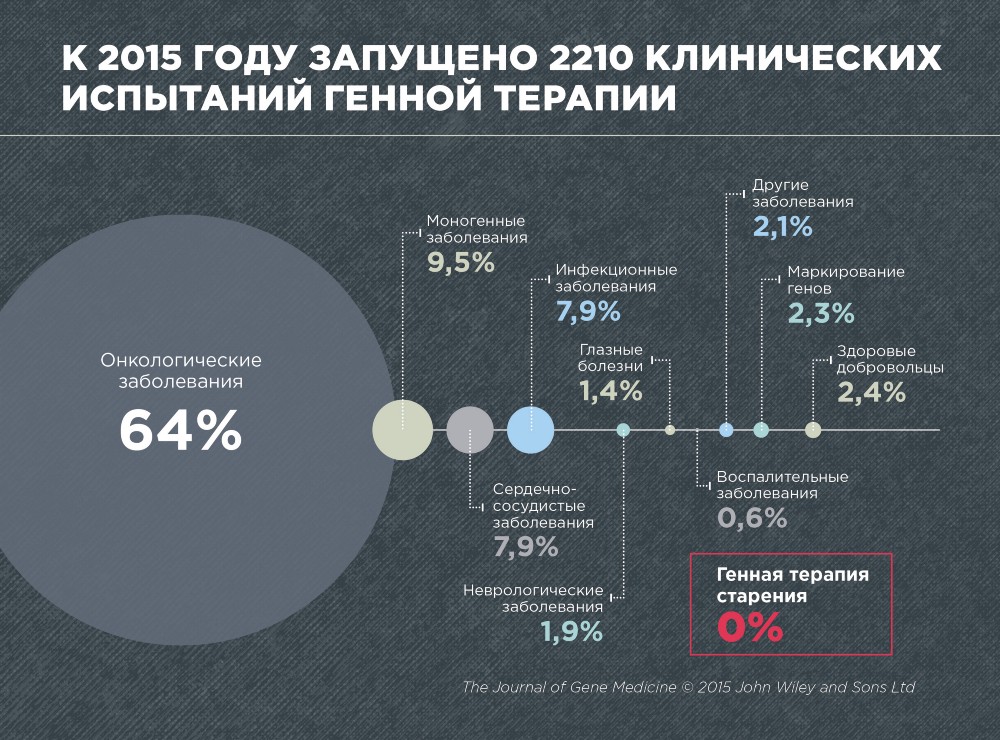
Laut der Zeitschrift Gene Medicine wurden 2015 2210 klinische Studien zur Gentherapie verschiedener Krankheiten durchgeführt. Dies sind hauptsächlich Krebs (64%), monogene Erkrankungen, die durch Mutationen in einem Gen (9,5%) verursacht werden, kardiovaskuläre (7,9%) und infektiöse (7,9%).
Es wurden keine klinischen Studien zur Gentherapie des Alterns durchgeführt, was nicht überraschend ist, da das Altern immer noch nicht als Krankheit erkannt wird. Darüber hinaus ist die Gentherapie für das Altern noch ein sehr junges und sich entwickelndes Gebiet.
Bei einer Reihe von Krankheiten war die Gentherapie recht erfolgreich. Darunter Erbkrankheiten des Immunsystems - schwerer kombinierter Immundefekt, Wiskott-Aldrich-Syndrom und chronische granulomatöse Erkrankung; eine Erbkrankheit im Zusammenhang mit Stoffwechselstörungen - Adrenoleukodystrophie; erbliche Netzhauterkrankung - Leber-Amaurose und einige Formen von Krebs.
Bisher wurden 4 Gentherapeutika zum Verkauf zugelassen. Im Jahr 2003 wurde in China Gendicine, ein Medikament zur Behandlung des Plattenepithelkarzinoms des Kopfes und des Halses auf der Basis des p53-Gens, und 2006 Oncorine, ein onkolytisches Virus zur Behandlung des Nasopharynxkarzinoms, auf den Markt gebracht. In Europa wurde 2012 die Produktion des Glybera-Präparats zur Behandlung des erblichen Lipoprotein-Lipase-Mangels (LPL) durch Abgabe des gleichen Gens aufgenommen. Und in Russland ist das Medikament "Neovasculgen" zum Verkauf zur Behandlung von Erkrankungen der peripheren Arterien zugelassen. Es ist ein VEGF-Gen (vaskulärer endothelialer Wachstumsfaktor).
Das Hauptproblem der Gentherapie besteht darin, wie ein therapeutisches Gen (oder eine RNA) an Zielzellen abgegeben werden kann. Typischerweise werden hierfür Liefervektoren - Träger genetischer Konstrukte - verwendet. Sie lassen nicht zu, dass DNA im Blut zerfällt, ermöglichen den Austritt von DNA aus Kapillaren (kleinen Blutgefäßen) in Gewebe und das Eindringen in Zellen und in den Zellkern.
Am häufigsten werden Viren als Vektoren verwendet, da sie sehr wirksame Mechanismen für das Eindringen tierischer Zellen durch perfektionierte Evolution aufweisen. Durch die Infektion einer Zelle in der Natur liefert das Virus sein genetisches Material an den Zellkern und beginnt, seine eigenen Proteine unter Verwendung der Mechanismen der Genexpression der Wirtszelle zu reproduzieren und zu produzieren.
Wissenschaftler haben Viren vereinfacht, indem sie Gene entfernt haben, die an der Pathogenese beteiligt sind und die Immunantwort des Körpers auslösen, und sie in Vektoren für die Abgabe von genetischem Material umgewandelt.

Die beliebtesten in der Gentherapie verwendeten Viren sind Adenoviren (sie werden in 22,2% der klinischen Studien verwendet) sowie Retroviren (sie machen 18,4% der Arbeit aus). Nur neuere Vektoren werden immer beliebter - Adeno-assoziierte Viren (6% der klinischen Studien) und Lentiviren (5% der Studien).
Die vielversprechendsten für die Gentherapie sind Adeno-assoziierte (AAV) und lentivirale Vektoren. Ersteres ermöglicht die systemische Abgabe des genetischen Konstrukts an den Körper (d. H. In eine Reihe von Geweben und Organen) ohne Nebenwirkungen. Es stimmt, dass sie kein genetisches Material in das Genom einbetten, so dass das gelieferte Gen im Laufe der Zeit verloren gehen kann.
Wenn eine hohe Abgabeeffizienz und die Integration des abgegebenen Konstrukts in das Genom sichergestellt werden müssen, sollten lentivirale Vektoren verwendet werden. Sie sind jedoch nicht für die systemische Abgabe geeignet und werden zur lokalen Injektion in einen kleinen Bereich des Gewebes oder in Zellen in vitro verwendet. Darüber hinaus können sie Nebenwirkungen verursachen, wenn sie in unerwünschte Teile des Genoms eingebaut werden (z. B. in Protoonkogene und Krebs verursachen).

Die Verwendung der CRISPR / Cas9-Genomeditierungstechnologie eröffnet neue Möglichkeiten in der Gentherapie. Mit CRISPR / Cas9 können Sie die DNA von Zellen sehr genau und sicher verändern. Und wenn Sie die CRISPR / Cas9-Technologie mit der Bereitstellung von Adeno-assoziierten Viren kombinieren, können Sie anscheinend den Körper systemisch beeinflussen und das Genom einer sehr großen Anzahl von Zellen vollständig sicher verändern. Das heißt, seine Verwendung ermöglicht es Ihnen, die Vorteile sowohl von adenoassoziierten als auch von lentiviralen Vektoren zu kombinieren.
In der Natur kommt dieses System in Bakterien und Archaeen vor. Es wird zum Schutz vor Bakteriophagen (bakteriellen Viren) oder anderen fremden genetischen Elementen verwendet. Im Falle einer Zellinfektion erkennt das CRISPR / Cas-System die Sequenzen von Fremd-DNA und schneidet sie. Das CRISPR / Cas-System wurde erstmals 1987 entdeckt, seine Funktionen wurden jedoch erst seit 2005 aktiv untersucht.
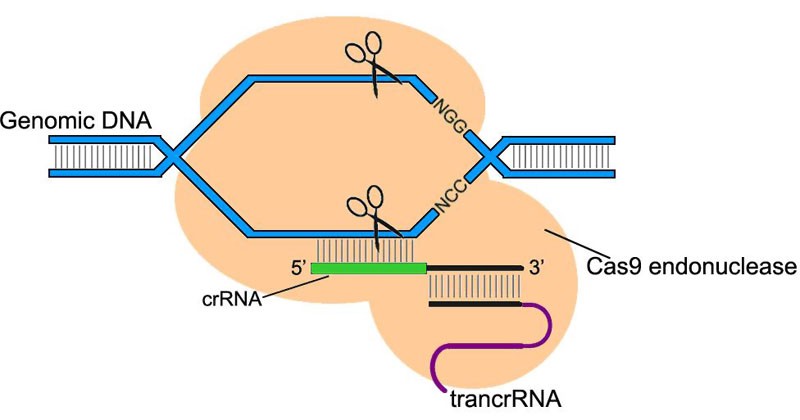
Da CRISPR / Cas DNA sehr genau erkennt und schneidet, haben Wissenschaftler beschlossen, sie für die Bearbeitung des Säugetiergenoms anzupassen. Die Verwendung von CRISPR / Cas hat alle Erwartungen übertroffen. Mit einer minimalen Anzahl von Fehlern konnten sowohl die erforderlichen Gene ausgeschaltet als auch neue Gene in genau definierte Teile des Genoms eingebettet werden.
Das CRISPR / Cas9-System besteht aus Cas9-Endonuklease, einem Enzym, das DNA schneidet und RNA steuert, die nur an eine streng definierte Genomsequenz bindet. Ein solches System ermöglicht es, Genomschnitte an der richtigen Stelle zu finden und zu schneiden und sie auf den RNA-Leitfaden auszurichten.
Der RNA-Leitfaden wird von den Forschern selbst ausgewählt, sodass das CRISPR / Cas9-System auf jeden gewünschten Teil des Genoms ausgerichtet werden kann.
Und in jüngerer Zeit, im Dezember 2015, hat die wissenschaftliche Gruppe Feng Jang dieses System so modifiziert, dass es völlig fehlerfrei wurde, was in der führenden wissenschaftlichen Zeitschrift Science veröffentlicht wurde. Die Wissenschaftler ersetzten 3 Aminosäuren (den „Baustein“, aus dem das Protein besteht) in der Cas9-Endonuklease, wonach die Anzahl der Fehler in einem solchen System auf nahezu Null reduziert wurde.
Die Verwendung von CRISP / Cas9 ist besonders relevant für die Gentherapie des Alterns, bei der es erforderlich ist, die Langlebigkeitspfade zu beeinflussen, die den meisten Körperzellen gemeinsam sind.
Arten von Liefervektoren und ihre EigenschaftenAdenoviren (AV) und Adeno-assoziierte Viren (AAV) können sowohl zur eng gezielten Abgabe von genetischem Material an bestimmte Gewebe als auch zur systemischen Abgabe an den Körper (dh an eine große Anzahl von Organen und Geweben) verwendet werden. Sie liefern das genetische Material sehr effizient und dringen in die Kerne von sich teilenden und nicht teilenden Zellen ein.
Ein wichtiges Merkmal dieser Viren ist, dass sie die gelieferten Gene nicht in das Genom integrieren. Es ist wahr, dass im Fall von Adeno-assoziierten Vektoren dennoch gezeigt wurde, dass <1% der Fälle in eine bestimmte Region des Wirtsgenoms eingebettet (integriert) sind.
Das Fehlen einer zufälligen Genintegration in das Genom ist ein großes Plus für die Sicherheit dieser Vektoren. In diesem Fall besteht kein Risiko, dass sich das Gen versehentlich in die Protoonkogensequenz integriert und Krebs verursacht. Wenn andererseits ein Gen nicht in das Genom integriert ist, kann es im Laufe der Zeit verloren gehen, beispielsweise bei der Zellteilung. Daher kann die therapeutische Wirkung im Fall der Verwendung solcher Vektoren vorübergehend sein.
Obwohl Adenoviren in der Gentherapie viel häufiger eingesetzt werden, sind Adeno-assoziierte Viren aufgrund ihrer höheren Sicherheit vielversprechender. Tatsache ist, dass Adenoviren beim Einbringen in den Körper eine starke Immunantwort und eine Entzündungsreaktion hervorrufen können.
In den frühen Stadien der Entwicklung der Gentherapie führte die Verwendung von adenoviralen Vektoren sogar zum Tod des Patienten. Jesse Jelsinger litt an einem Mangel an Ornithin-Transcarbamylase, einer genetisch bedingten Erkrankung der Leber. Im Alter von 18 Jahren nahm er an einer klinischen Studie zur Gentherapie teil und starb an einer systemischen Entzündungsreaktion als Reaktion auf die Einführung des Viruskonstrukts.
Im Gegenteil, die Einführung von Adeno-assoziierten Viren in den Körper führt nur zu einer unbedeutenden Immunantwort, da diese Viren in der Natur keine Säugetierkrankheiten verursachen und vom menschlichen Immunsystem kaum erkannt werden.
Andere virale Vektoren - Retroviren und Lentiviren - binden genetisches Material in das Genom ein und sorgen für eine stabile therapeutische Wirkung. Eine versehentliche Integration in das Genom kann jedoch zur Aktivierung von Krebsmechanismen führen, was in der Geschichte der Gentherapie bereits mehrmals vorgekommen ist.
Retro- und Lentiviren werden fast ausschließlich zur eng gezielten Abgabe an bestimmte Gewebe und ihre Stellen oder an Zellen in vitro verwendet, da sie im Gegensatz zu AV und AAV Material auf viel kürzere „Entfernungen“ übertragen. Der Nachteil von Retroviren besteht darin, dass sie nur in sich teilende Zellen eindringen können. Daher sind Lentiviren viel vielversprechender, da sie auch nicht teilende Zellen infizieren.
Darüber hinaus werden in der Gentherapie häufig nicht-virale Methoden zur Abgabe von DNA und RNA wie Liposomen eingesetzt. Sie sind viralen Vektoren in ihrer Effizienz viel unterlegen, aber sicherer und billiger.
 Vergleichende Analyse von Vektoren zur Abgabe von genetischem Material in die Zelle
Vergleichende Analyse von Vektoren zur Abgabe von genetischem Material in die Zelle Status und Perspektiven der Gentherapie des Alterns
Derzeit entwickelt sich die Gentherapie für das Altern schnell, befindet sich jedoch noch in einem präklinischen Entwicklungsstadium (dh es wurden noch keine menschlichen Experimente durchgeführt). Unter den bisher eingeleiteten 2210 klinischen Studien zur Gentherapie gibt es keine, die das Altern behandeln könnten. Dies ist teilweise auf rechtliche Probleme zurückzuführen: Altern wird immer noch nicht als Krankheit angesehen. Dieses Forschungsfeld selbst ist jedoch erst in jüngster Zeit entstanden. Die ersten Arbeiten zur Gentherapie des Alterns bei Mäusen wurden vor weniger als 5 Jahren durchgeführt.
Jetzt werden alle Studien zur Gentherapie des Alterns an Modellmäusen, Ratten, Affen und menschlichen Zellkulturen durchgeführt - Zellen in vitro.
Alle Ansätze zur Gentherapie des Alterns sind unterteilt in solche, bei denen das Langlebigkeitsgen an den Körper abgegeben wird, und solche, bei denen kleine RNAs eingeführt werden, um das Gen oder den Alterungsweg „auszuschalten“. Das heißt, im ersten Fall wird etwas Nützliches für die Langlebigkeit eingeführt, und im zweiten Fall wird das Schädliche ausgeschaltet.
Im engeren Sinne der Forschung zur Gentherapie des Alterns bei Säugetieren wurden nur zwei durchgeführt. In diesen Arbeiten wurde den Mäusen das therapeutische Gen injiziert und sie beobachteten, wie es das Altern und die Langlebigkeit beeinflusste. Die erste Arbeit wurde 2012 von einer Gruppe von Maria Blasco durchgeführt, bei der es gelang, die Lebensdauer von Mäusen um 20% zu verlängern. Und die zweite ist die Therapie des Hypothalamus mit dem NF-kB-Inhibitorgenom, die Dongsheng Kai und seine Kollegen 2013 durchgeführt haben. Darin erhöhte sich die Lebensdauer von Mäusen um 10%. Beide Arbeiten sind sehr ermutigend: Die Therapie war sehr effektiv und ohne Nebenwirkungen.

Viel mehr Arbeitsmodelle Gentherapie an transgenen Mäusen. In solchen Studien wird das therapeutische Gen nicht in den Körper einer erwachsenen Maus abgegeben, und Mäuse werden mithilfe der Gentechnik hergestellt, deren Genom von Geburt an verändert wird. Wie bei der Gentherapie können Sie hier untersuchen, wie sich eine Zunahme oder Abnahme der Aktivität verschiedener Gene auf die Lebenserwartung und das Altern des Körpers auswirkt.
Es gibt so viele Studien, in denen die Gentherapie für das Altern an Zelllinien modelliert wird. Solche Arbeiten untersuchen normalerweise, ob die Abgabe eines therapeutischen Gens die Zellalterung in vitro verlangsamt oder nicht. Dieser Ansatz führt jedoch zu gemischten Ergebnissen, da eine Therapie, die das Leben der Zellen verlängert, nicht immer das Leben des Körpers verlängert und umgekehrt. Beispielsweise verlängert eine erhöhte Aktivität des Langlebigkeitsgens und die Stressreaktion FOXO die Lebensdauer des Modells Drosophila. In Experimenten mit Stammzellen der Haut verlangsamte sich die Zellalterung, als das FOXO3-Gen im Gegenteil „ausgeschaltet“ wurde.
, : , , , , .
- , . , , .
46 - , . « »: ( — ) . , . , .
— 10 . — 6 , — 7, — 6, — 4, — 7, — 3, — 3 — 1 .
, , , , — 20%, , (, , 30–50%). !
, 2001 30%. 670 — , ! 2012 — 20%. 1 !
 , , .
, , ., , , - — .
—
30 . 1985 , , , 2004 .
1961 . , 50 , . , . , , .
10 . , , , . , . (, ), , , , .
— 1985 . , . , , — .
, . , «» .
, 90% . : ? , , . , . , .
, , . , .
(in vitro). , , , — , .
(TERT). .
TERT 1998 . , , 75–80 , 280. , ( ). — — .
, . TERT , — «» .
, (), ( ), ( ), — , -, ( ), .
, . , . TERT ( , , ). , , , .
, , . , . , , .
:
Die ersten Experimente zur Gentherapie des Alterns wurden 2012 von der spanischen Forscherin Maria Blasco unter Verwendung des Telomerase-Gens (TERT) durchgeführt. Die ersten Ergebnisse waren sehr, sehr beeindruckend. Gentherapie nicht nur bei Erwachsenen, sondern auch bei alten Mäusen verlängerte das Leben um bis zu 20%! Wenn wir uns vorstellen, dass solche Ergebnisse beim Menschen erzielt werden können, werden wir 14 Jahre Menschenleben retten!
Vor der Gentherapie wurden die Auswirkungen der Telomerase auf transgene Mäuse untersucht. Es stellte sich heraus, dass die Lebenserwartung um 40% steigt, wenn Sie das TERT-Gen in allen Mauszellen einschalten! Die konstante Aktivität der Telomerase erhöhte jedoch auch das Krebsrisiko.
Daher war die Frage, wie die Telomerase für eine kürzere Zeit aktiviert werden kann.
Genau das wurde in der Arbeit von Maria Blasco 2012 getan. Das Telomerase-Gen wurde der Maus unter Verwendung eines Adeno-assoziierten Virus (AAV9) verabreicht, das eine systemische Abgabe liefern kann. Adeno-assoziierte Viren sind sehr sicher: Sie integrieren das abgegebene Gen nicht in das Wirtsgenom und führen daher nicht zur Mutagenese. Darüber hinaus verursachen sie fast keine Immunantwort.
Das Telomerase-Gen wurde an eine Vielzahl von Geweben und Organen abgegeben, einschließlich Leber, Nieren, Lunge, Herz, Gehirn und Muskeln. In diesen Geweben wurde bereits 8 Monate nach dem Eingriff Telomerase nachgewiesen. Bei Tieren verbesserte sich eine Reihe von altersbedingten Parametern: Die Insulinsensitivität erhöhte sich, die neuromuskuläre Koordination verbesserte sich, das Osteoporoserisiko (Knochenschwund) und der Gehalt an molekularen Altersmarkern nahmen ab. Darüber hinaus war die TERT-Gentherapie völlig sicher: Das Krebsrisiko bei Mäusen stieg nicht an.
Und vor allem hat die Gentherapie das Leben von Mäusen erheblich verlängert. Die mittlere Lebenserwartung (das Alter, in dem mehr als die Hälfte der Personen in der Gruppe lebt) stieg bei erwachsenen (1 Jahr alten) und alten (2 Jahre alten) Mäusen um 24% bzw. 13%. Die maximale Lebenserwartung stieg ebenfalls: bei Erwachsenen um 13% und bei alten Mäusen um 20%.
In einer anschließenden Studie zeigte Maria Blasco, dass die Abgabe des TERT-Gens an das Herz von Mäusen nach einem Myokardinfarkt die Herzfunktion signifikant verbessert und das Risiko für Herzinsuffizienz und Mortalität um 17% verringert.
Dank dieser Experimente hat die Gentherapie mit Telomerase einen hervorragenden Ruf. Im September 2015 wurde das weltweit erste Experiment zur Gentherapie des Alterns beim Menschen durchgeführt. Die Amerikanerin Elizabeth Perrish führte das Telomerase-Gen in Kombination mit dem Myostatin-Inhibitor-Gen ein (um das Muskelwachstum zu stimulieren). Diese Studie hat gerade erst begonnen, daher ist es noch zu früh, um über die Ergebnisse zu sprechen, aber bisher geht es Elizabeth gut. Elizabeth versprach, auf Anfrage allen medizinischen Forschungsinstituten Material zur Analyse zur Verfügung zu stellen. Da jedoch nur eine Person an diesem Experiment teilgenommen hat, lassen die Ergebnisse keine verlässlichen, statistisch signifikanten Schlussfolgerungen zu.
Die Tatsache, dass Studien am Menschen begonnen haben, deutet jedoch darauf hin, dass ein TERT-basiertes Medikament auf dem Weg ist. Es ist ohne Zweifel der Kandidat Nummer eins für den Kampf gegen das Altern mit Gentherapie.
Gentherapie zur Verjüngung des Hypothalamus
Eine Möglichkeit, das Leben zu verlängern, ist eine eng gezielte Wirkung auf die Strukturen, die das Altern des gesamten Organismus regulieren. Neuere Studien zeigen, dass eine solche Struktur ein Teil des Gehirns ist - der Hypothalamus.
Im Jahr 2013 verlängerten amerikanische Wissenschaftler unter der Leitung von Donsheng Kai das Leben von Mäusen erheblich, indem sie den Hypothalamus mithilfe der Gentherapie verjüngten. Die Forscher unterdrückten die Entzündung, die mit dem Alter im Hypothalamus auftritt, wodurch die Anzahl der altersbedingten Pathologien abgenommen und die Lebenserwartung um 10% gestiegen ist.

Altern ist größtenteils mit einer Verletzung der Homöostase verbunden - Selbstregulierung des Körpers, seine Fähigkeit, seinen inneren Zustand aufrechtzuerhalten. Im „jungen“ Zustand reagiert der Körper auf die störende Wirkung durch einen Komplex von Maßnahmen, die ihn erfolgreich in seinen ursprünglichen „gesunden“ Zustand zurückversetzen. Zum Beispiel startet der Körper mit einem Anstieg der Körpertemperatur eine Reihe von Thermoregulationsprozessen (zum Beispiel Schwitzen), wodurch die Temperatur auf das ursprüngliche Niveau abfällt. Mit zunehmendem Alter wird jedoch die Fähigkeit zur Aufrechterhaltung der Homöostase beeinträchtigt, was zu einem "Ungleichgewicht" des Körpers führt.
Der Hypothalamus ist eines der Hauptzentren des Körpers, die die Homöostase regulieren. Trotz der Tatsache, dass es nicht mehr als 5% des Gehirns ausmacht, bindet er die nervösen und hormonellen Mechanismen der Aufrechterhaltung der Homöostase in einem einzigen System.
Mit zunehmendem Alter verschlechtert sich die Arbeit des Hypothalamus erheblich, insbesondere nimmt die Produktion des wichtigsten Hormons Gonadoliberin ab. Die „klassische“ Funktion dieses Hormons besteht darin, die sexuelle Funktion zu regulieren. Aber für das Altern spielt es eine sekundäre oder sogar tertiäre Rolle. Es ist wichtig, dass Gonadoliberin auch die Neurogenese aktiviert - die Bildung neuer Nervenzellen im Hypothalamus sowie in mehreren anderen Bereichen des Gehirns.
Eine der Hauptursachen für die altersbedingte Verschlechterung des Hypothalamus ist eine Entzündung. Mit zunehmendem Alter werden die Transkriptionsfaktoren NF-kB und IKK-b, regulatorische Moleküle, die die gesamte Kaskade der für Entzündungen verantwortlichen Gene aktivieren, im Hypothalamus aktiviert.
Um die Entzündung im Hypothalamus zu verjüngen und zu reduzieren, verwendeten Dongsheng Kai und Kollegen ein Gen, das die Arbeit von NF-kB - IkB-a hemmt. Das IkB-a-Gen wurde durch Injektion in den Hypothalamus in erwachsene Mäuse eingeführt. Damit das Gen in die Zellkerne eindringen und sich in das Genom integrieren konnte, wurden lentivirale Vektoren verwendet.
Die Therapie hatte einen sehr starken Einfluss auf das Altern. Die maximale Lebensdauer von Mäusen wurde um 10% erhöht! Die Gesundheit von Mäusen hat sich ebenfalls signifikant verbessert. Selbst 6 Monate nach der Injektion hatten die Mäuse eine bessere geistige Leistungsfähigkeit und die Muskeln arbeiteten besser. Eine Analyse der Gewebestruktur zeigte auch, dass sich die Muskeln, die Haut und die Knochen der Mäuse in einem „jungen“ Zustand befanden.
Somit ist der Hypothalamus ein wichtiges Zentrum zur Regulierung des systemischen Alterns. Seine Verjüngung führt offenbar zu einer Verlängerung des Lebens des Körpers, indem es sowohl seine eigenen regulatorischen Funktionen des Hypothalamus verbessert und Sexualhormone absondert als auch die Neurogenese stimuliert und infolgedessen die Funktion anderer Teile des Gehirns verbessert.
Gentherapie zur Erhöhung der Stressresistenz
Unter den bisher untersuchten Möglichkeiten zur Verlängerung des Lebens besteht die stärkste darin, die Stressresistenz zu erhöhen. Aufgrund der Auswirkungen auf diesen Pfad wurden alle aktuellen Lebensverlängerungsdatensätze festgelegt. Robert Schmuckler-Rice gelang es, die Lebensdauer des Fadenwurms zehnmal zu verlängern, und Andrzej Bartka die Lebensdauer der Maus - 1,8.
Während des gesamten Lebens ist der Körper ständig mit einer Vielzahl schädlicher Faktoren konfrontiert: Hunger, Durst, Kälte, giftige Substanzen, schädliche Strahlung, psychischer Stress. Die Beständigkeit gegen diese Faktoren wird als Spannungsbeständigkeit bezeichnet.
Eine erhöhte Stresstoleranz kann auf allen Ebenen auftreten: von Molekülen bis zum gesamten Organismus. Es wurden jedoch hauptsächlich molekulare Mechanismen untersucht. Eine erhöhte Stressresistenz geht mit einer Erhöhung der Proteinstabilität einher; Wenn es bereits Verstöße in der Struktur von Proteinmolekülen gibt - dann werden sie korrigiert und die Zelle wird vollständig zerstörte Moleküle los - wird sie in Ziegel zerlegt und verdaut.
Eine Erhöhung der Stresstoleranz kann auf verschiedene Arten erreicht werden.
Der erste und bekannteste Weg ist die Einschränkung der Ernährung. Gleichzeitig wird der Betrieb des MTOR-Komplexes "ausgeschaltet". MTOR ist eine Art molekularer „Schalter“. Er versetzt die Zelle in einen Zustand des aktiven Wachstums und der Fortpflanzung. Gleichzeitig werden energieaufwendige Stressresistenzmechanismen unterdrückt. Wenn MTOR ausgeschaltet ist, wechselt die Zelle im Gegensatz dazu in den Stressschutzmodus.
Der zweite, ebenfalls gut untersuchte Weg zur Erhöhung der Stresstoleranz besteht darin, die Signalübertragung von Insulin und Insulin-ähnlichem Wachstumsfaktor 1 (IGF-1) zu blockieren. Unter Signalisierung (oder Signalisierung) wird eine Kaskade molekularer Prozesse verstanden, die in der Zelle als Reaktion auf die Wirkung von Hormonen auftreten. Insulin und IGF-1 signalisieren der Zelle das Vorhandensein eines Glukosenährstoffs im Blut. Infolgedessen werden Wachstumsprozesse in der Zelle gestartet, der MTOR-Weg wird aktiviert und Stressresistenzprozesse werden unterdrückt.
Hemmung des MTOR- oder Insulinweges - startet eine ganze Kaskade von Stressantwortgenen, die sich auch als Langlebigkeitsgene herausstellten: FOXO, NRF2, AMPK, HIF-1, SIRT1 und SIRT6 usw. Der dritte Weg zur Erhöhung der Stressresistenz ist daher die künstliche Aktivierung Stressantwortgene.

Alle diese Ansätze werden aktiv für die Gentherapie des Alterns untersucht. In einigen Arbeiten wirken sie separat auf den Hypothalamus - die Struktur, die das Altern reguliert, in anderen - systemisch - auf die meisten Körperzellen. Es gibt nur sehr wenige echte Studien zur Gentherapie, bei denen ein therapeutisches Gen einem erwachsenen Tier oder vielmehr nur einem Tier zugeführt wird. In den meisten Studien wird die Gentherapie an transgenen Tieren oder Zelllinien (an Zellen in vitro) modelliert.
Aktivierung des Neuropeptid-Y-Gens im HypothalamusDie erste und einzige Arbeit zur Gentherapie zur Erhöhung der Stressresistenz wurde vor weniger als einem Jahr an Mäusen durchgeführt. Es wirkte auf den Regulator des systemischen Alterns - den Hypothalamus.
 Luís Pereira de Almeida, Janete Cunha Santos und Cláudia Cavadas
Luís Pereira de Almeida, Janete Cunha Santos und Cláudia CavadasEine Gruppe portugiesischer und deutscher Wissenschaftler unter der Leitung von Luís Pereira de Almeida und Cláudia Cavadas führte 2015 ein Experiment durch, bei dem sie das Neuropeptid Y (NPY) -Gen im Hypothalamus von Ratten aktivierten.
Das Neuropeptid Y ist eines der wichtigsten Signalmoleküle des Hypothalamus. In den letzten Jahren sind viele Daten über die Rolle dieser Substanz beim Altern erschienen. Zum Beispiel ist die Arbeit des NPY-Gens notwendig, damit eine Kalorieneinschränkung das Leben verlängert. Und bei transgenen Ratten, die mehr von diesem Neuropeptid produzierten, stieg die mittlere Lebenserwartung (das Alter, bis zu dem die Hälfte der Individuen in der Gruppe lebte) sogar an.
Es ist erstaunlich, dass vor einigen Jahren kein Wort über die Rolle von NPY beim Altern bekannt war. Und Neuropeptid Y wurde nur im Zusammenhang mit seiner Rolle bei Fettleibigkeit und seiner Fähigkeit, den Hunger zu stimulieren, erwähnt. Es ist überraschend, wie sich diese Funktionen mit der Fähigkeit verbinden, das Leben zu verlängern!
Wissenschaftler lieferten das NPY-Gen über das Adeno-assoziierte Virus an den Hypothalamus. Infolgedessen wurde der wichtigste Mechanismus der Stressresistenz in den Hypothalamuszellen stimuliert - die Autophagie (der Prozess der Selbstreinigung der Zellen von beschädigten Molekülen und Zellstrukturen durch deren Verdauung).
In dieser Arbeit wurden keine weiteren Auswirkungen der NPY-Gentherapie auf die Langlebigkeit untersucht, aber die Forscher werden dies in Zukunft tun.
Es kann jedoch bereits davon ausgegangen werden, dass die von de Almeida und Cavadas erfundene Therapie das Altern verlangsamt, indem der Hypothalamus (ein Regulator des systemischen Alterns) verjüngt wird. Andererseits ist es möglich, dass das Neuropeptid Y die Autophagie nicht nur im Hypothalamus, sondern auch in anderen Körperzellen stimuliert, was ebenfalls zu einer Verlangsamung des Alterns führt.
UCP2-Genaktivierung im HypothalamusIm Jahr 2006 führten amerikanische Wissenschaftler unter der Leitung von Tamás Bártfai ein weiteres elegantes Experiment durch, bei dem sie auch auf den Hypothalamus einwirkten. Die Exposition führte zu einem leichten Rückgang der Körpertemperatur und unerwartet zu einer erhöhten Lebenserwartung!
Dies war kein gentherapeutisches Experiment - es wurden transgene Mäuse verwendet, deren Genom von Geburt an verändert wurde. Angesichts der Wirksamkeit der derzeitigen Methoden zur Abgabe von Genen an den Körper stellt die Umsetzung dieser Studien in die Gentherapie jedoch keine besonderen Probleme dar.
Die transgenen Mäuse in den Tamás Bártfai-Experimenten produzierten eine erhöhte Menge an Entkopplungsprotein 2 (UCP2) im Hypothalamus. Dies ist ein mitochondriales Protein, das während der Arbeit die Effizienz der ATP-Synthese verringert und die Wärme fördert. Infolgedessen stieg die Temperatur des Hypothalamus leicht an. Und ein Temperaturanstieg im Hauptkörper-Thermoregulator führte dazu, dass die Gesamtkörpertemperatur leicht abfiel - um 0,3 ° - 0,5 ° C.
Eine leichte Abnahme der Körpertemperatur verursachte bei Mäusen einen ähnlichen Effekt wie die Einschränkung der Ernährung, obwohl die Mäuse so viel aßen, wie sie wollten. Darüber hinaus erhöhte sich die mittlere Lebensdauer von Mäusen signifikant: bei Männern um 12% und bei Frauen um 20%.
In anderen Arbeiten wurde die Stressresistenz erhöht und wirkte systemisch auf die meisten Körperzellen.
Inaktivierung des MTOR-AlterungswegsToren Finkel und Kollegen erhöhten die Stressresistenz und Langlebigkeit von Mäusen, indem sie den bekanntesten MTOR-Alterungsweg ausschalteten.
In den Experimenten wurden transgene Mäuse mit einer Mutation am MTOR-Ort (Regionen auf dem Chromosom, in denen sich die entsprechenden Gene befinden) verwendet, die 75% weniger MTOR-Protein in den Zellen hatten. Es stellte sich heraus, dass solche Mäuse 20% länger leben.

Darüber hinaus verbesserte die Mutation am MTOR-Ort viele Indikatoren für die Gesundheit der Maus signifikant: Eine Reihe von Organen und Geweben befanden sich in einem „jüngeren“ und besseren Zustand, es gab weniger Proteinaggregate (anhaftende Proteine) und Schäden im Gewebe. Darüber hinaus funktionierten das Gedächtnis, die motorische Koordination und das räumliche Denken dieser Mäuse besser.
Das „Ausschalten“ des MTOR-Signalwegs ging jedoch auch mit Nebenwirkungen einher: Der Zustand der Knochen verschlechterte sich, die Mäuse litten häufig an Infektionskrankheiten von Mund, Haut und Augen. Außerdem waren die Mäuse kleiner. Daher ist ein längeres Herunterfahren der Gene des MTOR-Komplexes für den Körper offensichtlich ziemlich traumatisch, und entweder sollte die Zeit der Inaktivierung des MTOR verkürzt oder mit einem anderen Effekt kombiniert werden, der negative Nebenwirkungen kompensiert.
PTEN-GenaktivierungEin weiteres vielversprechendes Ziel der Gentherapie ist das PTEN-Gen - es „schaltet“ den Insulinweg des Alterns aus. PTEN hemmt die Arbeit der Typ I-Phosphatidylinositol-3-Kinase (PI3K), einem Molekül, das für die Übertragung eines Insulinsignals an die Zelle erforderlich ist.
Spanische Wissenschaftler unter der Leitung von Manuel Serrano untersuchten transgene Mäuse mit Überexpression (erhöhte Aktivität) des PTEN-Gens. Diese Mäuse waren viel besser gegen Krebs geschützt und ihre maximale Lebenserwartung war 16% länger. Transgene Mäuse waren empfindlicher gegenüber Insulin, geschützt vor Diabetes und Steatose - pathologische Ansammlung von Fett in der Leber, sie hatten im Alter weniger DNA-Schäden.

In der Arbeit wurde ein weiterer Mechanismus entdeckt (zusätzlich zur Inaktivierung des Insulinwegs), durch den PTEN die Langlebigkeit beeinflusst. Die Aktivierung von PTEN führte dazu, dass braunes Fettgewebe begann, viel Energie in Form von Wärme freizusetzen, was einen erhöhten Energieaufwand des gesamten Organismus verursachte. Und wie aus früheren Arbeiten bekannt, hängt die Lebenserwartung direkt von der Intensität des Energieverbrauchs ab.
Herunterfahren des AC5-GensEine andere, weniger bekannte Möglichkeit, die Stresstoleranz zu erhöhen, besteht darin, die Übertragung des Signals vom Stresshormon Adrenalin zur Zelle zu blockieren. Adrenalin ist ein Hormon, das eine Flucht- oder Kampfreaktion hervorruft. Er beginnt aktiv aufzufallen, wenn er Gefahr, Angst, Verletzungen, Verbrennungen, Schock und in Grenzsituationen spürt und den Körper mobilisiert, um die Bedrohung zu beseitigen. Gleichzeitig ist Adrenalin ein sehr starkes Stresshormon, das bei längerer Exposition Zellen und ganze Gewebe schädigt und zu einer Erschöpfung des Körpers führt.
Der amerikanische Forscher Stephen F. Vatner und Kollegen schufen transgene Mäuse mit dem "ausgeschalteten" Typ 5-Adenylatcyclase-Gen (AC5), einem Molekül, das erforderlich ist, damit das Adrenalinsignal über einen seiner Rezeptortypen, die β-adrenergen Rezeptoren, auf die Zellen übertragen werden kann. Es ist wichtig zu beachten, dass solche Rezeptoren in fast allen Körperzellen vorhanden sind.
Das „Herunterfahren“ des AC5-Gens hatte unerwartet einen sehr starken Einfluss auf Gesundheit und Langlebigkeit. Transgene Mäuse lebten bis zu 30% länger als normale Mäuse und waren weniger anfällig für Knochen- und Herzerkrankungen.
Auf molekularer Ebene standen diese Effekte im Zusammenhang mit der Tatsache, dass die Inaktivierung von AC5 den Weg der Stressresistenz auslöste - Raf / MEK / ERK. Infolgedessen produzierte die Zelle eine ganze Reihe von Schutzmolekülen, die die Mechanismen des Zellüberlebens auslösten.
Darüber hinaus ist aus früheren Studien bekannt, dass die Wirkung von Adrenalin auf die Zelle durch β2-adrenerge Rezeptoren direkt DNA-Schäden verursacht. Somit kann angenommen werden, dass das "Herunterfahren" des AC5-Gens von Mäusen auch zu einer erhöhten Genomstabilität beitrug.
Aktivierung von Sirtuin-GenenAndere wichtige Teilnehmer an den Mechanismen der Stresstoleranz und Langlebigkeit sind Sirtuine. Insbesondere wurden die Sirtuine 1 und 6 (SIRT1 und SIRT6) untersucht. Sirtuine sind Histondeacetylasen - sie verändern die Packungsdichte von DNA und hemmen die Expression (Abnahme der Aktivität) von Genen.
Histone sind Moleküle, die eine räumliche Packung von DNA bereitstellen: DNA wird wie ein Faden auf einer Spule um sie gewickelt, und die Spulen sind dicht gepackt. Wenn die Spulen zu dicht gepackt sind, ist es fast unmöglich, genetische Informationen daraus zu lesen. Deacetylasen erhöhen lediglich die Dichte der DNA-Verpackung und machen sie zum Lesen unzugänglich. Infolge der Aktivierung von Sirtuinen wird die Expression eines ganzen Satzes von Genen gehemmt.
Sirtuin 11 : , , — — FOXO. , SIRT1 . 2010 , Manuel Serrano, SIRT1 . — , .

3 Shin-ichiro Imai SIRT1 , , . 16% , — 9%.
, , SIRT1, . SIRT1 ( ) — .
6— 6 (SIRT6). , 1 IGF1, .
SIRT6 , 2 .
2012 , Haim Y. Cohen, SIRT6 , ( ) 10–14,5%. , , , , , . ( ) SIRT6 , . , SIRT6 . , , .
SIRT6 . , .
, SIRT6 , — . . SIRT6 — , .
 NRF2
NRF2— NRF2. -: Snell.
NRF2 — , . 200 , , .
, ( — ), - .
, . , . NRF2 , .
NRF2 . NRF2 ( , ) — . NRF2 () .
, ! — , IGF-1 , — . — 1,8 . «» ( ) , — . — , .
— — . . — , , , .
, . , (SASP), , — .
-, , . , , , . (SASP) , , .
() , — , , . , , . , . , , , , , .
Jan M. van Deursen. 2011 Nature. . -, . — . — AP20187. , -, , .
, , ( , , ) . , . — .
Jan M. van Deursen . 2016 , Nature, , ( ) . , , , , , 17–35%!
, .
— , . « » — .
. , 1,5–2 . , , . , , «» .
, . « » — , . — , .
— PGC-1. — , — .
, 33–37%. PGC-1 . PGC-1 2 , PGC-1 .
PGC-1 , . , , .
Chinesische Forscher unter der Leitung von Wei-Jia Kong haben das PGC-1-Gen zur Behandlung von Taubheit in einem Zellmodell verwendet. Die Einführung dieses Gens verlangsamte die Alterung der Rattenzellen, die für die Wahrnehmung von Geräuschen verantwortlich sind. In einer anderen Studie verwendeten der chinesische Wissenschaftler Bing Chen und Kollegen erfolgreich die PGC-1-Genabgabe an Stammzellen, um deren Stressresistenz zu erhöhen. Und Pei-Qing Liu führte das PGC-1-Gen in die Herzzellen ein, wodurch sie vor Hypertrophie (pathologische Proliferation) geschützt wurden.. Zolt Arany PGC-1 . . Hollinger Selsby PGC-1 — , , , . : PGC-1 .
, -, . , — — .
— .
. , -, . : , ( ) .
: , , , , . , 3 : (), . ( ) .
— . .
— , — , . «». , , 2- 1- ; — , , , 2- , . , . , , .

2013 Gemma Calamandre MTH1. MTH1 , . — ( , «»).
, MTH1 22%. , . : .
Johannes Grillari — SNEV — . SNEV «» , .
SNEV () : 2 , . , .
— . , , 42% !
, — . , — , , . .

2011 , . , (shRNA), .
— .
, . , , , , , . . , , .
18 000 , . , , . . , , — «».
— — (, ). ( — «» ). — !
, , , , . , , (, ).
. — «» , , . «», — — . . «» — , . «» — .
, «» .
, «» .
Stephen L Helfand Suv39 — , , . — , .
Igor Kovalchuk Olga Kovalchuk , . , Suv39h1 . Suv39h1 ( ) , .
, — . «» . — .
– . , , — . , , ( ) , .
— !
klotho
20 , 1997 Yo-ichi Nabeshima , — Klotho. «» . 7 , klotho — 20–30%, — 19%.

2014 , klotho (SNP Rs9536314) .
klotho , . — IGF-1 ( ).
3 klotho — 2000 — , , , — . Ryozo Nagai .
4–5 klotho . , , - . — , , .
-
— , — , , , — .
, . , — — , . , , .
.
, - — , — . , , .
, , — , , . — «» «» , .
, , — . , — . 2–3 , — 40!
— , . , . — - , , ! , , ( ) — . , , — .
, — , , . « »: , . . .
— . , -, , — -, .
Herz-Kreislauf-System- 7 . — - — , 30% — 17,3 . , — , , . .
— , , . , — — BNP ( -), , . — — , .
, ; , .
Alain-Pierre Gadeau, — desert hedgehog (dh). , «» ( ), . — , , !
7 — , . . — .
. , 2 BMP, . (OPG) 1, . — , ; — .
, Xiao-Bing Zhanga — - . PDGFB — , — . : , — 45%! , — . , ( ), , .
5 — — , , . , , , — .
. , Sox9, — 2 . — . , , - NF-κB. , .
! , Wang, — SIRT6. , , . , . , .
— ; , — , . . , . , .
— , , , . , . «» , , — MyoPPT. Ketan Patel, : , «» (, FOXO).

, — , , — .
— ; , — — . , , 3, . , , .
— , - ( ). FoxN1, -. — , VEGF — . .
. IL-2 — — . , .
. ( mTOR), ! , , .
Zentralnervensystem() — — 10 ! , — -. , , ( ) -10 , — .
— , . «» — — . — Homer1c. ( PkcD, ). , . , — . , , .
Matthew J. During, , — . CREB ( ), — , !
, , - ! , . , , (Theodore Berger) 2025 !
— — , — Pars compacta. , , , — (, — ) .
« » ; — , — . , .
Pars compacta — ! GRP78, . — , , , — (-).
, , 3 , ! — - , .
— , - — IL-12 IL-23 , . , . — -1 (IGF-1)! , IGF-1 , — . IGF-1 , — .
Mark H. Tuszynski - NGF — , . — ( ) , ! , — .
, NGF — 15 .
, . , .
. — , «Massachusetts Male Aging Study» 39% 40 67% — 70 . — — , 50 . — .
6 , — . — NO, ( eNOS, ecSOD, ), — (, Maxi-K). , , — - , . — .
, , .
, ! — , IGF-1 — . , , , IGF-1 , . IGF-1 ( — -- (GnRH) ).
IGF-1 , — , . , IGF-1 . , , , , , !
, — . , , .
- , . , , (, ), — . — , .
3, . 2 .
— GDNF, . , — , , — , , , (CRH).
Pomc — — , . , . , , , . , — . , : , .
, , Wnt, , — ( ). Wnt . , : , , — . , , , , !
, , — , : , , — ! -, , — , .
, , (age-related macular degeneration — AMD), 65. , AMD , . — .
AMD — . , , — VEGF — .
, VEGF — sFlt1, VEGF. : , AMD.
, 2015 — 8 71 86 . sFlt01.19 , 52 — . , .
AMD — , — . , .
, AMD — . — VEGF, . , , , - . — VEGF, , !
, — , , — , . , 1415 , — 40–45 — , . (, , AMD, — AMD ). «» , -, , .
, , , . (, , ), , — .
, , , . . , , - NGF — , ( ) ! . , — .
, . -, , , , , .

Fazit
, — , .
( ), , (, ).
.
-, , . , — , . , , 20%, , - , .
NF-kb 10%, . , , , ( ).
, , - .
, , : , , , , (, ). , .
, . , , . , , , .
— , . .
-, , . , , -. , «» , 50%. , 80%. — — , 10 , : , , , .
, , , . , , , , , , .
20%, , , , .
1.
http://www.wiley.com//legacy/wileychi/genmed/clinical/2. Slaymaker IM, Gao L., Zetsche B., Scott DA, Yan WX, Zhang F. Rational konstruierte Cas9-Nukleasen mit verbesserter Spezifität. Wissenschaft. 2016, 1. Januar; 351 (6268): 84–8. doi: 10.1126 / science.aad5227. Epub 2015 1. Dezember.
3. Anderson WF, Blaese RM, Culver K. Das klinische Protokoll der menschlichen Gentherapie der ADA: Zu berücksichtigende Punkte mit dem klinischen Protokoll // Hum Gene Ther. - 1990. - v. 1 (3). - S.331-362.
4. Edelstein ML, Abedi MR, Wixon J., Edelstein RM Klinische Gentherapie-Studien weltweit 1989–2004 - ein Überblick // J Gene Med. No. - 2004. - v.6. - S.597-602.
5. Kay MA Genbasierte Therapien auf dem neuesten Stand der Technik: der Weg in die Zukunft // Nat Rev Genet. - 2011. - v. 12 (5) - S. 316–28.
6. Greider, CW & Blackburn, EH (1985) "Identifizierung einer spezifischen Aktivität der terminalen Telomertransferase in Tetrahymena-Extrakten." Cell v. 43, (2 Pt. 1) pp. 405-413.
7. Egan CA1, Savre-Zug I, Shay JW, Wilson SE, Bourne WM. Analyse der Telomerlängen in menschlichen Hornhautendothelzellen von Spendern unterschiedlichen Alters. Invest Ophthalmol Vis Sci. 1998 Mar; 39 (3): 648–53.
8. Kang MK, Guo W, Park NH. Die replikative Seneszenz normaler menschlicher oraler Keratinozyten ist mit dem Verlust der Telomeraseaktivität ohne Verkürzung der Telomere verbunden. Zellwachstum unterschiedlich. 1998 Jan; 9 (1): 85–95.
9. Ilmonen P., Panda B., Janina S., Dustin P. J., Michaela Th. Genetik der Telomerlänge in wild abgeleiteten Hausmäusen. Genetik der Telomerlänge in wild abgeleiteten Hausmäusen. 21. bis 23. August 2014, Santa Clara, USA
10. Bodnar AG, Ouellette M., Frolkis M., Holt SE, Chiu CP, Morin GB, Harley CB, Shay JW, Lichtsteiner S., Wright WE Verlängerung der Lebensdauer durch Einführung von Telomerase in normale menschliche Zellen // Wissenschaft . - 1998 - V.279 (5349). - S.349-52.
11. Jiang XR., Jimenez G., Chang E., Frolkis M., Kusler B., Sage M., Beeche M., Bodnar A., Wahl G., Tlsty T., Chiu CP. Die Telomerase-Expression in menschlichen Körperzellen induziert keine Veränderungen, die mit einem transformierten Phänotyp verbunden sind // Nat. Genet. - 1999. - v. 21. - S. 111–114.
12. Chung SA, Wei AQ, Connor DE, Webb GC, Molloy T., Pajic M., Diwan AD Nucleus pulposus zelluläre Langlebigkeit durch Telomerase-Gentherapie // Wirbelsäule. - 2007 - V.32 (11). - S.1188–96.
13. Bernardes de Jesus B., Vera E., Schneeberger K., Tejera AM, Ayuso E., Bosch F., Blasco MA Die Telomerase-Gentherapie bei erwachsenen und alten Mäusen verzögert das Altern und erhöht die Lebenserwartung, ohne den Krebs zu erhöhen // EMBO Mol Med. Dr. . - 2012.- .v.4 (8). - S.691–704.
14. Tomás-Loba A., Flores I., Fernández-Marcos PJ, Cayuela ML, Maraver A., Tejera A., Borrás C., Matheu A., Klatt P., Flores JM, Viña J., Serrano M., Blasco MA Telomerase Reverse Transkriptase verzögert das Altern bei krebsresistenten Mäusen // Cell. - 2008 - V.135 (4). - S. 609-22.
15. Bär C., Bernardes de Jesus B., Serrano R., Tejera A., Ayuso E., Jimenez V., Formentini I., Bobadilla M., Mizrahi J., de Martino A., Gomez G., Pisano D., Mulero F., Wollert K. C., Bosch F., Blasco MA. Die Telomerase-Expression verleiht dem erwachsenen Mausherz nach einem akuten Myokardinfarkt eine Kardioprotektion. Nat Commun. 2014, 18. Dezember; 5: 5863. doi: 10.1038 / ncomms6863.
16. Zhang G., Li J., Purkayastha S., Tang Y, Zhang H., Yin Y, Li B., Liu G., Cai D. Hypothalamische Programmierung des systemischen Alterns mit IKK-β, NF-κB und GnRH. Natur. 2013.v.497 (7448). S.211-6.
17. Michalkiewicz M., Knestaut KM, Bytchkova EY, Michalkiewicz T. (2003) Hypotonie und reduzierte Katecholamine bei transgenen Neuropeptid-Y-Ratten. Hypertension 41 (5): 1056 & ndash; 1062.
18. Aveleira CA, Botelho M., Carmo-Silva S., Pascoal J. F., Ferreira-Marques M., Nóbrega C., Cortes L., Valero J., Sousa-Ferreira L., Álvaro AR, Santana M., Kügler S., Pereira de Almeida L., Cavadas C. Neuropeptid Y stimuliert die Autophagie in hypothalamischen Neuronen Proc Natl Acad Sci USA, 31. März 2015; 112 (13): E1642-51. doi: 10.1073 / pnas.1416609112. Epub 2015 Mar 16.
19. Baranowska B et al. (2006) Neuroendokrine Kontrolle der metabolischen Homöostase bei polnischen Hundertjährigen. J Physiol Pharmacol 57 (Suppl 6): 55–61.
20. Conti B., Sanchez-Alavez M., Winsky-Sommerer R., Moral MC, Lucero J., Brownell S., Fabre V., Huitron-Resendiz S., Henriksen S., Zorrilla EP, de Lecea L., Bartfai T. Transgene Mäuse mit reduzierten Die Körpertemperatur hat eine längere Lebensdauer. Wissenschaft. 2006. v314 (5800). P825-8.
21. Wu JJ, Liu J, Chen EB, Wang JJ, Cao L., Narayan N., Fergusson MM, Rovira II, Allen M., Springer DA, Lago CU, Zhang S., DuBois W., Ward T., deCabo R., Gavrilova O., Mock B, Finkel T. Erhöhte Lebensdauer von Säugetieren und eine segmentale und gewebespezifische Verlangsamung des Alterns nach genetischer Reduktion der mTOR-Expression. Cell Rep. 2013, 12. September; 4 (5): 913–20. doi: 10.1016 / j.celrep.2013.07.0.030. Epub 2013 Aug 29.
22. Yan L., Vatner DE, O'Connor JP, Ivessa A., Ge H., Chen W., Hirotani S., Ishikawa Y., Sadoshima J., Vatner SF. Eine Störung der Adenylylcyclase vom Typ 5 erhöht die Lebensdauer und schützt vor Stress. Zelle. 2007 Jul 27; 130 (2): 247–58.
23. Yamashita et al. (2012). SIRT1 verhindert die replikative Seneszenz normaler menschlicher Nabelschnurfibroblasten durch Potenzierung der Transkription des humanen Telomerase-Reverse-Transkriptase-Gens. Biochemische und biophysikalische Forschungskommunikation. 417: 630-634.
24. Yuan et al. (2012). SIRT1 wird für das langfristige Wachstum menschlicher mesenchymaler Stammzellen benötigt. J Mol Med. 90: 389 & ndash; 400
25. Herranz et al. (2010) „Sirt1 verbessert das gesunde Altern und schützt vor Krebs, der mit dem metabolischen Syndrom assoziiert ist.“ Nat Commun 1: 3
26. Satoh et al. (2013) „Sirt1 verlängert die Lebensdauer und verzögert das Altern bei Mäusen durch die Regulierung der Nk2-Homöobox 1 in DMH und LH.“ Cell Metab. 18 (3): 416 & ndash; 430
27. Ortega-Molina A., Efeyan A., Lopez-Guadamillas E., Muñoz-Martin M., Gómez-López G., Cañamero M., Mulero F., Pastor J., Martinez S., Romanos E., Mar Gonzalez-Barroso M., Rial E., Valverde AM, Bischoff JR und Serrano M. Pten regulieren die Funktion des braunen Fettgewebes, den Energieverbrauch und die Langlebigkeit positiv. Cell Metab. 2012, 7. März; 15 (3): 382–94. doi: 10.1016 / j.cmet.2012.02.00.001.
28. Wu et al. (2015). Die Überexpression von Sirtuin 6 unterdrückt die zelluläre Seneszenz und NF-κB-vermittelte Entzündungsreaktionen bei der Entwicklung von Arthrose. Sci rep. 5: 17602.
29. Leiser SF, Miller RA. Nrf2-Signalisierung, ein Mechanismus für zelluläre Stressresistenz bei langlebigen Mäusen. Mol Cell Biol. 2010 Feb; 30 (3): 871–84. doi: 10.1128 / MCB.01145–09. Epub 2009 23. November.
30. Li et al. (2005). Die Stabilisierung von Nrf2 durch tBHQ verleiht Schutz vor oxidativem Stress-induziertem Zelltod in menschlichen neuralen Stammzellen. Toxicol. Sci. 83 (2): 313–328.
31. Kanninen et al. (2009). Die intrrahippocampale Injektion eines Nrf2 exprimierenden lentiviralen Vektors verbessert das räumliche Lernen in einem Mausmodell der Alzheimer-Krankheit. Proc Natl Acad Sci, US A. 106 (38): 16505–16510.
32. Wang et al. (2014). Die durch intranasale LV-NRF2-Behandlung vermittelte CD36-Hochregulation mildert das durch Hypoxie induzierte Fortschreiten der Alzheimer-ähnlichen Pathogenese. Antioxid-Redox-Signal. 21 (16): 2208 & ndash; 2230.
33. Minagawa et al. (2011). Beschleunigte Seneszenz von Epithelzellen in IPF und die inhibitorische Rolle von SIRT6 bei der TGF-β-induzierten Seneszenz von menschlichen Bronchialepithelzellen. Am J Physiol Lung Cell Mol Physiol. 300 (3): L391-401.
34. Takasaka et al. (2014). Die Induktion der Autophagie durch SIRT6 durch Abschwächung des Signals des insulinähnlichen Wachstumsfaktors ist an der Regulation der Seneszenz menschlicher Bronchialepithelzellen beteiligt. J Immunol. 192 (3): 958–968.
35. Liu et al. (2014). Oxidativer Stress induziert die Seneszenz von Endothelzellen durch Herunterregulieren von Sirt6. Biomed Res Int. 2014: 902842.
36. Mao et al. (2012). Sirtuin 6 (SIRT6) rettet den Rückgang der homologen Rekombinationsreparatur während der replikativen Seneszenz. Proc Natl Acad Sci USA. 109 (29): 11800-5.
37. Xu et al. (2015). SIRT6 rettet den altersbedingten Rückgang der Basenexzisionsreparatur in PARP1-abhängiger Weise. Zellzyklus 14 (2): 269–276.
38. Chung et al. (2015). Molekulare Einblicke in den SIRT1-Schutz gegen UV-induzierte Haut-Fibroblasten-Seneszenz durch Unterdrückung von oxidativem Stress und p53-Acetylierung. J Gerontol A Biol Sci Med Sci. 70 (8): 959–968.
39. Conti B., Sanchez-Alavez M., Winsky-Sommerer R., Moral MC, Lucero J., Brownell S., Fabre V., Huitron-Resendiz S., Henriksen S., Zorrilla EP, de Lecea L., Bartfai T. Transgene Mäuse mit reduzierten Die Körpertemperatur hat eine längere Lebensdauer. Wissenschaft. 2006. v314 (5800). P825-8.
40. Kanfi Y., Naiman S., Amir G., Peshti V., Zinman G., Nahum L., Bar-Joseph Z., Cohen HY. Das Sirtuin SIRT6 reguliert die Lebensdauer männlicher Mäuse. Natur. 2012, 22. Februar; 483 (7388): 218–21. doi: 10.1038 / nature10815.
41. Campisi J. Altern, zelluläre Seneszenz und Krebs. Annu Rev Physiol. 2013; 75: 685–705. doi: 10.1146 / annurev-physiol-030212-183653. Epub 2012 8. November.
42. Baker DJ, Wijshake T., Tchkonia T., LeBrasseur NK, Childs BG, van de Sluis B., Kirkland JL, van Deursen JM. Die Clearance von p16Ink4a-positiven seneszenten Zellen verzögert altersbedingte Störungen. Natur. 2011 Nov 2; 479 (7372): 232–6. doi: 10.1038 / nature10600.
43. Rera et al. (2011) „Modulation der Langlebigkeit und Gewebehomöostase durch das Drosophila PGC-1-Homolog.“ Cell Metab. 14 (5): 623-634.
44. Zhao et al. (2013). Die Wirkung der Überexpression von PGC-1a auf die häufige Deletion von mtDNA4834 in einem Seneszenzmodell für Ratten-Cochlea-Randzellen. Hörforschung. 296: 13 & ndash; 24
45. Jiang XY, Lu DB, Jiang YZ, Zhou LN, Cheng LQ, Chen B. PGC-1 & agr; verhindert die Apoptose in von Fett abgeleiteten Stammzellen, indem die Produktion reaktiver Sauerstoffspezies in einer diabetischen Mikroumgebung verringert wird. Diabetes Res Clin Pract. 2013 Jun; 100 (3): 368–75. doi: 10.1016 / j.diabres.2013.03.03.036. Epub 2013 Apr 22.
46. Liu XP, Gao H, Huang XY, Chen YF, Feng XJ, He YH, Li ZM, Liu PQ. Peroxisom-Proliferator-aktivierter Rezeptor-Gamma-Coaktivator 1 alpha schützt Kardiomyozyten vor Hypertrophie, indem er den Calcineurin-Kernfaktor des c4-Signalwegs der aktivierten T-Zellen unterdrückt. Transl Res. 2015 Nov; 166 (5): 459–473.e3. doi: 10.1016 / j.trsl.2015.06.06.003. Epub 2015 Jun 9.
47. Hollinger K, Selsby JT. Der PGC-1α-Gentransfer verbessert die Muskelfunktion im dystrophischen Muskel nach längerem Fortschreiten der Krankheit. Exp Physiol. 2015 Oct; 100 (10): 1145–58. doi: 10.1113 / EP085339. Epub 2015 Sep 8.
48. De Luca G., Ventura I., Sanghez V., Russo MT, Ajmone-Cat MA, Cacci E., Martire A., Popoli P., Falcone G., Michelini F., Crescenzi M., Degan P., Minghetti L., Bignami M., Calamandrei G. Verlängerte Lebensdauer mit verbessertem Explorationsverhalten bei Mäusen, die die oxidierte Nucleosidtriphosphatase hMTH1 überexprimieren. Alternde Zelle. 2013 Aug; 12 (4): 695–705. doi: 10.1111 / acel.12094. Epub 2013 30. Mai.
49. Wang J., Geesman GJ, Hostikka SL, Atallah M., Blackwell B., Lee E., Cook P. J., Pasaniuc B., Shariat G., Halperin E., Dobke M., Rosenfeld MG, Jordan IK, Lunyak VV. Die Hemmung der aktivierten perizentromeren SINE / Alu-Wiederholungstranskription in seneszenten menschlichen adulten Stammzellen stellt die Selbsterneuerung wieder her. Zellzyklus 2011, 1. September; 10 (17): 3016–30. Epub 2011 Sep 1.
50. Die Überexpression von SNEV verlängert die Lebensdauer menschlicher Endothelzellen. Voglauer R., Chang MW, Dampier B., Wieser M., Baumann K., Sterovsky T., Schreiber M., Katinger H., Grillari J. Exp. Cell Res. 2006 Apr 1; 312 (6): 746–59. Epub 2006 Jan 4.
51. Wood J., Nan Jiang, Brian C. Jones, Stephen L. Helfand Die Aufrechterhaltung von repressivem Heterochromatin verlängert die Lebensdauer von Drosophila. Abstracts von Beiträgen, die auf der Tagung 2014 zur Molekulargenetik des Alterns vom 29. September bis 3. Oktober 2014 in Cold Spring Harbor, USA, vorgestellt wurden.
52. Sidler et al. (2014). Eine Rolle für die SUV39H1-vermittelte H3K9-Trimethylierung bei der Kontrolle der Genomstabilität und Seneszenz in humanen diploiden WI38-Lungenfibroblasten. Aging 6 (7): 545 & ndash; 563.
53. Kurosu H., Yamamoto M., Clark J. D., Pastor J. V., Nandi A., Gurnani P., McGuinness OP, Chikuda H., Yamaguchi M., Kawaguchi H., Shimomura I., Takayama Y., Herz J., Kahn CR, Rosenblatt KP, Kuro-o M. Unterdrückung des Alterns bei Mäusen durch das Hormon Klotho. Wissenschaft. 2005, 16. September; 309 (5742): 1829–33. Epub 2005 Aug 25.
54. Kuro-oM, Matsumura Y, Aizawa H., Kawaguchi H., Suga T., Utsugi T., Ohyama Y., Kurabayashi M., Kaname T., Kume E., Iwasaki H., Iida A., Shiraki-Iida T., Nishikawa S., Nagai R. , Nabeshima YI. Die Mutation des Maus-Klotho-Gens führt zu einem altersähnlichen Syndrom. Natur. 1997, 6. November; 390 (6655): 45-51.
55. Wang Y, Kuro-o M, Sun Z. Die Klotho-Genabgabe unterdrückt die Nox2-Expression und schwächt den oxidativen Stress in glatten Muskelzellen der Rattenaorta über den cAMP-PKA-Weg ab. Alternde Zelle. 2012 Jun; 11 (3): 410–7. doi: 10.1111 / j.1474–9726.2012.00796.x. Epub 2012 22. Februar.
56. Wang et al. (2009). Klotho-Genabgabe verhindert das Fortschreiten von spontaner Hypertonie und Nierenschäden. Hypertonie 54 (4): 810.
57. Zhou et al. (2015). Klotho verbessert Nierenverletzungen und Fibrose und normalisiert den Blutdruck durch gezielte Behandlung des Renin-Angiotensin-Systems. Am J Pathol. 185 (12): 3211–3223.
58. Die Genabgabe von Deng M, Luo Y, Li Y, Yang Q, Deng X, Wu P und Ma H. Klotho verbessert die Nierenhypertrophie und Fibrose bei Streptozotocin-induzierten diabetischen Ratten durch Unterdrückung des Rho-assoziierten Coiled-Coil-Kinase-Signalwegs. Mol Med Rep. 2015 Jul; 12 (1): 45–54. doi: 10.3892 / mmr.2015.3367. Epub 2015 17. Februar.
59. Shu L., Chen M., Wen M., Huang C., Xu J. Untersuchung des Klotho-Gentransfers auf die Schutzwirkung der Herzkranzgefäße diabetischer Ratten. Pak J Pharm Sci. 2014 Nov; 27 (6 Suppl): 2095–9.
60. Dena B. Dubal et al., Lebensverlängerungsfaktor Klotho verbessert die Kognition, Cell Reports, 2014, DOI: 10.1016 / j.celrep.2014.03.03.076
61. Saito Y, Nakamura T., Ohyama Y, Suzuki T., Iida A., Shiraki-Iida T., Kuro-o M., Nabeshima Y, Kurabayashi M., Nagai R. In-vivo-Klotho-Genabgabe schützt vor endothelialer Dysfunktion beim Syndrom mit multiplem Risikofaktor . Biochem Biophys Res Commun. 2000, 24. September; 276 (2): 767–72.
62. Brown KA, Chu Y., Lund DD, Heistad DD, Faraci FM Der Gentransfer der extrazellulären Superoxiddismutase schützt vor Gefäßfunktionsstörungen mit zunehmendem Alter // Am J Physiol Heart Circ Physiol. - 2006 - V.290 (6). - H2600-5.
63. Schmidt U., del Monte F., Miyamoto MI, Matsui T., Gwathmey JK, Rosenzweig A., Hajjar RJ Wiederherstellung der diastolischen Funktion in seneszenten Rattenherzen durch adenoviralen Gentransfer des sarkoplasmatischen Retikulums Ca (2 +) - ATPase / / Auflage. - 2000.- v. 101 (7). - S. 790–6.
64. Schmidt U., Zhu X., Lebeche D., Huq F., Guerrero JL, Hajjar RJ In-vivo-Gentransfer von Parvalbumin verbessert die diastolische Funktion in gealterten Rattenherzen // Cardiovasc Res. - 2005 - V.66 (2). - S.318-23.
65. Wang H., Keiser JA, Olszewski B., Rosebury W., Robertson A., Kovesdi I., Gordon D. Verzögerte Angiogenese bei alternden Ratten und therapeutische Wirkung des adenoviralen Gentransfers von VEGF // Int J Mol Med. No. - 2004 .-- v.13 (4). - S.581–7.
66.
https://www.heart.org/idc/groups/ahamah-public/@wcm/@sop/@smd/documents/downloadable/ucm_470704.pdf67. Renault et al. (2013). Die Igel-abhängige Regulation der Angiogenese und Myogenese ist bei gealterten Mäusen beeinträchtigt. Arteriosklerose, Thrombose und Gefäßbiologie. 33: 2858–2866
68. Tonne et al. (2014). Die kardiale BNP-Genabgabe verlängert das Überleben bei gealterten spontan hypertensiven Ratten mit offener hypertensiver Herzkrankheit. Altern (Albany NY). 6 (4): 311–319.
69. Wang QL., Han QL., Kang J., Gou S.-H., Wang L.-Zh. Polyethylenimin-vermittelte BMP-7-Gentransfektion fördert die Frakturheilung bei älteren Ratten // Academic Journal der Second Military Medical University. - 2008 - V.28 (5). - S.514-518.
70. Yue B., Lu B., Dai KR, Zhang XL, Yu CF, Lou JR, Tang TT BMP2-Gentherapie zur Reparatur von Knochendefekten gealterter Ratten // Calcif Tissue Int. - 2005 - V.77 (6). - S.395–403.
71. Liu B, Tang J, Ji J, Gu J. Prävention von Osteoporose bei ovarektomierten Mäusen durch elektroporativen Gentransfer von Nebenschilddrüsenhormon. Biotechnol Lett. 2003 Dec; 25 (24): 2117–22.
72. Xie H, Xie PL, Luo XH, Wu XP, Zhou HD, Tang SY, Liao EY. Omentin-1 übt bei ovarektomierten Mäusen eine knochenschonende Wirkung aus. Osteoporos Int. 2012 Apr; 23 (4): 1425–36. doi: 10.1007 / s00198–011–1697–8. Epub 2011 Jul 14.
73. Chen W., Baylink DJ, Brier-Jones J., Neises A., Kiroyan J. B., Rundle CH, Lau KH, Zhang XB. Die PDGFB-basierte Stammzell-Gentherapie erhöht die Knochenstärke in der Maus. Proc Natl Acad Sci USA, 21. Juli 2015; 112 (29): E3893–900. doi: 10.1073 / pnas.1501759112. Epub 2015 6. Juli.
74. Kostenuik et al. (2004). Die Gentherapie mit humanem rekombinantem Osteoprotegerin kehrt die etablierte Osteopenie bei ovarektomierten Mäusen um. Bone 34: 656 & ndash; 664.
75. Yin et al. (2015). Adenovirale vektorvermittelte Überexpression von Osteoprotegerin beschleunigt die Osteointegration von Titanimplantaten bei ovarektomierten Ratten. Gene Ther. 22 (8): 636–644.
76. Paul et al. (2003). Mögliche Anwendung der Sox9-Gentherapie bei Bandscheibenerkrankungen. Wirbelsäule (Phila Pa 1976). 28 (8): 755–763.
77. Chen et al. (2008). Unterdrückung der frühen experimentellen Arthrose durch In-vivo-Abgabe der adenoviralen Vektor-vermittelten NF-kBp65-spezifischen siRNA. Arthrose und Knorpel. 16: 174–184
78. Hsieh et al. (2010). Der intraartikuläre Gentransfer von Thrombospondin-1 unterdrückt das Fortschreiten der Krankheit bei experimenteller Osteoarthritis. J Orthop Res. 28 (10): 1300–1306.
79. Chu et al. (2013). Schutzwirkung von Lentivirus-vermittelter siRNA gegen ADAMTS-5 auf den Knorpelabbau in einem Rattenmodell für Arthrose. INTERNATIONALES JOURNAL FÜR MOLEKULARE MEDIZIN 31: 1222–1228.
80. Pi et al. (2015). Intraartikuläre Abgabe von Anti-Hif-2α-siRNA durch Chondrozyten-Homing-Nanopartikel zur Verhinderung der Knorpeldegeneration bei arthritischen Mäusen. Gentherapie. 22 (6): 439 & ndash; 448.
81. Wu et al. (2015). Die Überexpression von Sirtuin 6 unterdrückt die zelluläre Seneszenz und NF-κB-vermittelte Entzündungsreaktionen bei der Entwicklung von Arthrose. Sci rep. 5: 17602.
82. Collins-Hooper et al. (2014). Die Propeptid-vermittelte Hemmung von Myostatin erhöht die Muskelmasse durch Hemmung proteolytischer Wege bei gealterten Mäusen. J Gerontol A Biol Sci Med Sci. 69 (9): 1049 & ndash; 1059.
83. Sun et al. (2010). Die abnehmende Expression eines einzelnen Epithelzell-autonomen Gens beschleunigt die altersbedingte Thymusinvolution. Alternde Zelle. 9 (3): 347–357.
84. Chung et al. (2014). Entwicklung der menschlichen Thymus-Mikroumgebung zur Unterstützung der Thymopoese in vivo. Stammzellen. 32 (9): 2386–2396.
85. Fayad R., Zhang H., Quinn D., Huang Y., Qiao L. Die orale Verabreichung mit Papillomavirus-Pseudovirus, das IL-2 codiert, stellt die mukosalen und systemischen Immunantworten auf Impfungen bei gealterten Mäusen vollständig wieder her // J Immunol. - 2004 - V. 173 (4). –P.2692–8.
86. Gerstein H., Lindstrom MJ, Burger C. Die Genabgabe von Homer1c rettet das räumliche Lernen in einem Nagetiermodell des kognitiven Alterns // Neurobiol Aging. - 2013.- v. 34 (8). - S. 1963–70.
87. Zhang GR, Liu M., Cao H., Kong L., Wang X., O'Brien JA, Wu SC, Cook RG, Geller AI Verbessertes räumliches Lernen bei gealterten Ratten durch genetische Aktivierung der Proteinkinase C in kleinen Gruppen von Hippocampus-Neuronen // Hippocampus. - 2009 .-- v.19 (5). - S. 413-23.
88. Sun M., Kong L., Wang X., Holmes C., Gao Q., Zhang W., Pfeilschifter J., Goldstein DS, Geller AI, Koexpression von Tyrosinhydroxylase, GTP-Cyclohydrolase I, aromatischer Aminosäure-Decarboxylase und Der vesikuläre Monoamintransporter-2 aus einem helfervirusfreien HSV-1-Vektor unterstützt eine hochgradige biochemische Langzeit- und Verhaltenskorrektur eines Rattenmodells der Parkinson-Krankheit // Hum Gene Ther. - 2004. - v.15. –P.1177–1196.
89. Mouravlev A., Dunning J., Young D., während MJ Somatischer Gentransfer von cAMP-Antwortelement-bindendem Protein schwächt Gedächtnisstörung bei alternden Ratten ab // Proc Natl Acad Sci US A. - 2006. - v. 103 (12 ) - S.4705-10.
90. Pertusa M., García-Matas S., Mammeri H., Adell A., Rodrigo T., Mallet J., Cristòfol R., Sarkis C., Sanfeliu C. Die Expression von GDNF-Transgen in Astrozyten verbessert die kognitiven Defizite im Alter Ratten // Neurobiol-Alterung. - 2008 - V.29 (9). - S.1366–79.
91. Nishida F., Morel GR, Hereñú CB, Schwerdt JI, Goya RG, Portiansky EL Restaurative Wirkung der intracerebroventrikulären Insulin-ähnlichen Wachstumsfaktor-I-Gentherapie auf die motorische Leistung bei alternden Ratten // Neurowissenschaften. - 2011 .-- v.177. - S.195–206.
92. Nagahara AH, Bernot T., Moseanko R., Brignolo L., Blesch A., Conner JM, Ramirez A., Gasmi M., Tuszynski MH Langzeitumkehr des cholinergen neuronalen Rückgangs bei gealterten nichtmenschlichen Primaten durch Lentivirus NGF-Genabgabe // Exp Neurol. - 2009 .-- v.215 (1). - S.153–9.
93. Rodríguez SS, Schwerdt JI, Barbeito CG, Flamini MA, Han Y., Bohn MC, Goya RG Die hypothalamische IGF-I-Gentherapie verlängert die Östruszyklizität und schützt die Eierstockstruktur bei weiblichen Ratten mittleren Alters // Endokrinologie. - 2013 - V.154 (6). - S.2166–73.
94. Bivalacqua TJ, Armstrong JS, Biggerstaff J., Abdel-Mageed AB, Kadowitz PJ, Hellstrom WJ, Champion HC Der Gentransfer von extrazellulärem SOD auf den Penis reduziert O2- * und verbessert die erektile Funktion bei gealterten Ratten // Am J Physiol Heart Circ Physiol. - 2003 - V.284 (4). - H1408-21.
95. Bivalacqua TJ, Deng W., Kendirci M., Usta MF, Robinson C., Taylor BK, Murthy SN, Champion HC, Hellstrom WJG, Kadowitz PJ Mesenchymale Stammzellen allein oder Ex-vivo-Gen, modifiziert mit dem umgekehrten Alter der endothelialen Stickoxidsynthase -assoziierte erektile Dysfunktion // Am J Physiol Heart Circ Physiol. - 2007. - v.292. - H1278 - H1290.
96. Bivalacqua TJ, Burnett AL, Hellstrom WJ, Champion HC Die Überexpression von Arginase im gealterten Mauspenis beeinträchtigt die erektile Funktion und verringert die eNOS-Aktivität: Einfluss der In-vivo-Gentherapie von Anti-Arginase // Am J Physiol Heart Circ Physiol. - 2007 - V.292 (3). - H1340-51. a.
97. Bivalacqua TJ, Champion HC, Mehta YS, Abdel-Mageed AB, Sikka SC, Ignarro LJ, Kadowitz PJ, Hellstrom WJ Adenoviraler Gentransfer der endothelialen Stickoxidsynthase (eNOS) zum Penis verbessert die agerelierte erektile Dysfunktion bei der Ratte // Int J Impot Res. - 2000. - Suppl 3: S8 - S17.
98. Also I., Chae MR, Lee SW Der Gentransfer des K (ATP) -Kanals stellt die altersbedingte erektile Dysfunktion bei Ratten wieder her // BJU Int. - 2007 - v.100 (5). - S.1154-60.
99. Melman A., Biggs G., Davies K., Zhao W., Tar MT, Christ GJ Der Gentransfer mit einem Vektor, der Maxi-K von einem glatten muskelspezifischen Promotor exprimiert, stellt die erektile Funktion bei der alternden Ratte wieder her // Gene Ther . - 2008 - V.15 (5). - S.364–70.
100. Tümer N., Scarpace PJ, Dr. Dogan, Broxson CS, Matheny M., Yurek DM, Peden CS, Burger C., Muzyczka N., Mandel RJ Hypothalamische rAAV-vermittelte GDNF-Genabgabe verbessert altersbedingte Fettleibigkeit // Neurobiol Altern. - 2006 - V.27 (3). - S.459–70.
101. Boghossian S., Ueno N., Dube MG, Kalra P., Kalra S. Der Leptin-Gentransfer im Hypothalamus erhöht die Langlebigkeit bei erwachsenen monogenen mutierten Mäusen in Abwesenheit von zirkulierendem Leptin // Neurobiol Aging. - 2007 - V.28 (10). - S.1594-604.
102. Aslanidi G1, Kroutov V., Philipsberg G., Lamb K., Campbell-Thompson M., Walter GA, Kurenov S., Ignacio Aguirre J., Keller P., Hankenson K., Macdougald OA, Zolotukhin S. Die ektopische Expression von Wnt10b verringert die Adipositas und verbessert die Glukose Homöostase bei fettleibigen Ratten. Am J Physiol Endocrinol Metab. 2007 Sep; 293 (3): E726–36. Epub 2007 Jun 19.
103. Manfredsson FP1, Tumer N., Erdos B., Landa T., Broxson CS, Sullivan LF, Rising AC, Foust KD, Zhang Y., Muzyczka N., Gorbatyuk OS, Scarpace PJ, Mandel RJ. Nigrostriatale rAAV-vermittelte GDNF-Überexpression induziert einen robusten Gewichtsverlust in einem Rattenmodell für altersbedingte Fettleibigkeit. Mol ther. 2009 Jun; 17 (6): 980–91. doi: 10.1038 / mt.2009.45. Epub 2009 Mar 10.
104. MacLachlan et al. (2011). Präklinische Sicherheitsbewertung von AAV2-sFLT01 - Eine Gentherapie bei altersbedingter Makuladegeneration. Die amerikanische Gesellschaft für Gen- und Zelltherapie. 19 (2): 326–334
105. Binley et al. (2012). Sicherheit und biologische Verteilung einer Gentherapie auf der Basis von infektiösem Anämievirus bei Pferden, RetinoStat, zur altersbedingten Makuladegeneration. MENSCHLICHE GEN-THERAPIE. 23: 980–991
106. Rakoczy et al. (2015). Gentherapie mit rekombinanten Adeno-assoziierten Vektoren für neovaskuläre altersbedingte Makuladegeneration: 1 Jahr Follow-up einer randomisierten klinischen Phase-1-Studie. Lancet.
107. Hwangbo DS, Gershman B., Tu MP, Palmer M., Tatar M. Drosophila dFOXO kontrolliert die Lebensdauer und reguliert die Insulinsignale im Gehirn und im Fettkörper. Natur. 3. Juni 2004; 429 (6991): 562-6.
Liu et al. (2015). Seneszenz von aus menschlicher Haut stammenden Vorläufern, die durch Akt-FOXO3-p27KIP1 / p15INK4b-Signal reguliert werden. Zelle. M.