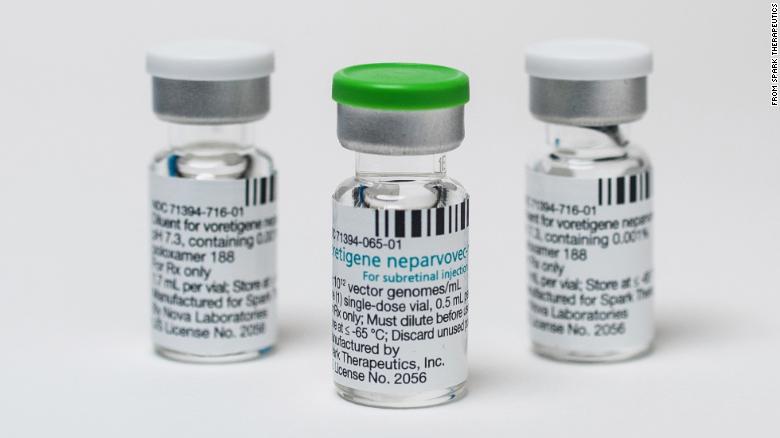
Das von Spark Therapeutics entwickelte Gentherapie-Medikament Luxturna hilft bei Patienten mit einer angeborenen Form der Blindheit, das Sehvermögen wiederherzustellen.
Die Dosis von DNA-gefüllten Viren, die direkt in die Augen injiziert werden, ist die erste Gentherapie, die in den USA zur Behandlung einer genetisch bedingten Krankheit zugelassen wurde. Die Auflösung eines solchen Arzneimittels ist ein bedeutender Moment für das von Höhen und Tiefen geprägte Gebiet, da die erste Studie zur Gentherapie vor fast drei Jahrzehnten begann.
Luxturna ist die dritte zugelassene Gentherapie in diesem Jahr. Im August genehmigte die Agentur Kymriah von Novartis (CAR-T-Zell-Immuntherapie, bei der die Immunzellen eines Patienten entfernt, außerhalb des Körpers modifiziert und dann zur Bekämpfung von Leukämie in den Blutkreislauf zurückgeführt werden). Die zweite zugelassene CAR-T-Zell-Immuntherapie war Yescarta von Gilead Sciences. Im Gegensatz zu den genannten ist Luxturna das erste Medikament, das der „traditionellen“ Wahrnehmung der Gentherapie entspricht, wenn mit DNA gefüllte Viren direkt in den Körper eingeschleust werden. Bisher werden in den USA mehr als 600 klinische Studien mit Gentherapie durchgeführt.
Die Ursprünge von Luxturna begannen in den 1990er Jahren mit Studien von Jean Bennet an der University of Pennsylvania. Im Jahr 2000 testete sie die Gentherapie zur Behandlung von genetischen Netzhauterkrankungen bei Hunden. Es gab jedoch Schwierigkeiten bei der weiteren Finanzierung nach weit verbreiteten Todesfällen von Patienten in anderen klinischen Studien zur Gentherapie. Bennett ging später eine Partnerschaft mit dem Philadelphia Children's Hospital ein, das beschloss, die Technologie zu kommerzialisieren, indem es 50 Millionen US-Dollar für die Einführung von Spark Therapeutics im Jahr 2013 bereitstellte.
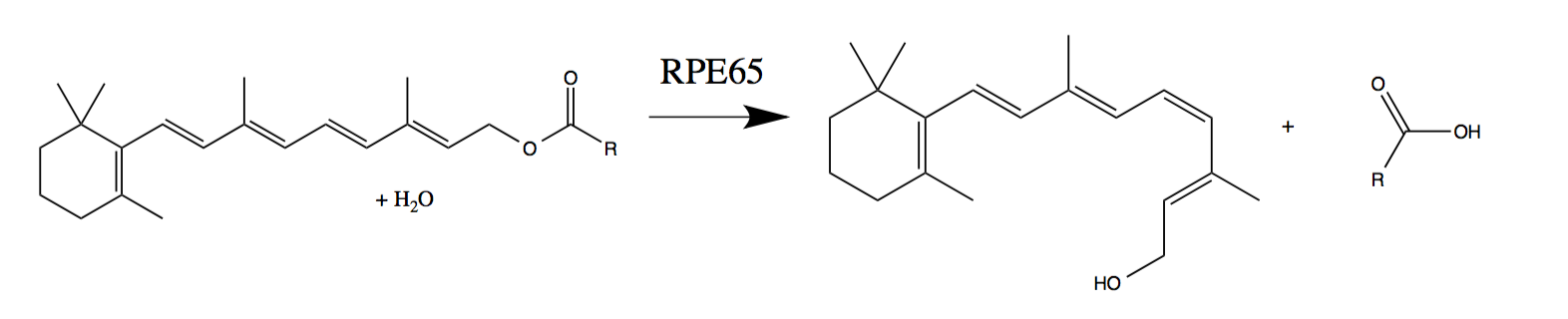
Luxturna verbessert das Sehvermögen bei Menschen mit einer Mutation im RPE65-Gen, das ein für das Sehvermögen wichtiges Enzym codiert.
Lichteinwirkung führt zum Übergang einer "gequetschten" cis-Netzhaut zu einer "dekomprimierten" trans-Netzhaut. Diese physische Veränderung löst das Signal an das Gehirn aus. Um den Zyklus erneut zu starten, gibt das RPE65-Enzym das trans-retinale zurück zum cis-retinalen. Menschen mit einer genetischen Mutation, die die Produktion von RPE65 hemmt, können jedoch nicht "zyklisieren". Dies führt zu Sehstörungen, die normalerweise im Säuglingsalter oder in der Kindheit beginnen und zu fast völliger Blindheit führen.
Regeneration lichtempfindlicher Zellen mit einem normal funktionierenden RPE65-Enzym (Phototransduktion von trans-Retinol in 11-cis-retinal -
Wiki ):
Obwohl viele Mutationen in RPE65 zur Erblindung führen können, sollte Luxturna sie theoretisch alle behandeln. Das Produkt enthält eine vollständige Kopie von RPE65, verpackt in einem Adeno-assoziierten Virus, das für die Übertragung von DNA auf Netzhautzellen erforderlich ist, um ein voll funktionsfähiges Enzym zu erhalten.
Das Werkzeug ist für die einmalige Therapie vorgesehen, bei der der Chirurg eine Lösung mit etwa 150 Milliarden Viruspartikeln gefüllter DNA direkt unter die Netzhaut jedes Auges injiziert. Tests an Hindernissen mit unterschiedlichen Beleuchtungsstärken zeigten, dass die Behandlung das Sehvermögen der Patienten verbesserte.
Laut FDA gibt es in den USA 1.000 bis 2.000 Patienten mit RPE65-Mutationen, die möglicherweise von Luxturna profitieren. Der hohe Preis des Arzneimittels kann jedoch selbst für eine kleine Anzahl von Patienten ein Problem sein, eine Therapie zu erhalten. Der Preis wurde noch nicht bekannt gegeben, aber laut einer Aussage des CEO von Spark können die Therapiekosten 1 Million USD pro Patient übersteigen.
Ergänzung, altes Video mit animierter Demonstration der Arzneimittelverabreichung:
NochWas Menschen mit dieser Form der Blindheit sehen können:
Jean Bennett und eine Demonstration des Therapieerfolgs am Beispiel eines Kindes mit RPE65-Arbeitsproblemen: