Die Entwicklung einer Alterungstherapie ist ohne eine zuverlässige Diagnose des Alterns nicht möglich. Es erscheint nicht vernünftig, den Tod einer Person oder den Beginn einer tödlichen Krankheit zu erwarten, um zu verstehen: Haben wir mit dieser oder jener Therapie den Alterungsprozess verlangsamt oder nicht? Wir müssen sofort das objektive Bild sehen, das durch unsere Anti-Aging-Interventionen verursacht wird.
In der klinischen Praxis gibt es noch keine "große Diagnose des Alterns". Das heißt, es ist dem Patienten und dem behandelnden Arzt nicht möglich, altersbedingte Veränderungen auf molekularer Ebene vor dem Ausbruch von Krankheiten festzustellen. Wir wollen diese Lücke schließen, indem wir zunächst alle Hauptmerkmale altersbedingter Veränderungen und das verfügbare technologische Niveau für deren Messung beschreiben.
Wir werden die Präsentation des Konzepts der SENS-Diagnostik des Alterns fortsetzen, basierend auf der Tatsache, dass das SENS-Programm (das durch technische Methoden vernachlässigbares Altern erreicht) heute Ansätze zur Verlängerung der menschlichen Lebensdauer am vollständigsten beschreibt.
Viele haben von Proteinglykosylierung, Glykationsendprodukten (CNG, AGE) und dem Schaden gehört, den sie dem Körper zufügen. Es sollte jedoch beachtet werden, dass die Zugabe von Zucker zu anderen Molekülen keineswegs immer eine Pathologie ist. Die Glykosylierung selbst ist ein sehr häufiger und wichtiger physiologischer Prozess in lebenden Organismen. Ein wesentlicher Teil aller in Zellen synthetisierten Proteine unterliegt einer enzymatischen Glykosylierung, die für ihre normale Funktion erforderlich ist.
Grundsätzlich sind zwei Glykane (der Kohlenhydratteil des Bandes ist ein organisches Molekül) an der Glykosylierung beteiligt: N-Glykane (verbunden mit der Amidgruppe von Asparagin) und O-Glykane (verbunden mit der Hydroxylgruppe von Serin oder Threonin). Aufgrund des Alterns interessieren wir uns mehr für N-Glykane. Es wird beschrieben, dass sich mit zunehmendem Alter das Spektrum der Zuckerketten ändert, die sich während der N-Glykosylierung an Immunproteine anlagern. Und eine solche Veränderung spielt eine Schlüsselrolle bei der altersbedingten Zunahme der allgemeinen Entzündung im Körper. Somit kann der Gehalt an glykosylierten IgG-Antikörpern das biologische Alter einer Person noch genauer vorhersagen als die Länge der Telomere [1].
Darüber hinaus erwiesen sich zwei weitere Glykane, NGA2F und N2AF, als vielversprechende alternde Biomarker. Im Rahmen des europäischen Forschungsprogramms MARK - AGE zu alternden Biomarkern, das 2013 endete, wurde der GlycoAgeTest-Test entwickelt, um das biologische Alter einer Person zu bestimmen. Es basiert auf dem Verhältnis der Anzahl der Glykane NGA2F (mit zunehmendem Alter) und N2AF (deren Gehalt mit dem Alter abnimmt). Ein weiterer potenzieller Biomarker für Alterung und altersbedingte Erkrankungen (Herz-Kreislauf und Diabetes), der in der MARK-AGE-Studie beschrieben wurde, war Glykoprotein-Clusterin, das an der Stabilisierung von Proteinstrukturen beteiligt ist [2].
Wir wenden uns nun der Betrachtung des pathologischen Teils dieses Phänomens zu. Neben der vom Körper regulierten Enzymglykosylierung gibt es eine nichtenzymatische Form dieses Prozesses, die sogenannte Maillard-Reaktion, deren Ergebnis das Auftreten einer Vielzahl von Glykationsprodukten im Körper ist. Es ist zu beachten, dass der Prozess der nichtenzymatischen Glykosylierung praktisch nicht reguliert wird. Es besteht zwar die Möglichkeit, die Glykosylierung durch Transglikation "einzuschränken", bei der Glutathion, Polyamine, Thiole, freie Aminosäuren, beispielsweise Taurin, Lysin, verbraucht werden. Und auch durch die Inaktivierung von Methylglyoxal durch das Glyoxalase-System: Glyoxalase I wandelt Methylglyoxal und reduziertes Glutathion in Lactoylglutathion um, das dann durch Glyoxalase II zu D-Lactat metabolisiert wird.
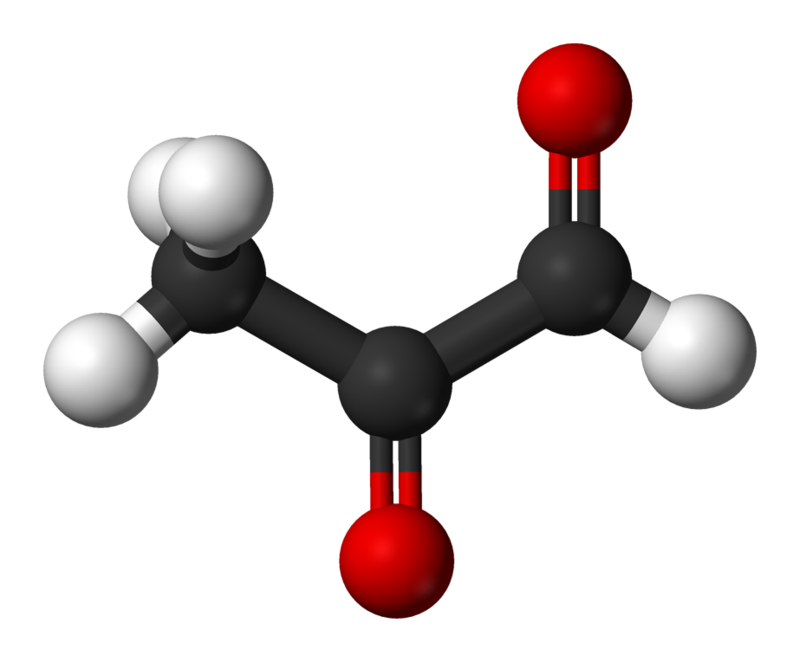 Methylglyoxalstruktur
MethylglyoxalstrukturUnter den Glykationsprodukten werden frühe (Amadori-Produkte) und späte (oder endgültige) Glykationsprodukte unterschieden. Die nichtenzymatische Glykosylierung erfolgt in mehreren Stufen. Dieser Prozess beginnt mit der Tatsache, dass sich Glucose und andere einfache Zucker mit der Aminogruppe verbinden und eine Kette weiterer Reaktionen auslösen. Zu Beginn wird während der Reaktion zwischen der Aldehydgruppe der Zucker und der Aminogruppe eine instabile Aldimingruppe (Schiffsche Base) gebildet, die sich in eine Reihe anderer, stabilerer Verbindungen, frühe Glykosylierungsprodukte, die sogenannten Glykosylierungsprodukte, verwandeln kann Amadori Produkte. Eines der frühesten Produkte der Glukoseaddition an Protein ist Ne-Fructosyl-Lysin, das wiederum verschiedene Endprodukte der Glykation (CNG) abbaut. Hydroimidazolone, Derivate von Argininresten, die durch Glyoxal, Methylglyoxal und 3-Desoxyglucoson (3-DG) modifiziert sind, werden in den größten Mengen als CNG hergestellt. Andere gut untersuchte CNGs sind Nδ-Carboxymethyl-Lysin (CML) und Nδ-Carboxyethyl-Lysin (CEL) sowie Glucosepan und Pentosidin, die für die Proteinvernetzung charakteristisch sind [3]. Eine der am einfachsten zu definierenden Arten von CNG ist Pentosidin, das sich beispielsweise ab dem 20. Lebensjahr in den Sehnen der großen Muskeln einer Person (dh dort, wo die Geschwindigkeit des Kollagenumsatzes verlangsamt wird) ansammelt und dessen Konzentration linear bis ins hohe Alter ansteigt.
Bis vor kurzem wurde angenommen, dass Glucose die Hauptsubstanz für die Bildung von CNG ist. Die genaue Ermittlung unterschiedlicher Raten der intra- und extrazellulären Bildung von CNG zeigte jedoch, dass dies nicht der Fall ist. Zucker wie Fructose, Glucose-6-phosphat und Glycerinaldehyd-3-phosphat weisen eine höhere Rate der intrazellulären CNG-Bildung auf. Die negative Wirkung von Glycerinaldehyd auf das Molekül des kontraktilen Haupt- und Zytoskelettproteins Actin wurde beschrieben, was zur Bildung von Pentosidin- und Bithyrosin-Vernetzungen und zum Verlust der Actin-Funktionalität führt [4].
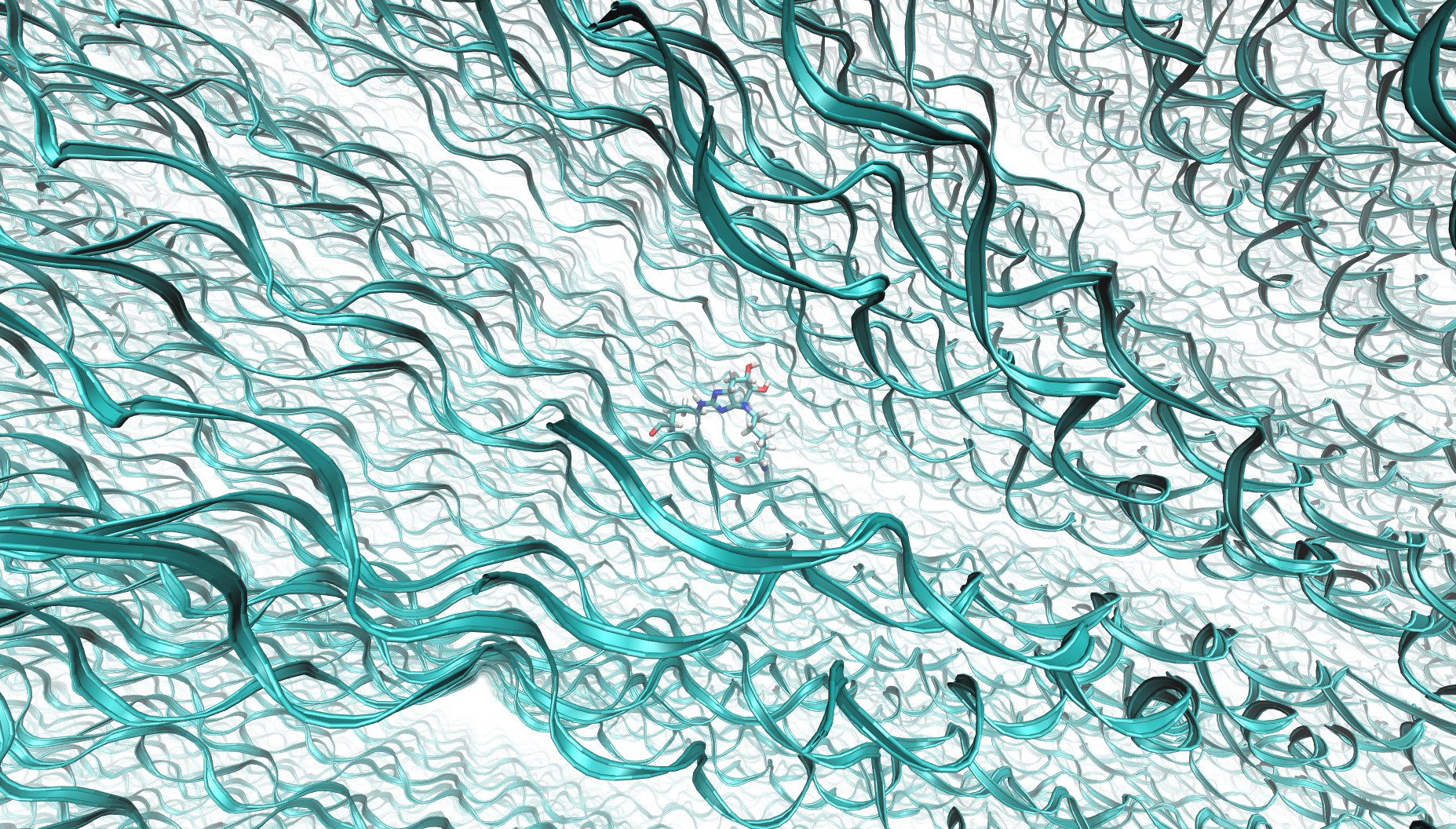 Vernetzung von Kollagenmolekülen mit Glucosepan.
Vernetzung von Kollagenmolekülen mit Glucosepan.Es wird angenommen, dass nichtenzymatische Glykosylierung und CNG eng mit einer Reihe von altersabhängigen Krankheiten verbunden sind, wie Diabetes, rheumatoide Arthritis, Atherosklerose, Parkinson- und Alzheimer-Krankheit, Amyotrophe Lateralsklerose, Katarakte und Krebs [5]. Proteine, die bei der Maillard-Reaktion einer Glykation unterzogen werden, werden aphisiologisch vernetzt, während sie ihre Eigenschaften verlieren. Dies stellt ein besonders großes Problem für langlebige Proteine dar (zum Beispiel haben Hautkollagenmoleküle nach einer Reihe von Studien eine Halbwertszeit von 15 Jahren und Knorpel von mehr als 100 Jahren), die einen bedeutenden Teil aller Proteine im Körper ausmachen - etwa ein Drittel. Die resultierende zusätzliche Vernetzung zwischen den Molekülen verletzt die Funktionen dieser Proteine, was zu einem Verlust der Gewebeelastizität führt und häufig bei Alterung und Pathologien beobachtet wird. Durch die Glykation wird das bereits langsam erneuerte Kollagenprotein noch langlebiger - nach der Glykation wird es resistent gegen die physiologische Wirkung endogener Kollagenasen, die für eine Gewebserneuerung sorgen.
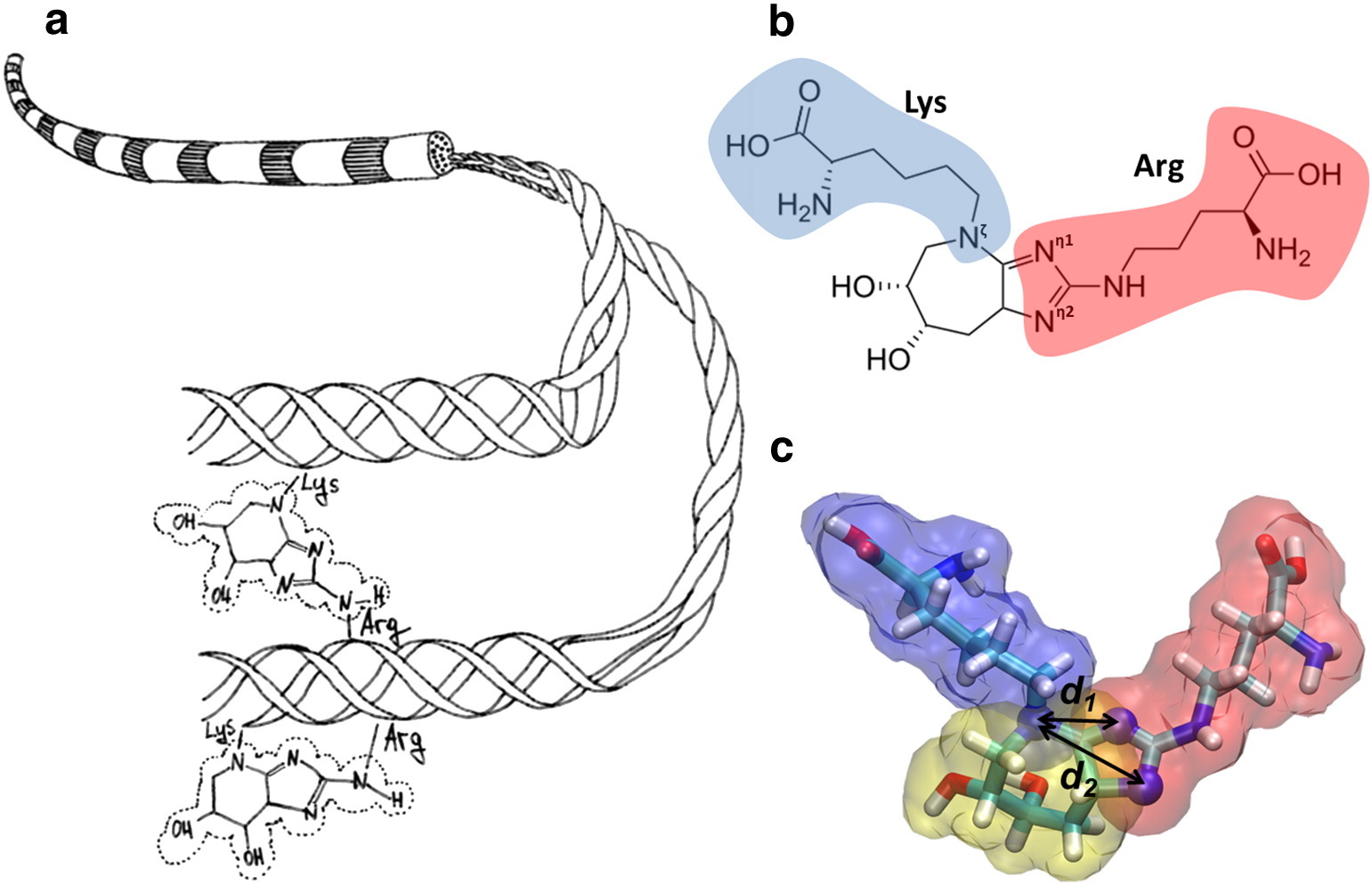 Abbildung (a) zeigt ein Diagramm von Kollagenfibrillen und der Bildung von Glucoseepan, das die Seitenketten von Lysin und Arginin kovalent bindet. (b) Die chemische Struktur von Glucosopan ist gezeigt, das Lysin (blau) mit Arginin (rot) vernetzt. (c) Ein molekulares Modell von Glucosopan ist gezeigt.
Abbildung (a) zeigt ein Diagramm von Kollagenfibrillen und der Bildung von Glucoseepan, das die Seitenketten von Lysin und Arginin kovalent bindet. (b) Die chemische Struktur von Glucosopan ist gezeigt, das Lysin (blau) mit Arginin (rot) vernetzt. (c) Ein molekulares Modell von Glucosopan ist gezeigt.Die Beteiligung des glykierten Fibroblasten-Wachstumsfaktors β-FGF an der Bildung von Fibrose wird beschrieben. Die Glykation der Arg-Gli-Asp-Sequenz des Fibronektin-Proteins führt zu einer Verletzung der vaskulären Regenerationsfähigkeit und zum Fortschreiten der vaskulären Pathologien. Mit zunehmendem Alter sammeln sich CNGs in der Linse und in der Netzhaut an. Kristalle, die Hauptstrukturproteine der Augenlinse, sind anfällig für Glykation und Vernetzung. Die Glykation der Linsenproteine führt zu Katarakten. Glykiertes Hämoglobin, das zur Bestimmung des durchschnittlichen Glykämieniveaus in den letzten 3 Monaten verwendet wird, verliert die Fähigkeit, Sauerstoff auf Gewebe zu übertragen, was viele chemische Prozesse negativ beeinflusst.
Es ist auch bekannt, dass die Proteinglykation und die Bildung von CNG mit einer Zunahme der Aktivität freier Radikale und der Lipidperoxidation einhergehen, was zur Entwicklung altersbedingter Krankheiten beiträgt. Dies ist auf die Tatsache zurückzuführen, dass bei der Proteinglykation die Prozesse der Autoautomatisierung von Zucker eingeleitet werden, die mit einer Erhöhung der Produktion reaktiver Sauerstoffspezies (ROS) einhergehen. Darüber hinaus führt die Bindung von CNG an den CNG-Rezeptor (RAGE) auch zur Bildung von reaktivem ROS und zur anschließenden Aktivierung des oxidativen stressempfindlichen Transkriptionsfaktors NF-kB, der mit Entzündung und Atherogenese verbunden ist.
Die Aktivierung von NF-κB erhöht wiederum die Expression von RAGE, wodurch ein positiver Rückkopplungszyklus erzeugt wird, der die Produktion von Entzündungspromotoren erhöht. Darüber hinaus aktiviert die CNG-RAGE-Wechselwirkung die NADPH-Oxidase (einen Komplex von Enzymen, die Superoxid produzieren), wodurch der intrazelluläre oxidative Stress erhöht wird. Und der Anstieg des oxidativen Stresses durch NADPH-Oxidase als Reaktion auf die Wechselwirkung von AGE-RAGE aktiviert wiederum NF-κB. Und hier können wir eine Reihe von "Teufelskreisen" beobachten - Zyklen mit positivem Feedback.
Die Glykation mitochondrialer Atmungskettenproteine trägt ebenfalls zu diesem Prozess bei: Eine Störung der Atmungskette dient als konstante Quelle für Superoxidradikale. Darüber hinaus kann die Bildung in Mitochondrien und anderen Strukturen unter dem Einfluss der Glykation nicht zusammensetzbarer CNGs für die Implementierung eines Phänomens wie des „metabolischen Gedächtnisses“ verantwortlich sein. Bei Patienten mit Typ-2-Diabetes verhindert eine strikte Blutzuckerkontrolle nicht mehr die Entwicklung von Komplikationen im Zusammenhang mit Herz-Kreislauf-Erkrankungen. Es wird angenommen, dass nicht zusammensetzbare CNGs eine wichtige Rolle bei diesem Phänomen spielen [6].
Mit der Glykation kommt es auch zu einer Zunahme von Entzündungsprozessen. Während der Kollagenglykosylierung reichern sich die Endprodukte dieses Prozesses in der extravaskulären Matrix an, die der Körper als fremd wahrnimmt. Aus diesem Grund entsteht eine Immunantwort, bei der Immunzellen - Makrophagen - die Sekretion entzündungsfördernder Zytokine (TNF-α, Interleukin-6 usw.) erhöhen, die für ihre Fähigkeit bekannt sind, die Insulinresistenz und Atherogenese negativ zu beeinflussen [7].
Darüber hinaus verändern „vernetzte“ Proteine die Struktur (Nanotopographie) und erhöhen die Steifheit der extrazellulären Matrix. Durch Membranmechanorezeptoren und das Zellzytoskelett beeinflussen Signalmoleküle zusammen mit Signalmolekülen die Expression von Genen, die Funktion von Zellen, Geweben und den Körper insgesamt. Darüber hinaus leiten Kollagenmoleküle dank des Prolins schwache elektromagnetische Wellen, die von Zellen und Geweben erzeugt werden, und bilden möglicherweise zusätzlich zu mechanischen und chemischen Signalen ein einziges bioelektrisches Signalsystem des Körpers. Es ist interessant festzustellen, dass Sie durch Ändern der Topographie des Mediums oder der elektromagnetischen Strahlung nicht nur den Zellzyklus steuern können, sondern auch adulte somatische Zellen ohne die Hilfe von Viren mit dem Vektor der Yamanaka-Faktoren in Stammzellen verwandeln können.
Selbst geringfügige Änderungen des Schermoduls und der Viskoelastizität des interzellulären Mediums wirken sich stark auf die Zellen aus - die „alte“ extrazelluläre Matrix kann die Wirksamkeit des Einsatzes von Senolytika und Stammzelltherapie erheblich einschränken. So altern „junge“ Fibroblasten in der alten Matrix schnell und umgekehrt - „alte“ Zellen verlieren Anzeichen eines altersbedingten sekretorischen Phänotyps in der „jungen“ Matrix.
Was sind die Ursachen für glykierte Proteine und CNG? Es wird angenommen, dass das wichtigste für den modernen Menschen heute Junk Food ist. Die gebratene braun-schwarze Kruste auf den Produkten stellt die Ansammlung von CNG dar, die durch die thermische Verarbeitung von Produkten (Braten von Fleisch, Kartoffeln usw.) bei hohen Temperaturen entsteht. Der gebratene Speck gilt als Rekordhalter für die Anzahl der gebildeten CNGs. Darüber hinaus kann der Verzehr von Lebensmitteln, die viele schnelle Kohlenhydrate enthalten (Süßwaren, zuckerhaltige Getränke usw.), auch zur Proteinglykation und zur Bildung von CNG beitragen. Es sind Produkte bekannt, die im Gegenteil dazu beitragen, der Anreicherung von CNG zu widerstehen - Rettich, Rettich, Brokkoli, dank der darin enthaltenen Substanz Sulforaphan. Es ist nicht überraschend, aber neben Feinschmeckern versorgen sich Raucher regelmäßig mit erhöhten CNG-Dosen. Tabakrauch enthält Glykotoxine, die mit Lysin- und Argininresten unter Bildung von CNG reagieren. Dies ist wahrscheinlich der Grund, warum Raucher eine chronische Entzündung der Atmungsorgane haben [8].
Wie bereits erwähnt, erfolgt die Bildung von CNG neben dem Einfluss externer Faktoren normalerweise auch endogen (dh im Körper) unter physiologischen Bedingungen. Obwohl dieser Prozess langsam und unbedeutend ist, nimmt er mit zunehmender Konzentration an freien Radikalen, Insulinresistenz, Diabetes mellitus und einem Anstieg des Blutzuckers signifikant zu. CNG sammelt sich im Körper an und zieht eine Person in den „Sumpf“ pathologischer Prozesse, aus denen es dann nicht so einfach ist, herauszukommen.
In der bildlichen Darstellung der Autoren von SENS wirkt die Proteinvernetzung als molekulare "Handschellen", die Proteinmoleküle binden und dadurch ihre Funktion verletzen. SENS-Autoren sehen eine Lösung für dieses Problem in der Entwicklung von Arzneimitteln, die mit Vernetzung reagieren und diese brechen können, ohne andere strukturelle Merkmale der Moleküle zu zerstören. Ein günstiger Umstand bei diesem Prozess ist ihrer Meinung nach, dass Vernetzungen, die als chemische Unfälle in den Strukturen unserer Proteinmoleküle auftreten, eine sehr ungewöhnliche chemische Struktur aufweisen, die normalerweise in vom Körper produzierten Substanzen nicht auftritt. Was soll die Suche und Schaffung von Therapeutika erleichtern.
Darüber hinaus identifizieren die Autoren von SENS eine Reihe vielversprechender Ansätze zur Lösung dieses Problems. B. das Finden oder Entwickeln von Enzymen anstelle von Medikamenten, um Vernetzungen abzubauen. Ebenso wie die Entwicklung von "Einweg" -Proteinen, die die Vernetzung zerstören würden und dann selbst zerstört würden. Es ist bekannt, dass solche Proteine für andere Zwecke existieren, beispielsweise für MGMT-DNA-regenerierendes Protein [9]. Für einen Ansatz zur Suche nach Enzymen spricht die Tatsache, dass dehydratisierende Enzyme in lebenden Organismen beschrieben werden. So wurden in Pilzen und Bakterien glykationsresistente Enzyme Amadoriasis, Fructosolysin-6-Kinase frlD und Fructosolysin-6-phosphat-Deglycase frlB gefunden, die auf niedermolekulare Aminosäureverbindungen mit Zucker wirken [10]. Bei Wirbeltieren wurden die Enzyme Fructosamin-3-Kinase (FN3K) und das verwandte Protein FN3K-RP gefunden, die Glykationsprodukte in ATP-abhängigen Prozessen intrazellulär abbauen können [11].
Es wird angenommen, dass Glucoseepane den größten Einfluss auf den Krankheitsverlauf bei älteren Menschen hat und daher ein vorrangiges Ziel für die Anti-Aging-Therapie ist.
Leider wurde Glucosepan nicht als Ziel für zuvor entwickelte Anti-Vernetzungsmittel gewählt, wie Alagebrium / ALT-711 (Wolffenbuttel et al., 1998), C36 (Cheng et al., 2007), TRC4149 (Pathal et al., 2008) ), und er muss nur seine Rolle in den Mechanismen des Alterns beweisen. Diese Substanzen zielten darauf ab, Carboxymethyllysin zu neutralisieren, das häufigste späte Maillard-Reaktionsprodukt, das sich mit Diabetes im Körper ansammelt.
Derzeit arbeitet eine Gruppe von David Spiegel von der Yale University an der Synthese von Antikörpern gegen Glucoseepan-haltige Proteine. Aubrey de Gray bestätigt die Bedeutung der Glucoseepane-Forschung und kündigte kürzlich die Registrierung von Revel an, auf deren Grundlage die an der Universität begonnene Forschung wahrscheinlich fortgesetzt wird.
Es ist jedoch wahrscheinlich, dass weder Antikörper noch Enzyme aufgrund ihrer Größe in der Lage sind, zwischen Kollagenfibrillen einzudringen. Darüber hinaus wird die zerrissene Vernetzung von Kollagen nach Einnahme des Arzneimittels wiederhergestellt, was eine zweite Therapie erfordert.
Daher scheinen künstliche enzymähnliche Katalysatoren, deren Größe um ein Vielfaches kleiner sein kann als die Größe der ursprünglichen Enzyme, eine interessantere Alternative zu sein. Ähnliche Moleküle mit einer bestimmten katalytischen Aktivität - Spiroligomere - werden von einer Gruppe von Christian Schaffmeister von der Temple University entwickelt.
Wie bereits erwähnt, kann ihre Quantifizierung ein genauer und zuverlässiger Biomarker für das Altern sein, da sich die Endprodukte der Glykation während des Alterns ansammeln. Sowohl der Nachweis von CNG im Körper als auch die frühzeitige Diagnose von Veränderungen in der Zusammensetzung und Struktur der interzellulären Matrix sind jedoch aufgrund der Art der Veränderungen, die durch Organe und Systeme begrenzt sind, und der Notwendigkeit mehrerer Biopsien schwierig. Selbst in einem Organismus sind die Ergebnisse je nach Ort der Biopsie und Art des untersuchten Endglykationsendprodukts sehr unterschiedlich.
Die verfügbaren Methoden zur Bestimmung der endgültigen Glykationsprodukte in der Haut, wie z. B. Autofluoreszenz, dh ohne Verwendung spezieller Farbstoffe (das von der niederländischen Firma DiagnOptics BV hergestellte AGE-READER-Gerät), liefern keine genauen Daten, und viele Faktoren können die Messergebnisse beeinflussen, z. B. Änderungen des Wassers - .
Die wichtigste und genaueste Methode zur Quantifizierung von CNG im Körper ist heute die Chromatographie in Kombination mit der massenspektrometrischen Detektion. Massenspektrometrie ermöglicht es, Proteine mit einem hohen Maß an Sicherheit zu identifizieren und ihre Mengen in komplexen Proteinmischungen zu bestimmen.Ein enzymgebundener Immunosorbens-Assay wird auch verwendet, um den CNG-Spiegel zu bestimmen. Diese Methode weist jedoch eine Reihe qualitativer Einschränkungen auf (unzureichende Spezifität der Antikörper, Einfluss freier Glykationsprodukte usw.). Daher wird angenommen, dass es ratsam ist, es in Kombination mit Massenspektrometrie durchzuführen. CNG kann auch anhand der Gesamtintensität ihrer Fluoreszenz identifiziert werden. Dies hat auch seine Grenzen (die meisten CNGs quantifizieren die Fluoreszenz nicht und können daher nicht bestimmt werden) und ermöglicht eine genauere Bestimmung von CNG-Peptiden mit niedrigem Molekulargewicht und freien Glykationsprodukten.Einer der vielversprechenden Biomarker, der nicht nur die Anreicherung von CNG, sondern auch das erhöhte Mortalitätsrisiko aus allen Gründen zeigt, ist Plasma-Carboxymethyl-Lysin (KML). KML ist eines der dominierenden CNGs im Körper, sowohl im Blutkreislauf als auch im Gewebe. Darüber hinaus ist KML das einzige CNG, das als Ligand für CNG-Rezeptoren (RAGEs) fungiert. Die Bindung von RAGE an KML führt zu einer Zunahme der Bildung freier Radikale, einer Aktivierung des Weges des Kernfaktors Nf-κB und einer Zunahme des Spiegels von Entzündungsmediatoren (wie Tumornekrosefaktor-alpha, Interleukin-6 und C-reaktivem Protein). Es ist bekannt, dass sich CML mit zunehmendem Alter in großen Blutgefäßen ansammelt. Hohe Konzentrationen dieses CNG im Serum sind mit einer höheren arteriellen Steifheit verbunden, einem starken Risikofaktor für die Entwicklung kardiovaskulärer Pathologien und deren Mortalität.wie aus der Längsschnittstudie des Alterns in Baltimore hervorgeht [12].Es ist auch bekannt, dass ältere Menschen mit zerebrovaskulären Erkrankungen einen erhöhten CML-Spiegel in kortikalen Neuronen und Gehirngefäßen aufweisen, was mit der Schwere der kognitiven Beeinträchtigung verbunden ist. In einer 6-Jahres-Studie zu Invecchiare in Chianti, an der 1.013 Personen über 65 Jahre teilnahmen, wurde gezeigt, dass die durchschnittliche Plasmakonzentration von CML, gemessen mit einem enzymgebundenen Immunosorbens-Assay, bei Personen, die aus allen Gründen starben, signifikant höher war als Überlebende [13]. Im Jahr 2018 beschrieb eine Gruppe dänischer und schwedischer Wissenschaftler einen neuen monoklonalen Antikörper, D1-B2, der auf KML abzielt und ein gutes Potenzial für den Nachweis dieses CNG durch einen enzymgebundenen Immunosorbens-Assay aufweist. [14]Zuvor wurden mithilfe der Methode der gekoppelten Flüssigkeitschromatographie zusammen mit der Massenspektrometrie eine Reihe von CNGs (Glucoseepan, DOGDIC, MODIC und GODIC) identifiziert, die sich während des Alterns und bei Pathologien im Gewebe ansammeln und als Marker für pathophysiologische Prozesse verwendet werden können [15]. Die Methode der Hochleistungsflüssigchromatographie ermöglicht den Nachweis von zwei weiteren CNG-Klassen im Zusammenhang mit Alterung und Diabetes - GOLD und MOLD [16].Autoren der Rezension: Denis Odinokov, Alexey Rzheshevsky.Referenzliste:- Krištić J, Vučković F, Menni C, Klarić L, Keser T, Beceheli I, Pučić-Baković M. et al. Glycans are a novel biomarker of chronological and biological ages.Gerontol A Biol Sci Med Sci. 2014 Jul;69(7):779-89.
- Bürkle A, Moreno-Villanueva M, Bernhard J, Blasco M, Zondag G, Hoeijmakers JH6, Toussaint O, Grubeck-Loebenstein B, Mocchegiani E, Collino S, Gonos ES, Sikora E. et al. MARK-AGE biomarkers of ageing. Mech Ageing Dev. 2015 Nov;151:2-12.
- Ahmed N., Thornalley PJ . . 2009. №9, . 642-51.
- . ., . ., . ., . . in vitro , . . 2006, №2, . 51-59.
- .., . : . , 2010, : 56(2), 168-178.
- .. «» . . . 2011. № 4.
- Bernheim J, Rashid G, Gavrieli R, Korzets Z, Wolach B. In vitro effect of advanced glycation end-products on human polymorphonuclear superoxide production. Eur J Clin Invest. 2001. Dec;31(12):1064-9.
- Mullick AE, McDonald JM, Melkonian G, Talbot P, Pinkerton KE, Rutledge JC. Reactive carbonyls from tobacco smoke increase arterial endothelial layer injury. Am J Physiol Heart Circ Physiol. 2002 Aug;283(2):H591-7.
- GlycoSENS: Breaking extracellular crosslinks.
- Monnier VM, Sell DR. Prevention and repair of protein damage by the Maillard reactionin vivo. Rejuvenation Res. 2006;9(2):264–273.
- Szwergold BS1, Bunker RD, Loomes KM. The physiological substrates of fructosamine-3-kinase-related-protein (FN3KRP) are intermediates of nonenzymatic reactions between biological amines and ketose sugars (fructation products). Med Hypotheses. 2011 Nov;77(5):739-44.
- Semba RD, Najjar SS, Sun K, et al. Serum carboxymethyl-lysine, an advanced glycation end product, is associated with increased aortic pulse wave velocity in adults. Bin J Hypertens. 2009;22:74–79
- Semba, RD, Bandinelli, S., Sun, K., Guralnik, JM, & Ferrucci, L. (2009). Plasma Carboxymethyl-Lysine, an Advanced Glycation End Product, and All-Cause and Cardiovascular Disease Mortality in Older Community-Dwelling Adults. Journal of the American Geriatrics Society, 57(10), 1874–1880.
- Wendel U, Persson N, Risinger C, Bengtsson E, Nodin B, Danielsson L, Welinder C, Nordin Fredrikson G, Jansson B, Blixt O. A novel monoclonal antibody targeting carboxymethyllysine, an advanced glycation end product in atherosclerosis and pancreatic cancer. PLoS One. 2018 Feb 8;13(2):e0191872.
- Biemel KM, Fried DA, Lederer MO. Identification and quantification of major maillard cross-links in human serum albumin and lens protein. Evidence for glucosepane as the dominant compound. J Biol Chem. 2002 Jul 12;277(28):24907-15. Epub 2002 Apr 26.
- Chellan P, Nagaraj RH. Protein crosslinking by the Maillard reaction: dicarbonyl-derived imidazolium crosslinks in aging and diabetes. Arch Biochem Biophys. 1999 Aug 1;368(1):98-104.