Anti-Aging-Mechanismen und längere Lebensdauer im Zusammenhang mit Kalorieneinschränkungen: Daten aus Studien mit gentechnisch veränderten Tieren.
Es ist bekannt, dass Kalorienreduktion (CR) die Lebenserwartung erhöht und verschiedene pathophysiologische Veränderungen hemmt. CR hemmt die Signalübertragung von Wachstumshormon / Insulin-ähnlichem Wachstumsfaktor und mTORC1, aktiviert Sirtuin und verstärkt die mitochondriale Redoxregulation. Die genauen Mechanismen werden jedoch diskutiert. In diesem Aufsatz werden wir CR-Mechanismen anhand von Tierstudien diskutieren, die gemäß den jüngsten Fortschritten in der molekularen und genetischen Technologie im Hinblick auf die von Holliday 1989 vorgeschlagene Hypothese der adaptiven Reaktion genetisch verändert wurden. Wir werden auch die positiven Wirkungen von CR erklären, klassifiziert danach, ob sie unter Ernährungs- oder Fastenbedingungen wirken.
1935 wurde beschrieben, dass CR die Lebenserwartung von Ratten erhöht [1]. CR, auch als diätetische Einschränkung oder Energieeinschränkung bekannt, wird in der Alterungsforschung häufig als starke und leicht reproduzierbare Manipulation der Ernährung zur Verlängerung der Lebensdauer eingesetzt. CR wurde bei verschiedenen Arten beobachtet, von Hefen und Nematoden bis zu Säugetieren. Bei Säugetieren wurde es hauptsächlich an Nagetieren untersucht, bei denen CR verschiedene altersbedingte pathophysiologische Veränderungen unterdrückt und die durchschnittliche und maximale Lebensdauer verlängert. Die vorteilhaften Wirkungen von CR verschwinden jedoch bei bestimmten Stämmen und / oder Bedingungen. In einer kürzlich erschienenen Übersicht werden diese Einschränkungen detailliert beschrieben [2]. Das Ausmaß, in dem CR vorteilhafte Wirkungen ausübt, hängt von Faktoren wie Nagetierarten, Stämmen und dem Zeitpunkt des Einsetzens von CR ab. Im Allgemeinen unterdrückt die in jungen Jahren begonnene Langzeit-CR jedoch altersbedingte pathophysiologische Veränderungen und verlängert die Lebenserwartung bei verschiedenen Nagetieren. Es ist auch wichtig, dass die Beschränkungen einzelner Nährstoffe (z. B. Glucose, Lipid, Protein) ohne Energieeinschränkung keine derart vorteilhaften Wirkungen hervorrufen [3, 4].
Vor mehr als 20 Jahren wurde festgestellt, dass Ames-Zwergmäuse, die eine Mutation des Prop1-Gens aufweisen, länger leben als Wildtyp-Mäuse [5]. Dies war der erste Bericht, dass eine einzelne Genmutation oder genetische Veränderung die Lebenserwartung von Säugetieren verlängern kann. Nach unserem Kenntnisstand leben mehr als 40 Mäuse und Ratten mit einer einzigen Genmutation oder genetischen Veränderung länger als Wildtyp-Tiere. Von diesen Mäusen und Ratten zeigt ungefähr ein Drittel eine unterdrückte Signalübertragung von Wachstumshormon (GH) / Insulin-ähnlichem Wachstumsfaktor 1 (IGF1). Da CR auch die GH / IGF1-Signalübertragung unterdrückt, können die vorteilhaften Wirkungen von CR darauf beruhen. Andere molekulare Mechanismen, die vorgeschlagen wurden, um die vorteilhaften Wirkungen von CR zu regulieren, umfassen die Hemmung der Aktivität des mechanistischen Ziels von Rapamycinkomplex 1 (mTORC1), die Aktivierung der Autophagie, die Aktivierung des NAD + - und Sirtuin-Metabolismus und eine erhöhte Redoxregulation der Mitochondrien [6, 7]. Diese Mechanismen sind jedoch nicht vollständig verstanden.
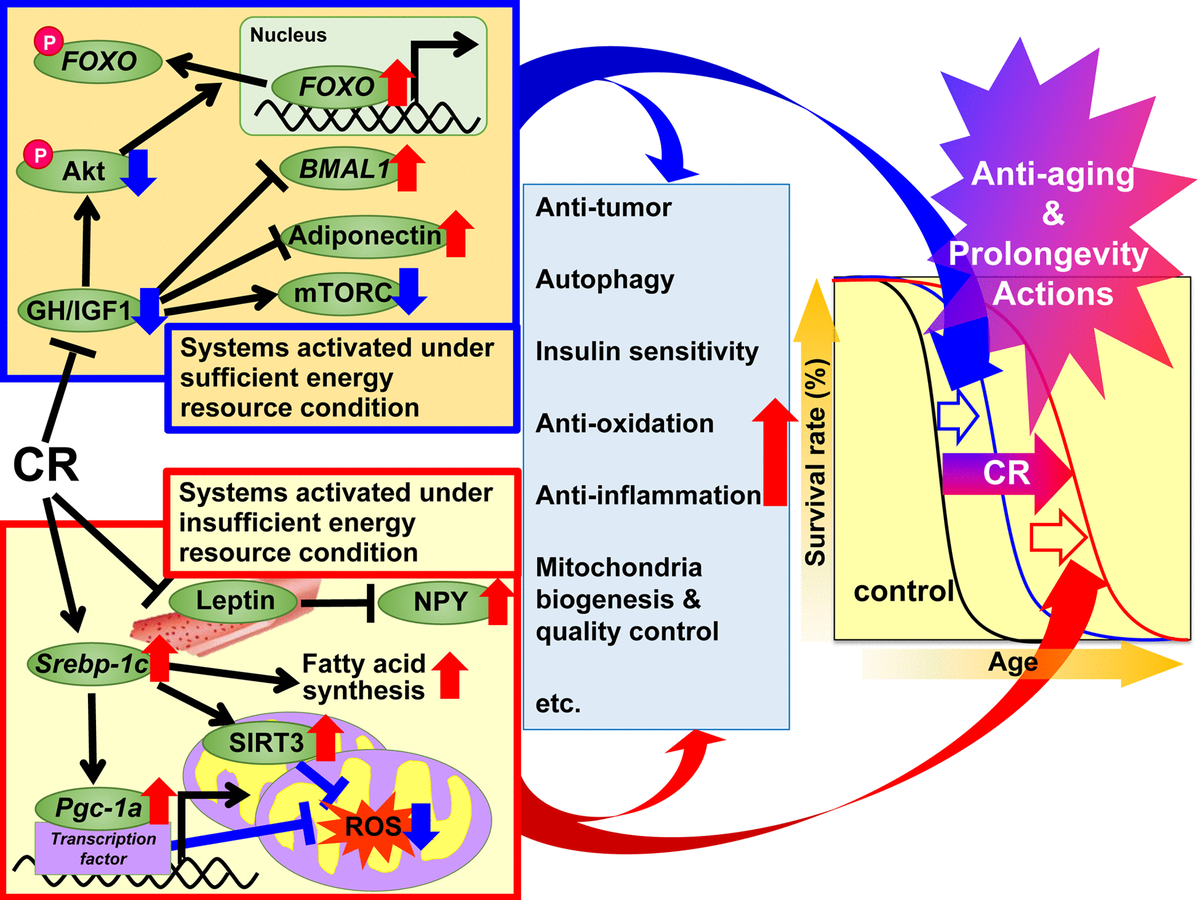 Abb. 1. Die vorgeschlagenen Wirkmechanismen der Kalorienreduktion (CR) gegen das Altern und zur Verlängerung der Lebensdauer basieren auf der Hypothese der adaptiven Reaktion. Es wird vorgeschlagen, die Regulierungsmechanismen von CR in zwei Systeme zu unterteilen. Das erste System wird unter ausreichenden Energiebedingungen aktiviert, wenn es möglich ist, Energie frei zu nutzen, und Tiere gut wachsen, sich mehr vermehren und überschüssige Energie in Form von Triglyceriden (TG) in weißem Fettgewebe (WAT) für die spätere Verwendung speichern. Dieses System umfasst Wachstumshormon (GH) / Insulin-ähnlichen Wachstumsfaktor 1 (IGF1), Akt, FOXO, mTORC, Adiponectin und BMAL1. Das zweite System wird unter Bedingungen unzureichender Energie aktiviert, wenn ein übermäßiger Energieverbrauch keinen Nutzen bringt und Tiere Wachstum und Fortpflanzung unterdrücken und die eingesparte Energie zur Aufrechterhaltung der biologischen Funktion nutzen. Dieses System umfasst solche Signalwege: SREBP-1c-Protein, Sirtuin (SIRT), PGC-1α-Protein, mitochondriale reaktive Sauerstoffspezies (ROS), Leptin und Neuropeptid Y (NPY). Bei Tieren mit CR sind diese Signale wirksam für Energieverbrauch. Darüber hinaus können verschiedene Signale und / oder Faktoren zu den mit CR verbundenen vorteilhaften Wirkungen beitragen, einschließlich antioxidativer, entzündungshemmender, Antitumor- und anderer CR-Wirkungen in unterschiedlichem Ausmaß in jedem Gewebe oder Organ, und dadurch zu einer Verjüngung und Verlängerung des Lebens führen.
Abb. 1. Die vorgeschlagenen Wirkmechanismen der Kalorienreduktion (CR) gegen das Altern und zur Verlängerung der Lebensdauer basieren auf der Hypothese der adaptiven Reaktion. Es wird vorgeschlagen, die Regulierungsmechanismen von CR in zwei Systeme zu unterteilen. Das erste System wird unter ausreichenden Energiebedingungen aktiviert, wenn es möglich ist, Energie frei zu nutzen, und Tiere gut wachsen, sich mehr vermehren und überschüssige Energie in Form von Triglyceriden (TG) in weißem Fettgewebe (WAT) für die spätere Verwendung speichern. Dieses System umfasst Wachstumshormon (GH) / Insulin-ähnlichen Wachstumsfaktor 1 (IGF1), Akt, FOXO, mTORC, Adiponectin und BMAL1. Das zweite System wird unter Bedingungen unzureichender Energie aktiviert, wenn ein übermäßiger Energieverbrauch keinen Nutzen bringt und Tiere Wachstum und Fortpflanzung unterdrücken und die eingesparte Energie zur Aufrechterhaltung der biologischen Funktion nutzen. Dieses System umfasst solche Signalwege: SREBP-1c-Protein, Sirtuin (SIRT), PGC-1α-Protein, mitochondriale reaktive Sauerstoffspezies (ROS), Leptin und Neuropeptid Y (NPY). Bei Tieren mit CR sind diese Signale wirksam für Energieverbrauch. Darüber hinaus können verschiedene Signale und / oder Faktoren zu den mit CR verbundenen vorteilhaften Wirkungen beitragen, einschließlich antioxidativer, entzündungshemmender, Antitumor- und anderer CR-Wirkungen in unterschiedlichem Ausmaß in jedem Gewebe oder Organ, und dadurch zu einer Verjüngung und Verlängerung des Lebens führen.Ziele und molekulare Mechanismen von CR
GH-, IGF1- und FOXO1-Signalisierung
GH reguliert die IGF1-Produktion vorwiegend in der Leber über den GH-Rezeptor (GHR). IGF1 wirkt auf den IGF1-Rezeptor und phosphoryliert dann Akt, Serin / Threonin-Kinase in den Zielzellen. Die phosphorylierte Form von Akt phosphoryliert dann die Transkriptionsfaktoren von FOXO und erleichtert so den Kernexport. Daher erhöht die Unterdrückung der GH / IGF1-Signalübertragung die Expression mehrerer Gene, die durch FOXO-Transkriptionsfaktoren aktiviert werden.
Mehrere modifizierte Mausarten, Ames-Zwerg, Snell-Zwerg und GHR-Knockout (GHR KO), zeigen eine unterdrückte GH-Signalübertragung und haben eine verlängerte Lebensdauer. Diese Zwergmäuse haben ähnliche Phänotypen wie CR-Mäuse, einschließlich der unterdrückten GH / IGF1-Signalübertragung, verringerter Spiegel von Schilddrüsenhormon, Insulin und Glucose, niedrigerer Körpertemperatur und verringerter Fettleibigkeit. Das Expressionsprofil von Lebergenen unterscheidet sich jedoch signifikant zwischen GHR KO-Mäusen und CR-Mäusen [8]. Wir berichteten auch, dass sich ein Teil des Genexpressionsprofils in weißem Fettgewebe (WAT) von CR-Ratten signifikant von dem von lebenslangen Zwergratten unterscheidet, die das GH-Antisense-Transgen tragen [9].
Bonkowski et al. berichteten, dass CR die Insulinsensitivität und die Lebenserwartung bei Wildtyp-Mäusen erhöht, nicht jedoch bei GHR-KO-Mäusen [10]. Daher schlugen sie vor, dass der Effekt der Erhöhung der CR-Lebensdauer von der Unterdrückung der GH / IGF1-Signalübertragung abhängt. Bei Zwergmäusen und Zwergratten, die das Antisense-GH-Transgen tragen, erhöhte CR die Lebenserwartung weiter [11, 12]. Diese Daten legen nahe, dass Anti-Aging-Maßnahmen und die Erhöhung der CR-Lebenserwartung sowohl unabhängig vom GH / IGF1-Signal als auch unabhängig reguliert werden können.
FOXO-Transkriptionsfaktoren bei Säugetieren bestehen aus vier Isoformen, dh FOXO1, 3, 4 und 6. FOXO1-KO-Mäuse (mit einem Knockout dieses Gens) haben eine verlängerte CR-Lebensdauer, es gab jedoch keine mit CR verbundene Antitumorwirkung [13]. Umgekehrt hemmte bei FOXO3-KO-Mäusen die Zugabe von CR die Tumorentstehung, es gab jedoch keine CR-induzierte Verlängerung der Lebensdauer [14]. Diese Unterschiede können mit einem unterschiedlichen Aktivierungsmuster in den Geweben und / oder Zellen der vier Isoformen der CROX-induzierten Transkriptionsfaktoren FOXO verbunden sein.
Protein BMAL1 ist ein Transkriptionsfaktor, der an der Regulation des zirkadianen Rhythmus beteiligt ist. Bei BMAL1 KO-Mäusen (aus diesem Gen ausgeschieden) nahm die Nahrungsaufnahme zu, das Körpergewicht ab und die Alterungsphänotypen beschleunigten sich. Bei denselben Mäusen senkte CR die Insulin- und IGF1-Spiegel nicht und erhöhte die Lebenserwartung nicht. Dies weist auf die Beteiligung von BMAL1 an der vorteilhaften Wirkung von CR hin und darauf, dass diese vorteilhafte Wirkung von der Übertragung von GH / IGF1-Signalen abhängt [15].
Alarm mTOR
mTOR-Kinase, Serin / Threonin-Kinase, wurde als Zielmolekül von Rapamycin identifiziert. Es bildet zwei separate Multiproteinkomplexe, die als mTORC1 und mTORC2 bekannt sind. Es ist bekannt, dass MTORC1 durch Aminosäuren und Wachstumsfaktoren (z. B. Insulin und IGF1) aktiviert wird. Die Aktivierung von mTORC1 fördert die Proteinsynthese über die ribosomale Proteinkinase S6 1, die Fettsäuresynthese über das steroidale regulatorische Bindungsprotein (SREBP) 1 und die Differenzierung der Adipozyten durch Peroxisom-Proliferator-aktivierte Rezeptoren (PPARγ). mTORC1 hemmt die Autophagie und die lysosomale Biosynthese durch den EB-Transkriptionsfaktor (TFEB). Die Funktion von mTORC2 ist kaum bekannt, es wird jedoch angenommen, dass sie wie bei mTORC1 erhöhte anabole Wirkungen und die Unterdrückung katabolischer Wirkungen umfasst [16].
Mäuse, denen über einen langen Zeitraum nach dem mittleren Alter eine negative Regulation von mTORC1-Rapamycin verabreicht wurde, hatten eine erhöhte Lebenserwartung [17]. Entsprechend dieser Entdeckung leben transgene Mäuse mit Überexpression des TSC1-Proteins, das mTORC1 negativ reguliert, länger als Wildtyp-Mäuse [18]. Darüber hinaus lebten Knockout-Mäuse mit ribosomaler S6 1 -Proteinkinase und mTOR-Mutantenmäusen länger als Wildtyp-Mäuse [19, 20].
Nach unserem Kenntnisstand wurden die vorteilhaften Wirkungen von CR bei Mäusen mit defekter mTORC1-Funktion noch nicht untersucht. Bei Hefen mit genetischer Hemmung verlängerte mTOR CR jedoch nicht die Lebensdauer [21]. Die Autophagie wird durch die Hemmung von mTORC1 verstärkt. Bei Nematoden, denen Gene im Zusammenhang mit der Autophagie fehlen, verlängerte CR die Lebensdauer nicht [22]. Basierend auf diesen Daten ist es wahrscheinlich, dass eine Abnahme der mTOR-Aktivität und die Aktivierung des autophagischen Apparats mit einer positiven Wirkung von CR verbunden sind.
Sirtuins
Sir2 wurde als neues Gen entdeckt, das an der Unterdrückung der Transkription in Hefe beteiligt ist. Danach wurde berichtet, dass es eine Schlüsselrolle bei der Verlängerung des Lebens in CR spielt [23, 24]. Sieben Sirtuin-Ortholog-Gene, Sirtuine Sirt1 - Sirt7, wurden bei Säugetieren identifiziert. Die Proteine SIRT1, 6 und 7 sind hauptsächlich im Kern lokalisiert, SIRT2 im Kern und im Zytoplasma und SIRT 3, 4 und 5 hauptsächlich in Mitochondrien. Sirtuine katalysieren Deacetylierungsreaktionen verschiedener Proteine, einschließlich Histone, abhängig von NAD [25].
Von sieben Sirtuinen bei Säugetieren sollen SIRT1, 3 und 6 an der altersbedingten Pathophysiologie und der Regulierung der Lebensspanne beteiligt sein [26]. Transgene Mäuse, bei denen das SIRT1-Protein in hypothalamischen Neuronen selektiv überexprimiert wurde, hatten eine längere Lebensdauer als Wildtyp-Mäuse. [27]. Transgene weibliche Mäuse, bei denen das SIRT6-Protein überexprimiert wurde, hatten eine längere Lebensdauer als Wildtyp-Mäuse [28]. Bei älteren Mäusen erhöhte CR die SIRT6-Expression und verbesserte das Nierenversagen für 6 Monate. Während die Überexpression von SIRT6 die Zellalterung unterdrückte, indem die Aktivität des entzündungsbedingten Transkriptionsfaktors NF-κB verringert wurde, beschleunigte der SIKT6-Knockout die Zellalterung [29]. Bei SIRT3 KO-Mäusen wurden zuvor verschiedene altersbedingte Pathologien beobachtet [30]. Obwohl CR bei Wildtyp-Mäusen einen altersbedingten Hörverlust verhinderte, wurde dieser Effekt bei SIRT3-KO-Mäusen nicht beobachtet [31].
Transkriptionsfaktor NRF2
NRF2 bindet an Elemente der Antioxidationsreaktion, um die Expression von Zielgenen als Reaktion auf oxidativen Stress zu induzieren, und verstärkt die Expression von Genen, die an Antioxidations- und Entgiftungsreaktionen beteiligt sind. Unter physiologischen Bedingungen bindet NRF2 an das Keap1-Protein im Zytoplasma, wo es abgebaut wird. Unter Stress, einschließlich oxidativem Stress, transloziert NRF2, nachdem Keap1 durch phosphoryliertes p62 eingefangen wurde, in den Kern, bindet an antioxidative Antwortelemente und aktiviert die Transkription von antioxidativen Genen [32].
Da die Expression von NRF2 bei Nagetieren mit zunehmendem Alter abnimmt, wird angenommen, dass der Gehalt an reaktiven Sauerstoffspezies und verschiedene Krebsrisiken zunehmen. CR unterdrückt jedoch einen altersbedingten Rückgang der antioxidativen Fähigkeit, indem es die Expression von Genen erhöht, die an der Antioxidation und Entgiftung beteiligt sind. Bei Nematoden ist Skn-1, ein Homolog von NRF2, für die Wirkung von CR zur Verlängerung seiner Lebensdauer unverzichtbar. NRF2-Knockout-Mäuse zeigen eine Abnahme der Expression von Genen, die an der antioxidativen Reaktion und Entgiftung beteiligt sind, was zu einer beschleunigten Onkogenese führt. Die Rolle von NRF2 bei den vorteilhaften Wirkungen von CR wurde unter Verwendung von NRF2-KO-Mäusen untersucht. Die Ergebnisse zeigten, dass NRF2 für die Antitumorwirkung von CR wichtig ist, jedoch nicht an den mit Langlebigkeit und erhöhter Insulinsensitivität von CR verbundenen Effekten beteiligt ist [33].
Neuropeptid Y (NPY)
Bei Säugetieren erfassen Neuronen im hypothalamischen bogenförmigen Kern den Energiestatus anhand der Hormonzirkulation. Eine CR-assoziierte negative Energiebilanz und die anschließende Verringerung der Fettmasse erhöhen die Durchblutung der Ghrelin- und Adiponektinspiegel und senken die Leptin-, Insulin- und IGF1-Spiegel im Blut. Diese hormonellen Veränderungen aktivieren NPY-Neuronen im hypothalamischen bogenförmigen Kern. Die meisten dieser Neuronen synthetisieren das Agrp-Protein und schwächen die Aktivität von POMC-Neuronen im bogenförmigen Kern. Eine Änderung der Aktivität von primären Neuronen hemmt sekundäre hypothalamische Neuronen, die Somatotropin, Gonadotropin und Thyrotropin freisetzendes Hormon absondern, und aktiviert Neuronen, die Corticotropin freisetzendes Hormon absondern. Diese hypothalamische Veränderung unterdrückt die GH / IGF1-Signalübertragung, die Schilddrüsenfunktion und die Reproduktion und aktiviert die Glukokortikoidfunktion der Nebennieren. Die meisten dieser veränderten neuronalen Sekretionsprofile werden bei Mäusen und Ratten mit CR beobachtet [34].
Bei NPY KO-ausgeschalteten Mäusen erhöhte die Zugabe von CR die Lebenserwartung nicht, verursachte eine Toleranz gegenüber oxidativem Stress in der Leber und veränderte das Profil der Neuronensekretion. CR senkte jedoch die Insulin- und IGF1-Spiegel im Blut, erhöhte die Adiponektin- und Corticosteronspiegel im Blut und verringerte die Expression von Genen, die an der Beta-Oxidation in der Leber beteiligt sind. Daher sollte NPY ein Schlüsselfaktor für GF / IGF1-unabhängige CR-Aktionen sein [35].
Mitochondriale DNA-Mutation (mtDNA)
Es wird angenommen, dass die Akkumulation von mtDNA-Mutationen einer der wichtigsten Pathogenesefaktoren bei altersbedingten Erkrankungen ist. PolgA D257A / D257A-Mäuse tragen eine Mutation in mtDNA-Polymerase-Gamma und zeigen eine frühere Entwicklung einer altersbedingten Akkumulation von mtDNA-Mutationen und Altersphänotypen in verschiedenen Geweben [36]. Bei PolgA-Mäusen verlängerte D257A / D257A CR die Lebensdauer nicht, beeinflusste die Akkumulation der mtDNA-Deletion im Skelettmuskel nicht und verbesserte die Herzfunktion nicht, was zur Sarkopenie beitrug. Diese Daten zeigen, dass die Akkumulation von mtDNA-Mutationen die vorteilhaften Wirkungen von CR hemmen kann [37].
Unsere neuen Ergebnisse: CR-Umbau von Fettgewebe
Viszerale Adipositas im Zusammenhang mit Diabetes, Hyperlipidämie und Bluthochdruck, die zusammen als „metabolisches Syndrom“ bezeichnet wird, ist ein bekannter Risikofaktor für die Entwicklung lebensbedrohlicher atherosklerotischer Erkrankungen, einschließlich Myokardinfarkt und Hirninfarkt. Fettgewebe, von dem ursprünglich angenommen wurde, dass es nur mit der Energiefunktion zusammenhängt, wurde kürzlich als endokrines Organ beschrieben, das verschiedene biologisch aktive Moleküle, sogenannte Adipokine, absondert. Große Adipozyten, die Triglyceride (TG) akkumulieren, erhöhen die Sekretion von entzündlichen Adipokinen, einschließlich Tumornekrosefaktor-α (TNF-α) und Interleukin-6 (IL-6), übermäßig und verringern die Adiponektinsekretion im Vergleich zu kleinen Adipozyten, die weniger akkumulieren TG. Diese Adipokin-Sekretionsprofile sind direkt an altersbedingten Pathologien beteiligt, einschließlich Insulinresistenz, Hypertonie und Atherosklerose [38]. Darüber hinaus wurde kürzlich berichtet, dass Fettgewebe und Adipokine eine Schlüsselrolle bei der Regulierung der Lebensdauer spielen. Beispielsweise zeigten Mäuse mit Insulinrezeptor-Knockout in Adipozyten eine Abnahme der Fettleibigkeit, eine Zunahme der mitochondrialen Biogenese und eine längere Lebensdauer als Wildtyp-Mäuse [39]. Transgene Mäuse mit Überexpression von Adiponectin in der Leber zeigten ein höheres Überleben als die Kontrolle [40]. Die Transkriptionsfaktoren PPAR & ggr; und CCAAT / Enhancer-Bindungsproteine & agr; (C / EBP & agr;) und & bgr; (C / EBP & bgr;) sind an der Differenzierung von Adipozyten beteiligt. Mäuse mit Zersetzung des C / EBPβ-Gens am C / EBP-Ort zeigten eine verbesserte mitochondriale Biogenese und eine längere Lebensdauer [41]. Im Gegensatz dazu hatten ausgeschlagene PPARγ KO-Mäuse eine kürzere Lebensdauer als Kontrollmäuse [42].
Es wurde berichtet, dass CR die aktive Form von Adiponectin bei Mäusen jeden Alters erhöht. Diese CR-assoziierte Regulation von Adiponectin hängt von der GH / IGF1-Signalübertragung ab [43, 44]. Wir analysierten die CR-assoziierte Änderung in chronologischer Reihenfolge und erhielten die folgenden Ergebnisse. CR erhöhte die Expression von Genen und / oder Proteinen, die an der Biosynthese von Fettsäuren (FA) und der mitochondrialen Biogenese im Fettgewebe nach der frühen Phase der CR beteiligt sind. CR-bedingte Veränderungen traten überwiegend im Fettgewebe auf als in anderen Geweben oder Organen. Danach traten morphologische Veränderungen auf, einschließlich einer Abnahme der Adipozytengröße und metabolischer Veränderungen in der Leber [45]. Um CR-bedingte Veränderungen des metabolischen Fettgewebes zu klären, die unabhängig vom GH / IGF1-Signal auftraten, verglichen wir dann das Genexpressionsprofil von CR im Fettgewebe von Wildtyp-Ratten mit transgenen Ratten, denen ad libitum (AL) verabreicht wurde. Unsere Ergebnisse zeigten, dass CR die Expression von Genen, die an der Fettsäurebiosynthese beteiligt sind, insbesondere im Haupttranskriptionsfaktor der Fettsäurebiosynthese, den regulatorischen Genen SREBP-1, unabhängig von GH / IGF1 verstärkt [9].
Daher verglichen wir dann die Wirkung von CR mit verschiedenen Parametern, einschließlich der Lebensdauer zwischen ausgeschlagenen SREBP-1c KO-Mäusen und Wildtyp-Mäusen. SREBP-1c KO-Mäuse hatten eine etwas kürzere Lebensdauer als Wildtyp-Mäuse. Bei Wildtyp-Mäusen mit verlängerter Lebensdauer erhöhte CR die Expression von Proteinen, die an der Fettsäurebiosynthese und der Biogenese der Mitochondrien beteiligt sind, und unterdrückte oxidativen Stress. Die meisten dieser Veränderungen wurden hauptsächlich im Fettgewebe und nicht in anderen Geweben beobachtet. Im Gegensatz dazu wurden bei SREBP-1c KO-Mäusen keine CR-assoziierten Veränderungen der Lebensverlängerung und des Fettgewebes beobachtet. Es wurde berichtet, dass das PGC-1α-Protein ein Schlüsselregulator der CR-induzierten mitochondrialen Biogenese ist [46]. Wir beobachteten, dass SREBP-1c an den Promotor des Pgc-1α-Gens bindet, was darauf hindeutetdass SREBP-1c die Transkription von Pgc-1α direkt reguliert [47]. Darüber hinaus zeigten die Ergebnisse der Analyse des Proteoms von Fettgewebe, dass CR den Pyruvat / Malat-Zyklus aktiviert [48]. In der Tat wurde berichtet, dass CR die De-novo-Fettsäurebiosynthese im Fettgewebe aktiviert, nicht jedoch in der Leber [45]. Diese Daten zeigen, dass SREBP-1c KO-Mäuse Fette unter CR-Bedingungen nicht effizient verwenden können. Somit kann Fettgewebe nicht nur als Gewebe zur Speicherung von Energie fungieren, sondern auch die Rolle spielen, Glucose über SREBP-1c unter CR-Bedingungen in eine energieintensivere Fettsäure umzuwandeln.aber nicht in der Leber [45]. Diese Daten zeigen, dass SREBP-1c KO-Mäuse Fette unter CR-Bedingungen nicht effizient verwenden können. Somit kann Fettgewebe nicht nur als Gewebe zur Speicherung von Energie fungieren, sondern auch die Rolle spielen, Glucose über SREBP-1c unter CR-Bedingungen in eine energieintensivere Fettsäure umzuwandeln.aber nicht in der Leber [45]. Diese Daten zeigen, dass SREBP-1c KO-Mäuse Fette unter CR-Bedingungen nicht effizient verwenden können. Somit kann Fettgewebe nicht nur als Gewebe zur Speicherung von Energie fungieren, sondern auch die Rolle spielen, Glucose über SREBP-1c unter CR-Bedingungen in eine energieintensivere Fettsäure umzuwandeln.CR
1989 erklärte Holliday die Auswirkungen von Anti-Aging und Lebenserwartung durch CR aus evolutionärer Sicht von Organismen, die adaptive Reaktionssysteme entwickelten, um das Überleben in Zeiten von Nahrungsmittelknappheit zu maximieren [49, 50]. Basierend auf dieser evolutionären Sichtweise haben wir die vorteilhaften Wirkungen von CR in zwei Systeme unterteilt; "Systeme, die unter ausreichenden Bedingungen für Energieressourcen aktiviert werden" und "Systeme, die unter unzureichenden Bedingungen für Energieressourcen betrieben werden". Die erste wird in vivo aktiviert, wodurch Tiere durch reichliche Ernährung frei Energie nutzen können. Mit anderen Worten, wenn es viel Nahrung für den freien Energieverbrauch gibt, wachsen die Tiere gut, vermehren sich mehr und speichern überschüssige Energie wie TG im Fettgewebe für die spätere Verwendung.aber nicht so sehr, dass sie fettleibig sind. Das zweite System wird in der natürlichen Umgebung aktiviert, wodurch aufgrund von Nahrungsmittelknappheit kein freier Energieverbrauch möglich ist. Mit anderen Worten, wenn die freie Nutzung von Energie keinen Nutzen bringt, unterdrücken Tiere Wachstum und Fortpflanzung und nutzen die eingesparte Energie aus Wachstum und Fortpflanzung, um die biologische Funktion aufrechtzuerhalten. Die Anpassung an natürliche Umweltveränderungen hat für das Überleben der Tiere höchste Priorität.Tiere hemmen Wachstum und Fortpflanzung und nutzen die durch Wachstum und Fortpflanzung eingesparte Energie, um die biologische Funktion aufrechtzuerhalten. Die Anpassung an natürliche Umweltveränderungen hat für das Überleben der Tiere höchste Priorität.Tiere hemmen Wachstum und Fortpflanzung und nutzen die durch Wachstum und Fortpflanzung eingesparte Energie, um die biologische Funktion aufrechtzuerhalten. Die Anpassung an natürliche Umweltveränderungen hat für das Überleben der Tiere höchste Priorität.Basierend auf der oben erwähnten Hypothese der adaptiven Reaktion und den jüngsten Erkenntnissen schlagen wir eine Reihe von Mechanismen für vorteilhafte CR-Aktionen vor.Da experimentelle CR-Bedingungen unzureichende Energiebedingungen simulieren können, haben wir angenommen, dass CR „unter ausreichenden Energiebedingungen aktivierte Systeme“ unterdrückt und „unter unzureichenden Energiebedingungen aktivierte Systeme“ aktiviert und additiv Anti-Aging-Maßnahmen induziert und die Lebensdauer verlängert. Der erste Satz von Systemen umfasst GH / IGF1-, FOXO-, mTORC-, Adiponectin- und BMAL1-Signale, und CR scheint diese anabolen Reaktionen zu unterdrücken. Der zweite Satz von Systemen umfasst die Signalisierung von SREBP-1c / Mitochondrien, SIRT und NPY, und wahrscheinlich aktiviert CR diese Reaktionen für die optimale Nutzung unzureichender Energieressourcen. Darüber hinaus können verschiedene Signale und / oder Faktoren in unterschiedlichem Maße zu den Anti-Aging- und lebensverlängernden Wirkungen von CR beitragen, wobei Antioxidationsmittel, entzündungshemmende,Antitumor und andere Wirkungen in verschiedenen Geweben.In Bezug auf die Paradigmen der diätetischen Intervention wurde nicht nur CR angewendet, sondern auch intermittierende Energieeinschränkung (IER) und Ernährungszeitbeschränkung (TRF) [2]. IER beinhaltet normalerweise das Fasten jeden zweiten Tag oder 2-3 Tage die Woche. TRF, das in der Adipositasforschung beliebter ist als in der Bioheronologieforschung, beinhaltet normalerweise die Einschränkung des Zugangs zu Nahrungsmitteln (fettreich) für mehrere Stunden am Tag. Die durch IER oder TRF verursachten vorteilhaften Wirkungen ähneln teilweise denen, die durch CR verursacht werden. Nach unserem Kenntnisstand haben jedoch keine Studien strenge Forschungspläne, einschließlich Ernährungspläne, verwendet, um die drei diätetischen Interventionen zu vergleichen. Daher sind möglicherweise in Zukunft vergleichende Studien zu CR, IER und TRF erforderlich.Perspektiven
Studien mit Affen zeigen, dass vorteilhafte Wirkungen von CR auch bei Menschen und anderen Säugetieren auftreten können [51]. Aktuelle CR-Studien konzentrieren sich auf zwei Themen, nämlich die Identifizierung der molekularen Mechanismen von CR sowie die Entwicklung mimetischer CR-Präparate. Wir glauben, dass die Entwicklung neuer Medikamente, die wie CR wirken, schwierig sein kann, ohne die molekularen Mechanismen von CR zu verstehen. Um solche Medikamente zu entwickeln, die auf den Menschen anwendbar sind, sind weitere Untersuchungen der molekularen Mechanismen von CR erforderlich, insbesondere bei Primaten. In diesem Bericht schlagen wir vor, die molekularen Mechanismen der vorteilhaften Wirkungen von Tscheka zu klassifizieren und zu diskutieren, je nachdem, ob sie unter Bedingungen mit reichen oder unzureichenden Energieressourcen wirken. Weitere Studien zu den molekularen Mechanismen der CR-Vorteile sollten ebenfalls berücksichtigt werdendas Ausmaß, in dem die beteiligten Signale / Faktoren zu den antioxidativen, entzündungshemmenden, Antitumor- und anderen CR-Wirkungen in jedem Gewebe oder Organ beitragen und dadurch zu einer Verjüngung und einer erhöhten Lebenserwartung führen. Studien an gentechnisch veränderten Tieren, die sich auf eines der beiden oben genannten Systeme konzentrieren, zeigen Unterschiede im Ausmaß der CR-induzierten Wirkungen bei Mäusen unterschiedlicher Herkunft, und diejenigen, die die vorteilhaften Wirkungen von CR mit IER- oder TRF-Faktoren vergleichen, helfen nicht nur, die weiteren molekularen Mechanismen von CR zu klären. aber auch solche im Zusammenhang mit der Lebenserwartung.und dadurch zur Verjüngung führen und die Lebenserwartung erhöhen. Studien an gentechnisch veränderten Tieren, die sich auf eines der beiden oben genannten Systeme konzentrieren, zeigen Unterschiede im Ausmaß der CR-induzierten Wirkungen bei Mäusen unterschiedlicher Herkunft, und diejenigen, die die vorteilhaften Wirkungen von CR mit IER- oder TRF-Faktoren vergleichen, werden nicht nur zur Klärung der weiteren molekularen Mechanismen von CR beitragen. aber auch solche im Zusammenhang mit der Lebenserwartung.und dadurch zur Verjüngung führen und die Lebenserwartung erhöhen. Studien an gentechnisch veränderten Tieren, die sich auf eines der beiden oben genannten Systeme konzentrieren, zeigen Unterschiede im Ausmaß der CR-induzierten Wirkungen bei Mäusen unterschiedlicher Herkunft, und diejenigen, die die vorteilhaften Wirkungen von CR mit IER- oder TRF-Faktoren vergleichen, helfen nicht nur, die weiteren molekularen Mechanismen von CR zu klären. aber auch solche im Zusammenhang mit der Lebenserwartung.die mit der Lebenserwartung zusammenhängen.die mit der Lebenserwartung zusammenhängen.: .
Quelle:
Hoshino S, Kobayashi M, Higami Y. Mechanisms of the anti-aging and prolongevity effects of caloric restriction: evidence from studies of genetically modified animals. Aging (Albany NY). 2018 Sep 16.