Seneszierende (alte) Zellen werden heute als Zellen bezeichnet, bei denen der Zellzyklus unter dem Einfluss verschiedener Faktoren (Stress oder Erschöpfung der Teilungsressource) gestoppt wird. Infolgedessen teilen sich solche Zellen nicht und werden nicht aktualisiert.
Die Konferenz über Zellalterung bei Krebs und Altern an der Universität von Cambridge gab die folgende Definition der Zellalterung: „
Zellalterung bezieht sich auf den anhaltenden Stopp der Proliferation, der durch verschiedene molekulare Auslöser, einschließlich der Aktivierung von Onkogenen, sowie übermäßige Zellteilungen verursacht wird. Darüber hinaus sind seneszierende Zellen durch die Sekretion einer Reihe von Stromaregulatoren und Entzündungsregulatoren (den sogenannten „mit dem Altern des Serotore-Phänotyps assoziierten“) gekennzeichnet, die die Funktion benachbarter Zellen, einschließlich immunkompetenter Zellen, beeinflussen. Eine Reihe überzeugender Tatsachen deuten darauf hin, dass die Zellalterung ein wirksamer Mechanismus zur Unterdrückung des Tumorwachstums ist. Gleichzeitig kann die Zellalterung zur Alterung des Gewebes und des gesamten Organismus beitragen . “
Aufgrund verschiedener ursächlicher Mechanismen werden drei Arten der Zellalterung unterschieden.
Das allererste in den frühen 60er Jahren des letzten Jahrhunderts wurde die zellreplikative Alterung entdeckt. In der bereits bekannten Arbeit stellten die amerikanischen Gerontologen L. Hayflick und P. Moorhead in Experimenten mit kultivierten menschlichen Fibroblasten fest, dass sich Zellen nicht auf unbestimmte Zeit teilen und es eine Grenze für die Zellteilung gibt (später als Hayflick-Grenze oder Grenze bezeichnet) [1]. Nach 10 Jahren gab der sowjetische Biologe Aleksey Olovnikov eine logische Erklärung für dieses Phänomen, indem er die Grenze der Zellteilung mit der allmählichen Verkürzung der terminalen Abschnitte von DNA, Telomeren, verband. Dies ist auf die Tatsache zurückzuführen, dass das Telomeraseenzym, das in der Lage ist, Telomere nach ihrer Verkürzung zu erhöhen, in den meisten somatischen Zellen nicht aktiv ist. Nachdem die Telomere auf ein kritisches Niveau verkürzt wurden, tritt eine DNA-Schadensantwort (DDR) auf, wodurch der Zellzyklus stoppt und die Zelle seneszent wird. Es ist bekannt, dass externe Faktoren, die die Gesundheit und Langlebigkeit beeinträchtigen (Fettleibigkeit, Bewegungsmangel, Stress), sich ebenfalls negativ auf die Verkürzung der Telomere auswirken [2]. Auch bei Patienten mit neurodegenerativen Erkrankungen wie Alzheimer wird eine Beschleunigung der Verringerung der Telomerlänge beobachtet [3].
Für die meisten Zellen wird angenommen, dass die Hayflick-Grenze etwa 50 Teilungen beträgt, wonach die Zelle aufhört, sich zu teilen. Um die Alterung des gesamten Körpers von der Zellalterung zu unterscheiden, führten Hayflick und Moorhead einen speziellen Begriff in die wissenschaftliche Revolution ein, der sich auf Zellalterung - Seneszenz (im Gegensatz zu Alterung - Alterung) bezieht.
Zusätzlich zur replikativen Alterung kann die Zellalterung auch durch andere Faktoren verursacht werden, die die Zellalterung unabhängig von der Telomerlänge vorzeitig induzieren. Diese Faktoren bilden die zweite und dritte Art der Zellalterung.
Daher verursacht die Aktivierung von Onkogenen wie RAS und RAF eine Zellalterung, die als Onkogen-induzierte Zellalterung (OIS) bezeichnet wird. Diese Form der Zellalterung ist mit der Unterdrückung von Tumoren verbunden. Genomische Vergleichsstudien an Zellen mit replikativem und OIS-Altern zeigen, dass es zwar einige allgemeine Veränderungen der Genexpression zwischen diesen beiden Spezies im Vergleich zu proliferierenden Zellen gibt, aber auch signifikante Unterschiede gibt [4]. Es ist bekannt, dass DNA-Schäden, die mit reaktiven Sauerstoffspezies (ROS) verbunden sind, eine wichtige Rolle bei den Mechanismen der OIS-Alterung spielen. Die ERK-Kinase ist auch aktiv am Auftreten von OIS beteiligt und stimuliert den Abbau von Proteinen, die für das Fortschreiten des Zellzyklus notwendig sind. Die Rolle der DNA-Schadensantwort (DDR) bei dieser Art der Zellalterung wurde nicht geklärt. Es ist bekannt, dass mutierte Onkogene wie H-Ras G12V das Potenzial haben, die molekularen Wege der Zellalterung zu aktivieren, die mit der p38-MAPK-Kinase und dem NF-kB-Transkriptionsfaktor verbunden sind, unabhängig von der DNA-Schädigung. Das onkogene Ras-Gen kann auch zur Hochregulation von p53 über p19ARF und zur Zellalterung beitragen, unabhängig von DNA-Schäden. [5]. Daher ist eine Stimulation der zellulären OIS-Alterung auch ohne DNA-Schädigung nicht ausgeschlossen.
Eine dritte Art der Zellalterung, die ebenfalls unabhängig von der Telomerlänge ist, ist die stressinduzierte vorzeitige Seneszenz (SIPS). Es entsteht als Reaktion auf Stressfaktoren verschiedener Art: ionisierende und ultraviolette Strahlung, ein Anstieg des ROS-Spiegels, Chemotherapeutika. Im Gegensatz zur OIS-Alterung hängt das Auftreten von SIPS vollständig von der Reaktion auf DNA-Schäden (DDR) ab. Phänotypisch sind SIPS und replikative Zellalterung weitgehend ähnlich, können sich jedoch auf der Ebene der Proteinexpression unterscheiden. Die Rolle von SIPS bei der allgemeinen Alterung des Körpers ist nicht vollständig geklärt - eine erhöhte Expression von Antioxidantien und die Unterdrückung von ROS, den Hauptfaktoren für das Auftreten von SIPS, führten nicht zu einer Verlängerung der Lebensdauer [6].
Die molekularen Mechanismen zum Stoppen des Zellzyklus in seneszenten Zellen werden heute aktiv untersucht. Es ist bekannt, dass der Grad der DNA-Schädigung den Zellzyklus auf unterschiedliche Weise beeinflusst. Eine mäßige DNA-Schädigung kann also zu einem vorübergehenden Wachstumsstopp führen, eine ausgedehnte DNA-Schädigung führt zum programmierten Zelltod, eine anhaltende DNA-Schädigung führt zur Zellalterung. Molekulare Determinanten (die Hauptfaktoren), die den Übergang von der vorübergehenden Unterbrechung des Wachstums zum irreversiblen Stillstand des Zyklus bestimmen, sind komplex und noch nicht vollständig beschrieben. Es ist bekannt, dass DNA-Schäden anfänglich den p53-p21-Weg aktivieren, der den Zellzyklus stoppt. Wenn dann der DNA-Schaden nicht repariert wird, geht die Zelle entweder in Apoptose oder wird seneszent. Im zweiten Fall spielt das p16 INK4a-Protein die Schlüsselrolle, das die langfristige Erhaltung des Zellzyklusstillstands über den pRb-E2F-Signalweg (Retinoblastom-Protein, pRb ist der Transkriptionsfaktor E2F) und Veränderungen der Chromatinstruktur reguliert [7].
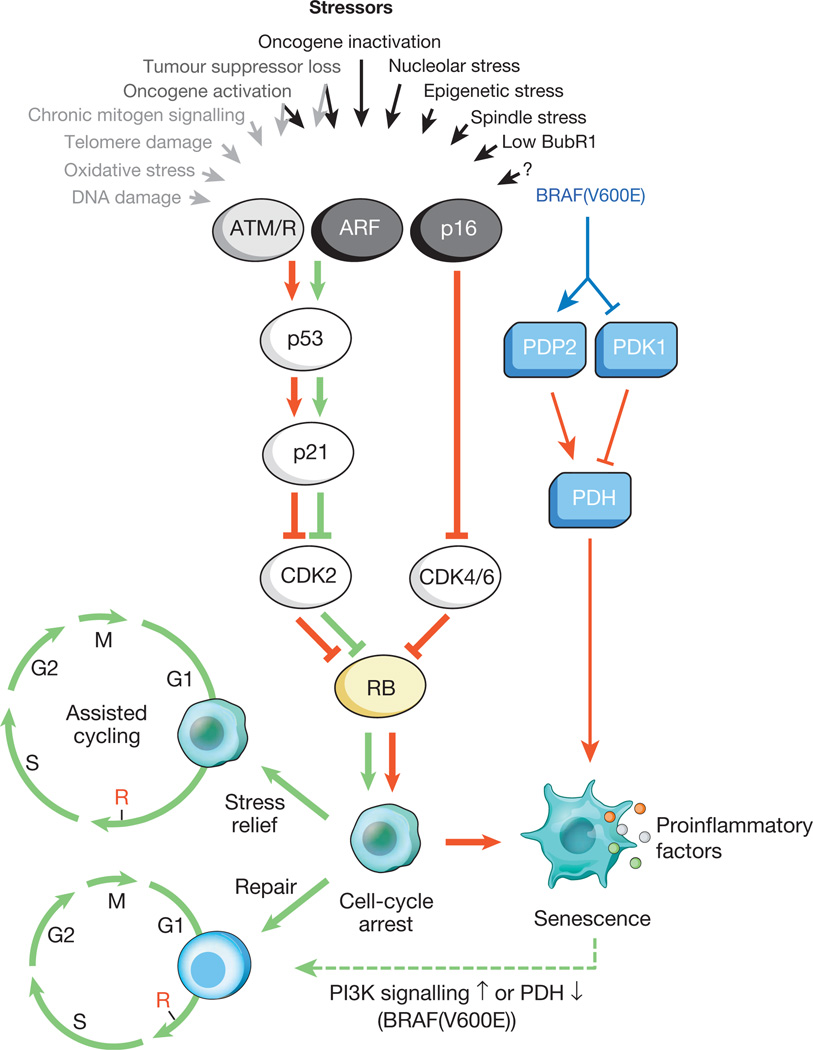
Abb. 1.
Stimuli, die Zellalterung und wichtige Effektorwege verursachenEine Vielzahl von intrazellulären und externen Belastungen kann das Zellalterungsprogramm aktivieren. Diese Stressoren erfassen verschiedene zelluläre Signalkaskaden und aktivieren schließlich p53 und p16 INK4a. Die Arten von Stress, die die p53-Signalübertragung über DDR aktivieren, sind durch grauen Text und Pfeile (ROS (ROS)) gekennzeichnet, die eine DNA-Schadensantwort (DDR) verursachen, die Gentranskription und DNA-Replikation stören sowie Telomere verkürzen. Aktiviertes p53 induziert p21, was durch Hemmung von Cyclin E-Cdk2 zu einem vorübergehenden Stillstand des Zellzyklus führt. p16 INK4a hemmt auch das Fortschreiten des Zellzyklus, jedoch durch Targeting von Cyclin D-Cdk4- und Cyclin D-Cdk6-Komplexen. Sowohl p21 als auch p16 INK4a verhindern die Inaktivierung von Rb, was zu einer fortgesetzten Repression der E2F-Zielgene führt, die für den Beginn der S-Phase erforderlich sind. Bei starkem Stress (rote Pfeile) treten vorübergehend blockierte Zellen in die Arrestphase des Zellzyklus ein. Zellen, die für geringfügige Schäden anfällig sind, können erfolgreich wiederhergestellt werden und den normalen Zyklus wieder aufnehmen. Somit kann der p53-p21-Weg im Alter je nach Art und Ausmaß des Stresses entweder antagonisieren oder mit p16 INK4a synergisieren. BRAF (V600E) ist mit dem Altern über den metabolischen Effektorweg verbunden. BRAF (V600E) aktiviert PDH durch Induktion von PDP2 und Hemmung der Expression von PDK1, wodurch eine Verschiebung von der Glykolyse zur oxidativen Phosphorylierung gefördert wird, die zu alterndem Redoxstress führt. Alternde Zellen induzieren unabhängig von altersbedingtem induzierendem Stress ein entzündliches Transkript (farbige Punkte repräsentieren verschiedene SASP-Faktoren). Die roten und grünen Pfeile zeigen eine Aktivität an, die das Altern und "Anti-Aging" fördert. Der gestrichelte grüne Pfeil zeigt den Mechanismus „Alterungsänderung“ an.Es ist bekannt, dass seneszierende Zellen ihre Mikroumgebung (das sie umgebende Gewebe) aktiv beeinflussen und eine Reihe aktiver Moleküle sekretieren: entzündungsfördernde Zytokine, Chemokine, Wachstumsfaktoren, Proteasen (insgesamt etwa 40 verschiedene Arten von Molekülen). Diese Substanzen wurden zu einer einzigen Gruppe zusammengefasst - dem seneszenzassoziierten sekretorischen Phänotyp (SASP), der mit der Zellalterung assoziiert ist. Es ist bekannt, dass SASP-Faktoren aktiv am Umbau des Gewebes in der Embryonalentwicklung beteiligt sind. Darüber hinaus werden unter ihrem Einfluss sowohl der Körper der Mutter als auch der Embryo wieder aufgebaut. Es wird angenommen, dass die evolutionäre Natur von SASP mit einer Reihe von Abwehrmechanismen verbunden ist: Tumorsuppression, Erholung von Trauma und Geweberegeneration.
Die vereinfachte physiologische Wirkung von SASP kann wie folgt beschrieben werden. Sekretierte entzündungsfördernde Moleküle bilden einen Entzündungsherd um die zu entfernenden seneszenten Zellen. Was zieht Zellen des Immunsystems an diesen Ort, um alternde Zellen zu beseitigen. SASP-Matrixmatrix-Metalloproteasen (MMP-1, MMP-10, MMP-3) und Serinproteasen bauen die extrazelluläre Matrix um, um das Eindringen von Zellen des Immunsystems in alternde Zellen zu erleichtern. Und schließlich stimulieren sekretierte Wachstumsfaktoren die Proliferation benachbarter Zellen, um entfernte seneszierende Zellen zu ersetzen.
Es wird beschrieben, wie der SASP-Mechanismus in einem jungen und gesunden Körper normal funktionieren sollte. Mit zunehmendem Alter und mit Abweichungen kann seine Wirksamkeit jedoch erheblich abnehmen, was zur Akkumulation seneszierender Zellen im Gewebe und infolgedessen zu einer verlängerten Sekretion entzündungsfördernder SASP-Faktoren führt. Was mit dem Auftreten chronischer Entzündungsherde einhergeht. Darüber hinaus ist bekannt, dass eine verlängerte SASP-Aktivität als Infektion normaler Zellen wirkt. Aktive Moleküle, die von seneszenten Zellen sekretiert werden, gelangen in den extrazellulären Raum und initiieren auf benachbarte normale Zellen einen Zellzyklusstillstand und einen Proliferationsstopp. Dies beschleunigt die Entwicklung der Zellalterung in Geweben erheblich.
Darüber hinaus ist eine verlängerte Sekretion von SASP-Faktoren durch alternde Zellen mit der Entwicklung altersbedingter Pathologien verbunden. Somit stimuliert eine erhöhte Sekretion von Matrixmetalloproteasen durch seneszierende Zellen die Entwicklung von koronarer Herzkrankheit, Osteoporose und Arthrose. Seneszierende glatte Muskelzellen sind an der Entwicklung von Atherosklerose beteiligt, indem sie eine große Anzahl entzündungsfördernder Zytokine sekretieren. Eine verlängerte Sekretion des proinflammatorischen Faktors TNF-α durch seneszierende T-Zellen ist an Prozessen beteiligt, die mit einer Knochendysfunktion verbunden sind. Darüber hinaus ist bekannt, dass ein Anstieg des proinflammatorischen IL-6-Spiegels mit Insulinresistenz, Diabetes, Atherosklerose und Lebererkrankungen verbunden ist. Um auf all diese Prozesse zu verweisen, die mit systemischer chronischer Entzündung und Alterung verbunden sind und bei denen SASP-Faktoren eine Schlüsselrolle spielen, wurde ein spezieller Begriff eingeführt - Entzündung. Darüber hinaus wurde die doppelte Rolle von SASP bei der Karzinogenese beschrieben - seine tumorsuppressive und tumorfördernde Aktivität [8].
Im Zusammenhang mit der oben beschriebenen Doppelrolle der Zellalterung bei Jung und Alt betrachten einige Wissenschaftler die Zellalterung als Beispiel für eine evolutionäre antagonistische Pleiotropie, die immer noch humorvoll mit dem Satz „Jetzt verwenden - später zahlen“ formuliert wird. Nach dieser Theorie können Prozesse, die sich in der Evolution festgesetzt haben, um das Überleben junger Organismen zu verbessern, bei älteren Menschen kumulative schädliche Auswirkungen haben. Die Mechanismen, die mit seneszenten Zellen in jungen Jahren verbunden sind, sind also an der Schwangerschaft, der Genesung von Verletzungen und dem Schutz vor Tumoren beteiligt. In einem späteren Alter verursachen dieselben Mechanismen systemische Entzündungen, Gewebedegeneration und die Entwicklung von Pathologien [9].
Unter den alternden Körperzellen heben die Autoren des SENS-Konzepts zwei Arten hervor, die mit Fettgewebe assoziiert sind: Preadipozyten und viszerale Fettgewebezellen. Und das ist kein Zufall, denn heute ist bekannt, dass viszerales Fett metabolisch aktiv ist und eine Reihe aktiver Moleküle freisetzt - Adipokine. Was wiederum mit der Entwicklung einer Reihe von altersbedingten Pathologien (Insulinresistenz, Diabetes, Herz-Kreislauf-Erkrankungen) verbunden ist. SENS-Autoren konzentrieren sich auch auf die altersbedingte Verschlechterung des Immunsystems. Ihrer Meinung nach ist dies auf die Überlastung des Körpers durch alternde Zellen und als Antwort auf die Überproduktion von T-Killern zurückzuführen, die seneszierende Zellen auf Kosten anderer Arten von Immunzellen zerstören. Was macht einen alternden Körper anfällig für verschiedene Infektionen.
SENS-Autoren sehen eine Lösung für das Problem der Ansammlung seneszierender Zellen in zwei Richtungen. Das erste ist die Entwicklung von Arzneimitteln, die für alte Zellen toxisch sind oder deren Apoptose verursachen, für gesunde, normale Zellen jedoch harmlos sind. Und die zweite Richtung ist die Suche nach Stimulanzien des Immunsystems, um alternde Zielzellen selektiv zu suchen und abzutöten. Der wahrscheinlichste Weg, diese abnormalen Zellen selektiv anzugreifen, wäre laut den SENS-Entwicklern die Verwendung der charakteristischen Moleküle, die sich auf ihren Oberflächen befinden. In der Tat weisen verschiedene Zelltypen Unterschiede in ihrer Oberfläche auf. Daher ist der erste Schritt die Identifizierung und Orientierung von Zelloberflächenmarkern, die für die zu entfernenden seneszenten Zellen spezifisch sind. Diese Strategie ist nicht abstrakt, bildet jedoch bereits die Grundlage einiger Krebsbehandlungen, die das Zellwachstum blockieren und Immunzellen anziehen, um sie zu zerstören [10].
Studien haben gezeigt, dass sich seneszierende Zellen tatsächlich mit dem Alter in verschiedenen Geweben ansammeln [11]. Es wurde auch beschrieben, dass die Eliminierung seneszenter Zellen, die sich in einem Modell schnell alternder Mäuse ansammeln, das Auftreten von drei Hauptalterungsphänotypen (Katarakte, Sarkopenie, Verlust von subkutanem Fett) verhindert [12]. In dieser Hinsicht ist es ziemlich offensichtlich, dass es notwendig ist, zuverlässige und wirksame Biomarker für die Zellalterung zu identifizieren. Welche sind in erster Linie notwendig, um die Auswirkungen potenzieller senolytischer Medikamente zu verfolgen.
Am häufigsten wird die seneszenzassoziierte Beta-Galactosidase SA-β-Gal als Biomarker für seneszierende Zellen verwendet. Das Enzym β-Galactosidase ist eine lysosomale Hydrolase, die terminale Beta-Galactose aus ihren Verbindungen (Lactose, Keratinsulfate, Sphingolipide usw.) abbaut. Bereits 1995 wurde beschrieben, dass die Expression von SA-β-Gal in seneszenten Zellen signifikant anstieg. Eine immunhistochemische Methode wird verwendet, um ihren Gehalt in alternden Geweben zu bestimmen. Als alternative Methode zur Bestimmung der Aktivität von SA-β-Gal in Zellen wird die Durchflusszytometrie unter Verwendung von 5-Dodecanoylaminofluorescein-di-β-D-Galactopyranosid als Substrat verwendet.
Die Verwendung von SA-β-Gal als Biomarker für die Zellalterung hat jedoch ihre eigenen Einschränkungen, da dieses Enzym falsch positive Ergebnisse liefern kann und die Expression nicht nur in alternden Zellen, sondern auch in "jungen" Zellen erhöht, für die aus verschiedenen Gründen die Proliferation begrenzt ist. Daher wird es heute als ratsam angesehen, SA-β-Gal zusammen mit anderen Markern der Zellalterung zu verwenden.
2017 entwickelte die israelische Zytologie eine neue, effizientere Technologie basierend auf der Durchflusszytometrie unter Verwendung des ImageStreamX-Zytometers. Dieses Verfahren ermöglichte den Nachweis von SA-β-Gal in Geweben mit einer Effizienz von mehr als 80%. Um die Effizienz der Analyse zu erhöhen, bestimmten die Wissenschaftler zusammen mit SA-β-Gal mehrere weitere Biomarker für die Zellalterung - die Proteine HMGB1 und γH2AX. HMGB1 ist ein Protein aus der Gruppe der nuklearen Nicht-Histon-Proteine HMG. In seneszenten Zellen verlässt es den Kern und wandert in den extrazellulären Raum. γH2AX, eine phosphorylierte Form des Histons H2AX, ist ein anerkannter Marker für frühe DNA-Schäden und Zellalterung. Darüber hinaus ermöglichte eine neue Methode israelischer Wissenschaftler, alternde Zellen anhand ihrer vergrößerten Größe zu bestimmen. Laut Forschern kann ihre Technologie verwendet werden, um schnell und effektiv die Wirksamkeit neuer pharmazeutischer Verbindungen zu bestimmen, die speziell entwickelt wurden, um alternde Zellen aus Geweben zu entfernen. [13].
Heterochromatin-Herde (SAHF), die mit der Zellalterung assoziiert sind, können auch ein weiterer Biomarker für die Alterung sein. SAHFs sind spezielle Heterochromatinstrukturen, die sich in den Kernen alternder Zellen bilden. Ihre Bildung ist mit einer irreversiblen Heterochromatinisierung verbunden, die mit der Inaktivierung der Gene verbunden ist, die an dem an dieser Stelle befindlichen Zellzyklus beteiligt sind (MCM3, PCNA, Cyclin A). SAHF kann nach Färbung mit einem speziellen DAPI-Farbstoff unter dem Mikroskop gesehen werden. Darüber hinaus wurde eine erhöhte Expression von Promyelozyten-Leukämie-Protein (PML) in seneszenten Zellen beschrieben, die auch ein zusätzlicher Marker für die Zellalterung sein kann [14].
Amerikanische Forscher haben p16 INK4a-Protein aus menschlichen peripheren Blut-T-Zellen als Biomarker für die Zellalterung beschrieben. p16 INK4a beteiligt sich, wie oben beschrieben, aktiv am Stoppen des Zellzyklus seneszierender Zellen. Die Expression von p16 INK4a ist in seneszenten Zellen erhöht und war, wie sich herausstellte, signifikant mit Rauchen und körperlicher Inaktivität verbunden. Zusätzlich war die Expression von p16 INK4a mit einer Konzentration von Plasma-IL-6 assoziiert, einem Marker für altersbedingte Entzündungen. Laut Wissenschaftlern ist die Expression von p16 INK4a ein leicht zu messender peripherer Blutbiomarker zur Bestimmung der Zellalterung [15].Anhang 1.Biomarker der Zellalterung.1. Assoziiert mit Zellalterung β-Galactosidase (Seneszenz-assoziierte Beta-Galactosidase, SA-β-Gal).2. Protein HMGB1 (hochmobiles Gruppenprotein B1).3. Phosphoryliertes Histon γH2AX.4. Assoziiert mit zellulären Alterungsheterochromatinherden (SAHF).5. Protein Promyelocytic Leukemia (PML).6. Protein p16 INK4a.Verfasser: Alexey Rzheshevsky.Referenzliste1. L.HayflickP.S.Moorhead. The serial cultivation of human diploid cell strains. Exp Cell Res. 1961 Dec;25:585-621.
2. Epel ES, Blackburn EH, Lin J, Dhabhar FS, Adler NE, Morrow JD, Cawthon RM. Accelerated telomere shortening in response to life stress. Proc Natl Acad Sci US A. 2004 Dec 7;101(49):17312-5.
3. Panossian LA, Porter VR, Valenzuela HF, Zhu X, Reback E, Masterman D, Cummings JL, Effros RB. Telomere shortening in T cells correlates with Alzheimer's disease status. Neurobiol-Alterung. 2003 Jan-Feb;24(1):77-84.
4. Nelson DM1, McBryan T, Jeyapalan JC, Sedivy JM, Adams PD. A comparison of oncogene-induced senescence and replicative senescence: implications for tumor suppression and aging. Age (Dordr). 2014 Jun;36(3):9637.
5. Palmero I, Pantoja C, Serrano M. p19ARF links the tumour suppressor p53 to Ras. Nature. 1998 Sep 10; 395(6698):125-6.
6. Pérez VI1, Van Remmen H, Bokov A, Epstein CJ, Vijg J, Richardson A. The overexpression of major antioxidant enzymes does not extend the lifespan of mice. Aging Cell. 2009 Feb;8(1):73-5.
7. Narita M, Nũnez S, Heard E, Narita M, Lin AW, Hearn SA, Spector DL, Hannon GJ, Lowe SW. Rb-mediated heterochromatin formation and silencing of E2F target genes during cellular senescence. Cell. 2003 Jun 13; 113(6):703-16.
8. .., .., .., .. « » : SASP ? Acta Naturae, 2018, 10(1). .4-15.
9. Shankar J. Chinta, Georgia Woods, Anand Rane, Marco Demaria, Judith Campisi, and Julie K Andersen. Cellular senescence and the aging brain. Exp Gerontol. 2015 Aug; 68: 3–7.
10. ApoptoSENS: Removing dysfunctional cells.
11. Jeyapalan JC, Ferreira M, Sedivy JM, Herbig U. Accumulation of senescent cells in mitotic tissue of aging primates. Mech Ageing Dev. 2007 Jan;128(1):36-44.
12. Baker DJ, Wijshake T, Tchkonia T, LeBrasseur NK, Childs BG, van de Sluis B, Kirkland JL, van Deursen JM. Clearance of p16Ink4a-positive senescent cells delays ageing-associated disorders. Nature. 2011 Nov 2;479(7372):232-6.
13. Anat Biran, Lior Zada, Paula Abou Karam, Ezra Vadai, Lior Roitman, Yossi Ovadya, Ziv Porat, and Valery Krizhanovsky. Quantitative identification of senescent cells in aging and disease. Aging Cell. 2017 Aug; 16(4): 661–671.
14. Bruno Bernardes de Jesus and Maria A. Blasco. Assessing Cell and Organ Senescence Biomarkers. Circ Res. 2012 Jun 22; 111(1): 97–109.
15. Yan Liu, Hanna K. Sanoff, Hyunsoon Cho, Christin E. Burd, Chad Torrice, Joseph G Ibrahim, Nancy E. Thomas, and Norman E. Sharpless. Expression of p16INK4a in peripheral blood T-cells is a biomarker of human aging. Aging Cell. 2009 Aug; 8(4): 439–448.